Новые замещенные димерные соединения, способ их получения и фармацевтические композиции, содержащие их
Номер патента: 3391
Опубликовано: 24.04.2003
Авторы: Ларрайа Карлос, Беннежан Каролин, Делагранж Филипп, Гийоме Жеральд, Депре Патрик, Декамп-Франсуа Кароль, Йус Сэд, Ренар Пьер, Шев Гвенаэль, Вио Мари-Клод
Формула / Реферат
1. Соединение формулы (I)
A-G1-Cy-G2-Cy'-G3-B (I),
где A обозначает -NHC(Q)R2, где Q означает O или S, a R2 означает (C1-C6)алкильную группу;
B обозначает -NHC(Q)R2, C(Q)OR2, где Q и R2 имеют вышеуказанные значения;
G1 и G3 обозначают возможно разветвленную алкиленовую группу,
Cy и Cy' обозначает нафтил, 1,4-бензодиоксин, тетрагидронафтил, бензотиенил, дигидробензотиенил, бензофурил, дигидробензофурил, пирроло[3,2-b]пиридинил, индолил, индолинилпиридинил, индолил, индолинил;
G2 обозначает окси(C1-C6)алкоксигруппу;
их энантиомеры и диастереоизомеры и их аддитивные соли фармацевтически приемлемой кислоты или основания.
2. Соединения формулы (I) по п.1, которые являются
N-(2-{7-[2-({3-[2-(ацетиламино)этил]-1-бензофуран-5-ил}окси)этокси]-1-нафтил}этил)ацетамидом,
N-(2-{5-[2-({8-[2-(ацетиламино)этил]-2-нафтил}окси)этокси]-1-бензофуран-3-ил}этил)-2-фурамидом,
N-(2-{5-[2-({8-[2-(ацетиламино)этил]-2-нафтил}окси)этокси]-1H-пирроло[2,3-b]пиридин-3-ил}этил)циклопропанкарбоксамидом,
N-(2-[7-[3-({3-[2-(ацетиламино)этил]-1-бензотиофен-5-ил}окси)пропокси]-1-нафтил}этил)ацетамидом,
N-[2-(5-{(6-({8-[2-(ацетиламино)этил]-2-нафтил}окси)гексил]окси}-1H-пирроло[2,3-b]пиридин-3-ил)этил]ацетамидом,
N-(2-{5-[4-({3-[2-(ацетиламино)этил]-1-бензотиен-5-ил}окси)бутокси]-1H-индол-3-ил}этил)ацетамидом,
N-(2-{5-[4-({3-[2-(ацетиламино)этил]-1-бензотиен-5-ил}окси)бутокси]-1H-пирроло[2,3-b]пиридин-3-ил}этил)ацетамидом,
N-(2-{5-[4-({3-[2-(ацетиламино)этил]-1-бензофуран-5-ил}окси)бутокси]-1H-пирроло[2,3-b]пиридин-3-ил}этил)ацетамидом,
N-(2-{5-[4-({3-[2-(ацетиламино)этил]-1H-индол-5-ил}окси)бутокси]-1H-пирроло[2,3-b]пиридин-3-ил}этил)ацетамидом,
и их аддитивные соли фармацевтически приемлемой кислоты или основания.
3. Соединения формулы (I) по п.1, которые являются
N-(2-{7-[4-({3-[2-(ацетиламино)этил]-1-бензофуран-5-ил}окси)бутокси]-1-нафтил}этил)ацетамидом,
N-{2-[5-[4-({8-[2-(ацетиламино)этил]-2-нафтил}окси)бутокси]-1-(фенилсульфонил)-1H-индол-3-ил]этил}ацетамидом,
N-(2-{7-[4-({8-[2-(ацетиламино)этил]-2-нафтил}окси)бутокси]-1,2,3,4-тетрагидро-1-нафталенил}этил)ацетамидом,
N-(2-{5-[4-({3-[2-(ацетиламино)этил]-1-бензофуран-5-ил}окси)бутокси]-1H-индол-3-ил}этил)ацетамидом,
N-(2-{7-[4-({3-[2-(ацетиламино)этил]-1-бензотиен-5-ил}окси)бутокси]-1-нафтил}этил)ацетамидом,
и их аддитивные соли фармацевтически приемлемой кислоты или основания.
4. Соединения формулы (I) по п.1, которые являются
N-[2-(7-{3-[2-(ацетиламино)этил]-1-бензофуран-5-ил}-1-нафтил)этил]ацетамидом,
N-[3-[5-{8-[2-(ацетиламино)этил]-2-нафтил}-1H-пирроло[2,3-b]пиридин-3-ил]пропил]гептанамидом,
N-[2-(7-{3-[2-(ацетиламино)этил]-1-бензотиен-5-ил}-1-нафтил)этил]ацетамидом,
N-[2-(5-{8-[2-(ацетиламино)этил]-2-нафтил}-1H-пирроло[2,3-b]пиридин-3-ил)этил]ацетамидом,
N-[2-(5-{3-[2-(ацетиламино)этил]-1-бензофуран-5-ил}-1-бензотиен-3-ил)этил]ацетамидом,
N-[2-(5-{3-[2-(ацетиламино)этил]-1-бензофуран-5-ил}-1H-индол-3-ил)этил]ацетамидом,
N-[2-(5-{3-[2-(ацетиламино)этил]-1-бензофуран-5-ил}-1H-пирроло[2,3-b]пиридин-3-ил)этил]ацетамидом,
N-[2-(5-{3-[2-(ацетиламино)этил]-1H-индол-5-ил}-1H-пирроло[2,3-b]пиридин-3-ил)этил]ацетамидом,
N-[2-(5-{3-[2-(ацетиламино)этил]-1-бензотиен-5-ил}-1H-пирроло[2,3-b]пиридин-3-ил)этил]ацетамидом,
и их аддитивные соли фармацевтически приемлемой кислоты или основания.
5. Способ получения соединений формулы (I) по п.1, отличающийся тем, что в качестве исходного соединения используют соединение формулы (V)
A-G1-Cy-OMe (V),
где A, G1 и Cy имеют значения, как определено для формулы (I),
которое подвергают деметилированию с использованием обычных реагентов, таких как HBr, AlCl3, AlBr3, BBr3 или бинарные системы кислота Льюиса/нуклеофил, например, такие как AlCl3/PhCH2SH или BBr3/Me2S для получения соединения формулы (VI)
A-G1-Cy-OH (VI),
где A, G1 и Cy имеют значения, как определено ранее,
которое превращают обычным способом
путем воздействия, например, N,N-диметилтиокарбамата натрия в соответствующий тиол формулы (VII)
A-G1-Cy-SH (VII),
где A, G1 и Cy имеют значения, как определено ранее,
или в соответствующий амин формулы (VIII)
A-G1-Cy-NHR'a (VIII),
где A, G1 и Cy имеют значения, как определено ранее, и R'a может иметь одно из значений Ra, как определено для формулы (I), и также может представлять атом водорода, причем
соединения формул (VI), (VII) и (VIII) представляют соединение формулы (IX)
A-G1-Cy-W4H (IX),
где W4 представляет атом кислорода или серы или группу NH или NRa (где Ra имеет значения, как определено ранее),
соединение формулы (IX) конденсируют с
соединением формулы (X)
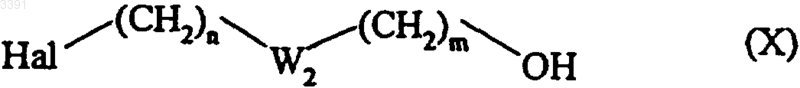
где Hal представляет атом брома, хлора или иода и n, W2 и m имеют значения, как определено для формулы (I) (при условии, что невозможно иметь два последовательных гетероатома, и что цепь, определенная таким образом, может иметь одну или более ненасыщенных связей),
или соединением формулы (XI)
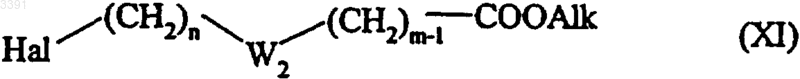
где Hal, n, m и W2 имеют значения, как определено ранее, и Alk представляет алкильный радикал (при условии, что невозможно иметь два последовательных гетероатома, и что цепь, определенная таким образом, может иметь одну или более ненасыщенных связей) с последующим восстановлением,
с получением соединения формулы (XII)
A-G1-Cy-W4-(CH2)n-W2-(CH2)m-OH (XII),
где A, G1, Cy, W4, n, m и W2 имеют значения, как определено ранее (при условии, что невозможно иметь два последовательных гетероатома в цепи -W4-(CH2)n-W2-(CH2)m-OH и что цепь, определенная таким образом, может иметь одну или более ненасыщенных связей),
гидроксильная функциональная группа которого превращается обычным образом в уходящую группу, например, такую как мезилат, тозилат или галоген, для получения соединения формулы (XII')
A-G1-Cy-W4-(CH2)n-W2-(CH2)m-E (XII')
где A, G1, Cy, W4, n, m и W2 имеют значения, как определено ранее, и E представляет радикал мезил или тозил или атом галогена,
которое подвергают воздействию соединения формулы (XIII)
B-G3-Cy'-W'4H (XIII),
где B, G3 и Cy' являются такими, как определено для формулы (I), и W'4 может иметь такие же значения, что для W4, определенные ранее,
с получением соединения формулы (I/a), частный случай соединений формулы (I)
A-G1-Cy-W4-(CH2)n-W2-(CH2)m-W'4-Cy'-G3-B (I/a),
где A, G1, Cy, Cy', W4, n, W2, m, W'4, G3 и B имеют значения, как определено ранее;
или превращают с использованием, например, фенил бис(трифторметансульфонимида) в щелочной среде в соответствующий трифторметансульфонат формулы (XIV)
A-G1-Cy-OSO2CF3 (XIV),
где A, G1 и Cy имеют значения, как определено ранее, который подвергают в условиях катализа с подходящим соединением палладия воздействию соединения борэющ кислоты (RbB(OH)2) или соединения олова (RbSnBu3) (где Rb представляет группу формулы (XV))
B-G3-Cy'-W3-(CH2)m-W2-(CH2)n-CH2- (XV),
где B, G3, Cy', W3, m, W2 и n имеют значения, как определено ранее, при условии, что невозможно иметь два последовательных гетероатома в цепи W3-(CH2)m-W2 и что цепь, определенная таким образом, может иметь одну или более ненасыщенных связей, с получением соединения формулы (I/b), частный случай соединений формулы (I)
A-G1-Cy-CH2-(CH2)n-W2-(CH2)m-W3-Cy'-G3-B (I/b),
где A, G1, Cy, Cy', n, W2, m, W3, G3 и B являются такими, как определено ранее (при условии, что невозможно иметь два последовательных гетероатома в цепочке W2-(CH2)m-W3-, и что цепь, определенная таким образом, может иметь одну или более ненасыщенных связей), причем
соединения формулы (I/c), частный случай соединений формулы (I)
A-G1-Cy-W1-(CH2)n-W2-(CH2)m-CH2-Cy'-G3-B (I/c),
где A, G1, Cy, Cy', W1, n, W2, m, G3 и B имеют значения, как определено ранее (при условии, что невозможно иметь два последовательных гетероатома в цепи W1-(CH2)n-W2-, и что цепь, определенная таким образом, может иметь одну или более ненасыщенных связей),
получают аналогичным способом, начиная с соединения формулы (XIV')
B-G3-Cy'-OSO2CF3 (XIV'),
где B, G3 и Cy' являются такими, как определено ранее,
или обрабатывают в условиях сочетания с использованием, например, соединений никеля или палладия, соединением формулы (XIV') для получения соединения формулы (I/d), частный случай соединений формулы (I)
A-G2-Cy-Cy'-G3-B (I/d),
где A, G2, Cy, Cy', G3 и B имеют значения, как определено ранее,
все количество соединений от (I/a) до (I/d), составляющее соединения формулы (I), которые можно очистить, если желательно, обычными способами очистки, разделяют, где уместно, на их изомеры обычными способами разделения и превращают, если необходимо, в их аддитивные соли фармацевтически приемлемой кислоты или основания.
6. Фармацевтические композиции, содержащие в качестве активного компонента, по меньшей мере, одно соединение формулы (I) по одному из пп.1-4 или его аддитивную соль с фармацевтически приемлемыми кислотой или основанием в сочетании с одним или более фармацевтически приемлемым наполнителем.
7. Фармацевтические композиции по п.6 для использования в производстве лекарственного препарата для лечения заболеваний, связанных с мелатонинергической системой.
Текст
1 Настоящее изобретение относится к новым димерным соединениям, способу их получения и фармацевтическим композициям, содержащим их. Из предыдущего уровня техники димерные структуры известны в ряду производных нафталина (J.Chem. Soc., Dalton Trans., 1979, (10), pp. 1497-502), которые изучали благодаря их координационным свойствам в комплексах металлов, или в ряду производных индола благодаря их курареподобной активности (Khim.-Farm.Zh., 1984, 18 (1), pp. 29-31). Кроме того, в заявках WO 9600720 и WO 9414771 описываются смешанные димерные структуры для использования в качестве 5-НТ 1-лиганд и синтеза промежуточных соединений, соответственно. Благодаря их ранее неизвестной структуре,соединения по настоящему изобретению являются новыми и обладают фармакологическими свойствами, которые являются очень полезными в отношении мелатонинергических рецепторов. В многочисленных исследованиях последних десяти лет была показана ключевая роль мелатонина (N-ацетил-5-метокситриптамина) во многих физиопатологических явлениях и в регуляции циркадного ритма. Однако период его полураспада является довольно коротким, благодаря тому, что он быстро метаболизируется. Следовательно, большой интерес лежит в возможности обеспечения врача аналогами мелатонина, которые являются метаболически более стабильными, имеют агонистические или антагонистические свойства и которые, как можно ожидать, будут оказывать более сильное терапевтическое действие, чем таковое у самого гормона. В дополнении к полезному действию в отношении нарушений циркадного ритма(J.Neurosurg., 1985, 63, pp. 321-341) и нарушений сна (Psychopharmacology, 1990, 100, pp. 222226) лиганды мелатонинергической системы обладают полезными фармакологическими свойствами в отношении центральной нервной системы, особенно анксиолитическими и антипсихотическими свойствами (Neuropharmacology of Pineal Secretions, 1990, 8 (3-4), pp. 264272) и обезболивающими свойствами (Pharmacopsychiat, 1987, 20, pp. 222-223), а также для лечения болезни Паркинсона (J.Neurosurg.,1985, 63, pp. 321-341) и болезни Алцгеймера(Brain Research, 1990, 528, pp. 170-174). Эти соединения также проявили активность в отношении некоторых видов опухолей (Melatonin Clinical Perspectives, Oxford University Press,1988, pp. 164-165), овуляции (Science 1987, 227,pp. 714-720), диабета (Clinical Endocrinology,1986, 24, pp. 359-364) и при лечении ожирения(4), pp. 443-446). Эти различные эффекты осуществляются при участии специфических рецепторов мелатонина. В опытах по молекулярной биологии 2 было показано наличие ряда подтипов рецепторов, которые способны связываться с этим гормоном (Trends Pharmacol. Sci, 1995, 16, р. 50;WO 97.04094). Оказалось возможным для некоторых видов, включая млекопитающих, определить локализацию и охарактеризовать некоторые из этих рецепторов. Для того, чтобы стало возможным лучше понять физиологические функции этих рецепторов, большим преимуществом является то, что имеются в наличии специфические лиганды. Более того, такие соединения, взаимодействуя избирательно с одним или другим рецептором, могут быть прекрасными лекарственными препаратами для врача при лечении патологий, связанных с мелатонинергической системой, некоторые из которых были упомянуты выше. В дополнении к факту о том, что соединения по настоящему изобретению являются новыми, они показывают очень сильную аффинность в отношении мелатониновых рецепторов и/или избирательность для одного или другого из подтипов мелатонинергических рецепторов. Более конкретно настоящее изобретение относится к соединениям формулы (I)Q представляет атом серы или кислорода;R1, R2 или R3, которые могут быть одинаковыми или различными, представляют атом водорода или группу Ra (где Ra представляет незамещенную или замещенную линейную или разветвленную (C1-C6)алкильную группу, незамещенную или замещенную линейную или разветвленную (С 2-С 6)алкенильную группу, незамещенную или замещенную линейную или разветвленную (С 2-С 6)алкинильную группу, незамещенную или замещенную (С 3-С 8)циклоалкильную группу, незамещенную или замещенную циклоалкил(С 3-С 8)алкильную группу, в которой алкильный фрагмент является линейным или разветвленным, полигалоген(C1-C6) алкильная группа, в которой алкильный фрагмент является линейным или разветвленным,арильную группу, арил-(C1-С 6)алкильную группу, в которой алкильный фрагмент является линейным или разветвленным, арил-(С 2-С 6)алкильную группу, в которой алкенильный фрагмент является линейным или разветвленным,гетероарильную группу, гетероарил-(C1-C6)алкильную группу, в которой алкильный фрагмент является линейным или разветвленным или гетероарил-(С 2-С 6) алкенильную группу, в которой алкенильный фрагмент является линейным или разветвленным, или радикалы R2 и R3 могут образовать с атомом азота, несущим их, радикал, выбранный из пиперазинила, пиперидинила и пирролидинила; В представляет группы формул где Q, R1, R2 и R3 имеют значения, как определено выше,G1 и G3, которые могут быть одинаковыми или различными, представляют линейную или разветвленную алкиленовую цепь, содержащую от 1 до 4 атомов углерода, которая необязательно замещена одним или более одинаковыми или различными радикалами, выбранными из гидрокси, карбокси, формила, Ra, ORa, COORa иCORa (где Ra является, как определено ранее),Су и Су', которые являются различными,представляют кольцевую структуру формулы (II) где Х и Y, которые могут быть одинаковыми или различными, представляют атом серы, кислорода или углерода или СН- или СН 2-группу;R4 представляет атом водорода или галогена или радикал СF3, гидрокси, карбокси, формил, амино, NHRa, NRaR1a, NHCORa, CONHRa,Ra, ORa, CORa или COORa (где Ra является, как определено ранее, и R1a может иметь любое из значений Ra); символ - - - - - означает, что связь является одинарной или двойной при условии, что валентность атомов соблюдается; где G2 замещает бензольное кольцо, и G1 замещает кольцо, содержащее Х и Y в случае Су,и G2 замещает бензольное кольцо, и G3,замещает кольцо, содержащее Х и Y в случае Су',или кольцевая структура формулы (III):Z представляет атом серы или кислорода или радикал СН 2, NH, NSO2Ph или NRa (где Ra является, как определено ранее),D представляет бензольное или пиридиновое кольцо,R4 является, как определено ранее,символ - - - - - означает, что связь является ординарной или двойной при условии, что валентность атомов соблюдается,где G2 замещает кольцо D и G1 замещает кольцо, содержащее Z в случае Су, иG2 замещает кольцо D и G3 замещает кольцо, содержащее Z в случае Су', два разных кольца Су и Су' соединений формулы (I), оба представлены структурой формулы (II) или структурой формулы (III), или одно из двух колец представлено структурой формулы (II) и другое представлено структурой формулы (III).G2 представляет цепь формулы (IV): 4 где W1, W2 и W3, которые могут быть одинаковыми или различными, представляют связь,атом кислорода или серы, или радикал CH2,CHRa, NH или NRa (где Ra является, как определено ранее);m представляет целое число, где 0m6; при условии, что невозможно иметь два последовательных гетероатома и что цепь формулы (IV), определенная таким образом, может иметь одну или более ненасыщенных связей,понимается, что арил означает группы нафтил, фенил и бифенил,гетероарил означает любую насыщенную или ненасыщенную моно- или бициклическую группу, содержащую от 5 до 10 кольцевых атомов и содержащую от 1 до 3 гетероатомов,выбранных из азота, серы и кислорода,возможно для групп арила и гетероарила быть замещенными одним или более одинаковыми или различными радикалами, выбранными из гидрокси, карбокси, линейного или разветвленного (C1-С 6)алкокси, линейного или разветвленного (С 1-С 6)алкила, полигалоген-(C1C6)алкила, в котором алкильный фрагмент является линейным или разветвленным, формила,циано, нитро, амино, линейного или разветвленного (C1-C6)алкиламино, ди-(C1-C6)алкиламино, в которых каждый алкильный фрагмент является линейным или разветвленным, и атомов галогена; термин замещенный, относящийся к терминам алкил, алкенил и алкинил, означает, что эти группы замещаются одним или более одинаковыми или различными радикалами, выбранными из гидрокси, линейного или разветвленного (C1-С 6)алкокси, полигалоген(C1-С 6)алкила, в котором алкильный фрагмент является линейным или разветвленным, амино,линейного или разветвленного (C1-С 6)алкиламино, ди-(C1-C6)алкиламино, в которых каждый алкильный фрагмент является линейным или разветвленным, или атомов галогена; термин замещенный, относящийся к терминам циклоалкил и циклоалкилалкил,означает, что циклическая часть этих радикалов замещается одним или более одинаковыми или различными радикалами, выбранными из гидрокси, линейного или разветвленного (C1-С 6) алкокси, полигалоген-(С 1-С 6)алкила, в котором алкильный фрагмент является линейным или разветвленным, амино, линейного или разветвленного (C1-С 6)алкиламино, ди-(С 1-С 6)алкиламино, в которых каждый алкильный фрагмент является линейным или разветвленным; и атомов галогена,к их энантиомерам и диастереоизомерам и их аддитивным солям фармацевтически приемлемой кислоты или основания. 5 Среди фармацевтически приемлемых кислот можно упомянуть в качестве неограничивающего примера соляную кислоту, бромистоводородную кислоту, серную кислоту, фосфоновую кислоту, уксусную кислоту, трифторуксусную кислоту, молочную кислоту, пировиноградную кислоту, малоновую кислоту, янтарную кислоту, глутаровую кислоту, фумаровую кислоту, винную кислоту, малеиновую кислоту,лимонную кислоту, аскорбиновую кислоту, метансульфокислоту, камфорную кислоту и т.д. Среди фармацевтически приемлемых оснований можно упомянуть в качестве неограничивающего примера гидроокись натрия, гидроокись калия, триэтиламин, трет-бутиламин и т.д. Предпочтительными соединениями по изобретению являются соединения формулы (I),где Су и Су', которые являются различными,представляют кольцевую структуру формулы(III), например, такую как индол, азаиндол, бензотиофен или бензофуран,Су представляет кольцевую структуру формулы (II) и Су' представляет кольцевую структуру формулы (III). Преимущественно, изобретение относится к соединениям формулы (I), где G2 представляет ординарную связь,или группу -W4-(СН 2)p-W'4- (где W4 и W'4,которые могут быть одинаковыми или различными, представляют атом кислорода или серы,или радикал NH или NRa, и р представляет собой целое число, где 1 р 12), например, такую, как группа -О-(СН 2)p-O- (где р является,как определено ранее),или группу формулы -W4(СН 2)p'-W'4(СН 2)p"-W"4- (где W4, W'4 и W"4, которые могут быть одинаковыми или различными, представляют атом кислорода или серы, или радикал NH или NRa, и р' и р" являются целыми числами,где 2 р' + р"12), например, такую как группа -О-(СН 2)p'-O-(СН 2)р"-O- (где р' и р" являются,как определено ранее). Предпочтительными заместителями А и В по изобретению являются группы NR1C(Q)R2,NR1C(Q)NR2R3 и C(Q)NR2RЗ и более конкретно группы NR1COR2 и CONSR2R3. Еще более конкретно, изобретение относится к соединениям формулы (I), которые являются 7 Энантиомеры, диастереоизомеры и их аддитивные соли фармацевтически приемлемой кислоты или основания предпочтительных соединений по изобретению представляют составляющую часть изобретения. Настоящее изобретение также относится к способу получения соединений формулы (I),отличающемуся тем, что в качестве исходного соединения используют соединение формулы(V),A-G1-Cy-OMe где A, G1 и Су являются, как определено для формулы (I), которое подвергают деметилированию с использованием обычных реагентов,таких как НВr, АlСl3, АlВr3, ВВr3 или бинарные системы кислота Льюиса/нуклеофил, например,такие как AlCl3/PhCH2SH или ВВr3/Ме 2S для получения соединения формулы (VI)(VI),A-G1-Cy-OH где A, G1 и Су являются, как определено ранее,которое превращают обычным способом при воздействии, например, N,N-диметилтиокарбамата натрия в соответствующий тиол формулы (VII)(VIII),A-G1-Cy-NHR'a где А, G1 и Су являются, как определено ранее,и R'a может иметь одно из значений Ra, как определено для формулы (I), и также может представлять атом водорода,эти соединения формул (VI), (VII) и (VIII) представляют соединение формулы (IX)(IX),A-G1-Cy-W4H где W4 представляет атом кислорода или серы или радикал NH или NRa (где Ra является, как определено ранее), это соединение формулы(IX) конденсируют с соединением формулы (X) где Hal представляет атом брома, хлора или йода и n, W2 и m являются, как определено для формулы (I) (при условии, что невозможно иметь два последовательных гетероатома и что цепь, определенная таким образом, может иметь одну или более ненасыщенных связей),или соединением формулы (XI) где Hal, n, m, и W; являются, как определено ранее, и Alk представляет радикал алкил (при условии, что невозможно иметь два последовательных гетероатома, и что цепь, определенная таким образом, может иметь одну или более ненасыщенных связей) с последующим восстановлением,с получением соединения формулы (XII)A-G1-Cy-W4-(CH2)n-W2-(CH2)m-OH (XII),где A, G1, Су, W4, n, m и W2 являются, как определено ранее (при условии, что невозможно иметь два последовательных гетероатома в цепи-W4-(СН 2)n-W2-(CH2)m-OH и что цепь, определенная таким образом, может иметь одну или более ненасыщенных связей),гидроксильная функциональная группа которого превращается обычным образом в уходящую группу, например, такую как мезилат,тозилат или галоген, для получения соединения формулы (ХII')(ХII'),A-G1-Cy-W4-(CH2)n-W2-(СН 2)m-E где A, G1, Су, W4, n, W2 и m являются, как определено ранее, и Е представляет радикал мезил или тозил или атом галогена,которое подвергают воздействию соединения формулы (XIII)(XIII),B-G3-Cy'-W'4H где В, G3 и Су' являются, как определено для формулы (I), и W'4 может иметь такие же значения, что для W4, определенные ранее, с получением соединения формулы (I/a), частный случай соединений формулы (I)A-G1-Cy-W4-(CH2)n-W2-(СН 2)m-W'4-Су'-G3-В (I/a),где А, G1, Су, Су', W4, n, W2, m, W'4, G3 и В являются, как определено ранее; или превращают с использованием, например, фенил бис(трифторметансульфонимида) в щелочной среде в соответствующий трифторметансульфонат формулы (XIV)(XIV),A-G1-Cy-OSO2CF3 где А, G1 и Су являются, как определено ранее,который подвергают в условиях катализа с пригодным соединением палладия воздействию соединения борной кислоты (RbВ(ОН)2) или соединения олова (RbSnВu3) (где Rb представляет группу формулы (XV В-G3-Су'-W3-(СН 2)m-W2-(СН 2)n-CH2- (XV),где В, G3, Су', W3, m, W2 и n являются, как определено ранее, при условии, что невозможно иметь два последовательных гетероатома в цепиW3-(CH2)m-W2 и что цепь, определенная таким образом, может иметь одну или более ненасыщенных связей, с получением соединения формулы (I/b), частный случай соединений формулы (I)A-G1-Cy-CH2-(CH2)n-W2-(СH2)m-W3-Cy'-G3-В (I/b),где A, G1, Су, Су', n, W2, m, W3, G3 и В являются, как определено ранее (при условии, что невозможно иметь два последовательных гетероатома в цепочке -W2-(CH2)m-W3- и что цепь, определенная таким образом, может иметь одну или более ненасыщенных связей), эти соединения формулы (I/с), частный случай соединений формулы (I)A-G1-Cy-W1-(CH2)n-W2-(CH2)m-CH2-Cy'-G3-B (I/c),где А, G1, Су, Су', W1, n, W2, m, G3 и В являются, как определено ранее (при условии, что невозможно иметь два последовательных гетероатома в цепи -W1-(CH2)n-W2-, и что цепь, определенная таким образом, может иметь одну или более ненасыщенных связей), получают аналогичным способом, начиная с соединения формулы (XIV'): 9 где В, G3 и Су' являются, как определено ранее,или обрабатывают в условиях сочетания с использованием, например, соединений никеля или палладия, соединением формулы (XIV') для получения соединения формулы (I/d), частный случай соединений формулы (I)(I/d),A-G1-Cy-Cy'-G3-B где А, G1, Су, Су', G3 и В являются, как определено ранее, все количество соединений от (I/a) до (I/d), составляющее соединения формулы (I),которые можно очистить, если желательно,обычными способами очистки, разделяют, где уместно, на их изомеры обычными способами разделения и превращают, если необходимо, в их аддитивные соли фармацевтически приемлемой кислоты или основания. Соединения формулы (V) легко доступны для получения специалистами в этой области с использованием способов, описанных в литературе. Соединения по изобретению и фармацевтические композиции, содержащие их, показали себя пригодными для лечения нарушений мелатонинергической системы. Фармакологическое изучение соединений по изобретению реально показало, что они являются нетоксичными, обладают высокой аффинностью к мелатониновым рецепторам и имеют существенную активность в отношении центральной нервной системы и в отношении микроциркуляции, давая возможность установить, что соединения по изобретению полезны для лечения стресса, нарушений сна, состояния тревоги, сезонных аффективных расстройств,сердечно-сосудистых патологий, патологий пищеварительной системы, бессоницы и утомления в результате расстройства циркадного ритма, шизофрении, приступов паники, меланхолии, нарушений аппетита, ожирения, бессоницы, боли, психотических расстройств, эпилепсии, диабета, болезни Паркинсона, старческого слабоумия, различных нарушений, связанных с нормальным и патологическим старением, мигрени, потери памяти, болезни Алцгеймера и нарушений мозгового кровообращения. В другой области активности оказалось, что соединения по изобретению можно использовать при лечении половых дисфункций, что они обладают ингибирующим действием на овуляцию и иммуномодулирующими свойствами и способны использоваться для лечения опухолей. Соединения будут предпочтительно использоваться для лечения сезонных аффективных расстройств, нарушений сна, сердечнососудистых патологий, бессонницы и утомления в результате нарушения циркадного ритма, нарушений аппетита и ожирения. Например, соединения будут использоваться при лечении сезонных аффективных расстройств и нарушений сна. Настоящее изобретение также относится к фармацевтическим композициям, включающим 10 эффективное количество, по меньшей мере, одного соединения формулы (I) самого по себе или в сочетании с одним или более фармацевтически приемлемым наполнителем. Среди фармацевтических композиций по изобретению более конкретно можно упомянуть те, которые пригодны для перорального, парентерального, интраназального, внутри- и транскожного, ректального, перлингвального, глазного и ингаляционного введения и, в частности,таблетки или драже, сублингвальные таблетки,саше, пакеты, желатиновые капсулы, глоссетте,лозинджис, суппозитории, кремы, мази, дермальные гели и растворы в ампулах для питья и инъекций. Доза варьирует в зависимости от пола,возраста и массы пациента, пути введения, природы лечебного назначения или любых связанных видов лечения и находится в пределах от 0,01 мг до 1 г в течение 24 ч при одном или более введений. Следующие примеры иллюстрируют изобретение, но ни коим образом не ограничивают его. Следующие способы получения дают соединения по изобретению или промежуточные продукты синтеза для использования в способе получения по изобретению. Получение 1. N-[2-(7-Гидрокси-1-нафтил) этил]ацетамад. В инертной атмосфере 27,5 ммоль комплекса трибромида бора/диметилсульфоксида растворяют в 100 мл дихлорметана и перемешивают в течение 15 мин при комнатной температуре. Добавляют 13,7 ммоль N-[2-(7-метокси-1 нафтил)этил]ацетамида в 50 мл дихлорметана и реакционную смесь кипятят с обратным холодильником в течение 30 ч. После охлаждения реакционную смесь осторожно гидролизуют и удаляют при выпаривании дихлорметан. Затем смесь экстрагируют этилацетатом и объединенные органические фазы промывают 1 М водным раствором бикарбоната натрия. Органическую фазу высушивают над сульфатом магния и концентрируют для получения титульного соединения. Белое твердое вещество. Точка плавления: 125-126 С. Получения 2-35 проводят, следуя получению 1, начиная с соответствующего субстрата. Получение 2. N-[2-(5-Гидрокси-1-бензофуран-3-ил)этил]ацетамид. Получение 3. N-[2-(5-Гидрокси-1-бензофуран-3-ил)этил]циклопропанкарбоксамид. Получение 4. N-[2-(5-Гидрокси-1-бензофуран-3-ил)этил]-2-фурамид. Получение 5. N-[2-(7-Гидрокси-1-нафтил) этил]бензамид. Получение 6. N-[2-(7-Гидрокси-1-нафтил) этил]-3-бутенамид. Получение 7. N-[2-(5-Гидрокси-1-бензофуран-3-ил)этил]-2-метилпропанамид. Получение 8. N-[2-(7-Гидрокси-1-нафтил) этил]-2-фенилацетамид. 11 Получение 9. N-[2-(5-Гидрокси-1-бензотиофен-3-ил)этил]ацетамид. Получение 10. N-[2-(5-Гидрокси-1 Н-пирроло[2,3-b]пиридин-3-ил)этил]циклопропанкарбоксамид. Получение 11. N-[2-(5-Гидрокси-1 Н-индол-3-ил)этил]ацетамид. Получение 12. N-[2-(5-Гидрокси-1 Н-пирроло[2,3-b]пиридин-3-ил)этил]ацетамид. Получение 13. N-[2-(7-Гидрокси-1-нафтил) этил]циклобутанкарбоксамид. Получение 14. 2,2,2-Трифтор-N-[2-(7-гидрокси-1-нафтил)этил]ацетамид. Получение 15. N-[(6-Гидрокси-2 Н-хромен 3-ил)метил]бутанамид. Получение 16. N-[(6-Гидрокси-2 Н-хромен 3-ил)метил]ацетамид. Получение 17. N-[(7-Гидрокси-1,4-бензодиоксин-2-ил)метил]-N'-пропилмочевина. Получение 18. N-[(7-Гидрокси-1,4-бензодиоксин-2-ил)метил]ацетамид. Получение 19. N-[2-(7-Гидрокси-1-нафтил) этил]фурамид. Получение 20. N-[2-(2-Бензил-5-гидрокси 1 Н-пирроло[2,3-b])-пиридин-3-ил)этил]ацетамид. Получение 21. N-[2-(5-Гидрокси-1-бензотиофен-3-ил)этил]циклогексанкарбоксамид. Получение 22. N-Гексил-2-(5-гидрокси-1 бензофуран-3-ил)ацетамид. Получение 23. 2,2,2-Трифтор-N-[2-(5 гидрокси-1-бензотиофен-3-ил)этил]ацетамид. Получение 24. N-[2-(6-Гидрокси-3,4-дигидро-2 Н-хромен-4-ил)-этил]ацетамид. Получение 25. N-[2-(7-Гидрокси-1,2,3,4 тетрагидро-1-нафталенил)этил]ацетамид. Получение 26. N-[2-(7-Гидрокси-1,2,3,4 тетрагидро-1-нафталенил)этил]циклопропанкарбоксамид. Получение 27. N-[2-(7-Гидрокси-1-нафтил) этил]гептанамид. Получение 28. N-[2-(5-Гидрокси-1 Н-индол-3-ил)этил]циклобутанкарбоксамид. Получение 29. 4-(7-Гидрокси-1-нафтил)-Nизопропилбутанамид. Получение 30. N-[2-(5-Гидрокси-1-бензофуран-3-ил)этил]-N'-фенилмочевина. Получение 31. N-Бензил-2-(5-Гидрокси-1 бензотиофен-3-ил)ацетамид. Получение 32. N-[2-(5-Гидрокси-1 Н-инден-3-ил)этил]пентамид. Получение 33. 3-(5-Гидрокси-1-бензофуран-3-ил)-N-метилпропанамид. Получение 34. N-[2-(5-Гидрокси-1 Н-пирроло[2,3-b]пиридин-3-ил)этил]-N'-метилмочевина. Получение 35. 4-(5-Гидрокси-1 Н-индол-3 ил)-N-метилбутанамид. Получение 36. N-[2-(5-Меркапто-1-бензофуран-3-ил)этил]ацетамид. Добавляют при перемешивании продукт,полученный на стадии А (9 ммоль), к раствору 12 гидроокиси калия (10 ммоль), растворенному в 15 мл воды и 16 мл тетрагидрофурана. Раствор охлаждают, используя ледяную с солью баню и прикапывают при перемешивании диметилтиокарбамоилхлорид (9 ммоль), растворенный в тетрагидрофуране (15 мл). После перемешивания в течение получаса, одновременно поддерживая холодную температуру, реакционную смесь экстрагируют хлороформом. Органические фазы объединяют, высушивают над сульфатом магния, фильтруют и затем концентрируют при пониженном давлении. Остаток переводят в дифениловый эфир (10 мл) и кипятят с обратным холодильником в атмосфере азота. Дифениловый эфир удаляют отгонкой при пониженном давлении, пока не получено примерно 2 мл раствора. 2 мл дистиллята, который еще горячий, осторожно выливают в 50 мл гексана для получения после охлаждения твердого вещества, которое отделяют фильтрованием. Собранное таким образом твердое вещество добавляют к раствору гидроокиси калия (380 мг), растворенной в смеси воды/метанола (1 мл/10 мл). Раствор кипятят с обратным холодильником в течение 12 ч и затем охлаждают и концентрируют при пониженном давлении. Остаток переводят в 20 мл хлороформа и экстрагируют 3 раза водой. Органическую фазу высушивают над сульфатом магния, фильтруют и концентрируют при пониженном давлении. Остаток хроматографируют на силикагеле для получения титульного соединения. Получение 37. N-[2-(5-Меркапто-1-бензотиофен-3-ил)этил]бутанамид. Стадия А. N-[2-(5-Гидрокси-1-бензотиофен-3-ил)этил]бутанамид. Методика является такой, как для получения 1, начиная с N-[2-(5-метокси-1-бензотиофен-3-ил)этил]бутанамида. Стадия В. N-[2-(5-Меркапто-1-бензотиофен-3-ил)этил]бутанамид. Методика является такой, как для получения 36, начиная с соединения, полученного на стадии А. Получение 38. N-(2-5-Меркапто-2-[4(трифторметил)бензил]-1-бензотиофен-3-ил этил)ацетамид. Стадия А. N-(2-5-Гидрокси-2-[4-(трифторметил)бензил]-1-бензотиофен-3-илэтил) ацетамид. Методика является такой, как для получения 1, начиная с N-(2-5-метокси-2-[4-(трифторметил)бензил]-1-бензотиофен-3-илэтил)ацетамида. Стадия В. N-(2-5-Меркапто-2-[4-(трифторметил)бензил]-1-бензотиофен-3-илэтил) ацетамид. Методика является такой, как для получения 36, начиная с соединения, полученного на стадии А. 13 Получение 39. N-[2-(7-Меркапто-1,2,3,4 тетрагидро-1-нафталенил)этил]циклопропанкарбоксамид. Методика является такой, как для получения 36, начиная с соединения, полученного в способе получения 26. Получение 40. N-[2-(5-Амино-1-бензофуран-3-ил)этил]ацетамид. Стадия А. N-[2-(5-Бром-1-бензофуран-3 ил)этил]ацетамид. Трифенилфосфин (10 ммоль) и ацетонитрил вносят в трехгорлую колбу емкостью 150 мл, снабженную капельной воронкой, холодильником, на верху которого помещается трубка, наполненная хлоридом кальция, и механической мешалкой. Раствор охлаждают, используя ледяную баню, одновременно поддерживая перемешивание, и добавляют бром (10 ммоль). Когда заканчивают добавление, ледяную баню удаляют и затем добавляют продукт,полученный в способе получения 2 (8 ммоль). Реакционную смесь перемешивают при 60-70 С,пока не исчезнет исходное вещество. В конце реакции смесь фильтруют и затем фильтрат концентрируют при пониженном давлении. Остаток переносят в этилацетат, промывают водой и затем насыщенным раствором бикарбоната калия и вновь водой и затем высушивают над сульфатом магния и концентрируют при пониженном давлении. Остаток пропускают через силикагель для получения таким образом титульного соединения. Стадия В. N-[2-(5-Йод-1-бензофуран-3 ил)этил]ацетамид. Смесь продукта, полученного на стадии А(2 ммоль), йодида калия (30 ммоль) и йодида меди (I) (10 ммоль) в гексаметилфосфорамиде (6 мл) нагревают при 150-160 С при перемешивании в атмосфере азота, пока не достигается 90% превращения. Затем добавляют разбавленную соляную кислоту, затем эфир, и затем смесь фильтруют для удаления нерастворимых солей меди (I). Органическую фазу отделяют, промывают сульфитом натрия и водой, высушивают над сульфатом магния и выпаривают для получения остатка, который хроматографируют на силикагеле для получения титульного соединения. Стадия С. N-[2-(5-Винил-1-бензофуран-3 ил)этил]ацетамид 15 ммоль продукта, полученного на стадии В, 16 ммоль винилтрибутилолова и 0,43 ммоль тетракси(трифенилфосфин) палладия нагревают при 110 С при перемешивании в течение 3 ч в 30 мл N-метилпирролидинона. После удаления растворителя при выпаривании остаток переводят в 20 мл дихлорметана и обрабатывают 10% водным раствором фторида калия. В результате экстракции,концентрирования при пониженном давлении и хроматографии на силикагеле получают чистый титульный продукт. 14 Стадия D. N-[2-(5-Формил-1-бензофуран 3-ил)этил]ацетамид 1,10 г четырехокиси осмия в 2-метил-2-пропаноле и затем 8,70 г периодата натрия добавляют при комнатной температуре к раствору 10 ммоль продукта, полученного на стадии С, в смеси 50 мл диоксана и 25 мл воды. После перемешивания в течение ночи при комнатной температуре суспензию фильтруют и фильтрат концентрируют при пониженном давлении. Полученный остаток переводят в дихлорметан. Органическую фазу промывают водой, высушивают и выпаривают. Остаток очищают хроматографией на силикагеле для получения титульного соединения. Стадия Е. 3-[2-(Ацетиламино)этил]-1 бензофуран-5-карбоновая кислота. 2,7 г перманганата калия в 50 мл смеси ацетона/воды (50/50) добавляют при комнатной температуре к раствору 6,88 ммоль продукта, полученного на стадии D в 30 мл ацетона. Раствор перемешивают в течение 2 ч при комнатной температуре и затем фильтруют. Фильтрат концентрируют при пониженном давлении и хроматографируют на силикагеле для получения титульного соединения. Стадия F. 3-[2-Ацетиламино)этил]-1-бензофуран-5-карбоновой кислоты хлорид. 5 ммоль продукта, полученного на стадии Е, растворяют в 40 мл тионилхлорида. После перемешивания в инертной атмосфере в течение 1 ч тионилхлорид удаляют отгонкой при пониженном давлении для получения титульного соединения. Стадия G. N-[2-(5-Амино-1-бензофуран-3 ил)этил]ацетамид. Раствор продукта, полученного на стадииF (20 ммоль), в дихлорметане (30 мл), содержащий тетрабутиламмоний бромид (20 мг), охлаждают на ледяной бане. После добавления азида натрия (25 ммоль), растворенного в 5 мл воды,раствор энергично перемешивают при 0 С в течение 2 ч. Органическую фазу отделяют, промывают водой (2 х 5 мл) и высушивают над сульфатом магния. После фильтрования добавляют трифторуксусную кислоту (30 ммоль) и раствор перемешивают при кипячении с обратным холодильником в течение 60 ч. После охлаждения органическую фазу промывают насыщенным раствором бикарбоната натрия (2 х 5 мл) и концентрируют при пониженном давлении. Остаток переводят в метанол (20 мл) и добавляют воду (80 мл) и затем карбонат калия (30 ммоль). После перемешивания при комнатной температуре в течение 20 ч, реакционную смесь концентрируют при пониженном давлении до объема примерно 60 мл и затем экстрагируют 3 раза эфиром (3 х 50 мл). После высушивания над сульфатом натрия органическую фазу фильтруют и затем выпаривают при пониженном давлении. Остаток хроматографируют на силикагеле для получения титульного соединения. 15 Получение 41. N-[2-(5-Амино-1-бензотиофен-3-ил)этил]пентанамид. Стадия А. N-[2-(5-Гидрокси-1-бензотиофен-3-ил)этил]пентамид. Методика является такой, как для получения 1, начиная с N-[2-(5-метокси-1-бензотиофен-3-ил)этил]пентанамида. Стадия В. N-[2-(5-Амино-1-бензотиофен-3 ил)этил]пентанамид. Методика является такой,как для получения 40, начиная с соединения,полученного на стадии А. Получение 42.N-2-[5-Амино-2-(3 метоксибензил)-1-бензофуран-3-ил]этилацетамид. Стадия А. N-2-[5-Гидрокси-2-(3-метоксибензил)-1-бензофуран-3-ил]этилацетамид. Методика является такой, как для получения 1, начиная с N-2-[5-метокси-2-(3-метоксибензил)-1-бензофуран-3-ил]этилацетамида. Стадия В. N-2-[5-Амино-2-(3-метоксибензил)-1-бензофуран-3-ил]этилацетамид. Методика является такой, как для получения 40, начиная с соединения, полученного на стадии А. Получение 43. N-[2-(5-Амино-1-бензофуран-3-ил)этил]-2-фурамид. Методика является такой, как для получения 40, начиная с соединения, полученного в способе получения 4. Получение 44. N-[2-(5-Амино-1-бензофуран-3-ил)этил]-N'-циклопропилмочевина. Стадия А. N-[2-(5-Гидрокси-1-бензофуран 3-ил)этил]-N'-циклопропилмочевина. Методика является такой, как для получения 1, начиная с N-[2-(5-Метокси-1-бензофуран 3-ил)этил]-N'-циклопропилмочевины. Стадия В. N-[2-(5-Амино-1-бензофуран-3 ил)этил]-N'-циклопропилмочевина. Методика является такой, как для получения 40, начиная с соединения, полученного на стадии А. Получение 45. 3-[2-(Ацетиламино)этил]-1 бензофуран-5-ил трифторметансульфонат. 60 мл триэтиламина добавляют к раствору 0,07 ммоль соединения, полученного в способе получения 1, в одном литре дихлорметана. Реакционную смесь кипятят с обратным холодильником до растворения и затем добавляют 0,1 моль фенил бис(трифторметансульфонимида) и 0,75 моль карбоната калия. После кипячения с обратным холодильником в течение 4 ч, смесь промывают одним литром 1 М бикарбоната натрия и затем одним литром 1 М соляной кислоты. Органическую фазу высушивают, концентрируют и очищают хроматографией на силикагеле для получения титульного соединения. Получения 46-70 проводят, следуя получению 45. Получение 46. 8-[2-(Ацетиламино)этил]-2 нафтил трифторметансульфонат. Исходное вещество: получение 1. 16 Получение 47. 3-2-[(Циклопропилкарбонил)амино]этил-1-бензотиофен-5-ил трифторметансульфонат. Исходное вещество: N-[2-(5-гидрокси-1 бензотиофен-3-ил)этил]циклопропанкарбоксамид, полученный следуя получению 1, начиная сN-[2-(5-метокси-1-бензотиофен-3-ил)этил] циклопропанкарбоксамида. Получение 48. 8-(2-[(Метиламино)карбонил]аминоэтил)-2-нафтил трифторметансульфонат. Исходное вещество: N-[2-(7-гидрокси-1 нафтил)этил]-N'-метилмочевина,полученная следуя получению 1, начиная с N-[2-(7-метокси 1-нафтил)этил]-N'-метилмочевины. Получение 49. 3-2-[(Анилинокарбонил) амино]этил-1-бензофуран-5-ил трифторметансульфонат. Исходное вещество: получение 30. Получение 50. 3-[2-(2-(Фуроиламино) этил]-1-бензотиофен-5-ил трифторметансульфонат. Исходное вещество: N-[2-(5-гидрокси-1 бензотиофен-3-ил)-этил]-2-фурамид, полученный следуя получению 1, начиная с N-[2-(5 метокси-1-бензотиофен-3-ил)этил]-2-фурамида. Получение 51. 3-[2-(Бензиламино)-2 оксоэтил]-1 Н-индол-5-ил трифторметансульфонат. Исходное вещество: N-бензил-2-(5-гидрокси-1 Н-индол-3-ил)ацетамид,полученный следуя получению 1, начиная с N-бензил-2-(5 метокси-1 Н-индол-3-ил)ацетамида. Получение 52. 3-[3-(Бензоиламино)пропил]-1 Н-индол-5-ил трифторметансульфонат. Исходное вещество: N-[3-(5-гидрокси-1 Ниндол-3-ил)пропил]бензамид, полученный следуя получению 1, начиная с N-[3-(5-мeтокси 1 Н-индол-3-ил)пропил]бензамида. Получение 53. 3-[2-(Изобутириламино) этил]-1-бензотиофен-5-ил трифторметансульфонат. Исходное вещество: N-[2-(5-гидрокси-1 бензотиофен-3-ил)этил]-2-метилпропанамид,полученный следуя получению 1, начиная с N[2-(5-метокси-1-бензотиофен-3-ил)этил]-2 метилпропанамида. Получение 54. 3-[2-(Гептаноиламино) этил]-1H-пирроло[2,3-b]пиридин-5-ил трифторметансульфонат. Исходное вещество: N-[2-(5-гидрокси-1 Нпирроло[2,3-b]пиридин-3-ил)этил]гептанамид,полученный следуя получению 1, начиная с N[2-(5-метокси-1H-пирроло[2,3-b]пиридин-3-ил) этил]гептанамида. Получение 55. 3-[2-(Ацетиламино)этил]1H-пирроло[2,3-b]пиридин-5-ил трифторметансульфонат. Исходное вещество: получение 12. Получение 56. 3-[4-(Циклопентиламино)4-оксобутил]-1-бензофуран-5-ил трифторметансульфонат. 17 Исходное вещество: N-циклопентил-4-(5 гидрокси-1-бензофуран-3-ил)бутанамид, полученный следуя получению 1, начиная с Nциклопентил-4-(5-метокси-1-бензофуран-3-ил) бутанамида. Получение 57. 3-2-[(Циклопропилкарбонил)амино]этил-1 Н-пирроло-[2,3-b]пиридин-5 ил трифторметансульфонат. Исходное вещество: получение 10. Получение 58. 3-(2-[(Аллиламино)карбонил]аминоэтил)-1-бензотиофен-5-ил трифторметансульфонат. Исходное вещество: N-аллил-N'-[2-(5 гидрокси-1-бензотиофен-3-ил)этил]мочевина,полученная следуя получению 1, начиная с Nаллил-N'-[2-(5-метокси-1-бензотиофен-3-ил) этил]мочевины. Получение 59. 3-[(Ацетиламино)этил]-1,4 бензодиоксин-6-илтрифторметансульфонат. Исходное вещество: получение 18. Получение 60. 3-[2-(Изобутириламино) этил]-1-бензофуран-5-ил трифторметансульфонат. Исходное вещество: получение 7. Получение 61. 4-2-[(2,2,2-Трифторацетил) амино]этил-3,4-дигидро-2 Н-хромен-6-ил трифторметансульфонат. Исходное вещество: 2,2,2-трифтор-N-[2-(6 гидрокси-3,4-дигидро-2 Н-хромен-4-ил)этил] ацетамид, полученный следуя получению 1,начиная с 2,2,2-трифтор-N-[2-(6-метокси-3,4 дигидро-2 Н-хромен-4-ил)этил]ацетамида. Получение 62. 3-(4-Анилино-4-оксобутил)1-бензотиофен-5-ил трифторметансульфонат. Исходное вещество: 4-(5-гидрокси-1-бензотиофен-3-ил)-N-фенилбутанамид, полученный следуя получению 1, начиная с 4-(5-метокси-1 бензотиофен-3-ил)-N-фенилбутанамида. Получение 63. 3-[(Ацетиламино)метил]3,4-дигидро-2 Н-хромен-6-ил трифторметансульфонат. Исходное вещество: N-[(6-гидрокси-3,4 дигидро-2 Н-хромен-3-ил)метил]ацетамид, полученный следуя получению 1, начиная с N-[(6 метокси-3,4-дигидро-2 Н-хромен-3-ил)метил] ацетамида. Получение 64. 3-[2-(Ацетиламино)этил]-2[4-(трифторметил)бензил]-1-бензофуран-5-ил трифторметансульфонат. Исходное вещество. N-(2-(5-Гидрокси-2[4-(трифторметил)бензил]-1-бензофуран-3-ил этил)ацетамид, полученный следуя получению 1, начиная с N-(2-5-метокси-2-[4-(трифторметил)бензил]-1-бензофуран-3-илэтил)ацетамида. Получение 65. 3-(2-[(Метиламино)карбонил]аминоэтил-1 Н-индол-5-ил трифторметансульфонат. Исходное вещество: N-[2-(5-гидрокси-1 Ниндол-3-ил)этил]-N'-метилмочевина, полученная следуя получению 1, начиная с N-[2-(5 003391 18 метокси-1 Н-индол-3-ил)этил]-N'-метилмочевины. Получение 66. 4-2-[2,2-(Диметилпропаноил)амино]этил-3,4-дигидро-2 Н-хромен-6-ил трифторметансульфонат. Исходное вещество: N-[2-(6-гидрокси-3,4 дигидро-2 Н-хромен-4-ил)этил]-2,2-диметилпропанамид, полученный следуя получению 1, начиная с N-[2-(6-метокси-3,4-дигидро-2 Н-хромен-4-ил)этил]-2,2-диметилпропанамида. Получение 67. 3-[2-(Ацетиламино)этил]1 Н-индол-5-ил трифторметансульфонат. Исходное вещество: N-ацетилсеротонин. Получение 68. 3-[(Циклогексилкарбонил) амино]метил-1,4-бензодиоксин-6-ил трифторметансульфонат. Исходное вещество: N-[(7-гидрокси-1,4 бензодиоксин-2-ил)метил]циклогексанкарбоксамид, полученный следуя получению 1, начиная с N-[(7-метокси-1,4-бензодиоксин-2-ил)метил]циклогексанкарбоксамида. Получение 69. 3-[2-(Ацетиламино)этил]-2(3-метоксибензил)-1-бензотиофен-5-ил трифторметансульфонат. Исходное вещество: N-2-[5-гидрокси-2(3-метоксибензил)-1-бензотиофен-3-ил]этил ацетамид, полученный следуя получению 1,начиная с N-2-[5-метокси-2-(3-метоксибензил)1-бензотиофен-3-ил]этилацетамида. Получение 70. 3-[3-(Ацетиламино)пропил]-1-бензофуран-5-илтрифторметансульфонат. Исходное вещество: N-[3-(5-гидрокси-1 бензофуран-3-ил)пропил]ацетамид, полученный следуя получению 1, начиная с N-[3-(5-метокси 1-бензофуран-3-ил)пропил]ацетамида. Получение 71. N-2-[5-Гидрокси-1-(фенилсульфонил)-1 Н-индол-3-ил]этилацетамид. Стадия А. N-2-[5-Метокси-1-(фенилсульфонил)-1H-индол-3-ил]этилацетамид. 5 г мелатонина растворяют в 150 мл дихлорметана и затем добавляют 3,41 г гидроокиси натрия и 0,35 г тетрабутиламмония бисульфата. Затем реакционную смесь охлаждают на ледяной бане и прикапывают 4,06 мл бензолсульфонилхлорида. После перемешивания в течение ночи при комнатной температуре избыток гидроокиси натрия и катализатор отфильтровывают, растворитель удаляют при выпаривании в вакууме, и полученное твердое вещество перекристаллизуют для получения титульного продукта в виде белых кристаллов. Точка плавления: 140-141 С. Стадия В. N-2-[5-Гидрокси-1-(фенилсульфонил)-1H-индол-3-ил]этилацетамид. 5 г соединения, полученного на стадии А,растворяют в 100 мл дихлорметана. Реакционную смесь затем охлаждают на ледяной бане и прикапывают 3,81 мл трибромида брома. После перемешивания при комнатной температуре в течение 2 ч реакционную смесь выливают в 500 мл воды и льда. Осадок, который образуется, 19 отфильтровывают, промывают водой и высушивают в печи при 50 С. Точка плавления: 205-206 С. Получение 72. 3-[2-(Ацетиламино)этил]-1 бензотиен-5-ил трифторметансульфонат. Методика является такой, как для получения 45, начиная с соединения, полученного в способе получения 9. Пример 1. N-(2-7-[2-(3-[2-(Ацетиламино) этил]-1-бензофуран-5-илокси)этокси]-1-нафтилэтил)ацетамид. Стадия A. N-2-[7-(2-Бромэтокси)нафт-1 ил]этилацетамид. Соединение, полученное в способе получения 1 (0,009 моль), растворяют в 20 мл смеси диметилсульфоксида (6 мл) и бутанона (14 мл). Добавляют 0,027 моль карбоната калия и 0,036 моль дибромэтана и смесь нагревают с обратным холодильником в течение 48 ч. Затем реакционную смесь охлаждают и выливают в воду. Водную фазу экстрагируют Et2O и затем органическую фазу промывают водой пока промывные воды не станут нейтральными и затем высушивают над сульфатом магния и выпаривают при пониженном давлении. Полученный остаток очищают хроматографией на силикагеле (элюент: ацетон/циклогексан (2/8 и перекристаллизуют. Белое твердое вещество. Точка плавления: 110-111 С. Элементный микроанализ: С НN Высчитано, %: 57,15 5,40 4,17 Обнаружено, %: 57,28 5,38 3,91 Стадия В. N-(2-7-[2-(3-[2-(Ацетиламино) этил]-1-бензофуран-5-илокси)этокси]-1-нафтилэтил)ацетамид. В круглодонной колбе емкостью 100 мл растворяют 0,003 моль соединения, полученного в способе получения 2 и 0,003 моль соединения, полученного на стадии А, в смеси 3 мл диметилсульфоксида и 20 мл бутанона. Добавляют 0,009 моль карбоната калия и один кристалл йодида калия и затем смесь нагревают с обратным холодильником в течение 12 ч. Реакционную смесь затем охлаждают и выливают в 100 мл воды. Осадок, который образуется, отделяют и перекристаллизуют. Пример 2. N-(2-5-[2-(8-[2-(Ацетиламино) этил]-2-нафтилокси)этокси]-1-бензофуран-3 илэтил)циклопропанкарбоксамид. Методика является такой, как в примере 1,на стадии В заменяя соединение, полученное в способе получения 2, на соединение, полученное в способе получения 3. Пример 3. N-(2-5-[2-(8-[2-(Ацетиламино) этил]-2-нафтилокси)этокси]-1-бензофуран-3 илэтил)-2-фурамид. Методика является такой, как в примере 1,на стадии В заменяя соединение, полученное в способе получения 2, на соединение, полученное в способе получения 4. 21 Методика является такой, как в примере 1,заменяя на стадии А соединение, полученное в способе получения 1, на соединение, полученное в способе получения 4; на стадии В соединение, полученное в способе получения 2, на соединение, полученное в способе получения 11. Пример 11. N-(2-5-[2-(3-[2-(Ацетиламино)этил]-1H-пирроло-[2,3-b]пиридин-5-илокси) этокси]-3 а,7 а-дигидро-1-бензофуран-3-илэтил)2-метилпропанамид. Методика является такой, как в примере 1,заменяя на стадии А соединение, полученное в способе получения 1, на соединение, полученное в способе получения 7; на стадии В соединение, полученное в способе получения 2, на соединение, полученное в способе получения 12. Пример 12. N-(2-7-[3-(3-[2-(Ацетиламино)этил]-1-бензотиофен-5-илокси)пропокси]-1 нафтилэтил)ацетамид. Стадия A. N-2-[7-(3-Гидроксипропилокси)нафт-1-ил]этилацетамид. В круглодонной колбе емкостью 100 мл растворяют 0,022 моль соединения, полученного в способе получения 1, в 30 мл диметилформамида. Добавляют 0,066 моль карбоната калия и 0,033 моль 3 бромпропан-1-ола, и затем смесь нагревают с обратным холодильником при 80 С в течение 4 ч. Реакционную смесь охлаждают и выливают в 100 мл 1 М раствора НСl. Водную фазу экстрагируют 3 раза Еt2 О и затем органическую фазу высушивают над MgSO4 и выпаривают при пониженном давлении. Титульный продукт получают перекристаллизацией. Белое твердое вещество. Точка плавления: 141-142 С. Стадия В. 3-(8-[2-(Ацетиламино)этил]-2 нафтилокси)пропил метансульфонат. В круглодонной колбе емкостью 250 мл,спирт, полученный на стадии А, растворяют в 50 мл дихлорметана и добавляют 0,012 моль триэтиламина. Смесь охлаждают на ледяной бане с солью при -10 С и затем прикапывают 0,012 моль мезилхлорида при перемешивании с магнитной мешалкой. Реакционную смесь перемешивают при комнатной температуре в течение 4 ч. Затем добавляют 100 мл воды с последующей экстракцией CH2Cl2. Органическую фазу промывают водой, высушивают надMgSO4 и выпаривают при пониженном давлении. Полученное масло очищают хроматографией на силикагеле (элюент:ацетон/циклогексан(2/8. Стадия С. N-(2-7-[3-(3-[2-(Ацетиламино) этил]-1-бензотиофен-5-илокси)пропокси-1 нафтилэтил]ацетамид. В круглодоннуго колбу емкостью 100 мл,содержащую 30 мл метанола, добавляют небольшими порциями 0,06 г натрия. Когда на 003391 22 трий полностью израсходован, добавляют 0,0033 моль соединения, полученного в способе получения 9, и смесь перемешивают в течение 20 мин. Метанол удаляют отгонкой при пониженном давлении, остаток переносят в 15 мл ДМФА и затем добавляют 0,0027 моль соединения, полученного на стадии В. Затем реакционную смесь кипятят с обратным холодильником в течение 12 ч и затем охлаждают и выливают в 100 мл воды и 10 мл 3 М НСl. После экстракции этилацетатом органическую фазу промывают 10% раствором гидроокиси натрия и затем водой. После высушивания над MgSO4 и удаления растворителя отгонкой при пониженном давлении титульное соединение очищают хроматографией на силикагеле. Пример 13. N-(2-7-[3-(3-[2-(Бутириламино)этил]-1-бензотиофен-5-илтио)пропокси]-1 нафтилэтил)циклобутанкарбоксамид. Методика является такой, как в примере 12, заменяя на стадии А соединение, полученное в способе получения 1, на соединение, полученное в способе получения 13; на стадии С соединение, полученное в способе получения 9, на соединение, полученное в способе получения 37. Пример 14. N-2-[5-(3-[(8-2-[2,2,2-(Трифторацетил)амино]этил-2-нафтил)окси]пропиламино)-1-бензотиофен-3-ил]этилпентанамид. Методика является такой, как в примере 12, заменяя: на стадии А соединение, полученное в способе получения 1, на соединение, полученное в способе получения 14; на стадии С соединение, полученное в способе получения 9, на соединение, полученное в способе получения 41. Пример 15. N-(6-[3-(8-[2-(Ацетиламино)этил]-2-нафтил]окси)пропокси]-2 Н-хромен 3-илметил]бутанамид. Методика является такой, как в примере 12, на стадии С заменяя соединение, полученное в способе получения 9, на соединение, полученное в способе получения 15. Пример 16. N-(2-5-[3-(3-[(Ацетиламино) метил]-2 Н-хромен-6-илокси)пропокси]-1-бензофуран-3-илэтил)циклопропанкарбоксамид. Методика является такой, как в примере 12, заменяя на стадии А соединение из получения 1 на соединение из получения 16; на стадии С соединение из получения 9 на соединение из получения 3. Пример 17. N-2-[5-(3-[3-([(Пропиламино)карбонил]аминометил)-1,4-бензодиоксин-6-ил]оксипропокси)-1H-пирроло[2,3-b] пиридин-3-ил]этилацетамид. Методика является такой, как в примере 12, заменяя 23 на стадии А соединение из получения 1 на соединение из получения 17; на стадии С соединение из получения 9 на соединение из получения 12. Пример 18. N-(7-[4-(8-[2-(Ацетиламино) этил]-2-нафтилокси)бутокси]-1,4-бензодиоксин-2-илметил)ацетамид. Стадия А. Этил 4-(8-[2-(ацетиламино) этил]-2-нафтилокси)бутаноат. В круглодонной колбе емкостью 100 мл 0,022 моль соединения, полученного в способе получения 1, растворяют в 50 мл ацетонитрила. Добавляют 0,066 моль карбоната калия и реакционную смесь перемешивают при 80 С в течение 30 мин. Затем прикапывают 0,033 моль этил 1-бромбутирата и реакционную смесь перемешивают в течение 1 ч при 80 С. Ацетонитрил удаляют отгонкой при пониженном давлении и остаток растворяют в 1 Н растворе НСl. После экстракции этилацетатом, промывания органической фазы водой, высушивания над MgSO4 и выпаривания при пониженном давлении, титульное соединение очищают перекристаллизацией. Бежевое твердое вещество. Точка плавления: 64-66 С. Стадия В. N-2-[7-(4-Гидроксибутилокси) нафт-1-ил]этилацетамид. В круглодонной колбе емкостью 250 мл полученный на стадии А сложный эфир (0,009 моль) растворяют в 100 мл безводного эфира. Порциями добавляют 0,009 моль алюмогидрида лития и реакционную смесь перемешивают в течение 6 ч при комнатной температуре. Реакционную смесь затем гидролизуют несколькими каплями 1 М NaOH и осадок, который образуется, отфильтровывают. Фильтрат высушивают над MgSO4 и выпаривают при пониженном давлении. Полученный остаток осаждают из смесиN Высчитано, %: 71,73 7,69 4,64 Обнаружено, %: 72,00 7,58 4,45 Стадия С. 4-(8-[2-(Ацетиламино)этил]-2 нафтилокси)бутил метансульфонат. Методика является такой, как на стадии В в примере 12, начиная с соединения, полученного на стадии В. Стадия D. N-(7-[4-(8-[2-(Ацетиламино) этил]-2-нафтилокси)бутокси]-1,4-бензодиоксин-2-илметил)ацетамид. Методика является такой, как на стадии С в примере 12, заменяя соединение, полученное в способе получения 9, на соединение, полученное в способе получения 18. Пример 19. N-2-[7-(4-[3-[(Ацетиламино) этил]-2-(3-метоксибензил)-1-бензофуран-5-ил] аминобутокси)-1-нафтил]этил-2-фурамид. 24 Методика является такой, как в примере 18, на стадии А заменяя соединение из получения 1 на соединение из получения 19, и на стадии D заменяя соединение из получения 9 на соединение из получения 42. Пример 20. N-(6-[4-(3-[(Ацетиламино) этил]-2-бензил-1 Н-пирроло[2,3-b]пиридин-5-ил окси)бутокси]-4 а,8 а-дигидро-2 Н-хромен-3-ил метил)бутанамид. Методика является такой, как в примере 18, на стадии А заменяя соединение из получения 1 на соединение из получения 15, и на стадии D заменяя соединение из получения 9 на соединение из получения 20. Пример 21. N-(2-5-[4-(3-[2-(Ацетиламино)этил]-2-[4-(трифторметил)бензил]-1-бензотиофен-5-илтио)бутокси]-1H-пирроло[2,3-b] пиридин-3-илэтил)циклопропанкарбоксамид. Методика является такой, как в примере 18, на стадии А заменяя соединение из получения 1 на соединение из получения 10, и на стадии D заменяя соединение из получения 9 на соединение из получения 38. Пример 22. N-(2-5-[4-(3-[(Ацетиламино) метил]-4 а,8 а-дигидро-2 Н-хромен-6-илокси) бутокси]-1-бензотиофен-3-илэтил)циклогексанкарбоксамид. Методика является такой, как в примере 18, на стадии А заменяя соединение из получения 1 на соединение из получения 16, и на стадии D заменяя соединение из получения 9 на соединение из получения 21. Пример 23. 2,2,2-Трифтор-N-(2-5-[4-(3[2-(гексиламино)-2-оксоэтил]-3 а,7 а-дигидро-1 бензофуран-5-илокси)бутокси]-1-бензотиофен 3-илэтил)ацетамид. Методика является такой, как в примере 18, на стадии А заменяя соединение из получения 1 на соединение из получения 22, и на стадии D заменяя соединение из получения 9 на соединение из получения 23. Пример 24. N-(2-7-(4-[2-(Ацетиламино) этил]-3,4-дигидро-2 Н-хромен-6-илокси)бутокси]-1,2,3,4-тетрагидро-1-нафталенилэтил)ацетамид. Методика является такой, как в примере 18, на стадии А заменяя соединение из получения 1 на соединение из получения 24, и на стадии D заменяя соединение из получения 9 на соединение из получения 25. Пример 25. N-2-[5-(4-[(8-2-[(Циклопропилкарбонил)амино]этил]-5,6,7,8-тетрагидро-2 нафталенил)окси)бутиламино)-1-бензофуран 3-ил]этил-2-фурамид. Методика является такой, как в примере 18, на стадии А заменяя соединение из получения 1 на соединение из получения 26, и на стадии D заменяя соединение из получения 9 на соединение из получения 43. Пример 26. N-(2-5-[4-(8-[2-(Гептаноиламино)этил]-2-нафтилокси)бутокси]-1 Н-индол 3-илэтил)циклобутанкарбоксамид. 25 Методика является такой, как в примере 18, на стадии А заменяя соединение из получения 1 на соединение из получения 27, и на стадии D заменяя соединение из получения 9 на соединение из получения 28. Пример 27. N-[2-(5-[6-(8-[2-(Ацетиламино)этил]-2-нафтилокси)гексил]окси-1 Нпирроло[2,3-b]пиридин-3-ил)этил]ацетамид. Стадия А. N-(2-7-[(6-Гидроксигексил)окси]-1-нафтилэтил)ацетамид. Методика является такой, как на стадии А в примере 12, заменяя 3-бромпропан-1-ол на 6 бромгексан-1-ол. Белое твердое вещество. Точка плавления: 58-61 С. Элементный микроанализ: С НN Высчитано, %: 72,91 8,41 4,25 Обнаружено, %: 73,22 8,17 4,02 Стадия В. 6-(8-[2-(Ацетиламино)этил]-2 нафтилокси)гексил метансульфонат. Методика является такой, как на стадии В в примере 12. Белое твердое вещество. Точка плавления: 66-67 С. Стадия С. N-[2-(5-[6-(8-[2-(Ацетиламино)этил]-2-нафтилокси)гексил]окси-1 Н-пирроло-[2,3-b]пиридин-3-ил)этил]ацетамид. Методика является такой, как на стадии С в примере 12, заменяя соединение, полученное в способе получения 9 на соединение, полученное в способе получения 12. Пример 28. 4-(7-[6-(3-[(Ацетиламино) метил]-2 Н-хромен-6-илокси)гексил]окси-1 нафтил-N-изопропилбутанамид. Методика является такой, как в примере 27, на стадии А заменяя соединение, полученное в способе получения 1 на соединение, полученное в способе получения 29, и на стадии С заменяя соединение, полученное в способе получения 9 на соединение, полученное в способе получения 16. Пример 29. N-[7-(6-[(3-2-(Анилинокарбонил)амино]этил-1-бензофуран-5-ил)окси] гексилокси)-1,4-бензодиоксин-2-ил]метил ацетамид. Методика является такой, как в примере 27, на стадии А заменяя соединение из получения 1 на соединение, полученное в способе получения 30, и на стадии С заменяя соединение из получения 9 на соединение, полученное в способе получения 18. Пример 30. N-[2-(7-[6-(3-[2-(Бензиламино)-2-оксоэтил]-1-бензотиофен-5-илокси)гексил]тио-1,2,3,4-тетрагидро-1-нафталенил)этил] циклопропанкарбоксамид. Методика является такой, как в примере 27, заменяя: на стадии А соединение из получения 1 на соединение из получения 31; на стадии C соединение из получения 9 на соединение из получения 26. 26 Пример 31. N-[2-(5-[6-(3-[3-(Метиламино)-3-оксопропил]-1-бензофуран-5-илокси) гексил]окси-1 Н-инден-3-ил)этил]пентанамид. Методика является такой, как в примере 17, на стадии А заменяя соединение из получения 1 на соединение, полученное в способе получения 32, и на стадии С заменяя соединение из получения 9 на соединение, полученное в способе получения 33. Пример 32. N-Циклопропил-N'-(2-5-[(6[3-(2-1(метиламино)карбонил]аминоэтил)1H-пирроло[2,3-b]пиридин-5-ил]оксигексил) амино]-1-бензофуран-3-илэтил)мочевина. Методика является такой, как в примере 27, на стадии А заменяя соединение из получения 1 на соединение из получения 34, и на стадии С заменяя соединение из получения 9 на соединение из получения 44. Пример 33. N-[2-(7-[6-(3-[4-(Метиламино)-4-оксобутил]-1 Н-индол-5-илокси)гексил] окси-1-нафтил)этил]-3-бутенамид. Методика является такой, как в примере 27, заменяя на стадии А соединение из получения 1 на соединение из получения 6; на стадии С соединение из получения 9 на соединение из получения 35. Пример 34. N-[2-(7-3-[2-(Ацетиламино) этил]-1-бензофуран-5-ил-1-нафтил)этил]ацетамид. Под азотом 2,76 ммоль соединения, полученного в способе получения 45, 2,76 ммоль соединения, полученного в способе получения 46, 1,94 ммоль дихлорбис(трифенилфосфин) никеля, 3,87 ммоль трифенилфосфина и 8,30 ммоль цинка суспендируют в 20 мл безводного ДМФА. После нагревания в течение 48 ч при 120 С под азотом, реакционную смесь концентрируют и полученный остаток распределяют между CH2Cl2 и 1 М NаНСО 3. Органическую фазу затем высушивают над Na2SO4 и концентрируют в вакууме. Титульное соединение выделяют хроматографией на силикагеле. В примерах 35-48 методика является такой, как в примере 34, начиная с соответствующих получений. Пример 35. N-(2-5-[8-(2-[(Метиламино) карбонил]аминоэтил)-2-нафтил]-1-бензотиофен-3-илэтил)циклопропанкарбоксамид. Исходные вещества: получения 47 и 48. Пример 36. N-2-[5-(3-2-[(Анилинокарбонил)амино]этил-1-бензофуран-5-ил)-1-бензотиофен-3-ил]этил-2-фурамид. Исходные вещества: получения 49 и 50. Пример 37. 2-(5-3-[2-(Ацетиламино)этил]1-бензофуран-5-ил-1 Н-индол-3-ил)-N-бензилацетамид. Исходные вещества: получения 45 и 51. Пример 38. N-[3-(5-3-[2-(Изобутириламино)этил]-1-бензотиофен-5-ил-1 Н-индол-3 ил)пропил]бензамид. Исходные вещества: получения 52 и 53. 27 Пример 39. N-[3-(5-8-[2-(Ацетиламино) этил]-2-нафтил-1 Н-пиролло[2,3-b]пиридин-3 ил)пропил]гептанамид. Исходные вещества: получения 46 и 54. Пример 40. 4-(5-3-[3-(Ацетиламино)этил]1H-пиролло[2,3-b]-пиридин-5-ил-1-бензофуран-3-ил)-N-циклопентилбутанамид. Исходные вещества: получения 55 и 56. Пример 41. N-(2-5-[3-(2-[(Аллиламино) карбонил]аминоэтил)-1-бензотиофен-5-ил]-1 Нпирроло[2,3-b]пиридин-3-илэтил)циклопропанкарбоксамид. Исходные вещества: получения 57 и 58. Пример 42. N-[2-(5-3-[(Ацетиламино)метил]-1,4-бензодиоксин-6-ил-1 Н-пирроло[2,3-b] пиридин-3-ил)этил]циклопропанкарбоксамид. Исходные вещества: получения 57 и 59. Пример 43. 2-Метил-N-2-[5-(4-2-[2,2,2 трифторацетил)амино]этил-3,4-дигидро-2 Нхромен-6-ил)-1-бензофуран-3-ил]этилпропанамид. Исходные вещества: получения 60 и 61. Пример 44. 4-(5-3-[(Ацетиламино)метил]3,4-дигидро-2 Н-хромен-6-ил-1-бензотиофен-3 ил)-N-фенилбутанамид. Исходные вещества: получения 62 и 63. Пример 45. N-(2-5-8-[2-(Ацетиламино) этил]-2-нафтил-2-[4-(трифторметил)бензил]-1 бензофуран-3-илэтил)ацетамид. Исходные вещества: получения 64 и 46. Пример 46. 2,2-Диметил-N-(2-6-[3-(2[(метиламино)карбонил]аминоэтил)-1 Н-индол-5-ил]-3,4-дигидро-2 Н-хромен-4-илэтил) пропанамид. Исходные вещества: получения 65 и 66. Пример 47. N-[(7-3-[2-(Ацетиламино) этил]-1 Н-индол-5-ил-1,4-бензодиоксин-2-ил) метил]циклогексанкарбоксамид. Исходные вещества: получения 67 и 68. Пример 48. N-(3-5-[3-[2-(Ацетиламино) этил]-2-(3-метоксибензил)-1-бензотиофен-5-ил]1-бензофуран-3-илпропил)ацетамид. Исходные вещества: получения 69 и 70. Пример 49. N-(2-7-[4-(3-[2-(Ацетиламино)этил]-1-бензофуран-5-илокси)бутокси]-1 нафтилэтил)ацетамид. Стадия A. N-2-[7-(4-Бромбутокси)-1-нафтил]этилацетамид. В круглодонной колбе емкостью 100 мл растворяют 10 ммоль соединения, полученного в способе получения 1, в 50 мл ацетонитрила. Добавляют 30 ммоль карбоната калия, смесь перемешивают при кипячении с обратным холодильником в течение 30 мин, используя магнитную мешалку, и затем добавляют 10 ммоль 1,4-дибромбутана. Через 12 ч кипячения с обратным холодильником ацетонитрил удаляют отгонкой в вакууме и полученный остаток переводят в 1 М раствор гидроокиси натрия. Полученный осадок отфильтровывают и перекристаллизуют для получения титульного продукта. 28 Стадия В. N-(2-7-[4-(3-[2-(Ацетиламино) этил]-1-бензофуран-5-илокси)бутокси]-1-нафтилэтил)ацетамид. В круглодонную колбу емкостью 100 мл,содержащую 30 мл метанола, небольшими порциями добавляют натрий (0,07 г; 0,0030 ат. г). Когда натрий полностью израсходован, добавляют 3,6 ммоль соединения, полученного в способе получения 2. После перемешивания в течение 20 мин метанол удаляют отгонкой при пониженном давлении и остаток переводят в 15 мл ДМФА. Добавляют 3 ммоль соединения, полученного на стадии А, и смесь нагревают с обратным холодильником в течение 12 ч. Реакционную смесь охлаждают и выливают в смесь из 100 мл воды и 10 мл 3 М соляной кислоты. Дважды проводят экстракцию водной фазы этилацетатом и органическую фазу промывают 10% раствором гидроокиси натрия и затем водой. Полученное твердое вещество перекристаллизуют из ацетонитрила для получения титульного продукта. Точка плавления: 160-162 С. Пример 50. N-2-[5-[4-(8-[2-(Ацетиламино)этил]-2-нафтилокси)бутокси]-1-(фенилсульфонил)-1H-индол-3-ил]этилацетамид. В круглодонной колбе емкостью 100 мл растворяют 10 ммоль соединения, полученного в способе получения 71, в 50 мл ацетонитрила и затем добавляют 4,17 г карбоната калия и реакционную смесь перемешивают при кипячении с обратным холодильником, используя магнитную мешалку, в течение 30 мин. Затем добавляют 10 ммоль соединения, полученного на стадии А в примере 49, и смесь нагревают с обратным холодильником в течение 12 ч. Ацетонитрил удаляют отгонкой в вакууме и полученный остаток переводят в 1 М водный раствор гидроокиси натрия. Полученный осадок отфильтровывают и перекристаллизуют из спирта при 95 С. Точка плавления: 135-137 С. Пример 51. N-(2-7-[4-(8-[2-Ацетиламино)этил]-2-нафтилокси)бутокси]-1,2,3,4-тетрагидро-1-нафталенилэтил)ацетамид. Методика является такой, как в примере 49, на стадии В заменяя продукт, полученный в способе получения 2 на продукт, полученный в способе получения 25. Перекристаллизация из ацетонитрила. Точка плавления: 63-65 С. Пример 52. N-(2-5-[4-(3-[2-(Ацетиламино)этил]-1-бензофуран-5-илокси)бутокси]1H-индол-3-илэтил)ацетамид. Стадия А. Этил 4-(3-[2-ацетиламино) этил]-1 Н-индол-5-илокси)бутаноат. 5,9 г соединения, полученного в способе получения 11, растворяют в 100 мл ацетонитрила и затем добавляют 11,22 г карбоната калия и 5,81 мл этил 4-бромбутаноата. После нагревания с обратным холодильником в течение ночи карбонат калия отфильтровывают, ацетонитрил 29 удаляют отгонкой и остаток переводят в 100 мл воды. Экстракцию проводят три раза по 50 мл этилацетата каждый раз, и органическую фазу затем промывают водой до нейтрального рН,высушивают над сульфатом магния и выпаривают в вакууме. Полученное масло осаждают из изопропилового эфира. Точка плавления: 107-108 С. Стадия В. N-2-[5-(4-Гидроксибутокси)1H-индол-3-ил]этилацетамид. Раствор 6,2 г соединения, полученного на стадии А, в 50 мл безводного ТГФ прикапывают к суспензии 1,42 г алюмогидрида лития в 50 мл безводного ТГФ, охлажденного на ледяной бане. После перемешивания в течение 30 мин при комнатной температуре прикапывают 5% раствор гидроокиси натрия пока не прекратится выделение газа. Осадок, который образуется,отфильтровывают, органическую фазу выпаривают и остаток переводят в 70 мл этилацетата. Органическую фазу промывают водой до нейтральной реакции, высушивают над сульфатом магния и выпаривают в вакууме для получения титульного продукта в виде масла. Стадия С. N-2-[5-(4-Бромбутокси)-1Hиндол-3-ил]этилацетамид. 3,92 г соединения, полученного на стадии В, растворяют в 50 мл ацетонитрила и затем при перемешивании добавляют 5,31 г трифенилфосфина и 6,71 г тетрабромида углерода. После выдерживания при комнатной температуре в течение ночи, ацетонитрил удаляют отгонкой в вакууме и полученный остаток очищают хроматографией на колонке с силикагелем (элюент: дихлорметан/метанол 96/4). Масло. Стадия D. N-(2-5-[4-(3-[2-(Ацетиламино) этил]-1-бензофуран-5-илокси)бутокси]-1 Н-индол-3-илэтил)ацетамид. 0,72 г соединения, полученного на стадии С, растворяют в 20 мл ацетонитрила и затем добавляют 0,57 г карбоната калия и 0,30 г соединения, полученного в способе получения 2. После нагревания с обратным холодильником в течение ночи реакционную смесь выливают в 200 мл воды и льда. Полученный осадок отфильтровывают, промывают эфиром, высушивают и перекристаллизуют для получения титульного продукта в виде белого порошка. Точка плавления: 164-166 С. Пример 53. N-(2-7-[4-(3-[2-(Ацетиламино)этил]-1-бензотиен-5-илокси)бутокси]-1 нафтилэтил)ацетамид. Методика является такой, как в примере 49, на стадии В заменяя продукт, полученный в способе получения 2 на продукт, полученный в способе получения 9. Перекристаллизация из ацетонитрила/метанола (2/1). Точка плавления: 169-170 С. 31 Пример 64. N-[2-(5-3-[2-(Ацетиламино) этил]-1-бензотиен-5-ил-1 Н-пирроло[2,3-b]пиридин-3-ил)этил]ацетамид. Исходные вещества: получения 55 и 72. Фармакологические исследования Пример А. Изучение острой токсичности. Острую токсичность оценивали после перорального введения группам животных, состоящим из 8 мышей каждая (262 г). В течение первого дня животных наблюдали через регулярные интервалы и ежедневно в течение двух недель после введения. Оценивали LD50(доза, которая вызывает падеж 50% животных),и была показана низкая токсичность соединений по изобретению. Пример В. Изучение связывания с мелатониновыми рецепторами на овечьих клетках parstuberalis. Исследования по связыванию соединений по изобретению с мелатониновыми рецепторами проводили обычными методами на овечьих клетках pars tuberalis. Par tuberalis аденогипофиза реально характеризуются высокой плотностью мелатониновых рецепторов у млекопитающих (Journal of Neuroendocrinology, 1, pp. 14, 1989). Ход опыта 1) Готовят мембраны овечьих клеток parstuberalis и используют в качестве мишеневой ткани в опытах с насыщением для определения способности к связыванию и аффинность для 2-[125I]йoд-мелатонина. 2) Мембраны овечьих клеток pars tuberalis используют в качестве мишеневой ткани в опытах по конкурентному связыванию, используя различные тестируемые соединения в сравнении с мелатонином. Каждый опыт проводят трижды и для каждого тестируемого соединения испытывают ряд различных концентраций. После статистической обработки результаты дают возможность определить аффинность связывания тестируемых соединений. Результаты Соединения по изобретению обладают сильной аффинностью в отношении рецепторов к мелатонину. Пример С. Изучение связывания с mt1- и МТ 2-рецепторами к мелатонину. Исследования связывания с mt1- или МТ 2 рецепторами проводят с использованием 2-[125I]-йодмелатонина в качестве стандартного меченого лиганда. Удерживаемую радиоактивность определяют с использованием жидкостного сцинтилляционного счетчика. Затем проводят опыты по конкурентному связыванию в трехкратной повторности, используя различные тестируемые соединения. Для каждого соединения испытывают ряд различных концентраций. Результаты дают возможность определить аффинность связывания тестируемых соединений (IC50). 32 Таким образом, установленные для соединений по изобретению значения IС 50 показывают связывание с одним из рецепторов субтиповmt1 и МТ 2, эти значения составляют 10 М. Пример D. Действие соединений по изобретению на циркадные ритмы двигательной активности у крыс. Участие мелатонина в регуляции большого количества физиологических, биологических и поведенческих циркадных ритмов при изменении день/ночь сделало возможным установить фармакологическую модель для исследования мелатонинергических лиганд. Тестируют действие соединений в отношении многочисленных параметров и, в частности, в отношении циркадных ритмов двигательной активности, которые являются надежным индикатором активности эндогенных циркадных часов. В этом исследовании оценивают действие таких соединений на конкретной экспериментальной модели, а именно на крысах, помещенных в условия временной изоляции (постоянная темнота). Ход опыта Крыс в возрасте одного месяца сразу же при поступлении в лабораторию подвергают воздействию светового цикла 12 ч света на 24 ч(СТ 12:12). Через 2-3 недели адаптации их помещают в клетки, снабженные приводом, соединенным с записывающей системой для того, чтобы определить фазы двигательной активности и таким образом прослеживать как ночные, так и дневные (СТ) или циркадные (ТТ) ритмы. Как только записанные ритмы показывают стабильную модель в световом цикле СТ 12:12,крыс помещают в постоянную темноту (ТТ). Через 2-3 недели, когда четко устанавливается свободное течение (ритм, отражающий эндогенные часы), крысам ежедневно вводят тестируемые соединения. Наблюдения проводят с помощью визуального контроля ритмов активности: влияние светового ритма на ритм активности,исчезновение влияния на ритмы в постоянной темноте,влияние ежедневного введения соединения; кратковременное или длительное действие. Программное обеспечение делает возможным определить продолжительность и интенсивность активности, период ритма животных во время свободного течения и при обработке,возможно показать с помощью спектрального анализа наличие циркадных и нециркадных (например, ультрадианных) компонентов. Результаты Четко показывается, что соединения по изобретению обладают сильным действием на 33 циркадный ритм посредством меланинергической системы. Пример Е. Тест с клеткой свет/темнота. Соединения по изобретению тестируют на поведенческой модели, тест с клеткой свет/ темнота, которая помогает выявить анксиолитическую активность соединений. Оборудование включает две поливиниловые коробки, покрытые плексиглазом. Одна из коробок темная. Над другой коробкой устанавливается лампа, дающая в центре коробки интенсивность света примерно 4000 лк. Светонепроницаемый пластиковый проход отделяет светлую коробку от темной коробки. Животные тестируются индивидуально в течение 5 мин. Дно каждой коробки очищается между каждыми периодами тестирования. В начале каждого теста мышь помещают в проход головой к темной коробке. Записывается время, проведенное мышью в освещенной коробке, и число пробегов через проход после первого вхождения в темную коробку. После назначения соединений за 30 мин до начала теста соединения по изобретению достоверно увеличивают время, проведенное в освещенной клетке, и число пробегов через проход,что показывает анксиолитическую активность соединений. Пример F. Активность соединений по изобретению на хвостовой артерии крыс. Соединения по изобретению тестировалиin vitro на хвостовой артерии крыс. Мелатонинергические рецепторы присутствуют в этих сосудах, обеспечивая таким образом релевантную фармакологическую модель для изучения мелатонинергической лигандной активности. Стимуляцию рецепторов можно индуцировать либо сужением, либо расширением сосудов в зависимости от тестируемого артериального сегмента. Ход опыта Крыс в возрасте одного месяца приучают к циклу свет/темнота 12 ч/12 ч в течение от 2 до 3 недель. После убоя отделяют хвостовую артерию и поддерживают в насыщаемой кислородом среде. Затем на оба конца артерий накладывают канюли, подвешивают вертикально в камере для органов в пригодной среде и перфузируют через их проксимальный конец. Давление, изменяющееся в перфузионном потоке, позволяет оценивать сосудосуживающее и сосудорасширяющее действие соединений. Активность соединений оценивают на сегментах, предварительно суженных под действием фенилэфрина (1 М). Определяют некумулятивно кривую концентрация/ответная реакция при добавлении концентрации тестируемого вещества на предварительно суженный сегмент. Когда наблюдаемый эффект достигает равновесия, среду заменяют и препарат оставляют на 20 мин перед добавлением той же концентрации 34 фенилэфрина и последующей концентрации тестируемого соединения. Результаты Соединения по изобретению значительно изменяют диаметр хвостовых артерий, предварительно суженных под действием фенилэфрина. Пример G. Фармацевтическая композиция: таблетки. 1000 таблеток, содержащих дозу в 5 мгN-(2-7-[4-(3-[2-(Ацетиламино)этил]-1 бензофуран-5-илокси)бутокси]-1 нафтилэтил)ацетамида (пример 49) Пшеничный крахмал Кукурузный крахмал Лактоза Магний стеарат Диоксид кремния ГидооксипропилцеллюлозаG1 и G3 обозначают возможно разветвленную алкиленовую группу,Су и Су обозначает нафтил, 1,4-бензодиоксин, тетрагидронафтил, бензотиенил, дигидробензотиенил, бензофурил, дигидробензофурил, пирроло[3,2-b]пиридинил, индолил, индолинилпиридинил, индолил, индолинил;G2 обозначает окси(С 1-С 6)алкоксигруппу; их энантиомеры и диастереоизомеры и их аддитивные соли фармацевтически приемлемой кислоты или основания. 2. Соединения формулы (I) по п.1, которые являются[2,3-b]пиридин-3-илэтил)ацетамидом,N-(2-5-[4-(3-[2-(ацетиламино)этил]-1 Ниндол-5-илокси)бутокси]-1 Н-пирроло[2,3-b] пиридин-3-илэтил)ацетамидом и их аддитивные соли фармацевтически приемлемой кислоты или основания. 3. Соединения формулы (I) по п.1, которые являютсяN-(2-7-[4-(3-[2-(ацетиламино)этил]-1 бензофуран-5-илокси)бутокси]-1-нафтилэтил) ацетамидом,N-2-[5-[4-(8-[2-(ацетиламино)этил]-2 нафтилокси)бутокси]-1-(фенилсульфонил)-1 Ниндол-3-ил]этилацетамидом,N-(2-7-[4-(8-[2-(ацетиламино)этил]-2 нафтилокси)бутокси]-1,2,3,4-тетрагидро-1 нафталенилэтил)ацетамидом,N-(2-5-[4-(3-[2-(ацетиламино)этил]-1 бензофуран-5-илокси)бутокси]-1 Н-индол-3 илэтил)ацетамидом,N-(2-7-[4-(3-[2-(ацетиламино)этил]-1 бензотиен-5-илокси)бутокси]-1-нафтилэтил) ацетамидом,и их аддитивные соли фармацевтически приемлемой кислоты или основания. 4. Соединения формулы (I) по п.1, которые являютсяN-[2-(7-3-[2-(ацетиламино)этил]-1-бензофуран-5-ил-1-нафтил)этил]ацетамидом,N-[3-[5-8-[2-(ацетиламино)этил]-2-нафтил-1 Н-пирроло[2,3-b]пиридин-3-ил]пропил] гептанамидом,N-[2-(7-3-[2-(ацетиламино)этил]-1 бензотиен-5-ил-1-нафтил)этил]ацетамидом,N-[2-(5-8-[2-(ацетиламино)этил]-2 нафтил-1 Н-пирроло[2,3-b]пиридин-3-ил) этил]ацетамидом,N-[2-(5-3-[2-(ацетиламино)этил]-1-бензофуран-5-ил-1-бензотиен-3-ил)этил]ацетамидом,N-[2-(5-3-[2-(ацетиламино)этил]-1 бензофуран-5-ил-1 Н-индол-3-ил)этил]ацетамидом,N-[2-(5-3-[2-(ацетиламино)этил]-1-бензофуран-5-ил-1 Н-пирроло[2,3-b]пиридин-3-ил) этил]ацетамидом,N-[2-(5-3-[2-(ацетиламино)этил]-1 Ниндол-5-ил-1 Н-пирроло[2,3-b]пиридин-3 ил)этил]ацетамидом,N-[2-(5-3-[2-(ацетиламино)этил]-1-бензотиен-5-ил-1 Н-пирроло[2,3-b]пиридин-3-ил) этил]ацетамидом,и их аддитивные соли фармацевтически приемлемой кислоты или основания. 5. Способ получения соединений формулы(I) по п.1, отличающийся тем, что в качестве исходного соединения используют соединение формулы (V) 36 где A, G1 и Су имеют значения, как определено для формулы (I),которое подвергают деметилированию с использованием обычных реагентов, таких как НВr, АlСl3, АlВr3, ВВr3 или бинарные системы кислота Льюиса/нуклеофил, например, такие как АlСl3/РhСН 2SН или ВВr3/Ме 2S для получения соединения формулы (VI)(VI),A-G1-Cy-OH где A, G1 и Су имеют значения, как определено ранее,которое превращают обычным способом путем воздействия, например, N,N-диметилтиокарбамата натрия в соответствующий тиол формулы (VII)(VIII),A-G1-Cy-NHR'a где А, G1 и Су имеют значения, как определено ранее, и R'a может иметь одно из значений Ra,как определено для формулы (I), и также может представлять атом водорода, причем соединения формул (VI), (VII) и (VIII) представляют соединение формулы (IX)(IX),A-G1-Cy-W4H где W4 представляет атом кислорода или серы или группу NH или NRa (где Ra имеет значения,как определено ранее),соединение формулы (IX) конденсируют с соединением формулы (X) где Hal представляет атом брома, хлора или иода, и n, W2 и m имеют значения, как определено для формулы (I) (при условии, что невозможно иметь два последовательных гетероатома, и что цепь, определенная таким образом, может иметь одну или более ненасыщенных связей),или соединением формулы (XI) где Hal, n, m и W2 имеют значения, как определено ранее, и Alk представляет алкильный радикал (при условии, что невозможно иметь два последовательных гетероатома, и что цепь, определенная таким образом, может иметь одну или более ненасыщенных связей) с последующим восстановленим,с получением соединения формулы (XII)(XII),A-G1-Cy-W4-(CH2)n-W2-(CH2)m-OH где A, G1, Су, W4, n, m и W2 имеют значения,как определено ранее (при условии, что невозможно иметь два последовательных гетероатома в цепи -W4-(CH2)n-W2-(CH2)m-OH и что цепь,определенная таким образом, может иметь одну или более ненасыщенных связей),гидроксильная функциональная группа которого превращается обычным образом в уходящую группу, например, такую как мезилат, 37 тозилат или галоген, для получения соединения формулы (ХII)(ХII),где А, G1, Су, W4, n, m и W2 имеют значения,как определено ранее, и Е представляет радикал мезил или тозил или атом галогена,которое подвергают воздействию соединения формулы (XIII)(XIII),где В, G3 и Су являются такими, как определено для формулы (I), и W4 может иметь такие же значения, что для W4, определенные ранее,с получением соединения формулы (I/a),частный случай соединений формулы (I)A-G1-Cy-W4-(CH2)n-W2-(CH2)m-W4-Cy-G3-B (I/a),где А, G1, Су, Су, W4, n, W2, m, W4, G3 и В имеют значения, как определено ранее; или превращают с использованием, например, фенил бис(трифторметансульфонимида) в щелочной среде в соответствующий трифторметансульфонат формулы (XIV)(XIV),где А, G1 и Су имеют значения, как определено ранее, который подвергают в условиях катализа с подходящим соединением палладия воздействию соединения борной кислоты(RbВ(ОН)2) или соединения олова (RbSnBu3) (гдеRb представляет группу формулы (XV(XV),B-G3-Cy-W3-(CH2)m-W2-(CH2)n-CH2 где В, G3, Су, W3, m, W2 и n имеют значения,как определено ранее, при условии, что невозможно иметь два последовательных гетероатома в цепи W3-(CH2)m-W2 и что цепь, определенная таким образом, может иметь одну или более ненасыщенных связей, с получением соединения формулы (I/b), частный случай соединений формулы (I)A-G1-Cy-CH2-(CH2)n-W2-(CH2)m-W3-Cy-G3-B (I/b),где A, G1, Су, Су, n, W2, m, W3, G3 и В являются такими, как определено ранее (при условии, что невозможно иметь два последовательных гетероатома в цепочке W2-(CH2)m-W3-, и что цепь,определенная таким образом, может иметь одну 38 или более ненасыщенных связей), причем соединения формулы (I/с), частный случай соединений формулы (I)A-G1-Cy-W1-(CH2)n-W2-(CH2)m-CH2-Cy'-G3-B (I/c),где A, G1, Су, Су, W1, n, W2, m, G3 и В имеют значения, как определено ранее (при условии, что невозможно иметь два последовательных гетероатома в цепи W1-(CH2)n-W2-, и что цепь, определенная таким образом, может иметь одну или более ненасыщенных связей),получают аналогичным способом, начиная с соединения формулы (XIV) В-G3-Су-OSO2 СF3(XIV),где В, G3 и Су являются такими, как определено ранее,или обрабатывают в условиях сочетания с использованием, например, соединений никеля или палладия, соединением формулы (XIV) для получения соединения формулы (I/d), частный случай соединений формулы (I)(I/d),где А, G2, Су, Су, G3 и В имеют значения, как определено ранее,все количество соединений от (I/a) до (I/d),составляющее соединения формулы (I), которые можно очистить, если желательно, обычными способами очистки, разделяют, где уместно, на их изомеры обычными способами разделения и превращают, если необходимо, в их аддитивные соли фармацевтически приемлемой кислоты или основания. 6. Фармацевтические композиции, содержащие в качестве активного компонента, по меньшей мере, одно соединение формулы (I) по одному из пп.1-4 или его аддитивную соль с фармацевтически приемлемыми кислотой или основанием в сочетании с одним или более фармацевтически приемлемым наполнителем. 7. Фармацевтические композиции по п.6 для использования в производстве лекарственного препарата для лечения заболеваний, связанных с мелатонинергической системой.
МПК / Метки
МПК: A61P 25/00, C07D 307/81, A61K 31/343, C07C 233/25
Метки: способ, композиции, димерные, новые, замещенные, содержащие, соединения, получения, фармацевтические
Код ссылки
<a href="https://eas.patents.su/20-3391-novye-zameshhennye-dimernye-soedineniya-sposob-ih-polucheniya-i-farmacevticheskie-kompozicii-soderzhashhie-ih.html" rel="bookmark" title="База патентов Евразийского Союза">Новые замещенные димерные соединения, способ их получения и фармацевтические композиции, содержащие их</a>
Предыдущий патент: Фунгицидная смесь на базе амидных соединений и тетрахлоризофталонитрила
Следующий патент: Производные желчных кислот
Случайный патент: Аттенуированный рекомбинантный вирус герпеса крупного рогатого скота типа i, вакцина на его основе и способ выявления животных, которым была введена такая вакцина
























