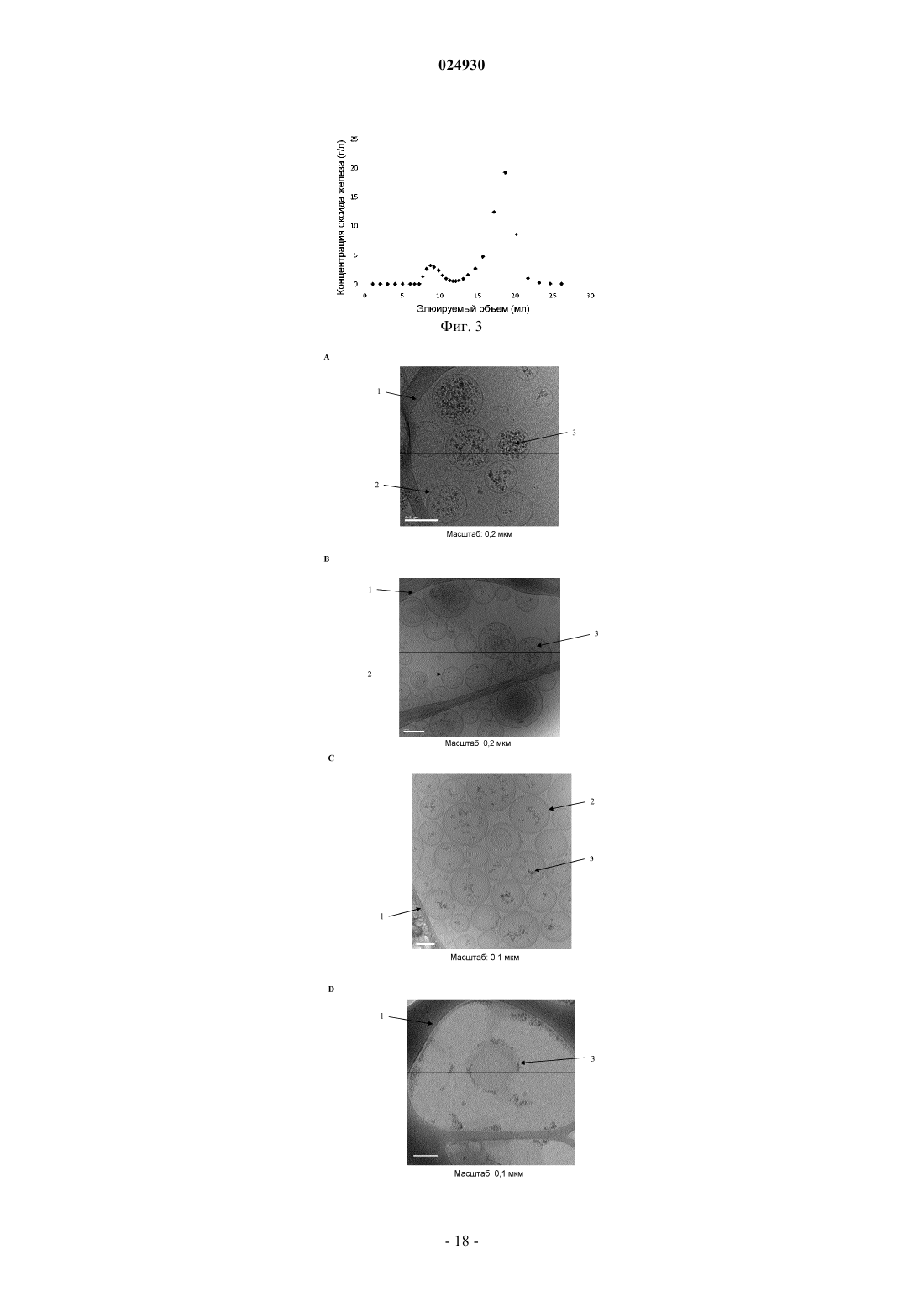
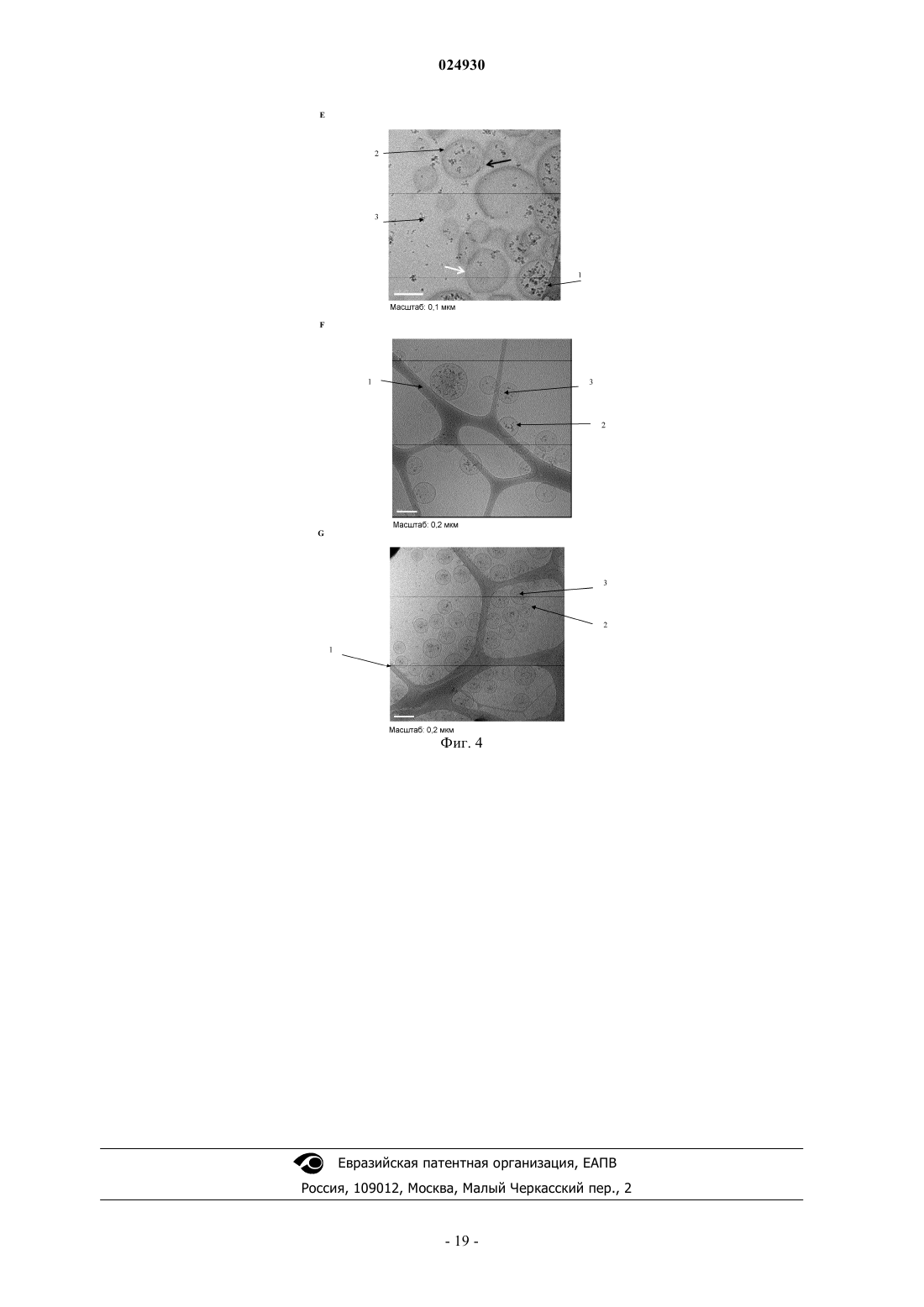
Системы доставки наночастиц, их получение и применение
Номер патента: 24930
Опубликовано: 30.11.2016
Авторы: Поттье Аньес, Мер Мари-Эдит, Леви Лоран, Жермэн Маттье
Формула / Реферат
1. Система доставки наночастиц, содержащая термочувствительные липосомы, разрушающиеся при температуре перехода кристаллической фазы из геля в жидкость (Tm) или выше Tm, где липосомы содержат термочувствительную липидную мембрану, инкапсулирующую наночастицы, являющиеся применимыми в качестве терапевтического или диагностического средства, каждая наночастица содержит неорганическое ядро, наибольший размер которого составляет менее чем 100 нм, и полностью покрыта веществом, отвечающим за присутствие на поверхности наночастиц электростатического заряда с потенциалом ниже -20 мВ или выше +20 мВ.
2. Система по п.1, где термочувствительная липидная мембрана содержит, по меньшей мере, фосфатидилхолин.
3. Система по п.2, где термочувствительная липидная мембрана дополнительно содержит холестерин.
4. Система по любому из пп.1-3, где термочувствительная липидная мембрана содержит дипальмитоилфосфатидилхолин, гидрогенизированный соевый фосфатидилхолин, холестерин и дистеарилфосфатидилэтаноламин-метоксиполиэтиленгликоль.
5. Система по п.2, где термочувствительная липидная мембрана содержит дипальмитоилфосфатидилхолин, дистеарилфосфатидилэтаноламин-метоксиполиэтиленгликоль и/или монопальмитоилфосфатидилхолин или моностеарилфосфатидилхолин.
6. Система по любому из пп.1-5, где средство, ответственное за наличие электростатического заряда на поверхности наночастиц, представляет собой органическую молекулу, имеющую две группы, R и X, R выбирают из амина, фосфата и карбоксилата и X выбирают из карбоксилата, силана, фосфоновой, фосфорной группы, фосфата и тиола.
7. Система по п.6, где наночастицы дополнительно содержат связывающую группу, выбираемую из сукцинимидилового эфира и малеимидной группы.
8. Система по любому из пп.1-7, где наночастицы дополнительно содержат нацеливающую группу, выбираемую из пептида, олигопептида, полипептида, белка, нуклеиновой кислоты, гормона, витамина, фермента, лиганда опухолевого антигена, рецептора гормона, рецептора цитокина и рецептора фактора роста.
9. Система по любому из пп.1-8, где наибольший размер липосом составляет между 50 и 500 нм, предпочтительно между 50 и 250 нм.
10. Система по любому из пп.1-9, где Tm составляет между 39 и 45°C.
11. Система по любому из пп.1-10, где, когда наночастицы используют в качестве терапевтического средства, наибольший размер ядра каждой наночастицы составляет между 5 и 100 нм, предпочтительно между 10 и 50 нм.
12. Система по любому из пп.1-11, где, когда наночастицы используют в качестве диагностического средства, наибольший размер ядра каждой наночастицы составляет между 2 и 10 нм.
13. Терапевтическая композиция, содержащая систему доставки наночастиц по любому из пп.1-12 и фармацевтически приемлемый носитель.
14. Диагностическая композиция, содержащая систему доставки наночастиц по любому из пп.1-12 и фармацевтически приемлемый носитель.
Текст
Изобретение относится к термочувствительным липосомам, инкапсулирующим наночастицы,которые могут быть использованы в области здравоохранения, в частности человеческого здравоохранения. Изобретение также относится к фармацевтическим и диагностическим композициям, включающим термочувствительные липосомы, как определено ранее, а также к их применению. Область изобретения Изобретение относится к системам доставки наночастиц, позволяющим их контролируемое высвобождение, в частности к термочувствительным липосомам, разрушающимся при Tm (температуре перехода кристаллической фазы из геля в жидкость) или выше Tm, которые могут быть использованы в области здравоохранения, в частности для охраны здоровья людей. Термочувствительные липосомы по изобретению включают термочувствительную мембрану, инкапсулирующую наночастицы, электростатический поверхностный заряд которых составляет преимущественно ниже -20 мВ или выше +20 мВ при измерении в водной среде при физиологическом уровне pH. Инкапсулированные частицы могут быть использованы в качестве терапевтического или диагностического средства. Изобретение также относится к фармацевтическим и диагностическим композициям, включающим системы доставки наночастиц, как определено ранее, а также к их применению. Предшествующий уровень техники Ограничением традиционного медицинского лечения с использованием терапевтического или диагностического средства является отсутствие специфичности. Действительно, в большинстве случаев только небольшая доля вводимой дозы терапевтического или диагностического средства достигает интересующего места, тогда как остаток средства распределяется по всему организму. Такое неизбежное распределение в здоровых органах и тканях ограничивает количество средства, которое можно вводить пациенту, и в свою очередь предотвращает достижение терапевтического или диагностического эффекта средства, на которое оно способно. Необходимость в сайт-специфичном носителе для доставки средства, которое не только увеличивает количество средства, достигающее предназначенного места, но также снижает количество, доставляемое в другие здоровые области организма, существует в течение длительного времени, в частности, для токсических химиотерапевтических средств. Такие носители, способные снижать или даже устранять побочные эффекты, сделают лечение существенно менее токсичным и более эффективным. Липосомы в течение десятилетия присутствуют в качестве носителей для доставки в наномасштабе для терапевтических и диагностических средств. Наибольшей проблемой любых носителей для доставки любого средства является возможность полного высвобождения инкапсулированных средств из носителя специфически в пораженном месте и с контролируемой скоростью. Более того, применение липосом в качестве средства доставки наночастиц все еще находится в стадии доклинических разработок в контексте наружно активируемых наночастиц (Al-Jamal W.T. et al., Nanomedicine, 2007; 2:85-98). Получение липосом, рецептированных с PEG-липидами, содержащих или способный к слиянию или pH-чувствительный липид для обеспечения дестабилизации эндосомальных мембран и получения квантовых точек (QD) цитоплазматического высвобождения, описано in vitro (Sigot et al., BioconjugateChem. 2010; 21:1465-1472). Диссоциация PEG-липида из липосом может быть облегчена путем включения способных к слиянию PEG-липидов с короткой акриловой цепью, обеспечивая перенос с липосомы на бислой в течение минут. Альтернативно, PEG-липид может быть высвобожден внутриклеточно путем добавления отщепляемого, pH-чувствительного аналога PEG, в котором полимерный компонент отщепляется от поверхности липосомы при воздействии кислого окружения определенных отделов эндосом. Тогда как такое "спонтанное" высвобождение может быть полезным (особенно для лечения отдаленных метастазов), так как оно полагается единственно на местное окружение, высвобождение содержимого липосом может все еще быть медленным и может совсем не проявляться, если окружение не является оптимальным. Следовательно, точный контроль за высвобождением содержимого липосом невозможен с такими липосомами. Также было описано получение липосом, включающих фотосенсибилизатор (US 2010/0233224). Фотосенсибилизатор способен окислять ненасыщенные фосфолипиды мембраны липосом при воздействии света и кислорода, вследствие перекисного окисления липидной цепи. Фотоокисление липосом может быть запущено для высвобождения их нагрузки по запросу и быстро посредством внешних световых стимулов. Окисление отвечает за разрыв мембраны липосом и за последующее высвобождение содержимого липосом. Однако такой источник света может быть использован только когда целевая ткань является поверхностно доступной. Липосомы, включенные в более глубокие ткани, не могут быть стимулированы светом. Липосомы, включающие фотосенсибилизатор, следовательно, не могут быть использованы для доставки наночастиц в глубокие органы или структуры человеческого организма. Активируемые лазером полые металлические наноструктуры также в прошлом использовали как средства для обеспечения проницаемости мембраны липосом, в которые они инкапсулированы с целью возможности селективного высвобождения лекарственного средства (WO 2009/097480). В US 2009004258 описаны термочувствительные липосомы, инкапсулирующие парамагнетические наночастицы оксида железа и лекарственные средства, парамагнитные частицы оксида железа, допускающие специфическое или селективное высвобождение лекарственных средств в целевом окружении при активации переменным магнитным полем. Однако такие липосомы не проницаемы для инкапсули-1 024930 рованных наночастиц. В настоящем изобретении авторы обеспечивают преимущественные системы, позволяющие безопасную доставку in vivo, и контролируемое и эффективное высвобождение наночастиц у пациента. Указанные системы в частности позволяют доставку и высвобождение наружно активируемых наночастиц в глубоких структурах человеческого организма. Примеры эффективно активируемых наночастиц, применимых в качестве диагностических и/или терапевтических средств, описаны авторами изобретения в WO 2007/118884, WO 2009/147214 и WO 2011/003999. Сущность изобретения Авторы в настоящем изобретении обеспечивают термочувствительные липосомы, разрушающиеся при Tm или выше Tm, где липосомы включают наночастицы, инкапсулированные в термочувствительные липидные мембраны, "электростатический поверхностный заряд" (также в настоящем описании определяемый как "заряд" или "поверхностный заряд") наночастиц составляет ниже -20 мВ или выше +20 мВ при измерении в водной среде при физиологическом уровне pH (между 6 и 8), и наночастицы используют в качестве терапевтического или диагностического средства. Авторы изобретения дополнительно в настоящем описании обеспечивают терапевтические и диагностические композиции, включающие термочувствительные липосомы по настоящему изобретению и фармацевтически приемлемый носитель. В другом аспекте настоящее описание обеспечивает наборы, включающие один или более из вышеуказанных продуктов, т.е. термочувствительных липосом и композиций, вместе с аннотацией, обеспечивающей инструкции для применения продукта(ов). Термочувствительные липосомы по настоящему изобретению преимущественно способны защищать наночастицы от биологического окружения и в частности от преждевременного поглощения или опсонизации системой мононуклеарных фагоцитов, также называемой ретикуло-эндотелиальной системой (RES). Липосомы по настоящему изобретению, следовательно, позволяют доставку и высвобождение интактных наночастиц при термической активации (термическая активация может быть достигнута посредством физиологического повышения температуры или посредством внешней активации с использованием, например, ионизирующего излучения или фокусированного ультразвука высокой интенсивности). При высвобождении в желаемом месте наночастицы могут действовать как терапевтическое или диагностическое средство, необязательно посредством внешней активации, как будет дополнительно объяснено ниже. Описанные в настоящем описании термочувствительные липосомы дополнительно преимущественно способны доставлять наночастицы в желаемые места, в частности в глубокие области или структуры организма пациента посредством сосудистого пути. Теперь возможен точный и эффективный контроль высвобождения наночастиц (в добавление к доставке). Высвобождение наночастиц из описанных в настоящем описании термочувствительных липосом было продемонстрировано авторами изобретения для температур Tr, равных Tm или выше Tm. Взаимодействия между наночастицами и липидным бислоем, ответственные за разрыв мембран липосом (физическое разрушение, разрыв или поломка), могут объяснить такой неожиданный результат (см. фиг. 4 Е,черная стрелка). Краткое описание чертежей Фиг. 1. Схематическая структура молекулы фосфатидилхолина. На фиг. 1 показана молекула фосфолипида, структурированная вокруг глицериновой основы: цепиsn-1 и sn-2 заменены на ацильной группе длинными углеводородными цепями (R1 и R2, включающими по меньшей мере 9 атомов углерода), и sn-3 цепь, включающая полярную головку с холиновой группой(N(CH3)3+) и фосфатной группой (PO4-), придавая молекуле цвиттерионный характер. Фиг. 2 А и 2 В. Изображения трансмиссионной электронной микроскопии (ТЕМ) наночастиц оксида железа. На фиг. 2 А показаны изображения ТЕМ наночастиц оксида железа размером 5 нм (см. пример 1)(масштабная полоска = 200 нм). На фиг. 2 В показаны изображения ТЕМ наночастиц оксида железа размером 30 нм (см. пример 2)(масштабная полоска = 200 нм). Фиг. 3. Типичный профиль элюции, полученный для липосом, содержащих оксид железа. На фиг. 3 показан профиль элюции для липосом, содержащих оксид железа, определяемый количественным определением магнитных наночастиц посредством УФ-видимой спектроскопии (спектрометрCary 100 Varian) посредством колориметрической реакции между ионами железа и фенантролином. Собирали фракции, содержащие липосомы. Концентрация оксида железа в липосомах варьируется от 1 до 2,5 г/л. Фиг. 4. Крио-ТЕМ изображения липосом, содержащих наночастицы. Стрелка 1 показывает границы отверстий крио-ТЕМ сетки. Стрелки 2 и 3 соответственно показывают мембрану липосом и наночастицы оксида железа. На фиг. 4 А показаны не-термочувствительные липосомы, нагруженные наночастицами оксида же-2 024930 леза (пример 4.2), выдержанные при комнатной температуре. На фиг. 4 В показаны не-термочувствительные липосомы, нагруженные наночастицами оксида железа (пример 4.2), выдержанные при температуре 60C. На фиг. 4 С показаны не-термочувствительные липосомы, нагруженные наночастицами оксида железа (пример 4.1), выдержанные при комнатной температуре. На фиг. 4D показаны наночастицы оксида железа, высвобождаемые из термочувствительных липосом после выдерживания при 43C (Tm) (пример 4.1). На фиг. 4 Е показаны наночастицы оксида железа, высвобождаемые из термочувствительных липосом, после выдерживания при 48C (выше Tm) (пример 4.1). На фиг. 4F показаны термочувствительные липосомы, нагруженные наночастицами оксида железа(пример 4.3), выдержанные при комнатной температуре. На фиг. 4G дополнительно показаны термочувствительные липосомы, нагруженные наночастицами оксида железа (пример 4.3), выдержанные при 43C (Tm). Подробное описание изобретения В настоящем описании авторы обеспечивают термочувствительные липосомы, разрушающиеся приTm (температура перехода кристаллической фазы из геля в жидкость) или выше Tm. Указанные липосомы включают термочувствительную липидную мембрану, инкапсулирующую наночастицы, применяемые у пациента в качестве терапевтического или диагностического средства. Авторы изобретения неожиданно обнаружили разрушение термочувствительных липосом при Tm или выше Tm, когда электростатический поверхностный заряд наночастиц равен ниже -20 мВ или выше+20 мВ при измерении в водной среде при физиологическом уровне pH (обычно между pH 6 и 8). Такое разрушение мембран липосом позволяет высвобождение инкапсулированных заряженных наночастиц. Как используется в настоящем описании, термин "пациент" обозначает любой организм. Термин относится не исключительно к человеку, который является одним примером пациентов, но также может относиться к животным и даже культурам тканей. Липосомы. Термин "липосома" относится к сферическому пузырьку, состоящему из по меньшей мере одного бислоя амфипатических молекул, которые образуют мембрану, отделяющую интравезикулярную среду от внешней среды. Интравезикулярная среда составляет внутреннее водное ядро липосомы. Гидрофильные молекулы или компоненты могут быть инкапсулированы внутри внутреннего водного ядра липосомы посредством активных методов инкапсулирования, известных специалисту в области техники, и далее дополнительно описанных ниже. Гидрофобные молекулы или компоненты могут быть захвачены в мембрану. Амфипатические молекулы, составляющие бислой, представляют собой липиды, в частности фосфолипиды. Амфипатические характеристики молекул фосфолипидов лежат в присутствии гидрофильной головки и глицериновой группы, и гидрофобного хвоста, состоящего из одной или двух жирных кислот(см. фиг. 1). В водной среде фосфолипиды имеют тенденцию самообъединяться для минимизации контакта цепей жирных кислот с водой, и они склонны адаптироваться к различным типам компоновки (мицеллы,ламелярная фаза и др) в соответствии с их химической структурой. В частности, известно, что фосфатидилхолины образуют ламеллярную фазу, состоящую из слипшихся бислоев, подвергшихся "спонтанному" искривлению и наконец образующих пузырьки (Lasic D.D. et al., Adv. Colloid. Interf. Sci. 2001; 8990:337-349). Фосфолипидная ламеллярная фаза составляет термотропный жидкий кристалл. Это означает, что степень упорядоченности амфипатических молекул зависит от температуры. Действительно,фосфолипидный слой демонстрирует температуру перехода основной фазы Tm (для температуры "плавления"), соответствующую переходу между "гелеподобной" ламеллярной фазой L в "жидкостьподобную" ламеллярную фазу L. В фазе "геля" сильные гидрофобные взаимодействия между углеродными цепями жирных кислот провоцируют кристаллический порядок молекул фосфолипидов: бислой является проницаемым только для мелких ионов. В "жидкой" фазе гидрофобные хвосты двигаются из-за термического движения, которое вызывает потерю порядка молекул фосфолипидов и приводит к "жидкой кристаллической" фазе: бислой становится проницаемым для молекул, таких как лекарственные средства. Температура перехода кристаллической фазы "гель-в-жидкость" Tm зависит от химической структуры молекулы фосфолипидов: длины углеводородной цепи, ненасыщенности, асимметрии и разветвленности жирных кислот, типа связи цепи-глицерина (сложный эфир, простой эфир, амид), положения прикрепления цепи к глицериновой основе (1,2- vs 1,3-) и модификации головной группы. В случае фосфатидилхолинов структура и конформация цепей жирных кислот имеет определенную значимость (Koynova et al., Biochim. Biophys. Acta 1998; 1376:91-145). Увеличение длины цепи жирных кислот увеличивает температуру перехода главной фазы. Например, было показано, что для насыщенных диацилфосфатидилхолинов с длиной цепи, варьирующейся от 9 до 24 атомов углерода, Tm линейно зависит от 1/n (n представляет число атомов углерода в цепях жирных кислот), с Tm увеличивающейся от, например 41C для n=16 до 80C для n=24. Эффект ненасыщенности на температуру перехода основной кристаллической фазы из геля в жидкость зависит от конформации (цис- или транстип), положения в цепи жирной кислоты и количества двойных связей. Например, введение единственного участка ненасыщенности цис типа на sn-2 цепи только и в обеих цепях фосфатидилхолина, включающих 18-атомов углерода, может оказывать эффект снижения основной температуры перехода плавления на 50C (от 54,5 до 3,8C) и 75C (от 54,5 до -21C) соответственно. Наоборот, когда двойная связь имеет транстип, эффект существенно меньше. Кроме того, Tm критически зависит от положения цис-двойной связи. Специфически, Tm минимизирована, когда двойная связь расположена около геометрического центра углеводородной цепи, и прогрессивно увеличивается при перемещении двойной связи в направлении любого конца цепи. Такие зависимости появляются, когда двойная связь присутствует только в sn-2 цепи или в обеих цепях фосфатидилхолина. Относительно влияния количества двойных цепей было показано, что при увеличении количества цисненасыщенности Tm снижается. Например, когда два или три участка цисненасыщенности вводят в обе ацильные цепи фосфатидилхолина, включающие 18-атомов углерода, температура перехода плавления цепи снижается на внушительные 109C (с 54,5 до -55,1C) и 116C (с 54,5 до -61,5C) соответственно(Koynova et al., Biochim. Biophys. Acta 1998; 1376:91-145). Смешанно-цепочечные фосфатидилхолины представляют собой цепи углеводородов различной длины в положениях sn-1 и sn-2. Были получены эмпирические уравнения, которые позволяют точно предсказать температуры перехода связанных фосфатидилхолинов определенной структуры. Был описан нормализованный параметр неравенства длины цепи, C/L, где C (=n1-n2+1,5) представляет собой эффективную разницу длины цепи, и n1 и n2 представляют собой количества атомов углерода в положениях sn-1 и sn-2 глицериновой основы соответственно. CL представляет собой эффективную длину более длинной из двух цепей. Для фосфатидилхолинов, имеющих одинаковое количество всех атомов углерода, составляющих две цепи (n1+n2=константа), температура плавления цепи снижается монотонно, когда параметр неравенства длины цепи C/L повышается до около 0,4. Когда C/L повышается выше около 0,4, перестройка упаковки, вызываемая метиловыми концами ацильных цепей, становится настолько преобладающей, что асимметричные молекулы фосфатидилхолина приспосабливаются к новой упакованной конструкции, называемой смешанным переплетением. При такой перестройке, Tm увеличивается с асимметрией длины цепи. С целью доставки лекарственных средств стериновый компонент может быть включен для придания липосомам подходящего физико-химического и биологического поведения. Такой стериновый компонент может быть выбран из холестерина или его производного, например, эргостерина или холестерингемисукцината, но предпочтительно является холестерином. Холестерин часто используют в липидных композициях липосом, так как обычно понимают, что присутствие холестерина снижает их проницаемость и защищает их от дестабилизирующих эффектов плазмы или белков сыворотки. Молекула холестерина содержит три хорошо различаемых участка: небольшая полярная гидроксильная группа, ригидное пластинчатое стероидное кольцо и хвост алкильной цепи. Когда холестерин встраивается в мембрану, его полярные гидроксильные группы располагаются около середины глицериновой основы молекулы фосфатидилхолина (Kepczynski M. et al., Chemistry and Physics of Lipids,2008;155:7-15). Включение в липидные бислои модификаторов, таких как холестерин, существенно изменяет структурные или физические свойства мембран липосом, такие как их организация, свободный объем, толщина, текучесть (вязкость) и полярность (гидрофобность). Вязкость бислоя зависит от положения холестерина в бислое, что влияет на свободный объем мембраны и на температуру. Эффект холестерина на микровязкость бислоя является скорее комплексным. Хорошо известно, что холестерин увеличивает очевидную микровязкость (снижает текучесть) мембран,находящихся в жидкой фазе (Cournia et al., J. Phys. Chem. B, 2007;111:1786-1801).Papahadjopoulos et al. показали, что защитный эффект холестерина для липосом зависит от физического состояния, т.е. "гель" или "жидкость", липидной мембраны в контакте с сывороткой или плазмой. В гелеобразном состоянии присутствие холестерина влияет на параметр упорядочивания фосфолипидных ацильных цепей в бислое и усиливает высвобождение захваченной молекулы. В жидком состоянии холестерин стабилизирует липосомы и предотвращает утечку инкапсулированного материала (Papahadjopoulos et al., Pharm. Research, 1995; 12(10): 1407-1416). При добавлении холестерина в концентрации выше 25 молярных процентов (мол.%), имеет место драматическое влияние на переход кристаллической фазы липида из геля в жидкость. Описан новый термодинамически стабильный промежуток сосуществования между жидко-неупорядоченной (жидкость) и твердо-упорядоченной (гель) фазами: жидкаяупорядоченная фаза (Cournia et al., J. Phys. Chem. B, 2007;111:1786-1801; Polozov et al., Biophysical Journal, 2006; 90:2051-2061). Такая новая фаза характеризуется текучестью, которая является промежуточной между текучестью гелевой фазы и текучестью жидкой фазы, сформированной чистыми липидами. Недавно было предложено, что жидкая упорядоченная фаза образуется, когда холестерин ассоциируется с насыщенными, высокоплавкими липидами, такими как дипальмитоилфосфатидилхолин (DPPC) и сфингомиелин, для получения динамических комплексов в моделях мембран, так называемых "липидные плиты". Холестерин запускает разделение фаз в моделях мембран, где образуются домены, обогащенные холестерином и обедненные холестерином (Radhakrishnan et al., Proc. Natl. Acad. Sci., 2000; 97: 1242212427; Mc Connell et al., Biochim. Biophys. Acta, 2003; 1610:159-173). Действительно, Gaber et al. (Pharm.Research, 1995; 12 (10): 1407-1416) показали, что две липидные композиции, содержащие 33 мол.% холестерин дипальмитоилфосфатидилхолина (DPPC), гидрогенизированного соевого фосфатидилхолина(HSPC) и холестерина в молярном соотношении 100:50:75 и 50:50:50 соответственно, не дают температуры перехода фаз между 30 и 65C, что демонстрируют дифференциальной сканирующей калориметрией. Липосомы с таким составом называют как "нетермочувствительные" липосомы. Типичные "термочувствительные" липосомы, применяемые в контексте настоящего изобретения(т.е. липосомы с основной температурой перехода фаз Tm, обычно составляющей между 39 и 55C, предпочтительно между 39 и 50C, еще более предпочтительно между 39 и 45C) включают, по меньшей мере, фосфатидилхолин. Фосфатидилхолин может быть выбран из дипальмитоилфосфатидилхолина (DPPC), дистеарилфосфатидилхолина (DSPC), гидрогенизированного соевого фосфатидилхолина (HSPC), монопальмитоилфосфатидилхолина (МРРС), моностеарилфосфатидилхолина (MSPC) и их любой смеси. В предпочтительном варианте осуществления термочувствительные липосомы дополнительно включают дистеарилфосфатидилэтаноламин(DSPE),дистеарилфосфатидилэтаноламин(DSPE)метоксиполиэтиленгликоль (PEG) (DSPE-PEG). В предпочтительном варианте осуществления изобретения холестерин добавляют в молярном соотношении ниже 25 мол.%. Предпочтительная термочувствительная липидная мембрана включает дипальмитоилфосфатидилхолин (DPPC), гидрогенизированный соевый фосфатидилхолин (HSPC), холестерин и дистеарилфосфатидилэтаноламин(DSPE)-метоксиполиэтиленгликоль (PEG), например, PEG2000 (DSPE-PEG2000). В определенном варианте осуществления изобретения молярное соотношение ранее идентифицированных соединений составляет предпочтительно 100:50:30:6 или 100:33:27:7. Другие предпочтительные термочувствительные липидные мембраны включают дипальмитоилфосфатидилхолин (DPPC), монопальмитоилфосфатидилхолин (МРРС) и дистеарилфосфатидилэтаноламин(DSPE)-метоксиполиэтиленгликоль (PEG), например метоксиполиэтиленгликоль-2000 (DSPEPEG2000). В определенном варианте осуществления изобретения молярное соотношение ранее идентифицированных соединений составляет предпочтительно 100:12:5. Другие предпочтительные термочувствительные липидные мембраны включают дипальмитоилфосфатидилхолин (DPPC), моностеарилфосфатидилхолин (MSPC), и дистеарилфосфатидилэтаноламин(DSPE)-метоксиполиэтиленгликоль (PEG), например метоксиполиэтиленгликоль-2000(DSPE-PEG2000). В определенном варианте осуществления изобретения молярное соотношение ранее идентифицированных соединений предпочтительно составляет 100:12:5. В зависимости от типа получения можно регулировать размер и степень пластинчатости. Несколько способов для получения однослойных липидных пузырьков описаны в литературе: выпаривание с обращенной фазой (Szoka et al., PNAS, 1978; 75(9): 4191-4198), инъекция этанола (Pons et al., InternationalJournal of Pharmaceutics, 1993; 95(1-3):51-56), метод нагревания (Mozafari et al., Journal of Biotechnology,2007; 129:604-613), но наиболее простым является способ гидратации липидной пленки (Bangham et al., J.Mol. Bio., 1965; 13:238-252). Коротко, в методе гидратации липидной пленки, липиды растворяют в органическом растворителе, таком как хлороформ. После гомогенизации раствора органический растворитель выпаривают в потоке азота. Полученная таким образом сухая липидная пленка затем гидратируется в водной среде при температуре выше температуры перехода основной фазы Tm, приводя к образованию многослойных пузырьков с размерами, варьирующимися от 100 до 800 нм (Mills J.K. et al., Methods inEnzymology 2004; 387:82-113). Циклы дегидратации и регидратации путем соответствующего замораживания (в жидком азоте) и оттаивания раствора (при температуре выше Tm) позволяют увеличить водный внутренний объем путем получения однослойных пузырьков. Процесс, позволяющий калибровку размеров пузырьков затем применяют для получения гомогенного распределения по размерам. Обработка ультразвуком дает мелкие однослойные пузырьки (SUV) размером, варьирующимся от 20 до 50 нм, тогда как процесс экструзии через фильтровальную мембрану дает крупные однослойные пузырьки (LUV) размером, варьирующимся от 50 до 500 нм в зависимости от размера отверстий фильтра. Оба процесса,обработка ультразвуком и экструзия, необходимо проводить при температуре выше Tm. Наибольший размер термочувствительных липосом по настоящему изобретению типично составляет между 50 и 500 нм, предпочтительно между 50 и 250 нм, например между около 50 и около 150 нм. Термочувствительные липосомы, используемые в настоящем изобретении, предпочтительно включают биосовместимую оболочку для обеспечения или улучшения их биосовместимости и специфического биораспределения. Биосовместимые оболочки позволяют или поддерживают стабильность липосом в биосовместимой суспензии, такой как физиологическая жидкость (кровь, плазма, сыворотка и др.), любой изотонической среде или физиологической среде, например среде, включающей глюкозу (5%) и/или NaCl (0,9%), которая требуется для фармацевтического введения. Такую биосовместимую оболочку получают путем обработки липосом средством для обработки поверхностей. Стабильность может быть подтверждена исследованиями динамического рассеяния света липосом в биосовместимой суспензии. Указанная оболочка преимущественно сохраняет целостность липосом in vivo, обеспечивает или улучшает их биосовместимость и облегчает их необязательную функционализацию (например, с помощью молекул спейсеров, биосовместимых полимеров, нацеливающих агентов, белков и др.). Оболочка может быть небиоразлагаемой или биоразлагаемой. Обе опции могут быть использованы в контексте настоящего изобретения. Примеры небиоразлагаемых оболочек представляют собой один или более материалов или средств для обработки поверхности, выбираемых из группы, состоящей из сахара (агароза, например), насыщенных полимеров углерода (полиэтиленоксид например), сетчатых или нет, модифицированных или нет(полиметакрилат или полистирол, например), а также их комбинаций. Примерами биоразлагаемых оболочек являются, например, один или более материалов или средств для обработки поверхности, выбираемых из группы, состоящей из биологической молекулы, модифицированной или нет, натуральной или нет, и биологического полимера; модифицированного или нет, натуральной формы или нет. Биологическим полимером может быть сахарид, олигосахарид или полисахарид,полисульфатированный или нет, например декстран. Вышеупомянутые материалы, соединения или средства для обработки поверхности могут быть использованы отдельно или в комбинациях, смесях или ансамблях, композитных или нет, ковалентных или нет, необязательно в комбинации с другими соединениями. Термочувствительные липосомы по настоящему изобретению могут дополнительно включать поверхностный компонент, позволяющий специфическое нацеливание на биологические ткани или клетки. Таким поверхностным компонентом является предпочтительно нацеливающее средство, позволяющее взаимодействие липосом с элементом распознавания, присутствующим на целевой биологической структуре. Такие нацеливающие средства могут действовать только, когда липосомы накапливаются в опухоли. В качестве подтверждения того, что нацеливающее средство отвечает за его взаимодействие с целью, плотность указанного нацеливающего средства необходимо тщательно контролировать в соответствии с методами, известными специалисту в области техники. Его высокая плотность может действительно нарушить конформацию нацеливающего агента и впоследствии его распознавание целевой клеткойRelease 2005; 104:113). Кроме того, высокая плотность нацеливающего агента может обеспечивать расщепление липосом ретикулоэндотелиальной системой (RES) во время циркуляции в кровотоке. Оболочка также может содержать различные функциональные группы (или линкерные сегменты),позволяющие любой интересующей молекуле связываться с поверхностью липосомы, такие как поверхностные компоненты, позволяющие специфическое нацеливание на биологические ткани или клетки. Наночастицы. Продукты и композиции по изобретению могут быть использованы во множестве областей, в частности в медицине и ветеринарии. Инкапсулированные наночастицы могут быть использованы после высвобождения из термочувствительных липосом в качестве терапевтического или в качестве диагностического средства и их структура непосредственно зависит от предназначения. Термин "наночастица" относится к частице или агрегату частиц, указанная наночастица включает ядро (или центральное ядро) и оболочку, наибольший размер ядра составляет менее чем около 100 нм. Обычно наибольший размер ядра наночастицы представляет собой диаметр наночастицы округлой или сферической формы, или наибольшую длину наночастицы овоидной или овальной формы. Термины "размер наночастицы" и "наибольший размер наночастицы" в настоящем описании относится к "наибольшему размеру ядра наночастицы"."Ядро" может обозначать одиночную частицу (кристалл или кристаллит) или агрегат частиц (агрегат кристаллов или кристаллитов). Трансмиссионная электронная микроскопия (ТЕМ) или криоТЕМ может быть преимущественно использована для измерения размера ядра наночастицы, особенно когда ядро состоит из единственной частицы (см. фиг. 2). Также динамическое рассеяние света (DLS) может быть использовано для измерения гидродинамического диаметра ядра наночастицы в растворе, когда указанное ядро состоит из частицы или в агрегате частиц. Указанные два метода могут дополнительно быть использованы один после другого для сравнения оценки размеров и подтверждения указанного размера. Центральное ядро наночастицы обычно получают из терапевтического или диагностического материала, который предпочтительно является активируемым или возбудимым материалом. Материал может быть неорганическим материалом, органическим материалом или их смесью. Предпочтительно материалом является неорганический материал. Любой тип наночастиц может быть инкапсулирован в термочувствительные липосомы по настоящему изобретению, если их электронный заряд ниже -15 мВ или выше +15 мВ, например между -15 и -20 мВ или между +15 и +20 мВ, как правило ниже -20 мВ или выше +20 мВ, при определении посредством измерений дзета потенциала, проводимыми на суспензиях наночастиц с концентрацией, варьирующейся между 0,2 и 8 г/л, наночастиц, суспендированных в водной среде при pH составляющем между 6 и 8. Форма наночастицы может быть, например, круглой, плоской, удлиненной, сферической, овоидной или овальной и подобной. Форма может быть определена или контролироваться посредством метода получения и адаптирована специалистом в области техники в соответствии с желаемым применением. Так как форма частиц может влиять на их "биосовместимость", при доставке в целевое место предпочтительными являются частицы, имеющие достаточно гомогенную форму. По фармакокинетическим причинам предпочтительными, следовательно, являются наночастицы, по существу сферические, круглые или овоидные по форме. Сферическая или округлая форма является особенно предпочтительной. Наибольший размер наночастиц, т.е. наибольшее измерение ядра наночастиц, используемое в контексте настоящего изобретения, обычно составляет между 1 и 100 нм. Он преимущественно составляет, когда наночастицы используют в качестве терапевтического средства, между около 5 и около 100 нм, например между около 5 и 80 нм, например между около 10 и около 80 нм, преимущественно между около 10 или 20 нм и около 70 нм, предпочтительно между около 15 и около 60 нм или между около 10 или 15 нм и около 50 нм. Он преимущественно составляет, когда наночастицы используют в качестве диагностического средства между около 2 и около 10 нм, например между около 4 и около 8 нм. Наночастицы, используемые в контексте настоящего изобретения, включают ядро и оболочку, указанная оболочка отвечает за присутствие электростатического поверхностного заряда ниже -20 мВ или выше +20 мВ при измерении в водной среде при физиологическом pH. Электростатическая оболочка преимущественно является "полной оболочкой" (полным монослоем). Это предполагает присутствие очень высокой плотности биосовместимых молекул, создающих соответствующий заряд на всей поверхности наночастицы. Такая полная оболочка обеспечивает разрыв мембраны термочувствительных липосом при Tm или выше Tm. Неорганический материал, составляющий ядро, может быть магнитным материалом. Магнитные материалы включают, например, железо, никель, кобальт, гадолиний, самарий, неодим,предпочтительно в форме оксида, гидроксида или металла, и их любой смеси. В специфических примерах материал, образующий ядро, может быть выбран из группы, состоящей из оксида двухвалентного и трехвалентного железа. В предпочтительном варианте осуществления настоящего изобретения наночастицы оксида сделаны из магнетита или магхемита. Смешанный материал также может быть использован для оптимизации взаимоотношений между магнитным полем и наночастицами. Формы твердого раствора (хорошо известные специалисту в области техники, как случайные смеси нескольких материалов), такие как CoFe2CO4, например, могут быть использованы в качестве смешанного материала. Форма твердого раствора в перемешанных фазах, таких какFe2O3/Co, например, может быть дополнительно использована. Когда магнитный материал используют в качестве терапевтического материала, он предпочтительно является ферромагнитным материалом. Когда магнитный материал используют в качестве диагностического материала, он предпочтительно является суперпарамагнетиком. Неорганическим материалом, составляющим ядро, может быть материал высокой электронной плотности, состоящий из металлического элемента, имеющего атомный номер (Z), по меньшей мере 50,предпочтительно по меньшей мере 60 или 61, более предпочтительно по меньшей мере 65, 66, 67 или даже 68. Атомный номер (также известный как протонное число) представляет собой количество протонов,обнаруживаемых в ядре атома. Его традиционно обозначают символом Z. Атомный номер уникально идентифицирует химический элемент. В атоме нейтрального заряда атомный номер равен количеству электронов.Z участвует в способности наночастиц абсорбировать падающее излучение. Неорганическим материалом, составляющим ядро, может быть оксид, выбираемый из оксида церия(Lu2O3), оксида гафния (IV) (HfO2), оксида тантала (V) (Та 2 О 5), оксида рения (IV) (ReO2). В контексте настоящего изобретения также возможна смесь неорганических оксидов. Неорганическим материалом, составляющим ядро, может быть металл, металл, имеющий предпочтительно атомный номер (Z), по меньшей мере 40 или 50, более предпочтительно по меньшей мере 60 или 70. Металл может быть выбран из золота (Au-Z=79), серебра (Ag-Z=47), платины (Pt-Z=78), палладия ропия (Eu-Z=63), холмия (Ho-Z=67), лантана (La-Z=57), неодима (Nd-Z=60), празеодиния (Pr-Z=59), и их любой смеси. В предпочтительном варианте осуществления настоящего изобретения ядро наночастиц состоит из золота. В контексте настоящего изобретения ядро наночастиц может состоять из смеси неорганического оксида и металла. Оболочкой, отвечающей за наличие электростатического поверхностного заряда ниже -20 мВ или выше + 20 мВ наночастиц при измерении в водной среде при физиологическом pH, может быть неорганическая или органическая оболочка. Неорганическая оболочка может быть выбрана из группы, состоящей из оксида, гидроксида и оксигидроксида. Неорганическая оболочка может включать, например, кремний, алюминий, кальций и/или магний. Неорганическое средство, выбираемое из группы, состоящей из, например, магния и кальция, дает положительный заряд (выше +20 мВ) поверхности наночастиц при pH 7. В другом варианте осуществления изобретения кремниевая группа может быть использована для придания поверхности наночастиц отрицательного заряда (ниже -20 мВ) при pH 7. Органическую оболочку получают с молекулами, способными взаимодействовать через ковалентные связи или электростатические связи с поверхностью наночастиц и придавать указанным наночастицам поверхностные свойства. Органические молекулы поверхностной оболочки имеют две группы, R и X. Функцией X является взаимодействие с поверхностью наночастиц и функцией R является придание поверхности наночастиц их специфических свойств.X может быть выбрана например из карбоксилатной (R-COO-), силановой (R-Si(OR)3), фосфоновойR придает, по меньшей мере, электронный поверхностный заряд наночастицам в водной суспензии при физиологическом pH. Когда R придает положительный заряд поверхности наночастиц, R может быть амином (NH2-X). Когда R придает отрицательный заряд поверхности наночастиц, R может быть фосфатом (РО 43X) или карбоксилатом (COO X). Органическая оболочка, придающая положительный заряд (выше +20 мВ) поверхности наночастиц,может быть выбрана из, например, аминопропилтриэтоксисилана, полилизина или 2-аминоэтантиола. Органическая оболочка, придающая отрицательный заряд (ниже -20 мВ) поверхности наночастиц,может быть выбрана из, например, полифосфата, метафосфата, пирофосфата и др. или, например, из цитрата или дикарбоновой кислоты, в частности янтарной кислоты. Также электростатическая оболочка является преимущественно "полной оболочкой". Такая электростатическая оболочка и особенно амино или карбоксильные компоненты могут дополнительно использоваться для связи любой группы на поверхности наночастиц. Например, она может быть использована для связи нацеливающей группы или связывающей группы, как описано в настоящем описании, на поверхности наночастиц с использованием, например, линкера, такого как карбодиимид. Необязательно, поверхность наночастиц может быть функционализирована с использованием группы, способной взаимодействовать ("связывающая группа") непосредственно с белками, когда наночастицы высвобождаются из термочувствительных липосом и образуют с ними ковалентную связь.R может состоять из реакционноспособной группы, способной ковалентно взаимодействовать с амином, карбоксильной или тиоловой группами, присутствующими на белках, такими как сукцинимидилэфирная группа (которая реагирует с аминогруппой) и/или малеимидная группа (которая реагирует с карбоксильной группой). Необязательно поверхность наночастиц может быть функционализирована с использованием группы, способной нацеливаться ("нацеливающая группа") на специфическую биологическую ткань или клетку. Нацеливающая группа может быть любой биологической или химической структурой, отражающей афинность к молекуле, присутствующей в организме человека или животного. Такая нацеливающая группа обычно действует, когда наночастицы накапливаются в целевом месте и высвобождаются из липосом при термической активации при Tm или выше Tm. Нацеливающая группа может быть выбрана из антигена, спейсерной молекулы, биосовместимого полимера. Нацеливающая группа может быть любой биологической или химической структурой, проявляющей афинность к молекулам, присутствующим в организме человека или животного. Например, это может быть пептид, олигопептид или полипептид, белок, нуклеиновая кислота (ДНК, РНК, SiPHK,тРНК, miPHK, и др.), гормон, витамин, фермент и подобные и в целом любой лиганд молекул (например,рецепторов, маркеров, антигенов и др). Лиганды молекул, экспрессируемые патологическими клетками,в частности лиганды опухолевых антигенов, рецепторы гормонов, рецепторы цитокинов или рецепторы факторов роста. Указанные нацеливающие группы могут быть выбраны, например, из группы, состоящей из LHRH, EGF, фолата, анти-B-FN антитела, E-селектина/P-селектина, анти-IL-2R антитела, GHRH и др. Электростатическая оболочка и/или связывающие группы, как описано в настоящем описании, могут быть использованы для связи любой группы на поверхности наночастиц. Например, их можно использовать как линкеры для соединения нацеливающей группы на поверхности наночастиц. Следовательно, определенным предметом, описанным в настоящем описании, являются термочувствительные липосомы, инкапсулирующие наночастицы, которые ковалентно или электростатически покрыты средством, ответственным за наличие электростатического поверхностного заряда ниже -20 мВ или выше +20 мВ. Указанным средством предпочтительно является органическая молекула, имеющая две группы, R иX, R выбирают из амина, фосфата и карбоксилата и X выбирают из карбоксилата, силана, фосфоновой группы, фосфорной группы и тиола. Наночастицы могут дополнительно включать связывающую группу, выбираемую из сукцинимидилового эфира и малеимидной группы и/или нацеливающую группу, выбираемую из пептида, олигопептида, полипептида, белка, нуклеиновой кислоты, гормона, витамина, фермента, лиганда опухолевого антигена, рецептора гормона, рецептора цитокина и рецептора фактора роста. Необязательно, поверхность наночастиц может быть функционализирована с использованием стерической группы. Такая группа может быть выбрана из полиэтиленгликоля (PEG), полиэтиленоксида,поливинилового спирта, полиакрилата, полиакриламида (поли(N-изопропилакриламида, поликарбамида, биополимера или полисахарида, такого как декстран, ксилан, целлюлоза, коллаген, и цвиттерионного соединения, такого как полисульфобетаин, и др. Такая стерическая группа увеличивает стабильность наночастиц в биосовместимой суспензии, такой как физиологическая жидкость (кровь, плазма, сыворотка, и др.), любой изотонической среде или физиологической среде, например, среде, включающей глюкозу (5%) и/или NaCl (0,9%). Из указаний настоящего изобретения специалист в области техники понимает, что наночастицы могут быть модифицированы без отклонения от рамок изобретения. Типичные методы для получения наночастиц или агрегатов наночастиц, применимые в контексте настоящего изобретения, описаны, например, в WO 2007/118884, WO 2009/147214, US 6514481 B1, WO 2011/003999 и в Liu et al., Journal of Magnetism и Magnetic Materials 270 (2004) 1-6 "Preparation и characterization of amino-silane modified superparamagnetic silica nanospheres". Терапевтическое применение. Эффективность терапевтических наночастиц увеличивается, если наночастицы интернализуются целевыми клетками или находятся с ними в контакте. Для достижения этой цели свойства поверхности наночастиц обычно модифицируют для обеспечения взаимодействия с целевой клеткой. Например, электрический заряд поверхности наночастиц может быть модифицирован или поверхность может быть связана с нацеливающей группой или средством, таким как описано в настоящем описании. Специфическими связывающими взаимодействиями являются таковые поверхностных лигандов(нацеливающих групп, как описано в настоящем описании), которые позволяют наночастицам специфически взаимодействовать с комплементарными молекулами или рецепторами на мембране клеток. Такие взаимодействия индуцируют рецептор-опосредованный эндоцитоз. Нацеливающий лиганд, конъюгированный с поверхностью наночастиц, может распознавать и связывать рецепторы, мембранные белки,поверхностные антигены, экспрессируемые на целевой клетке, таким образом запуская эндоцитоз и внутриклеточную доставку. Неспецифические притягивающие силы, которые запускают контакт клеток и потребление частиц,возникают в результате внутренних характеристик наночастиц, таких как заряд поверхности. Однако, как правило, такие модификации являются пагубными для биораспределения наночастиц. Описанные в настоящем описании термочувствительные липосомы преодолевают указанную проблему и допускают, как объясняется ранее, эффективное биораспределение (доставку) и контролируемое высвобождение терапевтических наночастиц в организме пациента. Такие липосомы способствуют концентрации наночастиц, в частности наночастиц, проявляющих модифицированные поверхностные свойства, в целевом месте. Контролируемое (в пространстве и во времени) высвобождение наночастиц возможно в настоящее время, т.е. частицы доставляются туда и в тот момент времени, когда необходимо, когда их терапевтическая эффективность зависит от их взаимодействия с клетками (наночастицы в контакте с клетками и/или интернализованные в клетки). Когда наночастицы используют в качестве терапевтического средства, их ядро получают из терапевтического материала, которым может быть внешне активируемый материал, т.е. материал, который может быть активирован внешним источником энергии. В определенном варианте осуществления изобретения терапевтический материал способен функционально нарушать, изменять или разрушать целевую клетку, ткань или орган. Терапевтический материал может быть выбран из материала высокой электронной плотности и магнитного материала, как описано ранее. Активирующим источником может быть источник ионизирующего излучения для наночастиц, ядро которых получают из материала высокой электронной плотности, такого как HfO2 или Au. Ионизирующее излучение обычно составляет от около 5 до около 25000 КэВ, в частности от около 5 до около 6000 КэВ (LINAC источник), или от около 5 до около 1500 КэВ (такой как источник кобальта 60). С использованием источника рентгеновского излучения, предпочтительное ионизирующее излучение обычно составляет от около 50 до около 12000 КэВ, например от около 50 до около 6000 КэВ. Требуемые дозы ионизирующего излучения предпочтительно представляют собой дозы, составляющие от около 0,05 до около 16 Грей, предпочтительно между около 0,05 и около 6 Грей, для применений in vitro. Дозы составляют между более чем около 0,05 и менее чем около 16 или 30 Грей для применений, в частности локально, ex vivo или in vivo. Общее ионизирующее излучение варьируется от около 1,5 до около 85 Грей у человека в соответствии с существующей практикой. Дополнительный пик излучения около 40 Грей также может быть обеспечен у людей в соответствии с существующей практикой. Общая доза применяемого излучения может быть дана, следуя различным схемам, таким как разовая доза, фракционированные дозы, гиперфракционированные дозы и др. В общем и не ограничивая, следующее рентгеновское излучение может применяться в различных случаях для активации наночастиц рентгеновское излучение от 50 до 150 КэВ, которое является особенно эффективным для поверхностных целевых тканей; рентгеновское излучение (ортовольтаж) от 200 до 500 КэВ, которое может проникать в ткань на толщину 6 см; рентгеновское излучение (мегавольтаж) от 1000 до 25000 КэВ. Например, ионизация наночастиц для лечения рака предстательной железы может проводиться посредством пяти сфокусированных рентгеновских лучей с энергией 15000 КэВ. Радиоактивные изотопы могут альтернативно быть использованы в качестве источника ионизирующего излучения (называемое кюритерапией или брахитерапией). В частности, преимущественно могут быть использованы йод I (t1/2=60,1 дней), палладий Pd103 (t1/2=17 дней), цезий Cs137 и иридий Ir192. Иммунорадионуклид (или иммунорадиомеченный лиганд) также может быть использован в качестве источника ионизирующего излучения в контексте радиоиммунотерапии. Подходящие радионуклиды для радиоиммунотерапии могут быть, например, выбраны из 131I, 186Re, 177Lu или 90Y. Заряженные частицы, такие как протоновые лучи, ионные лучи, такие как углерод, в частности высокоэнергетические ионные лучи, также могут быть использованы в качестве источника ионизирующего излучения. Лучи электронов также могут быть использованы в качестве источника ионизирующего излучения с энергией, составляющей между 4 и 25 МэВ. Специфический источник монохромного излучения может быть использован с целью селективного получения рентгеновских лучей с энергией, близкой к или соответствующей желаемой границе поглощения рентгеновского излучения атома(ов) наночастиц. Предпочтительные источники ионизирующего излучения могут быть выбраны из источников линейного ускорителя (LINAC), кобальта 60 и брахитерапии. Количества (диапазон общей дозы излучения) и схемы (планирование и доставка излучения в одной дозе или в контексте фракционированного или гиперфракционированного протокола и др.) определяют для каждого заболевания/анатомического места/стадии заболевания пациента/возраста пациента (ребенок,взрослый, пожилой пациент), и они составляют стандарты лечения для любой специфической ситуации. Излучение может быть применено в любой момент времени после высвобождения наночастиц, в одном или более случаев с использованием любой доступной в настоящее время системы лучевой терапии. В определенном варианте осуществления изобретения терапевтическим материалом является магнитный оксид (магнетит или магхемит), в частности ферромагнитный материал, и источником активации является источник магнитного поля. Магнитное поле, которое является предпочтительно непеременным или стабильным, может применяться постоянно после высвобождения наночастиц, в один или более моментов времени, с использованием любого источника магнитного поля. Источник магнитного поля является предпочтительно однородным и ненаправленным источником магнитного поля и может быть выбран из любого постоянного магнита, электромагнита и оборудования магнитного резонансной томографии (МРТ). Подходящее непеременное или стабильное магнитное поле доступно в стандартном оборудовании МРТ, которое обычно имеет магнитное поле в диапазоне от 0,5 до 5 Тесла. При воздействии магнитного поля и в зависимости от продолжительности воздействия, магнитные наночастицы запускают деструкцию клеток или ткани (продолжительностью несколько минут, например от 2 или 5 мин до 120 мин). Наночастицы или агрегаты наночастиц и композиции по настоящему изобретению могут быть преимущественно использованы для лизиса раковых клеток или предполагаемых раковых клеток под воздействием магнитного поля. Авторы настоящего изобретения описывают применение наночастиц, как описано в настоящем опи- 10024930 сании, или популяции идентичных или отличных наночастиц, как описано в настоящем описании, для получения фармацевтической композиции, предназначенной для лечения пациента, нуждающегося в этом. Термин "лечение" обозначает любое действие, проводимое для коррекции нарушенных функций,для предотвращения заболеваний, для облегчения патологических признаков, таких как в частности уменьшение размера или роста патологической ткани, в частности опухоли, контроля за указанным размером или ростом, подавления или деструкции патологических клеток или тканей, замедления прогрессирования заболевания, стабилизации заболевания с замедлением прогрессирования рака, уменьшения образования метастаз, регресса заболевания или полной ремиссии (в контексте рака, например) и др. Фармацевтическая композиция может быть композицией, предназначенной для нарушения, разрушения, изменения или распада целевых клеток у пациента, нуждающегося в этом, когда указанные клетки подвергают воздействию источника активации. Предметом настоящего изобретения являются термочувствительные липосомы, такие как определено выше в настоящем описании и/или которые могут быть получены методами, описанными в настоящем описании, для возмущения, нарушения, изменения или разрушения целевых клеток, где указанные клетки подвергают воздействию активирующего источника. Определенные термочувствительные липосомы по настоящему изобретению представляют собой липосомы для профилактики или лечения рака или для облегчения симптомов рака у пациента. Определенный метод, описанный в настоящем описании, представляет собой метод для индукции или обеспечения расстройства, лизиса, апоптоза или деструкции клеток у пациента, включающий а) введение термочувствительных липосом (как описано в настоящем описании выше), содержащих наночастицы, пациенту, b) нагревание термочувствительных липосом до Tm или выше Tm с целью возможности местного высвобождения наночастиц и их последующего взаимодействия с клетками, в частности целевыми клетками, и, необязательно, с) воздействия на клетки источника активации, обычно внешнего источника активации, такого как описано в настоящем описании, указанное воздействие активирует наночастицы, которые в свою очередь индуцируют или вызывают расстройство, лизис, апоптоз или деструкцию клеток. Термочувствительные липосомы по настоящему изобретению можно вводить различными путями,такими как местный (например, в опухоль (IT, подкожный, внутривенный (в/в), внутрикожный, интраартериальный, в дыхательные пути (ингаляция), интраперитонеальный, внутримышечный и пероральный путь (per os). Термочувствительные липосомы по настоящему изобретению можно дополнительно вводить в виртуальную полость ложа опухоли после туморэктомии. Предпочтительным путем введения является внутривенный путь. Спустя определенный период времени после инъекции внутривенным путем термочувствительных липосом эффект усиленной проницаемости и удержания ("EPR") отвечает за пассивное накопление термочувствительных липосом в массе опухоли. Действительно наблюдали, что опухолевые сосуды существенно отличаются от нормальных капилляров и что их сосудистая "негерметичность" обеспечивает селективную транссудацию липосом не обычную для нормальных тканей. Отсутствие эффективного лимфатического дренажа опухоли предотвращает клиренс пропотевших липосом и обеспечивает их накопление. Настоящие наночастицы, следовательно, способны успешно нацеливаться на первичные, а также на метастатические опухоли при высвобождении из вводимых внутривенно термочувствительных липосом. Целевыми клетками могут быть любые патологические клетки, о которых говорят, что клетки вовлечены в патологический механизм, например пролиферирующие клетки, такие как опухолевые клетки,стенозирующие клетки (фибробласты/гладкомышечные клетки), или клетки иммунной системы (патологические клоны клеток). Предпочтительное применение основано на лечении (например, деструкции или функциональном изменении) злокачественных клеток или тканей. Другой предмет изобретения относится к способу для профилактики или лечения заболевания, в частности, рака, или облегчения симптомов расстройства, у субъекта или пациента, включающий а) введение термочувствительных липосом пациенту, страдающему от расстройства, или композиции, такой как описано в настоящем описании, включающей указанные термочувствительные липосомы, b) нагревание термочувствительных липосом до Tm или выше Tm с целью возможности местного высвобождения наночастиц и их последующего взаимодействия с клетками, в частности целевыми клетками, и, с) последующее лечение пациента путем воздействия на указанного пациента источника активации, как описано в настоящем описании, такое воздействие приводит к изменению, нарушению или функциональному разрушению патологических клеток пациента, таким образом предотвращая или проводя лечение расстройства. В классическом лечении рака систематически используют возможности комбинированного лечения(например, комбинация лучевой терапии и химиотерапии). Описанные в настоящем описании наночастицы, подвергаемые воздействию источника активации,например, в контексте лучевой терапии могут быть использованы в ассоциации с различными схемами лечения рака. Такая схема может быть выбрана из группы, состоящей из хирургического лечения, лучевой хирургии, химиотерапии, лечения, включающего введение цитостатика(ов), цитотоксических средств, нацеленной терапии и любых других биологических или неорганических продуктов, предназна- 11024930 ченных для лечения рака. Термочувствительные липосомы по настоящему изобретению могут инкапсулировать вместе с наночастицами, описанными в настоящем описании, любую интересующую терапевтическую молекулу, в частности любой биологический или неорганический продукт, предназначенный для лечения рака. Описанные в настоящем описании наночастицы могут дополнительно быть использованы в контексте только лучевой терапии. Наблюдаемая увеличенная терапевтическая эффективность частично обусловлена повышенной концентрацией эффективных наночастиц в целевом месте, обусловленную их транспортом при помощи термочувствительных липосом по изобретению и их последующим контролируемым высвобождением. Изобретение может быть использовано для лечения любого типа злокачественных опухолей, таких как гематологические опухоли или злокачественные новообразования, и солидные опухоли, в частности,эпителиального, нейроэктодермального или мезенхимального происхождения. Кроме того, описанные в настоящем описании липосомы могут быть использованы для лечения презлокачественных изменений или специфических доброкачественных заболеваний, где лучевая терапия классически используется и/или показана. Опухолью или раком может быть рак, где лучевая терапия является классическим лечением. Такой рак можно выбирать в частности из группы, состоящей из рака кожи, включая злокачественные новообразования, ассоциированные с ВИЧ, меланомы; опухолей центральной нервной системы, включая головной мозг, ствол мозга, мозжечок, гипофиз, спинномозговой канал, глаз и глазница; опухолей головы и шеи; рака легкого; рака молочной железы; опухолей желудочно-кишечного тракта, таких как рак печени и гепатобилиарного тракта, рак толстой кишки, прямой кишки и анального канала, рак желудка, поджелудочной железы, пищевода; опухолей мужской мочеполовой системы, таких как рак предстательной железы, яичек, полового члена и уретры; гинекологических опухолей, таких как рак шейки матки, эндометрия, яичника, фаллопиевых труб, влагалища и вульвы; опухолей надпочечников и забрюшинных опухолей; сарком костей и мягких тканей вне зависимости от локализации; лимфомы; миеломы; лейкоза; и опухолей у детей, таких как опухоль Вильмса, нейробластома, опухоли центральной нервной системы,саркома Юинга и др. Изобретение является применимым в контексте лечения, к первичным опухолям, или вторичным инвазиям, локо-региональным или отдаленным метастазам и в контексте профилактики, с целью профилактики вторичного злокачественного поражения центральной нервной системы, такого как наблюдаемые инвазии (метастазы) меланомы, рака легких, рака почки, рака молочной железы и др. Термочувствительные липосомы могут быть использованы в любой момент времени на всем протяжении периода антиракового лечения. Их можно вводить, например, в качестве неоадъюванта (перед хирургическим вмешательством для иссечения опухоли) или в качестве адъюванта (после операции). Термочувствительные липосомы также могут быть использованы при запущенных опухолях, которые не могут быть удалены хирургически. Повторные инъекции или введение термочувствительных липосом можно проводить, когда необходимо. Диагностическое применение. Контролируемая доставка наночастиц также желательна для визуализации in vivo и/или диагностических целей и в настоящее время возможна, когда указанные наночастицы инкапсулированы в термочувствительные липосомы по настоящему изобретению. Авторы описывают в настоящем изобретении применение термочуствительных липосом по настоящему изобретению, в частности термочуствительных липосом, включающих наночастицы, как описано в настоящем описании, или популяции идентичных или отличных наночастиц, как описано в настоящем описании, для получения диагностической композиции, предназначенной для определения присутствия патологической ткани или клеток, в частности опухолевых клеток у пациента, предпочтительно когда указанного пациента подвергают воздействию внешнего источника энергии. Предметом изобретения являются термочувствительные липосомы, такие как липосомы, определяемые в настоящем описании выше, и/или которые могут быть получены методами, описанными в настоящем описании, для определения или визуализации патологических клеток у пациента, когда указанного пациента подвергают воздействию внешнего источника энергии. Диагностический материал может быть выбран из материала высокой электронной плотности и магнитного материала, как описано ранее. Когда наночастицы используют в качестве диагностического средства, предназначенного для определения или визуализации патологической ткани или клеток, их ядро преимущественно состоит из визуализируемого материала. Такой визуализируемый материал может преимущественно быть выбран из любого магнитного материала, такого как оксид двухвалентного или трехвалентного железа, как определено ранее. Например,наночастицы, используемые в настоящем изобретении, имеют ядро, сделанное из -Fe2O3 (магхемита) или Fe3O4 (магнетита) видимое на МРТ. Визуализируемый материал также может быть выбран из любого материала высокой электронной плотности, видимого под компьютерным томографом (КТ сканер), такого как HfO2 или Au. Для целей визуализации предпочтительным является добавление к наночастицам нацеливающей группы, как описано ранее. Другая задача изобретения относится к способу для определения или визуализации целевых клеток(позволяя в частности диагностировать заболевание, в частности рак), у пациента, предположительно страдающего от заболевания, включающий а) введение термочувствительных липосом пациенту, страдающему от заболевания, или композиции, такой как описано в настоящем описании, включающей такие термочувствительные липосомы, b) нагревание интересующей области до Tm или выше Tm с целью возможности локального высвобождения наночастиц и их последующего взаимодействия с клетками, в частности целевыми клетками, и с) последующее воздействие на пациента источника активации, как описано в настоящем описании, указанное воздействие позволяет обнаружение или визуализацию целевых клеток пациента. В определенном варианте осуществления изобретения термочувствительные липосомы, описанные в настоящем описании, способны нести нацеленные наночастицы (в частности, наночастицы, способные специфически распознавать опухолевые клетки) в кровотоке, избегая распознавания ретикулоэндотелиальной системой (RES). При наличии опухолевой массы наночастицы, высвобождаемые из термочувствительных липосом при Tm или выше Tm, входят в опухоль и взаимодействуют с целевыми раковыми клетками. Накопление наночастиц запускает сигнал возбуждения, видимый при МРТ для магнитных наночастиц, или увеличивается сигнал с KT томографа, если используют наночастицы высокой плотности. При отсутствии опухолевой массы наночастицы удаляются из циркуляции почками, и повышения сигнала или возбуждения не определяется или не визуализируется. Далее авторы в настоящем описании описывают применение термочувствительных липосом по настоящему изобретению, в частности термочувствительных липосом, включающих наночастицы, как описано в настоящем описании, или популяции идентичных или отличных наночастиц, как описано в настоящем описании, для получения диагностической композиции, предназначенной для получения белков из целевой области организма пациента, в частности опухоли и ее микроокружения, применимых для фенотипирования целевого участка. Другой предмет изобретения относится к способу для получения белков из целевой области (позволяющих в частности фенотипировать указанную целевую область), у субъекта или пациента, включающему а) введение термочувствительных липосом пациенту, страдающему от заболевания или композиции, такой как описанная в настоящем описании, включающей такие термочувствительные липосомы, b) нагревание термочувствительных липосом до Tm или выше Tm с целью возможности высвобождения наночастиц в целевой области и их последующего взаимодействия с указанной целевой областью, и с) последующий сбор наночастиц, покрытых белками указанной целевой области. Предшествующий метод может дополнительно включать стадию нагревания термочувствительных липосом при Tm или выше Tm с целью высвобождения наночастиц в кровоток и стадию сбора наночастиц, покрытых белками крови, с целью сравнения белков крови с белками из целевой области. Указанный подход имеет преимущество неинвазивной методики при сравнении с классическими биопсиями. Описанные в настоящем описании термочувствительные липосомы представляют собой диагностическое средство, применимое для персонализированной терапии, так как они могут обеспечить информацию, касающуюся стадии рака у определенного пациента, и могут помочь онкологу выбрать наиболее подходящее лечение для указанного пациента или отслеживать эффективность определенного лечения. Описанные в настоящем описании термочувствительные липосомы могут дополнительно обеспечить информацию для оценки ответа опухоли на определенную терапию и предсказать клинический исход для пациента (выживаемость без прогрессирования). Для такого специфического применения могут быть использованы любые наночастицы, как описано выше. Наночастицы предпочтительно получают из магнитного ядра, как определено ранее (например,Fe2O3 или Fe3O4). Для фенотипирования опухоли предпочтительным является применение наночастиц, включающих оболочку вместе со связывающей группой. Такая связывающая группа может преимущественно быть выбрана из сукцинимидилового эфира, малеимида и их любой смеси. Указанная группа создает ковалентную связь с амино и карбокси группами, обычно присутствующими на белках. В определенном варианте осуществления изобретения термочувствительные липосомы, описанные в настоящем описании, способны нести наночастицы, включающие оболочку вместе со связывающей группой, избегая распознавания ретикулоэндотелиальной системой(RES). Наночастицы, высвобождаемые из термочувствительных липосом при Tm или выше Tm, взаимодействуют с белками целевой области. Наночастицы, покрытые популяцией указанных белков, могут быть собраны в моче. Образец мочи может быть впоследствии обработан для концентрирования наночастиц перед анализом популяции белка с использованием например масс-спектрометрии после ферментативного переваривания белков и анализов пептидных фрагментов. Магнитные наночастицы могут иным образом быть собраны из целевой области с использованием,например, магнитного коллектора. Другим предметом изобретения является терапевтическая или диагностическая композиция, включающая термочувствительные липосомы, такие как определено в настоящем описании выше, и/или которые могут быть получены методами, описанными в настоящем описании, предпочтительно вместе с фармацевтически приемлемым вспомогательным веществом, носителем или основой. Диагностическая композиция может быть скомбинирована с фармацевтической композицией или сходна с фармацевтической композицией, особенно когда диагностику и лечение проводят одновременно. В последней ситуации одни и те же наночастицы обычно используют в качестве терапевтического и диагностического средства. Композиции могут быть в форме жидкости (частицы в суспензии), геля, пасты и подобного. Предпочтительные композиции находятся в форме инъекционной композиции, предпочтительно в жидкой форме. Вспомогательное вещество, основа или носитель, которые могут быть использованы, могут быть любой классической основой для такого типа применения, такой как, например, солевой раствор, изотонические, стерильные, буферные растворы и подобные. Композиции также могут включать стабилизаторы, подсластители, поверхностно-активные вещества и подобные. Композиции могут быть рецептированы, например, в виде ампул, бутылей, колб с использованием известных методик фармацевтического рецептирования. Концентрация наночастиц в композиции по изобретению легко регулируется специалистом в зависимости от, в частности, предназначенного применения, пациента, природы целевых клеток и выбранного пути введения. Фармацевтическая композиция может дополнительно включать дополнительное терапевтическое соединение (отличное от наночастицы или популяции наночастиц, как описано в настоящем описании),также предназначенное для лечения заболевания, например рака. Такое дополнительное терапевтическое соединение может быть инкапсулировано в липосомы вместе с наночастицами. Настоящее описание дополнительно обеспечивает наборы, включающие одно или более из вышеописанных термочувствительных липосом или композиций. Обычно набор включает по меньшей мере одни терапевтические липосомы или популяцию термочувствительных липосом по настоящему изобретению. Обычно набор также включает один или более контейнеров, заполненных одним или более ингредиентами фармацевтической или диагностической композиции по изобретению. В сочетании с таким контейнером(ами) может быть представлена аннотация, обеспечивающая инструкции для использования продуктов, для использования термочувствительных липосом, популяции термочувствительных липосом или композиции по настоящим методам. Другие аспекты и преимущества изобретения будут очевидны из следующих примеров, которые даны только для целей иллюстрации и не в качестве ограничения. Экспериментальный раздел Пример 1. Получение наночастиц размером 5 нм. Наночастицы оксида железа с распределением размеров, центрированным на 5 нм, синтезировали путем совместного осаждения ионов двухвалентного и трехвалентного железа, полученных по (US 4329241; Bacri et al., J. Magn. Magn. Mat, 1986;62:36-46). Коротко, реакционную среду с регулируемой ионной силой, состоящую из раствора нитрата натрия,выдерживали при pH 12. Получали 3 М раствор нитрата натрия ионов двухвалентного и трехвалентного железа в молярном соотношении Fe(III)/Fe(II) равном 2, и медленно добавляли к реакционной среде при перемешивании. Она быстро становилась черной. Затем весь раствор выдерживали в течение одной ночи при температуре окружающей среды при перемешивании. Ферритовые наночастицы затем осаждали на магните и надосадочную жидкость удаляли с целью устранения реакционной среды. Затем проводили пептизацию (подкисление) и окисление поверхности наночастиц путем разведения осадка в растворе азотной кислоты HNO3 2M при комнатной температуре при энергичном перемешивании. Окисление ядра наночастиц проводили путем инкубации осадка в растворе нитрата железа при повышенной температуре (90C) при энергичном перемешивании. Затем наночастицы промывали центрифугированием. Наконец, осадок разводили в подкисленной воде с целью достижения концентрации 150 г/л в оксиде железа. Раствор гомогенизировали обработкой ультразвуком и затем pH доводили до pH 2. Морфологию (размер и форму) наночастиц оценивали трансмиссионной электронной микроскопией (фиг. 2 А). Кристаллическую структуру наночастиц оксида железа подтверждали исследованием рентгеновской дифракции. Пример 2. Получение наночастиц оксида железа размером 30 нм. Наночастицы оксида железа с распределением размеров, центрированным на 30 нм, синтезировали путем осаждения ионов железа с последующим окислением осадка. Водную реакционную среду выдерживали при pH 8 при непрерывном барботировании азота. Получали раствор хлорида железа и раствор гидроксида натрия и одновременно добавляли к реакционной среде. Раствор становился зеленым и очень мутным ("молочным"). Стадию окисления проводили путем добавления раствора Н 2 О 2. Раствор становился черным, подтверждая образование ферритного материала. Подачу азота прекращали после полного добавления H2O2. Ферритовые наночастицы затем выдерживали в течение 2 ч при перемешивании. Ферритовые наночастицы осаждали на магните для удаления надосадочной жидкости. Пептизацию поверхности наночастиц перхлорной кислотой (HClO4) проводили путем разбавления осадка в раствореHClO4 1 М. Наконец, пептизированные наночастицы суспендировали в дистиллированной воде с целью получения магнитной жидкости при 180 г/л и pH 2. Размер и форму полученных таким образом наночастиц оксида железа наблюдали трансмиссионной электронной микроскопией (фиг. 2 В). Кристаллическую структуру наночастиц оксида железа подтверждали рентгеноструктурным анализом. Пример 3. Обработка поверхности наночастиц. 3.1. Функционализация наночастиц с помощью гексаметафосфата натрия (НМР). Суспензию гексаметафосфата натрия добавляли к суспензии наночастиц оксида железа из примера 1 (количество добавленного гексаметафосфата натрия составляет менее LD50/5) и pH суспензии доводили до pH составляющего между 6 и 8. Электронный заряд поверхности ( -20 мВ) определяли путем измерений дзета потенциала на Zetasizer NanoZS (Malvern Instruments) с использованием лазера 633 нм HeNe, проводимого на суспензиях наночастиц с концентрациями, варьирующимися между 0,2 и 2 г/л, наночастицы суспендировали в водной среде при pH, составляющем между 6 и 8. 3.2. Функционализация наночастиц с помощью диоксида кремния. Первое пропитывание диоксидом кремния проводили путем добавления силиката натрия в раствор частиц (780 мкл для 1 г частиц из примера 2 в 240 мл дистиллированной воды). Оставшийся силикат натрия отделяли от воды центрифугированием. 125 мг частиц диспергировали в растворе воды/этанола(1/4), содержащем 0,6 ммоль тетраортосиликата. Гидролиз и конденсацию предшественника диоксида кремния усиливали добавлением в партию раствора аммония. Раствор инкубировали в течение ночи перед промывкой частиц центрифугированием в дистиллированной воде. Покрытые оболочкой частицы выдерживали в воде (pH доводили до около 7,4). Электронный заряд поверхности ( -20 мВ) определяли по измерению дзета потенциала на ZetasizerNanoZS (Malvern Instruments) с использованием лазера 633 нм HeNe, проводимому на суспензиях наночастиц, с концентрациями, варьирующимися между 0,2 и 2 г/л, наночастицы суспендировали в водной среде при pH, составляющем между 6 и 8. 3.3. Функционализация наночастиц с помощью 2-[Метокси(полиэтиленокси)пропил]триметоксисилана; 90% 6-9 РЕ-единиц (РЕО-силан) РЕО-силан ковалентно закрепляли на поверхность наночастиц оксида железа (наночастицы из примера 1) путем гидролиза-конденсации, в условиях кислотной среды в качестве катализатора. Суспензию РЕО-силана добавляли к суспензии наночастиц оксида железа из примера 1. Обычно объем 246 мкл раствора РЕО-силана (92 мас.%) добавляли к 2 мл раствора наночастиц при 75 г/л по оксиду железа. pH раствора затем доводили до pH, составляющего между 6 и 8. Электронный заряд поверхности (+8 мВ) определяли измерением дзета потенциалов на ZetasizerNanoZS (Malvern Instruments), с использованием лазера 633 нм HeNe, проводимых на суспензиях наночастиц с концентрациями, варьирующимися между 0,2 и 2 г/л, наночастицы суспендированы в водной среде при pH, составляющей между 6 и 8. Пример 4. Получение липосом, содержащих наночастицы. 4.1. "Термочувствительные липосомы" (TSL), содержащие наночастицы, заряд которых ниже -20 мВ. Липосомы, содержащие наночастицы, получали с использованием метода регидратации липидной пленки (Bangham et al., J. Mol. Bio., 1965;13 :238-252; Martina et al., J. Am. Chem. Soc, 2005;127: 1067610685):a) Липиды растворяли в хлороформе. Наконец, хлороформ выпаривали в токе азота. Регидратацию липидной пленки проводили при 55C с 2 мл раствора оксида железа, описанного в примере 3.1, так что концентрация липида составила 50 мМ. Использовали следующие липидные композиции: дипальмитоилфосфатидилхолин (DPPC), гидрогенизированный соевый фосфатидилхолин (HSPC), холестерин (Chol) и пегилированный дистеарилфосфатидилэтаноламин (DSPE-PEG2000) в молярном соотношении 100:33:27:7 (DPPC:HSPC:Chol:DSPEPEG2000).b) Затем проводили циклы замораживания-оттаивания 20 раз, путем полного погружения образца в жидкий азот и в водяную баню, установленную на 55C.c) Экструзионный пресс с термобарабаном (LIPEX Extruder, Northern Lipids) использовали для калибровки размера липосом, содержащих наночастицы, при контролируемой температуре и давлении. Во всех случаях экструзию проводили при 55C, под давлением, варьирующимся от 2 до 20 бар.d) Отделение неинкапсулированных частиц проводили посредством хроматографии, вытеснительной по размерам, на фильтрационном геле Sephacryl S1000.e) Профиль элюции определяли путем количественной оценки магнитных наночастиц посредством УФ-видимой спектроскопии (спектрометр Cary 100 Varian) при помощи колориметрической реакции ионов железа/фенантролина, адаптированной из Che et al., Journal of Chromatography B, 1995; 669:45-51, иNigo et al., Talanta, 1981; 28:669-674. Собирали фракции, содержащие липосомы (фиг. 3, первый пик). Концентрация оксида железа в липосомах варьировалась от 1 до 2,5 г/л. Такая композиция имеет Tm 43C. 4.2. "He-термочувствительные липосомы" (NTSL), содержащие наночастицы, заряд которых составляет ниже -20 мВ. Ранее описанной методике следовали за исключением того, что на стадии а) использовали следующую липидную композицию: гидрогенизированный соевый фосфатидилхолин (HSPC), холестерин (Chol) и пегилированный дистеарилфосфатидилэтаноламин (DSPE-PEG2000) в молярном соотношении 100:65:7(HSPC:Chol:DSPE-PEG2000). В стадиях а), b) и с) регидратацию липидной пленки, циклы оттаивания и процесс экструзии проводили при 62C. 4.3. "Термочувствительные липосомы" (TSL), содержащие наночастицы, заряд которых составляет менее 15 мВ. Следовали ранее описанной методике примера 4.1 за исключением того, что использовали наночастицы из примера 3.3. Пример 5. Высвобождение наночастиц. С целью визуализации наночастиц, захваченных липосомами, 30 мкл растворов липосом, содержащих наночастицы, как получено в примере 4.1 и 4.2, нагревали на водной бане. Для анализа cryoTEM, впоследствии 5 мкл каждого раствора откладывали на медной пластине, покрытой пористым углеродом, избыток промокали фильтровальной бумагой и пластину погружали в баню жидкого этана, охлаждаемого жидким азотом. Образцы выдерживали и наблюдали при температуре приблизительно -170C. На фиг. 4 А и 4 В показаны сферические "нетермочувствительные" липосомы (NTSL) размером 230 нм, содержащие наночастицы оксида железа, до и после нагревания при 60C на водяной бане. На фиг. 4 С и 4D показаны сферические "термочувствительные" липосомы (TSL) размером 200 нм,содержащие наночастицы оксида железа, до и после нагревания на водяной бане при 43C (Tm). На фиг. 4 Е показаны сферические "термочувствительные" липосомы (TSL) размером 200 нм, содержащие наночастицы оксида железа, после нагревания на водяной бане при 48C (выше Tm). На фиг. 4F показаны термочувствительные липосомы, нагруженные наночастицами оксида железа(пример 4.3), выдержанные при комнатной температуре. На фиг. 4G дополнительно показаны термочувствительные липосомы, нагруженные наночастицами оксида железа (пример 4.3), выдержанные при 43C (Tm). Касательно "не-термочувствительных" липосом (NTSL) интактные липосомы размером 230 нм оценивали до и после нагревания (фиг. 4 А и 4 В). Касательно "термочувствительных" липосом (TSL) интактные липосомы размером 200 нм оценивали перед нагреванием на фиг. 4 С. Наоборот, после нагревания при Tr=43C на фиг. 4D и Tr=48C на фиг. 4 Е липосомы размером 200 нм приобретали модифицированную форму (фиг. 4 Е, белая стрелка) и бислой разрушался; некоторые фрагменты липидного бислоя также можно видеть. На некоторых рисунках показаны пузырьки, в которых больше не наблюдают интактных липидных мембран после нагревания и наночастицы оксида железа локализуются вокруг липидных пузырьков (фиг. 4D). Свободные наночастицы оксида железа часто наблюдают на сетке. Высвобождение наночастиц демонстрируют для температуры Tr=Tm=43C или для температуры выше Tm (48C). Взаимодействия между заряженными наночастицами и липидным бислоем(фиг. 4 Е, черная стрелка) могут объяснить такой неожиданный результат. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Система доставки наночастиц, содержащая термочувствительные липосомы, разрушающиеся при температуре перехода кристаллической фазы из геля в жидкость (Tm) или выше Tm, где липосомы содержат термочувствительную липидную мембрану, инкапсулирующую наночастицы, являющиеся применимыми в качестве терапевтического или диагностического средства, каждая наночастица содержит неорганическое ядро, наибольший размер которого составляет менее чем 100 нм, и полностью покрыта веществом, отвечающим за присутствие на поверхности наночастиц электростатического заряда с потенциалом ниже -20 мВ или выше +20 мВ. 2. Система по п.1, где термочувствительная липидная мембрана содержит, по меньшей мере, фосфатидилхолин. 3. Система по п.2, где термочувствительная липидная мембрана дополнительно содержит холестерин. 4. Система по любому из пп.1-3, где термочувствительная липидная мембрана содержит дипальмитоилфосфатидилхолин, гидрогенизированный соевый фосфатидилхолин, холестерин и дистеарилфосфатидилэтаноламин-метоксиполиэтиленгликоль. 5. Система по п.2, где термочувствительная липидная мембрана содержит дипальмитоилфосфатидилхолин, дистеарилфосфатидилэтаноламин-метоксиполиэтиленгликоль и/или монопальмитоилфосфатидилхолин или моностеарилфосфатидилхолин. 6. Система по любому из пп.1-5, где средство, ответственное за наличие электростатического заряда на поверхности наночастиц, представляет собой органическую молекулу, имеющую две группы, R и X, R выбирают из амина, фосфата и карбоксилата и X выбирают из карбоксилата, силана, фосфоновой, фосфорной группы, фосфата и тиола. 7. Система по п.6, где наночастицы дополнительно содержат связывающую группу, выбираемую из сукцинимидилового эфира и малеимидной группы. 8. Система по любому из пп.1-7, где наночастицы дополнительно содержат нацеливающую группу,выбираемую из пептида, олигопептида, полипептида, белка, нуклеиновой кислоты, гормона, витамина,фермента, лиганда опухолевого антигена, рецептора гормона, рецептора цитокина и рецептора фактора роста. 9. Система по любому из пп.1-8, где наибольший размер липосом составляет между 50 и 500 нм,предпочтительно между 50 и 250 нм. 10. Система по любому из пп.1-9, где Tm составляет между 39 и 45C. 11. Система по любому из пп.1-10, где, когда наночастицы используют в качестве терапевтического средства, наибольший размер ядра каждой наночастицы составляет между 5 и 100 нм, предпочтительно между 10 и 50 нм. 12. Система по любому из пп.1-11, где, когда наночастицы используют в качестве диагностического средства, наибольший размер ядра каждой наночастицы составляет между 2 и 10 нм. 13. Терапевтическая композиция, содержащая систему доставки наночастиц по любому из пп.1-12 и фармацевтически приемлемый носитель. 14. Диагностическая композиция, содержащая систему доставки наночастиц по любому из пп.1-12 и фармацевтически приемлемый носитель.
МПК / Метки
МПК: A61K 49/18, A61K 9/127, A61K 49/00, A61K 9/51, A61K 41/00
Метки: наночастиц, системы, применение, доставки, получение
Код ссылки
<a href="https://eas.patents.su/20-24930-sistemy-dostavki-nanochastic-ih-poluchenie-i-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Системы доставки наночастиц, их получение и применение</a>
Предыдущий патент: Обратный клапан
Следующий патент: Фотоэлемент
Случайный патент: Устройство и способ управления насосом для густой среды