Способ конъюгирования бактериальных полисахаридов с белками-носителями
Номер патента: 23059
Опубликовано: 29.04.2016
Авторы: Дювивье Пьер, Гавар Оливье Франсис Николя, Биман Ральф Леон
Формула / Реферат
1. Способ конъюгирования бактериального сахарида, включающий стадии:
a) взаимодействия бактериального сахарида с 0,001-0,7 молярными эквивалентами периодата с образованием активированного бактериального сахарида;
b) взаимодействия активированного бактериального сахарида и белка-носителя с восстановителем с образованием конъюгата;
или
а) взаимодействия бактериального сахарида с 0,001-0,7 молярными эквивалентами периодата с образованием активированного бактериального сахарида;
b') взаимодействия активированного бактериального сахарида с линкером при использовании восстановителя с образованием соединения бактериальный сахарид-линкер;
c) взаимодействия соединения бактериальный сахарид-линкер с белком-носителем с образованием конъюгата;
где стадия а) протекает в буфере, который не содержит аминогруппу и имеет концентрацию 1-100 мМ, и где бактериальный сахарид представляет собой капсульный сахарид S.pneumoniae 6B.
2. Способ по п.1, где рН на стадии а) составляет 3,5-8,0, 5,0-7,0 или 5,5-6,5 или приблизительно 6,0.
3. Способ конъюгирования бактериального сахарида, включающий стадии:
a) взаимодействия бактериального сахарида с 0,001-0,7 молярными эквивалентами периодата с образованием активированного бактериального сахарида;
b) взаимодействия активированного бактериального сахарида и белка-носителя с восстановителем с образованием конъюгата;
или
а) взаимодействия бактериального сахарида с 0,001-0,7 молярными эквивалентами периодата с образованием активированного бактериального сахарида;
b') взаимодействия активированного бактериального сахарида с линкером при использовании восстановителя с образованием соединения бактериальный сахарид-линкер;
с) взаимодействия соединения бактериальный сахарид-линкер с белком-носителем с образованием конъюгата;
где стадия а) протекает в буфере, который не содержит аминогруппу и имеет концентрацию 1-100 мМ при рН 5,5-6,5, и где бактериальный сахарид представляет собой капсульный сахарид S.pneumoniae 23F или 6В.
4. Способ по п.1 или 3, где буфер выбран из группы, состоящей из фосфатного буфера, малеатного буфера, ацетатного буфера, карбонатного буфера и цитратного буфера, возможно где буфер имеет концентрацию 1-50, 1-25, 1-10, 5-15, 8-12 или 10-50 мМ или приблизительно 10 мМ.
5. Способ по любому из пп.1-4, где средняя молекулярная масса бактериального сахарида составляет 1-1100, 100-470, 200-300, 600-1100 или 800-1000 кДа после стадии а).
6. Способ по любому из пп.1-5, где средняя молекулярная масса сахарида 23F составляет 100-470 или 200-300 кДа после стадии а).
7. Способ по любому из пп.1-6, где белок-носитель выбран из группы, состоящей из столбнячного анатоксина, фрагмента С столбнячного анатоксина, дифтерийного анатоксина, CRM197, пневмолизина, белка D, PhtD, PhtDE и N19.
8. Способ по любому из пп.1-7, где восстановитель включает цианборгидрид натрия или триацетоксиборгидрид натрия.
9. Способ по любому из пп.1-8, включающий дополнительную стадию е) очистки конъюгата.
10. Способ по любому из пп.1-9, включающий дополнительную стадию смешивания конъюгата с дополнительными антигенами, возможно где дополнительные антигены включают по меньшей мере 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 сахаридов S.pneumoniae, выбранных из группы, состоящей из 1, 2, 3, 4, 5, 6А, 6В, 7F, 8, 9N, 9V, 10А, 11A, 12F, 14, 15В, 17F, 18С, 19А, 19F, 20, 22F, 23F и 33F.
11. Способ по п.10, где дополнительные антигены включают один или более чем один белок S.pneumoniae, выбранный из группы, состоящей из полигистидинового триадного семейства (PhtX), семейства холинсвязывающих белков (CbpX), укороченных CbpX, LytX-семейства, укороченных LytX, химерных белков (или слитых конструкций) укороченных CbpX-укороченных LytX, пневмолизина (Ply), PspA, PsaA, Sp128, Sp101, Sp130, Sp125 и Sp133.
12. Способ по любому из пп.1-11, где конъюгат смешивают с адъювантом или фармацевтически приемлемым эксципиентом.
13. Конъюгат, получаемый способом по любому из пп.1-12.
14. Иммуногенная композиция, содержащая конъюгат по п.13 и фармацевтически приемлемый эксципиент, где фармацевтический эксципиент при необходимости включает малеатный буфер.
15. Применение иммуногенной композиции по п.14 в предупреждении или лечении бактериального заболевания.
16. Способ предупреждения или лечения бактериальной инфекции, включающий введение иммуногенной композиции по п.14 пациенту.
Текст
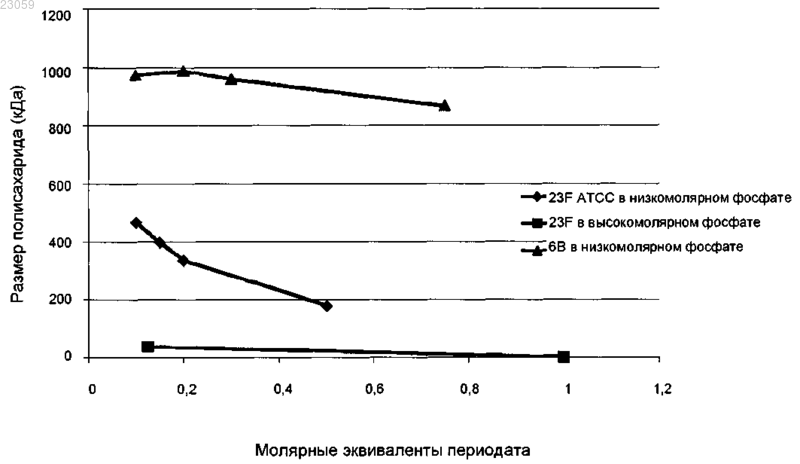
СПОСОБ КОНЪЮГИРОВАНИЯ БАКТЕРИАЛЬНЫХ ПОЛИСАХАРИДОВ С БЕЛКАМИ-НОСИТЕЛЯМИ В изобретении предложен способ конъюгирования бактериальных сахаридов, включая сахариды Streptococcus pneumoniae и Haemophilus influenzae, посредством восстановительного аминирования. Биман Ральф Леон, Дювивье Пьер,Гавар Оливье Франсис Николя (BE) Поликарпов А.В. (RU) Настоящее изобретение относится к способу конъюгирования. В частности, оно относится к конъюгированию сахаридов и белков посредством восстановительного аминирования. Предшествующий уровень техники Бактериальные капсульные полисахариды широко применялись в иммунологии в течение многих лет для предупреждения бактериального заболевания. Проблемой такого применения однако является Тнезависимая природа иммунного ответа. Эти антигены являются соответственно слабо иммуногенными у детей младшего возраста. Эта проблема была решена путем конъюгирования полисахаридных антигенов с белком-носителем (источник эпитопов Т-хелперов), который можно затем использовать, чтобы вызвать Т-зависимый иммунный ответ, даже на первом году жизни. Известны различные методы конъюгирования в данной области техники. Конъюгаты могут быть получены способами прямого восстановительного аминирования, которые описаны в US 200710184072(Hausdorff), US 4365170 (Jennings) и US 4673574 (Anderson). Другие способы описаны в ЕР 0161188, ЕР 208375 и ЕР 0477508. Способ конъюгирования альтернативно может быть основан на активации гидроксильных групп сахарида тетрафторборатом 1-циано-4-диметиламинопиридиния (CDAP) с образованием цианатного эфира. Такие конъюгаты описаны в опубликованной РСТ заявке WO 93/15760 UniformedServices University и WO 95/08348 и WO 96/29094 (см. также Chu С. et al. Infect. Immunity, 1983, 245-256). Восстановительное аминирование включает две стадии: (1) окисление антигена, (2) восстановление антигена и белка-носителя с образованием конъюгата. Стадия окисления может включать взаимодействие с периодатом, однако окисление периодатом может привести к уменьшению размера (WO 94/05325). Краткое изложение сущности изобретения Авторы изобретения неожиданно обнаружили, что применение более низких концентраций периодата в присутствии низшего фосфата может приводить к сохранению размера и/или сохранению эпитопов. В первом аспекте изобретения предложен способ конъюгирования бактериального сахарида (сахаридов), включающий стадии:a) взаимодействия бактериального сахарида с 0,001-0,7; 0,005-0,5; 0,01-0,5; 0,1-1,2; 0,1-0,5; 0,1-0,2; 0,5-0,8; 0,1-0,8; 0,3-1,0 или 0,4-0,9 молярными эквивалентами периодата с образованием активированного бактериального сахарида;b) смешивания активированного бактериального сахарида с белком-носителем;c) взаимодействия активированного бактериального сахарида и белка-носителя с восстановителем с образованием конъюгата; илиa) взаимодействия бактериального сахарида с 0,001-0,7; 0,005-0,5; 0,01-0,5; 0,1-1,2; 0,1-0,5; 0,1-0,2; 0,5-0,8; 0,1-0,8; 0,3-1,0 или 0,4-0,9 молярными эквивалентами периодата с образованием активированного бактериального сахарида;b) смешивания активированного бактериального сахарида с линкером; с') взаимодействия активированного бактериального сахарида с линкером при использовании восстановителя с образованием соединения бактериальный сахарид-линкер;d) взаимодействия соединения бактериальный сахарид-линкер с белком-носителем с образованием конъюгата; где стадия а) протекает в буфере, который не содержит аминогруппу и имеет концентрацию 1-100 мМ. Во втором аспекте изобретения предложен конъюгат, полученный способом по изобретению. В третьем аспекте изобретения предложен конъюгат, полученный способом по изобретению. В четвертом аспекте изобретения предложена иммуногенная композиция, содержащая конъюгат по изобретению и фармацевтически приемлемый эксципиент. В пятом аспекте изобретения предложена вакцина, содержащая иммуногенную композицию по изобретению. В шестом аспекте изобретения предложено применение иммуногенной композиции по изобретению или вакцины по изобретению в предупреждении или лечении бактериального заболевания. В седьмом аспекте изобретения предложено применение иммуногенной композиции по изобретению или вакцины по изобретению в изготовлении лекарственного средства для предупреждения или лечения бактериального заболевания. В восьмом аспекте изобретения предложен способ предупреждения или лечения бактериальной инфекции, включающий введение иммуногенной композиции по изобретению или вакцины по изобретению пациенту. В девятом аспекте изобретения предложен активированный бактериальный сахарид, содержащий повторяющуюся структурную единицу формулы (I) где активированный бактериальный сахарид содержит n повторяющихся структурных единиц и n составляет от 2 до 2400, от 500 до 2000, от 750 до 1500, от 1000 до 2000 или от 1500 до 2300; где по меньшей мере 0,001; 0,01; 0,1; 0,5; 1; 2; 5; 10 или 30%, но менее чем 0,001; 0,01; 0,1; 0,5; 1; 2; 5; 10; 30 или 50% Описание графических материалов Фиг. 1. Размер полисахаридов 23F и 6 В после обработки периодатом. Линия, помеченная треугольниками, показывает размер 6 В в 10 мМ фосфатном буфере, линия, помеченная ромбами, показывает размер 23F в 10 мМ фосфатном буфере, и линия, помеченная квадратами, показывает размер 23F в 100 мМ фосфатном буфере. Фиг. 2. Сравнение иммуногенности конъюгатов 23F, полученных посредством конъюгирования либо с помощью CDAP, либо путем восстановительного аминирования. На графике а) изображены результаты ELISA (твердофазный иммуноферментный анализ). На графике b) изображены результаты анализа опсонофагоцитирующей активности. Фиг. 3. Оценка иммуногенности PS06B-CRM, конъюгированного с использованием способов конъюгирования, описанных в примере 4, на модели с мышами линии Balb/c. Фиг. 4. Оценка иммуногенности PS06B-CRM, конъюгированного с использованием способов конъюгирования, описанных в примере 4, на модели с морскими свинками. Подробное описание изобретения Изобретение относится к улучшенному способу конъюгирования антигена с белком-носителем. В частности, согласно изобретению предложен способ конъюгирования бактериального сахарида (сахаридов), включающий стадии:a) взаимодействия бактериального сахарида с 0,001-0,7; 0,005-0,5; 0,01-0,5; 0,1-1,2; 0,1-0,5; 0,1-0,2; 0,5-0,8; 0,1-0,8; 0,3-1,0 или 0,4-0,9 молярными эквивалентами периодата с образованием активированного бактериального сахарида;b) смешивания активированного бактериального сахарида с белком-носителем;c) взаимодействия активированного бактериального сахарида и белка-носителя с восстановителем с образованием конъюгата; илиa) взаимодействия бактериального сахарида с 0,001-0,7; 0,005-0,5; 0,01-0,5; 0,1-1,2; 0,1-0,5; 0,1-0,2; 0,5-0,8; 0,1-0,8; 0,3-1,0 или 0,4-0,9 молярными эквивалентами периодата с образованием активированного бактериального сахарида;b) смешивания активированного бактериального сахарида с линкером; с') взаимодействия активированного бактериального сахарида с линкером при использовании восстановителя с образованием соединения бактериальный сахарид-линкер;d) взаимодействия соединения бактериальный сахарид-линкер с белком-носителем с образованием конъюгата; где стадия а) протекает в буфере, который не содержит аминогруппу и имеет концентрацию 1-100 мМ. Термин "периодат" включает как периодат, так и йодную кислоту. Этот термин также включает как метапериодат (IO4-), так и ортопериодат (IO65-), однако в одном конкретном воплощении периодат, используемый в способе по изобретению, представляет собой метапериодат. Термин "периодат" также включает различные соли периодата, включая периодат натрия и периодат калия. В одном воплощении используемый периодат представляет собой метапериодат натрия. Когда антиген взаимодействует с периодатом, периодат окисляет вицинальные гидроксильные группы с образованием карбонильных или альдегидных групп и вызывает расщепление С-С связи. По этой причине термин "взаимодействие антигена с периодатом" включает окисление периодатом вицинальных гидроксильных групп. Для целей изобретения "активированный бактериальный сахарид" представляет собой бактериальный сахарид, который был активирован посредством стадии а) способа по изобретению. Для целей изобретения термин "конъюгат" обозначает бактериальный сахарид, ковалентно связанный с белком-носителем. В одном воплощении бактериальный сахарид связан непосредственно с белком-носителем. Во втором воплощении бактериальный сахарид связан с белком посредством спейсера/линкера. Буфер, используемый на стадии а), представляет собой буфер, не содержащий аминогруппу. В одном воплощении буфер выбран из перечня, состоящего из фосфатного буфера, боратного буфера, ацетатного буфера, карбонатного буфера, малеатного буфера и цитратного буфера. Во втором воплощении буфер представляет собой неорганический буфер. Термин "неорганический буфер" включает любой буферный раствор, где буферная емкость обусловлена присутствием соединения, которое не содержит углерод. Неорганические буферы по изобретению включают фосфатный буфер и боратный буфер. В одном воплощении буфер представляет собой фосфатный буфер. В одном воплощении буфер имеет концентрацию 1-100, 5-80, 1-50, 1-25, 10-40, 1-10, 5-15, 8-12, 1020, 5-20, 10-50, приблизительно 10 или приблизительно 20 мМ. В дополнительном воплощении рН на стадии а) составляет 2,5-8,0, 5,0-7,0, 5,5-6,5, 5,8-6,3 или приблизительно 6,0. Термин "сахарид" в этом описании может обозначать полисахарид, тейхоевую кислоту или олигосахарид и включает все три наименования. Он может обозначать липополисахарид (ЛПС) или липоолигосахарид (ЛОС). Перед использованием полисахариды могут быть выделены из какого-либо исходного штамма или выделены из конкретного исходного штамма и подвергнуты изменению размера до некоторой степени известными способами (см., например, ЕР 497524 и ЕР 497525; Shousun Chen Szu et al.- Carbohydrate Research, vol. 152, p. 7-20 (1986, например посредством микрофлюидизации. Олигосахариды имеют небольшое число повторяющихся структурных единиц (типично 5-30 повторяющихся структурных единиц) и типично являются гидролизованными полисахаридами. В одном воплощении бактериальный сахарид представляет собой бактериальный капсульный сахарид. В одном воплощении настоящего изобретения бактериальный сахарид имеет происхождение из стрептококка группы В, Vibrio cholerae, Streptococcus pneumoniae (S.pneumoniae), Haemophilus influenzae(H.influenzae), Neisseria meningitidis (N.meningitidis), Staphylococcus aureus (S.aureus), энтерококков, Salmonella Vi или Staphylococcus epidermidis (S.epidermidis). В дополнительном воплощении бактериальный сахарид имеет происхождение из S.pneumoniae, H.influenzae, N.meningitidis, S.aureus, энтерококков, Salmonella Vi или S.epidermidis. В еще одном дополнительном воплощении бактериальный сахарид представляет собой бактериальный капсульный сахарид, выбранный из перечня, состоящего из: серогруппы А (MenA), В (MenB), С (MenC), W135 (MenW) или Y (MenY) N. meningitidis, группы Ia, Ib, II, III, IV, V,VI или VII стрептококка группы В, Staphylococcus aureus типа 5, Staphylococcus aureus типа 8, Salmonellatyphi (Vi сахарид), Vibrio cholerae или Н. influenzae тип b. В одном воплощении бактериальный сахарид представляет собой капсульный сахарид из серотипов 1, 2, 3, 4, 5, 6 А, 6 В, 7F, 8, 9N, 9V, 10 А, 11 А, 12F,14, 15 В, 17F, 18 С, 19 А, 19F, 20, 22F, 23F или 33F Streptococcus pneumoniae. В дополнительном воплощении бактериальный сахарид представляет собой капсульный сахарид S.pneumoniae, выбранный из группы, состоящей из 5, 6 В, 6 А, 7F, 9V, 14 или 23F. Возможно, бактериальный сахарид по изобретению представляет собой капсульный сахарид S.pneumoniae 23F, 6 В или 6 А. В одном воплощении бактериальный сахарид представляет собой капсульный сахарид S.pneumoniae 23F. В одном воплощении бактериальный сахарид представляет собой капсульный сахарид S.pneumoniae 6B. В одном воплощении бактериальный сахарид представляет собой капсульный сахарид S.pneumoniae 6A. В еще одном дополнительном воплощении бактериальный сахарид представляет собой полисахарид или олигосахарид Haemophilus influen-3 023059zae b (Hib). В одном воплощении бактериальный сахарид содержит вицинальные антидиолы. Бактериальный сахарид может быть либо природным полисахаридом, либо может быть уменьшен в размере не более чем в 2, 4, 6, 8, 10 или 20 раз (например, посредством микрофлюидизации [например, с помощью аппарата Emulsiflex C-50] или другого известного способа [например, теплового, химического,окислительного, ультразвукового способов]). В одном воплощении бактериальный сахарид микрофлюидизируют перед стадией а). Олигосахариды могут быть уменьшены значительно позже (например, посредством известных тепловых, химических или окислительных способов). Для целей изобретения "природный полисахарид" относится к бактериальному сахариду, который не был подвергнут процессу, целью которого является уменьшение размера сахарида. Полисахарид может быть слегка уменьшен в размере во время обычных процедур очистки. Такой сахарид еще считается природным. Только если полисахарид подвергали способам, которые уменьшают размер сахарида, полисахарид не считают природным. Среднемассовая молекулярная масса бактериального сахарида, подходящего для конъюгирования способом по изобретению, может составлять от 20 до 2000, от 30 до 1000, от 40 до 500, от 50 до 400, от 75 до 300 или от 1000 до 2000 кДа. В случае природного капсульного сахарида 23F из S.pneumoniae средняя молекулярная масса природного полисахарида составляет 750-1500 или 1200-1300 кДа. В случае природного сахарида Hib средняя молекулярная масса природного полисахарида составляет от 100 до 250 кДа. Молекулярная масса или средняя молекулярная масса сахарида относится здесь к среднемассовой молекулярной массе (Mw) бактериального сахарида, измеренной перед конъюгированием посредством MALLS (детектор по рассеянию света лазера под многими углами). Методика MALLS хорошо известна в данной области техники. Для MALLS-анализа сахаридов могут быть применены в комбинации две колонки (TSKG6000 и 5000PWxl), и сахариды элюируют в воде. Сахариды детектируют, применяя детектор рассеяния света (например, Wyatt Dawn DSP, оборудованный 10 мВт аргоновым лазером при 488 нм) и инферометрический рефрактометр (например, Wyatt Otilab DSP, оборудованный ячейкой Р 100 и красным фильтром на 498 нм). MALLS-анализы могут быть проведены при использованииTSKGMPwxl и 50 мМ Na/KPO4, 200 мМ NaCl с рН 7,0 в качестве элюирующего буфера со скоростью элюирования 0,75 мл/мин при использовании детектора RI/DAWN-EOS. В одном воплощении полидисперсность сахарида составляет 1-1,5; 1-1,3; 1-1,2; 1-1,1 или 1-1,05, а после конъюгирования с белкомносителем полидисперсность конъюгата составляет 1,0-2,5; 1,0-2,0; 1,0-1,5; 1,0-1,2; 1,5-2,5; 1,7-2,2 или 1,5-2,0. Все измерения полидисперсности проводят посредством MALLS. Обработка периодатом может приводить к уменьшению размера бактериального сахарида (эффект изменения размера). В одном воплощении способ по изобретению уменьшает этот эффект изменения размера. Это наблюдается для бактериального сахарида 23F из Streptococcus pneumoniae (как в примере 1). По этой причине в одном воплощении средняя молекулярная масса бактериального сахарида по изобретению составляет 1-1100, 100-470, 200-300, 600-1100 или 800-1000 кДа после стадии а) (измеренная посредством MALLS, как описано выше). В одном воплощении средняя молекулярная масса сахарида 23F составляет 100-470 или 200-300 кДа после стадии а). В одном воплощении средняя молекулярная масса бактериального сахарида Hib составляет от 1 до 50 или от 5 до 10 кДа после стадии а). Термин "белок-носитель" включает в себя как небольшие пептиды, так и большие полипептиды(более 10 кДа). Белок-носитель может представлять собой любой пептид или белок. Он может содержать один или несколько Т-хелперных эпитопов. Белок-носитель может представлять собой столбнячный анатоксин (ТТ), фрагмент С столбнячного анатоксина, нетоксичные мутанты столбнячного токсина (примечание: для целей этого изобретения считают, что все такие варианты ТТ представляют собой один и тот же тип белка-носителя), полипептиды, содержащие Т-клеточные эпитопы столбнячного анатоксина, такие как N19 (WO 2006/067632), дифтерийный анатоксин (DT), CRM197, другие нетоксичные мутанты дифтерийного токсина [такие как CRM176, CRM197, CRM228, CRM45 (Uchida et al. J. Biol. Chem. 218; 3838-3844, 1973); CRM9, CRM45, CRM102, CRM103 и CRM107 и другие мутации, описанные Nicholls иYoule в Genetically Engineered Toxins, Ed: Frankel, Maecel Dekker Inc., 1992; делеция или мутация Glu-148 на Asp, Gln или Ser и/или Ala 158 на Gly, и другие мутации, раскрытые в US 4709017 или 4950740; мутация по меньшей мере одного или нескольких остатков Lys 516, Lys 526, Phe 530 и/или Lys 534 и другие мутации, раскрытые в US 5917017 или 6455673; или фрагмент, раскрытый в US 5843711] (примечание: для целей этого изобретения считают, что все такие варианты DT представляют собой один и тот же тип белка-носителя), пневмококковый пневмолизин (Kuo et al. (1995) Infect Immun, 63; 2706-13), ОМРС (менингококковый белок наружной мембраны, обычно получаемый из N. meningitidis серогруппы ВЕР 0372501), синтетические пептиды (ЕР 0378881, ЕР 0427347), белки теплового шока (WO 93/17712, WO 94/03208), коклюшные белки (WO 98/58668, ЕР 0471177), цитокины, лимфокины, факторы роста или гормоны (WO 91/01146), искусственные белки, содержащие множественные человеческие CD4+ Тклеточные эпитопы из антигенов, имеющих происхождение от различных патогенов (Falugi et al. (2001)Eur J Immunol, 31; 3816-3824), такие как белок N19 (Baraldoi et al. (2004) Infect Immun, 72; 4884-7), пневмококковый поверхностный белок PspA (WO 02/091998), белки поглощения железа (WO 01/72337), токсин А или В C.difficile (WO 00/61761), белок D H.influenzae (EP 594610 и WO 00/56360), пневмококковый называемый Sp036D), пневмококковый PhtB (раскрытый в WO 00/37105 и также называемый Sp036B) или PhtE (раскрытый в WO 00/30299 и также называемый BVH-3). В одном воплощении согласно изобретению белок-носитель выбран из группы, состоящей из: столбнячного анатоксина (ТТ), фрагмента С столбнячного анатоксина, дифтерийного анатоксина (DT),CRM197, пневмолизина (Ply), белка D, PhtD, PhtDE и N19. В дополнительном воплощении белокноситель представляет собой CRM197. В еще одном дополнительном воплощении белок-носитель представляет собой столбнячный анатоксин (ТТ). В одном воплощении стадию а) проводят в темноте. Когда антиген взаимодействует с периодатом, периодат окисляет вицинальные гидроксильные группы с образованием карбонильных или альдегидных групп и вызывает расщепление С-С связи. Стадия окисления (стадия а может протекать, как описано ниже: Использование низких концентраций буфера, в частности фосфатного буфера, и небольших количеств периодата может уменьшать эффект изменения размера, описанный выше. Капсульные сахариды Streptococcus pneumoniae содержат вицинальные гидроксильные группы, которые могут быть окислены периодатом, как можно увидеть из структур повторяющихся участков, показанных ниже: PS1 В одном воплощении менее чем 0,001; 0,01; 0,1; 0,5; 1; 2; 5; 10; 30 или 50% вицинальных диолов бактериального сахарида окисляется во время стадии а). В одном воплощении карбонильная группа, образованная на стадии а), взаимодействует с аминогруппой белка-носителя на стадии с). Это может протекать согласно следующей схеме реакции: В одном воплощении бактериальный сахарид присутствует в концентрации от 0,2 до 14, от 8 до 12,от 10 до 12, от 1 до 4, от 0,2 до 1, или от 0,4 до 0,6, или приблизительно 11, или приблизительно 0,5 г/л на стадии а). В одном воплощении начальная концентрация белка-носителя на стадии b) составляет от 0,5 до 35, от 25 до 35, от 0,5 до 5, или от 0,8 до 2, или приблизительно 32, или 1 г/л. В дополнительном воплощении начальная концентрация активированного бактериального сахарида на стадии b) составляет от 0,2 до 20, от 10 до 28, или от 0,2 до 4, или от 1 до 2 , или приблизительно 15, или 1,6 г/л. В дополнительном воплощении начальное соотношение активированного бактериального сахарида и белка-носителя на стадии b) составляет от 2,0:1 до 0,1:1; от 1,8:1 до 0,4:1; от 1,4:1 до 1,6:1, от 1:1 до 1,4:1; от 1,8:1 до 1,6:1; от 0,8:1 до 0,4:1; от 0,7:1 до 0,5:1 или от 0,7:1 до 0,6:1 мас./мас. В дополнительном воплощении конечное соотношение белка-носителя и бактериального сахарида после стадии с) или с') составляет от 0,5:1 до 4:1; от 0,8:1 до 3,2:1; от 0,5:1 до 1,8:1; от 1,4:1 до 1,8:1; от 1:1 до 1,2:1 или от 2,5:1 до 3,5:1. В одном воплощении температура реакции на стадии а) составляет 4-40, 10-32, 17-30 или 22-27 С. Типично эту температуру поддерживают на всем протяжении стадии а). Температура реакции во время стадии с) составляет 4-40, 10-32, 17-30 или 22-27 С. Типично эту температуру поддерживают на всем протяжении стадии с). В одном воплощении стадия а) способа по изобретению протекает менее чем за 30, от 5 до 25, от 15 до 25 ч, от 30 мин до 25 ч, от 1 до 35, от 10 до 20 или от 15 до 20 ч, приблизительно 18 или приблизительно 1 ч. В одном воплощении стадия с) способа по изобретению протекает за 10-60, 10-20, 20-60, 3050 или 35-45 ч. Конъюгирование может также быть осуществлено посредством добавления гетеро- или гомобифункционального линкера при использовании химических процессов по изобретению. Один конец линкера будет взаимодействовать с активированным антигеном посредством восстановительного аминирования, тогда как другой конец линкера может взаимодействовать с белком-носителем при использовании любого типа химических процессов. По этой причине линкер будет содержать по меньшей мере одну активную аминогруппу; если линкер является гомобифункциональным, то он будет содержать две активные аминогруппы; если линкер является гетеробифункциональным, то он будет содержать одну активную аминогруппу и другую активную группу, в одном воплощении эта вторая активная группа представляет собой активную карбонильную группу. В одном воплощении линкер составляет от 1 до 20 ангстрем в длину. В дополнительном воплощении линкер имеет от 4 до 20, от 4 до 12 или от 5 до 10 атомов углерода. Возможный линкер представляет собой дигидразид адипиновой кислоты (ADH). Другие линкеры включают В-пропионамидо (WO 00/10599), нитрофенилэтиламин (Gever et al. (1979) Med.Microbiol. Immunol. 165; 171-288), галогеналкилгалогениды (US 4057685), гликозидные связи (US 4673574, US 4808700), гександиамин и 6-аминокапроновую кислоту (US 4459286). В основном могут быть использованы следующие типы химических групп белка-носителя для сочетания/конъюгирования в качестве второй активной группы:A) Карбоксильная (например, через аспарагиновую или глутаминовую кислоту). В одном воплощении эту группу связывают с аминогруппой линкера с помощью химических процессов с карбодиимидами, например, с помощью EDAC (1 -этил-3-(3-диметиламинопропил)карбодиимид). Примечание: вместо вышеупомянутого EDAC может быть использован любой подходящий карбодиимид.B) Аминогруппа (например, через лизин). В одном воплощении эту группу связывают с карбоксильной группой линкера с помощью химических процессов с карбодиимидами, например, с помощьюEDAC. В другом воплощении эту группу связывают с гидроксильными группами, активированнымиCDAP или CNBr на линкере; с линкерами, имеющими альдегидную группу; с линкерами, имеющими сукцинимидную эфирную группу.C) Сульфгидрильная (например, через цистеин). В одном воплощении эту группу связывают с бром- или хлорацетилированным линкером с помощью химических процессов с малеимидами. В одном воплощении эту группу активируют/модифицируют бис-диазобензидином.D) Белок может быть модифицирован так, чтобы содержать алкинильную или азидную группу, которая может быть конъюгирована с линкером посредством "клик"-химии (описана в Tetrahedron letters(June 2005) 46:4479-4482). Примечание: вместо вышеупомянутого EDAC может быть использован любой подходящий карбодиимид. Восстановители, которые подходят для применения в способе по изобретению, включают цианборгидриды, такие как цианборгидрид натрия, боранпиридиновый комплекс или боргидридную ионообменную смолу. В одном воплощении восстановитель представляет собой цианборгидрид натрия. В одном воплощении используют от 0,5 до 2, от 0,6 до 1,5 или от 0,8 до 1,2 или приблизительно 1,0 молярный эквивалент цианборгидрида натрия на стадии с). В дополнительном воплощении восстановитель включает триацетоксиборгидрид натрия, в дополнительном воплощении используют от 2 до 10 или от 3 до 9 молярных эквивалентов или приблизительно 2,5 молярного эквивалента триацетоксиборгидрида натрия на стадии с). Перед стадией с) активированный бактериальный сахарид и белок-носитель могут быть лиофили-7 023059 зированы. В одном воплощении активированный бактериальный сахарид и белок-носитель лиофилизируют вместе. Это может происходить перед стадией b) или после стадии b). В одном воплощении лиофилизация протекает в присутствии невосстанавливающего сахара, возможные невосстанавливающие сахара включают сахарозу, трегалозу, рафинозу, стахиозу, мелезитозу, декстран, маннит, лактит и палатинит. В дополнительном воплощении невосстанавливающий сахар выбран из группы, состоящей из сахарозы,трегалозы или маннита. В одном воплощении стадии b) и/или с) проводят в растворителе ДМСО (диметилсульфоксид). В дополнительном воплощении стадии b) и/или с) проводят в растворителе ДМФА (диметилформамид). Растворитель ДМСО или ДМФА может быть использован для повторного растворения активированного бактериального сахарида и белка-носителя, которые были лиофилизированы. В конце стадии с) могут присутствовать непрореагировавшие карбонильные группы, оставшиеся в конъюгатах, они могут быть блокированы с помощью подходящего блокирующего агента. В одном воплощении этот блокирующий агент представляет собой боргидрид натрия (NaBH4), например, продукт стадии с) может быть подвергнут взаимодействию с боргидридом натрия в течение 15 мин-15 ч, 15 -45 мин, 2-10 или 3-5 ч, приблизительно 30 мин или приблизительно 4 ч. В дополнительном воплощении блокировки достигают посредством смешивания продукта стадии с) с приблизительно 2 молярными эквивалентами или 1,5-10 молярными эквивалентами NaBH4. Согласно изобретению также предложена дополнительная стадия е) очистки конъюгата, которая может включать диафильтрацию, например диафильтрацию с отсечением 100 кДа. В дополнение или альтернативно стадия е) может включать ионообменную хроматографию. В дополнительном воплощении стадия е) может включать вытеснительную хроматографию. В одном воплощении способ по пп.1-51 включает дополнительную стадию f), где конъюгат стерильно фильтруют. Конъюгат можно также смешивать с дополнительными антигенами. В одном воплощении дополнительные антигены включают по меньшей мере 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 сахаридов S.pneumoniae, выбранных из группы, состоящей из 1, 2, 3, 4, 5, 6 А, 6 В, 7F, 8, 9N, 9V, 10 А, 11 А, 12F,14, 15 В, 17F, 18 С, 19 А, 19F, 20, 22F, 23F и 33F. В одном воплощении дополнительные антигены включают сахариды S.pneumoniae 4, 6 В, 9V, 14, 18 С, 19F и 23F. В одном воплощении дополнительные антигены включают сахариды S.pneumoniae 4, 6 В, 9V, 14, 18 С и 19F. В одном воплощении дополнительные антигены включают сахариды S.pneumoniae 4, 9V, 14, 18 С, 19F и 23F. В одном воплощении дополнительные антигены включают сахариды S.pneumoniae 1, 4, 5, 6 В, 7F, 9V, 14, 18 С, 19F и 23F. В одном воплощении дополнительные антигены включают сахариды S.pneumoniae 1, 4, 5, 6 В, 7F, 9V, 14, 18 С и 19F. В одном воплощении дополнительные антигены включают сахариды S.pneumoniae 1, 4, 5, 7F, 9V, 14, 18 С, 19F и 23F. В одном воплощении дополнительные антигены включают сахариды S.pneumoniae 1, 3, 4, 5, 6 А, 6 В,7F, 9V, 14, 18 С, 19 А, 19F и 23F. В одном воплощении дополнительные антигены включают сахаридыS.pneumoniae 1, 3, 4, 5, 6 А, 6 В, 7F, 9V, 14, 18 С, 19 А и 19F. В одном воплощении дополнительные антигены включают сахариды S.pneumoniae 1, 3, 4, 5, 6 А, 7F, 9V, 14, 18 С, 19 А, 19F и 23F. В одном воплощении дополнительные антигены включают сахариды S.pneumoniae 1, 4, 5, 6 А, 6 В, 7F, 9V, 14, 18 С, 19 А, 19F и 23F. В одном воплощении дополнительные антигены включают сахариды S.pneumoniae 1, 4, 5, 6 А, 6 В,7F, 9V, 14, 18 С, 19 А и 19F. В одном воплощении дополнительные антигены включают сахаридыS.pneumoniae 1, 4, 5, 6 А, 7F, 9V, 14, 18 С, 19 А, 19F и 23F. Любые сахариды, перечисленные как "дополнительные антигены", возможно, конъюгированы с белком-носителем либо способом по изобретению, либо другим способом. Возможно, эти дополнительные антигены конъюгированы с белками-носителями, перечисленными выше. В одном воплощении дополнительные антигены включают капсульный сахарид S.pneumoniae 1,конъюгированный с белком D или CRM197. В одном воплощении дополнительные антигены включают капсульный сахарид S.pneumoniae 3, конъюгированный с белком D, CRM197, пневмолизином, или PhtD или его фрагментом, или слитым белком. В одном воплощении дополнительные антигены включают капсульный сахарид S.pneumoniae 4, конъюгированный с белком D или CRM197. В одном воплощении дополнительные антигены включают капсульный сахарид S.pneumoniae 5, конъюгированный с белком D или CRM197. В одном воплощении дополнительные антигены включают капсульный сахаридS.pneumoniae 6B, конъюгированный с белком D или CRM197. В одном воплощении дополнительные антигены включают капсульный сахарид S.pneumoniae 7F, конъюгированный с белком D или CRM197. В одном воплощении дополнительные антигены включают капсульный сахарид S.pneumoniae 9V, конъюгированный с белком D или CRM197. В одном воплощении дополнительные антигены включают капсульный сахарид S.pneumoniae 14, конъюгированный с белком D или CRM197. В одном воплощении дополнительные антигены включают капсульный сахарид S.pneumoniae 23F, конъюгированный с белкомD или CRM197. В одном воплощении дополнительные антигены включают капсульный сахаридS.pneumoniae 18C, конъюгированный со столбнячным анатоксином или CRM197. В одном воплощении дополнительные антигены включают капсульный сахарид S.pneumoniae 19A, конъюгированный с пневмолизином или CRM197. В одном воплощении дополнительные антигены включают капсульный сахарид S.pneumoniae 22F, конъюгированный с CRM197, или PhtD или его фрагментом, или слитым белком. В одном воплощении дополнительные антигены включают капсульный сахарид S.pneumoniae 6A, конъ-8 023059 югированный с пневмолизином или белком H.influenzae, возможно белком D, или PhtD, или его слитым белком, или CRM197. В одном воплощении дополнительные антигены включают капсульный сахаридS.pneumoniae 6C, конъюгированный с пневмолизином или белком H.influenzae, возможно белком D, илиPhtD, или его слитым белком, или CRM197. В одном воплощении дополнительные антигены включают капсульный сахарид S.pneumoniae 19F, конъюгированный с дифтерийным анатоксином (DT). Дополнительные антигены могут также включать белки Streptococcus pneumoniae. В одном воплощении дополнительные антигены включают по меньшей мере один белок, выбранный из группы, состоящей из полигистидинового триадного семейства (PhtX), семейства холинсвязывающих белков(CbpX), укороченных CbpX, LytX-семейства, укороченных LytX, химерных белков (или слитых конструкций) укороченных CbpX-укороченных LytX, пневмолизина (Ply), PspA, PsaA, Sp128, Sp101, Sp130,Sp125 и Sp133. Дополнительные антигены могут также включать антигены из дополнительных бактериальных видов. В одном воплощении вакцина или иммуногенная композиция содержит антигены, имеющие происхождение из Streptococcus pneumoniae (S.pneumoniae), Haemophilus influenzae (H.Influenzae), Neisseriameningitidis (N.meningitidis), Escherichia coli (E.coli), Moraxella catarrhalis (M.catarrhalis), возбудителей столбняка, дифтерии, коклюша, Staphylococcus epidermidis (S.epidermidis), энтерококков, Pseudomonas sp. или Staphylococcus aureus (S.aureus). В одном воплощении дополнительные антигены включают антигены M.catarrhalis, предпочтительными антигенами M.catarrhalis являются: ОМР 106 [WO 97/41731 (Antex)WO 96/34960 (PMC)];OmpCD. Примеры антигенов нетипируемых штаммов Haemophilus influenzae, которые могут быть включены в комбинированную вакцину (особенно для предупреждения среднего отита), включают: белок фимбрин [(US 5766608 - Ohio State Research Foundation)] и слитые конструкции, содержащие его пептиды [например, LB1(f)-пептидные слитые конструкции; US 5843464 (OSU) или WO 99/64067]; ОМР 26D15. В дополнительном воплощении дополнительные антигены включают дифтерийный анатоксин (DT),столбнячный анатоксин (ТТ) и коклюшные компоненты [типично обезвреженный коклюшный анатоксин(РТ) и филаментозный гемагглютинин (FHA) с возможным пертактином (PRN) и/или агглютинином 1+2], например, продаваемая вакцина INFANRIX-DTPaTM (SmithKlineBeecham Biologicals), которая содержит антигены DT, ТТ, РТ, FHA и PRN, или с цельноклеточным коклюшным компонентом, например,как продаваемая SmithKlineBeecham Biologicals s.a., такая как TritanrixTM. В дополнительном воплощении дополнительные антигены включают поверхностный антиген гепатита В (НерВ). В дополнительном воплощении дополнительные антигены включают PRP капсульный сахарид Н.influenzae (Hib). В дополнительном воплощении дополнительные антигены включают по меньшей мере один капсульный сахарид из N.meningitidis А, С, W или Y. В дополнительном воплощении дополнительные антигены включают по меньшей мере один конъюгат капсульного сахарида из N.meningitidis А, С, W или Y. Конъюгат также может быть смешан с адъювантом. Подходящие адъюванты включают соли алюминия (фосфат алюминия или гидроксид алюминия), монофосфориллипид А (например, 3D-MPL), сапонины (например, QS21), эмульсии типа "масло-в-воде", пузырьковые препараты или препараты везикул наружной мембраны грамотрицательных бактериальных штаммов (таких как те, о которых сообщается вWO 02/09746), липид А или его производные, фосфаты алкилглюкозамина или комбинации двух или более этих адъювантов, но не ограничены ими. В дополнительном воплощении конъюгат по изобретению смешан с фармацевтически приемлемым эксципиентом. В дополнительном аспекте изобретения предложен конъюгат, получаемый способом по изобретению. В дополнительном аспекте изобретения предложен конъюгат, полученный способом по изобретению. Согласно изобретению также предложена иммуногенная композиция, содержащая конъюгат по изобретению и фармацевтически приемлемый эксципиент. В одном воплощении фармацевтически приемлемый эксципиент не включает хлорид, в дополнительном воплощении фармацевтический эксципиент не включает хлорид натрия. В одном воплощении фармацевтический эксципиент включает буфер, выбранный из группы, состоящей из малеата, трис-буфера или цитрата. В дополнительном воплощении буфер представляет собой малеатный буфер. Иммуногенная композиция по изобретению может содержать дополнительные антигены, в частности те, которые описаны выше как "дополнительные антигены". Иммуногенная композиция может содержать адъювант, в частности такой, как описан выше. Согласно изобретению также предложена вакцина, содержащая иммуногенную композицию по изобретению. Вакцинные препараты, содержащие иммуногенные композиции по настоящему изобретению, могут применяться для защиты или лечения млекопитающего, чувствительного к инфекции, посредством вве-9 023059 дения указанной вакцины системным или мукозальным путем. Эти способы введения могут включать инъекцию посредством внутримышечного, внутрибрюшинного, внутрикожного или подкожного путей введения или посредством мукозального введения в ротовую полость/пищеварительный, респираторный,мочеполовой тракты. Возможно интраназальное введение вакцин для лечения пневмонии или среднего отита (поскольку носоглоточное носительство пневмококков можно более эффективно предупредить,ослабляя тем самым инфекцию на самой ранней стадии). Хотя вакцину по изобретению можно вводить в виде однократной дозы, ее компоненты можно также вводить совместно в одно и то же время или в разные моменты времени (например, конъюгаты пневмококковых сахаридов можно вводить по отдельности в одно и то же время или через 1-2 недели после введения любого бактериального белкового компонента вакцины для оптимального координирования иммунных ответов по отношению друг к другу). Помимо одного пути введения, можно применять 2 разных пути введения. Например, сахариды или конъюгаты сахаридов можно вводить в/м (внутримышечно) или в/к (внутрикожно), а бактериальные белки можно вводить и/н (интраназально) или в/к. Кроме того, вакцины по изобретению можно вводить в/м в случае примирующих доз и и/н в случае бустерных доз. Содержание белковых антигенов в вакцине будет обычно находиться в пределах 1-100 мкг, возможно 5-50 мкг, наиболее типично в пределах 5-25 мкг. После первичной вакцинации субъекты могут получать одну или несколько бустерных иммунизаций через адекватные промежутки времени. Получение вакцины в общем описано в Vaccine Design ("The subunit and adjuvant approach" (edsPowell M.F.Newman M.J.) (1995) Plenum Press New York). Инкапсуляция в липосомы описана Fullerton, патент США 4235877. Хотя вакцины по настоящему изобретению можно вводить любым путем, введение описываемых вакцин в кожу (в/к) составляет одно из воплощений настоящего изобретения. Человеческая кожа содержит наружную "ороговевшую" кутикулу, называемую роговым слоем, которая покрывает эпидермис. Ниже этого эпидермиса находится слой, называемый дермой, который, в свою очередь, покрывает подкожную ткань. Исследователи показали, что инъекция вакцины в кожу, и ,в частности, в дерму, стимулирует иммунный ответ, что также может быть связано с рядом дополнительных преимуществ. Внутрикожная вакцинация описанной здесь вакциной образует дополнительный аспект настоящего изобретения. Стандартная методика внутрикожной инъекции, "процедура манту", включает стадии очистки кожи и затем при оттягивании одной рукой и, направляя срез тонкой иглы (калибр 26-31) вверх, введения иглы под углом 10-15. Как только срез иглы введен, стержень иглы опускают и продвигают дальше, осуществляя легкое надавливание, чтобы приподнять его под кожей. Затем очень медленно вводят жидкость,образуя таким образом пузырек или вздутие на поверхности кожи, после чего медленно извлекают иглу. Совсем недавно были описаны устройства, специально разработанные для введения жидких агентов в кожу или через нее, например устройства, описанные в WO 99/34850 и ЕР 1092444, а также устройства для струйных инъекций, описанные, например, в WO 01/13977; US 5480381, US 5599302, US 5334144, US 5993412, US 5649912, US 5569189, US 5704911, US 5383851, US 5893397, US 5466220, US 5339163, US 5312335, US 5503627, US 5064413, US 5520639, US 4596556, US 4790824, US 4941880, US 4940460, WO 97/37705 и WO 97/13537. Альтернативные способы внутрикожного введения вакцинных препаратов могут включать стандартные шприцы и иглы или устройства, сконструированные для баллистической доставки твердых вакцин (WO 99/27961), или трансдермальные пластыри (WO 97/48440; WO 98/28037); или накладываемые на поверхность кожи (трансдермальная или чрескожная доставка, WO 98/20734; WO 98/28037). Когда вакцины по настоящему изобретению предназначены для введения в кожу или, более конкретно, в дерму, вакцина находится в малом объеме жидкости, в частности в объеме от приблизительно 0,05 до 0,2 мл. Содержание антигенов в кожных или внутрикожных вакцинах по настоящему изобретению может быть аналогично обычным дозам, установленным для внутримышечных вакцин (см. выше). Однако как раз особенностью кожных или внутрикожных вакцин является то, что эти препараты могут быть "низкодозовыми". Соответственно белковые антигены в "низкодозовых" вакцинах, возможно, присутствуют в таких небольших количествах, как 0,1-10 или 0,1-5 мкг на дозу; а сахаридные (возможно, конъюгированные) антигены могут присутствовать в диапазоне 0,01-1 или от 0,01 до 0,5 мкг сахарида на дозу. Употребляемый здесь термин "внутрикожная доставка" означает доставку вакцины в область дермы в коже. Однако вакцина не обязательно будет локализована исключительно в дерме. Дерма представляет собой слой в коже, расположенный на расстоянии от приблизительно 1,0 до приблизительно 2,0 мм от поверхности кожи человека, но между индивидуумами и в разных частях организма имеет место определенная степень изменчивости. В общем случае можно ожидать достижения дермы, пройдя на 1,5 мм ниже поверхности кожи. Дерма расположена между роговым слоем и эпидермисом на поверхности и подкожным слоем, лежащим ниже. В зависимости от способа доставки вакцина может быть, в конечном счете, локализована исключительно или в основном в дерме или она может, в конечном счете, быть распределена в эпидермисе и дерме. В одном аспекте изобретения предложен вакцинный набор, содержащий флакон, который содержит иммуногенную композицию по изобретению, возможно в лиофилизированной форме, и дополнительно содержащий флакон, который содержит адъювант, который описан в изобретении. Предусматривается,что в этом аспекте изобретения адъювант будет использован для разведения лиофилизированной иммуногенной композиции. Дополнительный аспект изобретения представляет собой способ иммунизации человекареципиента против заболевания, вызываемого бактериальной инфекцией, включающий введение реципиенту иммунопротективной дозы иммуногенной композиции или вакцины или применение набора по изобретению. Дополнительный аспект изобретения представляет собой способ иммунизации человекареципиента против инфекции, вызываемой S.pneumoniae и/или Haemophilus influenzae, включающий введение реципиенту иммунопротективной дозы иммуногенной композиции или вакцины, или применение набора по изобретению. Дополнительный аспект изобретения представляет собой иммуногенную композицию по изобретению для применения в лечении или предупреждении бактериального заболевания. Дополнительный аспект изобретения представляет собой иммуногенную композицию по изобретению для применения в лечении или предупреждении заболевания, вызываемого инфекцией S.pneumoniae и/или Haemophilusinfluenzae. Дополнительный аспект изобретения представляет собой применение иммуногенной композиции,или вакцины, или набора по изобретению в изготовлении лекарственного средства для лечения или предупреждения бактериальных заболеваний. Дополнительный аспект изобретения представляет собой применение иммуногенной композиции, или вакцины, или набора по изобретению в изготовлении лекарственного средства для лечения или предупреждения заболеваний, вызываемых инфекцией S.pneumoniae и/или Haemophilus influenzae. Согласно изобретению также предложен активированный бактериальный сахарид, содержащий повторяющуюся структурную единицу формулы (I) где активированный бактериальный сахарид содержит n повторяющихся структурных единиц, и n составляет от 2 до 2400, от 20 до 2000, от 50 до 1500, от 1000 до 2000, от 1000 до 2500 или от 1500 до 2300; где по меньшей мере 0,001; 0,01; 0,1; 0,5; 1; 2; 5; 10 или 30%, но менее чем 0,001; 0,01; 0,1; 0,5; 1; 2; 5; 10; 30 или 50% В одном воплощении менее чем 0,001; 0,1; 0,5; 1; 2; 3; 5; 10; 30 или 50% S2 представляют собой В одном воплощении менее чем 0,1; 0,5; 1; 2; 3; 5; 10; 30 или 50% S3 представляют собой"Примерно" или "приблизительно" определяют как находящиеся в пределах 10% больше или меньше величины, заданной для целей изобретения. Авторами изобретения подразумевается, что термины "содержащий", "содержат" и "содержит" здесь возможно заменять на термины "состоящий из", "состоят из" и "состоит из" соответственно в каждом случае. Воплощения, относящиеся к "вакцинным композициям" по изобретению, здесь также применимы к воплощениям, относящимся к "иммуногенным композициям" по изобретению, и наоборот. Все источники информации или заявки на патенты, приведенные в этом описании изобретения к патенту, включены здесь посредством ссылки. Для возможности лучшего понимания изобретения предложены следующие примеры. Эти примеры приведены только в целях иллюстрации и не должны быть истолкованы как каким-либо образом ограничивающие объем изобретения. Примеры Пример 1. Окисление 23F и 6 В периодатом. Полисахариды (PS) 23F или 6 В растворяли в 100 мМ KH2PO4 (рН 7,4), 10 мМ KH2PO4 или WFI (вода для инъекций) с образованием растворов с концентрацией 2 мг PS/мл. Раствор инкубировали в течение 2 ч при перемешивании при комнатной температуре. По истечении этого времени значение рН доводили до рН 6,0 с помощью 1 н. HCl. Периодат добавляли в виде порошка или в жидкой форме (10 мг/мл вWFI) в различных количествах для достижения ряда молярных соотношений (табл. 1). Растворы инкубировали в течение 17 ч при комнатной температуре (20-25 С), по истечении этого времени образцы диализировали или подвергали диафильтрации против WFI. Высокоэффективную гель-фильтрационную хроматографию в сочетании с детектором коэффициента преломления и детектором по рассеянию света лазера под многими углами (MALLS) применяли для измерения молекулярной массы. Наполнители колонок для эксклюзионной хроматографии(TSK5000PWXL-Tosoh) применяли для характеристики распределения размеров молекул полисахарида(элюция со скоростью 0,5 мл/мин в 0,2 М NaCl - 0,02% NaN3). В табл. 1 и на фиг. 1 показаны результаты этих экспериментов. Они демонстрируют, что для сахарида 23F существенное изменение размера происходит при окислении с использованием высоко молярных эквивалентов периодата в 100 мМ фосфатном буфере. Этот эффект изменения размера может быть уменьшен путем снижения концентрации фосфатного буфера или молярных эквивалентов используемого периодата. Таблица 1 Пример 2. Конъюгирование 23F с CRM197 посредством восстановительного аминирования и с по- 12023059 мощью CDAP. Восстановительное аминирование. 1 г PS 23F растворяли в 500 мл 10 мМ KH2PO4, рН 7,15. Этот раствор инкубировали при комнатной температуре в течение 2 ч. Значение рН доводили до 6,0 с помощью 1 М HCl. 111 мг периодата (NalO4,0,4 молярных эквивалента периодата) добавляли к раствору PS 23F, и этот раствор инкубировали в течение 17 ч в темноте при комнатной температуре для окисления PS 23F. Затем раствор подвергали диафильтрации против WFI. Активированный PS 23F лиофилизировали с белком CRM197 (в соотношении CRM/PS (мас./мас.): 0,625) в присутствии стабилизатора. 900 мг лиофилизированной смеси PS 23F/CRM197 растворяли посредством добавления 350 мл растворителя ДМСО и инкубировали в течение 2 ч при комнатной температуре. Для восстановления смесиPS 23F/CRM197 добавляли 1 молярный эквивалент NaBH3CN (735 мкл раствора с концентрацией 100 мг/мл в WFI). Раствор инкубировали в течение еще 40 ч при комнатной температуре (15-25 С) при перемешивании. По истечении этого времени добавляли 2 молярных эквивалента NaBH4 (100 мг/мл в WFI), и раствор инкубировали в течение 4 ч при комнатной температуре. Добавляли 2200 мл 150 мМ NaCl перед диафильтрацией (отсечение 100 кДа) и очисткой с помощью DEAE (диэтиламиноэтил). Представляющие интерес фракции объединяли и фильтровали через фильтр на 0,22 мкм.CDAP. 200 мг микрофлюидизированного PS 23F растворяли в воде до достижения концентрации 10 мг/мл. К этому раствору добавляли NaCl в конечной концентрации 2 М. Добавляли достаточное количество раствора CDAP (100 мг/мл свежеприготовленного в ацетонитриле/WFI, 5/50 об./об.) для достижения соотношения CDAP:PS 0,75 мг/мг PS. Через 90 с значение рН повышали до рН 9,5 посредством добавления 0,1 н. NaOH. Спустя 3 мин добавляли достаточное количество CRM197 (10 мг/мл в 0,15 М NaCl) для достижения соотношения 1,5(CRM197:PS мас./мас.), поддерживали значение рН 9,5. Этот раствор инкубировали в течение 1 ч при рН 9,5. После этой стадии сочетания к смеси добавляли 10 мл 2 М раствора глицина, и значение рН доводили до рН 9,0 (ослабление рН). Раствор перемешивали в течение 30 мин при комнатной температуре. Конъюгат очищали, применяя фильтр на 5 мкм с последующей очисткой на колонке Sephacryl S400HR(XK50/100), которая удаляет небольшие молекулы и неконъюгированные полисахариды и белок. Скорость потока фиксировали при 150 мл/ч. Элюцию достигали применением 150 мМ NaCl. Представляющие интерес фракции объединяли и фильтровали с помощью Milipack 20. Полученный конъюгат имел конечное соотношение CRM197/PS мас./мас. 1,35 мас. Пример 3. Иммуногенность конъюгатов 23F-CRM197, полученных посредством восстановительного аминирования и с помощью CDAP. Конъюгаты получали способами, описанными в примере 2. Самок морских свинок иммунизировали внутримышечно три раза (на 0,14 и 28 сутки) с использованием 0,25 мкг конъюгатов PS 23F-CRM197. У животных отбирали кровь на 42 сутки и измеряли антителогенез, направленный против PS 23F, посредством ELISA и ОРА (анализ опсонофагоцитирующей активности).ELISA. Микропланшеты покрывали очищенным пневмококковым полисахаридом в PBS буфере (фосфатносолевой буфер). Планшеты промывали четыре раза 0,9% NaCl и 0,05% Твин 20. Сыворотки инкубировали в течение 1 ч при 37 С с CPS (хемилюминесцентный субстрат пероксидазы) (об./об.) в PBS-0,05% Твин 20. Сыворотки добавляли в микролунки и серийно разводили (двукратный шаг разведения) в PBS0,05% Твин. Планшеты инкубировали при перемешивании в течение 30 мин при комнатной температуре. Планшеты промывали, как указано выше, и добавляли конъюгат пероксидазы с антителами против IgG морских свинок, затем планшеты инкубировали в течение 30 мин при комнатной температуре. После промывания добавляли субстрат (4 мг OPDA (орто-фенилендиамин) в 10 мл 0,1 М цитрата рН 4,5 и 5 мкл Н 2 О 2) в каждую лунку на 15 мин. Реакцию останавливали добавлением 1 н. HCl. Поглощение считывали при 490-620 нм с использованием спектрофотометра. Проявляющаяся окраска прямо пропорциональна количеству антител, присутствующих в сыворотке. Уровень анти-PS IgG, присутствующий в сыворотках,определяли путем сравнения с контрольной кривой сыворотки, добавляемой в каждый планшет, и выражали в мкг/мл. Результаты анализировали статистически, приняв однородность дисперсии (проверяли с помощью критерия Кохрана) и нормальность (проверяли при использовании критерия Шапиро-Уилкса). Все статистические вычисления проводили при использовании Anova (дисперсионный анализ) (Tukey-HSD (критерий Тьюки достоверно значимой разницы после логарифмического преобразования концентрацииIgG. Опсонофагоцитоз. Образцы сыворотки нагревали в течение 45 мин при 56 С для инактивации любого оставшегося эндогенного комплемента. 25-микролитровые аликвоты каждого образца сыворотки, разбавленного 1:2,серийно разводили (двукратно) в 25 мкл буфера для ОРА (HBSS (сбалансированный солевой раствор Хенкса) - 14,4% инактивированной FBS (фетальная бычья сыворотка на лунку 96-луночного микротитрационного планшета с круглым дном. Затем в разведенные сыворотки добавляли 25 мкл смеси активированных HL-60 клеток (1107 клеток/мл), свежеразмороженного пневмококкового рабочего посевного материала и свежеразмороженного комплемента крольчат в соотношении, например, 4:2:1 (об./об./об.) с получением конечного объема 50 мкл. Аналитический планшет инкубировали в течение 2 ч при 37 С при ротационном перемешивании (210 об/мин) для стимулирования фагоцитарного процесса. Реакцию останавливали посредством помещения микропланшета на лед в течение по меньшей мере 1 мин. Затем 20 мкл аликвоту из каждой лунки планшета переносили в соответствующую лунку 96-луночного микропланшета с плоским дном и добавляли 50 мкл бульона Тодда-Хьюитта с 0,9% агара в каждую лунку. После инкубирования в течение ночи при 37 С и в атмосфере с 5% СО 2 подсчитывали появившиеся на поверхности агара колонии пневмококка, применяя автоматическую систему анализа изображений (KS 400,Zeiss, Oberkochen, Germany). Восемь лунок без образца сыворотки использовали в качестве бактериальных контролей для определения числа пневмококков на лунку. Определяли среднее число КОЕ (колониеобразующая единица) в контрольных лунках и использовали для подсчета цитолитической активности для каждого образца сыворотки. Титр ОРА для образцов сыворотки определяли посредством реципрокного разбавления сыворотки, способной обеспечивать 50% лизис пневмококков. Опсонофагоцитарный титр подсчитывали, применяя 4-параметрический анализ подбора кривой. Результаты анализировали статистически, приняв однородность дисперсии (проверяли с помощью критерия Кохрана) и нормальность (проверяли при использовании критерия Шапиро-Уилкса). Все статистические вычисления проводили при использовании Anova (Tukey-HSD) по логарифмическому преобразованию концентрации IgG для ELISA и критерия Крускала-Уоллиса по логарифму разведения для ОРА. Значительно более высокий антителогенез был индуцирован у морских свинок после иммунизацииPS 23F-CRM197, конъюгированным посредством восстановительного аминирования, чем PS 23FCRM197, конъюгированным с помощью CDAP, как показано на фиг. 2. Таблица 2 Пример 4. Дополнительный пример восстановительного аминирования 23F. 23F-CRM-RA-116. 150 мг природного PS 23F (PS 23FP114) растворяли до достижения концентрации 2 мг/мл в 10 мМ фосфатном буфере (рН 7,2) в течение 4 ч. После растворения значение рН доводили до рН 6,0 с помощью 1 н. HCl. Затем добавляли 0,4 молярного эквивалента периодата (NalO4) в раствор PS и инкубировали в течение 17 ч в темноте при 25 С. Затем раствор подвергали диафильтрации (отсечение 30 кДа) против WFI, и окисленный PS фильтровали на 0,22 мкм мембране. 50 мг окисленного PS и 75 мг CRM197 лиофилизировали вместе (соотношение CRM/PS мас./мас.:1,5/1) в присутствии стабилизатора. Смесь лиофилизированных PS и CRM197 растворяли в 20 мл ДМСО в течение 2 ч при комнатной температуре (15-25 С). Затем добавляли 1 молярный эквивалентTAB (триацетоксиборгидрид натрия) (13,7 мг) и после перемешивания в течение 17 ч добавляли 2 молярных эквивалента NaBH4 (100 мг/мл в 0,1 М NaOH) с последующим инкубированием при комнатной температуре в течение 30 мин. Раствор разбавляли в 5 раз посредством добавления WFI с последующей диафильтрацией (отсечение 30 кДа) против 10 мМ фосфатного буфера, 150 мМ NaCl рН 7,2. Конъюгат затем загружали на DEAE смолу и элюировали в 10 мМ фосфатном буфере, 500 мМ NaCl рН 7,2. Конъюгат окончательно фильтровали на 0,22 мкм мембране. Полученный конъюгат имеет конечное соотношение CRM/PS мас./мас.:2,3/1. Для дальнейших конъюгатов добавляли вторую стадию диафильтрации после DEAE колонки для замены буфера (150 мМ NaCl в качестве конечного буфера). Пример 5. Конъюгирование 6 В с CRM197 посредством восстановительного аминирования (с различными соотношениями белок:сахарид и микрофлюидизированными до различных размеров сахаридами 6 В) и с помощью CDAP. 6B-CRM-RA-122. 200 мг микрофлюидизированного PS 6B (84 кДа; 11,7 мг/мл) разводили до достижения концентрации 2 мг/мл в 10 мМ фосфатном буфере (рН 7,2). Значение рН доводили до рН 6,0 с помощью 1 н. HCl. Затем добавляли 0,1 молярного эквивалента периодата (NalO4) в раствор PS и инкубировали в течение 17 ч в темноте при комнатной температуре. Затем раствор подвергали диафильтрации (отсечение 30 кДа) против WFI. 50 мг PS и 30 мг CRM197 лиофилизировали вместе (соотношение CRM/PS мас./мас.:0,6/1) в присутствии стабилизатора. Смесь лиофилизированных PS и CRM197 растворяли в 20 мл ДМСО в течение 3 ч при комнатной температуре. Затем добавляли 2,5 молярного эквивалента TAB (триацетоксиборгидрид натрия) (38,7 мг) и после перемешивания в течение 16 ч добавляли 2 молярных эквивалентаNaBH4 (100 мг/мл в 0,1 М NaOH) с последующим инкубированием при комнатной температуре в течение 30 мин. Раствор разбавляли в 4 раза посредством добавления WFI с последующей диафильтрацией (отсечение 100 кДа). Конъюгат затем фильтровали на 0,22 мкм мембране. Полученный конъюгат имеет конечное соотношение CRM/PS мас./мас.:1,1/1. 6B-CRM-RA-123. Микрофлюидизированный PS 6B (84 кДа) конъюгировали с CRM197, как описано для 6B-CRM-RA122, за исключением того, что стадию лиофильной сушки проводили при использовании начального соотношения CRM197/PS 2/1 мас./мас. и использовали 30 мл ДМСО для растворения на стадии растворения в ДМСО (вместо 20 мл). Полученный конъюгат имел конечное соотношение CRM/PS мас./мас.:3,0/1. 6B-CRM-RA-124. 200 мг микрофлюидизированного PS 6B (350 кДа; 11,7 мг/мл), имеющего молекулярную массу 350 кДа, разводили до достижения концентрации 2 мг/мл в 10 мМ фосфатном буфере (рН 7,2). Значение рН доводили до рН 6,0 с помощью 1 н. HCl. Затем добавляли 0,1 молярного эквивалента периодата (NalO4) в раствор PS и инкубировали в течение 17 ч в темноте при комнатной температуре. Затем раствор подвергали диафильтрации (отсечение 100 кДа) против WFI. 50 мг PS и 60 мг CRM197 лиофилизировали вместеCRM197 растворяли в 20 мл ДМСО в течение 5 ч при комнатной температуре. Затем добавляли 2,5 молярного эквивалента TAB (триацетоксиборгидрид натрия) (38,7 мг) и после перемешивания в течение 16 ч добавляли 2 молярных эквивалента NaBH4 (100 мг/мл в 0,1 М NaOH) с последующим инкубированием в течение 30 мин при комнатной температуре. Раствор разбавляли в 4 раза посредством добавления WFI с последующей диафильтрацией (отсечение 100 кДа). Конъюгат затем фильтровали на 0,22 мкм мембране. Полученный конъюгат имеет конечное соотношение CRM/PS мас./мас.:1,6/1. 6B-CRM-RA-125. Микрофлюидизированный PS 6B (350 кДа) конъюгировали с CRM197, как описано для 6B-CRMRA-124, за исключением того, что стадию лиофильной сушки проводили при использовании начального соотношения CRM197/PS 2/1 мас./мас. и растворение в ДМСО проводили, используя 33 мл (вместо 20 мл). Полученный конъюгат имел конечное соотношение CRM/PS мас./мас.:2,9/1. 6B-CRM-003. 50 мг микрофлюидизированного PS 6B разводили до достижения концентрации 10 мг/мл в воде (10 мг/мл). Добавляли NaCl в твердой форме до достижения конечной концентрации 2 М. Добавляли растворCDAP (100 мг/мл свежеприготовленного в ацетонитриле/WFI, 50/50 об./об.) для достижения соответствующего соотношения CDAP/PS (1,5 мг/мг PS). Через 1,5 мин рН повышали до рН 9,5 посредством добавления 0,1 н. NaOH и обеспечивали это значение рН до момента добавления CRM197. Спустя 3 мин добавляли CRM197 (10 мг/мл в 0,15 М NaCl) для достижения соотношения CRM197/PS 2 мас./мас.; значение рН поддерживали на уровне рН 9,5. Раствор оставляли в течение 2 ч при регулировании рН. После стадии сочетания добавляли к смеси 2,5 мл 2 М раствора глицина. Значение рН доводили до значений ослабленного рН (рН 9,0). Раствор перемешивали в течение 30 мин при комнатной температуре. Затем конъюгат фильтровали, применяя фильтр на 5 мкм, и вводили в колонку Sephacryl S400HR(XK50/100) для удаления небольших молекул (включая DMAP (диметиламинопиридин и неконъюгированных PS и белка. Скорость потока фиксировали при 30 мл/ч. Элюцию проводили в 150 мМ NaCl. Представляющие интерес фракции объединяли и фильтровали на Milipack 20. Полученный конъюгат имел конечное соотношение CRM197/PS мас./мас.:1,5/1. 6B-CRM-RA-144. 1 г микрофлюидизированного PS 6 В (245 кДа; 9,47 мг/мл) разводили до достижения концентрации 2 мг/мл в 10 мМ фосфатном буфере (рН 7,2). Значение рН доводили до рН 6,0 с помощью 1 н. HCl. Затем добавляли 0,1 молярного эквивалента периодата (NalO4) в раствор PS и инкубировали в течение 18 ч в темноте при комнатной температуре. Затем раствор подвергали диафильтрации против WFI (Sartocon(триацетоксиборгидрид натрия) (154,9 мг) и после перемешивания в течение 16 ч при 25 С добавляли 2 молярных эквивалента NaBH4 (100 мг/мл в 0,1 М NaOH) и инкубировали в течение 30 мин. Раствор разбавляли в 5 раз в WFI и через 30 мин подвергали диафильтрации десять раз с 150 мМ NaCl и затем пять раз с 10 мМ РО 4 (K/K2), рН 7,2 и 150 мМ NaCl (Sartorius Sartocon Slice 200 Hydrosart 100 кДа). Затем концентрат загружали на DEAE колонку (XK26/40). Колонку промывали буфером 10 мМ РО 4(K/K2), рН 7,2/150 мМ NaCl. Конъюгат элюировали буфером 10 мМ РО 4 (K/K2), рН 7,2/500 мМ NaCl. Элюат концентрировали и подвергали диафильтрации с 5 объемами 150 мМ NaCl и затем фильтровали на фильтре на 0,22 мкм. Полученный конъюгат имеет конечное соотношение CRM/PS мас./мас.:1,6/1. Пример 6. Иммуногенность конъюгатов 6B-CRM197, полученных посредством восстановительного аминирования и с помощью CDAP. Группу из 40 самок мышей линии Balb/c (4-недельные) иммунизировали внутримышечно три раза на 0,14 и 28 сутки с использованием 0,1 мкг конъюгатов PS 6B, полученных посредством восстанови- 15023059 тельного аминирования или с помощью CDAP, приготовленных в виде препаратов на AIPO4. PS 6B-PD использовали в качестве эталона. У мышей отбирали кровь на 42 сутки и измеряли антителогенез, направленный против каждого антигена, посредством ELISA и ОРА. Группу из 20 самок морских свинок (150 г от Hartley) иммунизировали внутримышечно три раза на 0,14 и 28 сутки с использованием 0,25 мкг конъюгатов PS 6B, полученных посредством восстановительного аминирования или с помощью CDAP, с добавлением в качестве адъюванта AIPO4. PS 6B-PD использовали в качестве эталона. У морских свинок отбирали кровь на 42 сутки и измеряли антителогенез,направленный против каждого антигена, посредством ELISA и ОРА. ОРА на мышах и морских свинках. Образцы сыворотки нагревали в течение 45 мин при 56 С для инактивации любого оставшегося эндогенного комплемента. 25-микролитровые аликвоты каждого образца сыворотки, разбавленного 1:2,двукратно серийно разводили в 25 мкл буфера для ОРА (HBSS -14,4% инактивированной FBS) на лунку 96-луночного микротитрационного планшета с круглым дном. Затем в разведенные сыворотки добавляли 25 мкл смеси активированных HL-60 клеток (1107 клеток/мл), свежеразмороженного пневмококкового рабочего посевного материала и свежеразмороженного комплемента крольчат в соотношении, например,4/2/1 об./об./об. с получением конечного объема 50 мкл. Аналитический планшет инкубировали в течение 2 ч при 37 С при ротационном перемешивании (210 об/мин) для стимулирования фагоцитарного процесса. Реакцию останавливали посредством помещения микропланшета на лед в течение по меньшей мере 1 мин. Затем 20 мкл аликвоту из каждой лунки планшета переносили в соответствующую лунку 96 луночного микропланшета с плоским дном и добавляли 50 мкл бульона Тодда-Хьюитта с 0,9% агара в каждую лунку. После инкубирования в течение ночи при 37 С и в атмосфере с 5% CO2 подсчитывали появившиеся на поверхности агара колонии пневмококка, применяя автоматическую систему анализа изображений (KS 400, Zeiss, Oberkochen, Germany). Восемь лунок без образца сыворотки использовали в качестве бактериальных контролей для определения числа пневмококков на лунку. Определяли среднее число KOE в контрольных лунках и использовали для подсчета цитолитической активности для каждого образца сыворотки. Титр ОРА для образцов сыворотки определяли посредством реципрокного разбавления сыворотки, способной обеспечивать 50% лизис пневмококков. Опсонофагоцитарный титр подсчитывали, применяя 4-параметрический анализ подбора кривой. В табл. 3 описаны уровни GMC (среднее геометрическое концентраций), полученные в результате иммунизации мышей линии Balb/c конъюгатами, полученными способами по примеру 4. Таблица 3 Иммуногенность этих конъюгатов у мышей линии Balb/c показана на фиг. 3. Совместно на фиг. 3 и в табл. 3 продемонстрировано, что на модели с мышами конъюгаты, полученные посредством восстановительного аминирования, сопоставимы с конъюгатами, полученными с помощью CDAP. В частности,на фиг. 3 продемонстрировано, что иммуногенность конъюгатов, полученных посредством восстановительного аминирования, была выше, чем иммуногенность конъюгата, полученного с помощью CDAP. В табл. 4 описаны уровни GMC, полученные в результате иммунизации морских свинок конъюгатами, полученными способами по примеру 4. Таблица 4 Иммуногенность этих конъюгатов у морских свинок показана на фиг. 4. Аналогичные экспериментам, проведенным на модели с мышами, результаты в табл. 4 и на фиг. 4 показывают, что конъюгаты,полученные посредством восстановительного аминирования, сопоставимы с конъюгатами, полученными с помощью CDAP, в частности PS06B-CRM125 продемонстрировал значительно более высокие уровниGMC и иммуногенность, чем конъюгат, полученный с помощью CDAP. Пример 7. Конъюгирование Hib со столбнячным анатоксином посредством восстановительного аминирования(Na/K2), рН 6,2 в течение 4 ч 30 мин при комнатной температуре и затем в течение ночи при 4 С. Наблюдение за вязкостью проводили во время растворения. Через 4 ч растворения вязкость, по-видимому, была стабильной. PS разбавляли до концентрации 10 мг/мл фосфатным буфером и затем окисляли в темноте с помощью 0,07 молярного эквивалента NalO4 в течение 60 мин. Окисленный PS подвергали диафильтрации (Sartorius Hydrosart 2 кДа) против 3,5 объемов фосфатного буфера и затем фильтровали на фильтре на 0,22 мкм. Число повторяющихся структурных единиц, полученных после окисления, оценивали с помощью 1 Н-ЯМР, и оно, как обнаружили, составляло приблизительно 21.Hib-TT-LS210, 212 и 213. 200 мг окисленного PS (14,56 мг/мл) смешивали с 300 мг ТТ (31,18 мг/мл; соотношение TT/PS мас./мас.:1,5/1) и разбавляли до достижения концентрации 4 мг/мл с помощью 36,64 мл 10 мМ фосфатного буфера (Na/K2), рН 6,2. Раствор лиофилизировали в присутствии стабилизатора. Смесь лиофилизированных PS и ТТ растворяли в 20 мл ДМСО в течение 6 ч при 25 С. Затем добавляли 10 мг-экв. TAB(триацетоксиборгидрид натрия) (38,7 мг) и после перемешивания в течение 16 ч добавляли 2 молярных эквивалента NaBH4 (100 мг/мл в 0,1 М NaOH) с последующим инкубированием в течение 30 мин при комнатной температуре. Раствор разбавляли в 3 раза посредством добавления WFI с последующей стадией диафильтрации (5 объемов WFI с последующими 5 объемами 10 мМ ацетатного буфера, 150 мМNaCl, рН 6,2, MWCO (номинальное отсечение по молекулярной массе) 100 кДа). Образец затем загружали на смолу Sephacryl S300HR. Элюцию проводили в 10 мМ ацетатном буфере при использовании 150 мМ NaCl (pH 6,2). Представляющие интерес фракции объединяли и фильтровали на фильтре на 0,22 мкм. Полученные конъюгаты имели конечное соотношение TT/PS мас./мас.:2,1/1. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ конъюгирования бактериального сахарида, включающий стадии:a) взаимодействия бактериального сахарида с 0,001-0,7 молярными эквивалентами периодата с образованием активированного бактериального сахарида;b) взаимодействия активированного бактериального сахарида и белка-носителя с восстановителем с образованием конъюгата; или а) взаимодействия бактериального сахарида с 0,001-0,7 молярными эквивалентами периодата с образованием активированного бактериального сахарида;b') взаимодействия активированного бактериального сахарида с линкером при использовании восстановителя с образованием соединения бактериальный сахарид-линкер;c) взаимодействия соединения бактериальный сахарид-линкер с белком-носителем с образованием конъюгата; где стадия а) протекает в буфере, который не содержит аминогруппу и имеет концентрацию 1-100 мМ, и где бактериальный сахарид представляет собой капсульный сахарид S.pneumoniae 6B. 2. Способ по п.1, где рН на стадии а) составляет 3,5-8,0, 5,0-7,0 или 5,5-6,5 или приблизительно 6,0. 3. Способ конъюгирования бактериального сахарида, включающий стадии:a) взаимодействия бактериального сахарида с 0,001-0,7 молярными эквивалентами периодата с образованием активированного бактериального сахарида;b) взаимодействия активированного бактериального сахарида и белка-носителя с восстановителем с образованием конъюгата; или а) взаимодействия бактериального сахарида с 0,001-0,7 молярными эквивалентами периодата с образованием активированного бактериального сахарида;b') взаимодействия активированного бактериального сахарида с линкером при использовании восстановителя с образованием соединения бактериальный сахарид-линкер; с) взаимодействия соединения бактериальный сахарид-линкер с белком-носителем с образованием конъюгата; где стадия а) протекает в буфере, который не содержит аминогруппу и имеет концентрацию 1-100 мМ при рН 5,5-6,5, и где бактериальный сахарид представляет собой капсульный сахарид S.pneumoniae 23F или 6 В. 4. Способ по п.1 или 3, где буфер выбран из группы, состоящей из фосфатного буфера, малеатного буфера, ацетатного буфера, карбонатного буфера и цитратного буфера, возможно где буфер имеет концентрацию 1-50, 1-25, 1-10, 5-15, 8-12 или 10-50 мМ или приблизительно 10 мМ. 5. Способ по любому из пп.1-4, где средняя молекулярная масса бактериального сахарида составляет 1-1100, 100-470, 200-300, 600-1100 или 800-1000 кДа после стадии а). 6. Способ по любому из пп.1-5, где средняя молекулярная масса сахарида 23F составляет 100-470 или 200-300 кДа после стадии а). 7. Способ по любому из пп.1-6, где белок-носитель выбран из группы, состоящей из столбнячного анатоксина, фрагмента С столбнячного анатоксина, дифтерийного анатоксина, CRM197, пневмолизина,белка D, PhtD, PhtDE и N19. 8. Способ по любому из пп.1-7, где восстановитель включает цианборгидрид натрия или триацетоксиборгидрид натрия. 9. Способ по любому из пп.1-8, включающий дополнительную стадию е) очистки конъюгата. 10. Способ по любому из пп.1-9, включающий дополнительную стадию смешивания конъюгата с дополнительными антигенами, возможно где дополнительные антигены включают по меньшей мере 7, 8,9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 сахаридов S.pneumoniae, выбранных из группы, состоящей из 1, 2, 3, 4, 5, 6 А, 6 В, 7F, 8, 9N, 9V, 10 А, 11A, 12F, 14, 15 В, 17F, 18 С, 19 А, 19F, 20, 22F, 23F и 33F. 11. Способ по п.10, где дополнительные антигены включают один или более чем один белокS.pneumoniae, выбранный из группы, состоящей из полигистидинового триадного семейства (PhtX), семейства холинсвязывающих белков (CbpX), укороченных CbpX, LytX-семейства, укороченных LytX,химерных белков (или слитых конструкций) укороченных CbpX-укороченных LytX, пневмолизина (Ply),PspA, PsaA, Sp128, Sp101, Sp130, Sp125 и Sp133. 12. Способ по любому из пп.1-11, где конъюгат смешивают с адъювантом или фармацевтически приемлемым эксципиентом. 13. Конъюгат, получаемый способом по любому из пп.1-12. 14. Иммуногенная композиция, содержащая конъюгат по п.13 и фармацевтически приемлемый эксципиент, где фармацевтический эксципиент при необходимости включает малеатный буфер. 15. Применение иммуногенной композиции по п.14 в предупреждении или лечении бактериального заболевания. 16. Способ предупреждения или лечения бактериальной инфекции, включающий введение иммуногенной композиции по п.14 пациенту.
МПК / Метки
МПК: A61K 39/02
Метки: конъюгирования, бактериальных, полисахаридов, способ, белками-носителями
Код ссылки
<a href="https://eas.patents.su/20-23059-sposob-konyugirovaniya-bakterialnyh-polisaharidov-s-belkami-nositelyami.html" rel="bookmark" title="База патентов Евразийского Союза">Способ конъюгирования бактериальных полисахаридов с белками-носителями</a>
Предыдущий патент: Вакцинные векторы и способы усиления иммунных ответов
Следующий патент: Способ подземного выщелачивания окисленных никель-кобальтовых руд
Случайный патент: Способ индукции иммунного ответа, вакцинная композиция, ее применение и набор












