Способ ферментации плазмидной днк
Формула / Реферат
1. Способ продуцирования ковалентно замкнутой сверхспирализованной плазмидной ДНК путем периодической ферментации с подпиткой, включающий стадии:
А) выращивания бактериальных клеток, содержащих плазмиду, космиду или бактериальный искусственный хромосомный репликон, при пониженной температуре в течение периодической фазы с подпиткой;
Б) ограничения скорости роста в течение периодической фазы с подпиткой путем ограничения питания;
В) индукции продуцирования плазмиды путем сдвига температуры в сторону повышения и
Г) продолжения роста при повышенной температуре для накопления плазмидного продукта;
посредством чего указанный способ увеличивает выход плазмиды.
2. Способ по п.1, где пониженная температура в течение периодической фазы с подпиткой представляет собой температуру, определенную для поддержания выхода плазмиды меньше приблизительно 2 мг/л/OD600.
3. Способ по п.1, где пониженная температура в течение периодической фазы с подпиткой составляет приблизительно 30шC.
4. Способ по п.1, где сдвиг температуры находится в диапазоне 36-45шC.
5. Способ по п.1, где плазмида содержит ориджин репликации, полученный из ColE1.
6. Способ по п.1, где плазмида содержит ориджин репликации pMB1, содержащий мутацию pUC G в A.
7. Способ по п.1, где плазмида получена на основе VR1012.
8. Способ по п.1, где ферментационная среда представляет собой, по существу, среду полуопределенного состава с глицерином.
9. Способ ферментационного продуцирования ковалентно замкнутой сверхспирализованной плазмидной ДНК, включающий стадии:
А) выращивания бактериальных клеток, содержащих полученные из pBR322 плазмиду, космиду или бактериальный искусственный хромосомный репликон, в среде для периодической ферментации с подпиткой;
Б) ограничения скорости роста в течение периодической фазы с подпиткой путем ограничения питания и
В) продолжения роста для накопления плазмидного продукта;
посредством чего указанный способ увеличивает выход плазмиды.
10. Способ по п.9, где ферментационная среда представляет собой, по существу, среду полуопределенного состава с глицерином.
Текст
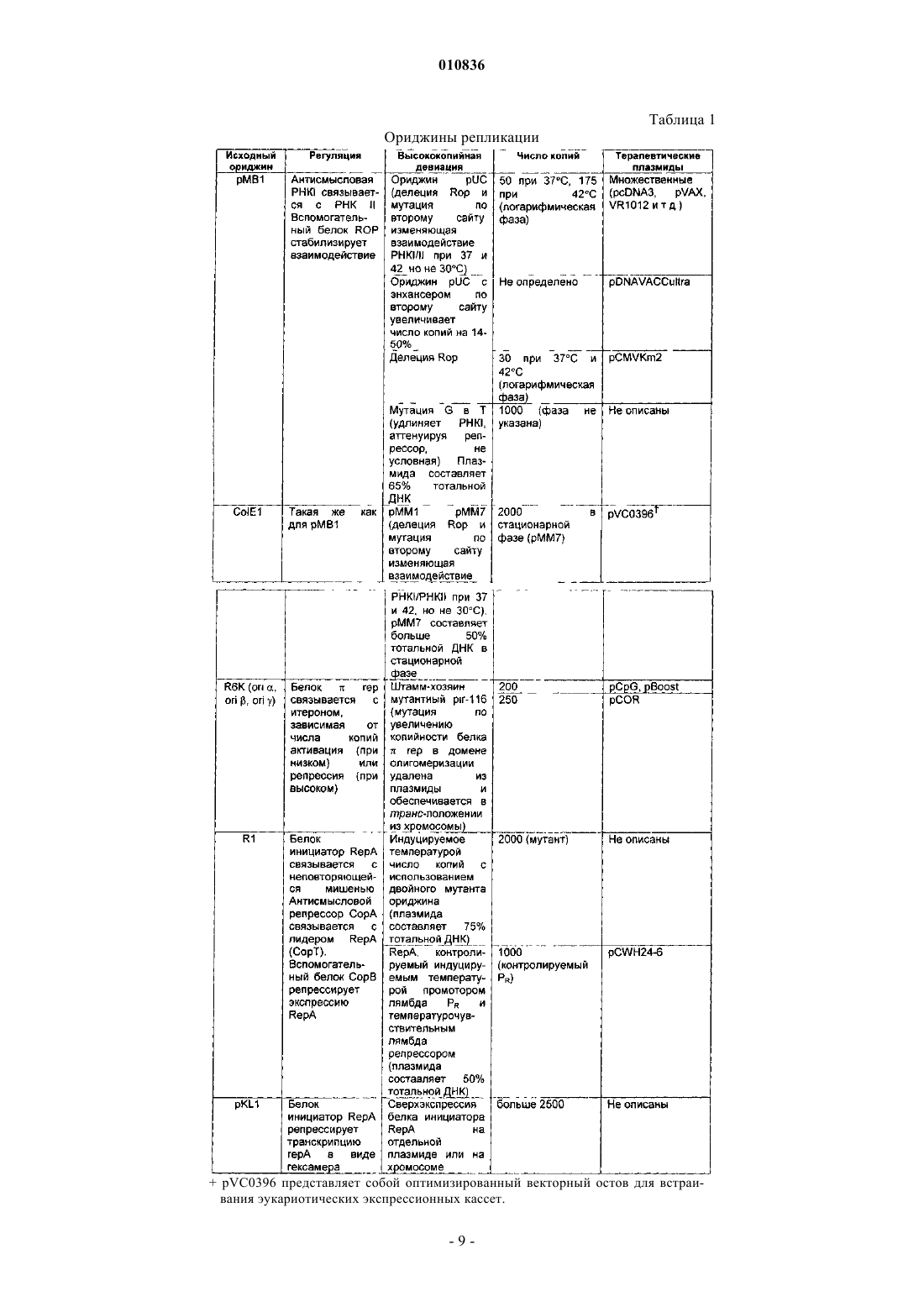
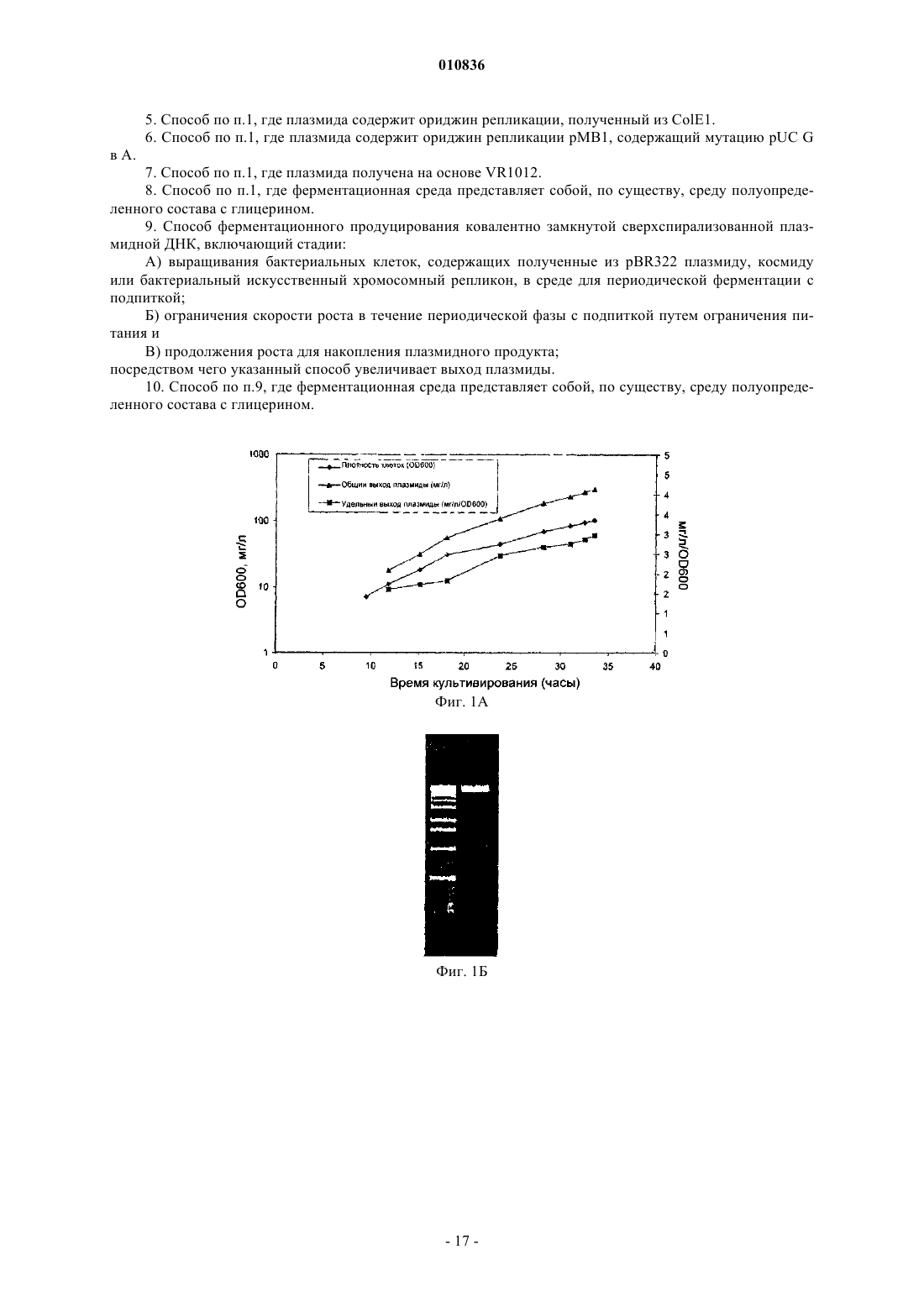
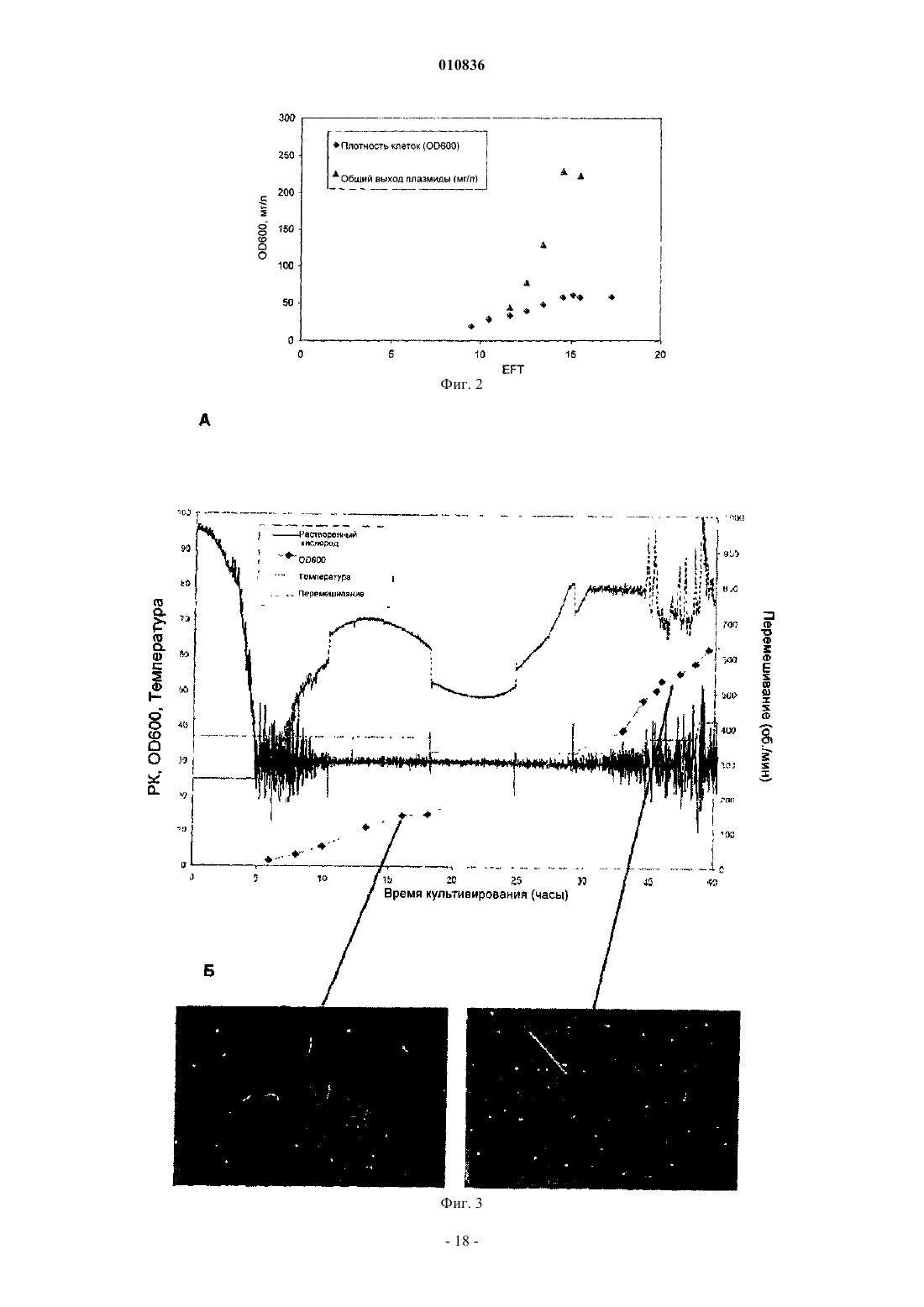
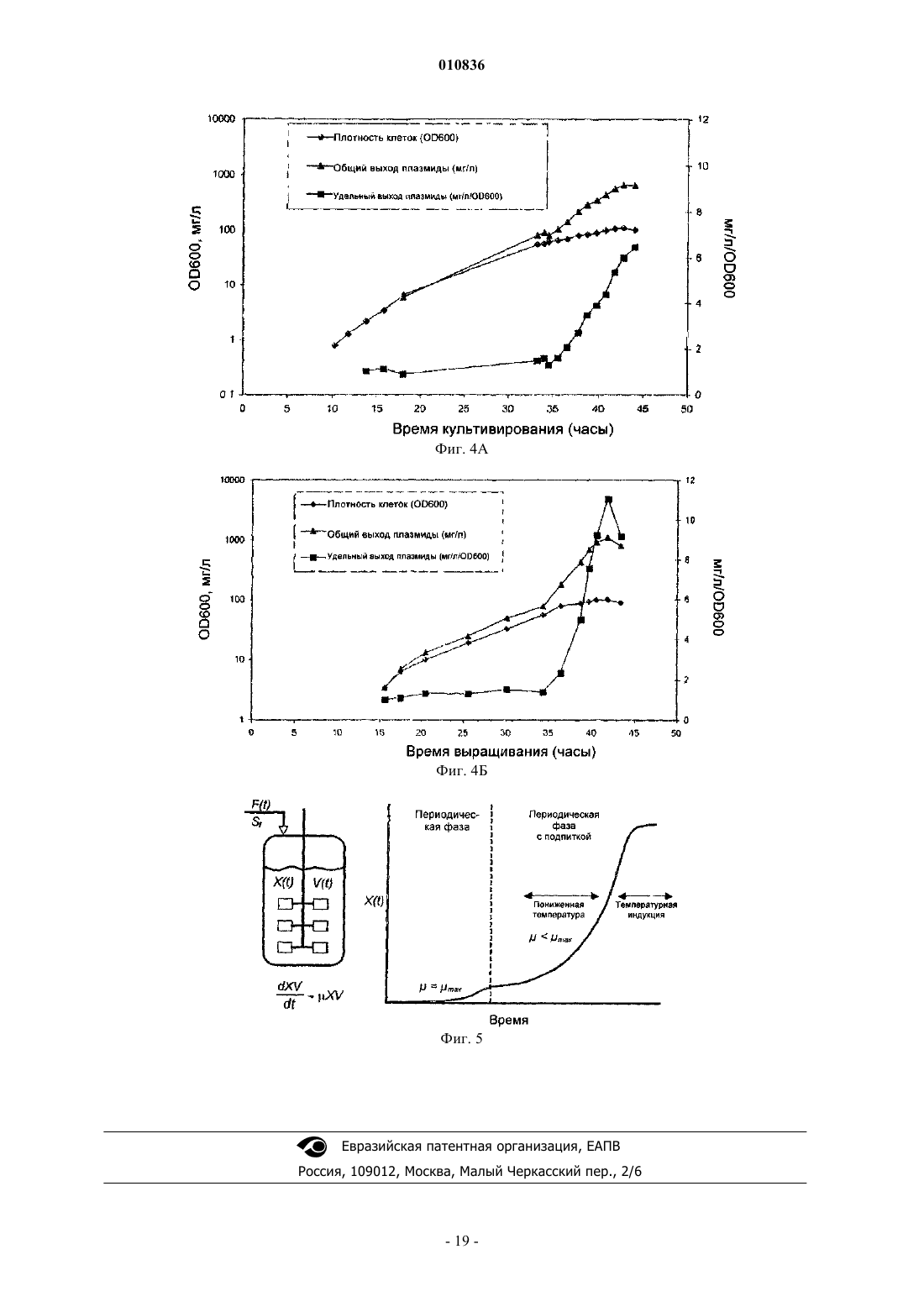
010836 Заявка на данное изобретение имеет приоритет на основании предварительной заявки на патентUS 60/603000, поданной 19 августа 2004 г. Область изобретения Настоящее изобретение относится к продуцированию ковалентно замкнутых кольцевых (кзк) рекомбинантных молекул дезоксирибонуклеиновой кислоты (ДНК), таких как плазмиды, космиды, бактериальные искусственные хромосомы (BAC), бактериофаги, вирусные векторы и их гибриды, и конкретнее представляет собой способ продуцирования указанных молекул ДНК с высокими уровнями в ферментационной культуре. Предшествующий уровень техники Настоящее изобретение относится к продуцированию ковалентно замкнутых кольцевых рекомбинантных молекул ДНК. Такие молекулы полезны в биотехнологии, трансгенных организмах, генной терапии, терапевтической вакцинации, сельскохозяйственных и ДНК-вакцинах. В свете изобретения было проведено исследование предшествующего уровня техники. ПлазмидыE.coli в течение длительного времени представляли собой единственный наиболее важный источник рекомбинантных молекул ДНК, используемых исследователями и в промышленности. В настоящее время плазмидная ДНК становится все более важной в качестве следующего поколения биотехнологических продуктов (генные лекарственные средства и ДНК-вакцины), занимающих свое место в клинических испытаниях и в конечном счете на фармацевтическом рынке. Плазмидные ДНК-вакцины могут найти применение в качестве профилактических вакцин при вирусных, бактериальных заболеваниях или заболеваниях, вызванных паразитами; в качестве иммунизирующих агентов для приготовления гипериммунных глобулиновых продуктов; в качестве терапевтических вакцин для инфекционных заболеваний или в качестве противораковых вакцин. Плазмиды также используют в генной терапии или генных заместительных приложениях, при которых желаемый генный продукт экспрессируется из плазмиды после введения пациенту. В настоящее время стандарты Управления по контролю за качеством пищевых продуктов, медикаментов и косметических средств (FDA) не определены, за исключением предварительной формы (см.FDA Points to Consider on Plasmid DNA Vaccines for Preventive Infectious Disease Indications, 1996). Тем не менее, в будущем международные стандарты чистоты плазмидной ДНК, вероятно, будут такими же, как стандарты, используемые для рекомбинантных белковых продуктов, аналогично продуцируемых путем ферментации E.coli, или очень схожими с ними, и такие стандарты превосходят чистоту, которую в настоящее время достигают путем применения общепризнанных способов. Наиболее приближенно, приемлемый стандарт меньше 100 пг геномной ДНК хозяина на дозу (см. FDA Points to consider in the characterization of cell lines used to produce biologies, 1993) значительно ниже уровней, которые в настоящее время могут быть достигнуты для очищенных плазмидных препаратов (100 пг на дозу 1 мг эквивалентны одной части на 10 млн). Хорошо известны основные способы получения плазмид (путем бактериальной ферментации) и их очистки (например, при помощи способа щелочного лизиса (Birnboim, Н.С., Doly J. 1979, Nucleic AcidsRes. 7: 1513-1523. Исходно, пасту ферментированных бактериальных клеток ресуспендируют и лизируют (с использованием комбинации гидроксида натрия и додецилсульфата натрия), после чего раствор нейтрализуют путем добавления кислой соли (например, ацетата калия), осаждающей бактериальную ДНК и большую часть клеточного дебриса. Основное количество сверхспирализованной плазмидной ДНК остается в растворе наряду с примесями бактериальной РНК, ДНК и белков, а также эндотоксиномE.coli (липополисахаридом или ЛПС). Растворимую фракцию затем отделяют путем фильтрования и подвергают множеству стадий очистки, которые могут включать расщепление РНКазой; хроматографию(ионообменную гель-фильтрацию, гидроксиапатитную хроматографию, гель-фильтрацию, хроматографию с гидрофобным взаимодействием, обращенно-фазовую хроматографию, высокоэффективную жидкостную хроматографию (ВЭЖХ) и т.д.); диафильтрацию; органическую экстракцию, избирательное осаждение и т.д. Очевидно, что увеличение чистоты исходного материала и достижение более хорошей последующей очистки представляют собой существенно важные задачи при производстве ДНК клинической чистоты в промышленном масштабе. Рассмотрение ферментационных сред. Разработка сбалансированной среды основана на энергетических потребностях клетки и элементном составе. Как правило, пищевые потребности удовлетворяются при помощи минимальных сред или сред полуопределенного состава. Среды полуопределенного состава содержат комплекс компонентов, таких как дрожжевой экстракт,казаминовые кислоты и пептоны. Добавление сложных соединений обеспечивает факторами роста, аминокислотами, пуринами и пиримидинами и часто поддерживает более высокие плотности клеток. Углерод составляет половину состава клеток. Соответственно, углерод включен в наибольших количествах. Источник углерода обеспечивает энергией и биомассой и обычно его используют в качестве лимитирующего питательного вещества. Глюкоза представляет собой обычный источник углерода. Она очень эффективно метаболизируется и поэтому обеспечивает более высокий клеточный выход. Однако-1 010836 высокие концентрации глюкозы вызывают нежелательную продукцию ацетата вследствие метаболического избытка (известного как эффект Крабтри (Crabtree. Также используют глицерин, и зачастую он представляет собой предпочтительный источник углерода в периодических культурах. Хотя клеточные выходы при применении глицерина несколько меньше по сравнению с глюкозой, глицерин не вызывает столь высоких уровней продукции ацетата и может быть использован в более высоких концентрациях, не оказывая ингибирующего действия. Глицерин также поддерживает уменьшенные максимальные удельные скорости роста. Потребность в азоте может быть удовлетворена при помощи неорганических или органических источников азота. Аммиак и соли аммония (например, NH4Cl, (NH4)2SO4) используют в минимальных средах. Среды полуопределенного состава обеспечивают азотом частично или полностью из комплексных компонентов, включающих дрожжевой экстракт, пептоны и казаминовые кислоты. Для роста, метаболизма и ферментативных реакций требуются неорганические вещества. Магний,фосфор, калий и серу, как правило, добавляют в виде отдельных компонентов сред. Ди- и монокалийортофосфаты обеспечивают калием и фосфором и в определенных пропорциях действуют в качестве буферных агентов. Гептагидрат сульфата магния часто используют в качестве источника магния и серы. Другие необходимые минеральные вещества включают кальций, медь, кобальт, железо, марганец, молибден и цинк. Они требуются в меньших количествах и часто обеспечиваются путем добавления раствора микроэлементов, хотя они обычно присутствуют в виде примесей к основным ингредиентам. Осмолярность доводят с помощью хлорида натрия. Применение продуктов животного происхождения, и в частности бычьих продуктов, при получении плазмиды неприемлемо ввиду риска заражения прионами или вирусами. Все компоненты сред должны быть аттестованы на отсутствие животного продукта. Для множества компонентов, имеющих животное происхождение, существуют полученные из растений заменители (например, растительный глицерин, соевый пептон). Рассмотрения способа ферментации плазмиды. Скорость роста. Обеспечение пониженной скорости роста представляет собой объединяющий принцип высококачественной ферментации с высоким выходом плазмиды. Высокие скорости роста ассоциированы с продукцией ацетата, нестабильностью плазмиды и меньшим процентным содержанием сверхспирализованной плазмиды. Пониженная скорость роста позволяет исключить зависимую от скорости роста нестабильность плазмиды путем обеспечения времени для репликации плазмиды, синхронизируемой с клеточным делением. Условия роста. Ферментация дает возможность контролировать и следить за множеством параметров, влияющих на качество и выход плазмиды. Известно, что на сверхспирализацию влияет содержание кислорода и температура (Dorman C.J. et al. 1988, J. Bacteriol 179: 2816-2826, Goldstein E., Drlica K. 1984 Proc. Natl.Acad. Sci. USA. 81: 4046-4050). Показано, что кислород играет роль в стабильности плазмиды. В одном из исследований (Hopkins D.J., Betenbaugh M.J., Dhurjati P. 1987 Biotechnol Bioeng. 29: 85-91) обнаружено, что одна капля с растворенной концентрацией кислорода до 5% насыщения воздуха приводит к быстрой утрате стабильности плазмиды. В другом исследовании (Namdev P.K., Irwin N., Thompson B.G.,Gray M.R. 1993, Biotechnol. Bioeng. 41: 666-670) показано, что колебания в поступлении кислорода приводят к нестабильности плазмиды. Кроме того, на образование плазмид с одноцепочечными разрывами и мультимеров может влиять множество параметров, включающих температуру, pH, растворенный кислород, концентрацию питательных веществ и скорость роста (Durland R.H., Eastman E.M. 1998, Adv. Drug.Deliver Rev. 30: 33-48). Оптимальная температура для роста E.coli составляет 37C. Однако для снижения максимальной удельной скорости роста при периодической ферментации могут быть использованы более низкие температуры (30-37C). Более высокие температуры (36-45C) также могут быть использованы для индукции избирательной амплификации плазмид с определенными ориджинами репликации, например pUC и pMM1 (Wong E.M., Muesing M.A., Polisky, В. 1982, Proc. Natl. Acad. Sci. USA. 79: 35703574, Lin-Chao S., Chen W.T., Wong T.T. 1992, Mol. Microbio. 6: 3385-3393), и неконтролируемый репликон R плазмид. Hamann et. al., 2000 (Hamann C.W., Nielsen J., Lagerslev E. 2000, международная заявка на патент WO 0028048) сообщают о способе продуцирования R плазмид, при котором продуцирование плазмид поддерживают на низком уровне (путем применения низкой температуры) для того, чтобы избежать замедления роста вследствие синтеза плазмидной ДНК; как только клеточная популяция становится высокой, индуцируют продуцирование плазмиды путем сдвига температуры. Периодическая ферментация. Периодическая ферментация имеет основное преимущество, заключающееся в простоте. Все питательные вещества, которые используют для клеточного роста и продуцирования плазмиды в течение периода культивирования, присутствуют в момент инокуляции. Периодическая ферментация имеет лаг-фазу, фазу экспоненциального роста и стационарную фазу. Применение подходящего инокулюма(1-5% объема культуры) сокращает длительность лаг-фазы. Во время экспоненциальной фазы все пита-2 010836 тельные вещества находятся в избытке, поэтому удельная скорость роста, по существу, представляет собой максимальную удельную скорость роста, макс, предсказываемую в соответствии с кинетикой Монода (Monod). Как обсуждалось ранее, для продуцирования плазмиды желательны пониженные скорости роста. При периодической ферментации скорость роста может быть уменьшена только путем уменьшения макс. Этого достигают путем выращивания при более низких температурах и путем использования глицерина вместо глюкозы. Периодическая ферментация при 30C с использованием глицерина, как правило, приводит в результате к макс не больше 0,3 ч-1, которая достаточна для предотвращения вредной аккумуляции ацетата и ассоциированной со скоростью роста нестабильности плазмиды (Thatcher D.R.,Hitchcock A., Hanak J.A.J., Varley D.L. 2003, патент США 6503738). Глицерин также может быть использован в гораздо более высоких концентрациях по сравнению с глюкозой при отсутствии ингибирования, приводя к более высоким выходам биомассы. Как правило, при периодической ферментации могут быть получены выходы биомассы до 60 г/л (масса клеток в граммах). Периодическая ферментация с подпиткой. Периодическая ферментация с подпиткой особенно полезна для продуцирования плазмид. Контролируемое добавление лимитирующего питательного вещества дает возможность для контроля скорости при скоростях меньших макс. Кроме того, периодическая ферментация с подпиткой приводит в результате к более высоким выходам. Ключевым для периодической ферментации с подпиткой является поступление субстрата с такой скоростью, чтобы он полностью потреблялся. В результате остаточная концентрация субстрата приблизительно равна нулю, и достигается максимальная конверсия субстрата. Избегают метаболического избытка вследствие избытка субстрата, уменьшая образование ингибирующего ацетата. Периодическая ферментация с подпиткой начинается с периодической фазы. Клетки инокулируют в исходный объем среды, содержащей все нелимитирующие питательные вещества и исходную концентрацию лимитирующего субстрата. Контролируемая подпитка лимитирующим питательным веществом начинается, как только клетки потребят исходное количество субстрата. Одна из наиболее простых и наиболее эффективных стратегий подпитки представляет собой экспоненциальную подпитку. Этот способ дает возможность для выращивания культуры с определенной скоростью меньше чем макс без необходимости контроля процесса конечным продуктом. Ферментация начинается с периодического режима, содержащего неингибирующую концентрацию субстрата. Клетки выращивают при макс до истощения субстрата, в этот момент начинается подпитка питательным веществом. Способы РК-стат. и pH-стат. достаточно легко осуществлять, поскольку большинство стандартных ферментационных систем включает контроль за содержанием растворенного кислорода и pH. Тенденции в содержании растворенного кислорода (РК) и pH могут указывать на то, доступен ли субстрат для клеток. Истощение субстрата вызывает уменьшенное поглощение кислорода, и концентрация РК в среде увеличивается. pH также увеличивается вследствие потребления метаболических кислот. Подпитка запускается тогда, когда содержание РК или pH увеличивается выше установленного порога. Скорость роста можно регулировать путем изменения порогового значения содержания РК или pH. Примеры способов ферментации плазмиды. Оценка достигаемых в настоящее время выходов свидетельствует о том, что типичная лабораторная культура во встряхиваемой колбе продуцирует от 1 до 5 мг плазмидной ДНК/л культуры, тогда как ферментатор, управляемый компьютером, может производить, как правило, 10-250 мг/л.Lahijani et al. (Lahijani R., Hulley G., Soriano G., Horn N.A., Marquet M. 1996 Human Gene Therapy 7: 1971-1980) сообщали об использовании плазмиды, полученной из pBR322, с температурочувствительной одноточечной мутацией (ориджин pUC) в ферментационной среде с экспоненциальной подпиткой и сдвигом температуры с 37 до 42-45C. Они достигли выхода плазмиды 220 мг/л в ферментаторе объемом 10 л. Та же самая плазмида без мутации при периодической ферментации (ориджин получен из pBR322) при 30C позволила получать только 3 мг/л плазмиды. Friehs et al. (Friehs K., Flaschel E., Schleef M.,Schmidt T., 2003, патент США 6664078) описывают периодический способ с подпиткой с использованием среды на основе дрожжевого экстракта с глицерином и с подпиткой, с контролем процесса конечным продуктом по типу РК-стат. Ферментацию начинали с исходного объема партии 7,5 л. Перемешивание увеличивали для поддержания РК выше 30%. Подпитывающую среду закачивали тогда, когда РК достигал установленного порогового значения 45%. Культура достигала стационарной фазы через 41 ч с получением 60 г/л DCW (масса клеток в граммах) и 230 мг/л плазмиды. Chen (Chen, W., 1999, патент США 5955323) использовал периодический способ с подпиткой в среде полуопределенного состава с комбинацией контроля процесса конечным продуктом по типу РК-стат. и pH-стат. Пороговые заданные величины РК и pH составляли соответственно 50% и 7,2. Когда содержание РК падало ниже 30% ввиду высокой метаболической активности, скорость перемешивания увеличивали на определенный процент от предшествующей скорости. В ферментаторе объемом 7 л эта стратегия обеспечивала удельную скорость роста 0,13 ч-1 и выходы плазмиды 82-98 мг/л. Durland and Eastman, выше, 1998, сообщают о периодической ферментации при 37C в запатентованной среде. Их способ, как правило, обеспечивает выход-3 010836 130 мг/л с максимальным выходом 250 мг/л. Даже с учетом предшествующего уровня техники сохраняется необходимость в экономичном способе продуцирования плазмидной ДНК высокой чистоты. Описанные выше ферментационные среды и способы включают среды и способы, известные в настоящее время в области техники для улучшения плазмидной продуктивности, такие как пониженная скорость роста и индукция копийности плазмиды при помощи высокой температуры. Эти способы выходят на плато при 200-250 мг плазмидной ДНК/л. Этот низкий выход накладывает бремя расходов и чистоты на коммерческое применение способов продуцирования плазмидной ДНК. Хотя экономия в силу увеличения масштабов производства в будущем значительно уменьшит стоимость ДНК, для достижения желаемой стоимости необходимо гораздо более экономичное решение этой проблемы. Кроме того, международные стандарты чистоты плазмидной ДНК, вероятно, будут такими же, как стандарты, используемые для рекомбинантных белковых продуктов, аналогично продуцируемых в результате ферментации E.coli, или очень сходными с ними, и такие стандарты превосходят существующую в настоящее время чистоту, которая достижима при помощи общепринятых способов. Увеличение выхода (1 мг ДНК/г клеточной пасты) ферментации уменьшит стоимость и увеличит чистоту ДНК (поскольку уменьшит количество перерабатываемого материала). Описание изобретения Изобретение представляет собой способ продуцирования репликонов ДНК с использованием улучшенных периодических способов и периодических способов с подпиткой для продуцирования плазмиды. Конкретно, раскрыт способ периодической ферментации с подпиткой, при котором содержащие плазмиду клетки E.coli выращивают при пониженной температуре в течение периодической фазы с подпиткой,в течение которой скорость роста ограничена, с последующим сдвигом температуры в сторону повышения и продолжающимся выращиванием при повышенной температуре для накопления плазмиды, при этом ограничение скорости роста за счет сдвига температуры увеличивает выход и чистоту плазмиды. В предпочтительном воплощении пониженную скорость роста определяют для поддержания выхода плазмиды меньше приблизительно 2 мг/л/РК. В еще одном предпочтительном воплощении пониженная температура составляет приблизительно 30C. В еще одном предпочтительном воплощении температуру увеличивают приблизительно до 36-45C. В еще одном предпочтительном воплощении плазмида содержит ориджин репликации, полученный из ColE1. В еще одном предпочтительном воплощении плазмида содержит ориджин репликации pMB1, содержащий мутацию pUC из G в A. В еще одном предпочтительном воплощении плазмида получена на основе VR1012. В одном из особенно предпочтительных воплощений ферментационные среды, по существу, представляют собой среды полуопределенного состава с глицерином. В еще одном окончательном предпочтительном воплощении плазмиду, полученную изpBR322, выращивают в E.coli в процессе периодической ферментации с подпиткой, в течение которой скорость роста ограничивают в течение периодической фазы с подпиткой, и рост продолжают для накопления плазмидного продукта. С учетом вышеизложенного эти способы демонстрируют стратегии выращивания с высокой плотностью клеток, комбинированные с новым ростом и сдвигами температуры на стадии индукции. При получении ДНК репликонов, содержащих ориджин, полученный из pBR322, периодическую ферментацию с подпиткой осуществляют при ограниченной скорости клеточного роста. При продуцировании индуцируемых температурой ДНК репликонов (например, плазмид, содержащих ориджин pUC или pMM1) периодическую ферментацию с подпиткой осуществляют при ограниченной скорости клеточного роста и пониженной температуре в течение фазы роста; продуцирование плазмиды затем индуцируют путем повышения температуры. Эти способы значительно увеличивают выход плазмидной ДНК при ферментации, в то же время сохраняя или улучшая целостность плазмиды по сравнению со способами, описанными в области техники. Краткое изложение сущности изобретения Задача настоящего изобретения заключается в том, чтобы предложить способы ферментации для продуцирования плазмидной ДНК. В задачу изобретения также входило повышение выхода продуцирования плазмидной ДНК в ферментационной культуре, а также улучшение качества плазмидной ДНК в ферментационной культуре. Задача изобретения также включала уменьшение количества примесей в очищенной плазмидной ДНК, а также создание улучшенных способов ферментации, которые по сравнению со способами, определенными в уровне техники, улучшены путем увеличения выхода плазмиды посредством индукции уровней плазмиды после продуцирования биомассы; улучшенного выхода и целостности для токсичных или нестабильных плазмид путем поддержания низких уровней плазмиды в ходе продуцирования биомассы; улучшенного качества плазмиды за счет уменьшенных уровней никированных (открытое кольцо) или линеаризованных вариантов плазмиды; увеличенного качества плазмиды путем увеличения процентного содержания мономера плазмиды; упрощенной продукции с использованием надежных автоматических контрольных параметров и подпиток; упрощенного масштабирования вследствие контроля за ростом и уменьшенного потребления ки-4 010836 слорода, требующегося в течение роста; уменьшенных уровней примесей после очистки плазмиды вследствие обогащенных уровней плазмиды в подпитывающем потоке для последующей обработки и улучшенного соответствия регламентирующим правилам путем устранения всех компонентов, полученных из животных продуктов. Дополнительные преимущества изобретения станут понятны из рассмотрения графических материалов и следующего описания. Краткое описание чертежей Фиг. 1 демонстрирует периодическую ферментацию с подпиткой плазмиды, полученной из pBR322,в E.coli в среде NTC3019. Фиг. 2 демонстрирует периодическую ферментацию плазмиды pUC в E.coli в среде NTC3018. Фиг. 3 демонстрирует периодическую ферментацию с подпиткой плазмиды gWiz GFP в E.coli в среде NTC3019. Фиг. 4 демонстрирует индуцируемую периодическую ферментацию gWiz GFP с подпиткой в E.coli в среде NTC3019 (индукция 37 или 42C). Фиг. 5 иллюстрирует способ индуцируемой периодической ферментации с подпиткой. Подробное описание изобретения Фиг. 1 демонстрирует периодическую ферментацию с подпиткой плазмиды, полученной из pBR322,в E.coli в среде NTC3019, показывая:(а) типичный рост и профиль продуктивности плазмиды, полученной из pBR322, в E.coli в течение периодической ферментации с подпиткой в среде NTC3019 и(б) что плазмидная ДНК, продуцируемая посредством способа периодической ферментации с подпиткой в среде NTC3019, в значительной степени сверхспирализована и лишена изоформ с одноцепочечными разрывами (никированных) и открытых кольцевых изоформ. На фиг. 2 представлен рост плазмиды и профиль продуктивности при периодической ферментации плазмиды pUC (pW2.0) в E.coli в среде NTC3018. Периодическая ферментация плазмиды pW2.0 обеспечивает плотность клеток 57 OD600 и обеспечивает выход 230 мг плазмиды/л. На фиг. 3 представлена периодическая ферментация плазмиды gWiz GFP с подпиткой в E.coli в среде NTC3019:(а) профиль роста и контрольного параметра (растворенный кислород, температура, перемешивание) при периодической ферментации gWiz GFP с подпиткой;(б) флуоресцентная микроскопия клеток, окрашенных SYBR Green I, демонстрирует филаментацию на плато (слева), тогда как после снижения температуры до 33C рост возобновляется и филаментация уменьшается (справа). На фиг. 4 представлена индуцируемая периодическая ферментация gWiz GFP с подпиткой в E.coli в среде NTC3019 (индукция при 37 или 42C):(а) выявлен профиль роста и продуктивности ферментации плазмиды gWiz-GFP/E.coli DH5 со сдвигом температуры 3037C в течение 35 ч, выход плазмиды достигает 670 мг/л и(б) продемонстрирован профиль роста и продуктивности ферментации плазмиды gWiz-GFP/E.coliDH5 со сдвигом температуры 3042C в течение 35 ч. Выход плазмиды достигает 1100 мг/л. На фиг. 5 проиллюстрирован способ индуцируемой периодической ферментации с подпиткой. Определения. В описании приняты следующие определения: кзк: ковалентно замкнутое кольцо; ориджин, полученный из ColE1: ориджин репликации, полученный из плазмиды типа ColE1 (например, рМВ 1, ColE1) путем делеции (например, ориджин, полученный из pBR322) и/или замены оснований (например, pUC из pMB1, pMM1, pMM5 из ColE1 и т.д.); ДНК репликон: плазмиды, космиды, бактериальные искусственные хромосомы (BAC), бактериофаги, вирусные векторы и их гибриды; ферментационная среда NTC3018: среда полуопределенного состава с глицерином для периодической ферментации; ферментационная среда NTC3019: среда полуопределенного состава с глицерином для периодической ферментации с подпиткой; пДНК: плазмидная ДНК; ориджин, полученный из pBR322: ориджин рМВ 1 из pBR322, из которого делетирован ген rop (репрессор праймера); плазмида: плазмиды, космиды, бактериальные искусственные хромосомы (BAC), бактериофаги, вирусные векторы и их гибриды; ориджин pUC: ориджин, полученный из pBR322, с транзицией G в A, увеличивающей копийность при повышенной температуре; среда полуопределенного состава с глицерином: ферментационная среда, которая содержит слож-5 010836 ный источник азота (например, дрожжевой экстракт, соевый экстракт) и глицерин в качестве источника углерода. Изобретение относится к способам продуцирования ковалентно замкнутых кольцевых (кзк) рекомбинантных молекул ДНК, таких как плазмиды, космиды, бактериальные искусственные хромосомы(BAC), бактериофаги, вирусные векторы и их гибриды (здесь вместе названные плазмидами) в бактериальном хозяине-продуценте, с использованием механического ферментационного сосуда. Способы ферментации, описанные в уровне техники, не являются оптимальными и характеризуются субоптимальным выходом плазмиды, качеством (например, образование в плазмиде одноцепочечных разрывов или линеаризация плазмиды), плохой масштабируемостью (например, вследствие избыточных потребностей в поступлении кислорода), и ограниченным применением (например, невозможность использования плазмид, содержащих нестабильные или токсичные последовательности). Изобретение представляет собой способ улучшения выхода и чистоты плазмидной ДНК во время ферментации культуры. Разработан экономичный подход для ферментации с высоким выходом, в котором используют способ индуцируемой периодической ферментации с подпиткой для улучшения выхода и чистоты плазмиды. Предпочтительные воплощения способа продуцирования плазмиды и сред. В одном из предпочтительных воплощений для продуцирования плазмид, полученных из pBR322,периодическую ферментацию с подпиткой осуществляют при ограниченной скорости клеточного роста. Этот способ значительно улучшает выход плазмидной ДНК в результате ферментации, в то же время сохраняя или улучшая целостность плазмиды по сравнению со способами, описанными в области техники. Используя этот способ для плазмид с умеренной копийностью (например, ориджин репликацииpBR322 с делецией гена ROP, здесь именуемый как плазмиды, полученные из pBR322) при автоматическом периодическом процессе ферментации с подпиткой при 37C, контролируемом для поддержания удельной скорости роста 0,12 ч-1, был достигнут выход 250-450 мг/л и плотности клеток 120 OD600. Это 100-кратное улучшение по сравнению с известными выходами (Lahijani et al., выше, 1996). Молекулярная основа этого нового значительного улучшения не известна. Независимо от механизма, применение изобретения для продуцирования других плазмид увеличит продуктивность ферментации без потери качества плазмид. В одном из предпочтительных воплощений для продуцирования индуцируемых температурой ДНК репликонов (например, плазмид, содержащих ориджин pUC или pMM1) осуществляют периодическую ферментацию с подпиткой с ограниченной скоростью клеточного роста и пониженной температурой в течение фазы роста; затем продуцирование плазмиды индуцируют путем повышения температуры. Этот способ значительно улучшает выход ферментации плазмидной ДНК, в то же время поддерживая или улучшая целостность плазмиды по сравнению со способами, описанными в уровне техники. Эта новая раскрытая здесь стратегия продуцирования плазмид с высококопийным ориджином (например, ориджин pUC) с высоким выходом приводит в результате к неожиданно высокой эффективности продуцирования плазмид и их качеству. Кроме того, во время периодической фазы с подпиткой скорость роста снижена. Способ изображен на фиг. 5. Эту новую комбинацию элементов не применяли для продуцирования плазмид с ориджином, полученным из ColE1, и при тестировании эта новая комбинация обеспечивала новый и неожиданный результат, заключающийся в повышенной продуктивности. Таким образом, авторы изобретения указывают на новое применение (повышенную продуктивность) комбинации пониженной скорости роста с 1) пониженной температурой для роста и продуцирования биомассы и 2) повышенной температурой для индукции продуцирования плазмиды. Обнаружение того, что комбинация исходной фазы роста при пониженной температуре с более поздней фазой продуцирования при высокой температуре приводит в результате к улучшенному общему росту, биомассе и выходу плазмиды, является новым и неожиданным и не упоминается в уровне техники. Hamann et al., выше, 2000, использовали индуцируемую температурой ферментацию специфически для уменьшения метаболической нагрузки, ассоциированной с R плазмидами, во время роста. Эту стратегию использовали для продуцирования R плазмид, и она не предлагалась для плазмид, содержащих ориджин ColE1. Кроме того, Hamann et al,. выше, 2000, не предполагают улучшения общей продуктивности при использовании этой стратегии. Таким образом, эта комбинация элементов не была предложена в уровне техники для улучшения выхода. Существует синергизм в данной комбинации, который превышает сумму для ее частей, что было установлено по повышенной продуктивности. Кроме того, ферментации с высоким выходом удовлетворяют существующую в течение длительного времени потребность,поскольку с использованием многочисленных предшествующих способов, описанных в области техники в течение последних 10 лет, не удалось продемонстрировать ферментацию с высоким выходом. Таким образом, авторы изобретения предлагают новую комбинацию элементов для продуцирования плазмид,содержащих ориджин ColE1, включающую медленный рост в сочетании с температурной индукцией,которая демонстрирует неожиданное и удивительное повышение эффективности продуцирования плазмид. Применение индуцируемого способа периодической ферментации с подпиткой для продуцирования высококопийных плазмид приводило в результате к выходам 1100 мг/л плазмидной ДНК и величинеOD600, равной 100. Это пятикратное улучшение по сравнению с выходами, получаемыми при использовании способов ферментации, известных из уровня техники. ДНК, полученная в результате всех этих способов, имеет высокую чистоту, будучи, по существу, на 100% сверхспирализованной. Авторы изобретения предлагают применение описанных здесь периодических способов ферментации и периодических способов ферментации с подпиткой для повышения эффективности продуцирования плазмид. При описанном здесь индуцируемом периодическом способе с подпиткой в течение фазы продуцирования биомассы поддерживались низкие уровни плазмид (меньше 2 мг/л/OD600 для векторов, полученных из VR1012), а после продуцирования биомассы обеспечивал неожиданную и беспрецедентно сверхвысокую продукцию плазмиды (больше 6 мг/л/OD600 для векторов, полученных из VR1012). Высокие выходы продукта очень желательны, поскольку увеличенный выход плазмиды на 1 г бактерий приводит непосредственно к более высокой чистоте конечного продукта. Авторы изобретения предлагают применение сдвига температуры по изобретению для поддержания низких уровней плазмиды (меньше 2 мг/л/OD600 для векторов, полученных из VR1012) в течение роста, индукцию продуцирования плазмиды до высоких уровней (больше 3 мг/л/OD600 для векторов, полученных из VR1012) после продукции биомассы. Эти уровни представляют собой общую величину для продуцирования векторов, полученных из VR1012. Другие плазмиды могут выдерживать более высокие или низкие уровни по сравнению с 2 мг/л/OD600 во время фазы роста. Максимальный уровень плазмиды во время фазы роста, который поддерживает приемлемую метаболическую нагрузку, стабильность плазмиды и повышенную продуктивность после сдвига температуры, может быть определен экспериментально для каждой новой плазмиды специалистом в области техники. Альтернативные воплощения ферментационных сред. При практической реализации изобретения могут быть использованы в качестве примеров такие препараты ферментационных сред, не содержащих животные продукты, как NTC3018 (для периодической ферментации), NTC3019 (для периодической ферментации с подпиткой). Эти среды представляют собой оптимизированные полусинтетические среды для роста, содержащие глицерин в качестве источника углерода, дрожжевой экстракт в качестве источника азота, и металлические микроэлементы, соли и буферы. Ожидают, что замена этих сред на описанные в области техники также приведет в результате к улучшенной продуктивности плазмиды при использовании описанных здесь способов ферментации. Предполагаются альтернативные источники азота неживотного происхождения для применения в средах NTC3018 и NTC3019. В качестве компонента сложных сред, дрожжевой экстракт обеспечивает азотом, аминокислотами, витаминами и углеродом. Возможные компоненты сложных сред (например,дрожжевых или соевых экстрактов), являющиеся ключевыми для клеточного метаболизма во время продуцирования плазмиды, включают аминокислоты, витамины, микроэлементы и альтернативные источники углерода. В качестве примера авторы изобретения рассматривают применение альтернативных препаратов дрожжевого экстракта, препарата сои (например, соевого пептона (Soytone) или phytone пептона от BD Biosciences) или других растительных препаратов (например, pea flower пептонов от Oxoid) в средах NTC3018 и NTC3019. Также предлагаются вариации определенных элементов в средах. Например, предлагается увеличенное содержание фосфата или магния в виде увеличения содержания компонента в средах для циклической ферментации или в качестве добавок к подпитке при периодической ферментации с подпиткой. Дополнительная оптимизация сред путем систематической оценки компонентов может быть осуществлена специалистом в области ферментации. Предусматриваются добавки к средам при использовании некоторых ауксотрофных клеточных линий. Например, таким клеточным линиям, как Stbl2 (InVitrogen Corp.), содержащим делецию proAB, для достижения максимального роста может потребоваться добавка аминокислот или альтернативного источника азота, обогащенного пролином. Такие модификации могут быть определены специалистом в области ферментации. Авторы изобретения также предлагают применение описанных здесь периодических способов ферментации и периодических способов ферментации с подпиткой с использованием сред для ферментации плазмид, описанных в области техники. Они включают среды определенного состава, такие как раскрытые Soubrier (Soubrier F. 2004 заявка на патент США 2004/0142452). Предпочтительные среды для применения со способами периодической ферментации с подпиткой по изобретению представляют собой препараты сред с глицерином с полуопределенными подпитками, таких как NTC3019, и сред, раскрытых в Lahijani et al., выше, 1996, Friehs et al., выше, 2003, Chen, выше, 1999 и Urthaler et al (Urthaler J., RomanN., Ascher C., Woehrer H. 2005, заявка на патент США 2005/0026177). Альтернативные воплощения способа ферментации. Здесь раскрыты улучшенные периодические способы с подпиткой и периодические способы продуцирования плазмид. Они отображают стратегии экспоненциальной подпитки, скомбинированные с новыми температурными сдвигами в фазе роста и индукции. При практическом применении периодических способов с подпиткой по изобретению авторы изобретения рассматривают различные стратегии подпитки для уменьшения скорости роста, включающие регуляцию конечным продуктом, по механизму прямой связи и предварительно заданную регуляцию-7 010836 подпитки питательными веществами. Например, подпитка питательной средой может быть добавлена в соответствии со стратегией экспоненциальной подпитки с ограничением по углероду. Авторы изобретения предлагают вариацию этой стратегии подпитки для регуляции скорости роста в приемлемых диапазонах. Предпочтительные диапазоны скорости ростасоставляют от 0,05 до 0,3 ч-1. Предпочтительная целевая скорость ростасоставляет 0,12 ч-1. Приемлемые диапазоны скорости роста являются специфическими для плазмиды и могут быть определены экспериментально специалистом в данной области техники. При практическом применении периодических способов с подпиткой по изобретению авторы изобретения предлагают различные периодические стратегии для уменьшения времени продуцирования. Содержание полуопределенного питательного вещества, включенного в периодическую фазу, может быть отрегулировано таким образом, чтобы дать возможность периодической фазе протекать до достижения более высоких концентраций биомассы. В случае более высокой концентрации биомассы общее время ферментации уменьшается, поскольку рост осуществляется быстрее в периодической фазе по сравнению с периодической фазой с подпиткой. Авторы изобретения предлагают вариацию этой периодической стратегии для контроля за началом периодической фазы способа с подпиткой. Предпочтительные диапазоны OD600 для запуска периодической фазы с подпиткой составляют от 1 до 60. Приемлемые диапазоны OD600 для запуска периодического способа с подпиткой могут быть специфическими для плазмиды и экспериментально могут быть определены специалистом в данной области техники. При практическом применении индуцируемого периодического способа с подпиткой и периодического способа по изобретению авторы изобретения предлагают различные стратегии сдвига температуры с фазы роста до фазы индукции. Фаза роста может быть осуществлена при температурах от 25 до 37 С,предпочтительно при 30-37 С. Для высококопийных плазмид фазу роста наиболее предпочтительно осуществляют при 30-32 С. Фаза индукции может быть осуществлена при температурах от 33 до 45 С и предпочтительно 37-42 С. При практическом применении индуцируемых способов со стратегиями сдвига температуры авторы изобретения предлагают использование концентрации питательных веществ, концентрации биомассы или оптической плотности в качестве показателя того, когда необходимо переключаться с фазы роста на фазу индукции. Регулярный пробоотбор из ферментационной культуры может обеспечить материал для измерений биомассы или оптической плотности, и сдвиг температуры может быть осуществлен при определенной концентрации биомассы. Для обеспечения непрерывного контроля за концентрацией биомассы также могут быть использованы интерактивные датчики, а ферментатор может быть установлен на автоматическое осуществление температурного сдвига при определенной концентрации биомассы. При практическом осуществлении индуцируемого периодического способа с подпиткой со стратегиями сдвига температуры авторы изобретения также предлагают осуществление сдвига температуры сразу,как только будет добавлено определенное количество питательного вещества. При практическом применении индуцируемых способов со стратегиями сдвига температуры авторы изобретения предусматривают использование более высоких температур в течение фазы роста для минимизации времени продуцирования. При описанном здесь периодическом способе с подпиткой поддерживаются низкие (меньше 2 мг/л/OD600) уровни плазмиды в течение фазы роста способа. Максимальная температура, которая может быть использована в течение фазы роста, поддерживающая приемлемую метаболическую нагрузку, стабильность плазмиды и увеличенную продуктивность после сдвига температуры, специфична для плазмиды и варьирует для различных плазмидных цепей. Например, некоторые плазмиды могут быть устойчивы при гораздо более высоких уровнях, чем 2 мг/л/OD600. Кроме того, продуктивность плазмиды может варьировать при низкой температуре, так что некоторые плазмиды могут не продуцироваться как высокие уровни плазмиды. В этих случаях авторы изобретения предлагают применение более высоких температур в течение фазы роста. Кроме того, повышенные максимальные температуры можно допускать в течение исходной циклической фазы вследствие неограниченного роста и соответствующей меньшей копийности плазмиды (фиг. 5). Максимальная температура, которая может быть использована в течение фазы роста (периодический компонент и периодический компонент с подпиткой), поддерживающая приемлемую метаболическую нагрузку, стабильность плазмиды и повышенную продуктивность после сдвига температуры, может быть определена экспериментально специалистом в данной области техники Плазмиды и штаммы-хозяева. Авторы изобретения предлагают применение изобретения в продуцировании плазмид с разными ориджинами репликации, которые обладают высокой копийностью, низкой копийностью и умеренной копийностью и индуцируются или не индуцируются температурой. Некоторые предпочтительные ориджины репликации и несущие их плазмиды приведены в табл. 1. В области техники известны модификации этих ориджинов, которые также предложены для применения.+ pVC0396 представляет собой оптимизированный векторный остов для встраивания эукариотических экспрессионных кассет.-9 010836 Предполагаются альтернативные штаммы-хозяева. Штамм E.coli DH5 представляет собой широко используемого хозяина для продуцирования плазмид. Его ключевые характеристики включают мутациюrecA, минимизирующую неспецифическую рекомбинацию клонированной ДНК, и мутацию endA1, устраняющую неспецифическое расщепление плазмиды эндонуклеазой I. В дополнение к DH5 для продуцирования плазмид подходит множество других штаммов; не ограничивающий объем изобретения перечень примеров штаммов-хозяев E.coli представлен в табл. 2. Таблица 2 Штаммы-хозяеваDH5, XL1-Blue, DH10B, JM109 и Top 10 общеизвестны в качестве штаммов, продуцирующих плазмиды. Mach1 и ECOS101 разработаны недавно и могут представлять собой желаемых хозяев для продуцирования плазмид. Клетки Stbl2, GT116 и Sure используют для продуцирования нестабильных ДНК-содержащих плазмид. Нестабильная ДНК содержит такие структуры, как прямые (например, ретровирусные длинные концевые повторы) или инвертированные повторы (например, палиндромы короткошпилечных РНК (shRNA, Z ДНК и т.д. Делеция гена dcm в GT116 устраняет метилирование dam,которое является иммуностимулирующим. Таким образом, продуцирование в GT116 уменьшает иммуногенность плазмидной ДНК. Подобные уменьшения иммуногенности наблюдают при использовании штаммов, экспрессирующих CpG метилазу. Продуцирование нестабильных плазмид. Авторы изобретения также предлагают применение изобретения в продуцировании плазмид, содержащих нестабильные последовательности. Палиндромные последовательности, прямые или инвертированные повторы и последовательности,образующие Z ДНК, являются нестабильными и подвергаются делеции или перестановке в хозяевахE.coli. В некоторых случаях плазмиды для терапевтического применения должны содержать нестабильные последовательности (инвертированные или прямые повторы для вирусных векторов, такие как AAV и HIV, сегменты, образующие Z ДНК или триплетные повторы для некоторых терапевтических генов). Используемые в настоящее время стратегии поддержания плазмид, содержащих нестабильные последовательности, заключаются в применении клеточных линий хозяев, несущих стабилизирующие мутации. Некоторые хозяева имеются в продаже для размножения этих плазмид, например клетки Sure- 10010836 ретровирусные векторы; этот эффект усиливается при пониженной температуре, предположительно вследствие уменьшенного числа копий. Специфические комбинации репарационных мутаций могут стабилизировать размножение плазмиды, в особенности при низкой температуре. Клеточные линии Sure иSure2 используют одну из таких комбинаций с дефектом гомологичной рекомбинации (recB, red) в сочетании с дефектом УФ репарации (uvrC) и репарации SOS (umuC) (для стабилизации длинных концевых повторов (LTR, и SbcC (и recJ) для стабилизации Z ДНК. Клеточная линия GT116 использует SbcC иSbcD для стабилизации палиндромных последовательностей. Эти штаммы функционируют, стабилизируя плазмиды только при низкой температуре (т.е. 30C), предположительно вследствие уменьшенного числа копий плазмид. Эта стратегия, очевидно, увеличивает стоимость продукции. Применение описанного здесь индуцируемого способа ферментации может дать возможность для размножения при 30C нестабильных плазмид в стабилизирующих клеточных линиях перед увеличением числа копий только в течение короткого периода перед сбором. Это должно максимизировать выход и стабильность (т.е. качество) нестабильных плазмид. Продуцирование ДНК и плазмид. Механизм, лежащий в основе наблюдаемого увеличенного выхода плазмидной ДНК (больше 6 мг/л/OD600) в индуцируемом периодическом способе с подпиткой, не известен. Это возможно может происходить вследствие индукции агентов, компактизующих ДНК (например, гистоноподобный белок или другие белки, связывающиеся с хроматином, такие как продукт гена dps), во время продуцирования биомассы при медленном росте и пониженной температуре. Изменение конденсации ДНК во время фазы индукции может увеличивать выход плазмиды путем увеличения допустимых уровней или числа копий плазмиды. Степень компактизации ДНК определяется двумя противоположными факторами; конденсацией белков хроматина и деконденсацией транскрипционных комплексов. На компактизацию плазмиды может оказывать влияние уровень транскрипции с плазмидных промоторов. Меньшая транскрипция может ассоциироваться с более высокой компактизацией и потенциально более высокой несущей способностью. В E.coli идентифицировано множество белков хроматина, которые вовлечены в компактизацию ДНК. Эти генные продукты связываются с плазмидной и геномной ДНК. В случае геномной ДНК они компактизируют ДНК в нуклеоид (обзор в Robinow С., Kellenberger E. 1994, Microbiol Review, 58: 211232). Основные компоненты нуклеоида представляют собой гистоноподобные белки HU, IHF и HN-S,StpA (относящийся к HN-S экспрессируется приблизительно на уровне 1/10) и Dps, которые однородно распределены в нуклеоиде, тогда как другие белки, такие как SeqA, CbpA, CbpB, Fis и IciA, находятся в меньшем количестве, демонстрируют неоднородное распределение в нуклеоиде и могут обладать регуляторными функциями. Выделенный белковый комплекс R плазмиды содержал три основных белка: 23%HN-S, 23% РНК-полимеразы и 5% HU. Он может предположительно меняться в зависимости от фазы роста, поскольку генные продукты, ассоциирующиеся с хроматином, по-разному регулируются в различных средах, при различных плотностях клеток и во время фазы роста и стационарной фазы. Fis, HU,HF-1, как правило, сильнее экспрессируются в логарифмической фазе, тогда как IHF и Dps имеют более высокие уровни в стационарной фазе. Dps конденсирует ДНК в жидкие биокристаллические комплексы в стационарной фазе для улучшения стрессоустойчивости. Сверхэкспрессия HN-S в течение фазы роста приводит к конденсации ДНК и утрате жизнеспособности. Клетки могут иметь более высокую плазмидную емкость когда ДНК высококомпактизирована. В способе ферментации, индуцируемом ноурзеотрицином (NTC), клетки, находящиеся в фазе роста, обладают меньшей общей емкостью в отношении плазмидной ДНК по сравнению с клетками, находящимися в фазе индукции. Это может являться следствием различий в комбинациях белков хроматина, представленных в фазе индукции, что может обеспечить более высокие уровни, допустимые для плазмиды, по сравнению с плазмидой в фазе роста. Изменения соотношения белков хроматина в течение фазы индукции может увеличить компактизацию плазмиды и несущую емкость. Изменения соотношения белков хроматина в течение фазы индукции также могут увеличить скорости репликации плазмиды. Например, экспрессия с промотора РНКII ориджина р 15 А, но не с промотора рМВ 1 (pBR322) PHKII, подавляется IHF; транскрипция с РНКII p15A увеличивается у мутантов по IHF.Dps и HU представляют собой белки, не специфически связывающиеся с ДНК, HN-S, CbpA и CbpB связываются с изогнутой ДНК. StpA относится к HN-S, с высокой аффинностью связывается с ДНК и также связывается с изогнутой ДНК. Fis, IHF, IciA и seqA специфичны в отношении последовательности. HN-S подавляет транскрипцию со множества промоторов, содержащих изогнутую ДНК. Промотор РНКIIpMBI (pUC и pBR322) содержит polyA и polyT цепи; эти последовательности образуют изогнутую ДНК. Уменьшенные уровни белков хроматина, связывающихся с изогнутой ДНК, подавляющих транскрипцию(например, HN-S) в стационарной фазе, могут быть ассоциированы с увеличенной степенью транскрипции РНКII к РНКI и документально подтвержденным увеличением в стационарной фазе числа копий плазмид. Изменения состава белков хроматина (например, дополнительное уменьшение HN-S), присутствующих во время фазы продуцирования способа ферментации NTC, могут приводить к увеличенному числу копий плазмид pMB1, таких как pUC. Гетерологичные агенты, компактизирующие ДНК, например- 11010836 кислоторастворимые споровые белки видов Bacillus, экспрессирующиеся в E.coli, также могут представлять собой полезные агенты, компактизирующие ДНК, для увеличения выхода плазмиды. Например,экспрессия небольшого кислоторастворимого белка В.subtilis в E.coli вызывает ДНК (Setlow В.,Hand A.R., Setlow P., J. Bacteriol. 173: 1642-1653). Изменения способа также могут улучшать выход посредством воздействия на конденсацию ДНК.Dps регулируется концентрацией магния (Mg); присутствие Dps не приводит в результате к конденсации ДНК; плотноупакованные комплексы кристаллическая ДНК:Dps образуются, когда концентрацияMg падает ниже порогового уровня (обзор в Frenkiel-Krispin D., Levin-Zaidman S., Shimoni E.,Wolf S.G., Wachtel E.J., Arad T., Finkel S.E., Kolter R., Minsky A., 2001, EMBO, J. 20: 1184-1191). Морфологически комплекс напоминает комплекс, индуцируемый путем добавления хлорамфеникола во время стационарной фазы. Добавление в растущие культуры 0,2 мМ спермидина ускоряет конденсацию ДНК в отсутствие Dps. Истощение фосфата оказывает такое же действие, возможно посредством усиленной деградации треонина и аргинина до спермидина (FrenMel-Krispin et al., выше, 2001). Изменения состава ферментационной среды или условий ферментации во время фазы индукции для изменения уровней двухвалентных катионов (например, Mg посредством экзогенного добавления или истощения), или изменение уровня положительно заряженных полиаминов (например, спермидина посредством экзогенного добавления или контроля бактериального синтеза) могут увеличивать выход плазмиды и рассматриваются как изменения среды. Авторы изобретения считают, что дополнительное увеличение выхода может быть достигнуто путем дополнительной компактизации плазмидной ДНК. Это может быть достигнуто путем добавления в подпитку во время процесса ферментации агентов, компактизирующих ДНК (например, полиэтиленимина, спермидина, спермина), или модификаций штамма, увеличивающих продуцирование агентов, компактизирующих ДНК штамма-хозяина, например продуцирование спермина или продуцирование белкаdps. Такие модификации штамма могут представлять собой изменения, которые дают возможность для индукции соответствующих генных продуктов во время процесса ферментации. При практической реализации индуцируемых способов авторы изобретения предполагают использование альтернативных стратегий для поддержания числа копий плазмид в течение фазы роста на низком уровне. Например, в дополнение к выращиванию при низкой температуре существуют другие механизмы уменьшения числа копий, которые могут быть включены в фазу роста. Например, показано, что уменьшение содержания растворенного кислорода во время ферментации уменьшает число копий плазмид (Carnes AE, 2005 BioProcess International 3:9, в печати). Улучшение чистоты конечного продукта. Авторы изобретения предлагают применение обогащенных плазмидой питающих потоков из описанной ферментационной культуры в способах очистки плазмиды, приведенных в качестве примера. Такие способы хорошо известны в уровне техники. Комбинация ферментации с высоким выходом и приведенного в качестве примера способа очистки может обеспечить рентабельные способы дополнительного уменьшения геномной ДНК до уровней, приемлемых для генной терапии и ДНК-вакцинации. Примеры Способ по изобретению дополнительно проиллюстрирован следующими примерами. Эти примеры приведены лишь для иллюстрации и не предполагается, что они каким-либо образом ограничивают объем изобретения. Пример 1. Ферментационные среды NTC3018 и NTC3019. Следующие критерии установлены для оценки оптимизированного способа ферментации для получения плазмидной ДНК: 1) высокий удельный выход плазмиды (1 мг плазмидной ДНК на г клеточной массы); 2) высокий выход биомассы; 3) сохранение высокого уровня сверхспирализованной плазмиды; 4) минимальные проблемы при последующей обработке; 5) соответствие регламентирующим требованиям и 6) сохранение структуры плазмиды (например, отсутствие делеций или других перестановок). Культуральные среды готовили таким образом, чтобы поддерживать высокий удельный выход плазмиды, высокий выход биомассы и высокое качество плазмиды. Среду для периодической ферментации подбирали для уменьшения удельной скорости роста. Пониженная скорость роста ассоциировалась с более высоким числом копий плазмиды и лучшей стабильностью плазмиды. В ходе периодических ферментации с подпиткой скорость роста поддерживали на уровне 0,12 ч-1 путем подпитки лимитирующим питательным веществом. Штамм-хозяин DH5 несет мутации endA1, recA и relA, которые являются существенными для продуцирования плазмиды. Кроме того, все компоненты, использованные в средах,были должным образом охарактеризованы и сертифицированы в отношении отсутствия в них животного продукта. Среды NTC3018 (для периодической ферментации) и NTC3019 (для периодической ферментации с подпиткой) оптимизированы в отношении множества компонентов для периодического способа и периодического способа с подпиткой. Например, для уменьшения скорости роста в качестве источника угле- 12010836 рода используют глицерин, а не глюкозу. Дрожжевой экстракт используют в качестве источника азота. Концентрации металлических микроэлементов и MgSO4 оптимизировали, основываясь на определенных потребностях продуцирующих штаммов E.coli. Пример 2. Культура циклической ферментации с подпиткой с плазмидами, полученными изpBR322, в среде NTC3019. Периодические ферментации с подпиткой осуществляли в ферментаторе New Brunswick BioFlo 110 при 37C. pH контролировали путем автоматического добавления 30% гидроксида аммония или 10% ортофосфорной кислоты. Датчик растворенного кислорода калибровали на 0% путем барботирования газообразного азота и на 100% путем насыщения воздухом. Сосуд аэрировали при 1 WM (объем воздуха/объем ферментатора в минуту) и поддерживали содержание растворенного кислорода на уровне 30% путем пропорционально-интегрального контроля перемешивания. При клеточных плотностях выше приблизительно 20 OD600 также требовалось снабжение О 2 для поддержания 30% насыщения. Посевные культуры получали из единичных выделенных колоний, инокулированных в среду Луриа-Бертани (LB) с 50 мкг/мл канамицина, и выращивали при 37C. Посевные культуры в середине экспоненциальной фазы (0,5-1,5 OD600) использовали для приготовления 1%-ных инокулюмов для ферментатора. В ходе периодического культивирования с подпиткой добавляли питательное вещество с полуопределенным составом в соответствии со стратегией экспоненциальной подпитки с лимитированием по углероду. Кратко, исходное количество углеродного субстрата потребляется во время периодической фазы с удельной скоростью роста макс. После истощения углеродного субстрата начинается периодическая фаза с подпиткой, и автоматически добавляется питательное вещество со скоростью, определяемой следующим уравнением (Carnes, выше, 2005): где= желаемая удельная скорость роста в течение периодической фазы с подпиткой; Хв = концентрация биомассы в конце периодической фазы, г DCW/л;VB = исходный объем жидкой культуры, л;Sf = концентрация лимитирующего субстрата в подпитывающей среде, г/л;Yx/s = коэффициент выхода биомассы из субстрата, г/г;t = время с начала периодической фазы с подпиткой. Как правило, при периодической ферментации с подпиткой в средах NTC3019 с несколькими независимыми устойчивыми к канамицину плазмидами, полученными из pBR322, достигают клеточной плотности 100-120 OD600 или 55-65 г сухой клеточной массы на 1 л (фиг. 1). Выходы плазмид в среднем составляют 260 мг/л и достигают 430 мг/л. Для сравнения, опубликованные выходы ферментации с плазмидами, полученными из pBR322, имеют порядок 3-4 мг/л (Lahijani et al., выше, 1996). Важно, что очень высоки удельные выходы плазмид, как правило от 2,5 до 3,8 мг/л/OD600, что превышает уровни, обнаруженные для других ферментационных сред/способов с использованием плазмид с гораздо более высококопийным ориджином pUC (табл. 3). Выходы экспрессирующих плазмид в показателях удельных выходов мг/л/OD600 указывают на количество плазмиды относительно общей клеточной массы. Высокие удельные выходы очень желательны, поскольку увеличенный выход плазмиды на 1 г бактерий приводит непосредственно к более высокой чистоте конечного продукта.- 13010836 Таблица 3 Сравнение удельных выходов плазмид с известными из публикаций способами ферментации с высоким выходом Данные свидетельствуют о том, что ферментационные среды NTC3019 значительно увеличивают ферментационные выходы плазмид с умеренным числом копий (например, pBR322 с делецией rop) по сравнению со средами и способами, описанными в уровне техники. Этот эффект не является специфичным для плазмид. ДНК, очищенная в результате этих способов, имеет высокое качество, по существу, являясь на 100% сверхспирализованной при отсутствии обнаруживаемой делеции или другой перестановки. Кроме того, с использованием клеток из этого способа осуществляли очистку ДНК в масштабе 1 г, что свидетельствует о том, что ферментации, осуществляемые в средах NTC3019 при периодическом процессе с подпиткой, пригодны для последующей крупномасштабной обработки. Пример 3. Периодическая ферментация в среде NTC3018 с высококопийной плазмидой для генной терапии. Осуществляли периодическое культивирование в среде NTC3018 с плазмидами с ориджином pUC. Использовали следующие плазмиды, содержащие ориджин pUC: 1) pW2.0, представляющая собой производное pUC19, имеющее измененную полилинкерную последовательность; 2) pMaxGFP; 3) pEGFP-C1. Периодические ферментации осуществляли в ферментаторе New Brunswick BioFlo 110 при 37C.pH регулировали путем автоматического добавления 30% гидроксида аммония или 10% ортофосфорной кислоты. Датчик растворенного кислорода калибровали на 0% путем барботирования газообразного азота и на 100% путем насыщения воздухом. Сосуд аэрировали при 1 WM (объем воздуха/объем ферментатора в минуту) и поддерживали содержание растворенного кислорода на уровне 30% путем пропорционально-интегрального контроля перемешивания. При клеточных плотностях выше приблизительно 20OD600 также требовалось снабжение О 2 для поддержания 30% насыщения. Посевные культуры получали из единичных выделенных колоний, инокулированных в среду Луриа-Бертани (LB) с 50 мкг/мл канамицина или 100 мкг/мл ампициллина, и выращивали при 37 С. Посевные культуры в середине экспоненциальной фазы (0,5-1,5 OD600) использовали для приготовления 1%-ных инокулюмов для ферментатора. Все ферментации осуществляли при 37C. Для pW2.0 копирование плазмиды индуцировали путем выращивания при 42C в поздней фазе ферментации. Периодические ферментации с плазмидами pUC позволяли достичь плотностей клеток лишь 16-57 OD600. Тем не менее, показатели удельного выхода плазмид являются обнадеживающими. Окончательные показатели для pEGFP-Cl составляли клеточную плотность 56 OD600 и выход 163 мг плазмиды/л (2,9 мг/л/OD600), для pMaxGFP - клеточную плотность 16 OD600 и выход 84 мг плазмиды/л (5,3 мг/л/OD600) и для pW2.0 - клеточную плотность 57 OD600 и выход 230 мг плазмиды/л (4,0 мг/л/OD600; фиг. 2).- 14010836 ДНК, очищенная в результате этих способов, имеет высокое качество, по существу, являясь на 100% сверхспирализованной при отсутствии обнаруживаемой делеции или другой перестановки. Кроме того, с использованием клеток из этого способа осуществляли очистку ДНК в масштабе 0,5 г, что свидетельствует о том, что ферментации, осуществляемые в среде NTC3018 при периодическом процессе,пригодны для последующей крупномасштабной обработки. Пример 4. Периодическая ферментация с подпиткой в средах NTC3019 с высококопийными плазмидами для генной терапии. Для оценки периодической ферментации с подпиткой была выбрана плазмида gWiz GFP (GeneTherapy Systems), представляющая собой производное вектора Vical VR1 012, содержащее ген зеленого флуоресцентного белка (GFP). Она представляет собой широко используемую плазмиду с устойчивостью к канамицину (kanR) для ДНК вакцины, содержащую ориджин pUC, имеющую размер 5757 п.о. Плазмиду gWiz GFP (Gene Therapy Systems) трансформировали в E.coli DH5. pMaxGFP также тестировали в периодических культурах с подпиткой; похожие результаты получены для обеих плазмид. Столкнулись с двумя проблемами при использовании сред NTC3019 для продуцирования этих плазмид. Первую проблему обнаружили, когда выращивали культуры плазмиды gWiz GFP при 37C, что было успешно осуществлено для плазмид, полученных из pBR322. При культивировании плазмид pUC клеточный рост останавливался приблизительно при 15 OD600. Флуоресцентная микроскопия продемонстрировала обширную филаментацию, указывающую на ингибирование клеточного деления. Это является летальным, поскольку филаменты в конечном итоге лизируются (Arends S.J.R., Weiss, D.S. 2004, J.Bacteriol. 186: 880-884). Например, фиг. 3A демонстрирует периодическую ферментацию с подпиткой с плазмидой gWiz GFP. Клеточный рост замедлялся и, по-видимому, входил в стационарную фазу преждевременно при 15 OD600. Анализ выхода плазмиды указывал на увеличенный удельный выход плазмиды,составлявший 2,7 мг/л/OD600, когда клеточный рост начинал останавливаться. Плазмиды pUC содержат температурочувствительную точечную мутацию, которая может демонстрировать 30-40-кратное увеличение числа копий при 42C по сравнению с 30C (Lin-Chao et al., 1992). Температуру затем уменьшали до 33C в попытках уменьшить число копий плазмиды и таким образом снизить метаболическую нагрузку в клетках, после чего уровень плазмиды уменьшался до 1,6 мг/л/OD600, и клеточный рост возобновлялся. Интересно, что удельный выход плазмиды вновь постепенно увеличивался, и рост входил в стационарную фазу приблизительно при 60 OD600 вместо ожидавшегося роста до более чем 100 OD600, даже несмотря на то, что продолжали добавлять питательное вещество. Фиг. 3 Б демонстрирует клеточную филаментацию, возникающую при 37C. После уменьшения температуры до 33 С образец растущих клеток демонстрировал гораздо меньшую филаментацию. Возможное объяснение заключалось в том, что клеточная популяция никогда полностью не восстанавливалась от филаментации и утрата жизнеспособности начиналась при 37C. Для проверки этого предположения осуществляли две последовательные периодические ферментации с подпиткой с той же самой плазмидой полностью при 33C. При обеих ферментациях культура достигала максимума при клеточных плотностях менее 60 OD600. Данные по выходу биомассы и ДНК для этих ферментаций указывают на снижение удельной скорости роста и резкое увеличение удельного выхода плазмиды перед ингибированием клеточного роста. Стремительное увеличение содержания плазмиды до такого высокого уровня было неожиданным и накладывало метаболическую нагрузку на клеточную популяцию, что могло являться причиной пониженной скорости роста. Однако также было продемонстрировано, что снижение скорости роста часто ведет к увеличению числа копий плазмиды (Satyagal V.N., Agrawal P. 1989 Biotechnol. Bioeng. 33: 1135-1144),(Seo J.H., Bailey J.E. 1985, Biotechnol. Bioeng. 27: 1668-1674). He ясно, вызывает ли неожиданно повышенный удельный выход плазмиды снижение скорости роста, или наоборот, или каждый из этих факторов вызывает другой комбинированно. Пример 5. Индуцибельный периодический способ с подпиткой для продукции высококопийных плазмид в средах NTC3019 с высоким выходом. Основываясь на результатах ферментации при 33 и 37C (пример 4), была разработана стратегия для преодоления неожиданного увеличения плазмиды, обнаруживаемого при периодическом режиме с подпиткой для плазмид, имеющих ориджин pUC. Плазмиду gWiz GFP в DH5 использовали в индуцибельном периодическом способе с подпиткой. Периодическую ферментацию с подпиткой в средеNTC3019 осуществляли в соответствии с изложенным в примере 4, за исключением того, что культуру выращивали при 30C до 60 OD600, и в этот момент температуру увеличивали до 37C. Неожиданные результаты представлены на фиг. 4 А. Рост при 30C вплоть до 60 OD600 устранял проблему остановки роста, и культура в конечном счете превосходила 100 OD600 с общим выходом плазмиды 670 мг/л. ДНК,очищенная из образцов, полученных этим способом, имеет высокое качество, по существу, являясь на 100% сверхспирализованной при отсутствии обнаруживаемой делеции или другой перестановки. Выходы плазмиды перед повышением температуры остаются низкими в течение фазы роста, оставаясь ниже 2 мг/л/OD600. Это противоречит результатам ферментации при 33 или 37C. Важно, что удельные выходы плазмиды после сдвига температуры являются очень высокими, вплоть до- 15010836 6,5 мг/л/OD600, значительно превышая уровни, наблюдаемые для других сред/способов ферментации(табл. 3). Ферментация при 30C в течение фазы роста и сдвиг до 42C приводили в результате к продуктивным выходам 1,1 г/л (11 мг/л/OD600) для gWiz GFP (фиг. 4 Б). Плато продуктивности не ассоциируется с обширной гибелью клеток, поскольку большая часть клеток остается живой. Модификация сред NTC3019 (четырехкратное увеличение по глицерину, дрожжевому экстракту и магнию в средах для периодической ферментации) для уменьшения длительности периодической фазы с подпиткой (путем продления периодической фазы до более высоких значений OD600) также приводила к похожим высоким выходам плазмиды после индукции при 42C, демонстрируя, что периодическая фаза с подпиткой может быть начата при более высоких значениях OD600 без утраты индукции плазмиды. Множество различных плазмид с различными цепями ориджина pUC, включающих различные гены устойчивости к антибиотикам и расположения прокариотических элементов, продуцировали с выходами больше чем 0,5 г/л в средах NTC3019, используя индуцибельный способ от 30 до 42C с DH5. Эти результаты демонстрируют, что индуцибельный способ не является специфическим для конкретной плазмиды. Плазмиду gWiz-GFP также продуцировали с выходами больше чем 500 мг/л в средах NTC3019, используя индуцибельный способ от 30 до 42 С с клеточной линией DH1. Этот результат демонстрирует,что индуцибельный способ не специфичен для конкретного штамма E.coli. Кроме того, осуществляли очистку ДНК в масштабе 1 г, используя клетки из этого способа, что свидетельствует о том, что индуцибельные ферментации, осуществляемые в средах NTC3019 при периодической ферментации с подпиткой, пригодны для крупномасштабной последующей обработки. Выходы экспрессирующих плазмид в величинах удельных выходов (мг/л/OD600) указывают на количество плазмиды относительно общей клеточной массы. Описанный здесь индуцибельный периодический способ с подпиткой поддерживал низкие (меньше 2 мг/л/OD600) уровни плазмид в течение фазы роста способа и обеспечивал беспрецедентно сверхвысокую продукцию плазмид (6-11 мг/л/OD600) после продуцирования биомассы. Высокие удельные выходы очень желательны, поскольку увеличенный выход плазмиды на 1 г бактерий ведет непосредственно к более высокой чистоте конечного продукта. Эти результаты демонстрируют общую полезность способов периодической ферментации с подпиткой и периодической ферментации по изобретению для улучшения продуктивности и качества плазмидной ДНК. Таким образом, способы продуцирования по изобретению обеспечивают способы для улучшенного продуцирования плазмид. Хотя вышеприведенное описание содержит много конкретного, его не следует рассматривать как ограничение изобретения, а скорее как пример одного из его предпочтительных воплощений. Возможно множество других вариантов. Например, индуцибельный периодический способ с подпиткой может быть интегрирован с периодическим способом таким образом, что ферментацию осуществляют в средах для периодической ферментации NTC3018 до истощения питательных веществ, после чего одновременно инициируют среды для периодической ферментации с подпиткой NTC3019 и индукцию. В этом воплощении с некоторыми плазмидами фаза роста может быть осуществлена при температуре вплоть до 37C,поскольку число копий плазмиды будет уменьшаться при более высокой скорости роста. Оптимальная температура для того, чтобы дать возможность для клеточного деления в течение фазы роста и сохранения индуцируемости плазмиды в течение периодической фазы с подпиткой, может быть определена специалистом в данной области техники. Соответственно, объем изобретения должен быть определен не по проиллюстрированным воплощениям, а по формуле изобретения и ее законным эквивалентам. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ продуцирования ковалентно замкнутой сверхспирализованной плазмидной ДНК путем периодической ферментации с подпиткой, включающий стадии: А) выращивания бактериальных клеток, содержащих плазмиду, космиду или бактериальный искусственный хромосомный репликон, при пониженной температуре в течение периодической фазы с подпиткой; Б) ограничения скорости роста в течение периодической фазы с подпиткой путем ограничения питания; В) индукции продуцирования плазмиды путем сдвига температуры в сторону повышения и Г) продолжения роста при повышенной температуре для накопления плазмидного продукта; посредством чего указанный способ увеличивает выход плазмиды. 2. Способ по п.1, где пониженная температура в течение периодической фазы с подпиткой представляет собой температуру, определенную для поддержания выхода плазмиды меньше приблизительно 2 мг/л/OD600. 3. Способ по п.1, где пониженная температура в течение периодической фазы с подпиткой составляет приблизительно 30C. 4. Способ по п.1, где сдвиг температуры находится в диапазоне 36-45C.- 16010836 5. Способ по п.1, где плазмида содержит ориджин репликации, полученный из ColE1. 6. Способ по п.1, где плазмида содержит ориджин репликации pMB1, содержащий мутацию pUC G в A. 7. Способ по п.1, где плазмида получена на основе VR1012. 8. Способ по п.1, где ферментационная среда представляет собой, по существу, среду полуопределенного состава с глицерином. 9. Способ ферментационного продуцирования ковалентно замкнутой сверхспирализованной плазмидной ДНК, включающий стадии: А) выращивания бактериальных клеток, содержащих полученные из pBR322 плазмиду, космиду или бактериальный искусственный хромосомный репликон, в среде для периодической ферментации с подпиткой; Б) ограничения скорости роста в течение периодической фазы с подпиткой путем ограничения питания и В) продолжения роста для накопления плазмидного продукта; посредством чего указанный способ увеличивает выход плазмиды. 10. Способ по п.9, где ферментационная среда представляет собой, по существу, среду полуопределенного состава с глицерином.
МПК / Метки
МПК: C12P 19/34
Метки: способ, плазмидной, днк, ферментации
Код ссылки
<a href="https://eas.patents.su/20-10836-sposob-fermentacii-plazmidnojj-dnk.html" rel="bookmark" title="База патентов Евразийского Союза">Способ ферментации плазмидной днк</a>
Предыдущий патент: Лекарственное средство для лечения рака
Следующий патент: Повышение выхода экспрессии протеина в системах бесклеточного синтеза протеинов путём добавления антипенных присадок
Случайный патент: Способ определения и/или контроля расстояния до объекта, а также устройство для его осуществления