Способ блокировки развития, или снижения тяжести, или проявлений заболевания, “трасплантат против хозяина”
Формула / Реферат
1. Способ блокировки развития, или лечения, или снижения тяжести, или проявлений заболевания "трансплантат против хозяина", или неудачной трансплантации органа в результате отторжения трансплантата у животного, подразумевающий стадию введения указанному животному фармацевтической композиции, которая содержит терапевтически эффективное количество моноклонального антитела, направленного против полипептида TWEAK, являющегося членом семейства белков TNF, и фармацевтически приемлемый носитель.
2. Способ по п.1, в котором указанное моноклональное антитело, направленное против полипептида TWEAK, выбрано из группы, включающей в себя
(a) химерное антитело;
(b) гуманизированное антитело и
(c) рекомбинантное антитело.
3. Способ по п.1, в котором животное является млекопитающим.
4. Способ по п.3, в котором млекопитающее является человеком.
5. Способ по п.1, в котором указанное заболевание "трансплантат против хозяина" или неудачная трансплантация органа вызваны иммунным ответом, опосредованным клетками Th1.
6. Способ по п.1, в котором указанное заболевание "трансплантат против хозяина" или неудачная трансплантация органа вызваны иммунным ответом, опосредованным клетками Th2.
7. Способ по п.1, в котором указанное заболевание "трансплантат против хозяина" или неудачная трансплантация органа вызваны комбинацией иммунных ответов, опосредованных клетками Th1 и Th2.
Текст
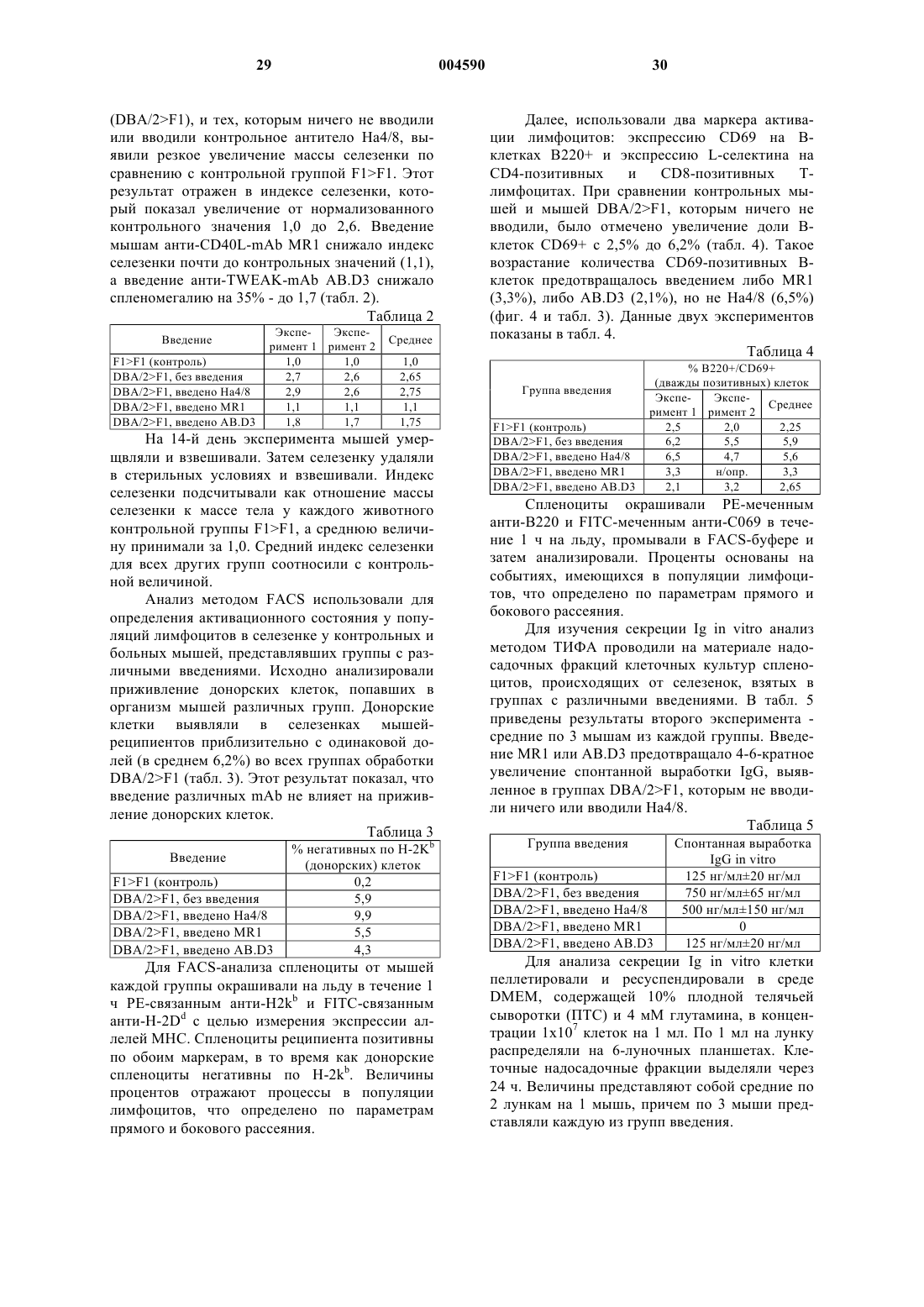
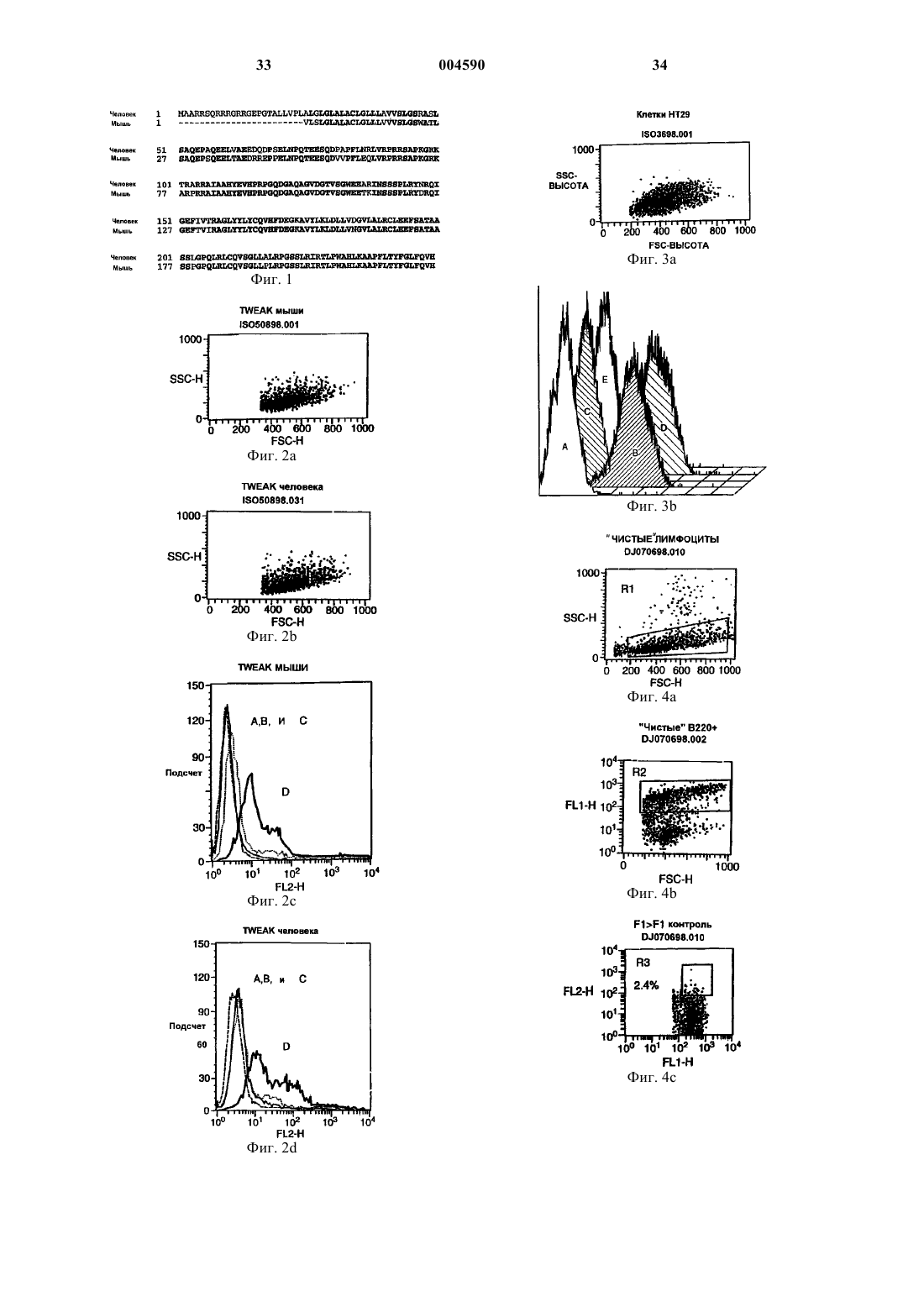
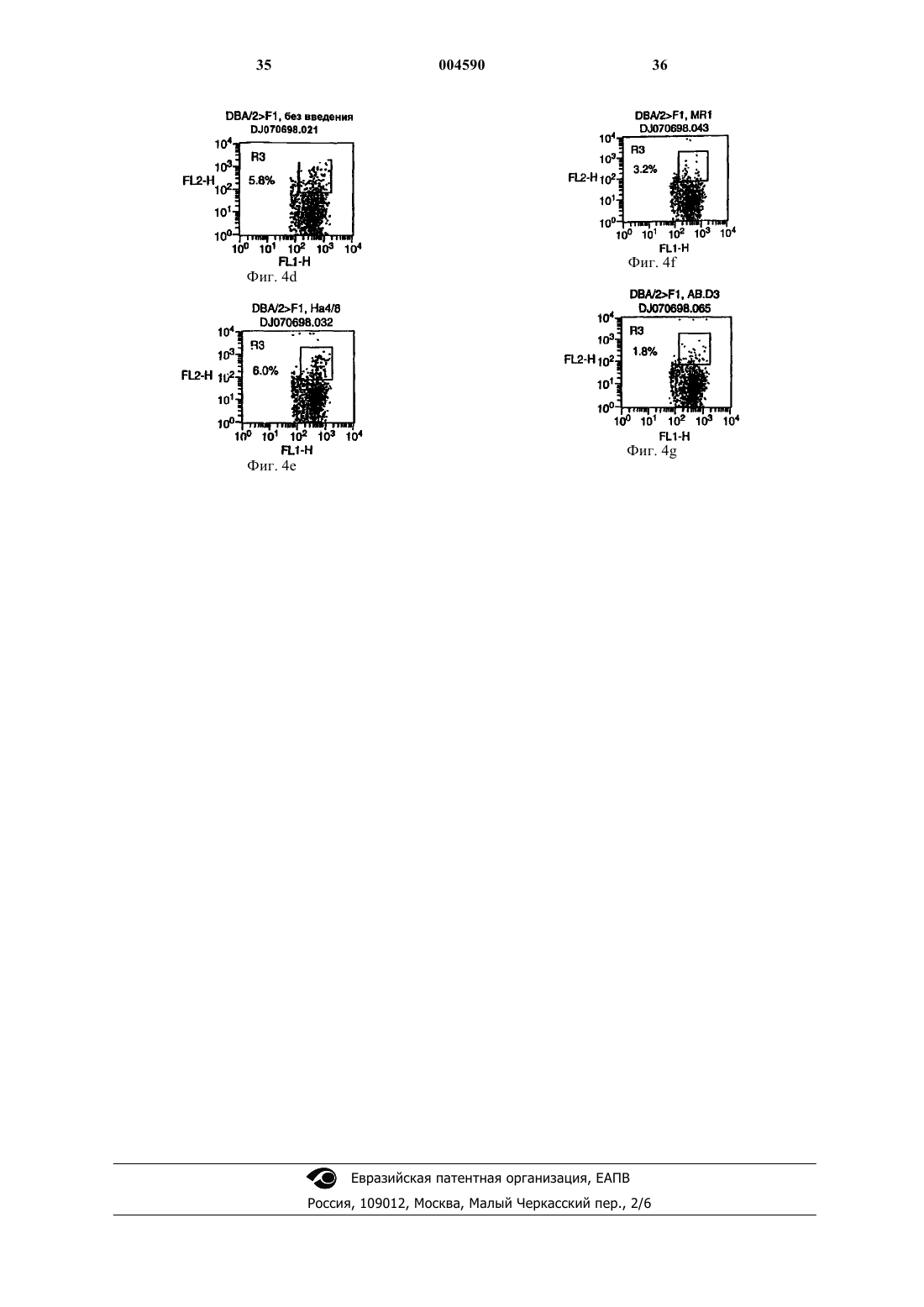
1 Область техники, к которой относится изобретение Настоящее изобретение касается композиций и способов, включающих в себя реагенты,которые связываются с новым белком TWEAK,а также использования TWEAK-связывающих реагентов для предотвращения развития иммунологических заболеваний.TWEAKсвязывающие реагенты включают в себя моноклональные антитела, которые используются здесь для предотвращения развития хронического синдрома трансплантат против хозяина,растворимые химерные белки TWEAKpeцeптop-Ig или другие молекулы, которые модифицируют связывание TWEAK с его рецептором (рецепторами). Другие варианты настоящего изобретения включают в себя реагенты, которые связывают рецептор(ы) TWEAK с целью модифицирования их активности или модифицирования внутриклеточной передачи сигналов от рецептора(ов) TWEAK. Предпосылки изобретения Иммунологические заболевания представлены широкой группой заболеваний и патологий, включая аутоиммунные заболевания, острые и хронические воспалительные заболевания, отторжение органов при пересадке, синдром (реакция) трансплантат против хозяина(СТПХ), злокачественные новообразования лимфоидных клеток, септический и другие формы шока, снижение иммунитета, например,при ВИЧ-инфекциях и иммунодефицитных синдромах (SCID), и утрата иммунного ответа на рост опухоли. Многие иммунологические заболевания опосредованы аномальными или неконтролируемыми реакциями на антиген. Аутоиммунные заболевания являются результатом неправильного ответа иммунной системы на собственные антигены, что приводит к повреждениям клеток и тканей. СТПХ развивается тогда, когда донорные клетки костно-мозгового трансплантата(КМТ) реагируют на антигены реципиента (т.е. больного). Отторжение пересаживаемых органов происходит тогда, когда иммунная система больного реагирует на антигены, происходящие от пересаженного органа. Острые воспалительные заболевания, такие как гипераллергические состояния и шок, являются следствием неконтролируемого иммунного ответа на опосредующие антигены. Для зависимых от Т-лимфоцитов иммунных ответов необходимо, чтобы Т-клетки распознавали антиген. Например, СТПХ обусловлен комплексным взаимодействием между Тклетками донора и клетками иммунной системы реципиента. Инициирующим событием является распознавание Т-клетками донора не своих антигенов, т.е. антигенов реципиента. Их называют аллоантигенами. Распознавание аллоантигенов данными донорными клетками обусловливает выработку иммунорегуляторных и вос 004590 2 палительных цитокинов и хемокинов, которые запускают и усиливают иммунный ответ донора против реципиента. Такое заболевание может развиваться либо в острой, либо в хронической форме, что зависит от регуляции комплексных сетей цитокинов, которые контролируют тип развивающегося иммунного ответа. Иммунные ответы могут быть охарактеризованы как Th0,Th1 или Th2, что зависит от (1) природы цитокинов и хемокинов, вырабатываемых активированными Т-лимфоцитами в процессе развития ответа, и (2) природы цитокинов и хемокинов,выработанных вспомогательными и другими клетками в ходе развития ответа. Примерами важных для иммунных ответов клеток, помимо Т-клеток, являются В-лимфоциты, дендритные клетки, моноциты и макрофаги, фолликулярные дендритные клетки и эндотелиальные клетки. Вместе выработанные цитокины приводят к дифференцировке различных типов клеток, а выработанные хемокины обусловливают перемещение и локализацию клеток. Ответы Th0 характеризуются кратковременной стимуляцией ранее непростимулированных (необученных) Т-лимфоцитов. Т-клетки Th0 вырабатывают средние количества ряда цитокинов, а именноIL-2 и TNF. Повторно или хронически простимулированные клетки Th0 могут дифференцироваться либо в клетки Th1, либо в клетки Th2,что зависит от ряда факторов. Такими факторами являются, не ограничиваясь ими, выработка цитокинов вспомогательными клетками, уровень активности Т-клеточных рецепторов и природа вторичных сигналов, получаемых, например, опосредованно через одновременно стимулируемый рецептор CD28. В частности,действие на активированные Т-клетки цитокинаIL-12, выработанного в основном активированными макрофагами, поддерживает дифференцировку в Т-клетки Th1, в то время как действиеIL-4 и IL-10 поддерживает дифференцировку в Т-клетки Th2. Т-клетки Тh1 вырабатывают цитокины, такие как IL-2 и -интерферон, которые ассоциированы с воспалительными ответами, Тклеточной цитотоксичностью и активацией макрофагов. Т-клетки Тh1 реагируют на хемокины, которые привлекают клетки в области воспаленной ткани, такие как Mip-1, MIP-1,RANTES, IP-10 и MIG. Поскольку цитотоксичные Т-клетки и активированные макрофаги активны в отношении элиминации поврежденных или инфицированных клеток, то ответ Тh1 отвечает за контроль иммунного ответа на внутриклеточные патогены. Важно то, что выработка хемоаттрактантных хемокинов Тh1, такая как выработка IP-10 и MIG макрофагами и эндотелиальными клетками, непосредственно регулируется -интерфероном, который является прототипным хемокином, вырабатываемым Тклетками Тh1. Таким образом, петли обратной 3 связи могут образовываться между активированными Т-клетками и их окружающей средой,которые способствуют развитию конкретного типа ответа в конкретный момент времени и в конкретном месте. Т-клетки Th2 вырабатывают цитокины, такие как IL-4, IL-5, IL-6 и IL-10, которые поддерживают развитие гуморальных иммунных ответов, включая те, для которых необходима выработка IgE, IgA и IgG. Данные иммуноглобулиновые ответы направляются опосредованной Т-клетками активацией В-клеток, которые переключают свой Ig-фенотип со связанных на поверхности IgM и IgD на секретируемый иммуноглобулин. Секретированные иммуноглобулины в норме функционируют как регуляторы инфекции патогенов в циркуляции (IgG),на поверхности слизистых оболочек, таких как в кишечнике и ротовой полости (IgA) и в дыхательном тракте (IgE). Избыточная выработка Ig может приводить к заболеванию, например, при СКВ (IgG и IgA), аллергической (1-го типа) гиперчувствительности (IgE) и СТПХ (IgG, IgA иIgE). Т-клетки Th2 также поддерживают активацию эозинофилов и тучных клеток, которыми могут быть опосредованы острые ответы на патогены, например, в дыхательном тракте. Тклетки Th2 реагируют на хемокины, такие как эотаксин и MDC, выработка которых непосредственно регулируется интерлейкином-4 - прототипным цитокином, вырабатываемым клеткамиNK1.1 и активированными Т-лимфоцитами. Взаимодействие Т-клеток с В-клетками является сложным и тщательно контролируемым процессом. Для запуска процесса активации В-клетки должны получить антигенный сигнал через В-клеточный рецептор антигена(мембранный Ig). Во-вторых, В-клетки должны получить специфичные сигналы, зависимые от контакта и независимые от контакта, от активированных Т-клеток. При необходимости зависимый от контакта сигнал обеспечивается за счет связывания CD40L на Т-клетках с CD40 на В-клетках. При необходимости независимый от контакта сигнал передается с помощью IL-4,секретированного активированными Т-клетками и клетками NK1.1, связывающегося с рецептором IL-4 на В-клетках. Данные сигналы, повидимому, имеют место в пределах Тклеточных областей вторичных лимфоидных органов, таких как селезенка. Селезенка, лимфатические узлы, миндалины, пейеровы бляшки и другие вторичные и третичные лимфоидные органы включают в себя отчетливо очерченные микроанатомические области, в пределах которых обычно остаются Т- и В-клетки. Все лимфоциты мигрируют из крови или из лимфы в Тклеточные области указанных органов - вначале путем преодоления слоев эндотелиальных клеток, таких как венулы с плотным эндотелием в лимфатических узлах и пейеровых бляшках и слой эндотелиальных клеток маргинального 4 синуса селезенки. Затем В-клетки перемещаются в В-клеточные области, известные как Вклеточные фолликулы. В-клетки, которые проходят через Т-клеточную область, но не являются активированными, покидают фолликулы спустя несколько дней. Активированные Вклетки претерпевают процесс дифференцировки. Некоторые активированные В-клетки, известные как плазмоциты, секретируют большие количества антиген-специфичного низкоаффинного антитела типа IgM или IgG. Обычно такие В-клетки появляются почти сразу после индукции иммунного ответа и перемещаются в красную пульпу селезенки и другие анатомические области, где они существуют в течение нескольких дней, секретируя антитела. Другие активированные В-клетки дифференцируются в пределах участка фолликула, известного под названием вторичного фолликула, или герминативного центра. Герминативные центры образуют вокруг себя сеть специализированных антиген-сохраняющих клеток, называемых фолликулярными дендритными клетками (ФДК), которые, как считается, обеспечивают представление антигена, чтобы направлять или уточнять реакцию герминативного центра. В-клетки в составе герминативного центра переключают свой иммуноглобулиновый фенотип и претерпевают аффинное созревание, в результате чего они проявляют высокий уровень аффинности в отношении своего антигена-мишени. В норме антигеном-мишенью является чужеродный антиген, хотя при таких заболеваниях как хронический СТПХ и аутоиммунные заболевания иммуноглобулины распознают собственные антигены. Наконец, В-клетки покидают фолликулы, перемещаются обратно через Тклеточные области и покидают орган за счет эфферентной циркуляции в кровяное русло. В-клетки, которые претерпели полную дифференцировку, так, чтобы экспрессировать высокоаффинные Ig, известны как бластные клетки, и они покидают В-клеточные фолликулы, чтобы приобрести местожительство в различных других средах, включая область красной пульпы в селезeнке, костный мозг, печень или клеточные слои слизистых оболочек,выстилающих дыхательный тракт и кишечник. Некоторые из этих полностью дифференцированных В-клеток известны как клетки памяти, и они могут существовать в течение длительного времени, будучи готовыми ответить на тот же самый антиген, если он появится вновь. Так как В-клетки перемещаются с места на место в пределах лимфоидных органов, то им необходимы специфические сигналы, которые бы направляли их, и специфические сигналы,обеспечивающие их жизнеспособность. Например, множественные сигналы необходимы для поддержания организации В-клеточных фолликулов в селезенке. Они включают в себя взаимодействие лиганда ВСА с хемокиновым ре 5 цептором BLR-1, взаимодействие TNF с TNFR55 и взаимодействие LT с рецептором LT-R(обзор ChaplinFu, 1998, Current Opin. Immunol., 10, 298-297). Мыши, которые дефицитны по любому из таких молекулярных механизмов,утрачивают целостность В-клеточных фолликулов в селезенке. Более того, все подобные гендефицитные мыши также утрачивают способность претерпевать реакции герминативных центров в селезенке. Разрушение других молекулярных механизмов нарушает только реакции герминативных центров. Например, у мышей,дефицитных по CD40L, В-клеточные фолликулы поддерживаются, а герминативные центры не образуются. Для В-клеток в пределах среды герминативного центра необходимы сигналы с участием CD40 для обеспечения выживаемости и для негативной регуляции IgM и переключения экспрессии на Ig. В-клетки перемещаются не только в пределах фолликула и герминативного центра, но также покидают фолликул после активации и перемещаются в другие области организма. Вклетки памяти можно обнаружить в костном мозге, а В-клетки, которые экспрессируют IgA,специфическим образом перемещаются к клеточным слоям кишечника и других областей слизистых оболочек. Предположительно другие сигналы направляют активированные Т-клетки к специфическим сайтам в пределах и между компартментами лимфатической системы. Например, цитотоксическая Т-клетка может мигрировать в сайт инфекции или иной очаг антигенной стимуляции с тем, чтобы обнаружить и лизировать свои мишени. Параметры всех сигналов, которые направляют Т- и В-клетки между их микроанатомическими локализациями,пока точно не установлены. Однако считается,что организация Т- и В-клеточных ответов на антиген происходит с участием множественных механизмов и во вторичных лимфоидных органах, и в областях инфекции или воспаления. СТПХ является хорошо изученным примером иммунного ответа, направляемого антигенами. СТПХ часто приводит к фатальным последствиям у больных после пересадки костного мозга (ПКМ). Заболевание может протекать в острой или в хронической форме. Острые и хронические формы СТПХ являются примерами-прототипами развития антиген-специфичных ответов Th1 и Th2, соответственно. Острая форма заболевания имеет место в первые 2 месяца после ПКМ и характеризуется повреждениями кожи, кишечника, печени и других органов, опосредуемыми донорскими цитотоксичными Т-клетками. Хроническая форма заболевания проявляется существенно позже(более 100 дней после ПКМ) и характеризуется сверхвыработкой иммуноглобулина (Ig), включая аутоантитела, и повреждениями кожи, почек и других органов, обусловленными отложениемIg. Развитие острого СТПХ является показа 004590 6 тельным и позволяет предсказать последующее развитие хронического СТПХ. Таким образом, у одного и того же больного могут развиться оба заболевания, одно за другим. Приблизительно у 50% всех больных с ПКМ развивается либо острый, либо хронический СТПХ. Примерно у 90% больных с СТПХ происходит развитие хронического СТПХ. В настоящее время нет успешных способов лечения хронического СПТХ в отношении большинства больных. СТПХ можно смоделировать на мышах с использованием режимов пересадки клеток от родителей потомкам в F1. В модели, описываемой здесь, спленоциты от мышей линии DBA2 инъецируют внутривенно мышам(DBA2xC57Bl/6)F1, которые были обозначены как B6D2F1. Инъецированные спленоциты составляют трансплантат, а донором этого трансплантата являются мыши линии DBA2. МышьF1, которая получает трансплантат, является реципиентом. Присутствующие в трансплантате донорские Т-клетки распознают половину маркеров МНС (гаплотипы) на клетках реципиента как чужеродные, потому что они происходят от другого родителя -С 57 В 1/6. Это индуцирует ответ донорских Т-клеток против реципиента,что и приводит к СТПХ. Когда родительские спленоциты DBA/2 инъецируют реципиентуB6D2F1, развивается хронический СТПХ. Напротив, когда спленоциты С 57 В 1/6 инъецируют реципиенту B6D2F1, развивается острый СТПХ. Хотя остается неясным, какие механизмы лежат в основе развития различных заболеваний при применении данных двух вариантов инъекций,считается, что цитокины, экспрессируемые клетками, находящимися в спленоцитарном трансплантате DBA/2, способствуют развитию хронического СТПХ, в то время как цитокины,экспрессируемые клетками, входящими в состав спленоцитарного трансплантата С 57 В 1/6, способствуют развитию острого СТПХ. Реагенты,которые нарушают взаимодействие Т-клеток с антигенпредставляющими клетками (например,дендритными клетками, макрофагами, Вклетками - АПК), эффективно предотвращают и острый, и хронический СТПХ. В ряде доказательных подходов подтверждается, что острый СТПХ является Th1 опосредованным заболеванием (KrengerFerrara, 1996, Immunol. Res., 15, 50-73; Williamsonet al., 1996, J. Immunol., 157, 689-699). Цитотоксическая активность СD4-позитивных и CD8 позитивных Т-клеток, нативных клетоккиллеров (NK) и активированных гранулоцитов,таких как макрофаги, является точно установленным следствием Th1-опосредованного Тклеточного ответа и проявляет отчетливую зависимость от экспрессии IL-2 и -интерферона,которые являются цитокинами, типичными дляTh1. Такая цитотоксичность является четкой характеристикой острого СТПХ. Более того,реагенты, которые блокируют ключевые цито 7 кины, вовлеченные в дифференцировку Тклеток Th1, такие как моноклональные антитела к IL-2 и IL-12, предотвращают развитие острого СТПХ. Цитотоксичность может быть непосредственно клеточной (например, за счет фагоцитоза клетками реципиента) или опосредованной действием секретируемых цитокинов, таких какTNF, которые могут индуцировать апоптоз, т.е. гибель клеток. Последствия донорской антиреципиентной цитотоксичности можно наблюдать различными способами. Во-первых, лимфоциты реципиента быстро разрушаются, в результате чего у мышей с острым СТПХ прогрессирует иммунодефицит. Во-вторых, донорские лимфоциты в составе трансплантата попадают в селезенку реципиента, и их цитотоксическая активность может быть непосредственно измерена invitro путем получения клеточных линий, экспрессирующих антигены донора, которые могут быть распознаны (в качестве чужеродных) донорскими клетками. Например, клеточные линии, экспрессирующие подходящие антигены,могут быть помечены радиоактивным изотопом хрома-51. Выход этого радиоактивного изотопа в культуральную среду является свидетельством гибели помеченной клетки. В-третьих, заболевание становится летальным при разрушении дополнительных тканей и клеточных популяций, и, следовательно, выживаемость является измеримым показателем заболевания. По-видимому, хронический СТПХ является заболеванием, опосредованным Т-клеткамиTh2 (De Wit et al., 1993, J. Immunol., 150, 361366). В мышиной модели развитие заболевания зависит от Тh2-цитокина - IL-4, и оно может быть блокировано воздействием моноклонального антитела к IL-4. Такая обработка предотвращает экспансию донорских В-клеток и сопутствующую сверхвыработку Ig. Развитие СТПХ может быть прослежено различными путями. Экспансия популяций Т-клеток донора и В-клеток реципиента может быть измерена с помощью индекса селезенки, являющегося отношением массы селезенки к массе тела, соотнесенным с параметрами контрольных мышей(без заболевания). Активация В-клеток у больных мышей может быть определена с помощью анализа маркеров В-клеточной активации. Наконец, проявления В-клеточной активации можно видеть в уровнях Ig в циркуляции (например, в сыворотке) или воспроизвести в культурах спленоцитов реципиента, взятых через несколько недель после индукции заболевания. Циркулирующие Ig у больных животных будут включать аутоантитела. В конечном счете больные животные не выдерживают недостаточности почек и других органов из-за накопления отложений Ig, и, следовательно, выживаемость является соответствующей мерой активности заболевания. Авторы изобретения с иcпользованием мышиной модели хронического СТПХ показа 004590 8 ли, что моноклональное антитело, специфичное в отношении TWEAK, эффективно и специфически предотвращает симптомы развития СТПХ. Предотвращение развития хронического СТПХ показано как снижение индекса селезенки, утрата маркеров активации В-клеток реципиента и снижение выработки Ig у животных,которым вводили aнти-TWEAK-aнтителo. Краткое содержание изобретения В настоящем изобретении представлены способы предотвращения развития или лечения,или снижения тяжести или проявлений иммунологического заболевания у животного, включающие в себя введение фармацевтической композиции, которая содержит терапевтически эффективное количество средства, блокирующего TWEAK, и фармацевтически приемлемый носитель. Соединение может быть антителом,специфичным в отношении лиганда TWEAK; антителом, специфичным в отношении рецептора TWEAK; средством, которое модифицирует связывание лиганда TWEAK с рецепторомTWEAK; средством, которое модифицирует кластеризацию рецепторов клеточной поверхности; и средством, которое способно прерывать внутриклеточную передачу сигнала от рецептора TWEAK. В предпочтительном варианте антитело является моноклональным антителом. В более предпочтительном варианте моноклональное антитело специфично в отношении лиганда клеточной поверхности TWEAK. Животное может быть млекопитающим и может быть человеком. Средство, блокирующее TWEAK,может являться растворимым рецепторомTWEAK, включающим в себя домен связывания лиганда, который способен избирательно связываться с поверхностным лигандом TWEAK. В одном варианте растворимый рецептор TWEAK может включать в себя домен иммуноглобулинаIgG человека. В предпочтительном варианте домен иммуноглобулина IgG человека содержит участки, ответственные за специфичное связывание антигена. Далее изобретение охватывает способ подавления иммунного ответа у животного, включающий в себя введение фармацевтической композиции, которая содержит эффективное количество средства, блокирующего TWEAK, и фармацевтически приемлемый носитель. Иммунный ответ может являться иммунным ответом, опосредуемым клетками Th1 или Th2, или ими обеими. Также изобретение охватывает композицию, содержащую терапевтически эффективное количество средства, блокирующего TWEAK, и фармацевтически приемлемый носитель. Краткое описание чертежей На фиг. 1 показано сопоставление последовательностей растворимых рекомбинантных белков TWEAK мыши и человека. На фиг. 2 показаны данные анализа методом FACS (сортировка клеток с возбуждаемой 9 флуоресценцией) связывания анти-TWEAKmAb AB.D3 хомяка с клетками EBNA293, экспрессирующими белок TWEAK мыши или белок TWEAK человека, по сравнению со связыванием mAb хомяка, которое распознает посторонний белок (гемоцианин слизня). На фиг. 3 показан FACS-анализ способности mAb AB.D3 блокировать связывание FLAGмеченного рекомбинантного растворимогоTWEAK человека с клетками, позитивными по рецептору TWEAK. На фиг. 4 показан FACS-анализ активационного состояния В-клеток у мышей с хроническим СТПХ, которым вводили анти-TWEAKmAb AB.D3, анти-СD40L-mАb MR1, контрольное mAb или не вводили ничего. Подробное описание изобретения Определения С целью более полного понимания описываемого здесь изобретения предлагается нижеследующее подробное описание. Термины гуморальный ответ и клеточный ответ в данном тексте указывают на иммунный ответ животного на антиген, при котором животное вырабатывает антитела к антигену или формирует цитотоксический ответ на антиген, или имеет место и то, и другое. Класс Т-хелперных лимфоцитов Th1 важен в связи с индукцией клеточного ответа, а класс Тхелперов Th2 важен в связи с эффективной выработкой высокоаффинных антител. Термин Т-хелперные клетки (Th) в данном тексте означает функциональный подкласс Т-лимфоцитов, который участвует (помогает) в формировании цитотоксических Т-клеток и который кооперируется с В-клетками в связи со стимуляцией выработки антител. Хелперные Тклетки распознают антиген вместе с молекулами класса II МНС и обеспечивают контактзависимые и контакт-независимые сигналы (цитокин и хемокин) к эффекторным клеткам. Термин Th1 означает подкласс Тхелперных клеток, которые вырабатывают TNF,-интерферон и IL-2 (и другие цитокины) и которые запускают воспалительные реакции, связанные с клеточным, т.е. не связанным с иммуноглобулинами ответом на стимул. Термин Th2 означает подкласс Тхелперных клеток, которые вырабатывают IL-4,IL-5, IL-6, IL-10 и другие цитокины, которые связаны с иммуноглобулиновым (гуморальным) ответом на иммунный стимул. Термин герминативный центр в данном тексте означает вторичный В-клеточный фолликул, который образуется после иммунизации антигеном. Возникновение данного гистологического сайта коррелирует с оптимальным формированием памяти, переключением изотипов,соматическим гипермутированием и, соответственно, приводит к созреванию аффинности ответа антитела. 10 Термин клетки, вырабатывающие антитела относится к В-клеткам, которые получили контакт-зависимые и контакт-независимые сигналы от клеток Th и секретируют иммуноглобулины подклассов IgM, IgG, IgA или IgE. Термин домен Fc антитела означает часть молекулы, включающую в себя шарнирный участок, домены СН 2 и СН 3, но лишенную антигенсвязывающих сайтов. Данный термин также призван включить в себя эквивалентные участки IgM или других изотипов антител. Термин aнти-TWEAK-антитело означает любое антитело, которое специфически связывается по крайней мере с одним эпитопом в составе белка TWEAK. Термин антитело к рецептору TWEAK означает любое антитело, которое специфически связывается по крайней мере с одним эпитопом рецептора TWEAK. Термин сигнальные пути рецептораTWEAK указывает на молекулярные процессы, связанные с работой рецептора TWEAK, и последующие молекулярные процессы, вытекающие из этого. Термины средство, модифицирующееTWEAK означают любое средство, которое способно модифицировать связывание лиганда с рецептором TWEAK, способно модифицировать кластеризацию рецепторов клеточной поверхности TWEAK или сигнальные пути рецептора TWEAK, или которое способно влиять на то, как сигнал от рецептора TWEAK будет интерпретирован внутри клетки. Термин лиганд TWEAK или белокTWEAK или его производному, которые способны специфически связываться с рецепторомTWEAK. Термин субъект означает животное или одну или несколько клеток, происходящих от животного. Предпочтительно животное является млекопитающим. Клетки могут находиться в любой форме, включая, но не ограничиваясь этим, клетки, остающиеся в ткани, клеточные кластеры, иммортализованные, трансфицированные или трансформированные клетки, а также клетки, происходящие от животного, которое было физически или фенотипически изменено. Лиганд TWEAKTWEAK является недавно открытым членом семейства белков TNF (Chicheportiche et al.,1997, J. Biol. Chem., 51, 32401-32410). Члены белкового семейства TNF связываются с рецепторами, входящими в белковое семейство TNFрецепторов (TNF-R). Взаимодействие белков семейства TNF с соответствующими рецепторами влияет на широкий круг функций иммунной системы. Хорошо известными примерами 11 являются белок CD40L, который связывается с рецептором CD40 со стимуляцией дифференцировки В-клеток в клетки, вырабатывающие антитела (GrewalFlavell, 1997, Immunol. Res.,16, 59-70), лиганд лимфотоксин- (LT-), который связывается с рецептором лимфотоксина-,что влияет на гуморальные иммунные ответы за счет регуляции дифференцированного состояния фолликулярных дендритных клеток (MackayBrowning, 1998, Nature, 395, 26-27), иOX40L, который связывается с ОХ 40 рецептором с регуляцией ответа В-клеток на Тклеточные сигналы (Flynn et al., 1998, J. Exp.Med., 188, 297-304). Другими парами лиганд/рецептор в составе семейств TNF/TNF-R,которые, как известно, играют ключевую роль в иммунной системе, являются TNF/TNF-R55,FasL/Fas и CD27/CD70. Биология TWEAK пока понятна лишь отчасти. Очищенный растворимый белок TWEAK был использован для индукции дифференцировки и/или гибели некоторых опухолевых клеточных линий, включая клетки аденокарциномы НТ 29 (клеточная гибель по механизму апоптоза), клетки карциномы шейки матки HeLa(морфологические изменения) и клетки меланомы А 375 (антипролиферация). Также TWEAK индуцировал у клеточных линий НТ 29 и А 375 секрецию хемокина IL-8, и такой же эффект наблюдался в отношении клеточной линии фибробластов WI-38 (Chicheportiche et al. , 1997, J.Biol. Chem., 51, 32401-32410). Кроме того,TWEAK индуцировал пролиферацию различных линий нормальных эндотелиальных клеток(Lynch et al., 1998, J. Interferon Cytokine Res., 18,A-46). Был описан предполагаемый рецептор дляTRAMP, Аро 3, WSL-1, DR-3 или LARD, входит в семейство TNF-R. Активация TRAMP способна индуцировать апоптоз за счет запуска либо каспаза-зависимого сигнального пути клеточной гибели, либо клеточной активации по сигнальным механизмам с участием NF-kB (AshkenaziDixit, 1998, Science, 281, 1305-1308). Экспрессия TWEAK широко представлена в тканях мыши и человека, при том, что информационная РНК (мРНК) обнаруживается, помимо других тканей, в сердце, головном мозге,легких, печени, а также во вторичных лимфоидных органах, таких как селезенка, лимфатические узлы и моноядерные клетки периферической крови (РВМС). По-видимому, TWEAK не экспрессирован в первичных лимфоидных органах, в которых развиваются клетки иммунной системы, таких как тимус, костный мозг и плодная печень. Таким образом, та роль, которую TWEAK может выполнять в иммунной системе, скорее всего, связана с иммунными отве 004590 12 тами, нежели с развитием собственно иммунной системы. Взаимодействие белков-лигандов со своими рецепторами может быть модифицировано с использованием ряда специфических подходов. Например, моноклональные антитела (mAb),которые специфически распознают лиганд, могут быть использованы для предотвращения или модифицирования связывания лиганд/рецептор за счет распознавания сайта связывания или за счет создания физических помех такому взаимодействию. Как альтернатива, mAb к лигандам могут влиять на сигнал, генерируемый рецептором, вследствие влияния на связывание других лигандов в тех случаях, когда у рецептора имеются множественные лиганды. Такие сложно организованные эффекты были отмечены для mAb к семейству В 7 лигандов CD28(Lenschow et al., 1995, J. Exp. Med. 181, 11451155). MAb к лигандам могут иметь даже более тонкий эффект в системах, в которых для конкретного лиганда имеется множество рецепторов, например, за счет модифицирования связывания лиганда с одним рецептором, при том, что связывание с другим рецептором остается неизменным. MAb, которые распознают рецептор,также могут быть использованы для модифицирования связывания лигандов, или же они сами по себе способны индуцировать или модифицировать сигналы от рецептора. Такие антирецепторные mAb могут быть антагонистами или агонистами. Примерами mAb, используемыми в мышиных или человеческих системах для модифицирования взаимодействий лиганд/рецептор у членов семейства TNF/TNF-R,являются, помимо прочих, mAb, специфичные для TNF, для CD40L, для LT-P, для Fas-L и дляTR2/HVEM. MAb могут быть использованы для предотвращения инициации или развития иммунологических и других заболеваний. Например, антитела к CD40L были использованы в лечении системной красной волчанки (СКВ) и для контроля недостаточности пересаженных органов. Мощные ингибиторы взаимодействия лиганд/рецептор также могут быть созданы путем клонирования последовательностей, которые кодируют внеклеточную часть последовательности рецептора, с последовательностями,которые кодируют тяжелую цепь иммуноглобулина (Ig) человека, с последующей экспрессией гибридного гена с использованием промотора подходящего гена в подходящей клеточной линии. Очищенные химерные белки рецептор-Ig могут быть использованы in vitro и in vivo для связывания с доступным белковым лигандом,тем самым модифицируя взаимодействие лиганда с нативным рецептором, прикрепленным к клетке. Модификации могут быть осуществлены с помощью различных механизмов, сходных с таковыми, которые описаны выше для 13 рецептор-Ig, использованных в мышиных или человеческих системах с целью модифицирования взаимодействий лиганд/рецептор членов семейства TNF/TNF-R, являются, помимо других, TNF-R55-Ig, TNF-R75-Ig, LT-R-Ig и OX40Ig. Химерные белки рецептор-Ig могут быть использованы для предотвращения инициации или развития иммунологических и других заболеваний. Например, TNF-R75-Ig был использован в лечении воспалительного заболевания кишечника (ВЗК). В данной заявке авторы показывают, чтоmAb, которое специфически связывается сTWEAK мыши и человека, предотвращает развитие обусловливаемого прототипным антигеном иммунологического заболевания - синдрома (реакции) трансплантат против хозяина(СТПХ). В настоящем изобретении предусматривается использование реагентов, модифицирующих TWEAK и рецептор (рецепторы)TWEAK, с целью лечения различных иммунологических заболеваний, вызываемых попаданием в организм больных чужеродного антигена, таких как СТПХ, являющихся результатом пересадки костно-мозговых или стволовых клеток, и недостаточности пересаженных органов,обусловливаемой отторжением трансплантата. Более того, настоящее изобретение связано с применением реагентов, модифицирующихTWEAK и рецептор (рецепторы) TWEAK, с целью лечения различных аутоиммунных заболеваний, таких как, помимо других примеров,СКВ, идиопатическая тромбоцитопеническая пурпура, гранулематоз Вегенера, узелковый полиартериит, ретинальный увеит, быстро прогрессирующий гломерулонефрит с полулуниями, ревматоидный артрит, рассеянный склероз и язвенный колит. Другими возможными путями использования является лечение острых и хронических воспалительных состояний, таких как,помимо прочего, аллергическое воспаление,астма, эозинофилия, болезнь Грэйвса и болезнь Чагаса. Материалы и методы Мыши. Самки мышей линий DBA/2 и С 57 В 1/6 возраста 6-8 недель и гибриды(DBA/2xC57Bl/6) F1 были закуплены в Джексоновской лаборатории (Bar Harbor, ME, США); их содержали в стандартных садках с защитными барьерами, а работа с ними велась в соответствии с инструкциями лаборатории. Моноклональные антитела Моноклональные антитела, которые распознают белок TWEAK человека и мыши, были сформированы в организме армянских хомячков с использованием растворимого белка TWEAK человека, который был выработан в бакуловирусах и очищен в соответствии с описанным(Chicheportiche et al., 1997, J. Biol. Chem., 51,32401-32410). Для первой иммунизации каждый хомячок получал 50 мкг TWEAK в полном адъюванте Фрейнда (ПАФ) путем внутрибрюшин 004590(через 14, 28 и 42 дня после первичной иммунизации) каждый хомячок внутрибрюшинно получал 50 мкг (14-й и 28-й дни) или 33 мкг (42-й день) TWEAK в неполном адъюванте Фрейнда(НАФ). Заключительную иммунизацию перед тем, как химеризовать клетки селезенки для получения гибридом, проводили внутрибрюшинно с помощью 100 мкг TWEAK без адъюванта. Формирование гибридом проводили с использованием стандартных процедур (Lerner,1981, Yale J. Biol. Med., 54, 387-402). Гибридома, которая вырабатывает mAbMAb к TWEAK человека анализировали по их способности связываться с TWEAK человека и мыши с помощью различных экспериментальных форматов. Некоторые mab, сформированные к белку TWEAK человека, также распознавали белок TWEAK мыши в процессе исходного скрининга активности mAb, который был проведен в формате тестов на основе ТИФА. Белок TWEAK мыши был получен в бакуловирусах с использованием методов, сходных с методами, описанными для белка TWEAK человека (Chicheportiche et al., 1997, J. Biol. Chem.,51, 32401-32410). Очищенные белки TWEAK человека и мыши наносили на 96-луночные планшеты, и различные хомячковые mAb тестировали по их способности связываться с данными иммобилизованными белками. Связывание хомячкового mAb иммобилизованными белкамиTWEAK визуализовали с использованием ослиного антихомячкового IgG, соединенного с пероксидазой (Jackson ImmunoResearch, WestGrove, PA, США), и проведения соответствующей зависимой от пероксидазы ферментативной реакции.FACS-анализ активности mAb Растворимый белок TWEAK индуцирует апоптоз у клеток НТ 29: это указывает на то, что данные клетки экспрессируют рецепторChem., 51, 32401-32410). Очищенные mab (10 мкг/мл) тестировали по их способности блокировать связывание FLAG-меченного TWEAK мыши или человека с клетками НТ 29, что выявляли с помощью биотинилированного антиFLАG-антитела, стрептавидин-пероксидазы и подходящего ферментативного субстрата. Индукция хронического СТПХ Самок мышей DBA/2 и B6D2F1 возраста 6-8 недель умерщвляли, и селезенки удаляли в стерильных условиях. Моноклеточные суспензии приготавливали путем тщательного измель 15 чения органов между матовыми предметными стеклами, удаляя крупные частички дебриса, с последующим пеллетированием осветленного надосадочного слоя. Полученный клеточный сгусток ресуспендировали в забуференном гипертоническом растворе Гейза и инкубировали на льду в течение 3 мин с целью лизиса эритроцитов. В расчете на каждую измельченную селезенку использовали 5 мл раствора Гейза. Клеточный раствор пеллетировали вновь, ресуспендировали в стерильном апирогенном ФСБ, пеллетировали и ресуспендировали второй раз в стерильном апирогенном ФСБ. Число клеток определяли с помощью гемоцитометра, и плотность клеток доводили до 2 х 108 на 1 мл. Этот раствор затем пропускали через стерильный клеточный фильтр с порами 70 мкм и выдерживали на льду до момента использования. В качестве реципиентов использовали самок мышейB6D2F1 в возрасте 6-8 недель. Каждому реципиенту инъецировали 500 мкл клеток (1 х 108) в хвостовую вену. Экспериментальные группы получали трансплантат от DBA/2 (DBA/2F1), в то время как группа контрольных животных получала трансплантат от B6D2F1 (F1F1). Животных анализировали по развитию хронического СТПХ через 14 дней после инъекции. Предотвращение хронического СТПХ Мыши получали анти-TWEAK-mAbmAb Ha4/8 или не получали ничего. Схема обработки включала 250 мкг mAb внутрибрюшинно за 4 ч до инъекции трансплантата и через 2, 4 и 6 дней после этого. Анализ развития болезни На 14-й день эксперимента мышей умерщвляли и взвешивали. Затем в стерильных условиях удаляли селезенку и взвешивали ее. Индекс селезенки подсчитывали как отношение массы селезенки к массе тела для каждого животного в контрольной группе F1F1, и среднюю величину принимали за 1,0. Средний индекс селезенки для всех других групп соотносили с контрольной величиной. Затем спленоциты выделяли из этих селезенок в соответствии с описанным выше, после этого разбавляли до концентрации 1 х 107 клеток на 1 мл в стерильном ФСБ. Для анализа методом FACS 100 мкл клеток окрашивали для последующих маркеров клеточной поверхности. Все описанные mab были закуплены в Pharmingen (San Diego, СА,США). Стрептавидиновый реагент был приобретен в Southern Biotechnology Corp. (Birmingham, AL, США). Спленоциты окрашивали биотинилированным анти-Н-2Kb - гаплотипическим маркером, который может отличать донорские клетки (негативные по Н-2Kb) от клеток реципиента (позитивных по Н-2Kb), в различных сочетаниях с непосредственно соединенными с 16 его сывороточного альбумина (БСА), 0,1% азида натрия (FACS-буфер), содержащем 10 мкг/млFcBlock (Pharmingen), позволяющим предотвращать неспецифическое связывание с Fcрецепторами. Клетки инкубировали с mab на льду в течение 1 ч. Каждый образец затем ресуспендировали с 2 мл FACS-буфера с целью промывки, затем центрифугировали для пеллетирования клеток. Клетки ресуспендировали вFACS-буфере, содержащем меченный CyChrome стрептавидин, который связывается с биотинилированным mAb, что предоставляет третий канал для FACS-сортировки, промывали в последний раз и анализировали с использованием установки для FACS-сканирования и программы Cellquest (Becton Dickenson, San Jose,СА, США). Для анализа секреции Ig in vitro клетки пеллетировали и ресуспендировали в средеDMEM, содержащей 10% плодной телячьей сыворотки (ПТС) + 4 мМ глутамина, при концентрации 1 х 107 клеток на 1 мл. По 1 мл на лунку наносили на 6-луночный планшет. Клеточные надосадочные фракции выделяли через 24 ч. Источник анти-ТWЕАK-антител В одном варианте настоящего изобретения антитела (Abs), специфичные в отношенииTWEAK, функционировали в качестве средств,блокирующих TWEAK. Антитела могут быть сформированы в отношении мономерных, димерных или тримерных форм белка TWEAK,содержащих или не содержащих гетерологичные субъединицы, если таковые существуют. Более того, антитела могут быть сформированы в отношении растворимой, мутантной, измененной или химерной форм белков TWEAK. Анти-TWEAK-антитела согласно изобретению могут быть поликлональными или моноклональными (mAb) и могут быть модифицированы с целью оптимизации их способности блокировать связывание TWEAK с соответствующими рецепторами, их биологической доступности invivo, стабильности или других желательных свойств. Поликлональные антисыворотки, специфичные в отношении TWEAK, приготавливают с использованием стандартных методов путем подкожного инъецирования животных, таких как козы, кролики, крысы, хомячки или мыши,белком TWEAK человека в полном адъюванте Фрейнда (ПАФ) с последующими бустерными внутрибрюшинными или подкожными инъекциями в неполном адъюванте Фрейнда (НАФ). Поликлональные антисыворотки, содержащие желательные антитела к TWEAK, подвергают скринингу с помощью стандартных иммунологических процедур. Моноклональные антитела (mAb) хомячка,специфичные в отношении TWEAK человека,приготавливают с использованием стандартных методов путем подкожного инъецирования ар 17 мянских хомячков рекомбинантным растворимым TWEAK человека в ПАФ с последующей бустерной внутрибрюшинной или подкожной инъекцией в НАФ. Гибридомная клеточная линия (AB.D3.7.2), которая вырабатывает хомячковое анти-TWEAK-mAb AB.D3, была депонирована в Американскую коллекцию типовых культур (АТСС) (Rockville, MD) в соответствии с условиями Будапештского договора, где получила депозитарный номер АТСС. Все ограничения по открытому доступу к указанному выше депозиту АТСС будут, безусловно, сняты после выдачи патента на настоящую заявку. Различные формы анти-ТWЕK-антител могут также быть сформированы с использованием стандартных технологий рекомбинантных ДНК (WinterMilstein, 1991, Nature, 349,pp.293-299). Например, могут быть сконструированы химерные антитела, в составе которых антиген-связывающий домен антитела животного соединен с константным доменом человека (например, Cabilly et al., патент США 4816567; Morrison et al., 1984, Proc. Natl. Acad.Sci. USA, 81, pp.6851-6855). Химерные антитела снижают наблюдаемые иммунные ответы, вызванные антителами животных, при использовании их в клинической практике для лечения людей. Кроме того, могут быть синтезированы рекомбинантные гуманизованные антитела,которые распознают TWEAK. Гуманизованные антитела - это химеры, включающие в основном последовательности IgG человека, в состав которых встроены участки, ответственные за специфичное связывание антигена (например, международная патентная заявка WO 94/04679). Животных иммунизуют желательным антигеном, выделяют соответствующие антитела и удаляют участок последовательностей вариабельного домена, ответственный за специфичное связывание антигена. Участки связывания антигена, происходящие от животного, затем клонируют в подходящее положение генов антител человека, из состава которых были делегированы антиген-связывающие участки. Гуманизованные антитела сводят к минимуму использование гетерологичных (от другого вида) последовательностей в антителах человека, поэтому менее вероятной оказывается индукция иммунных ответов у субъекта, лечение которого проводят. Конструирование различных классов рекомбинантных анти-TWEAK-антител также может быть осуществлено путем получения химерных или гуманизированных антител, включающих в себя вариабельные домены антиTWEAK и константные домены человека (СН 1,СН 2, СН 3), выделенные из иммуноглобулинов разных классов. Например, анти-ТWЕАKантитела класса IgM с увеличенными валентностями антигенсвязывающего сайта могут быть получены рекомбинантным путем с помощью 18 клонирования антиген-связывающего сайта в состав векторов, несущих константные домены тяжелой цепи IgM человека (Arulanandam et al.,1993, J. Exp. Med., 177, pp.1439-1450; Lane et al.,1993, Eur. J. Immunol., 22, pp. 2573-2578;Traunecker et al., 1989, Nature, 339, pp. 68-70). Кроме того, стандартные методы рекомбинантной ДНК могут быть применены для изменения аффинности связывания рекомбинантных антител с соответствующими им антигенами путем изменения аминокислотных остатков поблизости от антиген-связывающих сайтов. Аффинность по связыванию антигена у гуманизированного антитела может быть повышена с помощью мутагенеза на основании молекулярного моделирования (Queen et al., 1989, Proc.Natl. Acad. Sci. USA, 86, pp. 10029-10033; международная патентная заявка WO 94/04679). Желательным может быть увеличение или уменьшение аффинности анти-ТWЕАK-антител в отношении TWEAK, что зависит от типа ткани-мишени или конкретного плана лечения. Например, может иметь преимущество лечение больного с помощью постоянных уровней aнтиTWEAK-aнтител со сниженной способностью к модификации механизма TWEAK с целью полупрофилактического лечения. Подобным образом aнти-TWEAK-aнтителa с повышенной аффинностью в отношении TWEAK могут иметь преимущество для кратковременных курсов лечения. Выработка хомячкового моноклонального антитела к TWEAK-человека проиллюстрирована в примере 1. Использование анти-TWEAK-mAb для предотвращения развития хронического СТПХ, являющегося антиген-опосредуемым иммунологическим заболеванием Здесь авторы изобретения демонстрируют влияние средства, блокирующего TWEAK, mAb AB.D3 - на развитие иммунного ответа в мышиной модели синдрома трансплантат против хозяина (СТПХ). Способность предотвращать хронический СТПХ включает в себя влияние на активацию и пролиферацию В-клеток, а также на образование секретируемого IgG. Мышам внутрибрюшинно (в/б) вводили 250 мкг анти-TWEAK-mAb AB.D3, контрольного mАb На 4/8 к KLH, анти-СD40L-mАb MR1 или не вводили ничего. Через 4 ч мыши получали 1 х 108 спленоцитов, выделенных у мышей DBA/2, в 0,5 мл инъекционного раствора, вводимого внутривенно (в/в). Инъецированные в/в спленоциты DBA/2 представляли собой аллотрансплантат. Через 2, 4 и 6 дней после введения трансплантата мышам вновь вводили по 250 мкг анти-TWEAK-mAb AB.D3, контрольного mАb На 4/8 к KLH или анти-СD40L-mАb MR1. Контрольная группа мышей получала 1 х 108 спленоцитов B6D2F1, которые не способны вызывать заболевание у реципиентов линии B6D2F1. Как альтернатива, в качестве контроля использовали 19 мышей B6D2F1, которым ничего не пересаживали и не вводили. Через 14 дней после введения трансплантата мышей умерщвляли и анализировали на наличие заболевания. У мышей-реципиентов,получавших трансплантат, но не получавших лечения, проявляются различные симптомы, указывающие на развитие хронического СТПХ. Спленомегалия (увеличение селезенки) подтверждает, что донорские Т-клетки и В-клетки реципиента перешли в активированное состояние и претерпели поликлональную экспансию, выразившуюся в резком увеличении числа клеток. Появление белков клеточной поверхности, таких как CD69,у группы В-клеток указывает на активацию Вклеток. Утрата молекул L-селектина CD4 позитивными и CD8-позитивными Т-клетками подтверждает активацию Т-клеток. Секреция молекул Ig таких классов как IgG, IgA и IgE,либо в сыворотку, либо выявляемое in vitro в ходе анализа культивирования клеток, указывает на то, что В-клетки превратились в активированные и прошли этап переключения своего класса иммуноглобулина. В связи с этим возникновение аутоантител в сыворотке или в тестах in vitro с культивируемыми клетками показывает, что выработанные иммуноглобулины характеризуются несоответствующим распознаванием аутоантигенов. Наконец, выживаемость может быть определена как показатель различных режимов лечения. Авторы изобретения сравнили контрольных мышей с мышами, получавшими аллотрансплантат, но не получавшими лечения, с целью анализа степени спленомегалии, активации В-клеток и секреции Ig в ходе СТПХ. АнтиСD40L-mАb MR1 использовали в данных экспериментах в качестве позитивного контроля,поскольку ранее было показано, что блокировка взаимодействия CD40L/CD40 является эффективным средством для создания помех развитию хронического СТПХ (Durie et al., 1994, J.Ha4/8, полученное против гемоцианина слизня(KLH), выполняло роль негативного контроля. Результаты двух экспериментов показаны в табл. 2. В обоих экспериментах введение антиTWEAK-mAb AB.D3 приводило к снижению уровня спленомегалии (по сравнению с реципиентами, получавшими аллотрансплантат, но не получавшими лечения) приблизительно на 33%. Введение mAb Ha4/8 как негативного контроля влияния не оказывало, в то время как введение анти-СD40L-mАb MR1 подавляло спленомегалию почти на 70%. Для изучения клеточных популяций, затрагиваемых введением антиTWEAK-mAb AB.D3, FACS-анализ был проведен в отношении спленоцитов, взятых у мышейреципиентов через 14 дней после введения трансплантата. Клетки селезенки, выделенные от 3-4 особей из каждой группы, объединяли. Активация В-клеток реципиента является от 004590 20 четливым признаком хронического СТПХ. У мышей, которым не проводили лечения или вводили контрольное mAb, небольшая, но отчетливая доля В 200+ В-клеток экспрессировала активационный маркер CD69 (фиг. 4 и табл. 3). Напротив, по сути не было экспрессировавшихCD69 В 200+ В-клеток у мышей, которым вводили MR1 или AB.D3. Утрата выявляемой активации В-клеток в селезенке мышей, которым вводили AB.D3, может являться следствием работы одного или нескольких разных механизмов, включая утрату активации Т-клеток,утрату активации В-клеток или клеточную гибель (апоптоз). Далее авторы изобретения измерили общий уровень IgG в культурах спленоцитов у мышей из различных по способу лечения групп с целью определения того, коррелирует ли утрата активационного маркера CD69 у популяций В-клеток с функциональным процессом, т.е. с выработкой IgG. У контрольных мышей без лечения, у мышей с введением MR1 и мышей с введением AB.D3 вырабатывалось резко сниженное количество общего IgG по сравнению с мышами-реципиентами аллотрансплантата, не получавшими лечения или получавшими На 4/8 (табл. 4). Данный результат показывает, что секреция Ig активированными Вклетками, являющаяся отчетливым признаком хронического СТПХ, заблокирована введением анти-TWEAK-mAb. Использование антиTWEAK-mAb для предотвращения развития хронического СТПХ проиллюстрировано в примере 2. Другие заболевания, опосредованные антителами Многие специфичные для отдельных органов и системные аутоиммунные заболевания вовлекают патологические ответы с образованием антител. Такими состояниями являются миастения gravis,аутоиммунная гемолитическая анемия, болезнь Чагаса, болезнь Грейвса, идиопатическая тромбоцитопеническая пурпура (ИТП), системная красная волчанка (СКВ), гранулематоз Вегенера, узелковый полиартериит и быстро прогрессирующий гломерулонефрит с полулуниями (из Benjamini et al.,1996, "Immunology: A Sort Course", Wiley-Liss, NewYork, 3d ed.). Хотя этиология СКВ не установлена, изрядный объем информации имеется по иммунологическому механизму, ответственному за выявляемую патологию. По неизвестным причинам у больных с СКВ вырабатываются антитела к ядерным компонентам организма (антиядерные антитела - АЯА), в основном к нативной двухцепочечной ДНК. С клинической точки зрения присутствие таких антител четко коррелирует с почечной патологией, развивающейся при СКВ. Данные антитела образуют комплекс с ДНК, предположительно происходящей из разрывов нормальной ткани, и, как и при любых иммунологических (иммуноагрегационных) заболеваниях, такие комплексы образуют отло 21 жения, являющиеся ловушками для базальной мембраны клубочков, в стенках артериол и в синовиальных пространствах суставов. Такие комплексы активируют каскад комплемента и привлекают гранулоциты. Последующая воспалительная реакция характеризуется гломерулонефритом, в результате чего повреждаются почки, что приводит к протеинурии и гематурии. Уже в течение нескольких десятков лет СКВ изучают на мышиной модели. Развитие СКВ можно предотвратить с использованием таких реагентов как химерный белок CTLA4-Ig и анти-СD40L, которые прерывают ключевые стадии активации Т- и В-клеток (GrewalFlavell, 1996, Immunol. Rev., 153, 85-106). Недавно с помощью ряда моделей была оценена терапевтическая эффективность реагента, специфичного в отношении лиганда CD40 мыши (Mohan etal., 1995, J. Immunol., 154, pp.1470-1480). Ускоренное развитие волчанки путем переноса клеток, которые индуцируют выработку патогенных антител in vivo, как было показано, подавляется введением моноклонального антитела,которое блокирует взаимодействие лигандаCD40/CD40. Более того, кратковременное воздействие на волчаночных мышей антитела к лиганду CD40 имеет поддерживаемый положительный эффект в отношении спонтанного развития болезни в течение длительного времени после удаления антитела из организма этих мышей. Эксперименты показали, что патогенные В-клетки могут не вырабатывать антител даже через 9 месяцев после проведения лечения: это подтверждает, что имеется задержка экспансии аутоиммунных В-клеток памяти, что и проявляется в долговременном терапевтическом преимуществе. Более того, воздействие антиСD40L было способно остановить или замедлить развитие уже имеющейся СКВ в мышиной модели со спонтанной встречаемостью заболевания (Kalled et al., 1998, J. Immunol., 160, 21582165). Как показано авторами изобретения, реагенты, которые модифицируют взаимодействиеTWEAK и рецептора(ов) TWEAK in vivo, подавляют активацию В-клеток и выработку Ig,поэтому реагенты согласно изобретению будут применимы для лечения или профилактики СКВ. Нормальный иммунный ответ на некоторые патогенные инфекционные агенты вызывает ответы в виде выработки аутоантител, которая может становиться избыточной и составить медицинскую проблему. Одним из примеров является болезнь Чагаса - воспалительная кардиомиопатия, которая развивается у человека и экспериментальных животных при хроническом заражении трипаносомами Trypanosoma cruzi(T.cruzi). Недавно в ряде исследований были идентифицированы аутоантитела в сыворотке пациентов с болезнью Чагаса (Bach-Elias et al.,1998, Parasitol. Res., 84, 796-799). Более того,индукция специфичных для сердца аутоиммун 004590 22 ных ответов недавно получила существенную экспериментальную поддержку как возможный механизм, вовлеченный в патогенез кардиомиопатии Чагаса у человека. В недавнем исследовании (Tibbetts et al., 1994, J. Irnmunol., 152, pp. 1493-1499) было установлено, что сердечные антиген-специфичные антитела вырабатываются у мышей С 57 В 1/6, зараженных T.cruzi, с болезнью сердца. После заражения бразильским штаммом T.cruzi у мышей С 57 В 1/6 развивается кардиомиопатия, которая по гистологическим параметрам сходна с таковой, выявленной у хронически инфицированных людей. Антисыворотки от таких мышей взаимодействуют с тремя сердечными антигенами, в то время как у мышей С 57 В 1/6, зараженных гайанским штаммом T.cruzi, у которых кардиомиопатия не развивается, подобные антитела не вырабатываются. Эти данные указывают на то, что такие антитела являются маркерами, специфичными для кардиомиопатии. Способность средств, модифицирующих TWEAK, блокировать активацию В-клеток и выработку Ig будет применима для предотвращения поражений сердца, имеющих место у пациентов с болезнью Чагаса. Другим примером разрушения клеток под действием аутоантител, образованных как следствие некоторых инфекционных заболеваний или по другим, пока неизвестным, причинам является идиопатическая тромбоцитопеническая пурпура (ИТП). При этом состоянии антитела, специфичные в отношении тромбоцитов,обусловливают разрушение тромбоцитов (с участием комплемента или фагоцитирующих клеток, несущих рецептор Fc или С 3b), что может приводить к кровотечениям. Терапевтические средства, которые будут подавлять in vivo такие аутоиммунные ответы, опосредуемые антителами, такие как средства согласно изобретению,модифицирующие TWEAK, которые подавляют образование антител, будут применимы для лечения или профилактики также и таких аутоиммунных заболеваний. Нормальный иммунный ответ на некоторые патогенные инфекционные агенты также может вызывать реакции гиперчувствительности, которые могут становиться избыточными и сами по себе создают медицинскую проблему. Наиболее ярким примером гиперчувствительности I типа является аллергическая реакция. Она опосредуется антителами IgE, которые связываются через свои Fc-участки с рецепторами на поверхности тучных клеток и базофилов, опосредуя тем самым секрецию фармакологически активных средств, которые приводят к анафилаксии. Иногда считается, что ИТП и синдром Гудпасчера являются реакциями II типа, которые имеют место тогда, когда антитела IgM илиIgG связываются с антигеном на клеточной поверхности и активируют каскад комплемента. Затем к сайту активации привлекаются гранулоциты, и вследствие секреции литических 23 ферментов из их гранул происходит разрушение клеток. Считается, что ревматоидный артрит обусловливается реакцией гиперчувствительности III типа, опосредуемой иммунными комплексами антигена (в данном случае - ревматоидного фактора, являющегося аутоантителом типа IgM), который связывается с Fc-сегментом нормального IgG. Такие иммунные комплексы участвуют в индукции воспаления суставов и повреждений, характерных для данного заболевания. Поскольку отчасти данные патологии обусловливаются антителами, терапевтические средства, которые будут подавлять образование антител, такие как средства согласно изобретению, модифицирующие TWEAK, будут применимы для лечения или профилактики также и подобных заболеваний. Дополнительными примерами заболеваний, которые приводят к опосредованным антителами повреждениям у больного, являются болезнь Грейвса и острая гемолитическая анемия. Предусматривается, что средства, модифицирующие TWEAK, будут проявлять эффективность в профилактике или лечении таких заболеваний. Подавление клеточных иммунных ответов. Авторы изобретения показали, что введение реагентов, которые модифицируют активность белка TWEAK in vivo, предотвращают развитие опосредованного антителами (гуморального) иммунологического заболевания - хронического СТПХ. Другими мощными модификаторами иммунной системы, которые способны предотвращать развитие хронического СТПХ, являются анти-СD40L и химерный белок CTLA4-Ig. Данные реагенты блокируют критические стадии активации Т- и В-клеток (GrewalFlavell,1996, Immunol. Rev., 153, 85-106). Следовательно, терапевтическое манипулирование такими другими мощными механизмами иммунной системы не ограничивается гуморальными иммунными ответами. Например, анти-СD40L иCTLA4-Ig были использованы по отдельности и вместе друг с другом для контроля отторжения пересаживаемого органа в животных моделях(Kirk et al., 1997, Proc. Natl. Acad. Sci. USA, 94,8789-8794). Основная часть иммунного ответа на пересаженные органы опосредована Тлимфоцитами Th1 и состоит из цитотоксического клеточного иммунного ответа. Такие клеточные иммунные ответы отвечают за опосредованное клетками повреждение при ряде других иммунологических заболеваний, таких как аутоиммунные заболевания, например, воспалительное заболевание кишечника, ревматоидный артрит, рассеянный склероз, диабет, язвенный колит и болезнь Крона. Основываясь на способности предотвращать развитие хронического СТПХ, заявляемое изобретение предусматривает использование реагентов, модифицирующих 24 заболеваний, связанных с клеточным иммунитетом. Способы лечения с использованием средств,модифицирующих TWEAK и рецептор TWEAK Композиции согласно изобретению должны быть введены эффективной дозой с целью лечения конкретного клинического состояния. Определение предпочтительного фармацевтического препарата и режима терапевтически эффективных доз для конкретного применения хорошо известно специалистам в данной области техники, причем с учетом, например, состояния и массы тела больного, степени желательного лечения и переносимости больным данного лечения. Как ожидается, дозы примерно 5 мг/кг средства, модифицирующего TWEAK или рецептор TWEAK, будут подходящими исходными точками для оптимизации лечебных доз. Определение терапевтически эффективной дозы также может быть проведено с помощью экспериментов in vitro, в которых измеряют концентрацию модифицирующего средства,необходимую для обволакивания клетокмишеней (клеток, позитивных по TWEAK или рецептору TWEAK, в зависимости от модифицирующего средства) в течение подходящих периодов времени (периодов лечения). Описываемые здесь FACS- и ТИФА-тесты на связывание лиганд-рецептор могут быть использованы для контроля реакции обволакивания клеток. Основываясь на результатах таких тестов на связывание in vitro, диапазон подходящих концентраций модифицирующих средств может быть выбран для испытаний на животных. Введение растворимых модифицирующих средств согласно изобретению по отдельности или в сочетании, включая изолированные и очищенные формы антител к TWEAK и кTWEAK-R, химерные белки рецептор-Ig, другие средства, модифицирующие TWEAK и рецептор TWEAK, включая встречающиеся в естественных условиях или химически производные реагенты, а также их соли или их фармацевтически приемлемые производные, может быть осуществлено с использованием любого стандартным образом принятого пути введения средств, которые проявляют иммуносупрессорную активность. Фармацевтические композиции, используемые в данных способах лечения, также могут находиться в различных формах. Ими являются,например, твердые, полужидкие и жидкие дозированные формы, такие как таблетки, пилюли,порошки, жидкие растворы или суспензии, суппозитории и растворы для инъекций и инфузий. Предпочтительная форма зависит от выбранного пути введения и терапевтического применения. Путями введения могут являться пероральный, парентеральный, подкожный, внутривенный, внутрираневой или топический пути введения. 25 Средства согласно изобретению, модифицирующие TWEAK и рецептор TWEAK, могут быть, например, помещены в стерильные изотонические препараты, содержащие дополнительные компоненты, которые стимулируют поглощение или стабильность, или не содержащие их. Препарат предпочтительно является жидким или может быть лиофилизованным порошком. Например, средства согласно изобретению, модифицирующие TWEAK и рецептор TWEAK,могут быть разбавлены в препаративном буфере, содержащем 5,0 мг/мл моногидрата лимонной кислоты, 2,7 мг/мл тринатрийцитрата, 41 мг/мл маннита, 1 мг/мл глицина и 1 мг/мл полисорбата-20. Данный раствор можно лиофилизировать, хранить в холодильнике и реконституировать перед введением в стерильной воде для инъекций (USP). Также предпочтительно композиции должны содержать стандартные фармацевтически приемлемые носители, которые хорошо известны в данной области техники (см., например. Remington's Pharmaceutical Sciences, 16thEdition, Mac Publishing Co.). Такими фармацевтически приемлемыми носителями могут являться другие терапевтические средства, носители, генетические носители, адъюванты, наполнители и др., такие как сывороточный альбумин человека или препараты плазмы. Предпочтительно композиции имеют форму стандартной дозы и обычно должны вводиться один или несколько раз в день. Фармацевтические композиции согласно изобретению также могут быть введены с использованием микросфер, липосом, других доставочных систем на основе микрочастиц или препаратов для непрерывной секреции, помещаемых в кровяное русло или в поврежденную ткань, рядом с ней или в какой-либо иной связи с ней. Подходящими примерами носителей с непрерывной секрецией являются полупроницаемые полимерные матриксы в виде формованных изделий, таких как суппозитории или микрокапсулы. Имплантируемыми или микрокапсулярными матриксами с непрерывной секрецией являются полилактиды (патент США 3773319; ЕР 58481), сополимеры Lглутаминовой кислоты и этил-L-глутаматаTWEAK или рецептор TWEAK Средства согласно изобретению, модифицирующие TWEAK и рецептор TWEAK, способны подавлять иммунные ответы, на что указывает подавление активации В-клеток и выработки Ig в модели хронического СТПХ. Способность к избирательному подавлению таких 26 иммунных ответов будет применима для лечения иммунологических заболеваний, включая различные аутоиммунные заболевания, отторжение пересаживаемых органов и острые и хронические воспалительные состояния. Лечение таких патологических иммунных заболеваний в целом основано на иммуномодулирующих и иммуносупрессирующих средствах, которые обладают плейотропным действием на широкий круг типов клеток и иммунных ответов. Такие неспецифические имуносупрессорные средства,как правило, необходимы в высоких и зачастую цитотоксичных дозах, которые обусловливают неблагоприятные побочные эффекты. Например, тремя основными применяемыми группами иммуносупрессорных средств являются стероиды, циклофосфамид и азатиопрен. Стероиды являются плейотропными противовоспалительными средствами, которые подавляют активированные макрофаги и подавляют активность антиген-представляющих клеток такими путями, которые способствуют обратимости многие патологические Т-клеточные эффекты. Циклофосфамид, являющийся алкилирующим агентом, опосредует гибель клеток за счет подавления репликации и репарации ДНК. Азатиопрен является антипролиферативным средством, которое подавляет синтез ДНК. Такие неспецифические иммуносупрессорные средства в целом необходимы в высоких дозах, которые повышают их токсичность (например, нефро- и гепато-токсичность) и приводят к неблагоприятным побочным эффектам. Следовательно, они не подходят для долговременных курсов лечения. Таким образом, имеется насущная необходимость в дополнительных средствах и способах лечения, которые преодолевают проблемы,обусловливаемые стандартными способами лечения. Далее следуют примеры, которые иллюстрируют анти-TWEAK-mAb согласно изобретению, способы, использованные для характеристики данного mAb, и применение mAb для предотвращения антиген-опосредованного иммунологического заболевания. Данные примеры не должны рассматриваться как ограничивающие: примеры включены для иллюстрации настоящего изобретения, которое ограничено исключительно формулой изобретения. Примеры Пример 1. Выработка моноклонального антитела к белку TWEAK. Моноклональные антитела, которые распознают белок TWEAK человека и мыши, были сформированы в организме армянских хомячков с использованием растворимого белка TWEAK человека, который был получен в бакуловирусах в соответствии с описанным (Chicheporticheet al., 1997, J. Biol. Chem., 51, 32401-32410). Для первой иммунизации каждый хомячок получал 50 мкг TWEAK в полном адъюванте Фрейнда 27 последующих иммунизаций (14-й, 28-й и 42-й дни после первой иммунизации) каждый хомячок получал внутрибрюшинно 50 мкг (14-й и 28-й дни) или 33 мкг (42-й день) TWEAK в неполном адъюванте Фрейнда (НАФ). Последняя иммунизация перед слиянием клеток селезенки с целью образования гибридом составила 100 мкг TWEAK без адъюванта при внутрибрюшинном введении. Формирование гибридом проводили с использованием стандартных процедур (Lerner, 1981, Yale J. Biol. Med., 54, 387402). Исходный скрининг активности mAb был проведен с использованием тестов в формате ТИФА. Мышиный белок TWEAK получали в бакуловирусах с использованием методов,сходных с методами, описанными для белкаBiol. Chem., 51, 32401-32410). Очищенными белками TWEAK человека и мыши покрывали 96-луночные планшеты, и различные хомячковые mAb тестировали по их способности связываться с данными иммобилизованными белками. Связывание хомячкового mAb с иммобилизованными белками TWEAK визуализировали с использованием соединенного с пероксидазой хрена ослиного антихомячкового IgG (JacksonTWEAK TWEAK рование hTWEAK/ mTWEAK/ человека мыши лиганда 293 293 ТИФА TWEAK человека: mAb оценивали по их способности связываться с планшетом,покрытым TWEAK человека. ТИФА TWEAK мыши: mAb тестировали по их перекрестной реактивности с планшетом,покрытым TWEAK мыши.FACS блокирования лиганда: mAb тестировали по тому, способны ли они блокироватьFACS-анализ трансфектантов EBNA293: кДНК TWEAK человека и мыши использовали для трансфекции клеток линии EBNA293, иmAb тестировали по реактивности спустя 3 дня. Консерватизм антигенных эпитопов между видами не удивителен, если принять во внимание уровень белковой гомологии, выявленной между формами TWEAK мыши и человека(фиг. 1). FACS-анализ использовали для определения того, могут ли анти-TWEAK-mAb связываться с белками TWEAK, экспрессированными на поверхности клетки. Последовательности кДНК TWEAK человека и мыши были клонированы в состав экспрессирующего вектора СН 269 (Chicheportiche et al., 1997, J. Biol. Chem.,51, 32401-32410), и эти конструкции использовали для трансфекции с достижением перемежающейся экспрессии белка в клеткахEBNA293. Четыре mAb, включая AB.D3, эффективно связывались на клетках EBNA293,экспрессирующих TWEAK мыши (фиг. 2). Данные четыре mAb также были способны предотвращать связывание TWEAK человека с клетками НТ 29, для которых известна экспрессия одного или нескольких рецепторов TWEAK(например, фиг. 3). Взятые вместе, данные анализы методом FACS показали, что антиTWEAK-mAb специфическим образом распознавали белки TWEAK и могли модифицировать способность белков TWEAK связываться с одним или несколькими рецепторами TWEAK. Пример 2. Использование анти-TWEAKmAb AB.D3 для предотвращения развития спленомегалии, активации В-клеток и выработки Ig в мышиной модели хронического СТПХ. Хронический СТПХ индуцировали у самок мышей линии B6D2F1 в возрасте 6-8 недель с использованием трансплантата спленоцитовDBA/2 в соответствии с описанным в методах. Каждому реципиенту инъецировали 500 мкл(1 х 108) клеток в хвостовую вену. Экспериментальные группы получали трансплантат DBA/2(DBA/2F1), в то время как группа контрольных животных получала трансплантат B6D2F1mAb На 4/8 или не получали ничего. Животным вводили дозы по 250 мкг mAb внутрибрюшинно за 4 ч до введения трансплантата и через 2, 4 и 6 дней после этого. На 14-й день эксперимента мышей умерщвляли, и индекс селезенки подсчитывали как отношение массы селезенки к массе тела для каждого животного в контрольной группе F1F1, а среднюю величину принимали за 1,0. Средний индекс селезенки для всех других групп соотносили с контрольной величиной. Результаты, полученные в двух независимых экспериментах, показаны в табл. 2. У животных, получивших трансплантат DBA/2(DBA/2F1), и тех, которым ничего не вводили или вводили контрольное антитело На 4/8, выявили резкое увеличение массы селезенки по сравнению с контрольной группой F1F1. Этот результат отражен в индексе селезенки, который показал увеличение от нормализованного контрольного значения 1,0 до 2,6. Введение мышам анти-СD40L-mАb MR1 снижало индекс селезенки почти до контрольных значений (1,1),а введение анти-TWEAK-mAb AB.D3 снижало спленомегалию на 35% - до 1,7 (табл. 2). Таблица 2 Введение На 14-й день эксперимента мышей умерщвляли и взвешивали. Затем селезенку удаляли в стерильных условиях и взвешивали. Индекс селезенки подсчитывали как отношение массы селезенки к массе тела у каждого животного контрольной группы F1F1, a среднюю величину принимали за 1,0. Средний индекс селезенки для всех других групп соотносили с контрольной величиной. Анализ методом FACS использовали для определения активационного состояния у популяций лимфоцитов в селезенке у контрольных и больных мышей, представлявших группы с различными введениями. Исходно анализировали приживление донорских клеток, попавших в организм мышей различных групп. Донорские клетки выявляли в селезенках мышейреципиентов приблизительно с одинаковой долей (в среднем 6,2%) во всех группах обработкиDBA/2F1 (табл. 3). Этот результат показал, что введение различных mAb не влияет на приживление донорских клеток. Таблица 3 Введение Для FACS-анализа спленоциты от мышей каждой группы окрашивали на льду в течение 1 ч РЕ-связанным анти-Н 2kb и FITC-связанным анти-Н-2Dd с целью измерения экспрессии аллелей МНС. Спленоциты реципиента позитивны по обоим маркерам, в то время как донорские спленоциты негативны по Н-2kb. Величины процентов отражают процессы в популяции лимфоцитов, что определено по параметрам прямого и бокового рассеяния. 30 Далее, использовали два маркера активации лимфоцитов: экспрессию CD69 на Вклетках В 220+ и экспрессию L-селектина на СD4-позитивных иCD8-позитивных Тлимфоцитах. При сравнении контрольных мышей и мышей DBA/2F1, которым ничего не вводили, было отмечено увеличение доли Вклеток CD69+ с 2,5% до 6,2% (табл. 4). Такое возрастание количества СD69-позитивных Вклеток предотвращалось введением либо MR1(3,3%), либо AB.D3 (2,1%), но не На 4/8 (6,5%)(фиг. 4 и табл. 3). Данные двух экспериментов показаны в табл. 4. Таблица 4 Группа введения(дважды позитивных) клеток ЭкспеЭкспеСреднее римент 1 римент 2 2,5 2,0 2,25 6,2 5,5 5,9 6,5 4,7 5,6 3,3 н/опр. 3,3 2,1 3,2 2,65 Спленоциты окрашивали РЕ-меченным анти-В 220 и FITC-меченным анти-С 069 в течение 1 ч на льду, промывали в FACS-буфере и затем анализировали. Проценты основаны на событиях, имеющихся в популяции лимфоцитов, что определено по параметрам прямого и бокового рассеяния. Для изучения секреции Ig in vitro анализ методом ТИФА проводили на материале надосадочных фракций клеточных культур спленоцитов, происходящих от селезенок, взятых в группах с различными введениями. В табл. 5 приведены результаты второго эксперимента средние по 3 мышам из каждой группы. Введение MR1 или AB.D3 предотвращало 4-6-кратное увеличение спонтанной выработки IgG, выявленное в группах DBA/2F1, которым не вводили ничего или вводили На 4/8. Таблица 5 Группа введения Для анализа секреции Ig in vitro клетки пеллетировали и ресуспендировали в средеDMEM, содержащей 10% плодной телячьей сыворотки (ПТС) и 4 мМ глутамина, в концентрации 1 х 107 клеток на 1 мл. По 1 мл на лунку распределяли на 6-луночных планшетах. Клеточные надосадочные фракции выделяли через 24 ч. Величины представляют собой средние по 2 лункам на 1 мышь, причем по 3 мыши представляли каждую из групп введения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ блокировки развития, или лечения, или снижения тяжести, или проявлений заболевания трансплантат против хозяина,или неудачной трансплантации органа в результате отторжения трансплантата у животного,подразумевающий стадию введения указанному животному фармацевтической композиции, которая содержит терапевтически эффективное количество моноклонального антитела, направленного против полипептида TWEAK, являющегося членом семейства белков TNF, и фармацевтически приемлемый носитель. 2. Способ по п.1, в котором указанное моноклональное антитело, направленное против полипептида TWEAK, выбрано из группы,включающей в себя(c) рекомбинантное антитело. 3. Способ по п.1, в котором животное является млекопитающим. 4. Способ по п.3, в котором млекопитающее является человеком. 5. Способ по п.1, в котором указанное заболевание трансплантат против хозяина или неудачная трансплантация органа вызваны иммунным ответом, опосредованным клеткамиTh1. 6. Способ по п.1, в котором указанное заболевание трансплантат против хозяина или неудачная трансплантация органа вызваны иммунным ответом, опосредованным клеткамиTh2. 7. Способ по п.1, в котором указанное заболевание трансплантат против хозяина или неудачная трансплантация органа вызваны комбинацией иммунных ответов, опосредованных клетками Th1 и Th2.
МПК / Метки
МПК: A61P 37/06, A61K 38/17, C07K 16/28
Метки: блокировки, хозяина, заболевания, тяжести, снижения, трасплантат, развития, против, способ, проявлений
Код ссылки
<a href="https://eas.patents.su/19-4590-sposob-blokirovki-razvitiya-ili-snizheniya-tyazhesti-ili-proyavlenijj-zabolevaniya-trasplantat-protiv-hozyaina.html" rel="bookmark" title="База патентов Евразийского Союза">Способ блокировки развития, или снижения тяжести, или проявлений заболевания, “трасплантат против хозяина”</a>
Предыдущий патент: Водорастворимые комплексы трансплатины, проявляющие противораковую активность, и их применение
Следующий патент: Новые α-аминокислотные сульфонильные соединения, способ их получения и фармацевтические композиции, их содержащие
Случайный патент: Круглый строп для тяжелого режима работы