С-замещенные в кольце прегн-4-ен-21,17-карболактоны и фармацевтические продукты, содержащие их
Номер патента: 17570
Опубликовано: 30.01.2013
Авторы: Больманн Рольф, Ринг Свен, Прелле Катя, Кунке Йоахим, Цорн Лудвиг, Борден Штеффен
Формула / Реферат
1. Прегн-4-ен-21,17-карболактоны общей формулы I

в которой R6,7 представляет собой α- или β-метилен,
R9 представляет собой атом водорода и
R11 представляет собой атом брома, хлора или фтора или
R9 и R11 вместе означают связь.
2. Прегн-4-ен-21,17-карболактоны по п.1, отличающиеся тем, что R9 расположен в α-позиции.
3. Прегн-4-ен-21,17-карболактоны по п.1, отличающиеся тем, что R11 расположен в β-позиции.
4. Прегн-4-ен-21,17-карболактоны по п.1, отличающиеся тем, что атом галогена R11 представляет собой атом фтора или хлора.
5. Прегн-4-ен-21,17-карболактоны по п.4, отличающиеся тем, что атом галогена R11 представляет собой атом фтора.
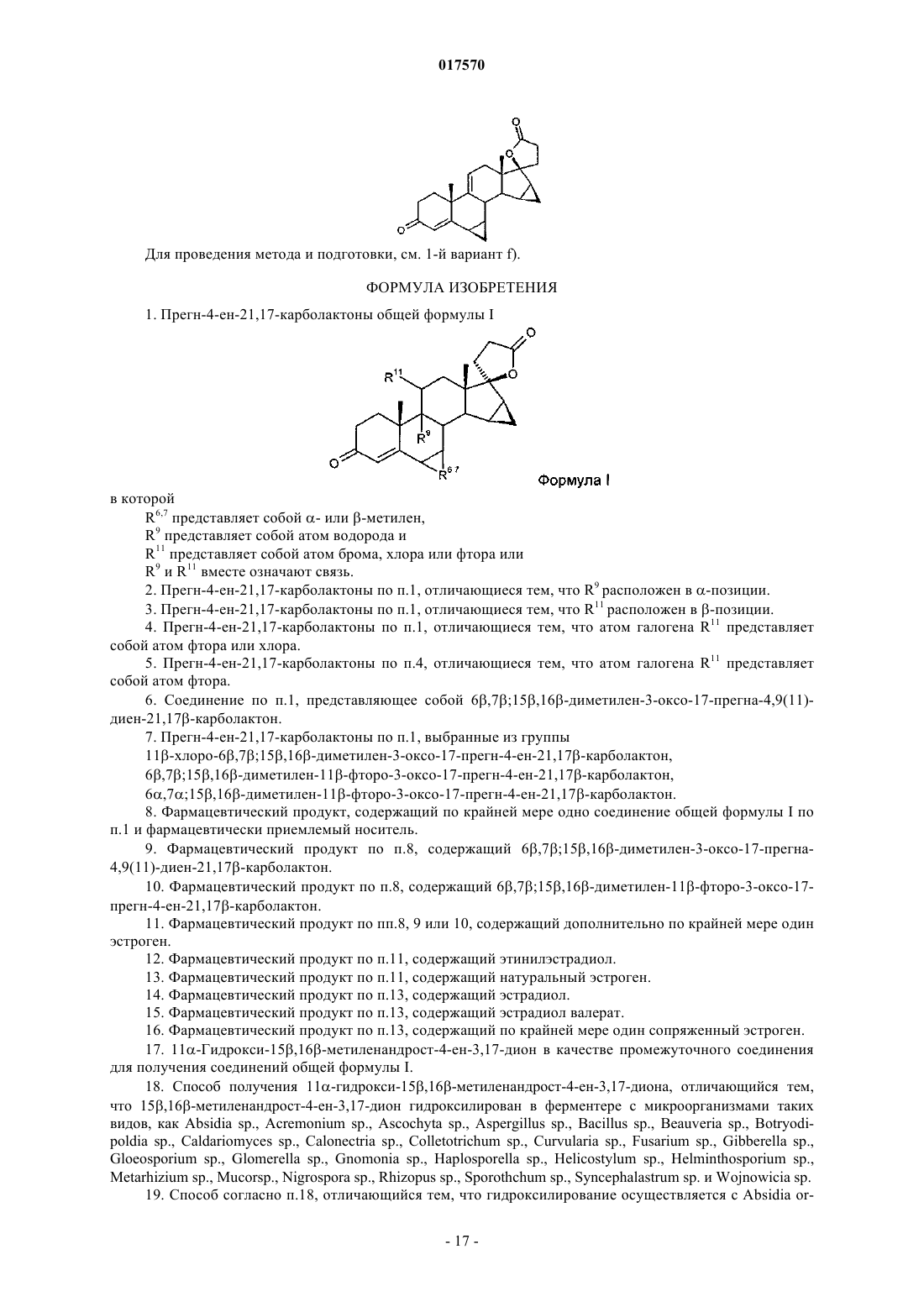
6. Соединение по п.1, представляющее собой 6β,7β;15β,16β-диметилен-3-оксо-17-прегна-4,9(11)-диен-21,17β-карболактон.
7. Прегн-4-ен-21,17-карболактоны по п.1, выбранные из группы
11β-хлоро-6β,7β;15β,16β-диметилен-3-оксо-17-прегн-4-ен-21,17β-карболактон,
6β,7β;15β,16β-диметилен-11β-фторо-3-оксо-17-прегн-4-ен-21,17β-карболактон,
6α,7α;15β,16β-диметилен-11β-фторо-3-оксо-17-прегн-4-ен-21,17β-карболактон.
8. Фармацевтический продукт, содержащий по крайней мере одно соединение общей формулы I по п.1 и фармацевтически приемлемый носитель.
9. Фармацевтический продукт по п.8, содержащий 6β,7β;15β,16β-диметилен-3-оксо-17-прегна-4,9(11)-диен-21,17β-карболактон.
10. Фармацевтический продукт по п.8, содержащий 6β,7β;15β,16β-диметилен-11β-фторо-3-оксо-17-прегн-4-ен-21,17β-карболактон.
11. Фармацевтический продукт по пп.8, 9 или 10, содержащий дополнительно по крайней мере один эстроген.
12. Фармацевтический продукт по п.11, содержащий этинилэстрадиол.
13. Фармацевтический продукт по п.11, содержащий натуральный эстроген.
14. Фармацевтический продукт по п.13, содержащий эстрадиол.
15. Фармацевтический продукт по п.13, содержащий эстрадиол валерат.
16. Фармацевтический продукт по п.13, содержащий по крайней мере один сопряженный эстроген.
17. 11α-Гидрокси-15β,16β-метиленандрост-4-ен-3,17-дион в качестве промежуточного соединения для получения соединений общей формулы I.
18. Способ получения 11α-гидрокси-15β,16β-метиленандрост-4-ен-3,17-диона, отличающийся тем, что 15β,16β-метиленандрост-4-ен-3,17-дион гидроксилирован в ферментере с микроорганизмами таких видов, как Absidia sp., Acremonium sp., Ascochyta sp., Aspergillus sp., Bacillus sp., Beauveria sp., Botryodipoldia sp., Caldariomyces sp., Calonectria sp., Colletotrichum sp., Curvularia sp., Fusarium sp., Gibberella sp., Gloeosporium sp., Glomerella sp., Gnomonia sp., Haplosporella sp., Helicostylum sp., Helminthosporium sp., Metarhizium sp., Mucorsp., Nigrospora sp., Rhizopus sp., Sporothchum sp., Syncephalastrum sp. и Wojnowicia sp.
19. Способ согласно п.18, отличающийся тем, что гидроксилирование осуществляется с Absidia orchidis, Absidia coerulea, Acremonium strictum, Ascochyta clematidina, Aspergillus alliaceus, Aspergillus awamori, Aspergillus fischeri, Aspergillus flavus, Aspergillus malignus, Aspergillus melleus, Aspergillus nidulans, Aspergillus niger, Aspergillus ochraceus, Aspergillus variecolor, Bacillus megaterium, Beauveria bassiana, Beauveria tenella, Botryodiplodia malorum, Caldariomyces fumago, Calonectria decora, Colletotrichum phomoides, Curvularia lunata, Fusarium oxysporium, Fusarium solani, Gibberella zeae, Glomerella cingulata, Gloeosporium fructigenum, Gloeosporium higgensianum, Gloeosporium kaki, Gloeosporium lacticolor, Gloeosporium olivarum, Glomerella fusaroides, Gnomonia cingulata, Haplosporella hesperedica, Helminthosporium sp., Helicostylum piriforme, Metarhizium anisopliae, Mucor plumbeus, Mucor spinosus, Nigrospora sphaerica, Rhizopus arrhizus, Rhizopus cohnii, Rhizopus delemar, Rhizopus japonicus, Rhizopus kazaensis, Rhizopus microsporus, Rhizopus oryzae, Rhizopus shanghaiensis, Rhizopus stolonifer, Rhizopus tritici, Sporotrichum sulfurescens, Syncephalastrum racemosum, Wojnowicia graminis и Wojnowicia hirta.
20. Способ согласно п.19, отличающийся тем, что гидроксилирование осуществляется с Absidia orchidis (ATCC 6647), Acremonium strictum (NRRL 5759), Ascochyta clematidina (CBS), Aspergillus alliaceus (ATCC 10060), Aspergillus awamori (CBS), Aspergillus fischeh (ATCC 1020), Aspergillus malignus (I Ml 16061), Aspergillus melleus (CBS), Aspergillus nidulans (ATCC 11267), Aspergillus niger (ATCC 9142, ATCC 11394), Aspergillus ochraceus (NRRL 405, NRRL 410, CBS 13252, ATCC 46504), Aspergillus variecolor (ATCC 10067), Bacillus megaterium (ATCC 13368), Beauveria bassiana (IFO 5838, ATCC 13144, IFO 4848, CBS 11025, CBS 12736, ATCC 7159), Botryodiplodia malorum (CBS 13450), Caldariomyces fumago (ATCC 16373), Calonectria decora (ATCC 14767), Curvularia lunata (IX 3, NRRL 2380), Fusarium solani (ATCC 12823), Fusarium oxysporum (ATCC 7808), Gibberella zeae (CBS 4474), Glomerella cingulata (ATCC 12097, ATCC 10534, CBS 23849, CBS 23749, ATCC 16646, IFO 6459, IFO 6425, IFO 6470, ATCC 15093, ATCC 10529, IFO 5257, ATCC 56596, ATCC 64682), Glomerella fusaroides (ATCC 9552), Gnomonia cingulata (CBS 15226), Haplosporella hesperedica (CBS 20837), Helicostylum piriforme (ATCC 8992), Helminthospohum sp. (NRRL 4671), Metarhizium anisopliae (IFO 5940), Mucor plumbeus (CBS 29563), Nigrospora sphaerica (ATCC 12772), Rhizopus arrhizus (ATCC 11145), Rhizopus oryzae (ATCC 4858, ATCC 34102, CBS 32947), Rhizopus stolonifer (ATCC 15441), Syncephalastrum racemosum (IFO 4827) и Wojnowicia graminis (CBS 89168).
Текст
Настоящее изобретение касается C-замещенных в кольце прегн-4-ен-21,17-карболактонов общей формулы I в которой R6,7 представляет собой - или -метилен, R9 представляет собой атом водорода и R11 представляет собой атом брома, хлора или фтора или R9 и R11 вместе означают связь. Новые соединения представляют собой антиминералокортикоидные прогестероны.(71)(73) Заявитель и патентовладелец: БАЙЕР ФАРМА АКЦИЕНГЕЗЕЛЬШАФТ (DE) 017570 Настоящее изобретение касается C-замещенных в кольце прегн-4-ен-21,17-карболактонов общей формулы IR6,7 представляет собой - или -метилен,R9 представляет собой атом водорода иR11 представляет собой атом брома, хлора или фтора илиR9 и R11 вместе означают связь. Атом водорода R9 преимущественно находиться в -положении. Атом галогена R11 преимущественно находиться в -положении. Атом фтора или хлора предпочтительны как атом галогена R11; в частности, атом фтора является предпочтительным. Соединения, указанные ниже, являются, в частности, предпочтительными согласно изобретению 11-хлоро-6,7;15,16-диметилен-3-оксо-17-прегн-4-ен-21,17-карболактон,6,7;15,16-диметилен-3-оксо-17-прегна-4,9(11)-диен-21,17-карболактон,6,7;15,16-диметилен-11-фторо-3-оксо-17-прегн-4-ен-21,17-карболактон,6,7;15,16-диметилен-11-фторо-3-оксо-17-прегн-4-ен-21,17-карболактон. Дроспиренон (6,7-15,16-диметилен-3-оксо-17-прегн-4-ен-21,17-карболактон) представляет собой новый прогестаген, который присутствует, к примеру, в оральном контрацептиве YASMIN и продукте ANGELIQ для лечения симптомов постменопаузы. Благодаря своему сравнительно низкому сходству с рецептором прогестагена и его сравнительно высокой ингибирующей овуляцию дозе, дроспиренон присутствует в YASMIN в относительно высокой суточной дозе - 3 мг. Дроспиренон известен тем, что имеет в дополнение к эффекту, способствующему наступлению или сохранению беременности, альдостеронантагонистический (антиминералокортикоидный) и антиандрогенный эффект. Эти два свойства делают дроспиренон подобным натуральному прогестогену прогестерона в его фармакологическом профиле, но в отличие от дроспиренона последний имеет недостаточную биодоступность при оральном введении препарата. Поэтому целью настоящего изобретения является обеспечить соединения, которые должны иметь более высокую активность, способствующую наступлению или сохранению беременности, чем дроспиренон in vivo. Это в конечном итоге предназначено для того, чтобы привести к низшей суточной дозе и к более низкому требуемому количеству активного соединения в веществе. Соединения, обеспеченные посредством настоящего изобретения, предназначены для того, чтобы дополнительно иметь антиминералокортикоидный эффект in vivo, который не более высок, чем у дроспиренона, а желательно менее интенсивен, чем у последнего. Также допольнительным предназначением является то, чтобы соединения изобретения имели антиандрогенную активность слабее, чем дроспиренон. В конце концов, соединения изобретения предназначены иметь высокую метаболическую стабильность.WO 2006072467 описывает соединения, которые показывают активность при тесте сохранения беременности у крыс, которая значительно выше, чем у дроспиренона, и показывают активность на минералкортикоидном рецепторе от гомогената почек у крыс, который сопоставим с дроспиреноном. Этими соединениями являются 18-метил-19-нор-17-прегн-4-ен-21,17-карболактоны. Соединения, имеющие in vitro меньше диссоциированного профиля, чем дроспиренон, в отношении с их связью к прогестогену и минералкортикоидным рецепторам, описаны в WO 2008000521. Этими соединениями являются 18-метил-19-нор-андрост-4-ен-17,17-спироэфиры. Способ получения 3-оксопрегн-4-ен-21,17-карболактонов путем окисления без металла 17-(3 гидроксипропил)-3,17-дигидроксиандростанов описан в EP 1746101 A1. Фармакологическая активность-1 017570 в основном не очевидна из EP 1746101 A1 для этих карболактонов. Упомянуто только конкретное соединение 6,7-15,16-диметилен-3-оксо-17-прегн-4-ен-21,17-карболактон (дроспиренон). 11-Гало- и 9,11-дегидросоединения, в частности, не показаны. Задача настоящего изобретения достигается за счет обеспечения C-замещенных в кольце прегн-4 ен-21,17-карболактонов общей формулы I, описанной тут. Соединения общей формулы I (и особенно те из примера 1 и 2) характеризуются улучшенным профилем эффектов. Соединения изобретения известны удивительно сильной активностью, способствующей наступлению или сохранению беременности, и имеют высокую активность в тесте сохранения беременности у крыс после подкожного введения. Соединения изобретения общей формулы имеют большую активность, способствующую наступлению или сохранению беременности, и в то же самое время более слабую связь с рецептором андрогена,чем дроспиренон. Дополнительно было обнаружено, что соединения изобретения показывают калийсохраняющий натрийуретический (антиминералкортикоидный) эффект у адреналэктомированных крыс. Благодаря их активности, способствующей наступлению или сохранению беременности, новые соединения общей формулы I могут использоваться самостоятельно или в комбинации с эстрогеном в фармацевтических продуктах для контрацепции. Таким образом, соединения изобретения общей формулы могут использоваться самостоятельно, к примеру, без эстрогена для приготовления так называемых ТП (таблетка прогестерона). Такие ТП на основе других соединений с активностью, способствующей наступлению или сохранению беременности,были описаны. К примеру, основанные на прогестогене левоноргестреле в форме продукта Microlut (28 единиц суточной дозы каждая содержит 30 мг левоноргестрела). Благодаря их благоприятному профилю эффектов, соединения изобретения в особенности приемлемы для лечения предменструальных симптомов, таких как головные боли, депрессивные настроения,задержка воды и мастодинии. Соединения изобретения благодаря их активности, способствующей наступлению или сохранению беременности, пригодны для дальнейшего возможного применения, которое является общеизвестным для прогестогенов, к примеру, для лечения тяжелых нарушений свертываемости, например меноррагии и метроррагии, лечения недостаточности желтого тела, т.е. лечения угрозы прерывания беременности, лечения задержки полового созревания и лечения состояний, которые делают, чтобы замена прогестогена казалась обозначенной. Таким образом, к настоящему изобретению также относятся фармацевтические продукты, которые включают по крайней мере одно соединение общей формулы I вместе с фармацевтически приемлемым носителем. Фармацевтическими продуктами, преимущественными согласно изобретению, являются те, что содержат 6,7;15,16-диметилен-3-оксо-17-прегна-4,9(11)-диен-21,17-карболактон или 6,7;15,16 диметилен-11-фторо-3-оксо-17-прегн-4-ен-21,17-карболактон в качестве активного ингредиента. К настоящему изобретению также относится фармацевтическая комбинация продуктов, которая, кроме соединения общей формулы I и фармацевтически приемлемого носителя, содержит эстроген. Дозировка соединений изобретения в контрацептивных продуктах должна быть от 0,01 до 5 мг, преимущественно от 0,01 до 2 мг в день. Суточная доза для лечения предменструальных симптомов должна быть от около 0,1 до 20 мг. Способствующие наступлению или сохранению беременности и эстрогенные компоненты активных ингредиентов преимущественно вводятся орально вместе в контрацептивных продуктах. Суточную дозу преимущественно вводят всю сразу. Подходящими эстрогенами в комбинированных продуктах изобретения для контрацепции являются эстрадиол и синтетические эстрогены, преимущественно этинилэстрадиол, а также местранол. Дополнительно возможными для использования являются сложные эфиры эстрадиола, а из них, в частности, валериат эстрадиола или еще бензоат эстрадиола. Эстроген вводят в суточном количестве, которое соответствует его эстрогенному эффекту от 0,01 до 0,04 мг этинилэстрадиола. Этинилэстрадиол самостоятельно используется в суточном количестве от 0,01 до 0,04 мг в таких противозачаточных продуктах. Новые соединения общей формулы I могут также применяться в фармацевтических продуктах для лечения пре-, пери- и постменопаузных симптомов и в продуктах для гормональной заместительной терапии (ГЗТ). Эстрогенами, которые применяются в продуктах этого типа для гормональной заместительной терапии, являются первоначально натуральные эстрогены, особенно эстрадиолы или его эстеры, например валериат эстрадиола, или еще сопряженные эстрогены (СЛЭ = сопряженные лошадиные эстрогены), как они присутствуют, к примеру, в продукте PREMARIN. Также недавно было описано введение фолиевой кислоты (WO 99/53910) или 5-метил-6-(S)тетрагидрофолата и, в частности, кальциевых солей 5-метил-6-(S)-тетрагидрофолиевой кислоты (Metafo-2 017570lin; WO 2006/120035), внутрь продуктов для контрацепции или гормональной заместительной терапии. Соответствующие стабильные композиции тетрагидрофолатов с одиночным прогестогеном и в частности с прогестогеном и с эстрогеном описаны в WO 2008/003432. В случае продуктов для контрацепции фолиевая кислота или компонент тетрагидрофолат служит для предотвращения мальформации созревания плода. Преимуществом в данном контексте является предотвращение ДНТ (дефектов нервной трубы) у новорожденных, серьезной физической мальформации. В рамках настоящего изобретения есть применение новых прогестогенов изобретения по аналогии с описанием в вышеуказанных публикациях для ранее известных прогестогенов. Фармацевтические продукты, основанные на новых соединениях, составлены известным образом путем переработки активного ингредиента в соответствующих случаях в комбинации с эстрогеном, с веществами носителями, растворителями, в случае необходимости с веществами, маскирующими вкус и т.д., которые распространены в фармацевтической технологии, и преобразуются в желаемую форму введения. Если применяются новые соединения, самостоятельно либо же вместе с эстрогеном совместно с фолиевой кислотой или с 5-метил-6-(S)-тетрагидрофолатом, могут быть получены соответствующие композиции, которые описаны в вышеуказанных публикациях. Подходящими для преимущественно орального введения являются таблетки, таблетки с покрытием,капсулы, гранулы, суспензии или растворы. Подходящими для парентерального введения, в частности, являются масляные растворы, такие как,например, растворы в кунжутном масле, касторовом масле или хлопковом масле. Также возможно добавлять солюбилизаторы, такие как, к примеру, бензилбензоат или бензиловый спирт, для увеличения растворимости. Также возможно ввести вещества изобретения в трансдермальную систему и вводить их с ней через кожу. Подобным образом возможно для новых соединений быть введенными самостоятельно или совместно с эстрогеном в систему для введения, которая высвобождает активное вещество или активные вещества в течение длительного времени, к примеру внутриматочную систему (ВМС), интравагинальное кольцо (ИВК), или в систему, которая имплантируется под кожу, из которой они постепенно высвобождаются после введения ее в полость матки или влагалища или имплантации под кожу. Фармакология Эффект, способствующий наступлению или сохранению беременности у овариэктомированных крыс. Эффект, способствующий наступлению или сохранению беременности, был определен, как описано в Muhn и др. (Muhn, P., Krattenmacher, R., Beier, S., Elger, W., и Schillinger, E. (1995). Дроспиренон: новый прогестоген с антиминералкортикоидной и антиандрогенной активностью. Фармакологическая характеристика на животных моделях. Контрацепция 51, 99-110). Это влечет за собой исследование свойств соединений для того, чтобы компенсировать недостаток прогестерона у овариэктомированных животных, которые не имеют своего собственного синтеза прогестерона, и для поддержания беременности ("сохранение беременности"). Были спарены животные женского пола весом 200-230 г. Животные были овариэктомированы на 8 день после случки (п.с.) и пролечены 5 мг/кг/д. эстрогена. Соединения для испытаний были даны в различных концентрациях (3, 10, 30 мг/кг/д.). Лечение было начато на 8 день п.с. и продолжалось 6 дней. Оценка. На следующий день после последнего лечения животные были вскрыты. Степень сохранения беременности была рассчитана путем деления количества живых плодов на количество обнаруживаемых участков имплантации. Наличие бьющегося сердца было решающим для оценки плода как живого. Не идентифицированные имплантационные сайты (контроль после овариэктомии) были определены как 0% сохранения беременности.ED50 (концентрация, при которой происходит половина максимального эффекта) была определена в качестве меры активности, способствующей наступлению или сохранению беременности. Было определено, что соединения изобретения имеют активность, способствующую наступлению или сохранению беременности, которая в четыре раза выше, чем эффект, способствующий наступлению или сохранению беременности дроспиренона.-3 017570 Таблица 1 Эффект, способствующий наступлению или сохранению беременности,соединений в тесте сохранения беременности Эффект, способствующий наступлению или сохранению беременности у овариэктомированных крыс, корреляция фармакокинетических значений и фармакодинамических эффектов. Для того чтобы описать разницу в их активности, способствующей наступлению или сохранению беременности, более точно, в изменении сохранения беременности экспериментальные образцы крови были дополнительно взяты в разное время, чтобы определить фармакокинетические параметры. Крысы были предварительно обработаны в этом случае, как описано в предыдущем эксперименте. Физиологическая основа фармакокинетической модели была разработана с использованием программ PK-SIM, версия 4.0.1 (Bayer Technology Services, Leverkusen, Germany), GastroPlus версия 5.2 (Simulations Plus, Inc.,Lancaster, CA, USA) и WinNonlin Professional (версия 5.2, Pharsight Corp., Mountain View, CA, USA). Соотношение было найдено между AUC (площадь под кривой профиля времени концентрации),достигнутой в ходе эксперимента, и измерением фармакологической активности, т.е. достигнутой сохранененной беременности. Таким образом, модель позволила оценить AUC50 значения. Статистически значимая разница в активностях, in vivo способствующих наступлению или сохранению беременности, между дроспиреноном и соединениями изобретения была найдена с AUC50 значениями больше чем в 6 раз ниже для соединений изобретения. Исходя из соотношения между системным воздействием и эффектом,была рассчитана AUC в крови, необходимая для достижения 80% успешной беременности в крысиной модели (табл. 2). Таблица 2 Показ количества, необходимого для достижения успешной беременности (рассчитанная) Антиминералкортикоидный эффект соединений у адреналэктомированных крыс (эксперименты диуреза). Антиминералкортикоидный эффект соединений определяли, как было описано выше Losert и др.Arzneimittelforschung 35, 459-471). Животные мужского пола весом 180-200 г были адреналэктомированы за 5 дней до эксперимента и получили замену глюкокортикоидов. Эксперимент диуреза проводился на 5 день после адреналэктомии. Непрерывную инфузию изотонического раствора NaCl плюс 5% глюкозы вводили животным внутривенно. Одновременным приемом 1 мкг/кг/ч d-альдостерона достигнут постоянный минералокортикоидный эффект, отличимый от удержания натрия и kaliuresis. Тестирующие соединения были введены подкожно в разных дозах (3, 10 и 30 мг/кг), и устранение альдостерониндуцированной задержки натрия указывает на антиминералкортикоидный эффект. Оценка. Животные содержались в метаболизме клеток, и фракции мочи собирали каждый час. Концентрацию натрия и ионов калия в моче определяли методом фотометрии пламени и оттуда рассчитывали отношение Na/K. Соотношения Na/K были изображены на графике в пределах установленного времени, и площадь под кривой [AUC] была определена. ED50 (концентрация, при которой происходит половина максимального эффекта) была определена в виде меры антиминералкортикоидной активности. Было обнаружено, что соединения изобретения имеют антиминералкортикоидную активность, которая составляет от около половины интенсивности до около интенсивности, такой как у дроспиренона.-4 017570 Таблица 3 Антиминералкортикоидный эффект соединений в эксперименте диуреза Антиандрогенный эффект соединений in vitro в анализе трансактивации антиандрогенов. Антиандрогенный эффект определяли, как описано в Schneider и др. (Schneider K., Graf E., Irran E.,Nicholson G., Stainsby F.M., Goodfellow M., Borden S.A., Keller S., Sussmuth R.D. и Fiedler H.P. (2008)Bendigoles A.-C., New Steroids from Gordonia australis Acta 2299, J. Antibiotics (Tokyo) 61 (6), 356-364). Культурной средой, используемой для культивирования клеток, используемых для анализа, былаRPMI (РАА, Е 15-49) с 10% FCS, 200 ммоль L-глутамина, 100 U/100 мкг/мл пенициллин/стрептомицин. Соответственные клеточные линии (клетки PC3, прочно трансфектированные с человеческим рецептором андрогена (hAR) и корреспондирующим структурным компонентом, который содержит люциферазу под контролем восприимчивого к андрогену ускорителя (MMTV были выращены при плотности 4104 клеток на ячейку на белых, непрозрачных пластинах для выращивания живых тканей с 96 ячейками в каждой (Perkin Elmer, P12-106-017) и поддержаны в культурной среде с 3% DCC-FCS (сыворотка,обработанная активированным углем для того, чтобы удалить интерферирующие компоненты, присутствующие в сыворотке). Соединения, которые должны быть исследованы, были добавлены спустя 8 ч, и клетки были инкубированы с соединениями в течение 16 ч. Эксперименты были проведены трижды. В конце инкубации содержащая эффектор среда была удалена и заменена лизирующим буфером. После исследования люциферазы был добавлен субстрат (Promega, E1501), пластины с этими 96 ячейками были затем вставлены в микропластинчатый люминометр (Pherastar, BMG labtech), и была измерена люминесценция. Значения IC50 были оценены с использованием программного обеспечения для вычисления взаимосвязей дозы-активности. Эффективность выражается в процентах максимального эффекта по сравнению с максимальным эффектом исходного антиандрогена (гидроксифлутамид). Было найдено, что соединения изобретения имеют более слабую антиандрогенную активность, чем дроспиренон in vitro. Таблица 4 Антиандрогенный эффект соединений в трансактивационном анализе Антиандрогенный эффект соединений у орхидэктомированных крыс (Хершбергер) Антиандрогенный эффект соединений был определен, как описано Muhn и др. (Muhn, P., Krattenmacher, R., Beier, S., Elger, W., and Schillinger, E. (1995). Дроспиренон: новый прогестоген с антиминералкортикоидной и антиандрогенной активностью. Фармакологическая характеристика на животных моделях. Контрацепция 51, 99-110). Это влечет за собой тестирование пригодности соединений для ингибирования зависимого от андрогена роста простаты, семенного пузырька и мышцы леватора у молодых мужского пола кастрированных крыс, получавших замену андрогена. С этой целью молодых крыс изначально кастрировали. 8 дней после орхидэктомии животные получали 1 мг/кг/день пропионат тестостерона (ПТ) подкожно самостоятельно или в комбинации с тестируемыми веществами (10 мг/кг/день) на протяжении семи дней. На 15-й день после орхидэктомии животных умерщвляют, простату, семенной пузырек и мышцу леватора иссекают и определяют относительно влажный вес. Ингибированный вызванный андрогеном рост служит мерой антиандрогенного эффекта тестируемого вещества. Антиандрогенный эффект был преобразован в процент ингибирования с полным эффектом (100% ингибирования), когда вес простаты соотносился с контрольной группой, и 0% ингибирования, когда вес простаты соотносился с ПТ лечением.-5 017570 Таблица 5 Антиандрогенный эффект соединений у орхидэктомированных крыс В соответствии с их клиническим профилем было установлено, что ацетат ципротерона показывает сильный антиандрогенный эффект, а дроспиренон меньший, но отличающийся антиандрогенный эффект. Это было найдено по контрасту с тем, что соединения изобретения не показывают антиандрогенный эффект. Антиандрогенный эффект соединений у орхидэктомированных крыс, исследование экспрессии генов. Как модификация анализа Хершбергера, описаного выше, в дополнение животных умерщвляли через 24 ч после первого лечения (1 мг/кг ПТ, 10 мг/кг тестируемого вещества), и ткани простаты были немедленно подвержены шоковой заморозке сразу после вскрытия, а затем использовались для мРНК изоляции. Количественный метод ПЦР (TaqMan) был использован для исследования индукции (хкратный фактор индукции) андрогенстимулированных генов, в частности биосинтеза стероидов (к примеру, IDI1, H. M. 004508,2) в качестве меры андрогенного эффекта ПТ и их ингибирование соединениями изобретения. Ингибирование было преображено в % ингибирования с полным ингибированием(100%), когда индукционный фактор равен 1, и 0% ингибирования, когда индукционным фактором является то же, что и ПТ. Таблица 6 Антиандрогенный эффект соединений: альтерация в экспрессии генов ПТ = пропионат тестостерона; ДПР = дроспиренон; ЦПТА = ципротерон ацетат. В соответствии с их клиническим профилем было установлено, что ацетат ципротерона показывает сильный антиандрогенный эффект, а дроспиренон меньший, но отличающийся антиандрогенный эффект. Это было найдено по контрасту с тем, что соединения примера 1 изобретения не показывают антиандрогенный эффект. Новые соединения общей формулы I получают согласно изобретению, как описано ниже. Путь синтеза новых С-замещенных в кольце прегн-4-ен-21,17-карболактонов показан на схеме 1, начиная, к примеру, с известного соединения 1 [CAS: 95218-07-8, Nickisch и др. J. Med. Chem. 1985, 546-550]. Введение 9,11 двойной связи, к примеру путем мезилирования и отщепления [Chamberlin и др. J. Условия: a) Aspergillus ochraceus; b) CH3SO2Cl, пиридин, DMAP; c) NaOAc, AcOH, Ac2O; d) дибромодиметилгидантоин, HF-пиридин (70%), дихлорометан; e) Bu3SnH/AIBN/бензол; f) 2,2-диметоксипропан, пиридиний-pTsOH; g) CH2=CHCH2OPO(NMe2)2, n-BuLi, ТГФ; h) 1. N-метилпирролидон,NaOAc/H2O, дибромодиметилгидантоин, 2. LiBr/Li2CO3; i) (CH3)3SO-I, ДМСО, NaH. Другой способ получения соединения изобретения показан на схеме 2.(5) Получен из известного 15,16-метиленандрост-4-ен-3,17-диона [Wiechert и др. Chem. Ber. 106,1973, 888] (4) путем микробиологического гидроксилирования в ферментере с микроорганизмами, которые вызывают гидроксилирование стероида в 11 положении, в частности в положении 11, к примеру, из видов Absidia sp., Acremonium sp., Ascochyta sp., Aspergillus sp., Bacillus sp., Beauveria sp., Botryodipoldiaoryzae (ATCC 4858, ATCC 34102, CBS 32947), Rhizopus stolonifer (ATCC 15441), Syncephalastrum racemosum (IFO 4827) и Wojnowicia graminis (CBS 89168). 11-Гидроксистероид 5 преобразован, к примеру, путем мезилирования и щелочным отщеплением метансульфоновой кислоты в 9(11) производное 7. Последний может быть преобразован, к примеру, путем бромофторирования 9(11) двойной связи известным способом, к примеру, в реагент Олаха/Nбромосукцинимидом [Olah и др. Synthesis 1973, 780] в дион 8, и преобразуется путем сокращения деброминирования, к примеру, с гидридом трибутилолова в фтородион 9. После защиты 4-ен-3-он системы (9),такой как диеноловый эфир 10, спиролактон установлен, к примеру, методом Sturtz [Synthesis 1980, 289] или альтернативно известным способом [Bittler Angew. i.e. 21 1982, 696; Laurent J. Steroid Biochem. 19 1983, 771]. Соединение 11 может быть преобразовано, к примеру, путем бромирования диенолового эфира по аналогии с методом [J.A. Zderic, Humberto Carpio, A. Bowers and Carl Djerassi Steroids 1 1963, 233] и отщиплением бромистого водорода путем нагревания соединения 6-бромо с основными реагентами, такими как, к примеру, LiBr или Li2CO3, в апротонных растворителях, таких как, к примеру, диметилформамид или 1-метил-2-пирролидон, при температуре 50-120C или еще при нагревании соединений 6 бромо в растворителе, таком как коллидин или лютидин, в 4,6-диен-3-он 12. Соединение 12 затем преобразовано путем метилирования 6 двойной связи известными процессами, к примеру, с диметилсульфоксониум метилидом [см., к примеру, DE-A 1183500, DE-A 2922500, EP-A 0019690, US-A 4291029; E.J.Corey und M. Chaykovsky, J. Am. Chem. Soc. 84 1962, 867] в соединение 13, в результате в смесь - и изомеров (соотношение зависит от используемых веществ, -изомеры обычно отчетливо преобладают),которая может быть разделена в индивидуальные изомеры, к примеру, путем хроматографии. Введение 11-фторогруппы может также иметь место, как показано на схеме 3, к примеру, начиная с 11-гидрокси-4-енедион 5 реакцией с нонафлилфторидом и DBU в органическом растворителе, к примеру тетрагидрофуране [см., к примеру, Bennua-Skalmowski, Tet. Lett. 1995, 2611], до образования смеси вышеупомянутого 11-фторстероида 9 и также вышеупомянутого 9(11) производного 7, который может быть выделен в индивидуальное соединение путем хроматографии и позже будет реагировать дополнительно,как описано выше. Схема 3 См. схему (R = метил, толил) для всех условий реакции. Начиная с 1-гидроксистероида 5 возможно в 5 стадий получить 4,6-диен-3-он 18 методами, описанными выше, из которых соединение 2 изобретения позже получено путем метилирования 6,7 двойной связи (см. выше). 4,6-Диен-3-он 18 также может быть получен, начиная с 4-ен-3-он 7, в три стадии методами, описанными выше. Промежуточные соединения формул 5, 6, 7, 8, 9, 10, 11, 12, 14, 15, 16, 17, 18, 19 и 20 - все новые соединения. Настоящее изобретение относится ко всем им. Настоящее изобретение дополнительно касается применения их как начальных соединений и промежуточных для получения соединения изобретения общей формулы I. Следующие примеры служат для пояснения изобретения более детально. Пример 1. 6,7;15,16-Диметилен-3-оксо-17-прегна-4,9(11)-диен-21,17-карболактон. 21,7 мл мезилхлорида было добавлено каплями к раствору 25 г 6,7;15,16-диметилен-11 гидрокси-3-оксо-17-прегн-4-ен-21,17-карболактона [CAS: 95218-07-8, Nickisch и др. J. Med. Chem. 1985,546-550] в 250 мл пиридина при 0C, и смесь перемешивали при 25C на протяжении 2 ч. Затем эту смесь разбавляли этилацетатом, промывали раствором бикарбоната натрия, водой и соляным раствором до нейтрализации, сушили над сульфатом натрия и концентрировали в вакууме при температуре 40C. Было получено 30 г чистого 6,7;15,16-диметилен-11-мезилокси-3-оксо-17-прегн-4-ен-21,17-карболактона в твердом виде. 1 0,5 мл ангидрида уксусной кислоты было добавлено к раствору 18.5 г 6,7;15,16-диметилен 11-мезилокси-3-оксо-17-прегн-4-ен-21,17-карболактона в 50 мл уксусной кислоты при 25C, и смесь была перемешана при температуре бани 100C на протяжении 8 ч. Затем добавляют в воду, экстрагируют три раза этилацетатом, промывают водой и соляным раствором до нейтрализации, сушат над сульфатом натрия и концентрируют в вакууме при температуре 40C. Было получено 15,2 г неочищенного 6,7;15,16-диметилен-3-оксо-17-прегна-4,9(11)-диен-21,17-карболактона. Хроматография на силикагеле с гексаном/этилацетатом привела к 7,5 г чистого продукта в твердом виде. MS (EI): m/z = 364 2 л колба Эрленмейера, содержащая 1 л питательного раствора, который был стерилизован в автоклаве при 121C в течение 30 мин, состоящий из 3%-го моногидрата глюкозы, 1%-го жидкого кукурузного экстракта, 0,2% нитрата натрия, 0,1% первичного кислого фосфата калия, 0,2% вторичного кислого фосфата калия, 0,05% хлорида калия, 0,05% магния сернокислого семиводного и 0,002% сульфата железа(II) семиводного (подогнан к pH 6,0), был инокулирован с 2 мл ледяного ДМСО культурой рода Aspergillus ochraceus (NRRL 405), его встряхивали при 27C на ротационном шейкере при 165 об/мин в течение 71,5 ч. Эта прекультура использовалась для инокулирования 20 л ферментера, который был заполнен 19 л стерильной среды того же самого финального состава, как описано для прекультуры. Кроме того,перед стерилизацией было также добавлено 1,0 мл силиконового масла и 1,0 мл Synperonic для контроля пенообразования. Этот ферментер был инкубирован под сверхатмосферным давлением 0,7 бар, при температуре 28C, с аэрацией 8 л/мин и со скоростью перемешивания 350 об/мин в течение 47,5 ч. 2,5 л прекультуры были удалены из этого 20 л ферментера для того, чтобы инокулировать 50 л ферментер, который был наполнен 47,5 л стерильной среды того же самого финального состава, как описано для прекультуры. Перед стерилизацией были добавлены 2,5 мл силиконового масла и 2,5 мл Synperonic. После 10 ч начальной фазы роста под сверхатмосферным давлением 0,7 бар, при температуре 28C, с аэрацией 10 л/мин и со скоростью перемешивания 350 об/мин было добавлено 10,0 г раствора 15,16-метиленандрост-4-ен-3,17-диона в 200 мл ДМФ. Перемешивание было продолжено с аэрацией. После 26 ч культуральная жидкость была собрана. 5,0 л прекультуры были удалены из этого 20 л ферментера для того, чтобы инокулировать 100 л ферментера, который был наполнен 95,0 л стерильной среды того же самого финального состава, как описано для прекультуры. Перед стерилизацией были добавлены 5,0 мл силиконового масла и 5,0 млSynperonic. После 10 ч начальной фазы роста под сверхатмосферным давлением 0,7 бар, при температуре 28C, с аэрацией 20 л/мин и со скоростью перемешивания 350 об/мин было добавлено 20,0 г раствора 15,16-метиленандрост-4-ен-3,17-диона в 400 мл ДМФ. Перемешивание было продолжено с аэрацией. После 26,25 ч культуральная жидкость была собрана. Две культуральные жидкости были скомбинированы и экстрагированы 60 л метилизобутилкетона в течение 19,75 ч. Комбинированные органические фазы были выпарены досуха. Остаток был промыт гексаном в целях извлечения силиконового масла. Продукт затем был кристаллизован из ацетона и 19,2 г(61% теоретического) 11-гидрокси-15,16-метиленандрост-4-ен-3,17-диона были выделены. 100 мг были рафинированы посредством препаративного ВЭЖХ (25040 мм, Luna C18, 10 , 100 А,вода-ацетонитрил 70:30, 100 мл/мин). Т.п.: 225/247-249C 23 мл мезил хлорида были добавлены по капле к раствору 22 г 11-гидрокси-15,16 метиленандрост-4-ен-3,17-диона в 220 мл пиридина при 0C, и смесь была перемешана при 25C в течение 2 ч. Затем она была разбавлена этилацетатом, промыта раствором бикарбоната натрия, водой и солевым раствором до нейтрального состояния, высушена через сульфат натрия и выпарена под вакуумом при 40C. Было получено 24,7 г 11-мезилокси-15,16-метиленандрост-4-ен-3,17-диона. 1 0,82 мл уксусного ангидрида было добавлено к 25,6 г раствора 11-мезилокси-15,16 метиленандрост-4-ен-3,17-диона в 80 мл уксусной кислоты при 25C, и смесь была перемешана при температуре бани 100C в течение 8 ч. Это сопровождалось добавлением в воду, экстракцией три раза этилацетатом, промыванием водой и солевым раствором до нейтрального состояния, высушиванием через сульфат натрия и выпариванием под вакуумом при 40C. Кристаллизация из этилацетата имела своим результатом 16,4 г 15,16-метиленандроста-4,9(11)диен-3,17-диона. 1 24,5 мл 70% концентрации HF/пиридин были медленно добавлены к 8,76 г суспензии дибромгидантоина в 250 мл дихлорметана. 16,3 г 15,16-метиленандроста-4,9(11)-диен-3,17-диона были введены в полученный в результате раствор и перемешаны при комнатной температуре в течение 30 мин. Это сопровождалось выливанием в смесь 200 мл водного раствора аммиака (25%) и 300 мл льда, экстрагированием три раза этилацетатом, промыванием водой и солевым раствором до нейтрального состояния, высушиванием над сульфатом натрия и выпариванием под вакуумом при 40C. Кристаллизация остатка из этилацетата имела своим результатом 15,2 г 9-бром-11-фтор-15,16-метиленандрост-4-ен-3,17-дион. 1- 11017570 перемешан с 42 мл гидрида трибутилолова и 416 мг азобисизобутиронитрила при 80C в течение 30 мин. Смесь была выпарена под вакуумом и остаток был хроматографирован на силикагеле 60. Кристаллизация из этилацетата имела своим результатом 18,7 г 11-фтор-15,16-метиленандрост-4-ен-3,17-диона. 1 1,3 г пиридина тозилата были введены в 10,79 г суспензии 11-фтор-15,16-метиленандрост-4-ен 3,17-диона в 220 мл 2,2-диметоксипропана. Затем они были перемешаны при температуре бани 100C в течение 3 ч. После охлаждения до комнатной температуры 2,5 мл триэтиламина были добавлены и смесь была выпарена досуха под вакуумом. Остаток был перемешан с 30 мл метанола и отфильтрован с отсасыванием. Было получено 9,6 г 11-фтор-3-метокси-15,16-метиленандроста-3,5-диен-17-она. 1 14 г аллилтетраметилфосфородиамидата, растворенные в 30 мл тетрагидрофурана, были добавлены по капле к 91 мл 1,6 М раствору бутиллития (в гексане) при -50C. После перемешивания при -20C в течение 30 мин было введено 22 мл N,N,N,N-тетраметилэтандиамина, и смесь нагревали до комнатной температуры. Раствор 15 г 11-фтор-3-метокси-15,16-метиленандроста-3,5-диен-17-она в 80 мл тетрагидрофурана был добавлен и смесь была перемешана при комнатной температуре в течение 4 ч. Это сопровождалось добавлением насыщенного водного раствора хлорида аммония и выливанием в воду, экстрагированием три раза этилацетатом, промыванием водой и солевым раствором до нейтрального состояния, высушиванием через сульфат натрия и выпариванием под вакуумом при 40C. Красталлизация из этилацетата имела своим результатом 15,8 г 11-фтор-3-метокси-15,16-метилен-17-прегна-3,5-диен 21,17-карболактона. 1 14,5 мл 10% концентрации раствор ацетата натрия и 5,11 г 1,3-дибромо-5,5-диметилгидантоин были постепенно добавлены в порциях при 0C к 13,5 г суспензии 11-фтор-3-метокси-15,16-метилен-17 прегна-3,5-диен-21,17-карболактона в 150 мл 1-метил-2-пирролидона. Смесь затем была перемешана при 0C (ледяная баня) в течение 0,5 ч и после добавления 4,86 г бромида лития и 4,27 г карбоната лития перемешана при температуре бани 100C в течение 3,5 ч. Затем это было налито в ледяную воду/хлорид натрия, и выделенный осадок был отфильтрован. Хроматография на силикагеле 60 (элюирование с гексаном/этилацетатом 1:1) имело своим результатом 9,1 г 11-фтор-15,16-метилен-3-оксо-17-прегна-4,6 диен-21,17-карболактона. 1 2,39 г гидрида натрия (60% в минеральном масле) были добавлены в порциях к 13,41 г раствору иодида триметилсульфоксониума в 250 мл сухого ДМСО при комнатной температуре и, после того как добавление было выполнено, смесь была перемешана при комнатной температуре в течение 3 ч. Затем 8,38 г 11-фторо-15,16-метилен-3-оксо-17-прегна-4,6-диен-21,17-карболактона были введены, и смесь была перемешана при комнатной температуре в течение 6 ч. Это сопровождалось выливанием в воду,экстрагированием три раза этилацетатом, промыванием водой и солевым раствором до нейтрального состояния, высушиванием через сульфат натрия и выпариванием под вакуумом при 40C. Очистка была проведена посредством хроматографии на силикагеле 60 (элюирование с гексаном этилацетатом 1:4). 2,6 г 6,7;15,16-диметилен-11-фтор-3-оксо-17-прегн-4-ен-21,17-карболактона были получены в виде фракции А. MS (EI): m/z = 384 (М+), 349, 273, 260; 1(d(br), 1H), 2.35 (m, 1H), 2.27 (m, 1H), 2.17-2.10 (m, 2H), 2.02-1.95 (m, 2H), 1.83 (m, 1H), 1.68-1.62 (m, 2H),1.61-1.52 (m, 2H), 1.49 (m, 1H), 1.40 (m, 1H), 1.29 (d, 3H), 1.25 (m, 1H), 1.21 (m, 1H), 1.15 (d, 3H), 1.04 (m,1H), 0.59 (m, 1 Н). Альтернативный метод для синтезирования. Пример 2. 0,47 мл 1,8-диазобицикло[5.4.0]ундек-7-ен (1.5-5) было добавлено по капле к 630 мг раствора 11 гидрокси-15,16-метиленандрост-4-ен-3,17-диона в 16 мл тетрагидрофурана при 0C таким образом,что внутренняя температура не превышала 5C. Смесь затем была перемешана при 0C в течение 30 мин,0,55 мл фторида декафторбутан-1-сульфонила были добавлены по капле таким образом, что внутренняя температура не превышала 5C, и смесь была перемешана при 0C в течение дополнительных 1,5 ч. Затем это было разбавлено этилацетатом, промыто 2 М серной кислоты, насыщенным раствором бикарбоната натрия и воды, высушено через сульфат натрия и выпарено под вакуумом при 40C. Хроматография на силикагеле после элюирования с гексаном/этилацетатом (1:1) имела своим результатом 15,16 метиленандроста-4,9(11)-диен-3,17-дион в виде фракции 1. 1 0,37 г 6,7;15,16-диметилен-11-фторо-3-оксо-17-прегн-4-ен-21,17-карболактона было получено как фракция B примера 2.- 13017570 Альтернативные методы синтеза примера 1. 1-й вариант. 3,2 г пиридин тозилата было введено в суспензию 27 г 11-гидрокси-15,16-метиленандрост-4-ен 3,17-диона в 422 мл 2,2-диметоксипропана. Затем смесь перемешивали при температуре бани 100C на протяжении 18 ч. Охлаждали до комнатной температуры с последующим добавлением 10 мл триэтиламина и выпаривали в вакууме досуха. Остаток перемешивали с 60 мл метанола и фильтровали с отсасыванием. Было получено 14,3 г 11-гидрокси-3-метокси-15,16-метиленандрост-3,5-диен-17-она. 1 10,24 г аллилтетраметилфосфородиамидата, растворенного в 13 мл тетрагидрофурана, было добавлено каплями к 66,6 мл 1,6 М раствора бутиллития (в гексане) при -50C. После перемешивания при-20C на протяжении 30 мин было введено 16 мл N,N,N',N'-тетраметилэтандиамина и затем был каплями добавлен раствор 5 г 11-гидрокси-3-метокси-15,16-метиленандрост-3,5-диен-17-она в 33,5 мл тетрагидрофурана. Смесь была нагрета до комнатной температуры и затем перемешивалась на протяжении 30 мин. За этим последовало добавление 25 мл насыщенного водного раствора хлорида аммония и выливание в воду, экстрагирование три раз этилацетатом, промывание водой и соляным раствором до нейтрализации, высушивание над сульфатом натрия и концентрирование в вакууме. Кристаллизация из диизопропилового эфира в результате дает 2,85 г 11-гидрокси-3-метокси-15,16-метилен-17-прегна-3,5-диен 21,17-карболактона. 1 14,8 мл 10% концентрации раствора ацетата натрия и 4 г 1,3-дибромо-5,5-диметилгидантоина были последовательно добавлены в порции при 0C к суспензии 13,5 г 11-гидрокси-3-метокси-15,16 метилен-17-прегна-3,5,9(11)-триен-21,17-карболактона в 144 мл 1-метил-2-пирролидона. Затем смесь перемешивали при 0C (ледяная баня) на протяжении 0,5 ч и после добавления 4,88 г литий бромида и 4,31 г литий карбоната перемешивали при температуре бани 80C на протяжении 3 ч. Затем смесь выливали в охлажденный насыщенный водный раствор хлорида натрия и экстрагировали этилацетатом, органическую фазу промывали водой и насыщенным водным раствором хлорида натрия, высушивали над сульфатом натрия и фильтровали и фильтрат концентрировали досуха. Было получено 12,8 г неочищенного продукта 11-гидрокси-15,16-метилен-3-оксо-17-прегна-4,6-диен-21,17-карболактона. Образец был хроматографирован на силикагеле со смесью гексана и этилацетата для аналитических целей. 1 12,8 г 11-гидрокси-15,16-метилен-3-оксо-17-прегна-4,6-диен-21,17-карболактона было растворено в 113 мл пиридина. Затем каплями было добавлено 10,91 мл метансульфонил хлорида. Смесь перемешивают при комнатной температуре на протяжении 90 мин и выливают в 1,5 л ледяной воды. Перемешивали на протяжении 2 ч с последующей фильтрацией с отсасыванием, и фильтрующий корж был высушен и хроматографирован на силикагеле смесью гексана и этилацетата. Было получено 5,4 г 11 мезилокси-15,16-метилен-3-оксо-17-прегна-4,6-диен-21,17-карболактона. 1 14,8 мл уксусной кислоты, 0,16 мл уксусного ангидрида и 2,44 г ацетата натрия перемешивались при 90C до тех пор, пока не растворился ацетат натрия. Было добавлено 5,3 г 11-мезилокси-15,16 метилен-3-оксо-17-прегна-4,6-диен-21,17-карболактона к этому раствору. Перемешивали при 100C на протяжении 5 ч с последующим выливанием в ледяную воду и экстрагированием три раза этилацетатом. Промывание органической фазы водой и насыщенным водным раствором хлорида натрия и высушивание над сульфатом магния было с последующей фильтрацией и конценрированием фильтрата. Хроматография на силикагеле смесью гексана и этилацетата в результате дает 2,12 г 15,16-метилен-3-оксо-17 прегна-4,6,9(11)-триен-21,17-карболактона. 1 0,09 г гидрида натрия (60% в минеральном масле) было добавлено в порции к раствору 0,52 г иодид триметилсульфоксония в 4 мл сухого ДМСО при комнатной температуре, смесь перемешивали при комнатной температуре на протяжении 2 ч. Затем было введено при 0C 0,2 г 15,16-метилен-3-оксо-17 прегна-4,6,9(11)-триен-21,17-карболактона, и смесь перемешивали при комнатной температуре на протяжении 2,5 ч. Затем смесь перемешивали в 100 мл серной кислоты (8 об.%) и экстрагировали этилацетатом. Органическая фаза была промыта последовательно водой и насыщенным раствором хлорида натрия,высушена над сульфатом натрия и отфильтрована. Концентрация в вакууме и хроматография на силикагеле с элюентом, содержащим этилацетат и гексан, в результате дает 30 мг 6,7;15,16-диметилен-3 оксо-17-прегна-4,9(11)-диен-21,17-карболактона. Для спектроскопических данных, см. пример 1b. 2-й вариант. 0,8 г пиридин тозилата было введено в суспензию 6,4 г 15,16-метиленандрост-4,6,9(11)-триен 3,17-диона в 106 мл 2,2-диметоксипропана. Затем смесь перемешивали при температуре бани 100C на протяжении 6 ч. Охлаждали до комнатной температуры с последующим добавлением 5 мл пиридина и после 5 мин выпаривали в вакууме досуха. Остаток перемешивали с 130 мл метанола и фильтровали с отсасыванием. Было получено 4,15 г 3-метокси-15,16-метиленандрост-3,5,9(11)-триен-17-она. 1 6,51 г аллилтетраметилфосфородиамидата, растворенного в 11,4 мл тетрагидрофурана, каплями добавляли к 42,2 мл 1,6 М раствора бутиллития (в гексане) при -50C. После перемешивания при -20C на протяжении 30 мин было введено 10,21 мл N,N,N'N'-тетраметилэтандиамина и затем раствор 4,14 г 3 метокси-15,16-метиленандрост-3,5,9(11)-триен-17-она в 29,4 мл тетрагидрофурана был добавлен каплями. Смесь была нагрета до комнатной температуры и перемешивалась на протяжении 30 мин. За этим последовало добавление 21 мл насыщенного водного раствора хлорида аммония и выливание в воду,экстрагирование трижды этилацетатом, промывание водой и соляным раствором до нейтрализации, высушивание над сульфатом натрия и концентрация в вакууме, после чего началась кристализация. После фильтрации с отсасыванием для удаления остатков растворителя получили 3,14 г 3-метокси-15,16 метилен-3,5,9(11)-триен-21,17-карболактона. 1 1,7 мл 10% концентрации раствора ацетата натрия и 0,6 г 1,3-дибромо-5,5-диметилгидантоина были последовательно добавлены в порции при 0C к суспензии 2,2 г 3-метокси-15,16-метилен-17-прегна 3,5,9(11)-триен-21,17-карболактона в 35 мл 1-метил-2-пирролидона. Затем смесь смешивали при 0C(ледяная баня) на протяжении 0,5 ч и после добавления 0,83 г бромида лития и 0,74 г карбоната лития перемешивали при температуре бани 100C на протяжении 3,5 ч. Затем выливали в ледяную воду/хлорид натрия и осадок отфильтровывали. Хроматография на силикагеле 60 (элюирование смесью гексан/этилацетат 1:1) в результате давала 1,2 г 15,16-метилен-3-оксо-17-прегна-4,6,9(11)-триен-21,17 карболактона. Для спектроскопических данных, сравнить первый вариант e). Для проведения метода и подготовки, см. 1-й вариант f). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Прегн-4-ен-21,17-карболактоны общей формулы IR6,7 представляет собой - или -метилен,R9 представляет собой атом водорода иR11 представляет собой атом брома, хлора или фтора илиR9 и R11 вместе означают связь. 2. Прегн-4-ен-21,17-карболактоны по п.1, отличающиеся тем, что R9 расположен в -позиции. 3. Прегн-4-ен-21,17-карболактоны по п.1, отличающиеся тем, что R11 расположен в -позиции. 4. Прегн-4-ен-21,17-карболактоны по п.1, отличающиеся тем, что атом галогена R11 представляет собой атом фтора или хлора. 5. Прегн-4-ен-21,17-карболактоны по п.4, отличающиеся тем, что атом галогена R11 представляет собой атом фтора. 6. Соединение по п.1, представляющее собой 6,7;15,16-диметилен-3-оксо-17-прегна-4,9(11)диен-21,17-карболактон. 7. Прегн-4-ен-21,17-карболактоны по п.1, выбранные из группы 11-хлоро-6,7;15,16-диметилен-3-оксо-17-прегн-4-ен-21,17-карболактон,6,7;15,16-диметилен-11-фторо-3-оксо-17-прегн-4-ен-21,17-карболактон,6,7;15,16-диметилен-11-фторо-3-оксо-17-прегн-4-ен-21,17-карболактон. 8. Фармацевтический продукт, содержащий по крайней мере одно соединение общей формулы I по п.1 и фармацевтически приемлемый носитель. 9. Фармацевтический продукт по п.8, содержащий 6,7;15,16-диметилен-3-оксо-17-прегна 4,9(11)-диен-21,17-карболактон. 10. Фармацевтический продукт по п.8, содержащий 6,7;15,16-диметилен-11-фторо-3-оксо-17 прегн-4-ен-21,17-карболактон. 11. Фармацевтический продукт по пп.8, 9 или 10, содержащий дополнительно по крайней мере один эстроген. 12. Фармацевтический продукт по п.11, содержащий этинилэстрадиол. 13. Фармацевтический продукт по п.11, содержащий натуральный эстроген. 14. Фармацевтический продукт по п.13, содержащий эстрадиол. 15. Фармацевтический продукт по п.13, содержащий эстрадиол валерат. 16. Фармацевтический продукт по п.13, содержащий по крайней мере один сопряженный эстроген. 17. 11-Гидрокси-15,16-метиленандрост-4-ен-3,17-дион в качестве промежуточного соединения для получения соединений общей формулы I. 18. Способ получения 11-гидрокси-15,16-метиленандрост-4-ен-3,17-диона, отличающийся тем,что 15,16-метиленандрост-4-ен-3,17-дион гидроксилирован в ферментере с микроорганизмами таких видов, как Absidia sp., Acremonium sp., Ascochyta sp., Aspergillus sp., Bacillus sp., Beauveria sp., Botryodipoldia sp., Caldariomyces sp., Calonectria sp., Colletotrichum sp., Curvularia sp., Fusarium sp., Gibberella sp.,Gloeosporium sp., Glomerella sp., Gnomonia sp., Haplosporella sp., Helicostylum sp., Helminthosporium sp.,Metarhizium sp., Mucorsp., Nigrospora sp., Rhizopus sp., Sporothchum sp., Syncephalastrum sp. и Wojnowicia sp. 19. Способ согласно п.18, отличающийся тем, что гидроксилирование осуществляется с Absidia or- 17017570sp., Helicostylum piriforme, Metarhizium anisopliae, Mucor plumbeus, Mucor spinosus, Nigrospora sphaerica,Rhizopus arrhizus, Rhizopus cohnii, Rhizopus delemar, Rhizopus japonicus, Rhizopus kazaensis, Rhizopus microsporus, Rhizopus oryzae, Rhizopus shanghaiensis, Rhizopus stolonifer, Rhizopus tritici, Sporotrichum sulfurescens, Syncephalastrum racemosum, Wojnowicia graminis и Wojnowicia hirta. 20. Способ согласно п.19, отличающийся тем, что гидроксилирование осуществляется с Absidia orchidis (ATCC 6647), Acremonium strictum (NRRL 5759), Ascochyta clematidina (CBS), Aspergillus alliaceus
МПК / Метки
МПК: A61P 5/34, A61K 31/58, A61P 5/42, C07J 53/00, A61P 5/28
Метки: продукты, содержащие, s-замещенные, прегн-4-ен-21,17-карболактоны, фармацевтические, кольце
Код ссылки
<a href="https://eas.patents.su/19-17570-s-zameshhennye-v-kolce-pregn-4-en-2117-karbolaktony-i-farmacevticheskie-produkty-soderzhashhie-ih.html" rel="bookmark" title="База патентов Евразийского Союза">С-замещенные в кольце прегн-4-ен-21,17-карболактоны и фармацевтические продукты, содержащие их</a>
Предыдущий патент: Способ формирования изображения на металлизированной алюминием поверхности рулонного полимерного материала и травильный раствор для его осуществления
Следующий патент: Многофункциональное клапанное устройство для резервуара для газа
Случайный патент: Лекарственная форма парацетамола