Применение пептидных соединений для лечения боли при раке кости, а также боли, вызванной химиотерапией и нуклеозидами
Формула / Реферат
1. Применение соединения, имеющего формулу (IIb)
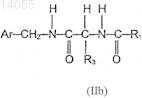
где Аr означает фенил, который не замещен или замещен по меньшей мере одним галогеном;
R3 означает CH2-Q, где Q - это алкокси, содержащий 1-6 атомов углерода, и
R1 означает алкил, содержащий 1-6 атомов углерода;
или его фармацевтически приемлемой соли, для получения фармацевтической композиции, полезной для предотвращения, облегчения и/или лечения боли при опухолях, боли, индуцированной химиотерапией, и/или боли, индуцированной по меньшей мере одним нуклеозидом и/или по меньшей мере одним аналогом нуклеозида, причем опухолевая боль является опухолевой болью, ассоциированной со СПИДом, болью при раке кости, болью, производимой при прогрессии опухоли путем инфильтрации в или давлении на кость, внутренние органы, мягкую ткань, болью, индуцированной метастазами, болью, индуцированной метастазами при раке кости, и/или болью, индуцированной метастатической болезнью у пациентов с раком груди, раком простаты или раком легких.
2. Применение по п.1, где Аr означает незамещенный фенил.
3. Применение по п.1, где галоген представлен фтором.
4. Применение по любому из пп.1-3, где R3 означает СН2-Q, где Q означает алкокси, содержащий 1-3 атома углерода.
5. Применение по любому из предшествующих пунктов, где соединение находится в R-конфигурации.
6. Применение по п.1, где соединение формулы (IIb) представляет собой (R)-2-ацетамидо-N-бензил-3-метоксипропионамид, O-метил-N-ацетил-D-серин-m-фторбензиламид, или О-метил-N-ацетил-D-серин-n-фторбензиламид или его фармацевтически приемлемую соль.
7. Применение по п.5 или 6, где соединение является, по существу, энантиомерно чистым.
8. Применение по любому из предшествующих пунктов, где индуцированная химиотерапией боль представляет собой индуцированную химиотерапией невропатическую боль, боль, индуцированную алкалоидами барвинка, и/или боль, индуцированную винкристином, и/или когда боль, индуцированная нуклеозидом и/или аналогами нуклеозида, представляет собой болезненную невропатию, индуцированную нуклеозидами или аналогами нуклеозидов, боль, индуцированную антиопухолевыми или антивирусными аналогами нуклеозидов, боль, индуцированную антивирусными аналогами нуклеозидов при терапии СПИДа, и/или боль, индуцированную AZT, ddC, ddI или/и d4T.
9. Применение по любому из предшествующих пунктов, в котором получают фармацевтическую композицию для лечения дозами соединения, составляющими по меньшей мере 100 мг/день.
10. Применение по любому из предшествующих пунктов, в котором получают фармацевтическую композицию для лечения дозами соединения, составляющими по меньшей мере 200 мг/день.
11. Применение по любому из предшествующих пунктов, в котором получают фармацевтическую композицию для лечения дозами соединения, составляющими по меньшей мере 300 мг/день.
12. Применение по любому из предшествующих пунктов, в котором получают фармацевтическую композицию для лечения дозами соединения, составляющими по меньшей мере 400 мг/день.
13. Применение по любому из предшествующих пунктов, в котором получают фармацевтическую композицию для лечения дозами соединения, составляющими максимум 6 г/день.
14. Применение по любому из предшествующих пунктов, в котором получают фармацевтическую композицию для лечения дозами соединения, составляющими максимум 1 г/день.
15. Применение по любому из предшествующих пунктов, в котором получают фармацевтическую композицию для лечения дозами соединения, составляющими максимум 600 мг/день.
16. Применение по любому из предшествующих пунктов, в котором получают фармацевтическую композицию для лечения повышающимися ежедневными дозами до тех пор, пока не будет достигнута заданная ежедневная доза, которая сохраняется на время дальнейшего лечения.
17. Применение по любому из предшествующих пунктов, в котором получают фармацевтическую композицию для лечения по три дозы в день.
18. Применение по любому из пп.1-16, в котором получают фармацевтическую композицию для лечения по две дозы в день.
19. Применение по любому из пп.1-16, в котором получают фармацевтическую композицию для лечения по одной дозе в день.
20. Применение по любому из предшествующих пунктов, в котором получают фармацевтическую композицию для введения, приводящего к концентрации в плазме крови от 0,1 до 15 мкг/мл (в нижней точке) и от 5 до 18,5 мкг/мл (на пике), рассчитанной как среднее значение для множества подвергаемых лечению субъектов.
21. Применение по любому из предшествующих пунктов, в котором фармацевтическая композиция приготавливается для перорального или внутривенного введения.
22. Применение по любому из предшествующих пунктов, в котором фармацевтическая композиция дополнительно включает активное средство для предотвращения, облегчения и/или лечения вирусной инфекции, такой как ВИЧ-инфекция, включая СПИД, рака, такого как рак груди, рак простаты, рак легких, рак кости, метастатической болезни и/или прогрессии опухоли путем инфильтрации в или давления на кость, внутренние органы, мягкую ткань или нервы, где указанное дополнительное активное средство выбрано из лекарственных средств для лечения СПИД-антиретровирусных нуклеозидных аналогов ddC (2',3'-дидезоксицитидин), ddI (2',3'-дидезоксиинозин) или d4T (2',3'-дидегидро-3'-дезокситимидин), алкалоидов барвинка типа винкристина, таксола, сурамина, цисплатина, карбоплатина или оксалиплатина.
23. Применение по п.22, где фармацевтическая композиция составляет единую лекарственную форму или составляет раздельные лекарственные формы, содержащие первую композицию, включающую соединение по любому из пп.1-7, и вторую композицию, включающую дополнительное активное средство.
24. Применение по любому из предшествующих пунктов, в котором получают фармацевтическую композицию для введения млекопитающим.
25. Применение по п.24, в котором получают фармацевтическую композицию для введения человеку.
Текст
ПРИМЕНЕНИЕ ПЕПТИДНЫХ СОЕДИНЕНИЙ ДЛЯ ЛЕЧЕНИЯ БОЛИ ПРИ РАКЕ КОСТИ, А ТАКЖЕ БОЛИ, ВЫЗВАННОЙ ХИМИОТЕРАПИЕЙ И НУКЛЕОЗИДАМИ Настоящее изобретение направлено на применение соединения, имеющего формулу (IIb), где Ar означает фенил, который не замещен или замещен по меньшей мере одним галогеном; R3 означает СН 2-Q, где Q - это алкокси, содержащий 1-6 атомов углерода, и R1 означает алкил,содержащий 1-6 атомов углерода; или его фармацевтически приемлемой соли для лечения опухолевой боли, в частности боли при раке кости, для лечения боли, индуцированной химиотерапией, и боли, индуцированной нуклеозидами.(71)(73) Заявитель и патентовладелец: ШВАРЦ ФАРМА АГ (DE) 014055 Область техники, к которой относится изобретение Настоящее изобретение направлено на применение класса пептидных соединений для лечения боли при опухоли, в частности для лечения боли при раке кости, для лечения боли, вызванной химиотерапией,и для лечения боли, вызванной нуклеозидами. Сведения о предшествующем уровне техники Известно, что определенные пептиды проявляют активность, направленную на центральную нервную систему (ЦНС), и полезны при лечении эпилепсии и других заболеваний ЦНС. Эти пептиды, описанные в патенте US5,378,729, имеют формулу (Ia): где R означает водород, низший алкил, низший алкенил, низший алкинил, арил, арил низший алкил,гетероциклил, гетероциклил низший алкил, низший алкил гетероциклил, низший циклоалкил, низший циклоалкил низший алкил, при этом R не замещен либо замещен по меньшей мере одной электроноакцепторной группой или электронодонорной группой;R1 означает водород или низший алкил, низший алкенил, низший алкинил, арил низший алкил,арил, гетероциклил низший алкил, гетероциклил, низший циклоалкил, низший циклоалкил низший алкил, каждый из которых не замещен либо замещен одной электронодонорной или одной электроноакцепторной группой; иR2 и R3 независимо означают водород, низший алкил, низший алкенил, низший алкинил, арил низший алкил, арил, гетероциклил, гетероциклил низший алкил, низший алкил гетероциклил, низший циклоалкил, низший циклоалкил низший алкил, или Z-Y,при этом R2 и R3 могут быть не замещены либо замещены по меньшей мере одной электроноакцепторной группой или одной электронодонорной группой;Y означает водород, низший алкил, арил, арил низший алкил, низший алкенил, низший алкинил,галоген, гетероциклил, гетероциклил низший алкил, при этом Y может быть не замещен либо замещен электронодонорной группой или электроноакцепторной группой, с условием, что если Y означает галоген, то Z означает химическую связь или,ZY совместно означают NR4NR5R7, NR4OR5, ONR4R7, OPR4R5, PR4OR5, SNR4R7, NR4SR7, SPR4R5,или PR4SR5, или PR4SR7, NR4PR5R6 или PR4NR5R7,R4, R5 и R6 независимо означают водород, низший алкил, арил, арил низший алкил, низший алкенил или низший алкинил, при этом R4, R5 и R6 могут быть не замещены или замещены электроноакцепторной группой или электронодонорной группой; иR8 означает водород либо низший алкил, либо арил низший алкил, при этом арильная или алкильная группа может быть не замещена либо замещена электроноакцепторной или электронодонорной группой; иn=1-4; и а=1-3. В патенте US5,773,475 раскрыты также и другие соединения, применимые для лечения заболеваний ЦНС. Эти соединения представляют собой N-бензил-2-амино-3-метоксипропионамид, имеющий формулу (IIa): где Ar означает арил, который не замещен либо замещен галогеном; R3 означает низший алкокси иR1 означает метил. Патенты US 5,378,729 и 5,773,475 включены в настоящее изобретение путем отсылки. Однако ни в одном из этих патентов не описывается применение этих соединений для лечения боли при опухоли, в частности боли при опухоли кости, для лечения боли, индуцированной химиотерапией, и для лечения боли, индуцированной нуклеозидами.WO 02/074297 касается применения соединений согласно формуле IIa, где Ar означает фенил, который может быть замещен по меньшей мере одним галогеном, R3 означает низший алкокси, содержащий 1-3 атома углерода, и R1 означает метил, для получения фармацевтических композиций, применимых для-1 014055 лечения аллодинии, связанной с болью при периферической невропатии.WO 02/074784 касается применения соединений согласно формуле Ia и/или формуле IIa, проявляющих антиноцицептивные свойства для лечения различных типов и симптомов острой и хронической боли, особенно не невропатической воспалительной боли, например боли при ревматоидном артрите и/или вторичной боли при воспалительном остеоартрите. В настоящее время не существует анальгетика, который обладал бы сильным эффектом при различных болевых синдромах. Разные механизмы, приводящие к воспалительной или невропатической боли, затрудняют идентификацию соединений, которые имеют общую анальгезирующую активность. Мы находимся лишь в начале понимания механизмов, лежащих в основе различных болевых синдромов,подобных боли при раке (например, боли, вызванной опухолью кости), боли, индуцированной химиотерапией, или боли, индуцированной нуклеозидами, которые, по-видимому, имеют различное молекулярное происхождение. Антидепрессанты, антиконвульсанты или опиоиды, которые входят в группу соединений, применяемых при лечении боли, не характеризуются наличием общего принципа, касающегося их эффективности при лечении болевых синдромов. Это затрудняет предсказание активности новых соединений при лечении различных болевых синдромов и требует подробной характеристики с применением множественных моделей на животных. Невропатическая боль после повреждения или дисфункции периферической или центральной нервной системы остается трудной клинической проблемой, при которой отсутствует эффективное лечение(Bennett, 1994; Murphy and Reid, 2001). Для контроля некоторых форм невропатической боли применяются антиконвульсанты (Sindrup and Jensen, 1999; Jensen, 2002). SPM 927 (R-2-ацетамид-N-бензил-3 метоксипропионамид), называемый также гаркосеридом, или ADD 234037, является новым антиконвульсантом. Он принадлежит к сериям функционализированных аминокислот, которые были синтезированы как новый класс антиконвульсантов (Kohn et al. 1991). Настоящее исследование демонстрирует анальгезирующие эффекты SPM 927 в моделях боли при раке на крысах, в частности боли при раке кости или боли, индуцированной химиотерапией, а также боли, индуцированной аналогами нуклеозидов. Кость является третьим наиболее распространенным местом метастазов после легких и печени, она является первичным участком метастазной болезни у пациентов с раком груди, простаты и легких. Поражение кости, которое возникает при метастазной болезни, вызывает также тяжелую боль в кости, которая является основной клинической проблемой у больных раком. Этот тип боли трудно поддается лечению, что обусловлено ее периодичностью, прогрессирующей природой и ухудшением при движении. Доминирующим симптомом в этой модели боли является механическая аллодиния. Были продемонстрированы также термическая и механическая гиперальгезия, измеренные путем различия в весовой нагрузке на две нижних конечности (Medhurst et al., 2002). Лечение боли в кости у людей ограничено в основном применением опиоидов, однако эффективность сильнодействующих опиоидов минимальна, и эффективные дозы производят ряд вредных для здоровья побочных эффектов. Вследствие этого имеется клиническая потребность в новых способах лечения, которые могут применяться для предотвращения,лечения и облегчения боли, вызванной раком кости. Кандидаты на такую терапию для лечения боли, вызванной раком кости, могут быть оценены с применением моделей на крысах, поскольку крыса является наилучшей для тестирования поведенческих ответов на болевые стимулы. Одна из моделей предусматривает введение крысе карциномных клеток молочной железы в пространство костного мозга проксимальной части большой берцовой кости с применением метода оценки конечной точки боли (Medhurst etal., 2002), которая была проведена на 7-15 дни после имплантации опухоли. Боль, индуцированная химиотерапией, является формой невропатической боли, ассоциированной с нейротоксическими лекарственными препаратами, такими как алкалоиды барвинка, например винкристин, и характеризуется болезненной парестезией и дизестезией. Клиническая антинеопластическая эффективность винкристина ограничена развитием смешанной сенсоромоторной невропатии (Casey et al.,1973; Tanner et al., 1998), которая, по-видимому, проходит через две основные стадии (Weiss et al., 1974). В ранней стадии винкристин повреждает периферические аксоны, и основными симптомами являются парестезия и дизестезия. В последней стадии, которая имеет место наиболее часто, когда более высокие дозы даются в течение более длительного периода, исчезают аксоны, и основным клиническим признаком является потеря моторной функции. Описанная винкристиновая модель на крысах, по-видимому,отражает раннюю стадию вызванной винкристином химиотерапевтической невропатии. Пока лежащий в основе этого механизм не полностью понятен, но было описано, что происходит дезорганизация аксонального цитоскелета микротрубочек, а также увеличение диаметра немиелинизированных сенсорных аксонов (Quasthoff et al., 2002). Эти результаты демонстрируют, что индуцированная винкристином гиперальгезия сопровождается изменениями в структуре микротрубочек ноцицептивных сенсорных нейронов. Болезненная периферическая невропатия, вызванная аналогами нуклеозидов, стала распознаваться как важный источник болезненности у индивидуумов, инфицированных вирусом иммунодефицита человека (ВИЧ) (Cohen, 2002). Этот тяжелый, влияющий на здоровье побочный эффект может вызвать сокращение или даже прекращение терапии приобретенного синдрома иммунодефицита (СПИД) (Yatlin etal., 1999). Эта невропатия характеризуется внезапным началом интенсивной жгучей боли в обеих ногах и умеренной в руках на примерно 10-ой неделе лечения, которая со временем достигает чрезвычайной интенсивности (Dubinsky et. al. 1989). Биохимические механизмы, лежащие в основе этой невропатии, пока не установлены, хотя сообщалось, что в ее развитие вносит вклад митохондриальная токсичность. Недавно было сообщение о том, что интоксикация крыс антиретровирусными аналогами нуклеозидов, применяемых в терапии СПИДа, ddC (2',3'-дидезоксицитидин), ddl (2',3'-дидезоксиинозин) или ddT (2',3'дидегидро-3'-дезокситимидин) усиливают ноцицепцию у крысы (Joseph et al, 2004). Лежащий в основе этого механизм, по-видимому, отличается от такового, который вносит вклад в другие модели метаболической или токсической болезненной периферической невропатии, поскольку антигиперальгезирующие лекарственные средства в этих моделях являются эффективными. Ингибиторы протеинкиназы А, протеинкиназы С, протеинкиназы G, р 42/44-митоген-активируемой протеинкиназы (ERK1/2) и NO-синтазы не оказывают действия на периферические невропатии, и не действуют на индуцированную ингибитором гиперчувствительность обратной транскриптазы. Модуляторы внутриклеточной концентрации кальция(ТМВ-8 и Quin-2) являются единственными агентами, способными обращать эту гиперчувствительность интоксицированных животных, что позволяет обоснованно предполагать роль внутриклеточного кальция в этом типе нейропатической боли. Химиотерапия, например лечение алкалоидами барвинка, подобными винкристину, или таксолом,сурамином, цисплатином, карбоплатином или оксалиплатином, применяется для лечения пациентов,имеющих рак или ВИЧ-инфицированных. Кроме того, ВИЧ-инфицированные и/или имеющие опухоли пациенты лечатся также антиретровирусными или антивирусными препаратами. О применении соединений формулы (Ib) и/или формулы (IIb) для лечения боли при раке, в частности боли при раке кости, для лечения боли, индуцированной химиотерапией, или боли, индуцированной нуклеозидами, до настоящего времени не сообщалось. Таким образом, настоящее изобретение касается применения данных соединений формулы (IIb) для получения фармацевтической композиции для предотвращения, облегчения и/или лечения боли при опухолях, в частности боли при опухоли, ассоциированной со СПИДом, боли при раке кости, боли, производимой во время прогрессии опухоли путем инфильтрации в или давлении на кость, внутренние органы, мягкую ткань или нервы, и/или боли, индуцированной метастазами, такой как, но не ограничиваясь этим, боль при раке кости, индуцированная метастазами, боль, вызванная метастазной болезнью у пациентов с раком груди, простаты или легких. Дополнительно настоящее изобретение касается применения данных соединений формулы (IIb) для получения фармацевтической композиции для предотвращения, облегчения и/или лечения боли, индуцированной химиотерапией, такой как, но не ограничиваясь этим, невропатической боли, индуцированной химиотерапией, боли, индуцированной алкалоидами барвинка, боли, индуцированной винкристином,и/или боли, индуцированной таксолом, сурамином, цисплатином, карбоплатином, и/или оксалиплатином. Дополнительно настоящее изобретение касается применения соединений формулы (IIb) для приготовления фармацевтической композиции для предотвращения, облегчения и/или лечения боли, индуцированной нуклеозидами и/или аналогами нуклеозидов, такими как, но не ограничиваясь этим, болезненная периферическая невропатия, индуцированная нуклеозидами и/или аналогами нуклеозидов, боль, индуцированная противоопухолевыми и/или противовирусными аналогами нуклеозидов, и/или боль, индуцированная противоретровирусными аналогами нуклеозидов, такими как AZT (3'-азидотимидин), ddC,ddI и/или ddT, например, при терапии СПИДа. Изобретение также касается применения соединений формулы (IIb) для получения фармацевтической композиции для предотвращения, облегчения и/или лечения боли при опухолях, боли, индуцированной химиотерапией, и/или боли, индуцированной по меньшей мере одним нуклеозидом и/или одним аналогом нуклеозида. Сущность изобретения Неожиданно оказалось, что применение соединений (IIb), в частности (R)-2-ацетамид-N-бензил-3 метоксипропионамида (SPM 927), уменьшает механическую и термическую гиперальгезию, а также механическую и термическую аллодинию в модели индуцированной опухолью боли при раке кости, в модели невропатической боли, индуцированной химиотерапией и аналогами нуклеозидов. Соединение по изобретению имеет общую формулу (IIb) где Ar означает фенил, который не замещен либо замещен по меньшей мере одним галогеном; R3 означает -CH2-Q, где Q означает низший алкокси; и R1 означает низший алкил, в особенности, метил. Настоящее изобретение также касается фармацевтической композиции, включающей соединение по формуле (IIb), применимой дня предотвращения, облегчения и/или лечения боли при опухоли, в частности боли при опухоли, ассоциированной со СПИДом, боли при раке кости, боли, производимой во время прогрессии опухоли путем инфильтрации в или давлении на кость, внутренние органы, мягкую-3 014055 ткань или нервы и/или боли, индуцированной метастазами, такой как, но не ограничиваясь этим, боли при раке кости, индуцированной метастазами, боли, вызванной метастатической болезнью у пациентов с раком груди, простаты или легких. Дополнительно настоящее изобретение касается фармацевтической композиции, включающей соединения формулы (IIb), применимой для предотвращения, облегчения и/или лечения боли, индуцированной химиотерапией, такой как, но не ограничиваясь этим, невропатической боли, индуцированной химиотерапией, а также боли, индуцированной алкалоидами барвинка, боли,индуцированной винкристином, и/или боли, индуцированной таксолом, сурамином, цисплатином, карбоплатином, и/или оксалиплатином. Дополнительно настоящее изобретение касается фармацевтической композиции, включающей соединения формулы (IIb), применимой для предотвращения, облегчения и/или лечения боли, индуцированной нуклеозидами, и/или боли, индуцированной аналогами нуклеозидов, такими как, но не ограничиваясь этим, болезненной периферической невропатии, индуцированной нуклеозидами и/или аналогами нуклеозидов, боли, индуцированной противоопухолевыми и/или противовирусными аналогами нуклеозидов, и/или боли, индуцированной противоретровирусными аналогами нуклеозидов, такими как AZT, ddC, ddI и/или ddT, например, при терапии СПИДа. Изобретение также касается фармацевтической композиции, включающей соединения по формуле(IIb) для предотвращения, облегчения и/или лечения боли при опухолях, боли, вызванной химиотерапией, и/или боли, индуцированной по меньшей мере одним нуклеозидом и/или одним аналогом нуклеозида. Низшие алкильные группы, сами по себе или в сочетании с другими группами, представляют собой низший алкил, содержащий от 1 до 6 атомов углерода, в особенности от 1 до 3 атомов углерода, и могут быть линейными или разветвленными. К этим группам относятся метил, этил, пропил, изопропил,бутил, изобутил, трет-бутил, амил, гексил и им подобные. Низшие алкоксигруппы представляют собой низший алкокси, содержащий от 1 до 6 атомов углерода, в особенности от 1 до 3 атомов углерода, и могут быть линейными или разветвленными. К этим группам относятся метокси, этокси, пропокси, бутокси, изобутокси, трет-бутокси, пентокси, гексокси и им подобные. Термин галоген включает фтор, хлор, бром, йод и т.п. Наиболее предпочтительно применяются соединения формулы (IIb): где Ar означает фенил, который не замещен либо замещен по меньшей мере одним галогеном,R1 означает алкил, содержащий 1-3 атома углерода; иR3 означает СН 2-Q, где Q означает алкокси, содержащий 1-3 атома углерода. Наиболее предпочтительно R1 означает СН 3. Наиболее предпочтительно Q означает метокси. Наиболее предпочтительным галогеном является фтор. К наиболее предпочтительным соединениям относятся:(R)-2-ацетамидо-N-бензил-3-метоксипропионамид; О-метил-N-ацетил-D-серин-m-фторбензиламид; О-метил-N-ацетил-D-серин-n-фторбензиламид. Следует иметь в виду, что предусматривается, что к области действия настоящего изобретения относятся разнообразные комбинации и перестановки групп Маркуша по R1 и R3, описанным в настоящем изобретении. Кроме того, настоящее изобретение охватывает также соединения и композиции, содержащие один или несколько элементов каждой из группировок Маркуша по R1 и R3 и различные комбинации из них. Таким образом, например, настоящее изобретение предусматривает, что R1 может означать один или несколько заместителей, перечисленных выше, в сочетании со всевозможными заместителямиR3. Соединения, используемые в настоящем изобретении, могут содержать один или более асимметрических атомов углерода и могут существовать в виде рацемических и оптически активных форм. Конфигурация по каждому асимметрическому атому углерода может представлять собой либо D, либо Lформу. В этой области также хорошо известно, что конфигурация по хиральным атомам может быть описана как R- или как S-конфигурация по системе номенклатуры Канна-Прелога-Ингольда. Настоящим изобретением предусмотрены все разнообразные конфигурации по каждому асимметрическому атому углерода, включая различные энантиомеры и диастереоизомеры, а также рацемические смеси и смеси энантиомеров, диастереомеров или тех и других. В основной цепи существует асимметрия по тому атому углерода, к которому присоединены группы Н и R3. В настоящем изобретении термин конфигурация относится к конфигурации по тому атому углерода, к которому присоединены группы Н и R3, даже если в молекуле могут быть и другие хиральные центры. Поэтому при указании конкретной конфигурации типа D или L следует иметь в виду, что это означает D- или L-стереоизомер по тому атому углерода, к которому присоединены группы Н и R3.-4 014055 Тем не менее, сюда включаются и все возможные энантиомеры и диастереоизомеры по другим хиральным центрам, если только они есть в соединении. Соединения настоящего изобретения относятся ко всем оптическим изомерам, то есть соединения настоящего изобретения представлены либо L-стереоизомерами, либо D-стереоизомерами (по тому атому углерода, к которому присоединены группы Н и R3). Эти стереоизомеры могут быть находиться в смесях из L- и D-стереоизомеров, например рацемических смесях. Предпочтителен D-стереоизомер. Более предпочтительны соединения формулы (IIb) в R-конфигурации, предпочтительно практически чистые энантиомеры, у которых заместителем Ar является фенил, который не замещен либо замещен по меньшей мере одной галогеновой группой, при этом R3 означает CH2-Q, где Q означает алкокси, содержащий 1-3 атома углерода, и где R1 означает метил. Предпочтительно Ar представляет собой незамещенный фенил или фенил, замещенный по меньшей мере одной группой галогена, который представлен фтором. В зависимости от заместителей соединения настоящего изобретения могут также образовывать простые соли. Предусматривается, что все эти формы относятся к области действия изобретения, в том числе и смеси стереоизомерных форм. Получение используемых соединений описано в патентах US5,378,729 и 5,773,475, содержание которых включено путем отсылки. Соединения, используемые в настоящем изобретении, применимы в том виде, как представлено формулой (IIb), либо они могут применяться в виде солей ввиду их основности, обусловленной наличием свободной аминогруппы. Так, соединения формулы (IIb) образуют соли с целым рядом кислот, органических и неорганических, включая фармацевтически приемлемые кислоты. Соли, образованные с терапевтически приемлемыми кислотами, конечно, применимы при получении тех лекарственных форм, для которых наиболее предпочтительна повышенная растворимость в воде. Такие фармацевтически приемлемые соли тоже обладают терапевтической эффективностью. К эти солям относятся соли таких неорганических кислот, как соляная, HI, HBr, фосфорная, метафосфорная,азотная и серная кислота, а также соли таких органических кислот, как винная, уксусная, лимонная, яблочная, бензойная, перхлорная, гликолевая, глюконовая, янтарная, арилсульфоновая (например, nтолуолсульфоновые, бензосульфоновые) кислоты, фосфорная, малоновая и подобные. Настоящее изобретение касается также способа предотвращения, облегчения и/или лечения заболеваний или состояний, описанных выше, у млекопитающих, включая человека, который включает введение по меньшей мере одного соединения формулы (IIb). Предпочтительно, соединение, используемое в настоящем изобретении, применяется в терапевтически эффективных количествах. Дозировка терапевтических средств настоящего изобретения, которая будет наиболее адекватной и будет варьировать в зависимости от способа введения и конкретного соединения, а также от самого пациента, его возраста, типа заболевания, подлежащего лечению, определяется лечащим врачом. Как правило, он должен начать лечение небольшими дозами, значительно меньшими, чем оптимальная доза соединения, и постепенно повышать дозировку до достижения оптимального эффекта в данных обстоятельствах. При приеме композиции внутрь орально потребуется большее количество активного агента для получения такого же эффекта, как при парентеральном введении меньшего количества. Соединения могут применяться таким же образом, как и другие аналогичные терапевтические агенты, а дозировка будет того же порядка, что вообще применяется в отношении таких терапевтических агентов. В предпочтительном воплощении соединения настоящего изобретения вводятся в количестве от 1 до 100 мг на килограмм веса тела в день, более предпочтительно в количестве от 1 до 10 мг на килограмм веса тела в день. Такая схема дозировки может подвергаться корректировке лечащим врачом для получения оптимального терапевтического результата. Нуждающимся в этом пациентам можно вводить дозы соединений настоящего изобретения, составляющие по меньшей мере 50 мг/день, предпочтительно по меньшей мере 200 мг/день, более предпочтительно по меньшей мере 300 мг/день и наиболее предпочтительно по меньшей мере 400 мг/день. Например, нуждающемуся в этом пациенту можно вводить дозы,составляющие максимум 6 г/день, более предпочтительно максимум 1 г/день и наиболее предпочтительно максимум 600 мг/день. В некоторых случаях, однако, могут потребоваться меньшие или большие дозы. В другом предпочтительном воплощении ежедневные дозировки повышаются до тех пор, пока не будет достигнута заданная ежедневная доза, которая сохраняется на время дальнейшего лечения. В следующем предпочтительном воплощении можно ежедневно вводить несколько раздельных доз. Например, можно вводить три дозы в день, предпочтительно две дозы в день. Более предпочтительно введение одной дозы в день. В следующем предпочтительном воплощении можно вводить такое количество соединений настоящего изобретения, которое дает концентрацию в плазме крови, составляющую от 0,1 до 15 мкг/мл (в нижней точке) и от 5 до 18,5 мкг/мл (на пике) как среднее значение из множества подвергаемых лечению субъектов. Соединения формулы (IIb) можно вводить общепринятым способом, к примеру перорально, внут-5 014055 ривенно (когда они водорастворимы), внутримышечно, интратекально или подкожно. Предпочтительным является пероральное и/или внутривенное введение. Фармацевтическая композиция настоящего изобретения может быть получена для режима лечения, описанного выше, в частности для лечения дозами, описанными выше, для достижения концентраций в плазме, описанных выше, для продолжительности и/или способа введения, указанных в воплощениях настоящего изобретения, описанных выше. В следующем предпочтительном воплощении способ настоящего изобретения, описанный выше для лечения нуждающихся в этом млекопитающих, включая человека, включает введение соединения настоящего изобретения в сочетании с введением еще одного активного агента для предотвращения, облегчения и/или лечения вирусной инфекции, такой как ретровирусная инфекция, ВИЧ инфекция, включая СПИД, или рака, такого как рак груди, рак простаты, рак легких, рак кости, метастазная болезнь и/или прогрессия опухоли путем инфильтрации в или давления на кость, внутренние органы, мягкую ткань или нервы. Соединение настоящего изобретения и дополнительное активное вещество можно вводить вместе, то есть в одной лекарственной форме, либо вводить по отдельности, то есть в раздельных лекарственных формах. Таким образом, фармацевтическая композиция настоящего изобретения может включать соединение настоящего изобретения, как определено выше, и дополнительно включать еще одно активное средство для предотвращения, облегчения и/или лечения вирусной инфекции, такой как ретровирусная инфекция, ВИЧ инфекция, включая СПИД, или рака, такого как рак груди, рак простаты,рак легких, рак кости, метастазная болезнь и/или прогрессия опухоли путем инфильтрации в или давления на кость, внутренние органы, мягкую ткань или нервы. Фармацевтическая композиция может включать одну лекарственную форму или может включать раздельные лекарственные формы, содержащие первую композицию, включающую соединение настоящего изобретения, как определено выше, и вторую композицию, включающую дополнительное активное средство. Соединения настоящего изобретения могут быть использованы для получения фармацевтической композиции, как описано выше. Соединения формулы (IIb) можно вводить перорально, к примеру, вместе с инертным разбавителем или с легко усвояемым носителем, либо их можно заключить в твердые или мягкие желатиновые капсулы, либо их можно запрессовать в таблетки, либо их можно включить непосредственно в рацион. Для перорального терапевтического применения активное соединение формулы (IIb) может быть включено вместе с наполнителями и может применяться в форме проглатываемых таблеток, защечных таблеток,капсул, эликсиров, суспензий, сиропов, облаток и т.п. Такие композиции и препараты должны содержать по меньшей мере 1% активного соединения формулы (IIb). Это содержание в композициях и препаратах может варьировать и обычно составляет от 5 до 80% их массы. Содержание активного соединения формулы (IIb) в таких терапевтически применяемых композициях должно быть таким, чтобы получилась подходящая дозировка. Предпочтительные композиции или препараты по настоящему изобретению содержат от 10 мг до 6 г активного соединения формулы (IIb). Таблетки, пастилки, пилюли, капсулы и т.п. могут также содержать следующее: связующее вещество типа камеди трагаканта, гуммиарабика, кукурузного крахмала или желатина; наполнители типа двузамещенного фосфата кальция; дезинтегрирующее вещество типа кукурузного крахмала, картофельного крахмала, альгиновой кислоты и т.п.; смазывающее вещество типа стеарата магния, и может быть добавлено подслащивающее вещество типа сахарозы, лактозы или сахарина, либо ароматизатор типа мяты перечной, грушанкового масла или аромата вишни. Если лекарственная форма представлена капсулами,то она может содержать наряду с материалами типа вышеприведенных и жидкий носитель. Различные другие материалы могут присутствовать в виде покрытия или иным образом модифицировать физическую форму дозированной единицы. Например, таблетки, пилюли или капсулы могут быть покрыты шеллаком, сахаром или тем и другим. Сироп или эликсир может содержать активное соединение, сахарозу в качестве подслащающего вещества, метил- и пропилпарабен в качестве консервантов,краситель или ароматизатор типа аромата вишни или апельсина. Конечно, любой материал, используемый при получении единичной лекарственной формы, должен быть фармацевтически чистым и практически нетоксичным в применяемых количествах. Кроме того, активное соединение может быть включено в препараты и композиции с замедленным выделением. Например, предусмотрены лекарственные формы с замедленным высвобождением, в которых активный ингредиент связан с ионообменной смолой,которая, необязательно, может быть покрыта покрытием - диффузионным барьером с тем, чтобы модифицировать характеристики высвобождения его из смолы. Активное соединение можно также вводить парентерально или внутрибрюшинно. Также можно получить дисперсии в глицерине, жидкости, полиэтиленгликоле, а также их смесях и в маслах. При обычных условиях хранения и применения эти препараты содержат консервант, чтобы предотвратить рост микроорганизмов. Фармацевтические формы, пригодные для инъекций, включают стерильные водные растворы (если они водорастворимы) или дисперсии и стерильные порошки для быстрого приготовления стерильных растворов или дисперсий для инъекций. Во всех случаях лекарственная форма должна быть стерильной и должна быть жидкой в такой степени, чтобы ее можно было легко набрать шприцом. Она должна быть стабильной в условиях производства и хранения и должна содержать консервант против загрязняющих-6 014055 микроорганизмов типа бактерий и грибков. Носитель может быть растворитель или диспергирующая среда, содержащая, к примеру, воду, этанол, полиоль (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль и т.п.), подходящие смеси из них и растительные масла. Надлежащую текучесть можно поддерживаться, к примеру, при помощи оболочки типа лецитина, соблюдением нужного размера частиц в случае дисперсий и с помощью поверхностно-активных веществ. Действие микроорганизмов можно предотвратить с помощью различных антибактериальных и противогрибковых средств, например парабенов, хлоробутанола, фенола, сорбиновой кислоты, тимеросала и др. Во многих случаях предпочтительно включение поддерживающих изотоничность веществ, к примеру сахаров или хлорида натрия. Всасывание композиций для инъекций можно пролонгировать применением в композициях веществ,замедляющих всасывание, например моностеарата алюминия и желатина. Стерильные растворы для инъекций получают путем заключения активного соединения в требуемом количестве в подходящий растворитель вместе с различными другими ингредиентами, перечисленными выше, по необходимости с последующей стерилизацией фильтрованием. Обычно дисперсии получают заключением различных стерилизованных активных ингредиентов в стерильный носитель, который содержит основную среду для дисперсии и требуемые другие ингредиенты из тех, что перечислены выше. В случае стерильных порошков для приготовления стерильных растворов для инъекций предпочтительными способами получения являются вакуумная сушка и лиофилизация вместе с любым дополнительным желаемым ингредиентом из предварительно стерилизованного фильтрованием раствора. В настоящем изобретении фармацевтически приемлемый носитель охватывает всевозможные растворители, среды диспергирования, покрытия, противобактериальные и противогрибковые средства,изотонические и замедляющие всасывание средства для фармацевтически активных веществ, что хорошо известно в этой области. За исключением тех случаев, когда какая-нибудь стандартная среда или вещество несовместимо с активным ингредиентом, предусматривается их использование в терапевтических композициях. Также в композиции могут быть включены вспомогательные активные ингредиенты. Особенно предпочтительно изготовление парентеральных композиций в единичной лекарственной форме для легкого введения и единообразия дозировки. Лекарственная форма в настоящем изобретении означает физически дискретные единицы, пригодные в качестве единиц дозировки для лечения субъектов-млекопитающих; каждая единица содержит заданное количество активного материала, рассчитанное таким образом, чтобы получить требуемый терапевтический эффект в сочетании с требуемым фармацевтическим носителем. Характеристики новых единичных лекарственных форм по изобретению определяются и прямо зависят от (а) уникальных характеристик активного материала и ожидаемого конкретного терапевтического эффекта, и (б) ограничений, присущих составлению рецептур с таким активным материалом для лечения заболеваний у живых субъектов, страдающих заболеванием, при котором происходит нарушение здоровья организма, как это подробно раскрыто в настоящем изобретении. Основной активный ингредиент смешивают для удобства и эффективного введения в эффективном количестве с подходящим фармацевтически приемлемым носителем в единичной лекарственной форме,как описано перед этим. Единичная лекарственная форма может, к примеру, содержать основное активное соединение в количестве от 10 мг до 6 г. В пересчете на носитель активное соединение обычно составляет от 1 до 750 мг/мл носителя. В случае композиций, содержащих дополнительные активные ингредиенты, дозировка определяется исходя из обычной дозы и способа применения данных ингредиентов. В настоящем изобретении термин пациент или субъект относится к теплокровным животным,предпочтительно млекопитающим, таким, к примеру, как кошки, собаки, лошади, коровы, свиньи, мыши,крысы и приматы, включая человека. Предпочтительным пациентом является человек. Термин лечить относится либо к ослаблению боли, связанной с заболеванием или состоянием,либо к облегчению заболевания или состояния пациента. Соединения настоящего изобретения вводятся пациентам, страдающим от вышеуказанного типа расстройства в эффективном количестве. Эти количества эквивалентны терапевтически эффективным количествам, описанным выше. В следующем примере представлены свойства SPM 927 в уменьшении механической и термальной гиперальгезии, а также механической и термальной аллодинии в модели боли, индуцированной раковой опухолью, и в моделях болей, индуцированных химиотерапией и аналогами нуклеозидов. Используемое вещество представляет собой SPM 927, что является синонимом для Гаркосерида. По стандартной химической номенклатуре это (R)-2-ацетамид-N-бензил-3-метоксипропионамид. Перечень фигур Фиг. 1 показывает тестирование механической аллодинии в модели боли при раке кости (у крыс). Крыс с раком кости, получавших возрастающие концентрации SPM 927 (10 мг, 20 мг и 40 мг), сравнивали с крысами с раком кости, получавшими морфин, и с крысами с раком кости, которые не получали лечения (только клетки), а также с контрольными крысами. Фиг. 2 показывает тестирование термальной стимуляции лапы на 14 и 15 дни в модели боли при раке кости (крысы). Крыс с раком кости, получавших возрастающие концентрации SPM 927 (3 мг, 10 мг и 30 мг), сравнивали с крысами с раком кости, получавшими морфин, и с крысами с раком кости, которые-7 014055 не получали лечения (только клетки), а также с контрольными крысами. Фиг. 3 показывает тестирование различий в весовой нагрузке на конечности в модели боли при раке кости (крысы). Крыс с раком кости, получавших возрастающие концентрации SPM 927 (10 мг, 20 мг и 40 мг), сравнивали с крысами с раком кости, получавшими морфин, и с крысами с раком кости, которые не получали лечения (только клетки), а также с контрольными крысами. Фиг. 4 показывает эффект возрастающих концентраций SPM 927 (3 мг/кг, 10 мг/кг и 30 мг/кг) на термальную аллодинию в тесте с холодной ванной в модели боли, индуцированной химиотерапией (крысы, обработанные винкристином), по сравнению с морфином (3 мг/кг). Фиг. 5 показывает эффект возрастающих концентраций SPM 927 (3 мг/кг, 10 мг/кг и 30 мг/кг) на термальную аллодинию в тесте с горячей пластиной (38 С) в модели боли, индуцированной химиотерапией (крысы, обработанные винкристином), по сравнению с морфином (3 мг/кг). Фиг. 6 показывает эффект возрастающих концентраций SPM 927 (3 мг/кг, 10 мг/кг и 30 мг/кг) на термальную гиперальгезию в тесте с горячей пластиной (52 С) в модели боли, индуцированной химиотерапией (крысы, обработанные винкристином), по сравнению с морфином (3 мг/кг). Фиг. 7 показывает эффект возрастающих концентраций SPM 927 (3 мг/кг, 10 мг/кг и 30 мг/кг) на механическую гиперальгезию в тесте со сдавливанием лапы в модели боли, индуцированной химиотерапией (крысы, обработанные винкристином), по сравнению с морфином (3 мг/кг). Фиг. 8 показывает эффект возрастающих концентраций SPM 927 (3 мг/кг, 10 мг/кг и 30 мг/кг) на механическую аллодинию в тестах со стимуляцией волосками Фрея в модели боли, индуцированной химиотерапией (крысы, обработанные винкристином), по сравнению с крысами, получавшими морфин (3 мг/кг). Фиг. 9 показывает эффект возрастающих концентраций SPM 927 (3 мг, 10 мг и 30 мг), введенного внутрибрюшинно, в тесте термальной аллодинии (холодная баня) в модели боли, индуцированной нуклеозидами (крысы, обработанные ddC), по сравнению с эффектом морфина (3 мг/кг, введение подкожное). Фиг. 10 показывает эффект возрастающих концентраций SPM 927 (3 мг/кг, 10 мг/кг и 30 мг/кг),введенного внутрибрюшинно, в тесте механической аллодинии (касание на 20-й день) в модели боли,индуцированной нуклеозидами (крысы, обработанные ddC), по сравнению с эффектом морфина (3 мг/кг,введенные подкожно). Фиг. 11 показывает эффект возрастающих концентраций SPM 927 (3 мг/кг, 10 мг/кг и 30 мг/кг),введенного внутрибрюшинно, в тесте механической аллодинии (волоски фон Фрея) в модели боли, индуцированной нуклеозидами (крысы, обработанные ddC), по сравнению с эффектом морфина (3 мг/кг,введенные подкожно). Фиг. 12 показывает эффект возрастающих концентраций SPM 927 (3 мг/кг, 10 мг/кг и 30 мг/кг), введенного внутрибрюшинно, в тесте термальной гиперальгезии (горячая пластина при 52 С) в модели боли, индуцированной нуклеозидами (крысы, обработанные ddC), по сравнению с эффектом морфина (3 мг/кг, введенные подкожно). Фиг. 13 показывает эффект возрастающих концентраций SPM 927 (3 мг/кг, 10 мг/кг и 30 мг/кг),введенного внутрибрюшинно, в тесте механической гиперальгезии (сдавливание лапы) в модели боли,индуцированной нуклеозидами (крысы, обработанные ddC), по сравнению с эффектом морфина (3 мг/кг,введенные подкожно). Сведения, подтверждающие возможность осуществления изобретения Пример Эффект системного введения SPM 927 был тестирован на крысах в модели с раком кости, индуцированным введением клеток опухоли, а также в моделях невропатической боли, индуцированной химиотерапией и введением аналогов нуклеозидов. В этих моделях SPM 927 снижал механическую и термальную гиперальгезию, а также механическую и термальную аллодинию. Это показывает, что SPM 927 применим как анальгезирующее средство для лечения боли при раке кости и невропатий, вызванных химиотерапией и нуклеозидами, и является везде более эффективным, нежели морфин. Материалы и методы Модель рака кости (крысы). Культура клеток. Клетки культивировали в среде, содержащей RPM-1640 (Gibco, 500 мл), 10% инактивированную нагреванием сыворотку теленка (Hyclone), L-глутамин (конечная концентрация 2 мМ, Gibco) и раствор антибиотиков (конечная концентрация 100 ед./мл пенициллина и 100 мкг/мл стрептомицин сульфата,Gibco). Клетки освобождали из колбы для тканевой культуры за счет непродолжительного выдерживания в 0,1% трипсине (Gibco) и готовили для инъекции следующим образом: клетки центрифугировали в течение 10 минут примерно при 1200 об/мин. Полученный осадок промывали дважды фосфатно-солевым буфером (PBS, Meditech), не содержащим кальция или магния. Конечный осадок ресуспендировали вPBS, после чего клетки подсчитывали с использованием гемоцитометра. Затем клетки разводили до конечных концентраций, применяемых для инъекций, и держали во льду до инъекции. Хирургическая операция. После выдерживания в течение недели на карантине каждой крысе инъецировали в медуллярную-8 014055 полость проксимальной части большой берцовой кости либо культуральную среду, либо 3104 сингенных MRMT-1 клеток карциномы молочной железы. Животных сначала анестезировали кетамином/ксилазином, область правой ноги выбривали и обрабатывали раствором йода, а затем очищали 70% раствором этанола. На коже в верхней половине большой берцовой кости был сделан 1 см ростральнокаудальный надрез. Для достижения кости был сделан прямой надрез с гарантией минимального повреждения мышц и кровеносных сосудов. Большую берцовую кость прокалывали с использованием иглы 23-калибра на 1-3 мм ниже коленного сустава. Иглу вставляли под углом так, чтобы ее можно было протолкнуть вниз в интрамедуллярный канал кости. После того как путь в интрамедуллярный канал был открыт, иглу 23 калибра удаляли и заменяли тупой иглой, прикрепленной к Гамильтоновскому шприцу объемом 5 мкл. В интрамедуллярную полость инъецировали 3 мкл культуральной среды + растворитель или опухолевые клетки + растворитель. Раковые клетки инъецировали медленно, одновременно удаляя шприц, чтобы дать возможность клеткам заполнить пространство в полости. После инъекции участок закрывали с использованием костного воска. Затем рану зашивали хирургическим сшивателем. Послеоперационный уход и наблюдения проводили, пока животное не приходило в сознание. Поведенческие измерения. Дозировка. На 8 или 15 дни крысам делали одну инъекцию растворителя, соединения сравнения или тестируемого соединения за 20 мин до начала тестирования на механическую аллодинию и приблизительно за 40 минут до начала тестирования на термальную гиперальгезию. На основании фармакологической активности SPM 927 тесты нужно было выполнить после введения лекарства за период, не превышающий 90 минут. На 9 день крысам давали соединение сравнения или тестируемое соединение до начала тестирования нагрузки на конечности. Оценка ноцицептивности. На 7, 8, 14 и 15 дни выполняли тесты по оценке боли. На 7, 14 дни проводили измерение базовых характеристик. Все животные получали внутрибрюшинную инъекцию солевого раствора приблизительно за 20 мин до базового тестирования. На 8, 15 дни, начиная приблизительно через 20 мин после инъекции тестируемого соединения и соединения сравнения, животных подвергали серии ноцицептивных тестов. Порядок тестирования оставался одинаковым для всех животных. Животных сначала подвергали тесту на механическую аллодинию, а затем на термальную гиперальгезию. Тестированию на весовую нагрузку проводили животным на 9 и 15 дни. Сначала животных оценивали по ответам на базовую весовую нагрузку. После базовых измерений крысам инъецировали тестируемое соединение и соединение сравнения и по меньшей мере через 20 мин животных подвергали анализу на весовую нагрузку. Механическая аллодиния. Тест фон Фрея на механическую аллодинию проводили на подвергнутой операции (правой) задней конечности у всех животных для определения базовых параметров (день 7) и на 8-й день. В этих тестах крыс помещали в небольшую коробку из плексигласа с ячеистым полом из проволоки. После примерно 10 мин привыкания снизу через пол клетки накладывали набор тонких нейлоновых волокон и сдавливали их против поверхности подошвы задней лапы. Во время теста крыс не сдерживали и не трогали. Диаметр волокон обеспечивал логарифмическую шкалу приложенной силы и, таким образом, линейную шкалу воспринимаемой интенсивности с интервалами. Волокно с наиболее слабой интенсивностью тестировали первым, и создаваемая им сила ниже порога детекции для большинства крыс. Тестировали каждое последовательно увеличивающееся по силе волокно, применяя в каждом случае силу, необходимую лишь для изгибания монофиламента. Когда крыса поднимала свою лапу в ответ на давление, регистрировали размер волокна и снова использовали более слабое волокно. Определяли порог, при котором происходило отдергивание в соответствии с методом Чапмана вверх-вниз, применяя последовательно большие и меньшие волокна для фокусирования на пороге отдергивания. Значительное увеличение аллодинии обосновывалось путем сравнения средних значений для группы. Тест на термальную гиперальгезию. Животных подвергали тесту на термальную гиперальгезию, устанавливающему базовые характеристики (день 7, 14), и на 8-й и 15-й дни. Каждую крысу помещали в небольшую камеру из плексигласа на возвышающейся нагреваемой стеклянной поверхности в течение примерно 10 мин для привыкания. Когда животное было неподвижным, оптико-волоконный источник тепла перемещали под стеклом и нацеливали на правую заднюю лапу. Включали инфракрасный луч, и когда крыса поднимала или перемещала лапу, луч выключался автоматически. Таймер на устройстве регистрировал задержку во времени при перемещении лапы, которую использовали для обозначения времени, необходимого животному для обнаружения боли, вызванной нагреванием. Если крыса не перемещала лапу в течение 25 с, источник тепла автоматически выключался, гарантируя отсутствие повреждения лапы. Тестировали только оперированную заднюю лапу. Эту процедуру повторяли, по меньшей мере, дважды для каждой крысы, примерно через 3 мин. Если времена задержки отличались друг от друга в пределах 2 с, то время усредняли. Если времена задержки отличались друг от друга более чем на 2 с, то крыс тестировали до тех пор, пока не обнаруживали 2 времени задержки, отличающиеся не более чем на 2 с, и эти два числа усредняли. Групповые значения для времени задержки для отдергивания лапы сравнивали между группами с минимальной задержкой, показывающей большую чувствительность к боли.-9 014055 Весовая нагрузка. После того как животные в группах 4-6 были случайным образом отобраны в группы для обработки лекарственным средством, в дни 9-й и 15-й все животные подвергались тестированию на весовую нагрузку. Весовую нагрузку подвергнутых операции задних конечностей оценивали как разницу в весе,выдерживаемую ипсилатеральной конечностью по сравнению с контралатеральной. Крыс помещали в камеру из плексигласа, устроенную так, что каждая лапа покоится на отдельном датчике, который регистрирует распределение веса тела животного на каждую лапу. Было получено пять значений для каждой лапы, после чего они усреднялись с результатами, выраженными как различия в весовой нагрузке (значение от контралатеральных конечностей - от ипсилатеральных конечностей). Крысы были распределены по 8 животных на группу на основе веса тела на следующий день после прибытия. Для каждой группы определяли средние веса для уверенности, что средние значения и стандартное отклонение удовлетворяют предположению о гомогенносги. Основываясь на результатах теста фон Фрея на 8-й день, группы 4-6 были случайным образом разбиты на новые группы для лечения с целью тестирования весовой нагрузки с тем, чтобы предотвратить любое смещение от предварительного распределения по группам. Животные в группах 1-3 оставались в ранее созданных группах, поскольку эти животные были наивными по отношению к обработке SPM 927. Модель боли, индуцированной винкристином. Обработка животных. Для этого исследования были использованы 86 самок Dark Agouti весом 150-200 г (Harlan, Gannat,Франция). Они содержались группами (по 3 животных в клетке) при контролируемой комнатной температуре (21-22 С) и 12-часовом цикле день/ночь со свободным доступом к пище и воде. Все эксперименты были проведены в соответствии с инструкциями института. Интоксикацию винкристином проводили путем ежедневных инъекций винкристина (0,15 мг/кг/день, внутрибрюшинно) с 1-го по 5-й, с 8 по 12 и с 15 по 16 день. В 17 день животных подвергали поведенческому тесту и фармакологическому воздействию. Крыс, получивших винкристин, случайным образом распределяли на 5 экспериментальных групп(по 11 крыс в группе): 1. винкристин/ растворитель, внутрибрюшинно; 2. винкристин/SPM 927 (3 мг/кг),внутрибрюшинно; 3. винкристин/SPM 927 (10 мг/кг), внутрибрюшинно; 4. винкристин/SPM 927 (30 мг/кг), внутрибрюшинно; 5. винкристин/морфин (3 мг/кг), подкожно. SPM 927 и морфин инъецировали соответственно за 30 и 45 мин до проведения поведенческих тестов. Тест холодная баня (термальная аллодиния). Животных помещали на ледяную платформу, погруженную на глубину примерно 1 см ниже поверхности в холодную воду (4 С), так что волосистая и лишенная волос части ног животного были в контакте с холодной водой. Регистрировали задержку первой реакции (облизывание, движение лап, небольшие подпрыгивания) с прекращением регистрации через 30 с. Тест горячая пластина (термальная аллодиния/гиперальгезия). Животных помещали в стеклянный цилиндр на горячую пластину (Bioblock, Франция) с температурой 38 С или 52 С. Регистрировали задержку между первой реакцией (облизывание, движение лапы,небольшие подпрыгивания или прыжки с целью избежать нагревания) с прекращением через 30 с. Тест стимуляции волоском фон Фрея (механическая аллодиния). Крыс помещали на металлический решетчатый пол. Ноцицептивное тестирование проводили путем вставления филамента фон Фрея (Bioseb, Франция) через решетчатый пол и прикосновения к поверхности подошвы задней лапы. Испытание состояло из нескольких прикосновений различными филаментами фон Фрея (с частотой 1-1,5 с). Применяли филаменты фон Фрея в ряду от 10 до 100 г. Регистрировали порог механической аллодинии, как только животное удаляло свою заднюю лапу, тестирование останавливали и регистрировали количество филаментов. Тест на сдавливание лапы (механическая гиперальгезия). Рефлекс ноцицептивного сгибания определяли с применением устройства для сдавливания лапы Рэндалла-Селитто (Bioseb, Франция), которое прикладывает линейно возрастающую механическую силу к задней части задней лапы крысы. Механический ноцицептивный порог был определен как сила в граммах, при которой крыса отдергивала лапу. Отсечение давления составляло 250 г. Анализ данных. Для сравнения групп по поведенческим данным в каждой индивидуальной точке времени был применен дисперсионный анализ ANOVA с последующим апостериорным анализом (тест Дуннета). Боль, индуцированная нуклеозидами. Животные, интоксикация ddC и экспериментальные группы. Для этого исследования были использованы 50 крыс-самцов (весом =220 г) Sprague Dawley (Janvier,LeGenest-St-Isle, Франция). Крыс содержат группами (по 3 животных в клетке) при контролируемой комнатной температуре (21-22 С) и 12-часовом цикле день/ночь со свободным доступом к пище и воде. Все эксперименты были проведены в соответствии с инструкциями института. Интоксикацию проводили путем единственной инъекции ddC (50 мг/кг, внутривенно в хвостовую вену). На 10-й и 20-й дни животных подвергали поведенческому тесту и они получили фармакологическое воздействие. Крыс, которым ввели ddC, распределяли случайным образом на 5 экспериментальных групп (по 10 крыс в группе): 1. контроль/растворитель, внутрибрюшинно; 2. ddC/растворитель, внутрибрюшинно; 3. SPM 927 (3 мг/кг),- 10014055 внутрибрюшинно; 3. SPM 927 (10 мг/кг), внутрибрюшинно; 4. SPM 927 (30 мг/кг), внутрибрюшинно; 5.ddC/морфин (3 мг/кг), подкожно. SPM 927 и морфин были введены за 30 и 45 мин соответственно до проведения поведенческого теста. Тест на прикосновение на 20-й день. К волосам на ногах, боках и нижней части спины последовательно прикасались аппликатором с хлопковым наконечником с применением осциллирующих движений (частота 1-2/с, 30 с). Прикосновение проводили с силой не больше, чем требуется для движения аппликатора сквозь волосы так, что нарушается только волосяной покров. Были подсчитаны вокализация и умеренные эффекты, обеспечивающие устранение прикосновения. Результаты Модель рака кости у крыс. Механическая аллодиния. Фиг. 1 описывает ответы групп на филаменты фон Фрея после базового тестирования и после обработки лекарством. Статистический анализ, выполненный с применением двухфакторного анализаANOVA, показал значительные отличия для группы, подвергнутой лечению (р 0,01), но не для базовых параметров по сравнению с эффектами лечения. Однофакторные тесты ANOVA при сравнении группы только клетки со следующей обработка для каждой из групп, подвергнутых лечению, выявили значительные различия в уровне механической аллолинии для группы, обработанной морфином (р 0,01) и 20 и 40 мг/кг SPM 927 (р 0,05). Доза 5 мг/кг морфина полностью обращала аллодинию, которая была выявлена во время тестирования на базовые параметры. Кроме того, были продемонстрированы значительные различия между данными после обработки между группой здоровых животных и группой,которой инъецировали только клетки (р 0,01). Существуют также статистические различия между базовыми значениями и последозовыми значениями для группы только клетки и группы, получавшей морфин (р 0,01). Термальная гиперальгезия. Данные по тестированию лапы на термальные воздействия (фиг. 2) на 14 и 15 дни показали, что базовая латентность по удалению лап была у всех крыс, которым инъецировали опухолевые клетки Это было подтверждено значимыми различиями с применением двухфакторного анализа ANOVA, в котором эффект лекарства был значимым с р 0,0001, а эффект лечения был статистически значимым при р 0,05. Базовые параметры или данные группы до обработки существенно различались для групп без клеток против только клетки (апостериорный тест Дуннетта; р 0,001) с другими группами, не показавшими различий при сравнении друг с другом. Кроме того, группы после обработки отличались от групп без клеток против только клетки (тест Дуннетта; р 0,001) и только клетки против SPM 927 в дозе 30 мг/кг (тест Дуннетта; р 0,001). Контрольная группа с морфином не показала статистически значимых различий, хотя был тренд, показывающий, что морфин увеличивает латентность при удалении лапы. Механическая гиперальгезия. График на фиг. 3 показывает общий двухфакторный анализ ANOVA, продемонстрировавший статистически значимые различия между группами, р 0,001. Поскольку различия в весовой нагрузке были определены как вес, ограниченный контралатеральной конечностью, минус вес, ограниченный ипсилатеральной конечностью (конечность, в которую вводили раковые клетки), большее число будет показывать большую весовую нагрузку на неповрежденную лапу с 0, означающим равное распределение веса на обе лапы. Собранные данные по базовым параметрам показали положительное число, свидетельствуя, что все эти животные размещали больший вес на неповрежденные лапы. В сравнении с группой только клетки группа, получавшая морфин и 40 мг/кг SPM 927 продемонстрировала существенное уменьшение(р 0,05) в весовой нагрузке, размещенной на контралатеральных лапах, после лечения по сравнению с группой только клетки. Боль, индуцированная винкристином. Тест холодная баня. Как показано на фиг. 4, наблюдались статистически значимые различия между 6 группами (р 0,05,тест ANOVA). Животные, обработанные винкристином с растворителем, демонстрировали очень короткую пороговую латентность в тесте холодная баня (примерно 9 с) по сравнению с контрольными животными, показавшими время латентности примерно 14 с. Лечение обработанных винкристином животных SPM 927 индуцировало значительное увеличение (р 0,05, тест Дуннетта) пороговой латентности,которое становились сравнимым с таковым для контрольных животных, в особенности при лечении дозами 10 и 30 мг/кг. Однако даже при дозе 3 мг/кг пороговая латентность была значительно больше, чем у обработанных винкристином животных, хотя статистическая значимость не была достигнута. Обработка морфином удлиняла пороговую латентность обработанных винкристином животных до уровня значительно более высокого, чем полученный у контрольных животных. Тест горячая пластина при 38 С. Фиг. 5 показывает, что пороговая латентность обработанных винкристином животных при тестировании на горячей пластине (38 С) была значительно меньше, чем таковая у контрольных животных(р 0,05, тест Дуннетта). Лечение обработанных винкристином крыс SPM 927 в дозах 3, 10 и 30 мг/кг индуцировало значительное (р 0,05, тест Дуннетта) увеличение пороговой латентности. При лечении доза- 11014055 ми 10 и 30 мг/кг, выполнение теста STZ-крысами становилось сравнимым с таковым контрольных животных. Подобно SPM 927 в дозах 10 и 30 мг/кг морфин в дозе 3 мг/кг увеличивал пороговую латентность STZ-животных до уровня, сравнимого с таковым для контрольных животных. Тест горячая пластина при 52 С. Как показано на фиг. 6, латентность при отдергивании лапы у обработанных винкристином крыс была значительно меньше, чем таковая у контрольных животных (р 0,05, тест Дуннетта). Лечение обработанных винкристином крыс SPM 927 вызывало существенное увеличение (р 0,05, тест Дуннетта) в латентности при отдергивании лапы по сравнению с животными, которым вводили растворитель. Эффект, полученный с дозами 3 и 10, 30 мг/кг, был сравним с таковым для контрольных животных. Тест на сдавливание лапы. С применением анальгезиметра RandallSelitto обработанные винкристином животные показали существенное уменьшение в латентности при отдергивании лапы по сравнению с выполнением теста контрольными животными (фиг. 7). Лечение обработанных винкристином крыс SPM 927 в дозах 10 и 30 мг/кг, но не в дозе 3 мг/кг, вызывало значительное увеличение (р 0,05, тест Дуннетта) в латентности при отдергивании лапы у крыс, обработанных винкристином. В этом тесте введение морфина не модифицировало показатели обработанных винкристином крыс (р 0,05, тест Дуннетта). Тест фон Фрея. В этом тесте (фиг. 8) латентность при отдергивании лапы обработанных винкристином крыс значительно снижалась (примерно 20 г) по сравнению с таковой у контрольных животных (примерно 60 г). Лечение SPM 927 уменьшало латентность для отдергивания лапы обработанных винкристином крыс. Различия по сравнению с крысами, получавшими растворитель, достигали значимого уровня при лечении дозами 10 и 30 мг/кг (р 0,05, тест Дуннетта). Обработка морфином восстанавливала показатели у обработанных винкристином крыс до уровня латентности, сравнимого с таковым для контрольных групп. Модель боли, индуцированной у крыс нуклеозидами. Термальная аллодиния. Как показано на фиг. 9, статистически значимое различие было видно у между 6 группами (р 0,05,тест ANOVA). Животные, получившие ddC и обработанные растворителем, демонстрировали очень короткий период пороговой латентности при тесте ледяная баня (примерно 11 с) по сравнению с контрольными животными, показавшими значение около 20 с. Лечение обработанных ddC животных SPM 927 тремя тестированными дозами 3, 10 и 30 мг/кг вызывало существенное увеличение пороговой латентности (р 0,05, тест Дуннетта), которое становилось сравнимым с таковым для контрольных животных для трех тестированных доз 3, 10 и 30 мг/кг. Введение морфина увеличивало пороговую латентность обработанных ddC животных до уровня, сравнимого с таковым, полученным для контрольных животных. Тест на прикосновение на 20-й день. Фиг. 10 показывает результаты теста на прикосновение, выполненного на 20-й день. Животные, обработанные SPM 927 (3, 10 и 30 мг/кг), продемонстрировали значительное снижение общего числа звуков (р 0,05, тест Дуннетта). Здесь вновь морфин в дозе 3 мг/кг был способен существенно уменьшить общее число звуков у животных, обработанных ddC. Тест с волосками фон Фрея на 10-й день. В этом тесте (фиг. 11) латентность при отдергивания лапы у обработанных ddC крыс существенно снижалась (примерно 50 г) по сравнению с контрольными крысами (примерно 85 г). Обработка SPM 927 увеличивала латентность при отдергивании лапы у крыс, обработанных ddC. Различия по сравнению с группой крыс, получавших растворитель, достигали статистически значимого уровня при лечении дозами 3, 10 и 30 мг/кг (р 0,05, тест Дуннетта) до уровня, сравнимого с контрольной группой. Введение морфина в дозе 3 мг/кг восстанавливало показатели у крыс, обработанных ddC, до уровня, характерного для контрольных групп. Тест горячая пластина при 52 С на 20-й день. Как показано на фиг. 12, латентность при отдергивании лапы у крыс, обработанных ddC, была значительно меньше, чем у контрольных животных (р 0,05, тест Дуннетта). Лечение обработанных ddC крыс SPM 927 индуцировало значительное увеличение (р 0,05, тест Дуннетта) в латентности при отдергивании лапы по сравнению с животными, которым вводили растворитель, только в дозе 30 мг/кг. Эффект, полученный с дозами 3 и 10 мг/кг, был сравним с таковым, полученным в группе животных, не получавших растворитель. После введения морфина показатели у крыс, обработанных ddC, становились такими же, как у контрольных животных. Тест на сдавливание лапы на 10-й день. С применением анальгезиметра RandallSelitto было показано, что крысы, обработанные ddC, демонстрируют значительное снижение латентности при отдергивании лапы по сравнению с таковым у контрольных животных (фиг. 13). Лечение крыс, обработанных ddC, SPM 927 во всех трех дозах 3, 10 и 30 мг/кг, вызывало значительное увеличение (р 0,05, тест Дуннетта) в латентности при отдергивания лапы у крыс, обработанных ddC. Морфин вновь увеличивал латентность у ddC-обработанных крыс- 12014055 Заключение Системное введение SPM 927 производило зависимое от дозы антиаллодиническое и антигиперальгезическое действие в модели крыс с болью, индуцированной раком, химиотерапией и нуклеозидами после введения единичной дозировки. Таким образом, SPM 927 и родственные соединения, как раскрыто в формуле (IIb), являются полезными для лечения боли при раке, например боли при раке кости, после химиотерапевтического лечения и лечения нуклеозидами. Литература- 13014055 где Ar означает фенил, который не замещен или замещен по меньшей мере одним галогеном;R1 означает алкил, содержащий 1-6 атомов углерода; или его фармацевтически приемлемой соли, для получения фармацевтической композиции, полезной для предотвращения, облегчения и/или лечения боли при опухолях, боли, индуцированной химиотерапией, и/или боли, индуцированной по меньшей мере одним нуклеозидом и/или по меньшей мере одним аналогом нуклеозида, причем опухолевая боль является опухолевой болью, ассоциированной со СПИДом, болью при раке кости, болью, производимой при прогрессии опухоли путем инфильтрации в или давлении на кость, внутренние органы, мягкую ткань, болью, индуцированной метастазами, болью,индуцированной метастазами при раке кости, и/или болью, индуцированной метастатической болезнью у пациентов с раком груди, раком простаты или раком легких. 2. Применение по п.1, где Ar означает незамещенный фенил. 3. Применение по п.1, где галоген представлен фтором. 4. Применение по любому из пп.1-3, где R3 означает СН 2-Q, где Q означает алкокси, содержащий 13 атома углерода. 5. Применение по любому из предшествующих пунктов, где соединение находится в Rконфигурации. 6. Применение по п.1, где соединение формулы (IIb) представляет собой (R)-2-ацетамидо-N-бензил 3-метоксипропионамид, O-метил-N-ацетил-D-серин-m-фторбензиламид, или О-метил-N-ацетил-D-серинn-фторбензиламид или его фармацевтически приемлемую соль. 7. Применение по п.5 или 6, где соединение является, по существу, энантиомерно чистым. 8. Применение по любому из предшествующих пунктов, где индуцированная химиотерапией боль представляет собой индуцированную химиотерапией невропатическую боль, боль, индуцированную алкалоидами барвинка, и/или боль, индуцированную винкристином, и/или когда боль, индуцированная нуклеозидом и/или аналогами нуклеозида, представляет собой болезненную невропатию, индуцированную нуклеозидами или аналогами нуклеозидов, боль, индуцированную антиопухолевыми или антивирусными аналогами нуклеозидов, боль, индуцированную антивирусными аналогами нуклеозидов при терапии СПИДа, и/или боль, индуцированную AZT, ddC, ddI или/и d4T. 9. Применение по любому из предшествующих пунктов, в котором получают фармацевтическую композицию для лечения дозами соединения, составляющими по меньшей мере 100 мг/день. 10. Применение по любому из предшествующих пунктов, в котором получают фармацевтическую композицию для лечения дозами соединения, составляющими по меньшей мере 200 мг/день. 11. Применение по любому из предшествующих пунктов, в котором получают фармацевтическую композицию для лечения дозами соединения, составляющими по меньшей мере 300 мг/день. 12. Применение по любому из предшествующих пунктов, в котором получают фармацевтическую композицию для лечения дозами соединения, составляющими по меньшей мере 400 мг/день. 13. Применение по любому из предшествующих пунктов, в котором получают фармацевтическую композицию для лечения дозами соединения, составляющими максимум 6 г/день. 14. Применение по любому из предшествующих пунктов, в котором получают фармацевтическую композицию для лечения дозами соединения, составляющими максимум 1 г/день. 15. Применение по любому из предшествующих пунктов, в котором получают фармацевтическую композицию для лечения дозами соединения, составляющими максимум 600 мг/день. 16. Применение по любому из предшествующих пунктов, в котором получают фармацевтическую композицию для лечения повышающимися ежедневными дозами до тех пор, пока не будет достигнута заданная ежедневная доза, которая сохраняется на время дальнейшего лечения. 17. Применение по любому из предшествующих пунктов, в котором получают фармацевтическую композицию для лечения по три дозы в день. 18. Применение по любому из пп.1-16, в котором получают фармацевтическую композицию для лечения по две дозы в день. 19. Применение по любому из пп.1-16, в котором получают фармацевтическую композицию для лечения по одной дозе в день. 20. Применение по любому из предшествующих пунктов, в котором получают фармацевтическую композицию для введения, приводящего к концентрации в плазме крови от 0,1 до 15 мкг/мл (в нижней точке) и от 5 до 18,5 мкг/мл (на пике), рассчитанной как среднее значение для множества подвергаемых лечению субъектов. 21. Применение по любому из предшествующих пунктов, в котором фармацевтическая композиция приготавливается для перорального или внутривенного введения. 22. Применение по любому из предшествующих пунктов, в котором фармацевтическая композиция дополнительно включает активное средство для предотвращения, облегчения и/или лечения вирусной инфекции, такой как ВИЧ-инфекция, включая СПИД, рака, такого как рак груди, рак простаты, рак легких, рак кости, метастатической болезни и/или прогрессии опухоли путем инфильтрации в или давления на кость, внутренние органы, мягкую ткань или нервы, где указанное дополнительное активное средство- 14014055 выбрано из лекарственных средств для лечения СПИД-антиретровирусных нуклеозидных аналогов ddC(2',3'-дидезоксицитидин), ddI (2',3'-дидезоксиинозин) или d4T (2',3'-дидегидро-3'-дезокситимидин), алкалоидов барвинка типа винкристина, таксола, сурамина, цисплатина, карбоплатина или оксалиплатина. 23. Применение по п.22, где фармацевтическая композиция составляет единую лекарственную форму или составляет раздельные лекарственные формы, содержащие первую композицию, включающую соединение по любому из пп.1-7, и вторую композицию, включающую дополнительное активное средство. 24. Применение по любому из предшествующих пунктов, в котором получают фармацевтическую композицию для введения млекопитающим. 25. Применение по п.24, в котором получают фармацевтическую композицию для введения человеку.
МПК / Метки
МПК: A61P 25/04, A61K 45/06, A61K 31/165
Метки: боли, лечения, соединений, нуклеозидами, химиотерапией, пептидных, вызванной, также, применение, кости, раке
Код ссылки
<a href="https://eas.patents.su/19-14055-primenenie-peptidnyh-soedinenijj-dlya-lecheniya-boli-pri-rake-kosti-a-takzhe-boli-vyzvannojj-himioterapiejj-i-nukleozidami.html" rel="bookmark" title="База патентов Евразийского Союза">Применение пептидных соединений для лечения боли при раке кости, а также боли, вызванной химиотерапией и нуклеозидами</a>












