Способ продуцирования гормона роста человека и применение среды, не содержащей сыворотки, для культивирования клеток млекопитающих, экспрессирующих гормон роста человека
Формула / Реферат
1. Способ продуцирования гормона роста человека, включающий стадию культивирования клеточной линии, экспрессирующей гормон роста, в культуральной среде, не содержащей компонентов, полученных из сыворотки животных, причем среда содержит цинк в концентрации в интервале от 0,2 до 1,75 мкМ, медь в концентрации в интервале от 10 до 75 нМ и ионы железа в концентрации в интервале от 1 до 10 мкМ, где клетки представляют собой мышиные клетки С127 и среда дополнительно содержит компоненты основной среды.
2. Способ по п.1, где среда содержит цинк в концентрации 0,2 мкМ.
3. Способ по любому из предшествующих пунктов, где среда содержит цинк в концентрации
0,5 мкМ.
4. Способ по любому из предшествующих пунктов, где среда содержит цинк в виде сульфата цинка.
5. Способ по любому из предшествующих пунктов, где среда содержит медь в концентрации 25 нМ.
6. Способ по любому из предшествующих пунктов, где среда содержит медь в виде сульфата меди.
7. Способ по любому из предшествующих пунктов, где среда содержит ионы железа в концентрации 5 или 6 мкМ.
8. Способ по любому из предшествующих пунктов, где среда содержит ионы железа в виде цитрата железа и/или нитрата железа.
9. Способ по любому из предшествующих пунктов, где основная среда представляет собой модифицированную Дульбекко среду Игла (DMEM).
10. Способ по любому из предшествующих пунктов, где гормон роста человека экспрессируется под контролем металлотионеинового (МТ) промотора.
11. Способ по п.10, где металлотионеиновый промотор представляет собой мышиный МТ-1-промотор.
12. Способ по любому из предшествующих пунктов, дополнительно включающий в себя стадию выделения гормона роста человека из культуры клеток.
13. Способ по п.12, дополнительно включающий стадию очистки гормона роста человека.
14. Применение среды, как она определена в любом из пп.1-9, для продуцирования гормона роста человека.
15. Применение среды, как она определена в любом из пп.1-9, для поддержания клеток в культуре в течение фазы продуцирования гормона роста человека.
Текст
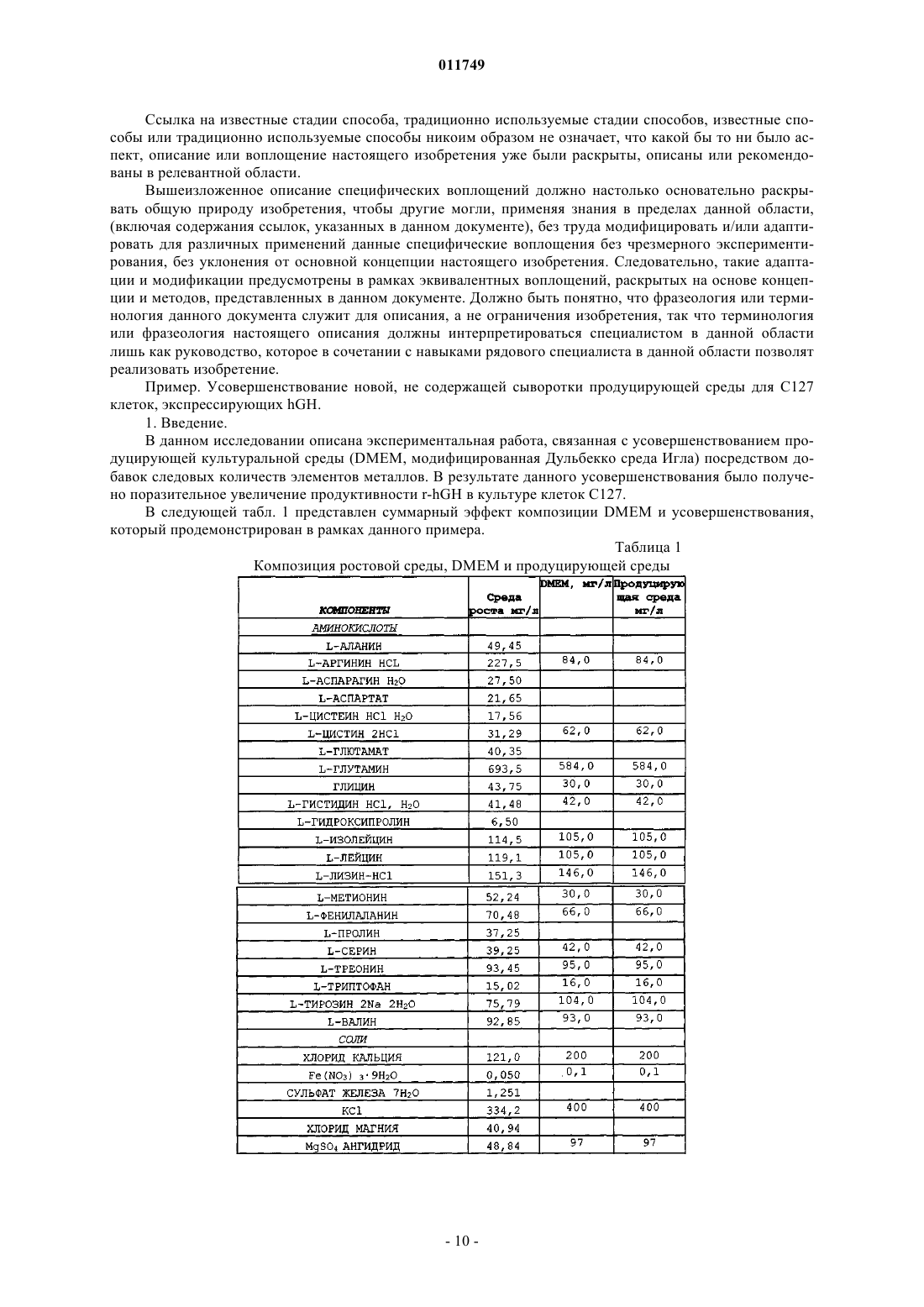
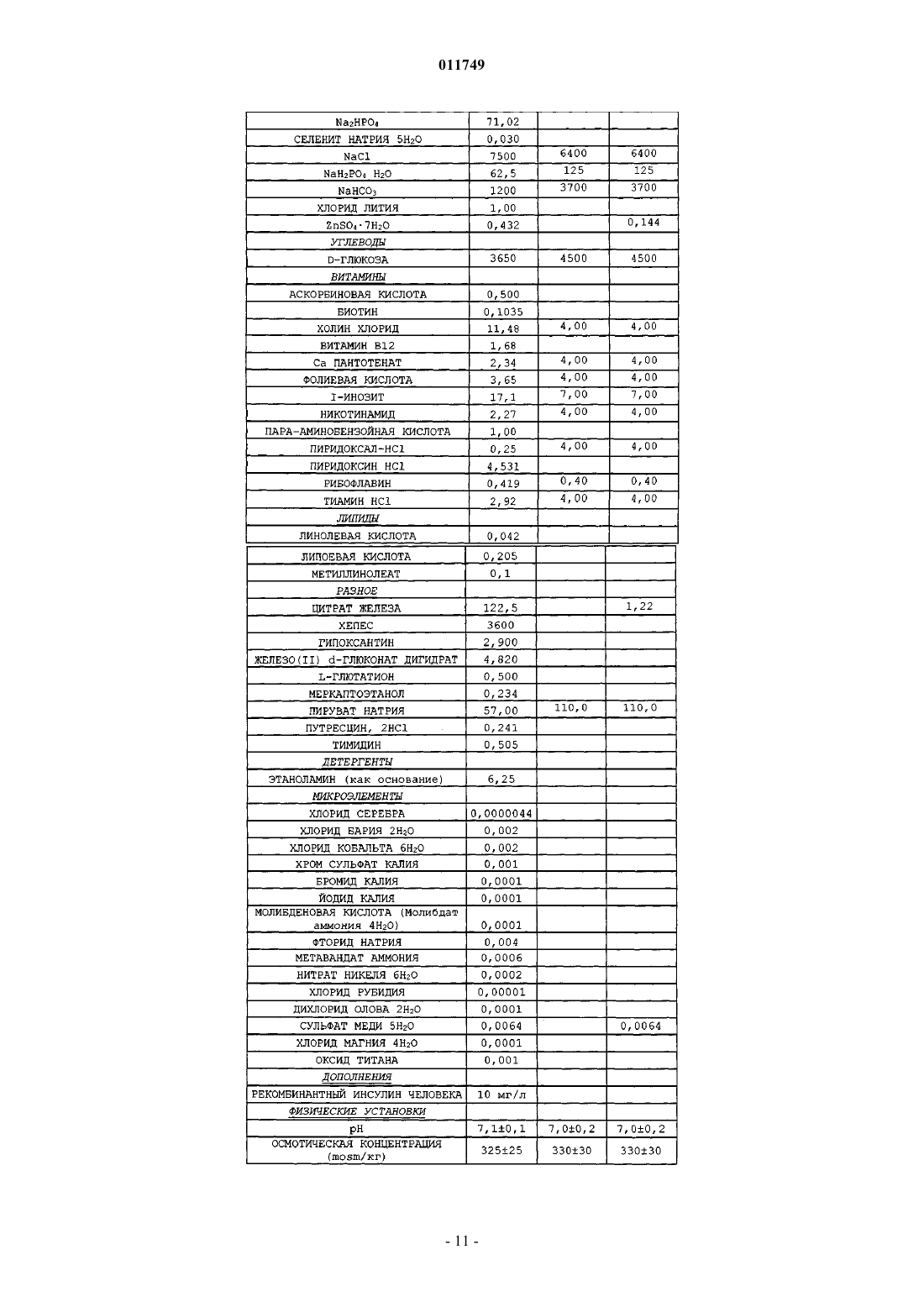
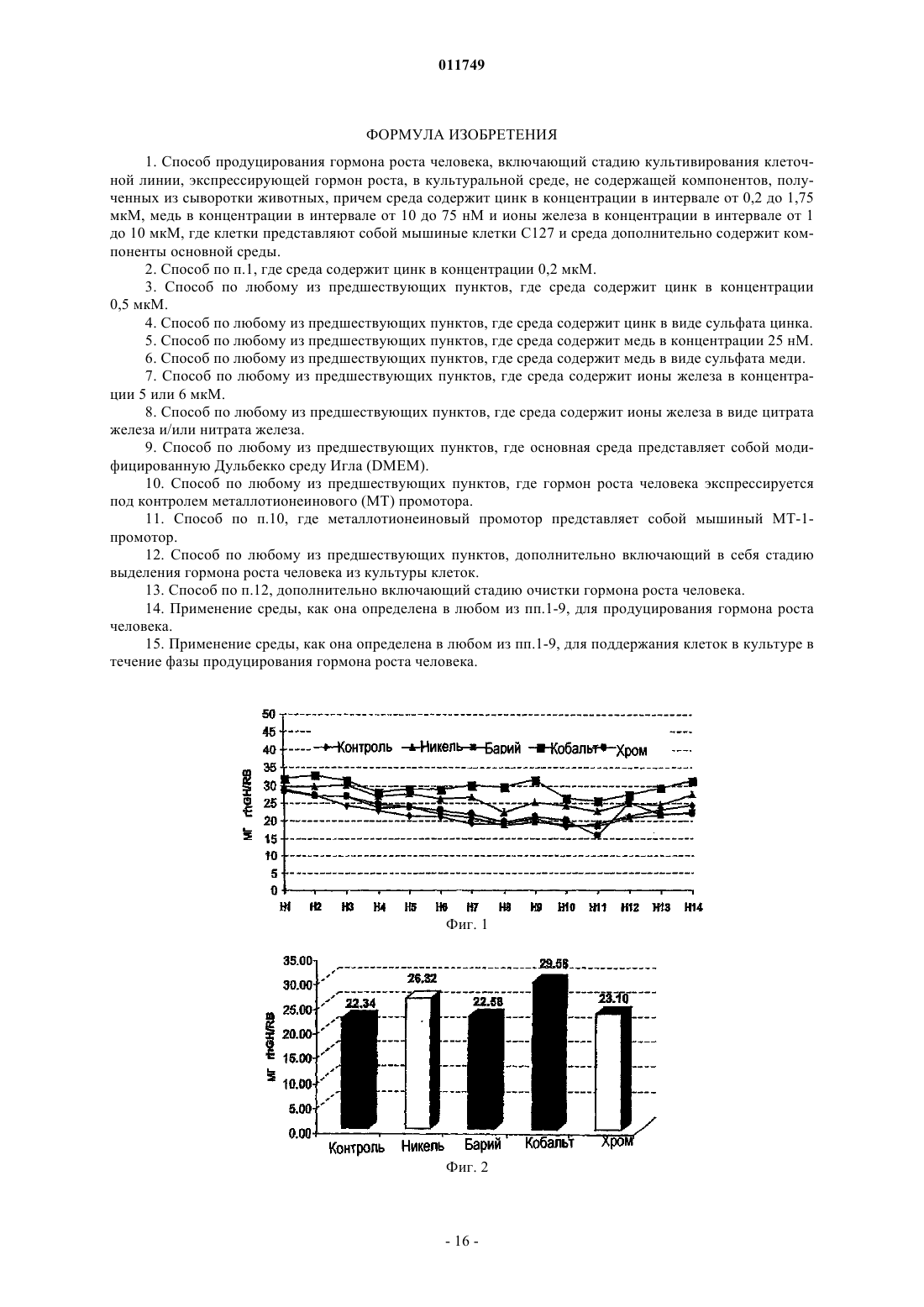
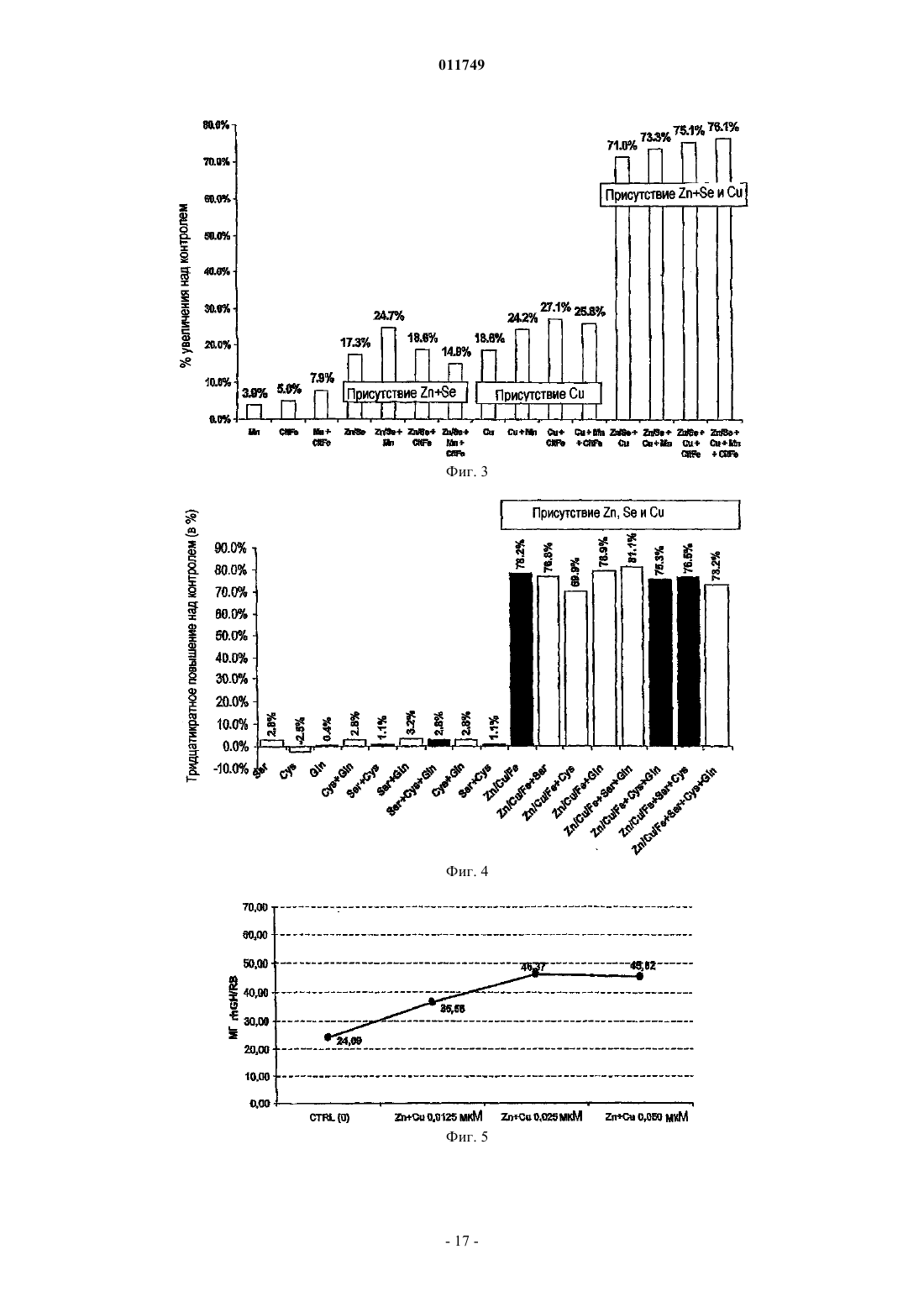
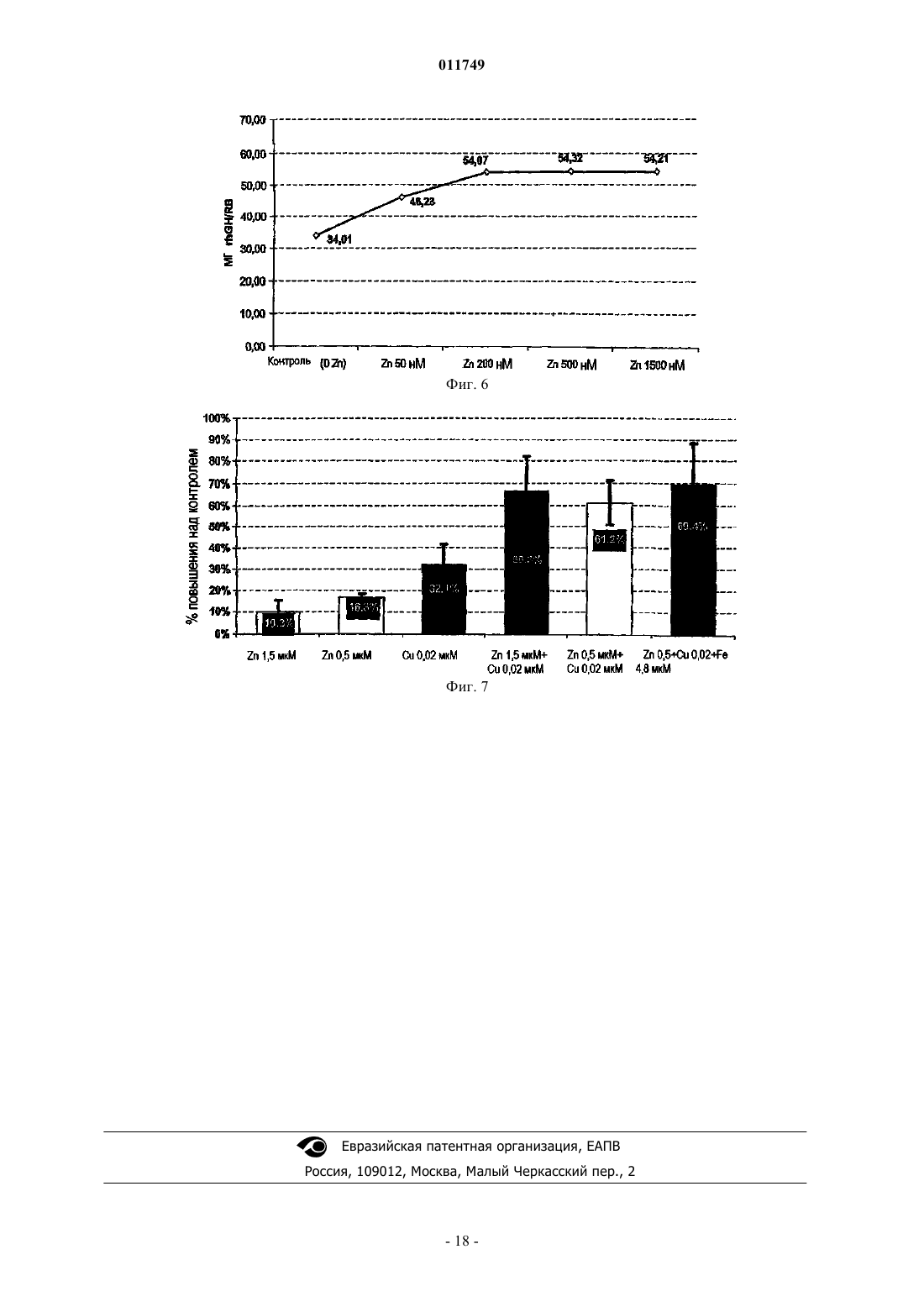
011749 Область изобретения Настоящее изобретение относится к области культивирования клеток млекопитающих в условиях отсутствия в культуре сыворотки, в частности изобретение связано с культивированием клеток, продуцирующих рекомбинантные белки, такие, например, как гормон роста человека (hGH). Основа изобретения Настоящее изобретение связано со средой, не содержащей сыворотки, предназначенной для роста и поддержания клеток млекопитающего в культуре. Клеточная культура широко используется в настоящее время для получения различных биологически активных продуктов, таких как вирусные вакцины, моноклональные антитела, не являющиеся антителами иммунорегуляторы, факторы роста полипептидов, гормоны, ферменты, опухолеспецифические антигены и т.д. Указанные вещества продуцируются нормальными или трансформированными и генетически модифицированными клетками. В прошлом культуральную среду для культивирования клеток дополняли сывороткой, которая служила универсальным питательным веществом для роста и поддержания всех линий клеток млекопитающего, которые продуцируют биологически активные продукты. Иммунная сыворотка содержит гормоны,факторы роста, транспортные белки, факторы прикрепления и распластывания, питательные вещества,микроэлементы и так далее. Культуральная среда обычно содержала приблизительно до 10% животной сыворотки, такой как эмбриональная бычья сыворотка (FBS), также называемая эмбриональной сывороткой теленка (FCS). Несмотря на широкое применение, сыворотка имеет множество ограничений в применении. Она содержит высокие уровни множества белков, влияющих на ограничение процентного количества представляющего интерес белка, продуцируемого клетками. Данные белки, полученные из сыворотки, должны быть отделены от продукта во время выполнения стадий процесса, такого как выделение представляющего интерес белка, что затрудняет способ и увеличивает затраты. Побочное действие BSE (губкообразная энцефалопатия крупного рогатого скота), трансмиссивного нейродегенеративного заболевания крупного рогатого скота с продолжительным латентным или инкубационным периодом, ставит вопрос о регуляторном участии использования сыворотки животного происхождения в продуцировании биологически активных продуктов. Следовательно, существует большая потребность в разработке альтернативной среды, не содержащей сыворотку животного, которая поддерживает рост клеток и сохраняет их в процессе продуцирования биологически активных продуктов. Как правило, культуральная клеточная среда содержит множество компонентов различных категорий, таких как аминокислоты, витамины, соли, жирные кислоты и другие соединения. Аминокислоты. Например, в патенте США 6048728 (Inlow и др.) описано, что в среде для культивирования клеток могут быть использованы следующие аминокислоты: аланин, аргинин, аспарагиновая кислота, цистеин, глутаминовая кислота, глутамин, глицин, гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, пролин, серин, триптофан, тирозин, треонин и валин. Витамины. В патенте США 2003/0096414 (Ciccarone и др.) или в патенте США 5811299 (Renner и др.) описано, например, что в среде для культивирования клеток могут быть использованы следующие витамины: биотин, пантотенат, холин хлорид, фолиевая кислота, миоиноцитол, ниациномид, пиридоксин,рибофлавин, витамин В 12, тиамин, путресцин. Соли. В патенте США 6399381 (Blum и др.), например, описана среда, содержащая CaCl2, KCl, MgCl2,NaCl, мононатрийфосфат, двухосновный натрий фосфат, селенит натрия, CuSO4, ZnCl2. Другим примером документа, в котором описаны неорганические соли, которые могут быть использованы в среде для культивирования клеток, является патент США 2003/0153042 (Arnold и др.), в котором описана среда,содержащая CaCl2, KCl, MgCl2, NaCl, мононатрийфосфат, двухосновный фосфат натрия, CuCl22H2O,ZnCl2. Жирные кислоты. Жирные кислоты, про которые известно, что они используются в культуральной среде, представляют собой арахидоновую кислоту, линолевую кислоту, олеиновую кислоту, лауриновую кислоту, миристиновую кислоту, так же как и метилбетациклодекстрин, см., например, патент США 5045468 (Darfler). Нужно отметить, что циклодекстрин, по существу, не является липидом, но он способен образовывать комплекс с липидами, и, таким образом, он используется для повышения растворимости липидов в среде для культивирования клеток. Другими компонентами, применяемыми, в частности, в среде для культивирования клеток, не содержащей иммунной сыворотки, являются такие соединения, как глюкоза, глутамин, Na-пируват, инсулин или этаноламин (см., например, ЕР 274445), или защитный агент, такой как Pluronic F68. PluronicF68 (известный также как Poloxamer 188) представляет собой блокирующий сополимер этиленоксида(ЕО) и пропиленоксида (PO). Стандартные "основные среды" также известны специалисту в данной области. Такие среды уже содержат несколько компонентов среды, упомянутой выше. Примерами таких сред, которые нашли широкое распространение, являются модифицированная Дульбекко среда Игла (DMEM), DMEM F12 (1:1),питательная смесь Ham's Nutrient mixture F-10, среда RPMI (Roswell Park Memorial Institute Medium), среда MCDB 131, или среда William's Medium E. Данные коммерческие среды доступны, например, отGibco, Invitrogen. Металлы, такие как цинк (Zn) и медь (Cu), вовлечены в метаболические взаимодействия (Vallee иFalchuk, 1993 или Lindner, 1991). Цинк играет существенную роль в структуре и функции большого количества макромолекул и большинства ферментативных реакций. Он играет роль катализатора, сокатализатора или структурную роль в специфическом сворачивании белков. Zn-АТФ необходим для синтеза пиридоксин-5-фосфата и динуклеотида флавин-аденозин (FAD), двух коферментов, необходимых для биогенного синтеза амина и метаболизма моноаминоксидазы. Активность цинка в предохранении биологических структур от повреждения свободными радикалами может осуществляться благодаря нескольким факторам: поддержанию соответствующего уровня металлобелков, которые также являются ловушками от свободных радикалов, в качестве существенного компонента супероксиддисмутазы, в качестве защитного агента для тиолов и в предотвращении взаимодействия химических групп с железом с образованием свободных радикалов. В дополнение к этому, наличие Zn предотвращает перекисное окисление липидов. Цинк также является эффектором полимеризации тубулина и действует in vitro на образование и стабилизацию актинового волокна. Цинк является также компонентом мотива цинковых пальцев ДНК-связанных белков, которые являются общим мотивом в транскрипционных белках. Ионы цинка существуют главным образом в виде комплексов с белками и нуклеиновыми кислотами и принимают участие во всех аспектах промежуточного метаболизма, трансмиссии и регуляции экспрессии генетической информации, хранении, синтезе и действии пептидных гормонов и структурном поддержании хроматина и биологических мембран. Медь также является важным микроэлементом для функционирования многих клеточных ферментов. Ионы меди могут принимать особые окислительно-восстановительные состояния, окисляя Cu (II) или восстанавливая Cu (I), позволяя металлу играть ведущую роль в клеточной физиологии в качестве каталитического кофактора в окислительно-восстановительной химии ферментов. Медь функционирует в группе оксидаз, которые включают в себя цитохром-С-оксидазу, тирозиназу, дофамин-монооксигеназу, аминоксидазы и лизилоксидазу. Медь принимает участие также в митохондриальном дыхании, гомеостазе железа в качестве компонента церулоплазмина, в удалении свободных радикалов и поперечном связывании эластина. Среда, не содержащая сыворотку, включающая в себя ионы металла, такие как ионы цинка или меди, известна специалистам в данной области, например, из патента США 6048728 (Inlow и др.), патента США 4767704 (Cleveland и др.) или Международной заявки WO 01/16294 (Life Technologies Inc.) Однако в этих документах не приведено данных об эффекте увеличения продуктивности при добавлении этих ионов в определенных концентрациях в стандартную продуцирующую среду. Для усовершенствования и поставки биологически активных продуктов, таких как лечебные белки или вакцины, необходим большой выход продукта. Соответствующими клетками, широко применяемыми для получения полипептидов, являются клетки яичника китайского хомячка (CHO). Клетки CHO впервые были культивированы Puck (J. Exp. Med. 108, 945, 1958) из материала биопсии яичника самки китайского хомячка. Из этих первоначальных клеток было получено несколько линий клеток с различными характеристиками. Одна из этих линий клеток CHO, CHO-K1, представляет собой пролинзависимую линию и является диплоидной по дигидрофолатредуктазному гену (DHFR). Другой линией, полученной из указанной линии клеток, является линия клеток CHO, дефицитная поDHFR (CHO DUK B11) (PNAS 77, 1980, 4216-4220), которая характеризуется потерей функции DHFR вследствие мутации в одном DHFR-гене и последующей потерей другого гена. Следующими клетками, часто используемыми для продуцирования белков, предназначенных для введения в человеческий организм, являются линии клетки человека, такие как линия клеток фибросаркомы человека НТ 1080 или линия эмбриональных клеток почки человека 293. Мышиная линия клеток С 127 также часто применяется для продуцирования рекомбинантных белков (Carter и др., 1989; Oka и Rupp, 1990). Одним из представляющих интерес лечебных белков является гормон роста. Гормон роста человека(hGH), известный также как соматропин (INN) или соматотропин, представляет собой белковый гормон,продуцируемый и секретируемый соматотропными клетками передней доли гипофиза. Гормон роста человека играет ключевую роль в соматическом росте в детском возрасте и в метаболизме в период совершеннолетия посредством его воздействия на метаболизм белков, углеводов и липидов. Гормон роста человека представляет собой единичную полипептидную цепь, состоящую из 191 аминокислоты (Bewly и др, 1972), имеющую две дисульфидные связи, одну между Cys-53 и Cys-165,-2 011749 образующую большую петлю в молекуле, и другую - между Cys-182 и Cys-189, образующую малую петлю вблизи С-концевого участка. Последовательность ДНК, которая подтвердила аминокислотную последовательность белка, была описана Martial и др. (1979). Очищенный hGH, в его лиофилизованной форме, представляет собой белый аморфный порошок. Он легко растворяется (в концентрации 10 мг/л) в водных буферах при pH в интервале от 6,5 до 8,5. В растворе hGH существует преимущественно как мономер, с незначительной фракцией в виде димеров и олигомеров с большим молекулярным весом. При определенных условиях hGH может быть индуцирован в виде, образующем большее количество димеров, тримеров и высших олигомеров. Известно несколько производных hGH, включая производные природного происхождения, варианты и продукты метаболизма, продукты деградации преимущественно биосинтетического hGH и генноинженерных производных hGH, получаемых генетическими способами. Одним из примеров производного hGH природного происхождения является GH-V, разновидность гормона роста, обнаруженного в плаценте. Другой представитель генного локуса описан у Chen и др. (1989). Любое производное hGH, включая производные, приспособленные к длительному пребыванию в организме, могут быть использованы для целей настоящего изобретения, пока у них сохраняется биологическая активность hGH. Метионил-hGH был первой формой hGH, полученной посредством технологии рекомбинантной ДНК. Данное соединение является в действительности производным hGH, имеющим дополнительный остаток метионина на N-концевом участке (Goeddel и др., 1979). Описана обнаруженная как в гипофизе, так и в кровотоке разновидность hGH природного происхождения, называемая 20-K-hGH (Lewis и др., 1978; Lewis и др., 1980). Данное соединение, у которого недостает 15 аминокислотных остатков, от Glu-32 до Gln-46, появляется при альтернативном сплайсинге мессенджер-рибонуклеиновой кислоты (DeNoto и др., 1981). Данное соединение обладает многими, но не всеми биологическими свойствами hGH. 20-K-hGH производится в гипофизе и секретируется в кровь. Он составляет приблизительно 5% гормона роста, вырабатываемого взрослым человеком, и приблизительно 20% гормона роста, вырабатываемого в детском возрасте. Он имеет такую же стимулирующую рост активность, что и гормон роста, и,как было выявлено, имеет величину липолитической активности, большую или равную активности формы в 22 кДа. Он связывается с рецепторами гормона роста с аффинностью, равной аффинности гормона роста в 22 кДа, и имеет одну десятую долю лактогенной (пролактиноподобной) биологической активности по сравнению с гормоном в 22 кДа. В отличие от гормона в 22 кДа, 20-k-hGH имеет слабую антиинсулиновую активность. Некоторое количество производных hGH является результатом протеолитической модификации молекулы. Начальный путь метаболизма молекулы hGH включает протеолиз. Область hGH вокруг остатков 130-150 чрезвычайно подвержена протеолизу, и выявлено несколько производных hGH, имеющих однонитевые разрывы или делеции в данной области (Thorlacus-Ussing, 1987). Данная область располагается в большой петле hGH, и расщепление пептидной связи приводит к возникновению двух цепей, которые соединены посредством дисульфидной связи около Cys-53 и Cys-165. Было выявлено, что многие из этих двухцепочечных образований имеют повышенную биологическую активность (Singh и др., 1974). Многие производные гормона роста человека были получены искусственно с помощью ферментов. Ферменты трипсин и субтилизин, а также другие ферменты были использованы для модификации hGH в различных местах по всей длине молекулы (Lewis и др., 1977; Graff и др., 1982). Одно такое производное,называемое двухцепочечным анаболическим белком (2-CAP), получили с помощью контролируемого протеолиза hGH трипсином (Becker и др., 1989). Было обнаружено, что 2-САР имеет биологические свойства, совершенно отличные от той интактной молекулы hGH, в которой стимулирующая рост активность молекулы hGH в основном сохранялась, а действие на углеводный метаболизм в основном было аннулировано. Аспарагиновые и глутаминовые остатки в белках в соответствующих условиях подвержены реакциям дезамидирования. Было показано, что гипофизарный hGH подвергается данному типу реакций,приводящих к превращению Asn-152 в аспарагиновую кислоту, а также, в меньшей степени, к превращению Gln-137 в глутаминовую кислоту (Lewis и др., 1981). Выявлено, что дезамидированный hGH имеет измененную чувствительность к протеолизу под действием фермента субтилизина, что указывает на то,что дезамидирование может иметь физиологическое значение в направленном протеолитическом расщеплении hGH. Известно, что биосинтетический hGH деградирует при определенных условиях хранения,приводя к дезамидированию у другого аспарагина (Asn-149). Это представляет собой основной сайт дезамидирования, но дезамидирование у Asn-152 также наблюдалось (Becker и др., 1988). Дезамидирования у Gln-137 в биосинтетическом hGH не обнаруживали. Метиониновые остатки в белках чувствительны к окислению в основном сульфоксидом. Оба, и вырабатываемый гипофизом, и биосинтетический hGH подвергаются сульфоксидированию у Met-14 и Met125 (Becker и др., 1988). Было выявлено, что окисление у Met-170 происходит в вырабатываемом гипофизом hGH, но не в биосинтетическом hGH. Оба, и дезамидированный hGH, и Met-14-сульфоксид-hGH,как было выявлено, проявляют полную биологическую активность (Becker и др., 1988).-3 011749 Получены усеченные формы hGH, каждый посредством действия ферментов или с помощью генетических способов. У 2-CAP, генерированного с помощью контролируемого действия трипсина, удалены первые восемь остатков у N-концевого участка hGH. Другие усеченные варианты hGH получены с помощью модификации гена прежде экспрессии его в подходящего хозяина. Первые 13 остатков были удалены, давая в результате производное, имеющее особенные биологические свойства (Gertler и др., 1986),в котором полипептидная цепь не разъединена. Хотя гормон роста человека первоначально был получен из гипофизов, взятых у трупов, данные препараты не были электрофоретически гомогенны, и антитела, появляющиеся в сыворотке пациентов,обработанных препаратами приблизительно 50% чистоты, иммуногенетически классифицировались как неактивные компоненты. Технология рекомбинантных ДНК дает возможность без ограничения продуцировать hGH в целом ряде различных систем. Очищению hGH из культуральной среды способствует наличие лишь небольшого количества примесных белков. Фактически было показано, что hGH может быть очищен в масштабе лаборатории посредством одной стадии очистки на колонке HPLC с обращенной фазой (Hsiung et al. (1989). Рекомбинантный гормон роста человека, rhGH, был продуцирован производителем Serono International S.A. как SEROSTIM, и было получено ускоренное одобрение FDA на применение этого продукта для лечения пациентов с потерей веса и истощением среди больных СПИДом. SAIZEN представляет собой рекомбинантный гормон роста человека, предназначенный для детей с дефицитом GH, при синдроме Тернера у девочек, а также при хронической почечной недостаточности у детей. PROTROPIN,полученный Genentech, Inc. (South San Francisco, CA), незначительно отличается по структуре от природной последовательности hGH, имеет дополнительный остаток метионина вблизи N-концевого участка. Рекомбинантный hGH главным образом поставляется во флаконах, содержащих hGH плюс дополнительный наполнитель, например глицин и маннит, в лиофилизованной форме. Предусмотренный сопутствующий растворитель во флаконе дает возможность пациенту получать продукт желаемой концентрации до введения дозы. Рекомбинантный hGH может также поставляться другими хорошо известными способами, такими как заранее заполненный шприц, и так далее. В основном не наблюдали значительного различия в фармакокинетике или биологической активности природной рекомбинантной последовательности hGH, рекомбинантного N-метионил-hGH или продуцируемого гипофизом человека субстрата (Moore и др., 1988; Jorgensson и др., 1988). Принимая во внимание различные медицинские показания, при которых используется гормон роста, существует необходимость в действенном и надежном способе продуцирования значительного количества его в культуре клеток, в частности в способе, в котором используется культура клеток, не содержащая сыворотки. Среда, не содержащая сыворотки, была описана в данной области. Например, в патенте США 6162643 описана базальная среда, не содержащая сыворотки, именуемая HECK-109, содержащая незначительные количества сульфата меди и хлорида цинка. Данная среда специально предназначена для первичной и вторичной культур обычных клеток человека, таких как кератиноцид, с целью генерации ткани для трансплантации человеку. Экспрессия рекомбинантных беков человека в линии клеток in vitro в данном патенте США не упоминается. В патенте США 5324656 описана базальная среда, не содержащая сыворотки, так называемаяMCDB120 и MCDB131M, содержащая незначительные количества сульфата меди и хлорида цинка. Данная среда специально предназначена для культивирования in vitro мышечных сателлитных клеток человека с целью предотвращения дифференцировки данных клеток. Продуцирование рекомбинантных белков человека не предусмотрено в рамках настоящего документа. В документе GB 2196348 описана синтетическая среда для культивирования in vitro клеток гибридомы и миеломы. Среда содержит медь, цинк и ионы железа. Культивирование клеток гибридомы и миеломы в данной среде проводится исключительно с целью получения моноклональных антител. В патенте США 6103529 предложен состав для культивирования in vitro клеток животного происхождения в не содержащей сыворотки культуральной клеточной среде. Клетки животного происхождения могут быть использованы для продуцирования вирусов, моноклональных антител, гормонов или факторов роста. Однако продуцирование гормона роста в данном документе не предусмотрено. В патенте США 6048728 описана не содержащая белков среда для культивирования клеток,включая в себя Co-, Zn- и Fe-ионы для культивирования клеток животного происхождения, с тем, чтобы получать, например, натуральные или рекомбинантные продукты, такие как антитела. Продуцирование таких продуктов посредством культивируемых клеток не включает в себя гормоны роста или факторы роста, которые упоминаются исключительно как составляющие среды, не содержащей сыворотки, для увеличения роста клеток в культуре. В патенте США 5316938 описана биохимически охарактеризованная среда для культивирования для клеток яичника китайского хомячка (CHO), содержащая цитрат железа, сульфат цинка и сульфат меди и называемая WCM5. Среда специально предназначена для продуцирования антитела и tPA в клетках CHO.-4 011749 В патенте США 5122459 описан способ продуцирования рекомбинантных белков в культуральной среде, не содержащей сыворотки, содержащей ионы цинка и железа, особенно пригодной для культивирования клеток CHO. Продуцирование гормона роста не предусматривалось в этом документе. Таким образом, проблема, лежащая в основе настоящего изобретения, связана с обеспечением не содержащей сыворотки среды для культивирования клеток, для эффективного продуцирования гормона роста, в частности гормона роста человека (hGH). Краткое изложение изобретения Настоящее изобретение основано на усовершенствовании среды для культивирования клеток, не содержащей компонентов, получаемых из сыворотки животного происхождения, и в то же время высокоэффективной для роста клеток и поддержания клеток млекопитающих в культуре, в частности дающей возможность продуцирования рекомбинантных белков. Таким образом, в первом аспекте изобретение связано со средой для культивирования клеток, не содержащей компонентов, полученных из сыворотки животного происхождения, содержащей цинк и/или медь в незначительных количествах. Предпочтительно среда согласно изобретению сверх этого содержит ионы железа в незначительных количествах. Во втором аспекте изобретение связано со способом продуцирования гормона роста человека,включающим в себя стадию экспрессии культивируемой клеткой гормона роста человека в среде согласно изобретению. Третий аспект изобретения связан с использованием среды согласно изобретению для продуцирования гормона роста человека. Четвертый аспект изобретения связан с использованием среды согласно изобретению для поддержания клеток в культуре в течение фазы продуцирования гормона роста человека. Краткое описание чертежей На фиг. 1 показан профиль продуктивности rhGH, полученный в фазе продуцирования при непрерывном добавлении различных элементов по 10 мкМ в культуральную среду DMEM (RB = роллерфлакон, Н 1-Н 14 = дни от 1 до 14 фазы продуцирования). На фиг. 2 показаны средние величины продуктивности rhGH, выраженные в мг rhGH на роллерфлакон, полученные в фазе продуцирования при непрерывном добавлении металлов (никель, барий, кобальт, хром) по 10 мкМ в культуральную среду DMEM. На фиг. 3 показаны средние величины продуктивности rhGH, увеличенные по сравнению с контролем, получаемые в факторном плане эксперимента для тестирования комбинаций цинка (Zn 0,5 мкМ),меди (Cu 0,02 мкМ), селена (Se 0,050 мкМ), марганца (Mn 0,001 мкМ) и цитрата железа (4,8 мкМ). На фиг. 4 показаны результаты факторного плана эксперимента для определения результата смешивания металлических микроэлементов (Zn 0,5 мкМ, Cu 0,02 мкМ и цитрат железа 4,8 мкМ) и аминокислот: глутамина (Gln 4,8 мМ), серина (Ser 0,49 мМ) и цистеина (Cys 0,29 мМ). На фиг. 5 показано действие различных концентраций меди, в комбинации с цинком и цитратом железа (Zn 0,5 мкМ, Fe цитрат 4,8 мкМ), на продуктивность rhGH в DMEM. На фиг. 6 показано действие различных концентраций цинка в сочетании с медью и цитратом железа (Cu 0,02 мкМ, Fe цитрат 4,8 мкМ) на продуктивность rhGH в DMEM. На фиг. 7 показано суммарное действие в отношении увеличения продуктивности rhGH, получаемого при добавлении меди, цинка и цитрата железа (Zn 1,5 и 0,5 мкМ, Cu 0,02 мкМ и цитрат железа 4,8 мкМ), в качестве добавок к DMEM на основании различных экспериментов с продуцирующими rhGH клетками С 127. Подробное описание изобретения Настоящее изобретение основано на усовершенствовании среды для культивирования клеток, которая не содержит сыворотки животного происхождения. Согласно настоящему изобретению среда для культивирования клеток, не содержащая сыворотку животного происхождения, включает в себя цинк (Zn) в диапазоне концентраций от 0,2 до 1,75 мкМ, и/или медь (Cu) в диапазоне концентраций от 10 до 75 нМ, и/или ионы железа (Fe) в диапазоне концентраций от 3 до 10 мкМ. Как показано на примерах ниже, добавление Zn и/или Cu в незначительных количествах к стандартной среде приводит к увеличению продуктивности клеток, экспрессирующих представляющий интерес секретируемый белок. Добавление обоих металлов, и Zn и Cu, в указанных выше концентрациях приводит к увеличению продуктивности рекомбинантного гормона роста человека (GH) в клетках С 127 до более чем 60% от контроля (те же клетки, культивируемые в стандартной среде DMEM). Когда GH-экспрессирующие клетки культивировали в среде, содержащей Zn, Cu и ионы Fe в указанных выше концентрациях, продуктивность увеличивалась приблизительно до 70% по сравнению с контролем. Предпочтительные области концентраций ионов металла в среде согласно изобретению следующие. Цинк приблизительно 0,2, 0,25, 0,30, 0,35, 0,40, 0,45, 0,5, 0,55, 0,60, 0,65, 0,70, 0,75, 0,80, 0,85, 0,90,0,95, 1, 1,05, 1,1, 1,15, 1,2, 1,25, 1,3, 1,35, 1,4, 1,45, 1,5, 1,55, 1.6, 1,65, 1,7, 1,75 мкМ.-5 011749 Предпочтительно, чтобы цинк составлял приблизительно 0,5 или приблизительно 1,5 мкМ. Предпочтительно также, чтобы цинк включался в виде сульфата цинка. Медь составляет приблизительно 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70 или 75 нМ. Предпочтительно, чтобы медь составляла приблизительно 25 нМ. Предпочтительно также, чтобы медь включалась в виде сульфата меди. Ионы железа составляют приблизительно 1, 1,5, 2, 2,5, 3, 3,5, 4, 4,5, 4,8, 5, 5,5, 6, 6,5, 7, 7,5, 8, 8,5, 9,9,5 или 10 мкМ. Предпочтительно, чтобы ионы железа составляли приблизительно 5 или 6 мкМ. Ионы железа предпочтительно могут быть включены в виде цитрата железа и/или нитрата железа, и, кроме того, предпочтительно, чтобы цитрат железа рассматривался как содержащий большую часть ионов железа в среде культивирования клетки. Среда может содержать, например, около 5 мкМ цитрата железа и около 1 мкМ нитрата железа. В предпочтительном воплощении среда дополнительно содержит компоненты основной среды. Предпочтительно, чтобы среда содержала модифицированную Дульбекко среду Игла (DMEM) в качестве основной среды. Композиция стандартной среды DMEM описана в примере ниже. Второй аспект настоящего изобретения связан со способом продуцирования белка, включающим в себя стадию культивирования клетки, экспрессирующей представляющий интерес белок в среде согласно изобретению. Стадия культивирования способа согласно изобретению может быть проведена в любых подходящих внешних условиях, таких как чашки Петри, Т-колбы или роллер-флаконы, но таким же образом стадия культивирования может проводиться в сосуде, имеющем больший объем, таком, например, как биореактор. Белок согласно изобретению может быть экспрессирован при использовании любого промотора,который подходит для конкретного типа культивируемой клетки. В особо предпочтительном воплощении белок экспрессируется из металлотионеинового (MT) промотора. Если для продуцирования белка используются мышиные клетки, в качестве промотора предпочтителен мышиный промотор МТ-1. Предпочтительно, чтобы способ дополнительно включал в себя стадию сбора среды, содержащей представляющий интерес белок. В предпочтительном воплощении способ дополнительно включает в себя стадию выделения представляющего интерес белка. В другом предпочтительном воплощении способ дополнительно включает в себя разработку рецептуры выделенного белка с фармацевтически приемлемым носителем для получения фармацевтической композиции. В третьем аспекте изобретение связано с применением среды согласно изобретению для продуцирования представляющего интерес полипептида. В четвертом аспекте изобретение связано с применением среды согласно изобретению для поддержания клеток в культуре в течение фазы продуцирования представляющего интерес полипептида. Клетки, используемые в рамках различных аспектов настоящего изобретения, предпочтительно представляют собой клетки млекопитающих. Они могут быть клетками человека или клетками животного. Примеры клеток млекопитающих, которые можно культивировать способом согласно настоящему изобретению, включают в себя, например, мышиные клетки С 127, клетки 3 Т 3, клетки COS, клетки остеосаркомы человека, клетки MRC-5, клетки BHK, клетки VERO, клетки CHO (клетки яичника китайского хомячка), клетки HEK 293, клетки rHEK 293, клетки нормальных фибробластов человека, стромальные клетки, гепатоциты или клетки PER.C6. Примеры гибридом, которые можно культивировать способом согласно настоящему изобретению, включают в себя, например, клетки DA4.4, клетки 123 А,клетки 127 А, клетки GAMMA и клетки 67-9-В. Предпочтительно культивирование мышиных клеток С 127 согласно настоящему изобретению. Клетки, культивируемые согласно настоящему изобретению, могут расти в суспензии или, в случае зависимых от "прикрепления" клеток, прикрепленными к твердой основе. Микроносители и диски Fibra-Cel используют для культивирования клеток млекопитающих для роста "прикрепленных", или "заякоренных", клеток, и они используются, в числе общепринятых технологических платформ, для индустриального продуцирования белков (см., например, Bohak и др., 1987;Petti и др., 1994). Способ предпочтительно подходит для продуцирования представляющего интерес полипептида. Среду согласно изобретению используют, таким образом, для продуцирования представляющего интерес полипептида или белка, который может представлять собой любой полипептид, низкомасштабное или крупномасштабное продуцирование которого желательно. Представляющим интерес полипептидом может быть, например, природно секретируемый белок,обычный цитоплазматический белок, обычный трансмембранный белок или гуманизированное антитело или антитело человека. Когда представляющий интерес белок представляет собой природный цитоплазматический или природный трансмембранный белок, белок предпочтительно подвергают генноинженерной модификации с тем, чтобы он стал растворимым и секретируемым, т.е. посредством разме-6 011749 щения сигнального пептида перед белком или его фрагментом (растворимым или внеклеточным). Представляющий интерес полипептид может иметь любое происхождение. Предпочтительно представляющие интерес полипептиды происходят из организма человека и более предпочтительно представляющие интерес белки обладают лечебным действием. Предпочтительно, чтобы представляющий интерес белок был выбран из гормона, цитокинсвязанного белка, интерферона, растворимого рецептора или антитела. Белки с лечебным действием, которые могут быть продуцированы способом согласно изобретению,включают в себя, например, хорионический гонадотропин, фолликулостимулирующий гормон, лутропин-хориогонадотропный гормон, тиреостимулирующий гормон, гормон роста, в частности гормон роста человека, интерфероны (например, интерферон бета-1a, интерферон бета-1b), рецепторы интерферона(например, рецептор интерферона гамма), TNF-рецепторы р 55 и р 75 и их растворимые варианты, TACIрецептор и его Fc-слитые белки, интерлейкины (например, интерлейкин-2, интерлейкин-11), интерлейкинсвязывающие белки (например, интерлейкин-18-связывающий белок), анти-CD11a-антитела, эритропоэтин, колониестимулирующий фактор гранулоцитов, колониестимулирующий фактор гранулоцитовмакрофагов, пептидные гормоны гипофиза, менопаузальный гонадотропин, инсулиноподобные факторы роста (например, соматомедин-С), фактор роста кератиноцитов, полученный из клеточной линии глиальных клеток нейротрофический фактор, тромбомодулин, основной фактор роста фибробластов, инсулин,фактор VIII, соматропин, морфогенетический белок-2 кости, фактор роста из тромбоцитов, гирудин,эпоиетин, рекомбинантный слитый белок LFA-3/IgG1, глюкоцереброзидаза и мутеины, фрагменты, растворимые формы, функциональные производные, их слитые белки. В предпочтительных воплощениях полипептид выбран из группы, состоящей из хорионического гонадотропина (CG), фолликулостимулирующего гормона (FSH), лутропин-хориогонадотропного гормона (LH), тиреостимулирующего гормона (TSH), гормона роста человека (hGH), интерферонов (например, интерферона бета-1a, интерферона бета-1b), рецепторов интерферона (например, рецептора гаммаинтерферона), TNF-рецепторов р 55 и р 75, интерлейкинов (например, интерлейкина-2, интерлейкина-11),интерлейкинсвязывающих белков (например, интерлейкин-18-связывающего белка), анти-CD11 аантител и мутеинов, фрагментов, растворимых форм, функциональных производных, их слитых белков. Далее, предпочтительные представляющие интерес полипептиды включат в себя, например, эритропоэтин, колониестимулирующий фактор гранулоцитов, колониестимулирующий фактор гранулоцитов-макрофагов, пептидные гормоны гипофиза, менопаузальный гонадотропин, инсулиноподобные факторы роста (например, соматомедин-С), фактор роста кератиноцитов, полученный из линии глиальных клеток нейротрофический фактор, тромбомодулин, основной фактор роста фибробластов, инсулин, фактор VIII, соматропин, морфогенетический белок-2 кости, фактор роста из тромбоцитов, гирудин, эпоиетин, рекомбинантный слитый белок LFA-3/IgG1, глюкоцереброзидаза и мутеины, фрагменты, растворимые формы, функциональные производные, их слитые белки. Если будет разработана рецептура представляющего интерес белка, продуцируемого способом согласно изобретению, с фармацевтически приемлемым носителем, то результатом способа будет фармацевтическая композиция. Формулировка "фармацевтически приемлемый" подразумевает включение любого носителя, который не влияет на эффективность биологической активности активного ингредиента и который не токсичен для организма хозяина, которому данный препарат вводится. Например, для парентерального введения активный белок(белки) может быть заключен в форму стандартной дозы для инъекций, в сочетании с носителем, таким как физиологический раствор, раствор декстрозы, сывороточный альбумин и раствор Рингера. Фармацевтическая композиция согласно изобретению может затем вводиться индивидууму различными способами. Способы введения включают в себя внутрикожный, трансдермальный (например, медленное введение состава), внутримышечный, внутрибрюшинный, внутривенный, подкожный, оральный,внутричерепной, эпидуральный, местный, ректальный и интраназальный способы. Любой другой терапевтически эффективный способ введения может быть использован, например абсорбция через эпителиальные или эндотелиальные ткани, или с использованием генной терапии, при которой пациенту вводится молекула ДНК, кодирующая активный агент (например, с помощью вектора), что приводит к тому,что активный агент экспрессируется и секретируется in vivo. Кроме того, белок(белки) согласно изобретению может быть введен вместе с другими компонентами биологически активных агентов, таких как фармацевтически приемлемые поверхностно-активные вещества, наполнители, носители, растворители и среды для лекарств. Для парентерального введения (например, внутривенного, подкожного, внутримышечного) активный белок(белки) должен входить в рецептуру в качестве раствора, суспензии, эмульсии или лиофилизованного порошка, вместе с фармацевтически приемлемым парентеральным наполнителем (например,вода, физиологический раствор, раствор декстрозы) и добавками, которые поддерживают изотоничность(например, маннит) или химическую стабильность (например, консерванты и буферы). Состав стерилизуют с помощью обычно используемых технологий.-7 011749 Согласно настоящему изобретению значительное предпочтение отдается использованию среды согласно изобретению для продуцирования гормона роста.GH может быть нативным, т.е. GH природного происхождения. Предпочтительно, чтобы GH, который должен быть продуцирован, был гормоном человека. Так как GH является растворимым секретируемым белком, он высвобождается в супернатант клеточной культуры либо посредством его природного сигнального пептида, либо посредством гетерологичного сигнального пептида, т.е. сигнального пептида, полученного из другого секретируемого белка, который может быть более эффективным в конкретно применяемой экспрессирующей системе. Термин "гормон роста" используется в данном документе в качестве синонима термину "GH". Данный термин включает в себя природный или нативный GH, рекомбинантно продуцируемый GH, a также различные GH, подробно описанные в разделе Основы изобретения". Термин GH", используемый в данном документе, дополнительно включает в себя мутеины, функциональные производные, активные фракции, слитые белки, пермутированные по кругу белки и соли GH. GH предпочтительно представляет собой гормон роста человека, но может также быть другой разновидности, в частности гормоном роста млекопитающих. Используемый в данном документе термин "мутеины" относится к аналогам GH, в которых один или более аминокислотных остатков природного GH заменены другими аминокислотными остатками или удалены, или один или более аминокислотных остатков добавлены к природной последовательностиGH, без значительного уменьшения активности результирующих продуктов по сравнению с GH дикого типа. Данные мутеины получают посредством известного синтеза и/или посредством техники сайтспецифического мутагенеза, или любыми другими подходящими для этого техническими приемами. Мутеины в соответствии с настоящим изобретением включают в себя белки, кодируемые нуклеиновой кислотой, такой как ДНК или РНК, которые в жестких условиях гибридизуются с ДНК или РНК,кодирующими GH. ДНК, кодирующие GH, известны из предшествующего уровня техники. Термин "жесткие условия" относится к условиям гибридизации и последовательной промывки, которые специалист в данной области традиционно относит к "жестким". См. Ausubel и др., Current Protocols in Molecular Biology, выше, Interscience, N.Y.,6.3 и 6.4 (1987, 1992). He ограничиваясь данными примерами, жесткие условия включают в себя условия промывания при 12-20 С ниже расчетной Tm гибрида при изучении,например, в 2SSC и 0,5% SDS в течение 5 мин, 2SSC и 0,1% SDS в течение 15 мин; 0,1SSC и 0,5%SDS при 37 С в течение 30-60 мин и затем 0,1SSC и 0,5% SDS при 68 С в течение 30-60 мин. Специалисту в данной области понятно, что жесткие условия зависят также от длины последовательностей ДНК, олигонуклеотидных зондов (например, в 10-40 оснований) или смеси олигонуклеотидных зондов. Если использовать смесь зондов, предпочтительно использование тетраметилхлоридаммония (TMAC) вместо SSC. См. Ausubel, выше. Идентичность, определяемая посредством сравнения последовательностей, отражает взаимосвязь между двумя или более полипептидными последовательностями или двумя или более полинуклеотидными последовательностями. Вообще идентичность основана на точном соответствии нуклеотида нуклеотиду или аминокислоты аминокислоте двух полинуклеотидов или двух полипептидных последовательностей, соответственно, по всей длине сравниваемых последовательностей. Для последовательностей, между которыми нет точного соответствия, можно определить "% идентичности". Обычно две последовательности, которые нужно сравнить, выравнивают для получения максимальной корреляции между последовательностями. Данный способ может включать в себя вставки"гэпов" в любой, одной или обеих последовательностях, увеличивающие степень выравнивания. % идентичности можно определить по всей длине каждой из последовательностей, которые сравнивали (так называемое глобальное выравнивание), что, в частности, удобно для последовательностей одинаковой или очень похожей длины, или более короткой, чем определяемая длина (так называемое локальное выравнивание), что более подходит для последовательностей неравной длины. Способы сравнения идентичности и гомологии двух или более последовательностей хорошо известны в данной области. Так, например, имеющиеся в распоряжении программы Wisconsin SequenceAnalysis Package, версия 9.1 (Devereux J. и др., 1984), например программы BESTFIT и GAP, могут быть использованы для определения % идентичности между двумя полинуклеотидами и % идентичности и % гомологии между двумя полипептидными последовательностями. В программе BESTFIT используется алгоритм "локальной гомологии" Smith и Waterman (1981), и она лучше всего обнаруживает единственную область подобия между двумя последовательностями. Другие программы для определения идентичности и/или подобия между последовательностями также известны в данной области, например семейство программ BLAST (Altschul S.F. и др., 1990, Altschul S.F. и др., 1997, доступные на домашней страницеNCBI на www.ncbi.nlm.nih.gov) и FASTA (Pearson W.R., 1990). Любой такой мутеин предпочтительно имеет последовательность аминокислот, в достаточной мере повторяющую последовательность GH так, чтобы он имел в основном активность, подобную GH. Один тип активности GH представляет собой его способность связываться с GH-рецептором. До тех пор пока мутеин имеет существенную связывающую активность с GH-рецептором (GHR), он может рассматри-8 011749 ваться как имеющий существенно подобную GH активность. Таким образом, можно определить то, имеет ли любой данный мутеин существенно сходную с GH активность, посредством стандартных экспериментов, включая, например, простой конкурентный сэндвич-анализ такого мутеина, для определения того, связывается ли он с соответствующим образом меченным GHR или клетками, экспрессирующимиGHR, такой анализ как радиоиммунологический анализ или ELISA. В предпочтительном воплощении любой такой мутеин имеет по меньшей мере 40% идентичности или гомологии с аминокислотной или ДНК-последовательностью GH. Такие последовательности известны в данной области, например DeNoto и др., 1981 или Martial и др., 1979. Более предпочтительно он имеет по меньшей мере 50%, по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80% или наиболее предпочтительно по меньшей мере 90 или 95% идентичности или гомологии с аминокислотной или ДНК-последовательностью GH. Предпочтительные замены для мутеинов согласно настоящему изобретению представляют собой те, которые известны как "консервативные" замены. Консервативные аминокислотные замены полипептидов GH могут включать в себя синонимичные аминокислоты в пределах группы, которая имеет достаточно сходные физико-химические свойства, так, чтобы при заменах между представителями в пределах группы сохранялась биологическая функция молекулы (Grantham, 1974). Ясно, что вставки и делеции аминокислот также могут иметь место в определенных выше последовательностях без изменения их функции, в частности если вставки или делеции состоят только из нескольких аминокислот, например меньше тридцати, и предпочтительно меньше десяти, и не удаляются или не замещаются аминокислоты,которые необходимы для функциональной конформации, например остатки цистеина. Белки и мутеины,продуцируемые посредством таких делеций и/или вставок, входят в объем, охватываемый настоящим изобретением. Термин "слитый белок" относится к полипептиду, содержащему GH, или мутеину, или его фрагменту, слитому с другим белком, который, например, имеет продолжительное время пребывания в жидкой среде организма. GH может, таким образом, быть слит с другим белком, полипептидом или прочим,например с иммуноглобулином или его фрагментом. Fc-участки IgG пригодны для получения слитых с иммуноглобулином белков. Слитые с Ig белки описаны, например, в патентах ЕР 314317 A1 (Genentech) или ЕР 0325224 А 2 (Zymogenetics Inc.). Под "активными фракциями" GH или мутеинов и слитых белков в настоящем изобретении предусмотрен любой фрагмент или предшественники полипептидной цепи белковой молекулы, отдельно или вместе с ассоциированными молекулами или связанными с ними остатками, например сахаром или фосфатными остатками, или агрегаты белковой молекулы или остатки сахара сами по себе, определяющие указанную фракцию, имеют, по существу, схожую с GH активность. Если GH согласно изобретению будет использоваться в качестве фармацевтической композиции,такая фармацевтическая композиция может быть использована для лечения и/или предотвращения ряда заболеваний или нарушений. Такие заболевания или нарушения предпочтительно связаны с недостаточным эндогенным продуцированием GH. Очищенный GH может быть использован, например, для лечения и/или предупреждения дефицита GH, истощения при СПИДе, липодистрофии (называемой также синдромом HARS-HIV ассоциированной дистрофией/дисметаболизмом), или синдрома укороченной тонкой кишки, в частности, в педиатрии. Кроме того, заболевания, при которых может быть показано введение гормона роста, включают в себя цирроз печени, недостаток роста у взрослых, атеросклероз,болезнь Крона и неспецифический язвенный колит, остеоартрит, сердечную кахексию, застойную сердечную недостаточность, хроническую почечную недостаточность, восстановление или мобилизацию клеток крови, мужское бесплодие, мобилизацию гематопоэтических стволовых клеток, множественный склероз, инсульт, множественную системную атрофию или злокачественную опухоль. Имея теперь полное описание данного изобретения, специалист в данной области оценит, что подобное можно воспроизвести в пределах широкого круга эквивалентных параметров, концентраций и условий без отступления от сущности и рамок изобретения и без чрезмерного экспериментирования. Несмотря на то что данное изобретение описано в связи с его специфическими воплощениями, следует понимать, что возможны и другие модификации. Настоящий патент подразумевает любые вариации, применения или приспособления изобретения, в целом следующие принципам данного изобретения и включающие такие отступления от настоящего описания, которые подпадают под обычную практику в рамках области, к которой относится изобретение, и которые могут быть использованы в отношении основных признаков, сформулированных выше в данном документе, в объеме, охватываемом прилагаемой формулой изобретения. Все ссылки, указанные в данном документе, включая журнальные статьи или краткие обзоры,опубликованные или неопубликованные в США, или иностранная заявка на патент, опубликованная в США, или иностранные патенты, или любые другие ссылки полностью включены в настоящее описание посредством ссылки, включая все данные, таблицы, рисунки и текст, представленные в указанных ссылках. Кроме того, полное содержание ссылок, упоминаемых документов, цитируемых в рамках ссылок,приведенных в данном документе, также в полном объеме включены в настоящее описание посредством ссылки.-9 011749 Ссылка на известные стадии способа, традиционно используемые стадии способов, известные способы или традиционно используемые способы никоим образом не означает, что какой бы то ни было аспект, описание или воплощение настоящего изобретения уже были раскрыты, описаны или рекомендованы в релевантной области. Вышеизложенное описание специфических воплощений должно настолько основательно раскрывать общую природу изобретения, чтобы другие могли, применяя знания в пределах данной области,(включая содержания ссылок, указанных в данном документе), без труда модифицировать и/или адаптировать для различных применений данные специфические воплощения без чрезмерного экспериментирования, без уклонения от основной концепции настоящего изобретения. Следовательно, такие адаптации и модификации предусмотрены в рамках эквивалентных воплощений, раскрытых на основе концепции и методов, представленных в данном документе. Должно быть понятно, что фразеология или терминология данного документа служит для описания, а не ограничения изобретения, так что терминология или фразеология настоящего описания должны интерпретироваться специалистом в данной области лишь как руководство, которое в сочетании с навыками рядового специалиста в данной области позволят реализовать изобретение. Пример. Усовершенствование новой, не содержащей сыворотки продуцирующей среды для С 127 клеток, экспрессирующих hGH. 1. Введение. В данном исследовании описана экспериментальная работа, связанная с усовершенствованием продуцирующей культуральной среды (DMEM, модифицированная Дульбекко среда Игла) посредством добавок следовых количеств элементов металлов. В результате данного усовершенствования было получено поразительное увеличение продуктивности r-hGH в культуре клеток С 127. В следующей табл. 1 представлен суммарный эффект композиции DMEM и усовершенствования,который продемонстрирован в рамках данного примера. Таблица 1 Композиция ростовой среды, DMEM и продуцирующей среды- 11011749 2. Материалы и способы. Реагенты и растворы. Все химические реагенты были получены от Merck: сульфат цинка (ZnSO47H2O), сульфат меди(SO6H4)2(H2O)2]6 Н 2 О), нитрат никеля (Ni(NO3)26 H2O), селенит натрия (Na2SeO35 Н 2 О). Цитрат железа (FeC6H5O7 Sigma, номер по каталогу F3388) использовали в качестве источника железа. Смесь микроэлементов для ростовой среды (100000 Х) предоставлена JRH Biosciences. Все растворы микроэлементов для опытов готовили в виде концентрированных растворов в дистиллированной воде и стерилизованных путем фильтрования через 0,2 мкм фильтр. Добавление различных анализируемых добавок (растворы металлов и т.д.) в разных экспериментах проводили непосредственно в свежую культуральную среду. Культуры клеток. Генетически модифицированные мышиные клетки С 127 (АТСС CRL 1616) использовали для экспрессии рекомбинантного гормона роста человека (rhGH). Вектор основан на BPV69T, содержащем множественно клонированный сайт pBR322 и содержащем мини-ген rhGH в 1,6 т.п.н. под контролем мышиного промотора металлотионеина-1 (МТ-1). В экспериментах использовали культуры, полученные в Working Cell Bank из разных серий, продуцирующих rhGH. Культуру клеток инкубировали при 360,5 С и 0,4 об/мин в 2125 см роллер-флаконах, содержащих 37515 мл культуральной среды, или в 1700 см 2 роллер-флаконах, содержащих 300 мл культуральной среды. Культурная среда. Культуральной средой, используемой для фазы продуцирования rhGH, была DMEM с 4,5 г/л глюкозы, забуференной бикарбонатом натрия (3,7 г/л). Титрование rhGH. Измерение rhGH в культуральной среде проводили ежедневно посредством титрования HPLC с обращенной фазой. Материалы.Symmetry 300, 504,6 мм внутренний диаметр, С 4 5 мкм, P/N 186000287 (Waters). Реагенты. Трифторуксусная кислота (ТФУ) (Pierce, Cat.28904 или эквивалент). Ацетонитрил (ACN) (Merck 1,00030 или эквивалент). Очищенная вода, PW (например, вода MilliQ, или эквивалент). Гелий. Растворы. Подвижная фаза А: ТФУ 0,08% в H2O (об./об.). К необходимому количеству объема воды PW в градуированной колбе добавляли ТФУ согласно следующей таблице. Взбалтывали и прикрепляли этикетку. Подвижная фаза В: ТФУ 0,08% в ацетонитриле (об./об.). К необходимому количеству объема PW воды в объемной колбе добавляли ТФУ, согласно следующей таблице. Взбалтывали и прикрепляли этикетку. Параметры хроматографии. Элюирование градиентом: сначала смесью фаза А/фаза В 60/40, в конце фаза А/фаза В 20/80. Градиент завершается за 5 мин (небольшие вариации зависят от используемого оборудования). Объем инжекции 50 мкл. Регистрация: УФ-поглощение при 215 нм. Калибровочная кривая: стандартный образец r-hGH при 10, 50, 100, 120 и 150 мкг/мл. Концентрацию образца r-hGH определяли посредством сравнения с концентрацией стандартного образца r-hGH. Продуктивность GH. Продуктивность выражается как мг rhGH на роллер-флакон. Приблизительные данные представляют собой концентрацию rhGH при сборе клеток (что измеряли посредством HPLC) и полное количество- 12011749 роллер-флаконов при сборе клеток. Обычно роллер-флакон во время фазы сбора содержит приблизительно 109 клеток. 3. Результаты. В первых сериях экспериментов анализировали действие высокой концентрации кобальта (20 мкМCoCl26H2O) при периодическом добавлении его в культуральную среду. Добавление кобальта проводили во время двух замен среды на начальной стадии (промывка и PM=продуцирующая среда, т.е. 0 точка фазы сбора) и в промежуточной стадии (сборы 6 и 7) фазы продуцирования в одной серии. Результаты(не показаны) свидетельствуют о том, что промотор активен и может быть модулирован. Увеличение продуктивности дополнительно подтверждали при использовании других металлических элементов. Проводили анализ, соответственно, с барием (BaCl22 Н 2 О), кобальтом (CoCl26H2O),хромом (K[Cr(SO6H4)2(H2O)2]6 Н 2 О) и никелем (Ni (NO3)26H2O), в концентрациях 10 мкМ, непрерывно добавлявшихся непрерывно в среду. Результаты данного эксперимента изображены на фиг. 1 и 2. На фиг. 1 показано количество hGH, секретируемое экспрессирующими hGH клетками С 127, при культивировании в среде, содержащей анализируемые элементы в течение времени эксперимента(14 дней). На фиг. 2 показаны средние значения продуктивности, достигаемые для каждого анализируемого элемента. Полученная средняя продуктивность продолжает увеличение процентного соотношения по сравнению с контролем, т.е. величиной без следовых количеств элементов, в пределах между 1,1% для бария и 32,4% для кобальта. Также было отмечено, что продуктивность rhGH растет от 9 до 32,5% по сравнению с контрольной величиной при непрерывном способе введения кобальта по сравнению с периодическим. Ни барий, ни хром не вызывали увеличения продуктивности при исследуемых концентрациях в DMEM. Измерения в присутствии следовых количеств отдельных элементов DMEM дополняли микроэлементами Zn, Cu, Se и Co в концентрациях, представленных ниже в табл. 2. Данные концентрации соответствуют концентрациям элементов металлов в среде роста. Увеличение продуктивности rhGH,достигаемое посредством добавления в DMEM следовых количеств элементов, показано в табл. 2. Таблица 2 Увеличение продуктивности rhGH в процентах при изучении эффекта ионов металлов в DMEM при указанных концентрациях в мкМ Нужно отметить, что в случае цинка оцениваемая концентрация в 1,5 мкМ является причиной феномена "отшелушивания", т.е. отделения клеточного монослоя от пластического субстрата роллерфлаконов. В некоторых случаях данный пилинг ведет к потере культуры на последних стадиях сбора клеток (особенно между сборами клеток 12-14). Феномен отшелушивания может быть получен при использовании соответствующих сосудов для культуры клеток, таких как роллер-флаконы компании Corning под торговой маркой Cellbind. Измерение взаимодействия между металлами. Основываясь на действии меди и цинка на уровень продуцирования hGH, проводили план факторных экспериментов для проверки возможного комбинированного действия металлов. Статистический анализ результатов показан в табл. 3. Наблюдали стойкий синергический эффект в отношении продуктивности (р 0,0001) при использовании Cu и Zn совместно. Таблица 3 Статистические анализы 3-факторного плана факторного исследованияR-квадрат (скорректированный для d.f.)=96,8565%. Отшелушивание наблюдали во всех культурах, обработанных цинком при концентрации 1,5 мкМ,независимо от того, присутствует ли медь или нет.- 13011749 Последовательные планы факторных экспериментов проводили для изучения совместного действия цинка и меди, когда концентрацию цинка уменьшали (Zn 0,5 мкМ) и добавляли другие микроэлементы в среду роста, такие как магний, селен или цитрат железа, которые могут увеличивать продуктивность и адгезию культур к субстрату. Непрерывный рост продолжался от общей стартовой точки продуктивности, приблизительно 20 мгrhGH на флакон, с конечными значениями около 70 мг rhGH/RB, по сравнению с 30 мг rhGH в контрольной культуре со стандартной DMEM (не показано). Средние значения увеличения продуктивности GH(т.е. продуктивности, измеренной в мг/RB на 14 день) по сравнению с контролем показаны на фиг. 3. В данных сериях экспериментов феномен отшелушивания уменьшался. Добавление аминокислот. Исследование действия аминокислот проводили для того, чтобы определить, ограничено ли увеличение продуктивности hGH наличием любой аминокислоты. В табл. 4 показано процентное отношение в сборе клеток после двух дней культивирования в среде с добавлением и без добавления цинка и меди. Таблица 4 Процентное отношение концентрации аминокислот в необработанной среде в сборе клеток после двух дней культивирования,созданной из культур, поддерживаемых стандартнойL-глутамин (Gln 4,8 мМ), L-серин (Ser 0,49 мМ) и L-цистеин (Cys 0,29 мМ). Результаты показаны на фиг. 4. Положительного действия на продуктивность любой из тестируемых аминокислот не наблюдали,как раздельно, так и в смеси. Когда металлы добавляли совместно с аминокислотами, наблюдали только незначительное действие на продуктивность: легкий положительный эффект от глутамина (от 78,2 до 81,1%) и отрицательный эффект от цистеина (от 78,2 до 69,9%). Такие различия не рассматривались как существенные. Продуктивность несомненно различается в культурах, обработанных смесью металлов в DMEM(приблизительно 30 мг rhGH/RB на сбор клеток). Принимая во внимание эти результаты, не считали необходимым модифицировать исходную аминокислотную композицию продуцирующей среды. Эффект титрования меди и цинка. Для того чтобы измерить оптимальную концентрацию меди, эксперимент проводили, удерживая концентрацию цитрата железа (4,8 мкМ) и концентрацию цинка (0,5 мкМ) постоянными и варьируя концентрацию меди (фиг. 5). Как показано на фиг. 5, эксперимент зависимости доза-эффект подтвердил, что оптимальная концентрация меди, добавляемой в DMEM, составляет 25,6 нМ при указанных концентрациях цинка и цитрата железа. В другом эксперименте концентрацию цитрата железа (4,8 мкМ) и меди (0,025 мкМ) удерживали постоянными и варьировали концентрацию цинка (фиг. 6): уровень максимальной продуктивности наблюдали (плато) при концентрациях цинка выше 200 нМ, стабилизация продуктивности наблюдалась на уровне приблизительно на 60% выше средней контрольной величины. Краткое изложение результатов На фиг. 7 суммированы результаты, полученные с ионами Zn и Cu в незначительных концентрациях совместно с ионами железа или без них. Нижеследующие величины были получены на основе данных, полученных по увеличению продуктивности посредством добавления в среду DMEM следовых количеств металлических элементов: цинк 1,5 мкМ: 10,35,0%, цинк 0,5 мкМ: 16,81,6%,медь 0,02 мкМ: 32,19,4%,цинк 1,5 мкМ + медь 0,02 мкМ: 66,316%,цинк 0,5 мкМ + медь 0,02 мкМ: 61,2% (10%),цинк 0,5 мкМ + медь 0,02 мкМ + цитрат железа 4,8 мкМ: 69,419%. Принимая во внимание эти данные, нижеследующая смесь является оптимальной в качестве присадки к среде DMEM.- 14011749 Медь в качестве сульфата меди (CuSO45H2O) при 25 нМ. Цинк в качестве сульфата цинка (ZnSO47H2O), между 50 и 1500 нМ с предпочтительными концентрациями от 200 до 500 нМ. Цитрат железа при концентрации ионов от 4,8 мкМ до конечной концентрации приблизительно в 6 мкМ, с учетом того, что нитрат железа уже присутствует в DMEM. Заключение. Использование ионов меди, цинка и железа в незначительных количествах в качестве добавок к среде DMEM увеличивает продуктивность rhGH более чем на 50% по сравнению со стандартной DMEM. Ссылки 1. Altschul S.F. et al., J. Mol. Biol., 215, 403-410, 1990. 2. Arnold et al. US 2003/0153042. 3. Ausubel et al., Current Protocols in Molecular Biology, supra, Interscience, N.Y.,6.3 and 6.4 (1987,1992). 4. Altschul S.F. et al., Nucleic Acids Res., 25:389-3402, 1997. 5. Becker et al., Biotechnol. Appl. Biochem. 10:326 (1988). 6. Bewly et al., Int. J. Peptide and Protein Res. 4:281-287 (1972). 7. Blum et al. US 6399381. 8. Bohak et al. 1987, Bohak Z., Kadouri A. et al. (1987), "Novel anchorage matrices for suspension culture ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ продуцирования гормона роста человека, включающий стадию культивирования клеточной линии, экспрессирующей гормон роста, в культуральной среде, не содержащей компонентов, полученных из сыворотки животных, причем среда содержит цинк в концентрации в интервале от 0,2 до 1,75 мкМ, медь в концентрации в интервале от 10 до 75 нМ и ионы железа в концентрации в интервале от 1 до 10 мкМ, где клетки представляют собой мышиные клетки С 127 и среда дополнительно содержит компоненты основной среды. 2. Способ по п.1, где среда содержит цинк в концентрации 0,2 мкМ. 3. Способ по любому из предшествующих пунктов, где среда содержит цинк в концентрации 0,5 мкМ. 4. Способ по любому из предшествующих пунктов, где среда содержит цинк в виде сульфата цинка. 5. Способ по любому из предшествующих пунктов, где среда содержит медь в концентрации 25 нМ. 6. Способ по любому из предшествующих пунктов, где среда содержит медь в виде сульфата меди. 7. Способ по любому из предшествующих пунктов, где среда содержит ионы железа в концентрации 5 или 6 мкМ. 8. Способ по любому из предшествующих пунктов, где среда содержит ионы железа в виде цитрата железа и/или нитрата железа. 9. Способ по любому из предшествующих пунктов, где основная среда представляет собой модифицированную Дульбекко среду Игла (DMEM). 10. Способ по любому из предшествующих пунктов, где гормон роста человека экспрессируется под контролем металлотионеинового (МТ) промотора. 11. Способ по п.10, где металлотионеиновый промотор представляет собой мышиный МТ-1 промотор. 12. Способ по любому из предшествующих пунктов, дополнительно включающий в себя стадию выделения гормона роста человека из культуры клеток. 13. Способ по п.12, дополнительно включающий стадию очистки гормона роста человека. 14. Применение среды, как она определена в любом из пп.1-9, для продуцирования гормона роста человека. 15. Применение среды, как она определена в любом из пп.1-9, для поддержания клеток в культуре в течение фазы продуцирования гормона роста человека.
МПК / Метки
МПК: C07K 14/61, C07K 14/825, C12N 5/02
Метки: клеток, гормона, человека, сыворотки, среды, роста, содержащей, гормон, млекопитающих, культивирования, способ, экспрессирующих, продуцирования, применение
Код ссылки
<a href="https://eas.patents.su/19-11749-sposob-producirovaniya-gormona-rosta-cheloveka-i-primenenie-sredy-ne-soderzhashhejj-syvorotki-dlya-kultivirovaniya-kletok-mlekopitayushhih-ekspressiruyushhih-gormon-rosta-cheloveka.html" rel="bookmark" title="База патентов Евразийского Союза">Способ продуцирования гормона роста человека и применение среды, не содержащей сыворотки, для культивирования клеток млекопитающих, экспрессирующих гормон роста человека</a>
Предыдущий патент: Способ получения рисперидона
Следующий патент: Стоматологический наконечник
Случайный патент: Лекарственный препарат местного применения для лечения асептического воспаления, содержащий в качестве активного ингредиента анемонин