Штаммы микроорганизма rhodococcus, способные превращать нитрил в амид, и способ получения амидов
Формула / Реферат
1. Штамм микроорганизма Rhodococcus sp. GF270 DSM 12211, а также его функционально эквивалентные варианты и мутанты, способные превращать нитрил в амид.
2. Штамм микроорганизма Rhodococcus sp. GF376 DSM 12175, а также его функционально эквивалентные варианты и мутанты, способные превращать нитрил в амид.
3. Способ получения амидов, отличающийся тем, что нитрил, применяемый в качестве субстрата, превращают в соответствующий амид с помощью штаммов микроорганизма по п.1 или 2, или экстракта, содержащего нитрилгидратазу, полученного из указанного микроорганизма.
4. Способ по п.3, отличающийся тем, что в качестве нитрила используют необязательно замещенный алифатический нитрил, содержащий от 1 до 10 атомов углерода.
5. Способ по п.4, отличающийся тем, что в качестве нитрила используют необязательно замещенный алифатический нитрил, содержащий от 4 до 10 атомов углерода.
6. Способ по п.3, отличающийся тем, что в качестве нитрила используют ароматический нитрил, выбранный из соединений общих формул
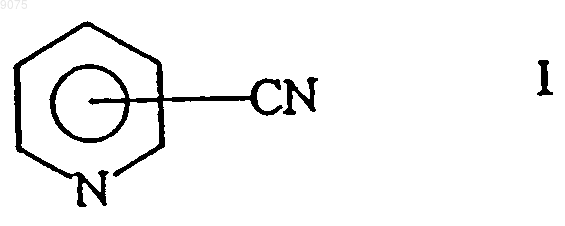
или
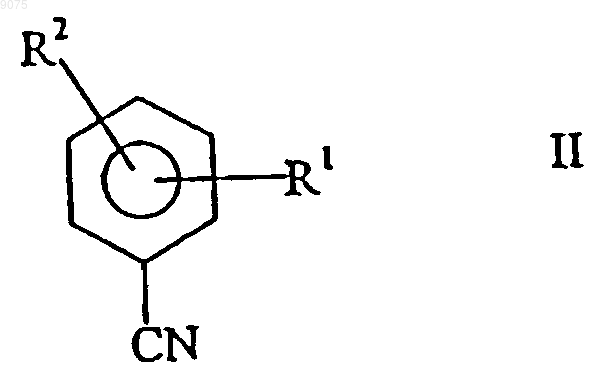
где R1 и R2 обозначают атом водорода, атом галогена или С1-С4алкил.
7. Способ по любому из пп.3-6, отличающийся тем, что превращение осуществляют при температуре от 0 до 50шС и при значении рН от 4,5 до 10.
Текст
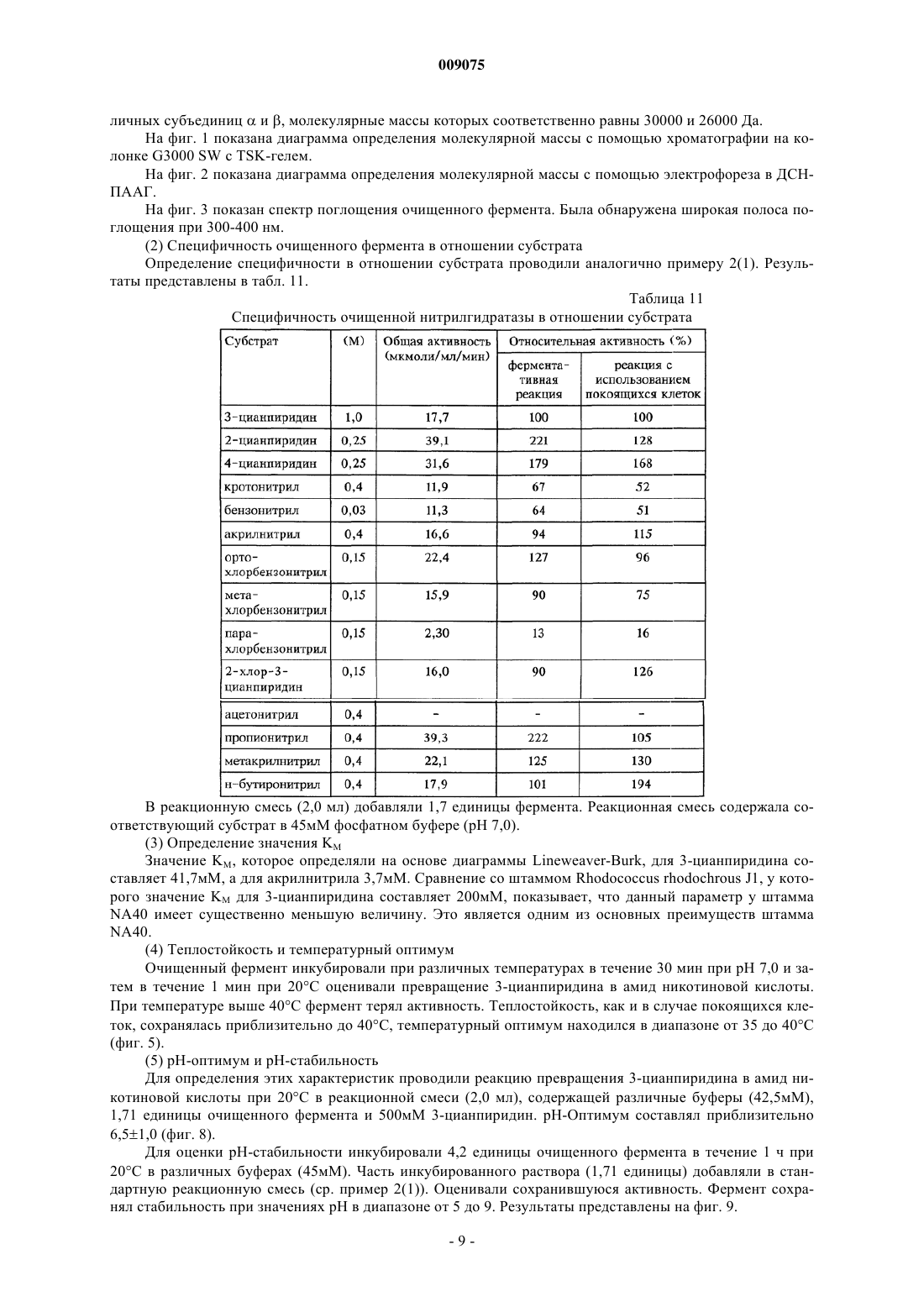
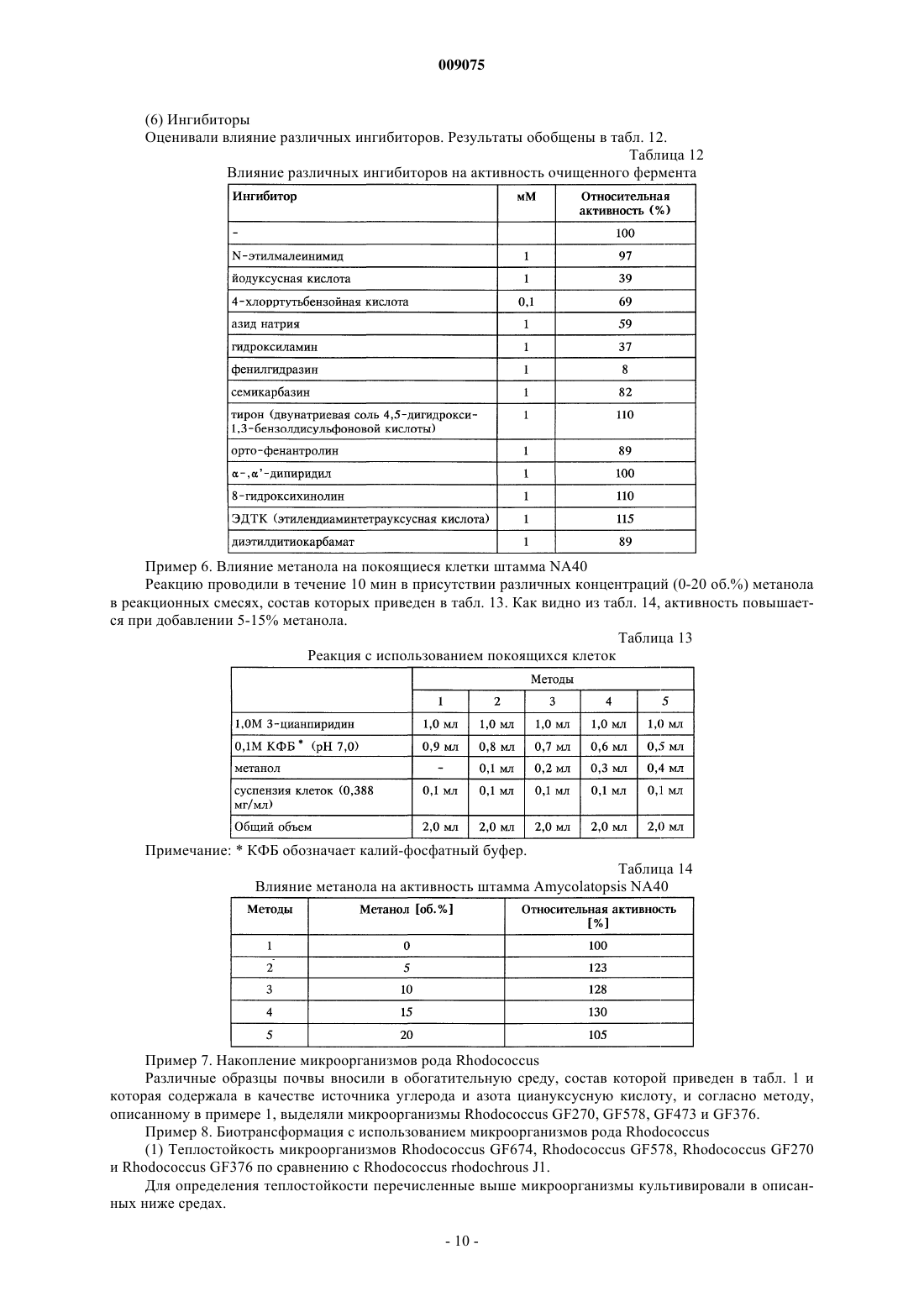
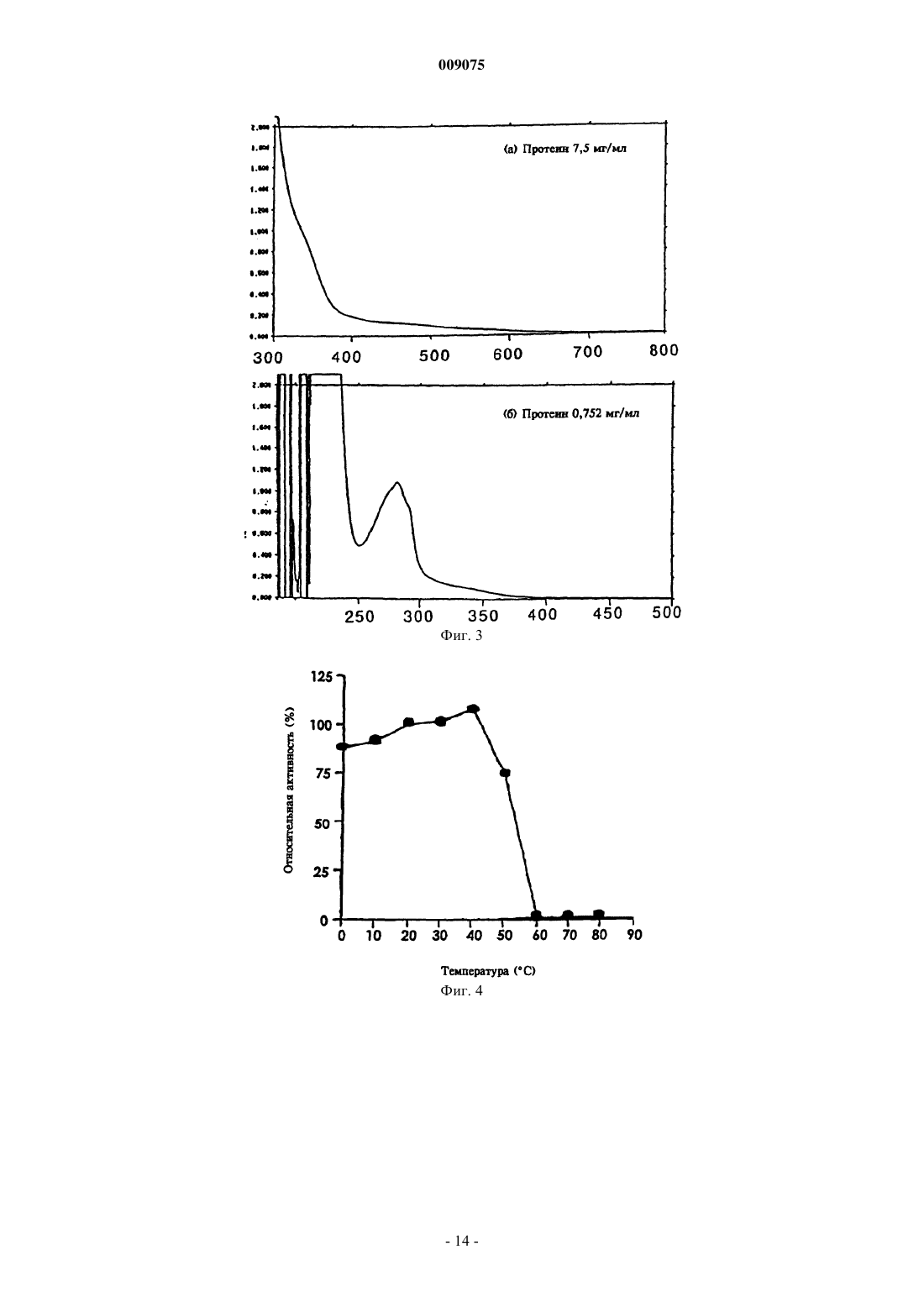
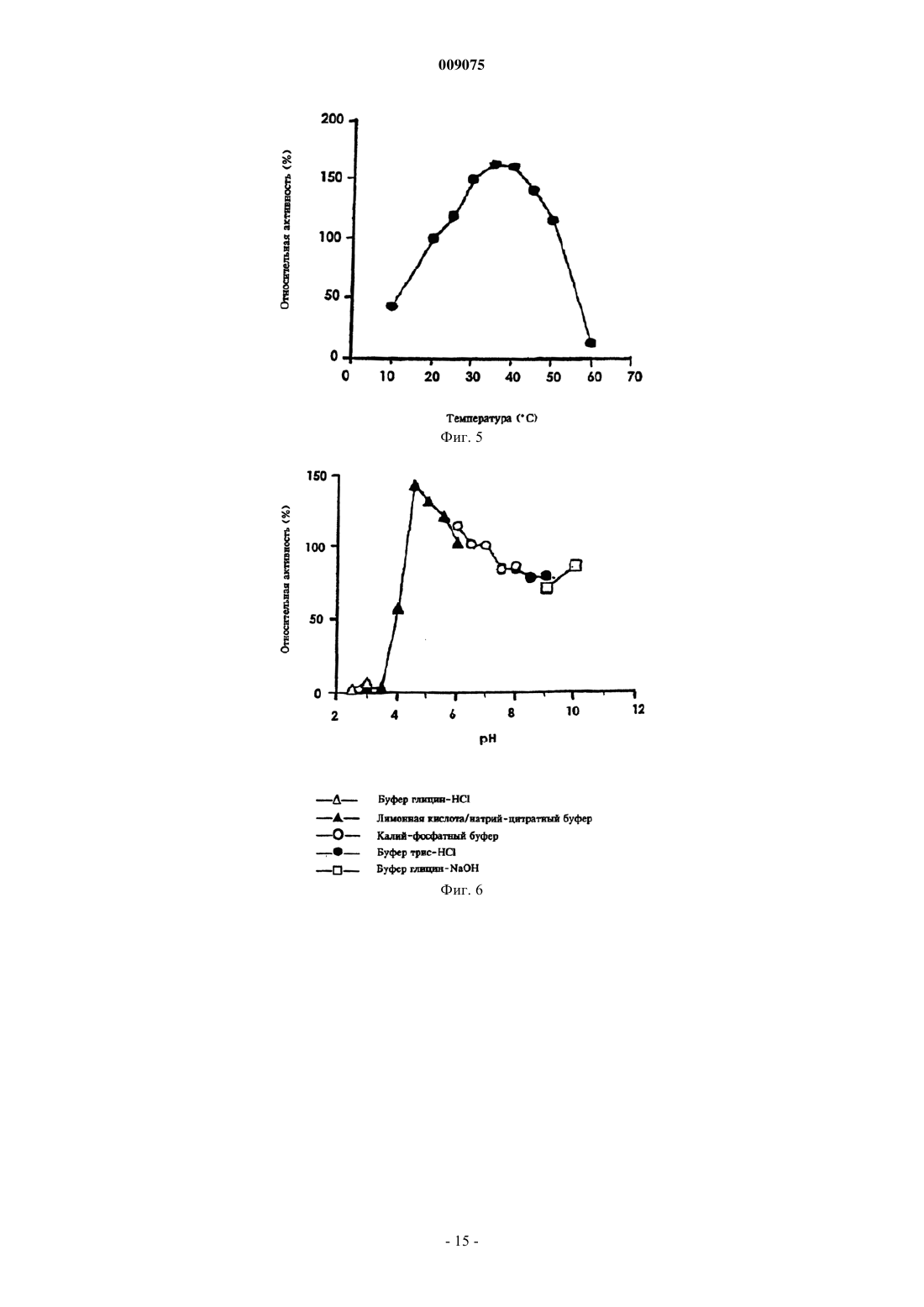
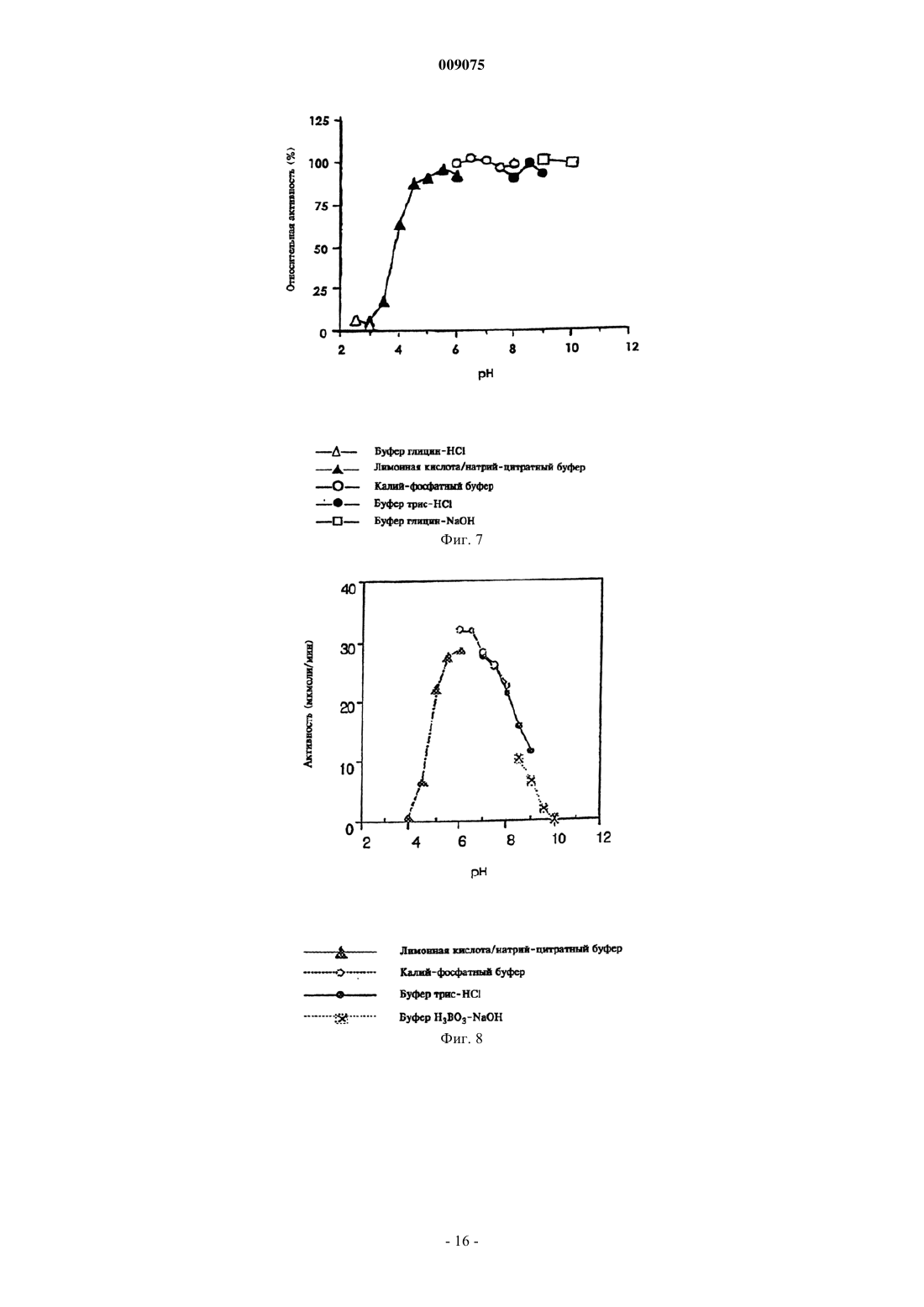
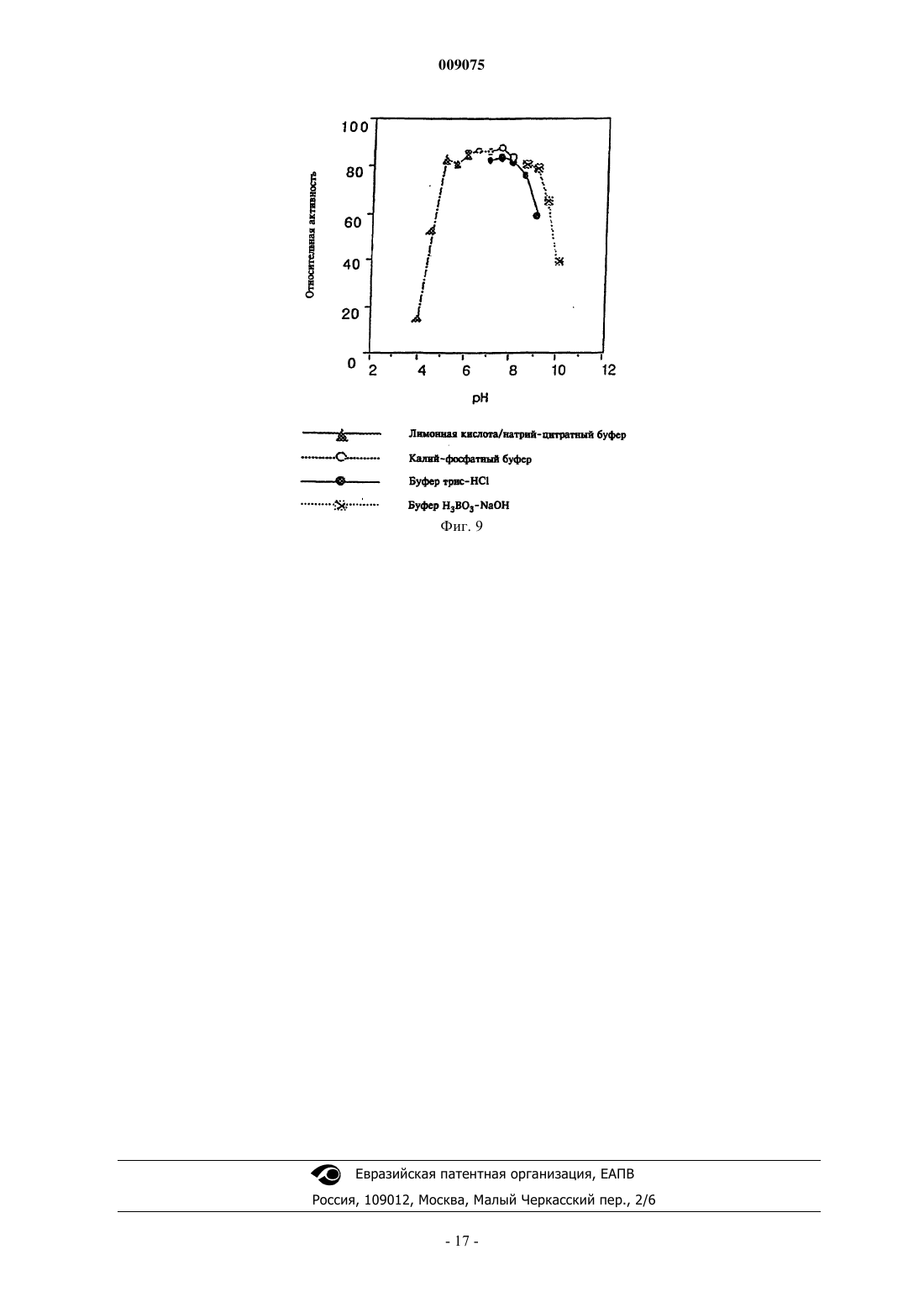
009075 Настоящее изобретение относится к новым микроорганизмам рода Rhodococcus, а также к новому способу получения амидов с использованием этих микроорганизмов, соответственно с использованием экстракта ферментов этих микроорганизмов. Для получения амидов, таких как, например, амид никотиновой кислоты, который является важным для животных и людей витамином комплекса витаминов В, уже известны многочисленные биотехнологические способы. Широко известно, что содержащие нитрилгидратазу микроорганизмы превращают нитрилы в соответствующие амиды. Так, в ЕР-А 0188316 описан способ получения амида никотиновой кислоты из 3-цианпиридина с использованием микроорганизмов родов Rhodococcus, Arthrobacter или микобактерий. Недостатком этого способа является то, что эти микроорганизмы обладают лишь незначительной активностью в отношении превращения 3-цианпиридина в амид никотиновой кислоты. В ЕР-А 0307926 описано превращение 3-цианпиридина в амид никотиновой кислоты с помощью микроорганизмов вида Rhodococcus rhodochrous J1. Для того чтобы эти микроорганизмы катализировали требуемое превращение, их необходимо индуцировать. Еще одним недостатком этого способа является то, что Rhodococcus rhodochrous J1 имеет красную окраску и вследствие этого происходит окрашивание продукта. Кроме того, этот микроорганизм обладает лишь незначительной теплостойкостью и ингибируется, например, субстратом 3-цианпиридином. Еще один способ получения амида никотиновой кислоты из 3-цианпиридина с помощью микроорганизмов вида Rhodococcus rhodochrous J1 описан в ЕР-А 0362829. Для повышения удельной активности содержащих нитрилгидратазу микроорганизмов в среду для культивирования в качестве индуктора добавляют мочевину или производное мочевины. При использовании этого способа, равно как и способа,описанного выше, происходит окрашивание продукта. Далее в WO 95/17505 описан способ получения ароматических амидов из соответствующих нитрилов с помощью микроорганизмов вида Rhodococcus rhodochrous M33. Недостатком этого способа является красная окраска Rhodococcus rhodochrous М 33, а также высокое значение KM для субстрата 3 цианпиридина. Задачей настоящего изобретения является устранение этих недостатков и разработка такого способа получения амидов, который обеспечивал бы получение соответствующих амидов с высоким выходом и высокой степенью чистоты. Указанная задача решается с помощью новых микроорганизмов, а также с помощью способа с их использованием. Суть способа по изобретению заключается в том, что используемый в качестве субстрата нитрил превращают в соответствующий амид с помощью микроорганизмов рода Rhodococcus, с помощью экстракта ферментов этих микроорганизмов. Применяемые для биотрансформации нитрилы, такие как, например, 3-цианпиридин, представляют собой имеющиеся в продаже соединения. Микроорганизмы по изобретению обладают способностью превращать используемые в качестве субстрата нитрилы в соответствующие амиды. Предпочтительно, чтобы эти микроорганизмы обладали способностью расти на средах, содержащих нитрилы или амиды в качестве единственных источников углерода и/или азота. Микроорганизмы по изобретению получают путем соответствующего отбора, например, из образцов почвы, ила или сточных вод с помощью обычных микробиологических методов. Целесообразно осуществлять отбор микроорганизмов путем выращивания в среде, содержащей нитрилы или амиды предпочтительно в качестве единственных источников углерода и азота, в присутствии ионов кобальта. Пригодные для осуществления отбора нитрилы и амиды представляют собой прежде всего нитрилы, которые также применяют в качестве субстрата для последующей биотрансформации, и соответствующие получаемые из них амиды. Пригодные для роста среды также известны специалисту в данной области; например, может использоваться среда, представленная в табл. 1. Как правило, микроорганизмы до осуществления собственно биотрансформации культивируют(выращивают) в одних и тех же условиях, при этом применяют указанные выше среды. Как известно специалистам, нитрилгидратаза образуется только тогда, когда среда для роста содержит ионы кобальта в качестве кофактора. Пригодными "кобальтовыми соединениями, образующими ионы кобальта" являются соли, содержащие Co2+ или Co3+. Примерами содержащих Co2+ или Co3+ солей являются хлорид кобальта, сульфат кобальта и ацетат кобальта. В качестве кобальтового соединения целесообразно применять соль, содержащую Co2+, такую, как,например, СоСl2. Выращивание можно также осуществлять в присутствии витамина В 12 вместе с металлическим кобальтом или другими кобальтовыми соединениями, которые in situ дают ионы кобальта. Целесообразно применять кобальтовое соединение в количестве от 1 до 10 мг/л, предпочтительно от 1 до 3 мг/л. Как правило, выращивание осуществляют при температуре от 20 до 50 С и при значении рН в диапазоне от 5 до 8, предпочтительно при температуре от 30 до 45 С и значении рН в диапазоне от 5,5 до 7,5.-1 009075 При создании изобретения далее было установлено, что некоторые микроорганизмы родаRhodococcus обладают лучшими характеристиками в отношении превращения нитрилов в амиды по сравнению с Rhodococcus rhodochrous J1, описанным в ЕР-А 0362829. Этими микроорганизмами являются Rhodococcus GF674, Rhodococcus GF578, Rhodococcus GF473, Rhodococcus GF270 (DSMZ 12211) иRhodococcus GF376 (DSMZ 12175) или их функционально эквивалентные варианты и мутанты. В соответствии с Будапештским договором в Немецкую коллекцию микроорганизмов и клеточных культур 15.05.1998 г. был помещен микроорганизм, имеющий регистрационный номер DSMZ 12175, а 08.06.1998 г. был помещен микроорганизм, имеющий регистрационный номер DSMZ 12211. Штаммы Rhodococcus GF270, GF376, GF473, GF578 и GF674 после идентификации отнесены к еще не описанным в научной литературе видам рода Rhodococcus. Таким образом, изобретение также относится к микроорганизмам Rhodococcus GF270, Rhodococcus GF376, Rhodococcus GF473, RhodococcusGF578 и Rhodococcus GF674. В отличие от этого микроорганизмы рода Rhodococcus целесообразно индуцировать перед их использованием для собственно биосинтеза. В качестве индукторов пригодны индукторы, описанные в ЕРА 0307926, такие как, например, ацетамид, амид масляной кислоты, метакриламид, амид пропионовой кислоты, кротонамид и амид валериановой кислоты. Под "функционально эквивалентными вариантами и мутантами" подразумеваются микроорганизмы, происходящие из вышеуказанных организмов-предшественников и обладающие в основном такими же свойствами и функциями, что и последние. Такие варианты и мутанты могут возникать случайно,например, в результате облучения ультрафиолетовым светом или под действием вызывающих мутации химических веществ. Сокращения и пояснения, использовавшиеся при идентификации 30% ДАП диаминопимелиновая кислота АРА арабиноза ГАЛ галактоза МАД мадуроза КСИ ксилоза ГЛЮ глюкоза РИБ рибоза Типы сахаров даны согласно Lechevalier и др., 1971 Типы жирных кислот даны согласно Kroppenstedt, 1985 и 1992 9/4 МК-9 (Н 4) 9/6 МК-9 (Н 6) 9/8 МК-9 (Н 8) МК миколовые кислоты ФЭ фосфатидилэтаноламин ОН-ФЭ гидрокси-ФЭ мет-ФЭ фосфатидилметилэтаноламин ФХ фосфатидилхолин ФГА фосфатидилглюкозамин ФИ фосфатидилинозитол ФИМ фосфатидилинозитолманнозид ФГ фосфатидилглицерин ДФГ дифосфатидилглицерин ГЛ гликолипид Жирные кислоты изо-16 изогексадекановые кислоты или 14-метилпентадекановые кислоты 10-Ме-18 туберкулостеариновая кислота 2-ОН-16 2-гидроксипальмитиновая кислота Идентификация штаммов GF270, GF376, GF473, GF578 и GF674 Идентификацию этих штаммов проводили на основе 5 независимых друг от друга характеристик. 1. Морфология и цвет колоний: Короткие разветвленные гифы, которые распадаются на элементы,напоминающие палочки и споры. Колонии штаммов GF270 и GF376 имеют розовато-красный цвет (RAL 3022), а колонии штаммов GF578 и GF674 имеют ярко-красный цвет (RAL 3012). 2. Диаминокислоты пептидогликанов: Мезодиаминопимелиновая кислота. 3. Миколовые кислоты: миколовые кислоты Rhodococcus: Определение миколовой кислоты с длинной цепью осуществляли с помощью высокотемпературной газовой хроматографии. Профили элюирования миколовых кислот штаммов GF270 и GF376, а также штаммов GF473, GF578 и GF674 были иден-2 009075 тичными. Цепи миколовых кислот штаммов GF270 и GF376 включали 38-46 атомов углерода, а цепи миколовых кислот штаммов GF473, GF578 и GF674 включали 40-48 атомов углерода. Характеристики миколовых кислот сравнивали с характеристиками миколовых кислот штаммов Rhodococcus. ШтаммGF270 был идентифицирован с очень низким коэффициентом корреляции (0,086) как принадлежащий к виду Rhodococcus rhodochrous; GF376 не мог быть идентифицирован этим методом. Остальные три изолята GF473, GF578 и GF674 были идентифицированы с очень низким коэффициентом корреляции как принадлежащие к виду Rhodococcus ruber. 4. Спектр жирных кислот: Неразветвленные насыщенные и ненасыщенные жирные кислоты, включая туберкулостеариновую кислоту. Спектр жирных кислот является диагностическим признаком для представителей всех родов Rhodococcus и близкородственных родов Mycobacterium, Nocardia, Dietzia,Tsukamurella и некоторых видов коринебактерий. Идентификацию на видовом уровне осуществляли на основе количественных и качественных различий характеристик жирных кислот штаммов GF270, GF376,GF473, GF578 и GF674 и жирных кислот видов Rhodococcus. 5. Частичные последовательности 16S-рДHK штаммов GF270 и GF376 были идентичными (100%),хотя их сравнение с последовательностями штаммов Rhodococcus выявило сходство только на 99,1% с наиболее близкородственным видом Rhodococcus rhodochrous. Штаммы GF473 и GF578 имели идентичные последовательности 16S-рДHK (100%). Штамм GF674 имел отличие от штамма GF578 только в одной паре оснований из 500 (99,8%). Все три изолята имели лишь отдаленное родственное сходство сRhodococcus coprophilus (98,4%). На основе хемотаксических и молекулярно-биологических данных можно сделать заключение о том, что GF270 и GF376, с одной стороны, и GF473, GF578 и GF674, с другой стороны, представляют собой штаммы двух новых видов Rhodococcus. По своим последовательностям 16S-рДHK штаммыGF270 и GF376 являются близкородственными с Rhodococcus rhodochrous (99,1%), а штаммы GF473,GF578 и GF674 имеют лишь отдаленное родственное сходство с Rhodococcus coprophilus (98,4%). Экстракт ферментов может быть получен путем хорошо известного специалистам разрушения микроорганизмов, например, с помощью ультразвука, с помощью пресса типа Френч или с использованием лизозима. Очевидно, что для осуществления способа этот экстракт ферментов, равно как и целые клетки микроорганизмов, могут быть иммобилизованы на пригодном носителе, представляющем собой полимер, или абсорбирован на пригодном носителе. Ферменты по изобретению, обладающие нитрилгидратазной активностью, могут быть получены из микроорганизмов рода Amycolatopsis, прежде всего из штамма Amycolatopsis NA40 (DSMZ 11617), и они обладают способностью превращать нитрил в амид. Основными свойствами этих ферментов являются следующие: а) рН-оптимум составляет 6,51,0; б) температурный оптимум при рН 7,0 находится между 35 и 40 С; в) значение KM для субстрата 3-цианпиридина составляет 41,77,7 мМ (20 С, 45 мМ фосфатный буфер, рН 7,0), прежде всего ферменты имеют г) молекулярную массу 105 кДа, что может быть определено, например, с помощью электрофореза в ДСН-ПААГ. В качестве субстрата для биотрансформации могут применяться в принципе любые нитрилы. Целесообразно применять либо алифатические нитрилы, содержащие от 1 до 10 атомов углерода, при необходимости замещенные, например, гидрокси-, аминогруппой, галогеном или карбоксигруппой, либо замещенные или незамещенные ароматические нитрилы, содержащие от 4 до 10 атомов углерода в ароматической кольцевой системе. В качестве алифатических нитрилов, содержащих от 1 до 10 атомов углерода, могут применяться динитрилы, гидроксинитрилы, аминонитрилы, такие как, например, ноктаннитрил, циануксусная кислота, изокапронитрил, н-валеронитрил, адипонитрил, глутаронитрил,сукцинонитрил, себаконитрил, пропионитрил, кротонитрил, акрилнитрил, метакрилнитрил, нитрил нмасляной кислоты или азеланитрил. В качестве ароматических нитрилов, содержащих от 4 до 10 атомов углерода, могут применяться нитрилы общих формул где R1 и R2 обозначают атом водорода, атом галогена или С 1-С 4 алкил. Атом галогена может представлять собой F, Cl, Br или J.-3 009075 С 1-С 4 алкил может представлять собой метил, этил, пропил, изопропил, трет-пропил, бутил, изобутил или трет-бутил. Пригодными представителями ароматических нитрилов общей формулы I или II являются 2-, 3- или 4-цианпиридин, бензонитрил, фтор-, хлор-, бромбензонитрил, например, орто-, мета-,пара-хлорбензонитрил или 2-хлор-3-цианпиридин. Предпочтительно в качестве ароматического нитрила,содержащего от 4 до 10 атомов углерода, применять 3-цианпиридин. Биотрансформацию с применением однократной или непрерывной загрузки субстрата целесообразно проводить таким образом, чтобы концентрация субстрата не превышала 40 мас.%, предпочтительно 30 мас.%. Способ целесообразно осуществлять с использованием покоящихся (не растущих) клеток. В качестве сред для биотрансформации пригодны обычные в данной области техники среды, такие как, например, низкомолярный фосфатный буфер, буфер HEPES (N-2-гидроксиэтилпиперазин-N'-2 этансульфоновая кислота), цитратный буфер, боратный буфер, среды, состав которых представлен в табл. 1-3, или их модифицированные формы, такие как, например, среда, описанная в примере 8(1), или буфер трис-НСl. Биотрансформацию целесообразно проводить при температуре от 0 до 50 С и при значении рН в диапазоне от 4,5 до 10, предпочтительно при температуре от 20 до 40 С и при значении рН в диапазоне от 4,5 до 10,0. В особенно предпочтительном варианте осуществления биотрансформацию можно проводить в присутствии С 1-С 4 спиртов. В качестве С 1-С 4 спиртов могут применяться метанол, этанол, пропанол или бутанол. Предпочтительно применяют метанол. По завершении превращения соответствующие амиды могут быть выделены с помощью обычных методов переработки, например с помощью кристаллизации. Примеры Пример 1. Культивирование микроорганизмов родов Actinomadura и Amycolatopsis а) В различные образцы почвы, помещенные в обогатительную среду, состав которой приведен в табл. 1, вносили различные нитрилы или амиды в качестве источников углерода и азота и инкубировали в течение 7-10 дней при 37 или 45 С. После этого культуры пересевали в такую же среду и еще раз культивировали в течение 7-10 дней при 37 С. Весь процесс повторяли трижды. После этого культуры разжижали и высевали на планшеты для получения отдельных колоний. Планшеты инкубировали в течение 5 дней при 37 С. После этого различные колонии тестировали на требуемую активность. Таким путем выделяли штаммы Amycolatopsis NA40 (DSMZ 11617) и Amycolatopsis NE31 (DSMZ 11616) и затем выращивали их в оптимизированной среде (табл. 3) при встряхивании в течение 90-100 ч при 37 С. Для Amycolatopsis NE31 (DSMZ 11616), Actinomadura spadix E3733 и Actinomadura spadix E3736 в качестве источника углерода и азота использовали адипонитрил, для Amycolatopsis NA40 (DSMZ 11617) и Actinomadura spadix 45A32 в качестве источника углерода и азота использовали азеланитрил, для Actinomadura spadix 4501 в качестве источника углерода и азота использовали н-октанитрил, а для Actinomadura spadix С 15 в качестве источника углерода и азота использовали циануксусную кислоту. б) Штамм Amycolatopsis NA40 культивировали в среде, состав которой представлен в табл. 3. Культивирование осуществляли в субкультурах (в пробирках объемом 4 мл) и в "основной культуре" (в колбах объемом 500 мл) в аэробных условиях при температуре 37 С в течение 2, соответственно 3-4 дней. Рост клеток измеряли турбидиметрическим методом при длине волны 610 нм и сухую массу клеток подсчитывали следующим образом: масса сухих клеток (в мг/мл) = ОП 610 нм 0,277. Таблица 1 Пример 2. Биотрансформация с использованием микроорганизмов родов Actinomadura и Amycolatopsis(1) Для определения нитрилгидратазной активности реакционную смесь (2 мл), содержащую 3 цианпиридин (1,0 М, 1,0 мл), калий-фосфатный буфер (рН 7,0, 0,1 М, 0,5 мл) и 0,5 мл суспензии клеток,инкубировали при перемешивании при 20 С в течение 30 мин. Реакцию прекращали путем добавления 0,2 мл 3 н. HCl. После кратковременного центрифугирования определяли содержание образовавшегося никотинамида с помощью ЖХВР (система типа Shimadzu SPD 6 А с С 18-колонкой (Develosil ODS-HG-5,4,6250 см); растворитель: 10 мМ KН 2 РО 4/Н 3 РО 4 (рН 2,8)/ацетонитрил (в объемном соотношении 9:1); скорость потока: 1 мл/мин; абсорбцию измеряли при 230 нм). Удельную активность выражали в виде количества (мкмоль) образовавшегося никотинамида/мл/мин/ОП 610 нм. Скорости превращения алифатических нитрилов в обогатительной среде (табл. 1) с использованием выделенных бактерий представлены в табл. 5, влияние индукторов и кофакторов, внесенных в основную среду (табл. 2), представлено в табл. 4, а сравнение активности Amycolatopsis и Rhodococcus в основной среде (табл. 2) представлено в табл. 6. Данные из табл. 4 свидетельствуют о том, что нитрилгидратаза изAmycolatopsis NA40 экспрессируется конститутивным образом, однако для проявления активности в качестве кофактора необходим кобальт.(2) Влияние температуры на рост штамма NA40 Субкультуры (2 мл) инкубировали в среде, представленной в табл. 3, в течение 2 дней при 37 С, затем их пересевали в 20 мл среды, представленной в табл. 3 и содержащейся во встряхиваемых колбах. Культивирование проводили при 37, 40, 45, 50 и 55 С в течение 3-4 дней при встряхивании. Измеряли рост клеток и оценивали нитрилгидратазную активность при 20 С. В табл. 7 представлены данные о влиянии температуры на нитрилгидратазную активность и рост клеток. Таблица 4 Влияние индукторов и кофакторов на удельную активность в основной среде-5 009075 Таблица 5 Скорости превращения алифатических нитрилов при использовании выделенных бактерий(3) Для определения активности штамма NA40 в отношении других субстратов клетки с сухой массой 0,0388 мг инкубировали в описанном выше буфере. Реакцию начинали путем добавления соответствующего субстрата и смесь инкубировали при встряхивании в течение 10 мин при 20 С. Реакцию прекращали, добавляя 0,2 мл 2 н. HCl, и реакционную смесь центрифугировали в течение короткого промежутка времени. Надосадочную жидкость анализировали с помощью ЖХВР или газовой хроматографии. В табл. 8 приведены условия опытов по определению специфичности в отношении субстрата, а в табл. 9 представлены данные по специфичности покоящихся клеток штамма NA40 в отношении различных субстратов. Соответствующие условия опытов обобщены в табл. 8, а результаты - в табл. 9. Таблица 7 Влияние температуры выращивания на нитрилгидратазную активность и на рост клеток-6 009075 Таблица 8 Условия опытов для определения специфичности в отношении субстрата Примечание: орто-, мета-, парахлорбензонитрил и 2-хлор-3-цианпиридин добавляли в реакционную смесь в виде раствора в метаноле. Таблица 9 Специфичность нитрилгидратазы штамма NA40 в отношении субстрата(4) Температурный оптимум покоящихся клеток и их теплостойкость Реакцию проводили в течение 10 мин в стандартной реакционной смеси. Температурный оптимум находился в диапазоне от 35 до 40 С (фиг. 5). После этого клетки инкубировали в течение 30 мин при различных температурах и оценивали активность в стандартных реакционных условиях. Как видно из фиг. 4, теплостойкость сохранялась приблизительно до 40 С.(5) рН-оптимум и рН-стабильность покоящихся клеток Для определения этих характеристик проводили реакцию в течение 10 мин в стандартной реакционной смеси, в которой калий-фосфатный буфер заменяли различными 0,1 М буферами. Как видно из фиг. 6, оптимальное значение рН находится в диапазоне от 4,5 до 10. После инкубации клеточной суспензии в течение 30 мин при 20 С при различных значениях рН клетки центрифугировали. Затем клетки промывали и ресуспендировали в 0,1 М калий-фосфатном буфере с рН 7,0. Реакцию проводили в течение 10 мин в стандартных условиях при добавлении 3-цианпиридина. Фермент оставался стабильным при значениях рН в диапазоне от 4,5 до 10,0 (фиг. 7).(6) Накопление никотинамида, получаемого из 3-цианпиридина с использованием штамма NA40 Реакцию проводили в реакционной смеси (30 мл), содержащей 500 мМ 3-цианпиридин, 40 мМ калий-фосфатный буфер (рН 7,0) и покоящиеся клетки (сухая масса 2,3 мг). В ходе реакции 7 раз добавляли 3-цианпиридин (500 мМ) по мере израсходования предыдущей порции. Таким образом, в течение 15 ч было внесено 4,0 моль 3-цианпиридина, в результате образовывалось 3,89 моль (475 г/л) никотинамида,-7 009075 что соответствует выходу 97,3%. Никотиновая кислота не образовывалась. Пример 3. Идентификация микроорганизмов рода Amycolatopsis Идентификация основывалась на использовании следующих 5 хемотаксономических маркеров. 1. Диагностическая аминокислота пептидогликана: мезодиаминопимелиновая кислота. 2. Диагностические сахара: арабиноза и галактоза. 3. Миколовые кислоты: миколовые кислоты отсутствуют. 4. Менахинон: МК-9 (Н 4). 5. Спектр жирных кислот: изо/антеизоразветвленные и 2-гидроксижирные кислоты, кроме того, выявлены незначительные количества 10-метилразветвленных жирных кислот. Такой спектр жирных кислот обнаружен у всех представителей рода Amycolatopsis (спектр жирных кислот 3f). Комбинация этих химических признаков достаточна для обнаружения всех видов рода Amycolatopsis. Характеристики жирных кислот обеих культур сравнивали с информацией, находящейся в банке данных жирных кислот, с использованием анализа основных компонентов. С помощью этого метода оказалось возможным отнести как штамм NE31, так и штамм NA40 к роду Amycolatopsis, однако осуществить видовую идентификацию оказалось невозможным, так как коэффициент корреляции был слишком низким. Однако на основе сравнения спектра жирных кислот обоих штаммов было установлено, что они представляют собой два штамма, относящиеся к различным видам. Этот факт был подтвержден результатами анализа последовательности 16S-рДНК. В этом случае также была установлена принадлежность к роду Amycolatopsis, однако не была установлена принадлежность ни к одному из описанных видов рода Amycolatopsis. С помощью этого метода путем прямого секвенирования была определена последовательность 16S-рДНК, полученная в результате амплификации с использованием ПЦР гена 16S-рДНК. Диагностическую часть последовательности 16S-рДНК сравнивали с последовательностями типичных представителей видов рода Amycolatopsis и родственных таксонов. Результаты показали, что штамм принадлежит к роду Amycolatopsis. Было обнаружено наибольшее сходство с Amycolatopsis methanolica, составляющее для штамма NA40 96,9% и для штамма NE31 96,1%. Сходство последовательностей обоих штаммов между собой составляло 99,0%. Исследования заявителей, проведенные на представителях рода Amycolatopsis, свидетельствуют о том, что для надежной идентификации видов коэффициент корреляции должен быть выше 99,5%. Поскольку величина 96,9% существенно меньше 99,5%, то можно предположить, что оба изолята не относятся к представителям известных видов Amycolatopsis. На основе представленных результатов изоляты не могут быть отнесены к какому-либо из известных видов Amycolatopsis. Заявители исходили из того, что NA40 и NE31 представляют собой штаммы двух новых, до сих пор не описанных видов рода Amycolatopsis. Пример 4. Очистка нитрилгидратазы из микроорганизма штамма NA40 Штамм культивировали при 37 С в течение 3 дней в среде, состав которой приведен в табл. 3. Клетки 2-литровой культуры собирали центрифугированием и затем ресуспендировали в 0,85%-ном растворе NaCl. После этого клетки переносили в 0,1 М калий-фосфатный буфер (рН 7,0), содержащий 44 мМ н-масляную кислоту, и обрабатывали ультразвуком. Экстракт клеток центрифугировали и отделяли клеточный дебрис. Этот экстракт применяли для очистки фермента. На протяжении всей очистки применяли калий-фосфатный буфер (рН 7,0), содержащий 44 мМ нмасляную кислоту. Как видно из табл. 10, фермент после трех стадий очистки достигал гомогенного состояния. Таблица 10 Очистка нитрилгидратазы из штамма NA40 Примечание: 1 единица соответствует количеству фермента, которое катализирует образование никотинамида со скоростью 1 мкмоль/мин при 20 С. Пример 5. Изучение свойств нитрилгидратазы(1) Определение молекулярной массы, структуры субъединиц и содержания ионов кобальта С помощью хроматографии на колонках типа G3000 SW (0,7560 см) с TSK-гелем с использованием 0,1 М калий-фосфатного буфера (рН 7,0) с добавлением 0,2 М KСl и 44 мМ н-масляной кислоты было установлено, что молекулярная масса равна 106 кДа. Было обнаружено, что фермент состоит из 2 раз-8 009075 личных субъединици , молекулярные массы которых соответственно равны 30000 и 26000 Да. На фиг. 1 показана диаграмма определения молекулярной массы с помощью хроматографии на колонке G3000 SW с TSK-гелем. На фиг. 2 показана диаграмма определения молекулярной массы с помощью электрофореза в ДСНПААГ. На фиг. 3 показан спектр поглощения очищенного фермента. Была обнаружена широкая полоса поглощения при 300-400 нм.(2) Специфичность очищенного фермента в отношении субстрата Определение специфичности в отношении субстрата проводили аналогично примеру 2(1). Результаты представлены в табл. 11. Таблица 11 Специфичность очищенной нитрилгидратазы в отношении субстрата В реакционную смесь (2,0 мл) добавляли 1,7 единицы фермента. Реакционная смесь содержала соответствующий субстрат в 45 мМ фосфатном буфере (рН 7,0).(3) Определение значения KM Значение KM, которое определяли на основе диаграммы Lineweaver-Burk, для 3-цианпиридина составляет 41,7 мМ, а для акрилнитрила 3,7 мМ. Сравнение со штаммом Rhodococcus rhodochrous J1, у которого значение KM для 3-цианпиридина составляет 200 мМ, показывает, что данный параметр у штаммаNA40 имеет существенно меньшую величину. Это является одним из основных преимуществ штамма(4) Теплостойкость и температурный оптимум Очищенный фермент инкубировали при различных температурах в течение 30 мин при рН 7,0 и затем в течение 1 мин при 20 С оценивали превращение 3-цианпиридина в амид никотиновой кислоты. При температуре выше 40 С фермент терял активность. Теплостойкость, как и в случае покоящихся клеток, сохранялась приблизительно до 40 С, температурный оптимум находился в диапазоне от 35 до 40 С(5) рН-оптимум и рН-стабильность Для определения этих характеристик проводили реакцию превращения 3-цианпиридина в амид никотиновой кислоты при 20 С в реакционной смеси (2,0 мл), содержащей различные буферы (42,5 мМ),1,71 единицы очищенного фермента и 500 мМ 3-цианпиридин. рН-Оптимум составлял приблизительно 6,51,0 (фиг. 8). Для оценки рН-стабильности инкубировали 4,2 единицы очищенного фермента в течение 1 ч при 20 С в различных буферах (45 мМ). Часть инкубированного раствора (1,71 единицы) добавляли в стандартную реакционную смесь (ср. пример 2(1. Оценивали сохранившуюся активность. Фермент сохранял стабильность при значениях рН в диапазоне от 5 до 9. Результаты представлены на фиг. 9.(6) Ингибиторы Оценивали влияние различных ингибиторов. Результаты обобщены в табл. 12. Таблица 12 Влияние различных ингибиторов на активность очищенного фермента Пример 6. Влияние метанола на покоящиеся клетки штамма NA40 Реакцию проводили в течение 10 мин в присутствии различных концентраций (0-20 об.%) метанола в реакционных смесях, состав которых приведен в табл. 13. Как видно из табл. 14, активность повышается при добавлении 5-15% метанола. Таблица 13 Реакция с использованием покоящихся клеток Примечание:КФБ обозначает калий-фосфатный буфер. Таблица 14 Влияние метанола на активность штамма Amycolatopsis NA40 Пример 7. Накопление микроорганизмов рода Rhodococcus Различные образцы почвы вносили в обогатительную среду, состав которой приведен в табл. 1 и которая содержала в качестве источника углерода и азота циануксусную кислоту, и согласно методу,описанному в примере 1, выделяли микроорганизмы Rhodococcus GF270, GF578, GF473 и GF376. Пример 8. Биотрансформация с использованием микроорганизмов рода Rhodococcus(1) Теплостойкость микроорганизмов Rhodococcus GF674, Rhodococcus GF578, Rhodococcus GF270 и Rhodococcus GF376 по сравнению с Rhodococcus rhodochrous J1. Для определения теплостойкости перечисленные выше микроорганизмы культивировали в описанных ниже средах.MgSO47H2O и 15,0 мг СоСl26 Н 2O. Затем покоящиеся клетки инкубировали в течение 15 мин при различных температурах и после этого определяли сохранившуюся активность в стандартных реакционных условиях согласно примеру 2(1). При этом было установлено, что штамм Rhodococcus GF674 при температуре 50 С обладает относительной активностью, близкой к 100%, а при 60 С еще сохраняет приблизительно 10% активности. Штамм Rhodococcus GF578 при температуре 50 С также обладает относительной активностью, составляющей 100%, и обладает относительной активностью, составляющей 20% при 60 С. Штамм Rhodococcus GF376 обладает 100%-ной относительной активностью при температуре до 50 С, 70%-ной активностью при 60 С и при 70 С сохраняет еще приблизительно 5%-ную относительную активность. Rhodococcus GF270 обладает почти 100%-ной относительной активностью при температуре до 60 С и также еще сохраняет при 70 С 5%-ную относительную активность. В сравнении с этим штамм Rhodococcus rhodochrous J1 сохраняет до 50 С 100%-ную относительную активность, при 60 С имеет 80%-ную активность и при 70 С полностью теряет активность. Таким образом, можно утверждать, что штаммы Rhodococcus GF270 и GF376 обладают лучшей теплостойкостью по сравнению со штаммом J1, при этом штамм GF270 обладает наиболее высокой теплостойкостью.(2) Оптимальное значение рН для штаммов Rhodococcus Влияние значения рН на нитрилгидратазную активность штаммов Rhodococcus GF674, GF578,GF270 и GF376 определяли аналогично примеру 2(5). Оптимальное значение рН для штамма Rhodococcus GF674 составляет 7,5-9,5, для GF578 составляет 8-8,5, для GF270 составляет 6-7,0 и для GF376 составляет 6-8.(3) Специфичность штаммов Rhodococcus в отношении субстрата Данные о специфичности в отношении субстрата в виде значений относительной активности обобщены в табл. 15.(4) Накопление никотинамида штаммами Rhodococcus Штаммы Rhodococcus GF674, GF578, GF270 и GF376 культивировали аналогично примеру 2(6) с использованием в качестве субстрата 3-цианпиридина (приблизительно 500 мМ). При этом штамм(5) Толерантность активности штаммов Rhodococcus в отношении 3-цианпиридина Для изучения толерантности в отношении 3-цианпиридина покоящиеся клетки инкубировали в течение 15 мин при 20 С при концентрациях 3-цианпиридина в диапазоне от 1 до 10% (мас./об.), после чего клетки центрифугировали. После промывки клеток 0,85%-ным NaCl измеряли сохранившуюся активность. Толерантность в отношении 3-цианпиридина в качестве субстрата изучали при различных концентрациях субстрата. Было установлено, что при концентрации субстрата 2% (мас./об.) нитрилгидратазная активность штамма Rhodococcus rhodochrous J1 снижается в 1,4 раза, нитрилгидратазная активность штамма Rhodococcus GF674 снижается в 1,4 раза при концентрации субстрата 4% (мас./об.), нитрилгидратазная активность штамма Rhodococcus GF578 остается практически постоянной вплоть до концентрации субстрата 8%, нитрилгидратазная активность штамма Rhodococcus GF270 снижается в 1,7 раза при концентрации субстрата 4% (мас./об.) и нитрилгидратазная активность штамма Rhodococcus GF376 снижается в 1,25 раза при концентрации субстрата 10% (мас./об.). Штамм Rhodococcus rhodochrous J1 обладает наихудшей толерантностью в отношении 3 цианпиридина по сравнению с другими штаммами Rhodococcus. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Штамм микроорганизма Rhodococcus sp. GF270 DSM 12211, а также его функционально эквивалентные варианты и мутанты, способные превращать нитрил в амид. 2. Штамм микроорганизма Rhodococcus sp. GF376 DSM 12175, а также его функционально эквивалентные варианты и мутанты, способные превращать нитрил в амид. 3. Способ получения амидов, отличающийся тем, что нитрил, применяемый в качестве субстрата,превращают в соответствующий амид с помощью штаммов микроорганизма по п.1 или 2, или экстракта,содержащего нитрилгидратазу, полученного из указанного микроорганизма. 4. Способ по п.3, отличающийся тем, что в качестве нитрила используют необязательно замещенный алифатический нитрил, содержащий от 1 до 10 атомов углерода. 5. Способ по п.4, отличающийся тем, что в качестве нитрила используют необязательно замещенный алифатический нитрил, содержащий от 4 до 10 атомов углерода. 6. Способ по п.3, отличающийся тем, что в качестве нитрила используют ароматический нитрил,выбранный из соединений общих формул где R1 и R2 обозначают атом водорода, атом галогена или С 1-С 4 алкил. 7. Способ по любому из пп.3-6, отличающийся тем, что превращение осуществляют при температуре от 0 до 50 С и при значении рН от 4,5 до 10.
МПК / Метки
МПК: C12P 13/02, C12N 1/20, C12N 9/88
Метки: превращать, rhodococcus, амидов, амид, нитрил, получения, микроорганизма, штаммы, способ, способные
Код ссылки
<a href="https://eas.patents.su/18-9075-shtammy-mikroorganizma-rhodococcus-sposobnye-prevrashhat-nitril-v-amid-i-sposob-polucheniya-amidov.html" rel="bookmark" title="База патентов Евразийского Союза">Штаммы микроорганизма rhodococcus, способные превращать нитрил в амид, и способ получения амидов</a>
Предыдущий патент: Антагонистические антитела против htnfsf13b человека
Следующий патент: Пенообразующий ингредиент и продукты, содержащие такой ингредиент
Случайный патент: Выделение минералов меди из пирита с использованием аэрирования и метабисульфитной обработки