Рекомбинантные бактерии и их применение для получения этанола
Формула / Реферат
1. Рекомбинантная бактерия Deinococcus, продуцирующая этанол, которая содержит рекомбинантную нуклеотидную конструкцию, кодирующую пируватдекарбоксилазу (ПДК) и/или алкогольдегидрогеназу (АДГ), где ПДК- и АДГ-кодирующие последовательности помещены в оперон под контролем одиночного промотора в указанной конструкции и где указанная конструкция интегрирована в геном бактерии.
2. Бактерия по п.1, в которой ПДК- и АДГ-кодирующие последовательности происходят из Zymomonas.
3. Бактерия по любому из пп.1 и 2, которая имеет модифицированный геном, содержащий инактивированный ген лактатдегидрогеназы (ЛДГ).
4. Бактерия по любому из пп.1 и 2, в которой ген ЛДГ удален, полностью или частично, и не кодирует функциональный белок.
5. Бактерия по п.3, в которой ген ЛДГ инактивирован путем вставки рекомбинантной нуклеиновой кислоты, кодирующей указанную пируватдекарбоксилазу (ПДК) и алкогольдегидрогеназу (АДГ).
6. Бактерия по любому из предшествующих пунктов, которая выбрана из D. radiodurans, D. geothermalis, D. murrayi, D. cellulosilyticus или D. deserti.
7. Бактерия по любому из предшествующих пунктов, которая представляет собой термофильную бактерию Deinococcus.
8. Способ выработки этанола, включающий культивирование бактерии по любому из пп.1-7 в присутствии соответствующего субстрата, и сбор этанола.
9. Способ по п.8, в котором культивирование осуществляют при температуре около 40°С или выше.
10. Способ по п.8 или 9, в котором культивирование осуществляют в условиях с кислым значением рН.
11. Применение бактерии по любому из пп.1-7 для выработки этанола.
12. Применение по п.11 при температуре около 40°С или выше.
13. Применение по п.11 или 12, в котором бактерию используют в условиях с кислым значением рН.
14. Способ получения рекомбинантной бактерии по любому из пп.1-7, который включает
получение бактерии Deinococcus;
введение в выбранную бактерию нуклеотидной конструкции, кодирующей ПДК и/или АДГ, где ПДК- и АДГ-кодирующие последовательности помещены в оперон под контролем одиночного промотора в указанной рекомбинантной нуклеотидной конструкции и где указанную рекомбинантную нуклеотидную конструкцию интегрируют в геном бактерии.
15. Способ по п.14, который дополнительно включает обработку бактерии для инактивации гена ЛДГ и отбор бактерии, содержащей инактивированный ген ЛДГ.
Текст
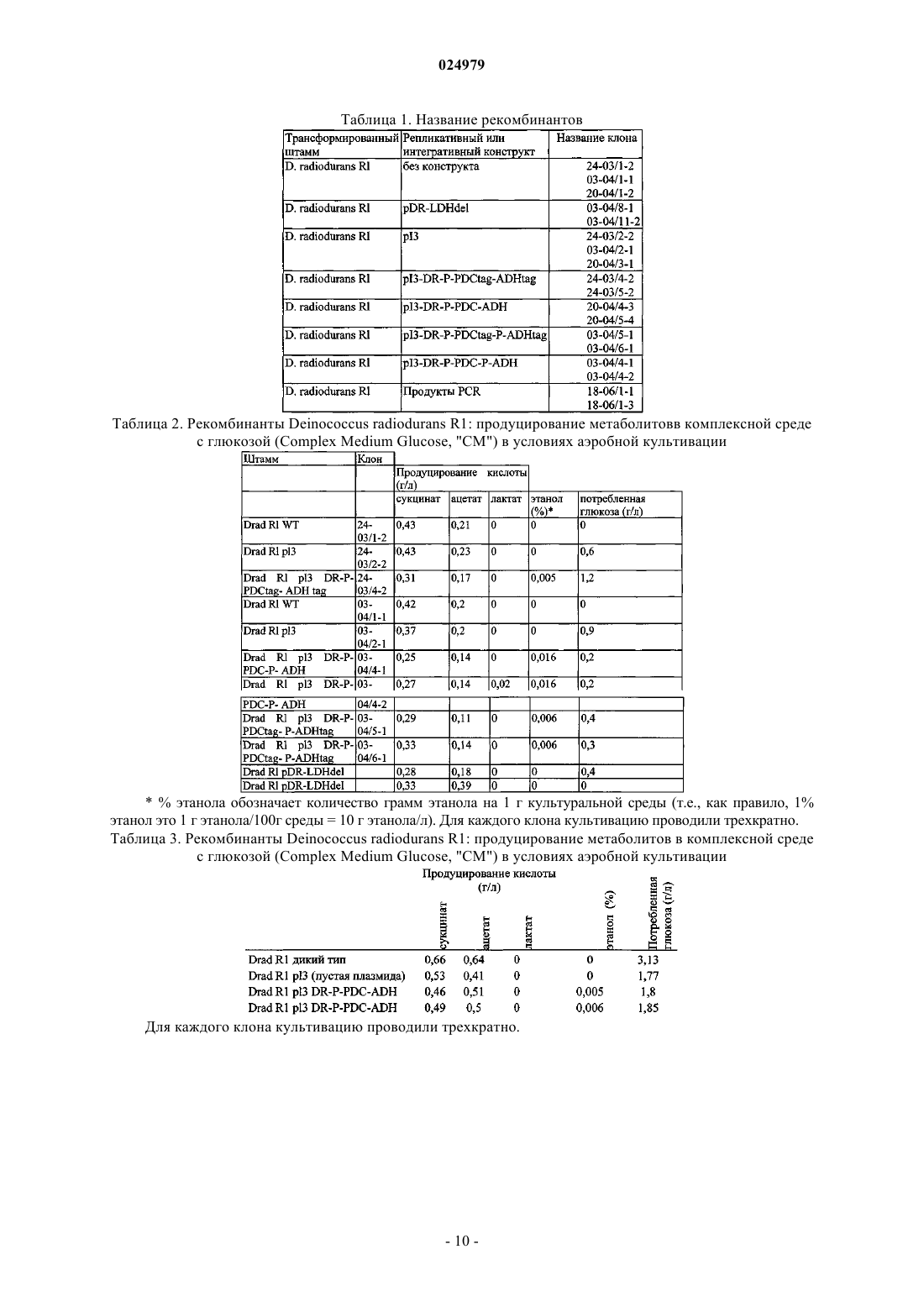
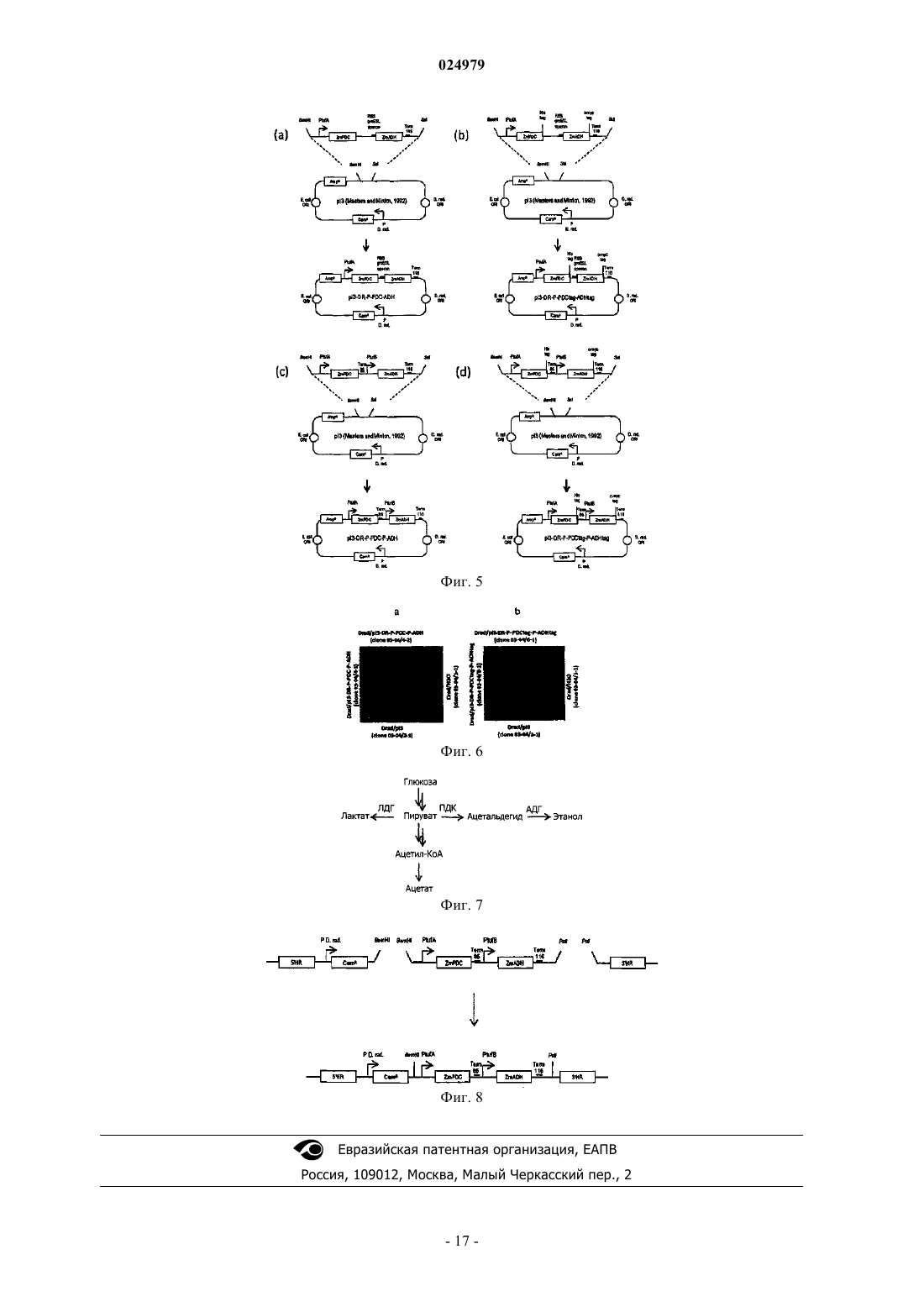
РЕКОМБИНАНТНЫЕ БАКТЕРИИ И ИХ ПРИМЕНЕНИЕ ДЛЯ ПОЛУЧЕНИЯ ЭТАНОЛА Изобретение относится к рекомбинантным бактериями и к их применению, в частности для получения этанола. Изобретение также относится к способам получения таких бактерий, а также к конструктам нуклеиновой кислоты, подходящим для такого получения. Изобретение в частности относится к бактериям, лишенным функционального гена ЛДГ и/или содержащим рекомбинантную нуклеиновую кислоту, кодирующую ПДК и АДГ. Бактерии по настоящему изобретению могут быть получены из любых стрессоустойчивых бактерий. 024979 Область техники Изобретение относится к рекомбинантным бактериями и к их применению, в частности для получения этанола. Изобретение также относится к способам получения таких бактерий, а также к конструктам нуклеиновой кислоты, подходящим для такого получения. Изобретение конкретно относится к бактериям, утратившим функциональный ген ЛДГ (LDH) и/или содержащим рекомбинантную нуклеиновую кислоту, кодирующую ПДК (PDC) или АДГ (ADH). Бактерии данного изобретения могут быть получены из любых стрессоустойчивых бактерий, особенно из штамма Deinococcus, включая экстремофильные штаммы, такие как, без ограничения перечисленным, D. radiodurans, D. geothermalis, D. murrayi, D. cellulosilyticus или D. deserti. Уровень техники В уровне техники имеются сообщения о бактериях, обладающих способностью собирать заново свои геномы, разрушенные стрессом, таких как бактерии Deinococcus. Deinococcus является грамположительной бактерией, которая была выделена в 1956 году Anderson и соавторами. Этот экстремофильный организм устойчив к разрушению ДНК УФ и ионизирующими излучениями или перекрестносшивающим агентом (митомицином С) и переносит высыхание. В WO 01/023526 продемонстрирована необычная устойчивость Deinococcus к излучению и дополнительно предложены генно-инженерные модификации и применение в биоремедиации. В патентной заявкеWO 2009/063079, не опубликованной до приоритетной даты настоящей заявки, показано, что бактерии Deinococcus могут противодействовать растворителям и могут трансформировать биомассу с образованием этанола. Другие стрессоустойчивые бактерии раскрыты в патентной заявкеEP 09305041.7, в настоящее время не опубликованной, а также раскрыты способы их выделения и/или отбора и их способность продуцировать метаболиты, такие как антибиотики. Генетически измененные грамположительные или штаммы Geobacillus были упомянуты в WO 95/27064 и WO 2006/131734. С промышленной точки зрения для этих штаммов не было раскрыто удовлетворительного продуцирования метаболитов. Более того, штаммы Geobacillus продуцируют споры,которые являются существенным недостатком для промышленного применения. Изобретение демонстрирует, что геном стрессоустойчивых бактерий, особенно геном бактерий Deinococcus, можно модифицировать для улучшения их способности продуцировать этанол. Более конкретно, настоящее изобретение демонстрирует, что можно модифицировать метаболические пути в стрессоустойчивых бактериях, конкретно в бактериях Deinococcus для повышения эффективности продуцирования ими этанола. Сущность изобретения Объектом настоящего изобретения является рекомбинантная стрессоустойчивая бактерия, конкретно бактерия Deinococcus, с модифицированным геном, содержащим инактивированный ген Lлактатдегидрогеназы (ЛДГ). В конкретном воплощении ген ЛДГ удален, полностью или частично и не кодирует функциональный фермент лактатдегидрогеназу. Рекомбинантная бактерия данного изобретения предпочтительно дополнительно содержит рекомбинантную молекулу кодирующую пируватдекарбоксилазу (ПДК) и/или алкогольдегидрогеназу (АДГ). В связи с этим дополнительным объектом изобретения является рекомбинантная стрессоустойчивая бактерия, конкретно бактерия Deinococcus, которая содержит рекомбинантную нуклеиновую кислоту,предпочтительно плазмиду, содержащую нуклеиновую кислоту, кодирующую пируватдекарбоксилазу и/или алкогольдегидрогеназу. Бактерия изобретения может быть выбрана из различных видов стрессоустойчивых бактерий, таких как Deinococcus, Tepidimonas, Truepera, Porphyrabacter, Novosphingobium или Exiguobacterium. Предпочтительными бактериями данного изобретения являются бактерии Deinococcus, такие как, без ограничения перечисленным, D. radiodurans, D. geothermalis, D murrayi, D. cellulosilyticus или D. deserti, предпочтительно термофильная бактерия Deinococcus. Дополнительный объект данного изобретения представляет собой способ получения биотоплива,особенно этанола, который включает культивирование определенной выше бактерии в присутствии соответствующего субстрата, и сбор биотоплива. Изобретение также относится к применению определенной выше бактерии для получения этанола. Изобретение также относится к способу получения рекомбинантной стрессоустойчивой бактерии,конкретно определенной выше бактерии Deinococcus, или ее предшественника, который включает обеспечение (родительской) стрессоустойчивой бактерии, конкретно бактерии Deinococcus; обработку бактерии для инактивации гена ЛДГ, и отбор бактерии, имеющей инактивированный ген ЛДГ. Изобретение также относится к способу получения рекомбинантной стрессоустойчивой бактерии,конкретно определенной выше бактерии Deinococcus или ее предшественника, который включает обеспечение (родительской) стрессоустойчивой бактерии, конкретно бактерии Deinococcus,введение в указанную бактерию молекулы рекомбинантной нуклеиновой кислоты, кодирующей-1 024979 ПДК и/или АДГ, и отбор бактерии, которая экспрессирует указанную нуклеиновую кислоту. Изобретение также относится к плазмидному конструкту, который реплицируется в бактерии Deinococcus и содержит нуклеиновую кислоту, кодирующую ПДК и/или АДГ. Перечень фигур Фиг. 1 - конструкция и структура интегрируемого конструкта pDR-LDHdel для частичной делеции ЛДГ. Вставку с гомологичными областями и кассетой хлорамфеникола синтезировали и клонировали вDeinococcus radiodurans; 5'HR, 5'-гомологичная область; 3'HR, 3'-гомологичная область; Е. coli ORI, точка начала репликации Escherichia coli; фиг. 2 - последовательности 5' (SEQ ID NO: 1) и 3' (SEQ ID NO: 2) гомологичных областей; фиг. 3 - способ конструирования мутантов Deinococcus radiodurans по L-лактатдегидрогеназе (locusDR2364) с помощью гомологичной рекомбинации. CamR, устойчивость к хлорамфениколу; AmpR, устойчивость к ампициллину; 5' HR, 5'-гомологичная область; 3' HR, 3'-гомологичная область; Е. coli ORI,точка начала репликации Escherichia coli; фиг. 4 - нуклеотидные последовательности генов ZmPDC (SEQ ID NO: 3) и ZmADH II (SEQ ID NO: 4); фиг. 5 - конструирование и структура плазмид pI3-DR-P-PDC-ADH (a), pI3-DR-P-PDCtag-ADHtag(b), pI3-DR-P-PDC-P-ADH (с) и pI3-DR-P-PDCtag-P-ADHtag (d), RBS groESL operon, участок связывания с рибосомой, расположенный выше оперона groESL Deinococcus radiodurans (Meima et al, 2001) ; AmpR,устойчивость к ампициллину; CamR, устойчивость к хлорамфениколу; Е. coli ORI, точка начала репликации Escherichia coli ; PtufA, 432 п.о., расположенные выше предсказанного старт-кодона начала трансляции гена tufA; PtufB, 234 п.о., расположенные выше предсказанного старт-кодона начала трансляции гена tufB; ZmPDC, ген пируватдекарбоксилазы Zymomonas mobilis; ZmADH, ген алкогольдегидрогеназы IIZymomonas mobilis; Term85, межгенная последовательность, расположенная между локусами DR1184 иDR1185, содержащая предполагаемый терминатор транскрипции; Term116, терминатор транскрипцииTerm116 (Lecointe et al, 2004); D. rad. ORI, точка начала репликации Deinococcus radiodurans; P D. rad.,промотор Deinococcus radiodurans; фиг. 6 - активность алкогольдегидрогеназы в D. radiodurans трансформированной pI3-DR-P-PDC-PADH (а) или pI3-DR-P-PDCtag-P-ADHtag (b); фиг. 7 - модернизированный метаболический путь; фиг. 8 - тройное лигирование продуктов ПЦР для создания мутанта ПДК+АДГ+ЛДГ. CamR, устойчивость к хлорамфениколу; PtufA, 432 п.о., расположенные выше предсказанного старт-кодона начала трансляции гена tufA; PtufB, 234 п.о., расположенные выше предсказанного старт-кодона начала трансляции гена tufB; ZmPDC, ген пируватдекарбоксилазы Zymomonas mobilis; ZmADH, ген алкогольдегидрогеназы II Zymomonas mobilis; Term85, межгенная последовательность, расположенная между локусамиDR1184 и DR1185, содержащая предполагаемый терминатор транскрипции; Term116, терминатор транскрипции Term116 (Lecointe et al, 2004); Р D. rad., предполагаемый промотор Deinococcusradiodurans; 5' HR, 5'-гомологичная область; 3' HR, 3'-гомологичная область. Табл. 1 - названия рекомбинантов, использованных для метаболического анализа. Табл. 2-5 - рекомбинанты Deinococcus: продуцирование метаболитов в комплексной среде или среде определнного состава. Подробное описание изобретения Изобретение относится к рекомбинатным стрессоустойчивым бактериями и к их применению для получения биотоплива и других метаболитов. В пределах контекста данного изобретения термин "стрессоустойчивая бактерия" означает более конкретно бактерию, обладающую способностью пересобирать свой геном, полностью или частично,при разрушении под действием стресса. Стресс может быть любым воздействием, разрушающим клетку и повреждающим ДНК, т.е. воздействием, которого достаточно для того, чтобы вызвать 90% или большую клеточную смерть в культуре бактерий Е. coli. Еще более предпочтительно, если воздействие, разрушающее клетку и повреждающее ДНК, является воздействием, достаточным для снижения бактериального титра в культуре Е. coli по меньшей мере на 2 логарифмические единицы. Примеры такого воздействия включают облучение, предпочтительно повторяющееся и непрерывное облучение УФ, и/или применение генотоксичных агентов. Предпочтительным стрессовой воздействием является воздействие УФ от 0,5 до 400 мДж/см 2, более предпочтительно от 1 до 200 мДж/см 2, как правило от 1 до 100 мДж/см 2,применяемое в течение периода времени от 5 с до 5 мин. Предпочтительным воздействием УФ является 4 мДж/см 2 в течение 30 с, которое может быть повторено в период времени от 1 до 8 ч, предпочтительно от 3 до 5 ч, а более предпочтительно около 4 ч. Конкретные стрессовые воздействия на клетки в соответствии с изобретением были описаны в неопубликованной патентной заявкеEP 09305041.7, которая включена в данный документ ссылкой. Устойчивые к клеточному стрессу бактерии в соответствии с настоящим изобретением включают более конкретно бактерии Deinococcus, Tepidimonas, Truepera, Porphyrabacter, Novosphingobium или Ex-2 024979iguobacterium. Предпочтительными бактериями данного изобретения являются бактерии Deinococcus,такие как, без ограничения перечисленным, D. radiodurans, D. geothermalis, D murrayi, D. cellulosilyticus или D. deserti, предпочтительно термофильная бактерия Deinococcus. Было показано, что бактерии Deinococcus обладают способностью пересобирать свой геном, полностью или частично, при разрушении под действием стресса. Как упомянуто выше, эти бактерии, особенно D. radiodurans, были предложены для биоремедиации. Способность бактерий Deinococcus производить продукты для биоэнергетики из биомассы раскрыта в WO 2009/063079, не опубликованной на момент приоритетной даты настоящего изобретения. Настоящее изобретение в настоящее время демонстрирует, что эффективность стрессоустойчивых бактерий, таких как бактерии Deinococcus, может быть улучшено модификацией метаболических путей с помощью рекомбинантных технологий. Более конкретно, изобретение обеспечивает новые рекомбинантные стрессоустойчивые бактерии, имеющие модифицированный путь биосинтеза этанола. В данном аспекте изобретатели разработали и создали новые биосинтетические пути в стрессоустойчивых штаммах бактерий, которые базируются на изменении пути конверсии пирувата. Более конкретно, авторы разработали новые рекомбинантные штаммы, в которых пируват эффективно используется в качестве субстрата для получения этанола. В связи с этим авторы вставили один или несколько ферментов (или соответствующих генов), которые вызывают или катализируют конверсию пирувата в этанол. Авторы также удалили эндогенный путь, который использует пируват для получения лактата,что, тем самым, увеличило количество пирувата, вовлеченного в путь синтеза этанола. Задача изобретения, таким образом, относится к (рекомбинантной или генетически модифицированной) стрессоустойчивой бактерии, конкретно к бактерии Deinococcus, которая содержит рекомбинантную нуклеиновую кислоту, кодирующую ПДК. Термин "рекомбинантная бактерия" обозначает бактерию, которая содержит модифицированный геном как результат или делеции и/или вставки гетерологичной (например, не присутствующего естественно в указанной бактерии) последовательности или молекулы нуклеиновой кислоты. "Рекомбинантная нуклеиновая кислота", следовательно, означает нуклеиновую кислоту, которая была сконструирована и которая не встречается в бактериях дикого типа. Другая задача изобретения, таким образом, относится к (рекомбинантной или генетически модифицированной) стрессоустойчивой бактерии, конкретно к бактерии Deinococcus, которая содержит рекомбинантную нуклеиновую кислоту, кодирующую АДГ. В дополнительном предпочтительно воплощении, изобретение относится к (рекомбинантной или генетически модифицированной) стрессоустойчивой бактерии, конкретно к бактерии Deinococcus, которая содержит рекомбинантную нуклеиновую кислоту, кодирующую ПДК и АДГ. Другая задача настоящего изобретения относится к (рекомбинантной или генетически модифицированной) стрессоустойчивой бактерии, конкретно к бактерии Deinococcus, которая имеет модифицированный геном, содержащий инактивированный ген лактатдегидрогеназы (ЛДГ). Наиболее предпочтительная задача данного изобретения заключается в (рекомбинатной или генетически модифицированной) стрессоустойчивой бактерии, конкретно бактерии Deinococcus, которая имеет модифицированный геном, содержащий инактивированный ген лактатдегидрогеназы (ЛДГ), а также указанная бактерия содержит рекомбинантную нуклеиновую кислоту, кодирующую ПДК и/или АДГ. Пируватдекарбоксилаза (ПДК, ЕС: 4.1.1.1) катализирует моноокислительное декарбоксилирование пирувата в ацетальдегид и диоксид углерода. Алкогольдегидрогеназа (АДГ, ЕС: 1.1.1.1) катализирует конверсию ацетальдегида в этанол. В целях создания или улучшения данного метаболического пути молекулу нуклеиновой кислоты,кодирующую ПДК и/или АДГ клонировали и успешно интродуцировали в стрессоустйчивую бактерию,конкретно в штамм Deinococcus. Термин нуклеиновая кислота предпочтительно обозначает ДНК, хотя рекомбинантная нуклеиновая кислота может быть РНК. В зависимости от ситуации, молекула нуклеиновой кислоты может быть двух- или одноцепочечной. Более конкретно, была получена молекула нуклеиновой кислоты, кодирующая функциональную ПДК. Такая молекула нуклеиновой кислоты может содержать всю или часть последовательности естественного или синтетического или мутантного гена ПДК, при условии, что молекула нуклеиновой кислоты кодирует белок, который катализирует моноокислительное окисление пирувата в ацетальдегид и диоксид углерода. ПДК присутствует в растениях, грибах и дрожжах, но является редкой в бактериях. ПДК не была найдена в геноме D. radiodurans, который был полностью секвенирован. Гены ПДК были выявлены во множестве штаммов, таких как Zymomonas mobilis (Brau and Sahm, 1986 ; Conway et al, 1987a ; Neale etAF354297) (Lowe and Zeikus, 1992) и Zymobacter palmae (Genbank: AF474145) (Raj et al, 2002). В предпочтительном воплощении нуклеиновая кислота ПДК содержит последовательность всего или части бактериального гена ПДК. В конкретном воплощении нуклеиновая кислота включает последовательность гена ПДК из Zymomonas mobilis (ZmPDC, ZMO 1360). Последовательность гена ZmPDC состоит из 1707 пар оснований и представлена на фиг. 4.-3 024979 Более того, для создания активности АДГ в стрессоустойчивых бактериях, таких как Deinococcus,была подготовлена молекула нуклеиновой кислоты, кодирующая функциональный АДГ. Такая молекула нуклеиновой кислоты может содержать всю или часть последовательности естественного или синтетического или мутантного гена АДГ при условии, что молекула нуклеиновой кислоты кодирует белок, который катализирует конверсию ацетальдегида в этанол. Гены АДГ были клонированы из различных организмов, включая, без ограничения перечисленным,Zymomonas mobilis (Ingram et al, 1987), Lactobacillus brevis (Liu et al, 2007) или Geobacillus stearothermophilus (Genbank: Z25544) (Talarico et al, 2005). Предполагаемый ген АДГ (DR2279) также был обнаружен в геноме D. radiodurans. Однако отдельная его экспрессия, по всей видимости, не дает эффективного продуцирования этанола. В предпочтительном воплощении нуклеиновая кислота АДГ содержит последовательность всего или части бактериального гена АДГ. В конкретном воплощении нуклеиновая кислота включает последовательность гена АДГ из Zymomonas mobilis (ZmADH, ZMO1596). ZmADH II состоит из 1152 пар оснований и его последовательность отображена на фиг. 4. Эти нуклеиновые кислоты дополнительно могут содержать регуляторные последовательности или области, такие как, к примеру, промотор (например, промотор tufB) и терминатор. Промотор может быть эндогенным по отношению к хозяину (например, промотор из гена Deinococcus для клонирования рекомбинантной нуклеиновой кислоты изобретения в штамме Deinococcus) или гетерологичным (например, другого происхождения, а именно, из другой бактерии, фага, синтетический или гибридный промотор и т.п.). Предпочтительными являются эндогенные промоторы. В связи с этим промоторы Deinococcus изучали и применяли для генной экспрессии. Примеры таких промоторов включают PtufA и PtufB из Tuгенов факторов элонгации трансляции tufA (DR0309) и tufB (DR2050), промотор гена resU, кодирующий предполагаемую резольвазу, расположенную в pI3, и промоторную область PgroESL оперона groESL(Lecointe et al, 2004; Meima et al., 2001). Нуклеиновые кислоты могут быть клонированы как отдельные сущности (например, в раздельных нуклеотидных конструктах) или в одном и том же конструкте под управлением различных промоторных областей или в опероне. Примеры, представленные в настоящей заявке, раскрывают создание новых конструктов где генZmPDC и ген алкогольдегидрогеназы II из Zymomonas mobilis (ZmADH) клонировали в одном и том же конструкте либо под управлением отдельных промоторов, либо в опероне. Эти конструкты с успехом были введены в штаммы Deinococcus, что в результате дало продуцирование этанола указанными рекомбинантными штаммами, тогда как немодифицированный (родительский) штамм не продуцировал какоелибо количество этанола в тестируемых условиях. Нуклеиновая(ые) кислота(ы) может быть вставлена в геном бактерии или вставлена в виде (автономно) реплицирующейся молекулы, например, в виде плазмиды, эписомы, искусственной хромосомы и т.п. В типичном воплощении рекомбинантная нуклеиновая(ые) кислота(ы) клонирована в подходящий вектор, который может быть репликативным в Deinococcus. Типичные плазмиды содержат в дополнение к клонированной вставке, селективный ген (например, устойчивости к антибиотику, краситель, и т.п.) и точку начала репликации, эффективную в Deinococcus или позволяющую интегрировать в геном Deinococcus. Плазмида (или рекомбинантные нуклеиновые кислоты) дополнительно может содержать регуляторные последовательности, такие как, например, промоторы, терминаторы и/или энхансеры. Примеры таких векторов включают pMD66, pI3, pRAD1 и pUE30. pMD66 является большим вектором (27 kb) для D. radiodurans и Е. coli, содержащим фрагмент pI3, длиной 12 тыс. п.о. (Daly et al, 1994).Radiodurans и Е. coli, содержащей минимальный репликон D. radiodurans (Meima and Lidstrom, 2000).pUE30 является эндогенной плазмидой, полученной из штамма D. radiopugnans, которая способна реплицироваться в Deinococcus (см. US2003/0175977). Конкретная задача настоящего изобретения заключается в плазмидном конструкте, который реплицируется в стрессоустойчивой бактерии, конкретно в бактерии Deinococcus, и содержит нуклеиновую кислоту, кодирующую ПДК и/или АДГ. ПДК и АДГ, кодируемые нуклеиновыми кислотами могут находиться в опероне или в виде различных экспрессирующих единиц в одной и той же плазмиде или в разных плазмидах. Предпочтительные плазмиды данного изобретения кодируют ПДК и/или АДГ из Zymomonas. Конкретными примерами плазмид данного изобретения являются pI3-DR-P-PDC-ADH, pI3-DR-PPDCtag-ADHtag, pI3-P-PDC-P-ADH и pI3-DR-P-PDCtag-P-ADHtag. Рекомбинантная нуклеиновая кислота также может быть клонирована в интегрируемую кассету,подходящую для интеграции в геном бактерии Deinococcus. Такая интегрируемая кассета содержит, как правило, рекомбинантную нуклеиновую кислоту, связанную (или фланкированную) одной или несколькими последовательностями, позволяющими интеграцию, предпочтительно сайт-направленную интеграцию. Такие последовательности могут быть, например, нуклеотидными последовательностями, гомологичными целевой области генома, что делает возможным интеграцию кроссинговером. В связи с этим конкретная бактерия изобретения содержит рекомбинантую нуклеиновую кислоту, кодирующую ПДК и/или АДГ интегрированную в геном, вместо всего или части эндогенного гена, кодирующего ЛДГ. В-4 024979 данном контексте термин "часть гена ЛДГ" означает любой сегмент гена, делеция которого достаточна для того, чтобы вызвать инактивацию гена в клетке. Различные методы могут быть использованы для вставки рекомбинантной(ых) молекулы(ул) нуклеиновой кислоты в стрессоустойчивые бактерии, конкретно в Deinococcus. В частности, они могут быть вставлены естественной трансформацией (которая может быть дополнительно усилена в присутствии хлорида натрия) или электропорацией. В связи с этим изобретение также относится к способу получения рекомбинантной стрессоустойчивой бактерии, конкретно определенной выше бактерии Deinococcus или ее предшественника, который включает обеспечение (родительской) стрессоустойчивой бактерии, конкретно бактерии Deinococcus,введение в указанную бактерию молекулы рекомбинантной нуклеиновой кислоты, кодирующей ПДК и/или АДГ, и отбор бактерии, которая экспрессирует указанную нуклеиновую кислоту. Рекомбинанты, содержащие вставки нуклеиновых кислот, могут быть отобраны в соответствии с известными методами, такими как устойчивость к антибиотикам. Экспрессия соответствующих ПДК или АДГ может быть подтверждена количественной ПЦР, а продуцирование этих ферментов может быть подтверждено с помощью вестерн-блоттинг-анализа или с помощью ферментативных анализов, известных в данной области. Активность ПДК может быть измерена путем анализа восстановления NAD+, а активность АДГ может быть измерена путем анализа восстановления NAD+ или окисления NADH, вследствие активности этих ферментов (Conway et al, 1987a и b). Как описано в примерах, были получены бактерии Deinococcus, содержащие рекомбинантную нуклеиновую кислоту, кодирующую ПДК и АДГ. Эти бактерии, которые можно культивировать, жизнеспособны и стабильно содержат рекомбинантную нуклеиновую кислоту. Стабильность рекомбинантов предпочтительно является такой, что после 2 циклов роста более чем 95% трансформированных бактерий все еще содержат вектор. Результаты демонстрируют, что геномная вставка ПДК и АДГ стабильна даже после 2 циклов роста. Эти бактерии продуцируют этанол и объединяют множество преимуществ в плане специфичности субстрата, условий культивирования и продуцирования метаболитов. Кроме того, с целью дополнительного улучшения получения этанола, также были получены стрессоустойчивые бактерии, конкретно Deinococcus, в которых ген лактатдегидрогеназы становился неактивным. Ген ЛДГ (лактатдегидрогеназы) вовлечен в превращение пирувата в лактат. Ген ЛДГ D. radiodurans клонировали в 1996 Narumi и Watanabe. Этот фермент представляет собой тетрамер, и его кристаллографическая структура была получена (Coquelle et al., 2007). Авторы изобретения в настоящее время создали новую бактерию, в которой указанный фермент неактивен. В конкретном воплощении ген ЛДГ делетирован полностью или частично и не кодирует функциональный белок. Ген ЛДГ может быть инактивирован в указанной бактерии или в ее предшественнике путем гомологичной рекомбинации, заменой гена или направленным мутагенезом или с помощью любого другого метода, известного в данной области. В предпочтительном воплощении ген ЛДГ инактивирован путем делеции по меньшей мере части указанного гена, который может быть заменен гетерологичной нуклеиновой кислотой (например, селективным маркером). Ген ЛДГ состоит из 915 пар оснований. Он локализован между координатами 2362890 и 2363804 в геноме Deinococcus. Последовательность указанного гена доступна, например, под номеромgeneSeql799712. В предпочтительном воплощении бактерия по настоящему изобретению лишена указанного гена, предпочтительно, по меньшей мере, лишена его 100 последовательно расположенных нуклеотидов, более предпочтительно по меньшей мере 200, 300, 400 или 500. В примерах был получен дефектный штамм Deinococcus, который лишен 589 последовательно расположенных нуклеотидов гена ЛДГ. Этот штамм был получен путем двойного кроссинговера с использованием конкретного конструкта, содержащего маркерный ген, фланкированный двумя участками, гомологичными областям гена ЛДГ и (необязательно) областям участков, фланкирующих ген ЛДГ (см. фиг. 3). Типичные гомологичные участки должны быть достаточно длинными для того, чтобы была возможность гибридизации и кроссинговера,например, выше 200 нуклеотидов, предпочтительно более 300 нуклеотидов, как правило от 300 до 700. Такие конструкты представляют собой конкретную задачу настоящего изобретения (см. фиг. 1 и 2). В этом отношении изобретение также относится к способу получения рекомбинантной стрессоустойчивой бактерии, конкретно определенной выше бактерии Deinococcus или ее предшественника,который включает обеспечение (родительской) стрессоустойчивой бактерии, конкретно бактерии Deinococcus; обработку бактерии для инактивации гена ЛДГ, и отбор бактерии, имеющей инактивированный ген ЛДГ. Бактерию по настоящему изобретению можно культивировать и/или поддерживать в любой подходящей культуральной среде и в любом подходящем устройстве. Примеры такой среды включают ком-5 024979 плексную среду с глюкозой или среду определенного состава, как описано в примерах, такую как, например, среду определенного состава с сахарозой, среду определенного состава с крахмалом. Подходящая среда также является коммерчески доступной. Дополнительная задача настоящего изобретения относится к применению определенной выше бактерии при получении этанола или других метаболитов. Изобретение также относится к способу получения биотоплива, конкретно этанола, причем способ включает культивацию определенной выше бактерии в присутствии соответствующего субстрата и сбор биотоплива. Субстрат может представлять собой любую культуральную среду или различные типы биомассы или продукты, полученные из нее. В частности, биотопливо может быть получено из возобновляемых источников, особенно из растительной или животной биомассы, или из коммунально-бытовых и промышленных отходов. Термин биотопливо согласно изобретению включает "биотопливо первого поколения" и/или "биотопливо второго поколения". Биотоплива первого поколения получают из растительного и животного органического материала, предпочтительно из сахара, крахмала, растительного масла или из животных жиров. Главным источником для получения биотоплива первого поколения являются пищевые растения или их части. Биотопливо первого поколения включает растительное масло, биодизель, биоспирты, биогаз, синтетический газ и твердое биотопливо. Биоспирты включают этанол, пропанол и бутанол. Биотопливо второго поколения получают предпочтительно из непищевых растений или из непищевых частей растений. Они включают непищевые зерновые культуры, отходы биомассы, стебли пшеницы,кукурузы и древесину. Более предпочтительно, если способ по изобретению используется для получения этанола. Способ по изобретению может быть осуществлен в реакторе для конверсии. Под термином "реактор" понимается соответствующий ферментационный чан или любое устройство или система для конверсии биомассы, специально разработанный для осуществления изобретения и, таким образом, в частности состоящий из биореакторов, биофильтров, дисковых биофильтров, и других газофазных и/или жидкофазных биореакторов, особенно таких, которые адаптированы для обработки биомассы или производных биомассы. Устройство, которое можно использовать в соответствствии с изобретением, может быть устройством непрерывной использования или устройством периодической загрузки. В реакторе для осуществления способа по изобретению используется по меньшей мере одна бактерия по изобретению или бактериальный экстракт из нее, в то время как указанный реактор монтируется и оборудуется так, чтобы в нем были установлены и поддерживались такие физико-химические условия, при которых указанная бактерия является функциональной для обсуждаемого применения и при которых, необязательно был возможен бактериальный рост и предпочтительно возможно его стимулирование. Способ может осуществляться в аэробных условиях, анаэробных или в микроаэробных условиях в зависимости от субстрата и бактерии. Преимущество изобретения относится к способности бактерий по изобретению противостоять стрессовым условиям, включающим присутствие этанола в культуральной среде. Способ по изобретению таким образом может осуществляться при температуре около 40 С или выше, конкретно при температуре в интервале 40-70 С; в условиях кислого рН, и/или в присутствии этанола. Дополнительные аспекты и преимущества изобретения будут описаны в следующих примерах, которые следует рассматривать в качестве наглядных и которые не ограничивают объем притязаний данной заявки. Сведения, подтверждающие возможность осуществления изобретения. Материалы и методы. Бактериальные штаммы и условия роста. Штаммы Escherichia coli (E. coli) SCS110, JM109 или DH5 использовали для размножения плазмид. Их культивировали при 37 С и 200 об./мин в среде Luria-Bertani (LB) (на один литр: Триптон 10 г,дрожжевой экстракт 5 г, хлорид натрия 10 г). Твердую среду получали путем добавления агара 1,5%.PGY. Состав среды TGY представлен ниже, на один литр: триптон (5 г), дрожжевой экстракт (1,5 г) и глюкоза (1 г). Состав твердой среды на один литр: триптон (5 г), дрожжевой экстракт (2,5 г), глюкоза (1 г) и агар (15 г). Состав среды PGY представлен ниже, на один литр: пептон (10 г), дрожжевой экстракт (5 г) и глюкоза (1 г). Состав твердой среды на один литр: пептон (10 г), дрожжевой экстракт (5 г), глюкоза(1 г) и агар (15 г). В среду LB или TGY добавляли, при необходимости, соответствующие антибиотики (хлорамфеникол в конечной концентрации 3 мкг/мл для трансформантов D. radiodurans или ампициллин 100 мкг/мл для трансформантов Е. coli). Трансформация. Трансформацию Е. coli проводили с использованием коммерческих компетентных клеток SCS110 от "Stratagene" или JM109 от "Promega". Для получения компетентных клеток D. radiodurans свежую культуру в стационарной фазе разводили в 100 раз в 50 мл TGY. Клетки выращивали до достижения ранней экспоненциальной фазы(OD600 нм=0,3); осадок ресуспендировали в соответствующем объеме ледяного раствора 2TGY/10% об./об. Глицерин /30 мМ CaCl2. Для трансформации целевое количество плазмидной ДНК добавляли к 100 мкл клеток. Смесь инкубировали 30 мин на льду перед тем, как переносить пробирки при 30 С. Через 90 мин инкубации при 30 С, к клеткам добавляли 900 мкл предварительно нагретой 2TGY. Трансформанты встряхивали при 200 об./мин и при 30 С в течение 20 ч. Их последовательно разводили и рассевали на соответствующие неселективные или селективные чашки с TGY. Манипуляции с ДНК.LITMUS28i от "New England Biolabs". Минипрепаративное выделение плазмид из клеток Е. coli проводили с помощью набора реактивов системы очистки ДНК "WizardPlus SV minipreps" от "Promega", a выделение средних масштабов проводили с использованием набора реактивов для очистки плазмидной ДНК "NucleoBond Xtra Midi Plus EF" от"Macherey-Nagel". Эти выделения осуществляли из 3-100 мл культуры Е. coli в стационарной фазе. Для выделения плазмид из D. radiodurans 50 мл клеток в стационарной фазе ресуспендировали в 0,5 М ЭДТА и в 0,5 М ЭДТА, насыщенном бутанолом. Через 15 мин инкубации при комнатной температуре осадок ресуспендировали в 0,5 М ЭДТА и клетки помещали на 30 мин при 70 С. Осадок промывали дважды буфером для лизоцима (10 мМ Tris HCl, 5 мМ ЭДТА, 0,5 М NaCl) перед добавлением лизоцима в концентрации 5 мг/мл (в буфере для лизоцима). Образец инкубировали в течение 30 мин при 37 С перед добавлением РНКазы и протеиназы К. Смесь инкубировали в течение 1 ч при 56 С. Затем добавляли 200 мМ NaOH к образцу, который переворачивали несколько раз для перемешивания; добавляли 3 М ацетат калия к образцу, который переворачивали для перемешивания; смесь инкубировали в течение 10 мин на льду перед добавлением к надосадочной жидкости этанола; эту смесь инкубировали в течение 10 мин на льду и осадок промывали 70% этанолом. Высушенный осадок ДНК ресуспендировали в воде. Проводили экстракцию геномной ДНК из D. radiodurans с помощью коммерческого набора реактивов "DNeasy Blood and Tissue" от "Qiagen". Эти выделения осуществляли из 5 мл культур в стационарной фазе. Олигонуклеотиды были синтезированы "Eurogentec". Полимеразы, использованные для амплификации ПЦР, представляли собой ДНК-полимеразу "DyNAzyme EXT" от "Finnzymes" или фермент "Extensor Hi-Fidelity PCR Enzyme" от "Thermo Scientific". ПЦР-фрагменты очищали с помощью геля "WizardSV Gel" и системы очистки ПЦР-продуктов "PCR Clean-Up System" от "Promega". Т 4 ДНК-лигазу (New England Biolabs) применяли для лигирования ДНК. Плазмидную ДНК или ПЦР-продукты гидролизовали ферментами рестрикции от "New EnglandBiolabs". Генетический материал (ПЦР-продукты или продукты гидролиза) разделяли электрофорезом в агарозном геле. ДНК оценивали количественно с помощью "Biophotometer" от "Eppendorf". Синтезированные "Genecust Europe" ДНК-вставки клонировали в соответствующий вектор. Тест на активность алкогольдегидрогеназы. 4 мл парарозанилина (Sigma) в концентрации 2,5 мг/мл в абсолютном этаноле добавляли к 200 млLB-arapa, содержащего 50 мг бисульфита натрия (Conway et al, 1987b). 2-суточные клетки D. radiodurans,выращенные на чашках с TGY-агаром (с добавлением, при необходимости, соответствующего антибиотика), рассевали на индикаторные чашки и инкубировали при 37 С в течение 2-3 ч. Продуцирование метаболитов. Этот метод дает возможность оценить способность генетически модифицированных микроорганизмов продуцировать представляющие интерес метаболиты из биомассы или из производного биомассы. Тест проводили при 30 С. Предварительные культуры (в стационарной фазе), полученные в комплексной среде с глюкозой(Complex medium Glucose), высевали в 6 мл обогащенной среды (высевали с плотностью 1% об./об.). Проверенными обогащенными культуральными средами являются комплексная среда с глюкозой(Complex Medium Glucose), среда определенного состава с сахарозой (Defined Medium Sucrose), среда определенного состава с крахмалом (Defined Medium Starch). Комплексная среда с глюкозой содержит: пептон 2 г/л, дрожжевой экстракт 5 г/л и глюкозу 10 г/л в осмозированной воде: раствор стерилизовали автоклавированием (15 мин при 120 С). К этому раствору добавляли следующие растворы: буферный раствор MOPS (10) рН 7 [кислый MOPS 400 мМ, NH4Cl 200 мМ, NaOH 100 мМ, КОН 100 мМ, CaCl2 5 мМ, Na2SO4 2,76 мМ, MgCl2 5,28 мМ]; микроэлементыFeCl3 (100) 2 мМ в C6H5Na3O7 20 мМ; K2HPO4 1 г/л: растворы стерилизовали фильтрацией (0,2 мкм). Среда с определенным составом содержит: источник углерода 10 г/л в осмозированной воде: раствор стерилизовали автоклавированием (15 мин при 120 С). К этому раствору добавляли следующие растворы. Буферный раствор MOPS (10) рН 7 [кислый MOPS 400 мМ, NHCl 200 мМ, NaOH 100 мМ, КОН 100 мМ, CaCl2 5 мМ, Na2SO4 2,76 мМ, MgCl2 5,28 мМ]; микроэлементы (10000 Х) [(NH4)6(Mo7)24 300 мМ,Н 3 ВО 3 4 мМ, CoCl2 0,3 мМ, CuSO4 ОД мМ, MnCl2 2,5 мМ, ZnSO4 0,1 мМ]; FeCl3 (100) 2 мМ в C6H5Na3O7-7 024979 20 мМ; K2HPO4 1 г/л: растворы стерилизовали фильтрацией (0,2 мкм). К этим культуральным средам за исключением сред для штаммов дикого типа перед рассеванием добавляли хлорамфеникол: 3 мкг/мл культуральной среды. Культуры вели как в аэробных, так и в анаэробных условиях (Biomerieux, Genbag). Культуры в аэробных условиях оставляли в инкубаторе при 30 С при перемешивании в течение 7 дней. Затем культуры центрифугировали в течение 10 мин при 4000 об./мин. Надосадочные жидкости фильтровали (0,2 мкм), переливали в другие пробирки и помещали на -80 С. Культуры в анаэробных условиях оставляли в инкубаторе при 30 С в течение 4 недель. Культуры затем центрифугировали в течение 10 мин при 4000 об./мин. Надосадочные жидкости фильтровали (0,2 мкм), переливали в другие пробирки и помещали на -80 С. Газовая хроматография с пламенно-ионизационным детектором (Gas Chromatography FID analysis)(Varian CP-WAX 57 CB колонка 25 м 0,32 мм) использовали для количественной оценки спиртов. Органические кислоты оценивали количественно с помощью капиллярного электрофореза (5 мМ 2,6 пиридиндикарбоновая кислота 0,5 мМ, цетилтриметиламмоний бромид; буферы с регуляцией рН до 5,6/61 см длина, 50 мкм диаметр капилляра "Agilent"). Остаточную глюкозу оценивали количественно с помощью ВЭЖХ, совмещенной с рефрактометрией (Phenomenex LUNA 3 мкм NH2 100A колонка 1504,6 мм, подвижная фаза ацетонитрил/Н 2 О 85:15). Пример 1. Делеционные мутанты Deinococcus radiodurans R1 по L-лактатдегидрогеназе (ЛДГ). ЛДГ-Мутанты из Deinococcus radiodurans R1 (D. radiodurans) дикого типа получали следующим образом. а. Конструкт для делеции ЛДГ (pDR-LDHdel). Заявители создали новый конструкт, названный pDR-LDHdel, для частичной делеции гена ЛДГ(DR2364) в диком типе D. radiodurans (см. фиг. 1). Для этого заявители использовали каркас плазмидыLITMUS28i, которая реплицируется в Е. coli, но не реплицируется в D. radiodurans. Синтезированную ДНК-вставку клонировали в LITMUS28i; эту вставку получали из кассеты, содержащей ген устойчивости к хлорамфениколу (CamR) (1344 нуклеотида) и из 5'- и 3'-фланкирующих гомологичных участков(фиг. 2). Конструкт pDR-LDHdel получали путем замены 589 нуклеотидов гена ЛДГ (некоторые из этих 589 нуклеотидов кодируют остатки, вовлеченные в катализ) на кассету CamR.D. radiodurans дикого типа трансформировали плазмидой pDR-LDHdel согласно процедуре, описанной в материалах и методах, для создания нокаутных мутантов. Трансформанты отбирали на среде TGY с добавлением хлорамфеникола. Замену части гена ЛДГ на кассету с геном устойчивости к хлорамфениколу (фиг. 3) контролировали ПЦР с соответствующими праймерами, которые отжигаются на участке кассеты с геном устойчивости к хлорамфениколу. Два клона с двойным кроссинговером, названных 03-04/8-1 и 03-04/11-2, отбирали для анализа метаболитов (табл. 1). При гомологичной рекомбинации полученная в результате бактерия содержала делецию из 589 нуклеотидов, которые были заменены на кассету CamR. Геномные участки 03-04/8-1 и 03-04/11-2, бывшие частью гена ЛДГ, замененной на кассету CamR, были частично секвенированы. Пример 2. Продуцирование пируватдекарбоксилазы и алкогольдегдрогеназы в D. Radiodurans. Штаммы D. radiodurans, продуцирующие пируватдекарбоксилазу (ZmPDC) и алкогольдегидрогеназу (ZmADH) из Zymomonas mobilis, создавали следующим образом. а. Создание конструктов, несущих гены, ответственные за продуцирование этанола. Было создано четыре конструкта для продуцирования этанола в клетках D. radiodurans (см. фиг. 2). Для первого конструкта под названием pI3-DR-P-PDC-ADH ген пируватдекарбоксилазы (ZmPDC,ZMO1360) и ген алкогольдегидрогеназы II (ZmADH, ZMO1596) из Zymomonas mobilis subsp. MobilisZM4 (фиг. 4) помещали в оперон и клонировали по сайтам BamHI и SaiI репликативной в D. radiodurans плазмиды pI3 (Masters and Minton, 1992) (см. фиг. 5). Вектор pI3 придает устойчивость к хлорамфениколу в D. radiodurans. Участок из 432 пар оснований, расположенный выше старт-кодона начала трансляции фактора элонгации TU tufA (DR0309) и содержащий промоторную активность (Lecointe et al, 2004),помещали перед опероном ZmPDC-ADH. Между генами ZmPDC и ZmADH присутствует спейсер в виде рибосомной связывающей последовательности (RBS) из оперона groESL D. radiodurans (Meima et al,2001), помещенного перед кодоном инициации трансляции ZmADH. Терминатор транскрипции Term116D. radiodurans (Lecointe et al, 2004) помещали в 3'-области по отношению к гену ZmADH. Создавали второй конструкт, полученный из pI3-DR-P-PDC-ADH, который назвали pI3-DR-P-PDCtag-ADHtag. В этом конструкте his-фрагмент (6 гистидинов) помещали в С-конец ZmPDC и c-myc-фрагмент (EQKLISEEDL) помещали в С-конец ZmADH (фиг. 5). Для конструкта pI3-DR-P-PDC-P-ADH участок, содержащий предполагаемый терминатор транскрипции, названный Term85, помещали ниже гена ZmPDC, a 234 нуклеотида, расположенные выше старт-кодона начала трансляции фактора элонгации TU tufB (DR 2050) (который соответствует промо-8 024979 торному участку tufB, Lecointe et al, 2004), помещали между Term85 и геном ZmADH (фиг. 5). Последний конструкт получали из pI3-P-PDC-P-ADH и давали название pI3-DR-P-PDCtag-P-ADHtag; в этом векторе, his-фрагмент (6 гистидинов) помещали в С-конец гена ZmPDC и с-тус-фрагмент (EQKLISEEDL) помещали в С-конец гена ZmADH (фиг. 5).ZmPDC и ZmADH. Трансформанты отбирали по устойчивости к хлорамфениколу. Присутствие плазмиды контролировали амплификацией ПЦР со специфичными праймерами или с помощью ферментативного гидролиза конструкта, выделенного из клонов D. radiodurans. Для каждого из 4 конструктов по два клона использовали для метаболических исследований (табл. 1). Пример 3. Создание интегративных ЛДГ-мутантов Deinococcus radiodurans, продуцирующихZmPDC и ZmADH. 589 нуклеотидов гена ЛДГ (DR2364) заменяли в клетках D. radiodurans дикого типа на кассету с геном устойчивости к хлорамфениколу, за которой следуют гены ZmPDC и ZmADH, соответственно, под контролем промоторов PtufA и PtufB. С целью создания данного мутанта ПДК+ЛДГ+ЛДГ- 3 следующие нуклеотидные последовательности амплифицировали с помощью ПЦР 5'-фланкирующую гомологичную область, за которой следует кассета с геном устойчивости к хлорамфениколу, амплифицировали с помощью праймеров EG31F и EG32R (см. список ниже) с использованием pDR-LDHdel в качестве матрицы. Последовательность P-PDC-P-ADH амплифицировали с помощью праймеров EG33F и EG34R (см. список ниже) с использованием pI3-P-PDC-P-ADH в качестве матрицы 3'-фланкирующую гомологичную область амплифицировали с помощью праймеров EG35F и EG36R (см. список ниже) с использованием Продукт лигирования этих трех ампликонов использовали для трансформации D. radiodurans для получения мутанта ПДК+АДГ+ЛДГ- (фиг. 8). Трансформанты отбирали по устойчивости к хлорамфениколу. Частично делетированный ген ЛДГ, геномную вставку гена устойчивости к хлорамфенколу и геныZmPDC и ZmADH контролировали с помощью ПЦР с использованием соответствующих праймеров. Два клона с двойным кроссинговером, названные 18-06/1-1 и 18-06/1-3, отобрали для анализа метаболитов(табл. 1 и 4). Пример 4. Рекомбинанты Deinococcus radiodurans R1. Активность алкогольдегидрогеназы. Продуцирование альдегида и активность АДГ с помощью колориметрического теста согласно Conway и соавторам (1987b) заявители определяли в различных рекомбинантах, трансформированных плазмидами, содержащими гены ZmPDC и ZmADH. Этот тест основан на образовании фиолетового основания Шиффа после взаимодействия ацетальдегида, продуцируемого АДГ из этанола, и лейкокрасителя. Как показано на фиг. 6, рекомбинанты по настоящему изобретению окрашивались в фиолетовый цвет через 2-3 ч инкубации при 37 С на чашках с LB-агаром с добавлением этанола, парарозанилина и бисульфита натрия. Это окрашивание демонстрирует активность АДГ в каждом клоне рекомбинантнов,трансформированных плазмидой pI3-DR-P-PDC-P-ADH или pI3-DR-P-PDCtag-P-ADHtag. В этих рекомбинантах транскрипция гена ZmADH контролировалась промотором tufB. Пример 5. Рекомбинанты Deinococcus radiodurans R1: продуцирование метаболитов. Анализировали метаболиты, продуцируемые рекомбинантами по изобретению. Заявители смогли детектировать изменение в метаболитах, продуцируемых рекомбинантами по настоящему изобретению (например, клонами 24-03/4-2, 03-04/4-1, 03-04/4-2), по сравнению с дикими типом или с контрольным рекомбинантом, трансформированным пустым вектором pI3 (см. табл. 2-5). В частности, обнаружили продуцирование этанола при различных условиях культивации, в то время как родительский штамм не продуцирует этанол. Таблица 2. Рекомбинанты Deinococcus radiodurans R1: продуцирование метаболитовв комплексной среде с глюкозой (Complex Medium Glucose, "CM") в условиях аэробной культивации% этанола обозначает количество грамм этанола на 1 г культуральной среды (т.е., как правило, 1% этанол это 1 г этанола/100 г среды = 10 г этанола/л). Для каждого клона культивацию проводили трехкратно. Таблица 3. Рекомбинанты Deinococcus radiodurans R1: продуцирование метаболитов в комплексной среде с глюкозой (Complex Medium Glucose, "CM") в условиях аэробной культивации Для каждого клона культивацию проводили трехкратно. Таблица 5. Рекомбинанты Deinococcus radiodurans R1: продуцирование метаболитов в среде определенного состава с сахарозой (Defined Medium Sucrose, "DM") в условиях аэробной культивации Данные результаты демонстрируют, что продуцирование этанола может быть индуцировано или увеличено в стрессоустойчивых бактериях путем создания новых метаболических путей. Результаты дополнительно демонстрируют, что дефектные по ЛДГ штаммы являются жизнеспособными и что инактивация этого гена дополнительно увеличивает продуцирование этанола в бактериях по изобретению. Кроме того, результаты демонстрируют, что штаммы могут использовать различные типы субстратов и могут расти в различных типах культуральных сред, продуцируя этанол. Рекомбинантные штаммы по настоящему изобретению, таким образом, объединяют преимущества стрессоустойчивости, условий культивации, приемлемости субстрата и продуцирования метаболита. Список литературы ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Рекомбинантная бактерия Deinococcus, продуцирующая этанол, которая содержит рекомбинантную нуклеотидную конструкцию, кодирующую пируватдекарбоксилазу (ПДК) и/или алкогольдегидрогеназу(АДГ), где ПДК- и АДГ-кодирующие последовательности помещены в оперон под контролем одиночного промотора в указанной конструкции и где указанная конструкция интегрирована в геном бактерии. 2. Бактерия по п.1, в которой ПДК- и АДГ-кодирующие последовательности происходят из Zymomonas. 3. Бактерия по любому из пп.1 и 2, которая имеет модифицированный геном, содержащий инактивированный ген лактатдегидрогеназы (ЛДГ). 4. Бактерия по любому из пп.1 и 2, в которой ген ЛДГ удален, полностью или частично, и не кодирует функциональный белок. 5. Бактерия по п.3, в которой ген ЛДГ инактивирован путем вставки рекомбинантной нуклеиновой кислоты, кодирующей указанную пируватдекарбоксилазу (ПДК) и алкогольдегидрогеназу (АДГ). 6. Бактерия по любому из предшествующих пунктов, которая выбрана из D. radiodurans, D. geothermalis, D. murrayi, D. cellulosilyticus или D. deserti. 7. Бактерия по любому из предшествующих пунктов, которая представляет собой термофильную бактерию Deinococcus. 8. Способ выработки этанола, включающий культивирование бактерии по любому из пп.1-7 в присутствии соответствующего субстрата, и сбор этанола. 9. Способ по п.8, в котором культивирование осуществляют при температуре около 40 С или выше. 10. Способ по п.8 или 9, в котором культивирование осуществляют в условиях с кислым значением рН. 11. Применение бактерии по любому из пп.1-7 для выработки этанола. 12. Применение по п.11 при температуре около 40 С или выше. 13. Применение по п.11 или 12, в котором бактерию используют в условиях с кислым значением рН. 14. Способ получения рекомбинантной бактерии по любому из пп.1-7, который включает получение бактерии Deinococcus; введение в выбранную бактерию нуклеотидной конструкции, кодирующей ПДК и/или АДГ, где ПДК- и АДГ-кодирующие последовательности помещены в оперон под контролем одиночного промотора в указанной рекомбинантной нуклеотидной конструкции и где указанную рекомбинантную нуклеотидную конструкцию интегрируют в геном бактерии. 15. Способ по п.14, который дополнительно включает обработку бактерии для инактивации гена ЛДГ и отбор бактерии, содержащей инактивированный ген ЛДГ.
МПК / Метки
МПК: C12N 9/88, C12P 7/06, C12N 9/04, C12N 1/21, C12N 15/74
Метки: применение, бактерии, получения, этанола, рекомбинантные
Код ссылки
<a href="https://eas.patents.su/18-24979-rekombinantnye-bakterii-i-ih-primenenie-dlya-polucheniya-etanola.html" rel="bookmark" title="База патентов Евразийского Союза">Рекомбинантные бактерии и их применение для получения этанола</a>
Предыдущий патент: Способ подавления коррозии и образования окалины на поверхностях, контактирующих с серосодержащими материалами
Следующий патент: Лекарственные формы, содержащие основание прасугреля или его фармацевтически приемлемые соли присоединения кислоты, и способы их приготовления
Случайный патент: Способ применения электрических и акустических измерений анизотропии для выявления трещин