Олигопептид, связывающий гидролизующие аутоантитела к основному белку миелина mbp, композиции и способ лечения рассеянного склероза
Номер патента: 24832
Опубликовано: 31.10.2016
Авторы: Габибов Александр Габибович, Пономаренко Наталья Александровна, Белогуров Алексей Анатольевич
Формула / Реферат
1. Олигопептид, связывающий гидролизующие аутоантитела к основному белку миелина MBP (ESAMBPCAA), имеющий аминокислотную последовательность GGDRGAPKRGSGKDSHH (SEQ ID NO: 2).
2. Фармацевтическая композиция для лечения рассеянного склероза, содержащая терапевтически эффективное количество олигопептида по п.1 в качестве активного ингредиента и фармацевтически приемлемый носитель, наполнитель или систему доставки активного ингредиента.
3. Фармацевтическая композиция по п.2, дополнительно содержащая по меньшей мере один олигопептид, выбранный из олигопептидов с последовательностями SEQ ID NO: 3 и SEQ ID NO: 4.
4. Фармацевтическая композиция по п.3, отличающаяся тем, что она содержит олигопептид по п.1 и олигопептиды с последовательностями SEQ ID NO: 3 и SEQ ID NO: 4.
5. Фармацевтическая композиция по п.3 или 4, в которой олигопептиды имеют форму солей.
6. Фармацевтическая композиция по п.5, в которой соли представляют собой ацетаты.
7. Гибридный пептид, связывающий гидролизующие аутоантитела к основному белку миелина MBP (ESAMBPCAA), состоящий из олигопептида по п.1 (SEQ ID NO: 2), соединенного в любом порядке пептидным или непептидным линкером с олигопептидом с последовательностью SEQ ID NO: 3 и/или с олигопептидом с последовательностью SEQ ID NO: 4.
8. Фармацевтическая композиция для лечения рассеянного склероза, содержащая терапевтически эффективное количество гибридного пептида по п.7 в качестве активного ингредиента и фармацевтически приемлемый носитель, наполнитель или систему доставки активного ингредиента.
9. Способ лечения или предотвращения рассеянного склероза у субъекта, нуждающегося в этом, включающий введение субъекту композиции по любому из пп.2-6 или 8.
10. Применение композиции по любому из пп.2-6 или 8 для получения лекарственного средства для лечения рассеянного склероза.
Текст
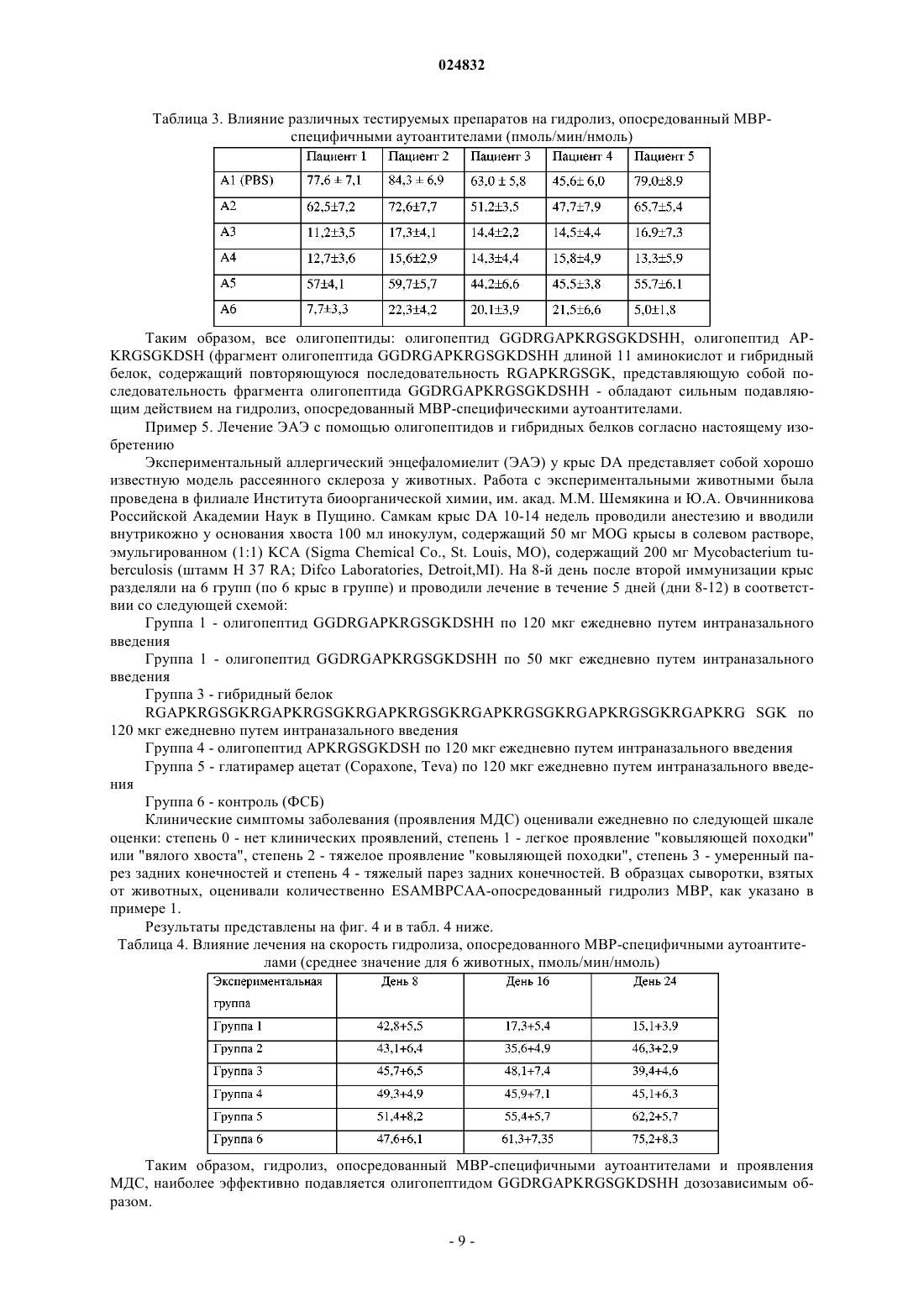
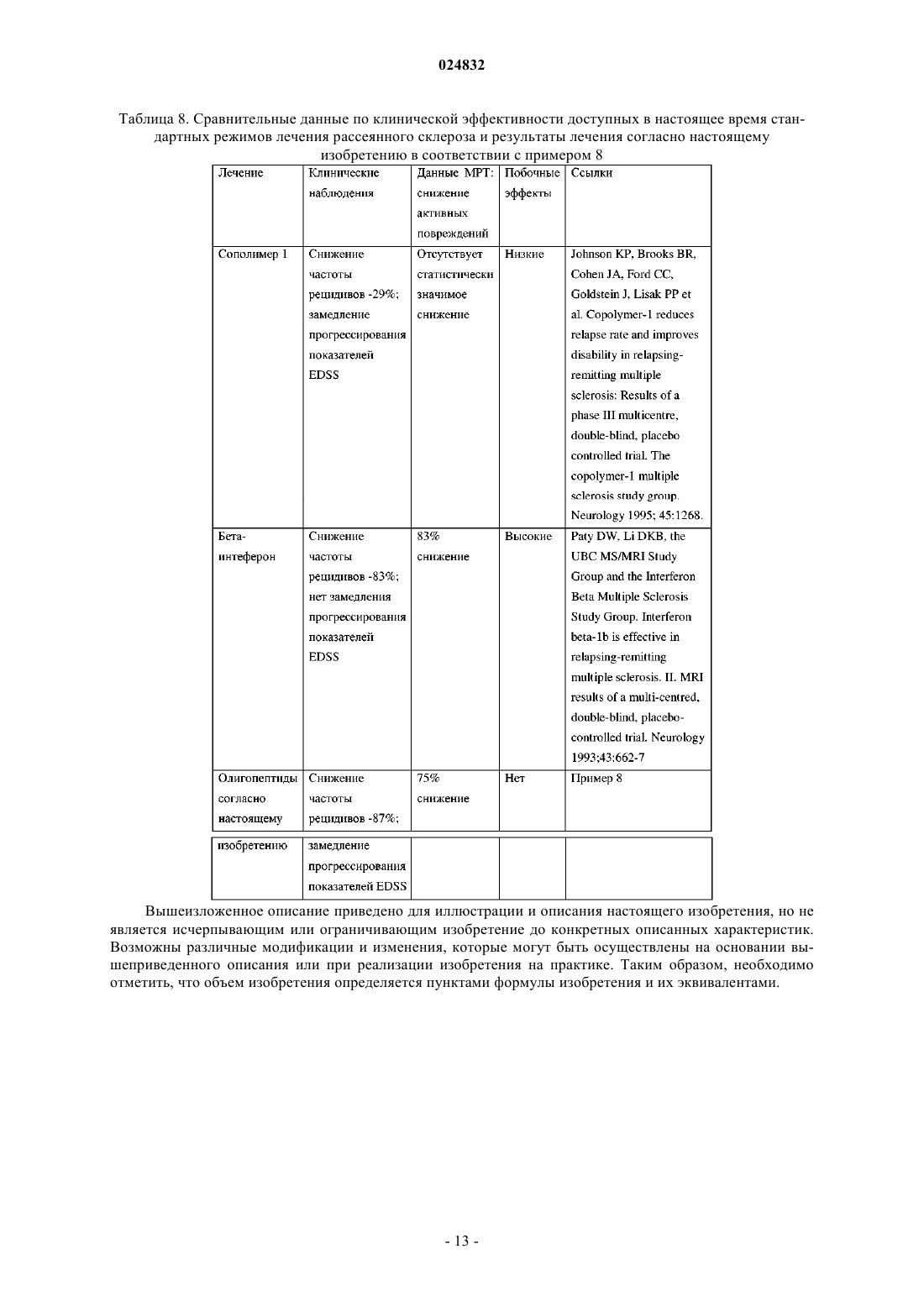
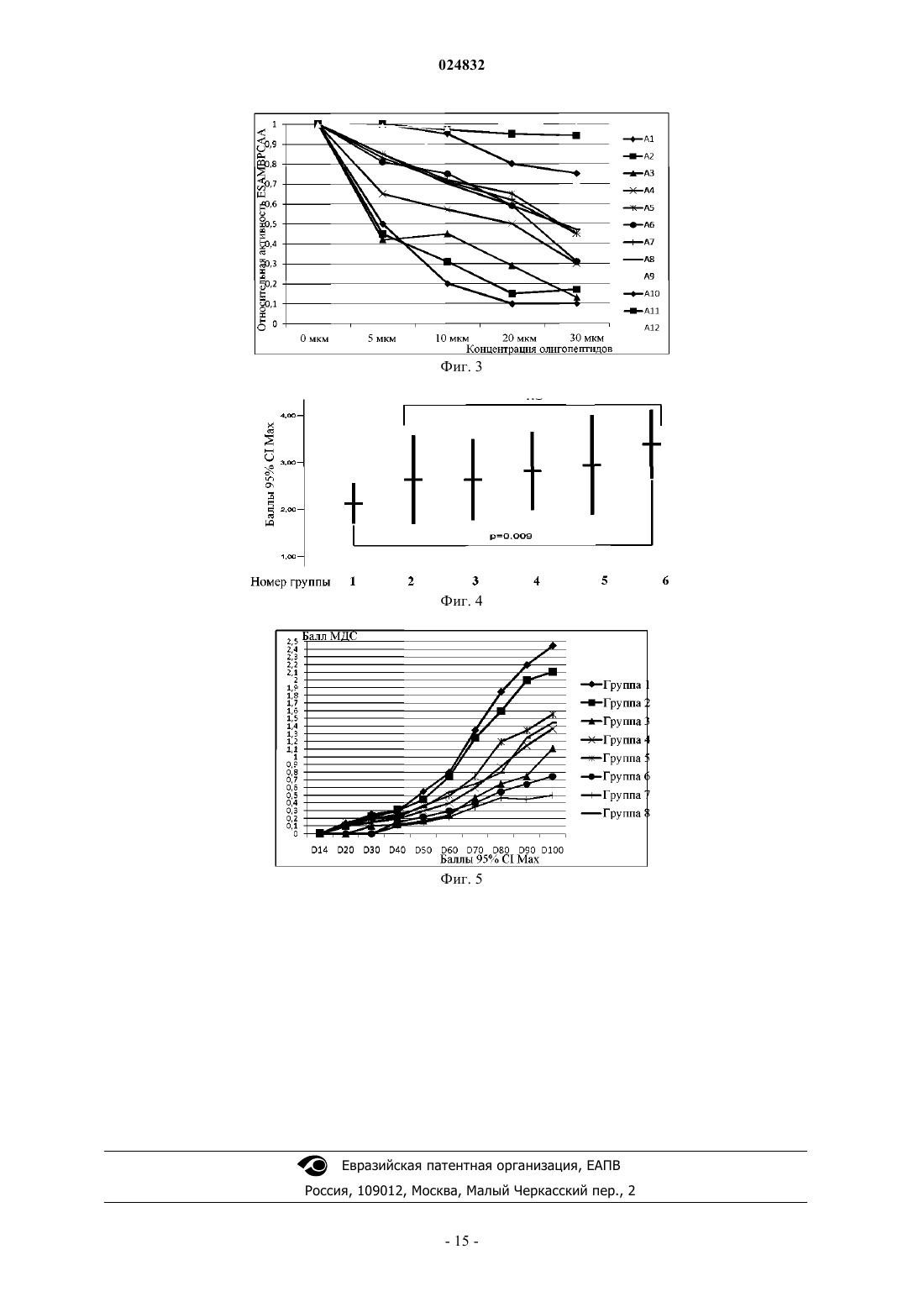
ОЛИГОПЕПТИД, СВЯЗЫВАЮЩИЙ ГИДРОЛИЗУЮЩИЕ АУТОАНТИТЕЛА К ОСНОВНОМУ БЕЛКУ МИЕЛИНА MBP, КОМПОЗИЦИИ И СПОСОБ ЛЕЧЕНИЯ РАССЕЯННОГО СКЛЕРОЗА Настоящее изобретение относится к лечению рассеянного склероза. Предложены олигопептид,связывающий гидролизующие аутоантитела к основному белку миелина MBP (ESAMBPCAA),имеющий аминокислотную последовательность GGDRGAPKRGSGKDSHH (SEQ ID NO: 2),фармацевтические композиции и гибридные белки, содержащие указанный олигопептид, а также способ лечения или предотвращения рассеянного склероза у субъекта, нуждающегося в этом,включающий введение субъекту композиции, содержащей олигопептид с последовательностью Область техники Изобретение относится к олигопептидам и гибридным белкам, а также к их применению для инактивации эпитоп-специфичных аутоантител к MBP (англ. Myelin Basic Protein, основной белок миелина)(ESAMBPCAA), вовлеченных в связывание и каталитическое расщепление MBP в ходе прогрессирования рассеянного склероза. Настоящее изобретение также относится к фармацевтическим композициям,содержащим указанные олигопептиды, комбинации указанных олигопептидов и гибридные белки, состоящие из вышеупомянутых олигопептидов, а также к их применению для лечения рассеянного склероза. Уровень техники Рассеянный склероз (далее сокращенно PC) представляет собой воспалительное демиелинизирующее заболевание центральной нервной системы человека с неоднородными патофизиологическими и клиническими проявлениями и очень сложной этиологией (Hafler et al., 2004. J. Clin. Invest. 113: 788-794;Komek et al., 2003. Brain Res. Bull. 61: 321-326). Прогрессирование данного заболевания у людей приводит к разрушению миелиновой оболочки и, в конечном счете, влияет на способность нервов проводить электрические импульсы (Schwartz, R. S., 1993//Fundamental Immunology, ed. Paul, W. E. (Raven, NewYork), pp. 1033-1097). Для объяснения возникновения такой патологии была предложена гипотеза вирусной мимикрии(Merkler et al., 2006. J. Clin. Invest. 116: 1254-1263). Однако истинные механизмы запуска развития заболевания до сих пор четко не определены (Hohlfeld et al., 2004.Proc. Natl. Acad. Sci. USA 101 (Suppl. 2): 14599-14606). Было показано, что некоторые из пролиферирующих Т-клеток у пациентов с PC направлены противMBP (Allegretta и соавт., Наука, 247, 718-721, 1990), и что Т-клетки человека могут распознавать несколько эпитопов на молекуле MBP (Richert et al., J. Neuroimmun 23, 55-66, 1989). Также оказалось, что МВР способен активировать некоторые Т-клетки без участия антигенпрезентирующих клеток (Altman etal., Eur. J. Immun. 17, 1635-1640, 1987). Несмотря на убедительные и общепринятые доказательства участия иммунных Т-клеток в развитии и прогрессировании рассеянного склероза у людей и в экспериментальных моделях заболевания у животных вклад специфичного В-клеточного ответа в разрушение миелиновой оболочки изучен в гораздо меньшей степени (Klawiter et al., 2007. Curr. Neurol. Neurosci. Rep. 7: 231-238.; Nikbin et al., 2007. Int. Rev.Neurobiol. 79: 13-42). Целый ряд данных указывает на то, что значительная часть случаев PC характеризуется наличием в крови аутоантител, направленных против компонентов MBP (Reindl et al., 1999, Brain, 122, 2047-2056;Genain et al., 1999, Nat. Med. 5, 170-175). Кроме того, микроскопический анализ с высоким разрешением выявил миелин-специфичные аутоантитела в областях бляшек демиелинизации при PC у человека, а также при РС-подобном заболевании у обезьян-игрунков, что позволяет предположить, что такие антитела вносят непосредственный вклад в разрушение миелина (Genain et al., 1999, Nat. Med. 5, 170-175). Хотя механизм участия аутоантител в патогенезе PC не известен, аутоантитела к МБР и гликопротеину миелина олигодендроцитов (англ. myelin oligodendrocyte glycoprotein, MOG) были предложены в качестве биомаркеров для клинического прогнозирования PC (et al., 2003, N. Engl. J. Med. 349, 139-145.10). Подобные иммуноглобулины были также обнаружены у мышей с индуцированным экспериментальным аллергическим энцефаломиелитом (ЭАЭ), представляющим собой модель рассеянного склероза у животных (Fritz et al., 1983, J. Immunol. 130, 191-194). Повышенный титр аутоантител к MBP был обнаружен в спинномозговой жидкости (ликворе) пациентов с активными формами рассеянного склероза (Warren et al., Ann Neurol 209:20-25, 1986). Клинически PC характеризуется наличием фаз активности заболевания, таких как острые рецидивы или хроническое прогрессирование, и фаз клинической ремиссии. Активный PC связан с повышенным интратекальным уровнем аутоантител к MBP (Warren et al., Ann Neurol 209:20-25, 1986; Catz et al., Can J Neurol Sci 13:21-24, 1986). Такие антитела обнаруживаются преимущественно в свободной форме (F) в ходе острых рецидивов и преимущественно в связанной (В) форме при прогрессировании заболевания без явных симптомов (Warren et al., Ann Neurol 209:20-25, 1986). Лечение пациентов с рецидивирующе-ремиттирующим рассеянным склерозом (РРРС) с помощью ритуксимаба моноклонального антитела, которое селективно воздействует и снижает уровень CD20+ В-лимфоцитов,по-видимому, является безопасным и эффективным до некоторой степени (Stv О. et al., Long-term Blymphocyte depletion with rituximab in patients with relapsing-remitting multiple sclerosis., Arch Neurol. 2009Feb; 66(2): 259-61). В соответствии с данными существующими научными предпосылками в течение последнего десятилетия был разработан подход к лечению PC, основанный на иммуномодуляции с помощью целой молекулы MBP и многочисленных пептидов, представляющих собой фрагменты и гомологи белка MBP и их фрагменты. Как известно, MBP человека состоит из 170 аминокислотных остатков. В научной и патентной литературе фрагменты MBP обозначают в соответствии с положением их первого и последнего аминокислотного остатка, считая от С-конца полной последовательности MBP (SEQ ID NO: 1). В международной публикации WO 9612737 предложен ряд пептидов (фрагментов MBP человека),обладающих "Т-клеточной активностью" (т.е. способностью влиять на активность или функции иммун-1 024832 ных Т-клеток или их субпопуляций), для предотвращения и лечения рассеянного склероза, которые охарактеризованы как пептиды, пригодные для терапевтического применения. Для выявления эпитопов вMBP, узнаваемых Т-клетками, 16 коротких (каждый длиной около 20 аминокислотных остатков) и три длинных (82-100, 83-105, 141-165) "перекрывающихся" друг с другом пептидных последовательности были протестированы на способность стимулировать in vitro пролиферацию клеток периферической крови у пациентов с рассеянным склерозом. Аминокислотный состав пептидов, предложенных авторами упомянутого изобретения, соответствует следующим фрагментам MBP: 11-30, 11-29, 11-31, 83-105, 82105, 82-104, 80-98, 82-102, 80-104; 80-102; 111-130; 111-129; 141-165; 101-125. Кроме того, авторы упомянутого изобретения описывают комбинацию раскрытых в изобретении пептидов с другими пептидами, для которых из предшествующего уровня техники была известна Т-клеточная активность MBP: 1325; 31-50; 61-80; 82-92; 82-96; 82-97; 82-98; 82-100; 82-100; 83-100; 83-101; 84-97; 84-100; 85-100; 86-105; 87-99; 87-99 [91KА]; 88-100; 88-99; 82-100; 111-135; 122-140; 139-170; 141-160; 142-166; 142-168; 146160;153-170.Wraith D.C. с соавторами предлагают способ выбора пептидов, вызывающих иммунологическую толерантность, способных связываться с молекулами МНС I или II класса без последующего процессинга антигена, и применение таких пептидов в фармацевтической композиции для лечения и/или профилактики рассеянного склероза. Авторами был синтезирован ряд пептидов, соответствующих фрагментам 1-24, 15-39, 30-54, 45-69, 60-84, 75-99, 90-114, 105-129, 120-144, 135-159, 150-170, 131-145, 132-146, 133147, 134-148, 135-149, 136-150, 137-151, 138-152, 139-153, 140-154, 141-155, 142-156, 143-157, 144-158MBP человека, которые применялись авторами для идентификации эпитопов MBP человека, узнаваемых клетками периферической крови у пациентов с PC, а затем для изучения способности таких пептидов связываться с молекулами МНС I класса или II класса. Был выбран ряд коротких пептидов, активных в отношении модуляции функции иммунных Т-клеток и предложенных для лечения PC: 134-148, 135-149,136-150, 137-151, 138-152, 139-153, 140-154, 30-44, 80-94, 83-99, 81-95, 82-96, 83-97, 84-98, 110-124, 130144, 131-145, 132-146, 133-147 (см. заявки ЕР 1918298, US 11/979224, WO 03/64464). В US 2005209156 для лечения рассеянного склероза предложен пептид, выбранный из фрагментаMBP (75-98), имеющий аминокислотную последовательность AGAPVVHPPLAIVTPAT, включающую замены, вставки или делеции. В патенте США 5858980 было установлено, что фрагменты MBP 84-102 и 143-168 содержат иммунодоминантные эпитопы МВР, узнаваемые Т-клетками, активные при развитии рассеянного склероза,и предложен пептид, содержащий аминокислотную последовательность ENPVVHFFKNIVTPRT (фрагмент МВР 83-98) и их аналоги и AQGTLSKIFKLGGRD (фрагмент МВР 146-160), а также фармацевтическая композиция, содержащая такие пептиды.Warren K.G. с соавторами предложены растворимые синтетические пептиды, подходящие для нейтрализации аутоантител к МВР, имеющие последовательность аминокислот, соответствующую следующим аминокислотным остаткам МВР человека: 61-75, 64-78, 69-83, 75-95, 69-83; 80-97, 91-106, 84-93, 8594, 86-95, 87-96, 82-98. Такие пептиды перекрываются с последовательностью МВР от аминокислотных остатков с 61 по 106 (см. WO 98/45327). Один из выбранных пептидов (а именно МВР 75-95) продемонстрировал способность связываться со свободными антителами к МВР как in vitro, так и in vivo (в крови пациентов с PC). Напротив, не демонстрирующий связывания контрольный пептид 35-58 МВР не оказывал влияния на свободные и связанные антитела к МВР у пациентов с PC. Некоторые пептиды на основе МВР и ДНК-вакцины были протестированы в клинических испытаниях: ДНК-вакцина ВНТ-3009 от Bayhill Therapeutics, содержащая ген полноразмерного МВР, измененные пептидные лиганды GP77116 и НБР-5788 от Neurocrine Biosciences, композиция Myloral для перорального применения, вызывающая иммунологическую толерантность, на основе полноразмерного МВР от Autoimmune(R). Однако при применении таких вариантов терапии какого-либо значительного успеха не наблюдалось из-за серьезных побочных эффектов или невозможности замедления прогрессированияPC (Hohlfeld et al., Proc Nat Acad. Sci U S A. 2004, October 5; 101 (Suppl. 2): 14599-14606). В настоящее время вышеуказанный синтетический пептид, имеющий последовательность, соответствующую аминокислотным остаткам 82-98 белка МВР (DENPVVHFFKNIVTPRT) и обозначаемый как МВР 8298 активно исследуется на II фазе клинических испытаний для лечения прогрессирующего рассеянного склероза. Пептид в дозе 500 мг вводили внутривенно каждые шесть месяцев. Было показано, что на лечение с помощью МВР 8298 реагируют только пациенты, имеющие гаплотипы HLA DR2 и/или DR4 (Warren, K.G.et al, European Journal of Immunology, 2006, vol. 13, No 8, pp. 887-895). Вышеупомянутый фрагмент MBP 84-102 (патент США 5858980) применяли в качестве активного ингредиента для препарата для лечения вторично-прогрессирующего PC в I фазе клинических испытаний. Согласно измерению по Расширенной шкале оценки состояния инвалидности не было выявлено эффективности такого лечения в тесте с девятью отверстиями и стержнями (англ. Nine Hole Peg Test), и были обнаружены новые повреждения, диагностированные с помощью магнитно-резонансной томографии (Goodkin, D. E. et al. Neurology 2000, vol. 54, pp. 1414-1420). Таким образом, поиск и отбор новых фрагментов MBP, олигопептидов, обладающих терапевтической активностью в отношении PC, представляет нетривиальную задачу, и лечебные свойства любого из таких олигопептидов в отношении лечения PC не могут быть предсказаны заранее специалистом в данной области техники даже на основании обширных доклинических испытаний in vitro и/или in vivo. Выявление и отбор таких новых эффективных пептидов могут быть осуществлены за счет открытия новых иммунопатологических механизмов, участвующих в развитии и прогрессировании рассеянного склероза. Ранее нами были представлены доказательства того, что небольшая часть аутоантител к MBP, циркулирующих в крови пациентов с PC, демонстрирует сайт-специфическое протеолитическое расщепление молекулы MBP, что представляет собой новый иммунопатологический механизм разрушения миелина и прогрессирования PC (Ponomarenko et al. Immunology Letters 103, 2006, pp. 45-50). Таким образом, задачей настоящего изобретения является нахождение новых олигопептидов, которые были бы способны нейтрализовать эпитоп-специфичные аутоантитела к MBP, вовлеченные в связывание и каталитическое расщепление MBP в ходе прогрессирования рассеянного склероза (ESAMBPCAA-эпитоп-специфичные каталитические аутоантитела к MBP), а также обеспечение новых эффективных способов лечения PC с применением таких новых олигопептидов. Указанная задача достигается путем обеспечения новых олигопептидных молекул (олигопептиды,гибридные белки, состоящие из таких олигопептидов, и фрагменты таких олигопептидов), фармацевтической композиции, содержащей указанные олигопептиды и гибридные белки, которые нейтрализуютESAMBPCAA. Неожиданным образом, несмотря на то, что ESAMBPCAA представляет собой лишь незначительную долю циркулирующих аутоантител к MBP при PC, авторы настоящего изобретения обнаружили, что олигопептиды, имеющие последовательность, содержащую всего лишь 6 аминокислотных остатков из SEQ ID NO: 2, которые нейтрализуют ESAMBPCAA, демонстрируют неожиданно высокую эффективность при лечении рассеянного склероза. Другие преимущества и аспекты настоящего изобретения станут очевидными после ознакомления с последующим подробным описанием изобретения. Краткое описание изобретения В одном варианте реализации, согласно настоящему изобретению предложен олигопептид (I), имеющий аминокислотную последовательность GGDRGAPKRGSGKDSHH (SEQ ID NO: 2). В другом варианте реализации, согласно настоящему изобретению предложена фармацевтическая композиция, содержащая в качестве активного ингредиента терапевтически эффективное количество одного из следующих олигопептид I, имеющий аминокислотную последовательность GGDRGAPKRGSGKDSHH (SEQ ID NO: 2); В другом варианте реализации, согласно настоящему изобретению предложена фармацевтическая композиция, содержащая в качестве активного ингредиента терапевтически эффективное количество олигопептида I, имеющего аминокислотную последовательность SEQ ID NO: 2 и дополнительно содержащая по меньшей мере один олигопептид, выбранный из олигопептида II, имеющего последовательность SEQ ID NO: 3, и олигопептида III, имеющего последовательность SEQ ID NO: 4. В другом варианте реализации, согласно настоящему изобретению предложен гибридный пептид,состоящий из олигопептида, имеющего последовательность SEQ ID NO: 2, и одного или более олигопептидов SEQ ID NO: 3 и SEQ ID NO: 4 или их фрагментов, которые соединены последовательно друг с другом пептидным или непептидным линкером в любом порядке. В другом варианте реализации изобретения предложен способ лечения рассеянного склероза,включающий введение эффективной дозы олигопептида или фармацевтической композиции согласно настоящему изобретению субъекту, нуждающемуся в таком лечении. В другом варианте реализации предложено применение олигопептида или гибридного белка согласно настоящему изобретению для получения лекарственного средства для лечения рассеянного склероза. Краткое описание графических материалов На фиг. 1 показана последовательность аминокислот интактной молекулы MBP человека. Печатными буквами показаны аминокислотные остатки MBP человека. Также представлены участки аминокислотной последовательности MBP, которые соответствуют аминокислотной последовательности олигопептида настоящего изобретения (SEQ ID NO: 2) и олигопептидов, имеющих аминокислотную последовательность SEQ ID NO: 3 и SEQ ID NO: 4 соответственно. Эти участки аминокислотной последовательности MBP обведены черной линией. На фиг. 2 показано расщепление MBP в присутствии ESAMBPCAA и ингибирование расщепления в присутствии различных пептидных фрагментов MBP (горизонтальный ряд чисел соответствует позиции первого и последнего аминокислотного остатка). На фиг. 3 показано ингибирование активности ESAMBPCAA различными синтетическими олигопептидами, содержащими аминокислотные последовательности фрагмента MBP 43-68. Горизонтальная ось - концентрация олигопептидов, используемых в анализе ингибирования; вертикальная ось - относительная активность ESAMBPCAA (активность ESAMBPCAA в контроле (ФСБ) принимали за 1). Обозначения олигопептидов указаны в примере 3. На фиг. 4 показано подавление проявлений миелодиспластического синдрома (МДС) у крыс агути темных DA (Dark Agouti), имеющих экспериментальный аллергический энцефаломиелит (ЭАЭ), которых лечили с помощью олигопептидов согласно настоящему изобретению и гибридного белка. Подавление показателей МДС при протекании ЕАЕ у крыс DA на 24 день. Максимальный клинический результат в каждой группе крыс, среднее значение и доверительный интервал при доверительной вероятности 95%. На фиг. 5 показано подавление проявлений МДС при протекании экспериментального PC (инфекция вирусом Тейлера) с помощью комбинаций олигопептидов. Подробное описание изобретения Определения Используемый в настоящей заявке термин "олигопептид" относится к любой молекуле, включающей вплоть до примерно 20 аминокислотных остатков, связанных пептидной связью (связями), то есть термин "олигопептид" обозначает полипептид длиной до 20 аминокислот. Термин "олигопептид" или"олигопептиды" охватывает олигопептиды, а также их соли. Подходящие соли включают соли натрия или калия или соли уксусной или фосфорной кислоты. При использовании в настоящем описании термин "олигопептид" охватывает "олигопептид", имеющих определенную последовательность аминокислот, и его функциональные варианты. Функциональные варианты включают любой фрагмент олигопептида определенной последовательности, при этом длина фрагмента составляет от 6 до 20 аминокислот при условии, что такой вариант сохраняет возможность связывания с ESAMBPCAA. Используемый в настоящем описании термин "фрагмент" олигопептида настоящего изобретения включает по меньшей мере примерно 6, предпочтительно по меньшей мере примерно 8, предпочтительно по меньшей мере примерно 12, более предпочтительно по меньшей мере примерно 14, и наиболее предпочтительно по меньшей мере примерно 16 или более последовательных аминокислотных остатков. Кроме того, предусмотрены варианты олигопептидов настоящего изобретения, полученные путем изменения аминокислотной последовательности исходных олигопептидов. Такие изменения могут включать одну или более аминокислотных замен, делеций, вставок или добавлений, при том условии, что образующийся в результате вариант содержит по меньшей мере 6 последовательных аминокислот исходной последовательности и способен связываться с ESAMBPCAA. Используемый в настоящем описании термин "гибридный белок" относится к олигопептиду или его фрагменту, слитому с другим олигопептидом или его фрагментом, при этом каждая из таких частей, слитых в гибридной молекуле соединена с другой напрямую через пептидную связь (аминогруппа (NH2) изN-конца одного олигопептида, связанная с карбоксильной группой (СООН) С-конца другого олигопептида или его фрагмента) или посредством линкера. "Линкер" может быть выбран из "пептидного линкера" или "непептидного линкера". "Пептидный линкер" может включать последовательность, содержащую примерно от 1 до 20 аминокислот, которые линейно связаны друг с другом пептидной связью и могут включать последовательность сайта расщепления протеазой. Термин "непептидный линкер", используемый в настоящей заявке, относится к любой связывающей молекуле с двумя или более реакционноспособными группами, отличный от пептидного линкера. Предпочтительный линкер представляет собой непептидный полимер. Непептидный полимер, применяемый в качестве линкера в настоящем изобретении, представляет собой полимер, несущий реакционноспособные группы на обоих концах, которые способны независимо связываться с реакционноспособными группами олигопептида, при этом примеры реакционноспособной группы олигопептида включают концевую аминогруппу или концевую карбоксильную группу, остаток лизина, остаток гистидина или остаток цистеина. Реакционноспособные группы полимера включают альдегидную группу, группу пропионового альдегида, группу масляного альдегида,малеимидную группу, кетонную группу, винилсульфонную группу, тиоловую группу, гидразидную группу, карбонилдиимидазольную (КДИ) группу, нитрофенилкарбонатную (НФК) группу, тризилатную группу, изоцианатную группу и сукцинимидные производные. Примеры сукцинимидных производных включают сукцинимидил пропионат (СПК), сукцинимидил бутановую кислоту (СБК), сукцинимидил карбоксиметилат (СКМ), сукцинимидил сукцинамид (ССА), сукцинимидил сукцинат (СС), сукцинимидил карбонат и N-гидроксисукцинимид (N-ГС). Реакционноспособные группы на концах непептидного полимера могут быть одинаковыми или разными. Например, полимер может иметь малеимидную группу на одном конце и альдегидную группу на другом конце. Низкомолекулярные линкеры включают карбодиимид или глутаральдегид. Используемый в данном описании термин "ESAMBPCAA" относится к небольшой фракции аутологичных молекул иммуноглобулина, циркулирующих в крови пациента с PC, которые связываются с основным белком миелина (MBP) и катализируют сайт-специфическое протеолитическое расщепление молекулы MBP. В настоящем описании термины "лечить", "лечение" относятся к введению лекарственного средства, агента, соединения или композиции субъекту, страдающему заболеванием, для уменьшения, облегчения или устранения по меньшей мере одного симптома патологического состояния, подлежащего лечению по оценке лечащего врача или специалиста в данной области любым известным способом. В настоящем описании термин "нейтрализация, инактивация, подавление" обозначает снижение специфичной активности, измеренной с помощью подходящей тест-системы. В настоящем описании "эффективное количество" представляет собой количество олигопептида,-4 024832 его фрагмента, или гибридного белка, описанных выше, которое при введении способно уменьшать, ослаблять или ликвидировать по меньшей мере один из симптомов рассеянного склероза. Кроме того, "эффективное количество" обозначает количество, способное уменьшить или предотвратить состояние рассеянного склероза. На основании предыдущей работы авторов изобретения (Belogurov at al., The Journal of Immunology,2008, 180: 1258-1267) был обнаружен новый класс аутоантител, участвующих в распознавании и расщеплении основного белка миелина у пациентов с PC. Такие каталитически активные антитела представляют собой весьма незначительную долю антител к МВР, однако было установлено, что их каталитическая активность коррелирует с прогрессирующим состоянием PC. Таким образом, количественное определение протеолиза МВР, опосредованное аутоантителами к МВР, было предложено в качестве нового биомаркера PC. Несмотря на то, что ESAMBPCAA представляет собой лишь незначительную долю циркулирующих аутоантител к MBP при PC, авторы настоящего изобретения неожиданно обнаружили, что некоторые олигопептиды, обладающие сильной нейтрализующей активностью по отношению кESAMBPCAA, демонстрируют неожиданно высокую эффективность в лечении PC как у людей, так и в общепринятых моделях рассеянного склероза у животных. В соответствии с настоящим изобретением предложен олигопептид, имеющий аминокислотную последовательность GGDRGAPKRGSGKDSHH(SEQ ID NO: 2). Эта последовательность соответствует аминокислотной последовательности 46-62 MBP человека и обозначена как "MBP 46-62". Указанный олигопептид способен ингибировать ESAMBPCAA. Олигопептиды, имеющие последовательности GFGYGGRASDYKSAHK (SEQ ID NO: 3) и QGTLSKIFKLGGRDSRSGSPMARR (SEQ ID NO: 4) содержат хорошо известные в данной области эпитопыMBP пациентов с PC. Авторы настоящего изобретения неожиданно обнаружили, что эти два олигопептида (SEQ ID NO: 3 и SEQ ID NO: 4) синергически повышают эффективность олигопептида (SEQ ID NO: 2) согласно настоящему изобретению в лечении рассеянного склероза у людей и в предотвращении (или уменьшении) развития принятой модели PC у животных - экспериментального аллергического энцефаломиелита (ЭАЭ). Несмотря на наличие низкой ингибирующей активности в отношении ESAMBPCAA,по сравнению с олигопептидом (SEQ ID NO: 2), эти два олигопептида усиливают терапевтический эффект олигопептида GGDRGAPKRGSGKDSHH при одновременном введении животным и у людям. Вне связи с какой-либо теорией, можно предположить, что это связано с тем, что одновременная модуляция нескольких иммунных механизмов - функции иммунных Т-клеток и гидролиза MBP, опосредованного аутоантителами, может обеспечить увеличение терапевтического эффекта. В соответствии с этим,предложена фармацевтическая композиция, содержащая олигопептид SEQ ID NO: 2, его фрагменты или функциональные варианты и по меньшей мере один из двух олигопептидов последовательности SEQID NO: 3 или SEQ ID NO: 4. В другом варианте реализации настоящего изобретения олигопептиды последовательности SEQ IDNO: 2, их фрагменты или функциональные варианты соединены друг с другом с образованием гибридного пептида. Такой гибридный пептид состоит из нескольких копий фрагмента, инактивирующегоESAMBPCAA. В другом варианте реализации настоящего изобретения олигопептид (SEQ ID NO: 2) или его фрагменты или функциональные аналоги и олигопептид (SEQ ID NO: 3) или его фрагменты, и олигопептид(SEQ ID NO: 4) или его фрагменты соединены друг с другом в любом порядке с образованием гибридного пептида. Таким образом, гибридный пептид согласно настоящему изобретению может содержать несколько повторяющихся копий инактивирующего ESAMBPCAA фрагмента олигопептида (SEQ ID NO: 2) и эпитопы олигопептидов (SEQ ID NO: 3) и (SEQ ID NO: 4). Кроме того, согласно настоящему изобретению предложена фармацевтическая композиция, содержащая терапевтически эффективное количество олигопептида согласно настоящему изобретению (SEQID NO: 2) или гибридного белка, и фармацевтически приемлемый носитель или разбавитель и/или систему доставки лекарственного средства. Примеры фармацевтически приемлемых носителей хорошо известны в данной области и включают, например, физиологический раствор. Примеры систем доставки лекарственного средства также хорошо известны в данной области и включают, например, липосомы или синтетические полимерные наночастицы. Олигопептиды согласно настоящему изобретению могут быть получены в соответствии с существующими способами синтеза олигопептидов, имеющих формулу в соответствии с настоящим описанием. Гибридные белки могут быть получены с помощью технологии рекомбинантной ДНК. Зная последовательность выбранных гибридных белков, как описано в настоящем изобретении, соответствующие последовательности ДНК могут быть получены в соответствии со стандартными известными способами синтеза ДНК. Последовательности ДНК, полученные таким образом,могут быть клонированы в соответствующих векторах для клонирования, и их можно применять для трансформации подходящей клетки-хозяина с получением рекомбинантного пептида. Все методики,упомянутые выше, являются стандартными и хорошо известными специалистам в данной области. Кроме того, согласно настоящему изобретению предложен способ лечения рассеянного склероза,включающий введение эффективной дозы олигопептида или гибридного пептида или содержащей их фармацевтической композиции нуждающемуся в этом субъекту. Терапевтическая доза олигопептидов или гибридного белка для лечения рассеянного склероза может составлять от примерно 0,01 мг на килограмм массы тела до примерно 10,0 мг на килограмм массы тела, при этом композицию можно вводить внутривенно, подкожно, интратекально. В одном из примеров реализации настоящего изобретения соединение вводят перорально, для направленного воздействия на так называемый "путь доставки через слизитую оболочку". Композицию можно вводить в виде единой или последовательных доз, по необходимости. Несмотря на то, что настоящее изобретение подробно описано с особым акцентом на предпочтительные варианты его реализации, следующие примеры лишь иллюстрируют, но не ограничивают настоящее изобретение. Примеры Пример I. Обнаружение ESAMBPCAA-аутологичных молекул иммуноглобулина, которые связываются с основным белком миелина и катализируют сайт-специфическое протеолитическое расщепление молекулы MBP в крови пациентов с рассеянным склерозом Очистку и определение характеристик аутоантител к MBP проводили с помощью сыворотки крови 24 пациентов с рассеянным склерозом (в возрасте 17-54 лет, средний возраст 32 года), которым не оказывали лечение стероидами или нестероидными противовоспалительными препаратами. Диагноз PC проверяли и подтверждали, и рассчитывали баллы по Расширенной шкале оценки состояния инвалидности (англ. EDSS, Expanded Disability Status Scale) в соответствии с классификацией прогрессирования заболевания по Позеру, с использованием клинических, иммунологических данных и данных MPT (Poseret al., Clin Neural Neurosurg 2001; 103:1-11). Иммуноглобулины (IgG) были выделены из сыворотки путем трехкратного 50% осаждения сульфатом аммония с последующей аффинной хроматографией на белокG-Сефарозе (Amersham Biosciences). IgG-содержащие фракции затем подвергали диализу против ФСБ или ТСБ с 0,05% NaN3 при 4 С. Проводили количественное определение IgG и стандартизацию с помощью ИФА. Степень чистоты IgG оценивали с помощью электрофореза с последующим окрашиванием серебром, иммуноблоттингом при невосстанавливающих условиях и масс-спектрометрии с усиленной поверхностью лазерной десорбцией/ионизацией (SELDI). IgG дополнительно разделяли путем антигенаффинной хроматографии на колонке с MBP, иммобилизованным на NHS-сефарозе (Amersham), и степень их чистоты оценивали с помощью электрофореза с последующим окрашиванием серебром.MBP получали из мозга быка согласно методике Миллера (Miller et al., 1996. Experimental autoimmune encephalomyelitis in the mouse.//Current Protocols in Immunology; J. E. Coligan, ed. Wiley, New York,p. S19). Образующийся в результате белок очищали с помощью обращенно-фазовой высокоэффективной жидкостной хроматографии на колонке С 4 10/250 (Mashery-Nagel, Germany). Гидролиз MBP с помощью аутоантител к MBP оценивали следующим образом: очищенные антитела (0,1-1 мкг) инкубировали при 37 С в течение 14 ч в конечном объеме 12,5 мкл ФСБ, 0,02% NaN3, содержащем 1-2 мкг MBP. Образцы смешивали с буфером Laemmli. Степень расщепления MBP определяли с помощью ДСН-ПААГ в трис-глициновой и трициновой буферной системе. Для количественного определения расщепления MBP (10 мкМ) инкубировали при 37 С с антителами (60 нМ) в 0,1 мл ФСБ,0,02% NaN3 в течение 12 ч. Реакцию останавливали добавлением 10% ТФУ до рН 2,5. Образцы далее разделяли с помощью хроматографии на колонке С 4 4.0/150 (Waters). Количество нерасщепленного MBP рассчитывали на основании поглощения при 280 нм. Результаты представлены в табл. 1. Таблица 1. Клинический статус 24 пациентов с рассеянным склерозом и соответствующие скорости гидролиза MBP под действием ESAMBPCAA ВП - вторично-прогрессирующий,ПП - первично-прогрессирующий,ВР-возвратно-ремиттирующий. Необходимо отметить, что уровень ESAMBPCAA-опосредованного расщепления MBP коррелирует с состоянием пациента по Расширенной шкале оценки состояния инвалидности (EDSS) (r2 = 0,85, Р 0,001 согласно ранговой корреляции Спирмена). Наиболее высокий уровень антитело-посредованного катализа происходит в случаях с высоким баллом EDSS (от 3,0 до 6,0), в основном на стадии прогрессирования заболевания или обострения при возвратно-ремиттирующем (ВР) течении заболевания. Пример 2. Скрининг ESAMBPCAA-ингибирующих последовательностей Двенадцать фрагментов ДНК, кодирующих пептиды МВР, человека, представляющие различные участки молекулы МВР (1-27, 17-41, 25-54, 43-68, 53-81, 81-103, 91-114, 107-132, 123-140, 130-156, 146170), были получены с помощью ПНР с четырьмя перекрываниями, соответствующими линкеру(SGGGG)3S. Конечные продукты ПНР клонировали в рамке в плазмиде рЕТ 32 СН при сайтах рестрикцииNcol и BamHI. Продукты экспрессии таких плазмид, включающие МВР пептиды, слитые с Trx, применяли для анализа расщепления. В качестве контроля использовали плазмиду, кодирующую Trx (тиоредоксин) вместе с линкером (SGGGG)3S. Растворимый рекомбинантный His-меченный белок получали в результате экспрессии в Escherichia coli и выделяли путем сорбции на колонке Talon SuperFlow (BD Biosciences) с последующей катионообменной хроматографией на колонке Mono S column (Amersham Pharmacia) при pH 5,0 и последующей эксклюзионной хроматографией на колонке Superdex 75 GL 10300(Amersham Pharmacia) в 150 мМ буфере NH4HCO3. Характер гидролиза МВР под действием ESAMBPCAA, выделенного из плазмы мышей SJL с ЭАЭ,индуцированным введением МВР в полном адъюванте Фрейнда, оценивали с помощью ДСН-ПААГ, как указано в примере 1, в присутствии 0,5 мкМ различных пептидов МВР. Результаты представлены на фиг. 2. Фрагмент МВР 43-68, содержащий последовательность GGDRGAPKRGSGKDSHH, демонстрирует сильную ингибирующую активность по отношению к гидролизу МВР, индуцированному аутоантителами к МВР. Пример 3. Подавление гидролиза, обусловленного МВР-специфичными аутоантителами, с помощью синтетических олигопептидов, содержащих аминокислотные последовательности фрагмента МВР 43-68 Для определения последовательности аминокислот, необходимых для эффективного ингибирования активности ESAMBPCAA, был синтезирован следующий ряд пептидов: Таблица 2 Была исследована эффективность олигопептидов в подавлении ESAMBPCAA-опосредованного гидролиза MBP с использованием ESAMBPCAA, собранного от пациентов с прогрессирующем PC, как указано в примере 1. Различные концентрации тестируемых пептидов смешивали с антителом (30 нМ) вместе с MBP (4 мкМ) в ТБС с 0,1% NaN3 и 10 мМ CaCl2. Образцы инкубировали в течение 16 ч при температуре 37 С и анализировали в 15% ДСН-ПААГ. Гели окрашивали с помощью реактива Кумасси и анализировали денситометрически с использованием программного обеспечения TOTALLAB 2,01 (Nonlinear Dynamics, Ltd., Newcastle upon Tyne, U.K). Данные представлены на фиг. 3, показывают, что среди анализируемых олигопептидов олигопептид A3, содержащий аминокислотную последовательностьGGDRGAPKRGSGKDSHH, демонстрирует наиболее эффективную ингибирующую активность, при этом включая меньшее количество аминокислотных остатков, чем олигопептиды А 1 и А 2. Укорочение длины олигопептида до менее 6 аминокислот приводит к полному отсутствию ESAMBPCAA-ингибирующей активности. Пример 4. Подавление гидролиза, опосредованного МВР-специфичными аутоантителами, с помощью синтетических олигопептидов, содержащих аминокислотную последовательность GGDRGAPKRGSGKDSHH, их фрагментов и гибридных белков. Образцы сыворотки от 5 пациентов, страдающих прогрессирующим PC, количественно оценивали с помощью ESAMBPCAA-опосредованного гидролиза MBP, как указано в примере 1, в присутствии следующих веществ: А 1-отрицательный контроль: фосфатный буферный раствор (PBS); А 2-глатирамер ацетат (Copaxone, Teva Pharmaceuticals), 100 нМ; А 3-олигопептид GGDRGAPKRGSGKDSHH, 100 нМ; А 4 олигопептидов APKRGSGKDSH (фрагмент олигопептида GGDRGAPKRGSGKDSHH 100 нМ; А 5 олигопептид SGKDS (фрагмент олигопептида GGDRGAPKRGSGKDSHH) -100 нм; А 6-гибридный белокRGAPKRGSGKRGAPKRGSGKRGAPKRGSGKRGAPKRGSGKRGAPKRGSGKRGAPKRG SGK (содержащий повторяющуюся последовательность RGAPKRGSGK, представляющую собой последовательность фрагмента олигопептида GGDRGAPKRGSGKDSHH) 100 нМм. Продукты A3, А 4 и А 5 были синтезировали с помощью лабораторного твердофазного органического синтеза (Институт биоорганической химии, им. акад. М.М. Шемякина и Ю.А. Овчинникова РАН). Продукт А 6 синтезировали с помощью бесклеточной системы трансляции ABNOVA (www.abnova.tw). Результаты анализа представлены в табл. 3 ниже. Таблица 3. Влияние различных тестируемых препаратов на гидролиз, опосредованный МВРспецифичными аутоантителами (пмоль/мин/нмоль) Таким образом, все олигопептиды: олигопептид GGDRGAPKRGSGKDSHH, олигопептид APKRGSGKDSH (фрагмент олигопептида GGDRGAPKRGSGKDSHH длиной 11 аминокислот и гибридный белок, содержащий повторяющуюся последовательность RGAPKRGSGK, представляющую собой последовательность фрагмента олигопептида GGDRGAPKRGSGKDSHH - обладают сильным подавляющим действием на гидролиз, опосредованный МВР-специфическими аутоантителами. Пример 5. Лечение ЭАЭ с помощью олигопептидов и гибридных белков согласно настоящему изобретению Экспериментальный аллергический энцефаломиелит (ЭАЭ) у крыс DA представляет собой хорошо известную модель рассеянного склероза у животных. Работа с экспериментальными животными была проведена в филиале Института биоорганической химии, им. акад. М.М. Шемякина и Ю.А. Овчинникова Российской Академии Наук в Пущино. Самкам крыс DA 10-14 недель проводили анестезию и вводили внутрикожно у основания хвоста 100 мл инокулум, содержащий 50 мг MOG крысы в солевом растворе,эмульгированном (1:1) KCA (Sigma Chemical Co., St. Louis, МО), содержащий 200 мг Mycobacterium tuberculosis (штамм H 37 RA; Difco Laboratories, Detroit,MI). На 8-й день после второй иммунизации крыс разделяли на 6 групп (по 6 крыс в группе) и проводили лечение в течение 5 дней (дни 8-12) в соответствии со следующей схемой: Группа 1 - олигопептид GGDRGAPKRGSGKDSHH по 120 мкг ежедневно путем интраназального введения Группа 1 - олигопептид GGDRGAPKRGSGKDSHH по 50 мкг ежедневно путем интраназального введения Группа 3 - гибридный белокRGAPKRGSGKRGAPKRGSGKRGAPKRGSGKRGAPKRGSGKRGAPKRGSGKRGAPKRG SGK по 120 мкг ежедневно путем интраназального введения Группа 4 - олигопептид APKRGSGKDSH по 120 мкг ежедневно путем интраназального введения Группа 5 - глатирамер ацетат (Copaxone, Teva) по 120 мкг ежедневно путем интраназального введения Группа 6 - контроль (ФСБ) Клинические симптомы заболевания (проявления МДС) оценивали ежедневно по следующей шкале оценки: степень 0 - нет клинических проявлений, степень 1 - легкое проявление "ковыляющей походки" или "вялого хвоста", степень 2 - тяжелое проявление "ковыляющей походки", степень 3 - умеренный парез задних конечностей и степень 4 - тяжелый парез задних конечностей. В образцах сыворотки, взятых от животных, оценивали количественно ESAMBPCAA-опосредованный гидролиз MBP, как указано в примере 1. Результаты представлены на фиг. 4 и в табл. 4 ниже. Таблица 4. Влияние лечения на скорость гидролиза, опосредованного МВР-специфичными аутоантителами (среднее значение для 6 животных, пмоль/мин/нмоль) Таким образом, гидролиз, опосредованный МВР-специфичными аутоантителами и проявления МДС, наиболее эффективно подавляется олигопептидом GGDRGAPKRGSGKDSHH дозозависимым образом.RGAPKRGSGKRGAPKRGSGKRGAPKRGSGKRGAPKRGSGKRGAPKRGSGKRGAPKRG SGK и олигопептид APKRGSGKDSH также активны в отношении подавления гидролиза, опосредованного МВР-специфичными аутоантителами и проявлений МДС. Пример 6. Лечение экспериментального PC (инфицирование вирусом Тейлера) с помощью олигопептидов и их комбинаций олигопептидов согласно настоящему изобретению Штамм BeAn мышиного вируса энцефаломиелита Тейлера (TMEV), используемый в данном исследовании, получали и размножали в клетках ВНК-21, выращенных в среде Дульбекко, модифицированной Иглом, с добавлением 7,5% донорской телячьей сыворотки. Для в.ч. инфекции в правое полушарие головного мозга вводили 30 мкл вирусного раствора (от 0,2106 до 6106 БОЕ) 6-8-недельным мышам SJL (8 животных в каждой группе) под наркозом с изофлураном. Клинические симптомы (проявления МДС) заболевания оценивали еженедельно по следующей шкале оценки: степень 0 - нет клинических проявлений, степень 1 - легкое проявление "ковыляющей походки" или "вялого хвоста", степень 2 - тяжелое проявление "ковыляющей походки", степень 3 - умеренный парез задних конечностей и степень 4 - тяжелый парез задних конечностей. В образцах сыворотки, взятых у животных, проводили количественную оценку ESAMBPCAA-опосредованного гидролиза МВР, как указано в примере 1. Как известно, олигопептиды GFGYGGRASDYKSAHK (SEQ ID NO: 3) и QGTLSKIFKLGGRDSRSGSPMARR (SEQ ID NO: 4) способны модулировать иммунную активность Т-клеток при PC, что обуславливает их эффективность в лечении PC. На день 14 после инфицирования мышей разделяли на 6 групп (30 мышей в каждой группе) и подвергали их лечению в течение 10 дней (14-24 дней) по следующей схеме: Группа 1 - контроль - ФСБ ежедневно путем подкожной инъекции Группа 2 - Копаксон ежедневно по 30 мкг ежедневно путем подкожной инъекции Группа 3 - олигопептид GGDRGAPKRGSGKDSHH по 20 мкг в день путем подкожной инъекции Группа 4 - олигопептид GFGYGGRASDYKSAHK по 20 мкг в день путем подкожной инъекции Группа 5 - олигопептид QGTLSKIFKLGGRDSRSGSPMARR по 20 мкг в день путем подкожной инъекции Группа 6 - олигопептид GGDRGAPKRGSGKDSHH на 20 мкг и олигопептид GFGYGGRASDYKSAHK по 20 мкг в день путем подкожной инъекции Группа 7 - олигопептид GGDRGAPKRGSGKDSHH по 20 мкг, олигопептид GFGYGGRASDYKSAHK по 20 мкг и олигопептид QGTLSKIFKLGGRDSRSGSPMARR по 20 мкг в день путем подкожной инъекции Группа 8 - олигопептид GFGYGGRASDYKSAHK по 20 мкг и олигопептид QGTLSKIFKLGGRDSRSGSPMARR по 20 мкг в день путем подкожной инъекции Результаты представлены на фиг. 5 и в табл. 5 ниже. Таблица 5. Влияние проводимого лечения на проявления болезни и степень гидролиза MBP,опосредованного аутоантителами Таким образом, гидролиз, опосредованный МВР-специфичными аутоантителами, и проявления МДС наиболее эффективно подавляются олигопептидом GGDRGAPKRGSGKDSHH в отдельности или в комбинации с олигопептидом GFGYGGRASDYKSAHK и/или олигопептидом QGTLSKIFKLGGRDSRSGSPMARR. Олигопептиды GFGYGGRASDYKSAHK и олигопептид QGTLSKIFKLGGRDSRSGSPMARR в отдельности или в комбинации обладают умеренным терапевтическим эффектом и не оказывает влияние на гидролиз, опосредованный МВР-специфичными аутоантителами. Комбинация GGDRGAPKRGSGKDSHH с GFGYGGRASDYKSAHK и QGTLSKIFKLGGRDSRSGSPMARR обладает слабым благоприятным терапевтическим эффектом. Важно отметить, что пептид GGDRGAPKRGSGKDSHH и его комбинация с олигопептидом GFGYGGRASDYKSAHK и/или олигопептидом QGTLSKIFKLG- 10024832GRDSRSGSPMARR также обладает предупреждающей развитие заболевания (профилактической) активностью. Пример 7. Подавление гидролиза, опосредованного МВР-специфичными аутоантителами, и лечение PC путем введение в кровь пациента гибридных белков согласно настоящему изобретению: Три гибридных белка, имеющих следующие формулы, были синтезированы с применением бесклеточной системы трансляции ABNOVA (www.abnova.tw): 1)GAPKRGSGKYGGRASDYKSGTLSKIFKLGGRDSRRGAPKRGSGKYGGRASDYKSGTLSKIFKLGGRDSR 3) GGDRGAPKRGSGKDSHHGFGYGGRASDYKSAHKQGTLSKIFKLGGRDSRSGSPMARR Таким образом, эти гибридные белки включают последовательности SEQ ID NO: 2, SEQ ID NO: 3,SEQ ID NO: 4, соединенные в различном порядке. Все три олигопептида присоединяли к CNBr-активированным сефарозным гранулам (Pharmacia) по 0,1 мг каждого олигопептида на 1 мл гранул в асептических условиях. После это сефарозу с присоединенными олигопептидами тщательно промывали забуференным 0,01 М Трис раствором 1,14 М NaCl, pH 8,0, содержащим 10 мМ ЭДТА, для удаления нековалентно связанных веществ и упаковывали в 400 мл колонки. В случае аутоантител ESAMBPCAA аферез проводили в Санкт-Петербургской Медицинской академии на кафедре неврологии. Авторами изобретения был проведен аферез ESAMBPCAA у 18-летнего пациента с быстро прогрессирующей тяжелой формой вторичного прогрессирующего PC, признанного устойчивым к традиционной терапии (кортикостероиды и иммунодепрессанты). Пациент прошел 5 циклов афереза, по одному циклу в неделю. Плазму пациента отделяли с помощью сепаратора плазмы с непрерывным потоком, Cobe Spectra, США. Ток крови варьировал от 50 до 70 мл/мин. Также добавляли гепарин в виде первоначального болюса 5000 ед., далее на первом этапе 50 ед./мин с помощью насоса. Затем плазму промывали через сефарозную колонку и оставшуюся часть крови возвращали пациенту. Поток плазмы через сефарозную колонку контролировали с помощью автоматизированного устройства для адсорбции-десорбции ADA-Medicap. После прохождения через колонку плазму возвращали пациенту. В каждом цикле обрабатывали 3000 мл плазмы. Показатель по шкале EDSS снизился со значения 6 до первого афереза до 5,5 через две недели после последнего цикла. Контрольный анализ путем МРТ, проведенный через один месяц после последнего цикла, показал стабилизацию предыдущих поражений при сокращении двух поражений. Новых очагов не было обнаружено. Степень гидролиза, опосредованного МВР-специфичными аутоантителами, определяли, как указано в примере 1, до и через две недели после последнего цикла афереза. Данные представлены в табл. 6 ниже. Таблица 6. Подавление гидролиза, опосредованного МВР-специфичными аутоантителами,после проведения лечения Таким образом, воздействие на кровь пациента с PC гибридных белков согласно настоящему изобретению подавляет активность ESAMBPCAA и обеспечивает эффективное лечение PC. Кроме того, были получены некоторые другие гибридные белки, содержащие SEQ ID NO: 2, SEQID NO: 3, SEQ ID NO: 4, соединенные в другом порядке (с помощью пептидных и непептидных линкеров), и успешно протестированы на способность подавлять активность ESAMBPCAA и способность облегчать симптомы PC и снижать биомаркер PC. Пример 7. Фармацевтическая композиция, содержащая фрагменты олигопептида Три олигопептида, имеющие следующие формулы: GGDRGAPKRGSGKDSHH, GFGYGGRASDYKSAHK и QGTLSKIFKLGGRDSRSGSPMARR, были синтезированы в лаборатории твердофазного органического синтеза (Институт биоорганической химии им М.М. Шемякина и Ю.А. Овчинникова РАН), фосфолипиды были приобретены в Sigma-Aldrich и Avanti Polar Lipids. 50 г смеси яичного фосфатидилхолина (ФХ), диолеоил-фосфатидилхолина (ДОФХ) и 1,2-диолеоил-3-триметиламмоний-пропана(ДОТАП) (в молярном соотношении 4:2:1) растворяли в хлороформе, затем хлороформ удаляли путем испарения. Олигопептиды 1, 2 и 3 растворяли в фосфатно-солевом буфере (PBS), рН 7,4 при концентрации каждого отдельного олигопептида 5 г/л (15 г/л суммарного белка). Липидную пленку в сосуде для выпаривания регидратировали путем смешивания с 10 л раствора ФСБ-пептиды и перемешивания в течение 30 минут при 40 С. Полученную эмульсию липид/белок переносили в 10 мл ампулы и лиофилизировали. Сухой порошок солюбилизировали "ex-tempore" с 5 мл воды для инъекций (ВДИ) с образованием больших мультиламеллярных липосом (МЛЛ), содержащих указанные олигопептиды. Пример 8 Лечение пациентов с возвратно-ремиттирующим PC с помощью перорального введения липосомных составов олигопептидов Исследование проводили в период с апреля 2003 года по июнь 2005 года в Санкт-Петербургской Медицинской академии на кафедре неврологии. При одобрении местного комитета по этике в общей сложности в испытание были включены 15 пациентов (5 мужчин и 10 женщин со средним возрастом 32 года) с ремиттирующим PC (диагностированным в соответствии с критериями Постера и Макдональда),имеющих по меньшей мере два зафиксированных документально рецидива в течение двух последних лет и имеющих показатель по шкале EDSS (Расширенная шкала инвалидизации) Куртцке от 0 до 5,5 . Пациентам вводили ежедневно путем перорального приема липосомы (МЛЛ), изготовленные, как описано в примере 8 по 0,5 мг белка на кг массы тела. Лечение проводили в качестве непрерывной монотерапии ежедневно в течение 2 лет. Показатели по шкале EDSS проверяли раз в два месяца. Проверку с помощью МРТ мозга в отношении активных очагов демиелинизации (АОД) проводили один раз в два месяца. Анализ частоты и продолжительности рецидивов проводили в конце 2-летнего периода наблюдения. Подсчет клеток крови,активность ESAMBPCAA, биохимические показатели крови и иммунологические показатели проверяли в начале и в конце исследования. Все 15 пациентов имели стабильные показатели по шкале EDSS в течение первых 6 месяцев лечения. Средняя частота рецидивов снизилась с 2,7 в год с момента начала лечения до 1,5 в год в конце периода лечения. В течение 2-летнего последующего врачебного наблюдения у 11 пациентов не были рецидивов. У 6 пациентов (40%) число АОД было снижено к концу периода лечения. У 7 пациентов (47%) наблюдалась стабилизация имеющегося числа АОД. У 2 пациентов (13%) число АОД возросло. Никаких неблагоприятных эффектов, связанных с препаратами настоящего изобретения, не было выявлено. Иммунологические показатели крови и биохимические показатели клеток крови существенно не изменились к концу периода лечения. Данные представлены в табл. 7. Таблица 7. Иммунологические, клеточные и биохимические показатели крови в начале и в конце лечения Было отмечено снижение степени гидролиза, опосредованного МВР-специфичными аутоантителами, и это соответствовало значительному достигнутому лечебному эффекту. Таким образом, пероральный прием олигопептидов в соответствии с настоящим изобретением производит благоприятный терапевтический эффект, связанный со снижением активности ESAMBPCAA. В сравнении с доступными ретроспективными данными для существующих способов лечения, результаты лечения согласно настоящему изобретению показывают лучшие результаты, чем для бета-интерферона, представляющего собой существующий стандарт терапии PC. Сравнительная табл. 8 приведена ниже. Таблица 8. Сравнительные данные по клинической эффективности доступных в настоящее время стандартных режимов лечения рассеянного склероза и результаты лечения согласно настоящему изобретению в соответствии с примером 8 Вышеизложенное описание приведено для иллюстрации и описания настоящего изобретения, но не является исчерпывающим или ограничивающим изобретение до конкретных описанных характеристик. Возможны различные модификации и изменения, которые могут быть осуществлены на основании вышеприведенного описания или при реализации изобретения на практике. Таким образом, необходимо отметить, что объем изобретения определяется пунктами формулы изобретения и их эквивалентами.- 13 ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ НУКЛЕОТИДОВ И/ИЛИ АМИНОКИСЛОТ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ РАССЕЯННОГО СКЛЕРОЗА ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Олигопептид, связывающий гидролизующие аутоантитела к основному белку миелина MBP(ESAMBPCAA), имеющий аминокислотную последовательность GGDRGAPKRGSGKDSHH (SEQ IDNO: 2). 2. Фармацевтическая композиция для лечения рассеянного склероза, содержащая терапевтически эффективное количество олигопептида по п.1 в качестве активного ингредиента и фармацевтически приемлемый носитель, наполнитель или систему доставки активного ингредиента. 3. Фармацевтическая композиция по п.2, дополнительно содержащая по меньшей мере один олигопептид, выбранный из олигопептидов с последовательностями SEQ ID NO: 3 и SEQ ID NO: 4. 4. Фармацевтическая композиция по п.3, отличающаяся тем, что она содержит олигопептид по п.1 и олигопептиды с последовательностями SEQ ID NO: 3 и SEQ ID NO: 4. 5. Фармацевтическая композиция по п.3 или 4, в которой олигопептиды имеют форму солей. 6. Фармацевтическая композиция по п.5, в которой соли представляют собой ацетаты. 7. Гибридный пептид, связывающий гидролизующие аутоантитела к основному белку миелинаMBP (ESAMBPCAA), состоящий из олигопептида по п.1 (SEQ ID NO: 2), соединенного в любом порядке пептидным или непептидным линкером с олигопептидом с последовательностью SEQ ID NO: 3 и/или с олигопептидом с последовательностью SEQ ID NO: 4. 8. Фармацевтическая композиция для лечения рассеянного склероза, содержащая терапевтически эффективное количество гибридного пептида по п.7 в качестве активного ингредиента и фармацевтически приемлемый носитель, наполнитель или систему доставки активного ингредиента. 9. Способ лечения или предотвращения рассеянного склероза у субъекта, нуждающегося в этом,включающий введение субъекту композиции по любому из пп.2-6 или 8. 10. Применение композиции по любому из пп.2-6 или 8 для получения лекарственного средства для лечения рассеянного склероза.
МПК / Метки
МПК: C07K 14/47, A61K 39/00
Метки: лечения, гидролизующие, миелина, композиции, олигопептид, основному, связывающий, рассеянного, аутоантитела, способ, белку, склероза
Код ссылки
<a href="https://eas.patents.su/18-24832-oligopeptid-svyazyvayushhijj-gidrolizuyushhie-autoantitela-k-osnovnomu-belku-mielina-mbp-kompozicii-i-sposob-lecheniya-rasseyannogo-skleroza.html" rel="bookmark" title="База патентов Евразийского Союза">Олигопептид, связывающий гидролизующие аутоантитела к основному белку миелина mbp, композиции и способ лечения рассеянного склероза</a>
Предыдущий патент: Буровая жидкость для нефтяных скважин
Следующий патент: Огнеупорный блок и стекловаренная печь
Случайный патент: Эсциталопрамгидробромид, его применение и фармкомпозиция