Способы продуцирования антител из плазматических клеток
Формула / Реферат
1. Способ продуцирования антитела, включающий стадии, на которых:
(i) культивируют CD138-положительные плазматические клетки в ограниченных количествах и поддерживают живыми по меньшей мере 30% указанных плазматических клеток в течение по меньшей мере 5 дней;
(ii) получают указанное антитело из указанных культивируемых плазматических клеток,
где число культивируемых плазматических клеток составляет 25 или меньше и при этом плазматические клетки культивируют в культуральной среде, содержащей экзогенный компонент, увеличивающий выживание плазматических клеток.
2. Способ по п.1, отличающийся тем, что число культивируемых плазматических клеток составляет 1.
3. Способ по п.1 или 2, отличающийся тем, что антитело представляет собой человеческое антитело и плазматические клетки являются человеческими плазматическими клетками.
4. Способ по любому из пп.1-3, отличающийся тем, что выживание плазматических клеток увеличивают на короткий период времени и в котором короткий период времени составляет от примерно 5 до примерно 7 дней.
5. Способ по любому из пп.1-3, отличающийся тем, что выживание плазматических клеток увеличивают на длительный период времени и в котором длительный период времени составляет по меньшей мере 10 дней.
6. Способ по любому из пп.1-3 или 5, отличающийся тем, что выживание плазматических клеток увеличивают по меньшей мере на 20 дней или по меньшей мере на 30 дней.
7. Способ по любому из пп.1-4, отличающийся тем, что экзогенный компонент, увеличивающий выживание плазматических клеток, содержит лиганд рецептора, экспрессируемого плазматической клеткой.
8. Способ по любому из пп.1-4 или 7, отличающийся тем, что экзогенный компонент содержит один или несколько лигандов, выбранных из группы, состоящей из IL-5, IL-6, фактора стромальных клеток-1 (SDF-1), TNF-α, лигандов CD44 и их комбинаций.
9. Способ по любому из пп.1-7, отличающийся тем, что экзогенный компонент содержит неплазматическую клетку и в котором неплазматическая клетка представляет собой мезенхимальную стромальную клетку, фибробласт или остеокласт.
10. Способ продуцирования антитела или фрагмента антитела, включающий стадии, на которых:
a) культивируют ограниченное число плазматических клеток в соответствии со способом по любому из пп.1-9;
b) идентифицируют культуры, продуцирующие антитело с желательной характеристикой;
c) выделяют нуклеиновую кислоту, кодирующую указанное антитело;
d) экспрессируют указанную нуклеиновую кислоту в клетке-хозяине.
11. Способ по любому из пп.1-10, отличающийся тем, что дополнительно включает проведение функциональных анализов для определения функции антитела или фрагмента антитела, анализов связывания для определения специфичности связывания антитела или фрагмента антитела или эпитопа, распознаваемого антителом или фрагментом антитела, и/или анализов нейтрализации для определения способности антитела или фрагмента антитела нейтрализовать токсин или патоген.

Текст
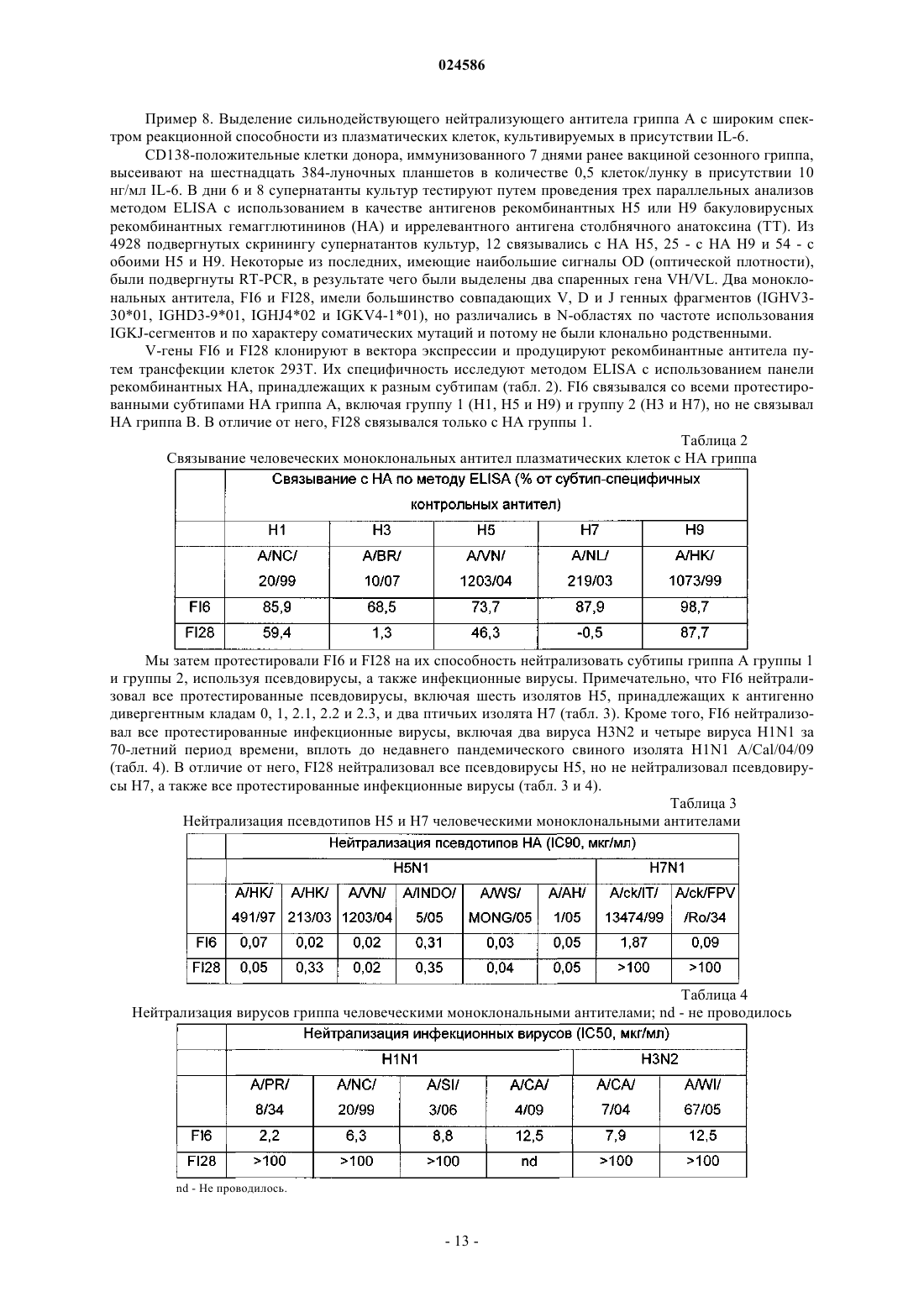
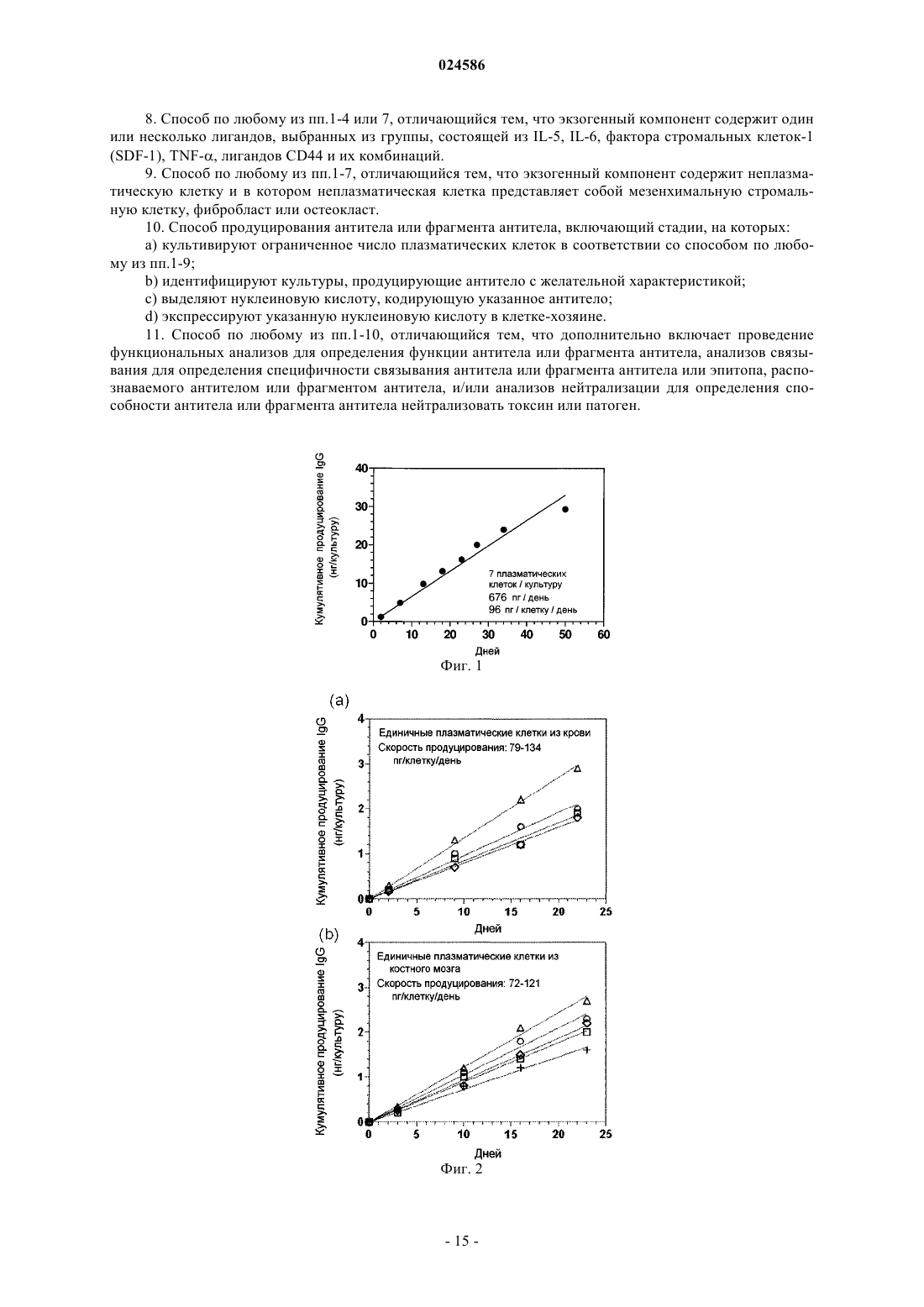
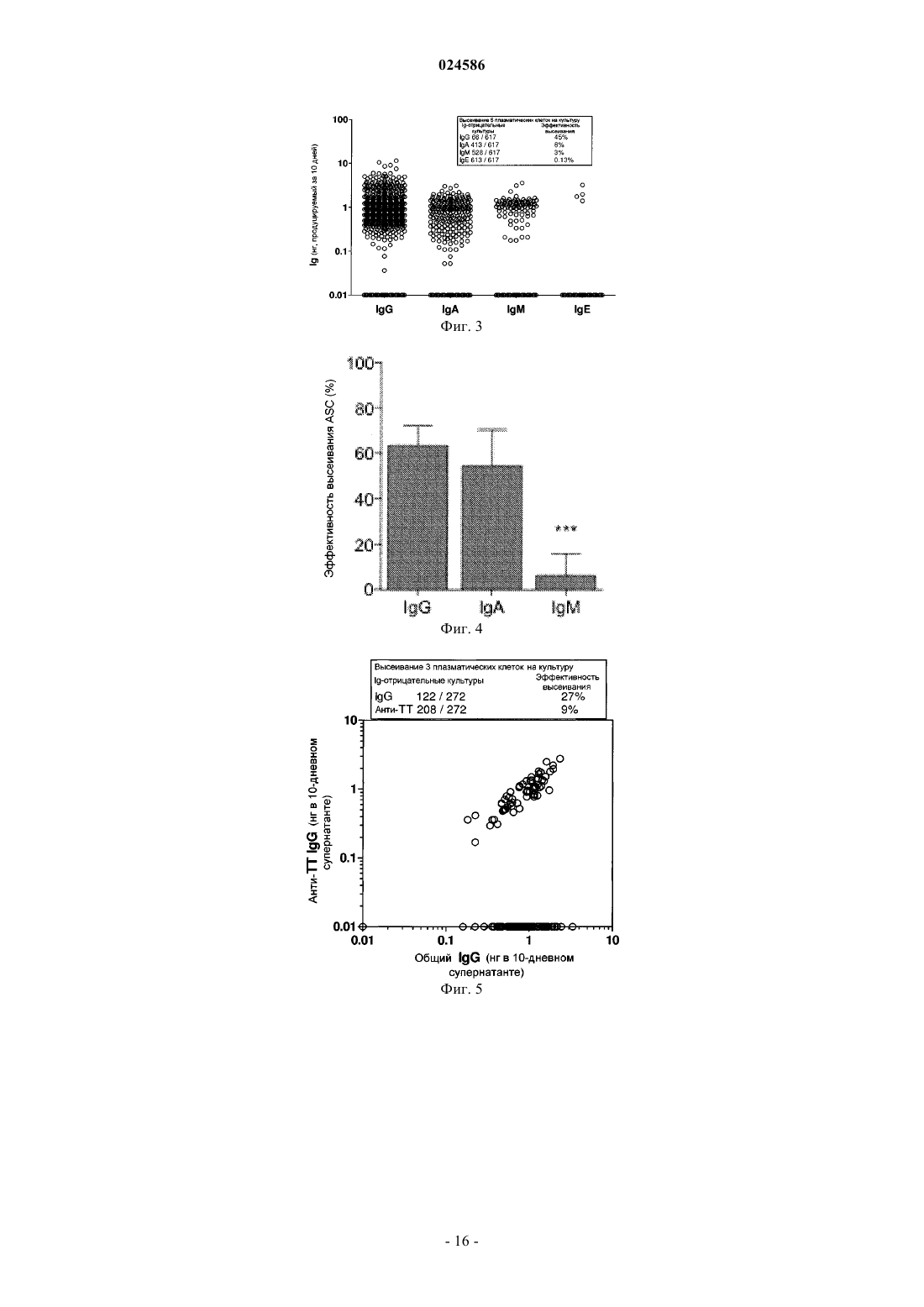
СПОСОБЫ ПРОДУЦИРОВАНИЯ АНТИТЕЛ ИЗ ПЛАЗМАТИЧЕСКИХ КЛЕТОК Изобретение относится к способам продуцирования антител, включая моноклональные антитела,включающим культивацию ограниченного числа плазматических клеток. Оно также относится к способам идентификации антител путем проведения анализов антител, продуцируемых культивируемыми плазматическими клетками, для определения их функции, специфичности связывания, специфичности к эпитопам и/или их способности нейтрализовать токсин или патоген. Изобретение также относится к антителам и фрагментам антител, продуцируемым с помощью способов по изобретению, а также к способам использования антител и фрагментов антител.(71)(73) Заявитель и патентовладелец: ИНСТИТУТ ФО РЕСЧ ИН БИОМЕДИЦИНЕ (CH) Настоящая заявка претендует на приоритет заявки GB0819376.5, поданной 22 октября 2008 г.,предварительной заявки США 61/181582, поданной 27 мая 2009 г., заявки РСТPCT/US2009/051851 и заявки США 12/509731, обе поданные 27 июля 2009 г. Известный уровень техники Плазматические клетки представляют собой терминально дифференцированные непролиферирующие клетки, которые секретируют антитела в очень высоких количествах (тысячи молекул в секунду, что соответствует примерно 30-50 пг на клетку в день). Выделение антител, например моноклональных антител, из плазматических клеток основано на клонировании и экспрессии генов иммуноглобулина. Оно может быть осуществлено с использованием библиотек фагового дисплея "запутанных" (scrambled) VH и VL генов, выделенных из плазматических клеток, или путем выделения спаренных VH и VL генов из отдельных плазматических клеток с помощью ПЦР единичных клеток. Однако для скрининга антител, продуцируемых плазматическими клетками,гены иммуноглобулина должны быть клонированы и экспрессированы в рекомбинантной форме с целью определения специфичности и функциональных свойств кодированного антитела. Этот способ является затруднительным, дорогим, трудоемким, неадаптируемым для повышения производительности и неэффективным для выделения редких антител, которые продуцируются незначительной частью общего репертуара плазматических клеток. Соответственно существует потребность в определении более эффективного способа, который может быть адаптирован для высокопроизводительного выделения и скрининга антител, например моноклональных антител, из плазматических клеток. Сущность изобретения Изобретение основано, частично, на открытии эффективного и высокопроизводительного способа продуцирования антител из плазматических клеток, который позволяет охарактеризовать антитела без использования клонирования и экспрессии генов иммуноглобулина. Антитела, продуцируемые с использованием настоящего изобретения, могут быть охарактеризованы путем проведения множественных скринингов, включая связывание, функциональный анализ и/или анализы нейтрализации. Изобретение обеспечивает способ идентификации редких антител, продуцируемых плазматическими клетками. Соответственно в одном аспекте изобретения предусматривается способ продуцирования антитела из плазматических клеток, включающий культивацию плазматических клеток в ограниченных количествах. В одном варианте исполнения предусматривается способ продуцирования моноклонального антитела из плазматических клеток, включающий культивацию плазматических клеток в культурах, выделенных из одной клетки. Способы по изобретению могут дополнительно включать характеризацию антител или фрагментов антител. Характеризация антител или фрагментов антител включает, без ограничений,проведение функциональных анализов для определения функции антитела или фрагмента антитела, анализов связывания для определения специфичности связывания антитела или фрагмента антитела или эпитопа, распознаваемого антителом или фрагментом антитела, и/или анализов нейтрализации для определения способности антитела или фрагмента антитела нейтрализовать токсин или патоген. В другом варианте исполнения предусматривается способ продуцирования антитела или фрагмента антитела. Способ включает культивацию ограниченного числа плазматических клеток, идентификацию культур, продуцирующих антитело с желательной характеристикой, выделение нуклеиновой кислоты,кодирующей продуцируемое антитело, и экспрессию нуклеиновой кислоты в клетке-хозяине. В другом аспекте изобретения предусматривается выделенное антитело или фрагмент антитела,продуцируемые с помощью способа по изобретению. Изобретение также предусматривает способы диагностики и/или лечения различных состояний или болезней с использованием выделенных антител или фрагментов антител по изобретению. Краткое описание чертежей Фиг. 1 изображает кумулятивное продуцирование IgG плазматическими клетками CD138+, выделенными из периферической крови и культивируемыми на монослоях мезенхимальных стромальных клеток в течение 50 дней. Фиг. 2 изображает кумулятивное продуцирование IgG плазматическими клетками CD138+ в культурах, содержащих единичные плазматические клетки, полученные из (А) периферической крови и (В) костного мозга. Фиг. 3 изображает результаты тестирования супернатантов 10-дневной культуры плазматических клеток с высоким содержанием CD138, полученных из периферической крови и культивируемых на монослоях мезенхимальных стромальных клеток, на присутствие IgG, IgA, IgM и IgE. Фиг. 4 изображает эффективность посева секретирующих антитела клеток (ASC), продуцирующихIgG, IgA или IgM антитела при культивации на клетках hMSC-TERT, выраженную в процентной доле плазматических клеток, выживающих в течение достаточно длительного периода времени для того, чтобы продуцировать детектируемые количества антител в супернатанте. Фиг. 5 изображает идентификацию плазматических клеток, секретирующих столбнячный анатоксин-специфический IgG, из плазматических клеток, выделенных из периферической крови, взятой через 7 дней после бустер-иммунизации столбнячным анатоксином (ТТ). Фиг. 6 изображает связывание со столбнячным анатоксином рекомбинантного продуцируемого антитела путем клонирования и экспрессии генов VH и VL, полученных от культивируемой плазматической клетки, взятой из крови донора через 10 лет после вакцинации столбнячным анатоксином. Детальное описание изобретения Изобретение основано на открытии эффективного и высокопроизводительного способа продуцирования антител из плазматических клеток, позволяющего производить характеризацию антител без использования клонирования и экспрессии генов иммуноглобулина. В одном аспекте изобретение предусматривает способ продуцирования антитела из плазматических клеток, включающий культивацию плазматических клеток в ограниченных количествах. Антитела, продуцируемые с использованием настоящего изобретения, могут быть удобно охарактеризованы посредством множественных скринингов,включая анализы связывания, функциональные анализы и/или анализы нейтрализации, которые могут быть проведены даже in situ, т.е. в лунках, где культивировались плазматические клетки. В используемом тут значении, термин "плазматическая клетка" включает все первичные антителосекретирующие клетки (ASC), присутствующие в периферической крови, костном мозгу, тканях или биологических жидкостях, или генерируемые in vitro В-клетками. Свежеобразованные плазматические клетки называются "плазмобластами". Образующиеся в природных условиях плазмобласты обычно присутствуют в крови, особенно в периферической крови. Плазмобласты также могут быть получены invitro, путем стимуляции В-клеток различными раздражителями, включая поликлональные активаторы,такие как агонисты TLR (толл-подобных рецепторов). Здесь, термин "плазматическая клетка" или "плазматические клетки" должен рассматриваться как включающий "плазматические клетки", "плазмобласты" и ASC. Теоретически, любое число плазматических клеток может культивироваться в культуральной среде для продуцирования и идентификации антитела с желательными характеристиками. Практически, число плазматических клеток, которые могут культивироваться, ограничено имеющимися технологиями клонирования и экспрессии множественных генных последовательностей VH и VL и их комбинаций, присутствующих в культуре поликлональных клеток. В одном варианте исполнения "ограниченное число плазматических клеток" относится к числу плазматических клеток, составляющему примерно 100 или меньше, например 90 или меньше, 80 или меньше, 70 или меньше, 60 или меньше, 50 или меньше, 45 или меньше, 40 или меньше, 35 или меньше, 30 или меньше, 25 или меньше, 20 или меньше, 17 или меньше,15 или меньше, 12 или меньше, 10 или меньше, 9 или меньше, 8 или меньше, 7 или меньше, 6 или меньше, 5 или меньше, 4 или меньше, 3 или меньше, 2 или меньше или 1 или меньше. В одном варианте исполнения предусматривается способ продуцирования антитела из плазматических клеток, включающий культивацию плазматических клеток при низкой концентрации плазматических клеток в культуре. Низкая концентрация плазматических клеток в культуре обычно составляет от примерно 1 до примерно 10, или от примерно 1 до примерно 15, или от примерно 1 до примерно 20, или от примерно 1 до примерно 25, или от примерно 1 до примерно 30, или от примерно 1 до примерно 40,или от примерно 1 до примерно 50, или от примерно 1 до примерно 60, или от примерно 1 до примерно 70, или от примерно 1 до примерно 80, или от примерно 1 до примерно 90, или от примерно 1 до примерно 100 клеток в культуре. В другом варианте исполнения предусматривается способ продуцирования антитела из плазматических клеток, включающий культивацию плазматических клеток, где плазматические клетки разбавлены до низкой концентрации клеток в культуре. В еще одном варианте исполнения предусматривается способ продуцирования антитела из плазматических клеток, включающий культивацию пониженного числа плазматических клеток. Число плазматических клеток, выделенных, например, из биологического источника, может быть снижено, как описано ниже. В используемом тут значении, "пониженное число плазматических клеток" используется взаимозаменяемо с "ограниченным числом плазматических клеток",как описано выше. Методики получения числа желательных клеток в культуре хорошо известны специалистам. Такие методики включают, без ограничений, серийное разведение, или сортировку и сбор (deposition) клеток. Например, культуры, содержащие ограниченное или пониженное число плазматических клеток, могут быть получены путем отбора (deposition) единичной клетки с помощью клеточного сортера или путем разведения суспензии плазматических клеток достаточным количеством культуральной среды, так чтобы 1, 2, 3 или больше клеток, например 5, 10, 15, 20, 25, 30, 40, 50, 60, 70, 80, 90 или 100 клеток, приходилось на лунку микротитровального культурального планшета. В одном варианте исполнения культивируется единичная плазматическая клетка. Учитывая моноклональный характер антител, продуцируемых единичной плазматической клеткой, культивация плазматических клеток в культуре, выделенной из одной клетки, приведет к получению популяции моноклональных антител. Таким образом, в одном варианте исполнения предусматривается способ продуцирования моноклонального антитела из плазматических клеток, включающий культивацию плазматических клеток в культурах, выделенных из одной клетки. В используемом тут значении, "культура, выделенная из одной клетки", используется взаимозаменяемо с "культивацией единичной плазматической клетки" и относится к культуре, содержащей, в сред-2 024586 нем, единичную плазматическую клетку. Таким образом, на многолуночном планшете, например 96 луночном, 384-луночном планшете или 1536-луночном планшете, большинство лунок будет содержать единичную плазматическую клетку, некоторые не будут содержать плазматических клеток и некоторые другие будут содержать несколько плазматических клеток. В некоторых вариантах исполнения, плазматические клетки могут культивироваться в культурах, в которых на лунку приходится, в среднем, менее 1 клетки, например 0,8, 0,6, 0,5, 0,3 или 0,1 клеток/лунку. Методики получения единичной клетки в культуре похожи на описанные выше, за исключением того, что в данном случае в среднем на лунку микротитровального культурального планшета приходится 1 или менее 1 клетки. Изобретение дополнительно предусматривает способ продуцирования антитела или фрагмента антитела. Способ включает культивацию ограниченного числа плазматических клеток в соответствии с любым способом по изобретению, идентификацию культур, продуцирующих антитело с желательной характеристикой, выделение нуклеиновой кислоты, кодирующей продуцируемое антитело, и экспрессию нуклеиновой кислоты в клетке-хозяине. В отличие от В-клеток памяти, которые могут быть расширены в клоны антитела-продуцирующих клеток иммортализацией (Traggiai et al., 2004, Nat Med 10:871-875; Lanzavecchia et al., 2007, Curr OpinBiotechnol. 18:523-528), плазматические клетки не делятся и не могут быть стимулированы или иммортализованы. Поэтому для обеспечения сколько-нибудь плодотворного использования этих "фабрик антител", плазматические клетки должны поддерживаться живыми в культуре. Плазматические клетки непрерывно продуцируют и секретируют антитела, и размер популяции антител поэтому увеличивается со временем. Хотя in vivo плазматические клетки живут на протяжении очень длительных периодов времени, in vitro они не живут значительно более суток (экспериментальные данные не приведены). Соответственно изобретение предусматривает способ продуцирования антител путем культивации плазматических клеток, включая, без ограничений, единичной плазматической клетки, в культуральной среде, содержащей экзогенный компонент или компоненты, увеличивающие время выживания культивируемых плазматических клеток. В общем, выживание культивируемых плазматических клеток увеличивается на достаточный период времени, так чтобы антитело продуцировалось в количествах, необходимых для характеризации антитела, т.е. чтобы культуральная среда содержала достаточно антител для проведения скрининговых анализов, включая, без ограничений, анализы связывания, анализы нейтрализации или другие анализы, с помощью которых определяют функцию или иначе характеризуют антитела. Культуры, содержащие антитело желательной специфичности, могут быть затем выделены и гены иммуноглобулина могут быть амплифицированы, секвенированы и экспрессированы для продуцирования моноклинального антитела. Выживание плазматических клеток в культуре, включая, без ограничений, единичную плазматическую клетку, может быть увеличено на короткий период времени или на длительный период времени. В используемом тут значении, "короткий период времени" относится к периоду по меньшей мере от двух до примерно 9 дней, т.е. 2, 3, 4, 5, 6, 7, 8 или примерно 9 дней. В используемом тут значении, "длительный период времени" относится к периоду по меньшей мере 10 дней, например 10, 15, 20, 25, 30, 35, 40,45, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140 или примерно 150 дней. Хотя увеличение выживания плазматических клеток на короткий период времени не позволяет продуцировать такое же большое количество антител, как при увеличении выживания плазматических клеток на длительный период времени, увеличение выживания плазматических клеток на короткий период времени, как описано тут, является более простым, быстрым и экономичным и особенно пригодно для скрининга антитела с помощью чувствительных методов анализа. Увеличение выживания плазматических клеток на длительный период времени особенно пригодно в обстоятельствах, когда характеризация антител требует проведения множества скрининговых анализов или анализов с низкой чувствительностью. В одном варианте исполнения экзогенный компонент, присутствующий в культуральной среде,увеличивает выживание культивируемых плазматических клеток на короткий период времени. В другом варианте исполнения экзогенный компонент увеличивает выживание культивируемых плазматических клеток на длительный период времени. Экзогенный компонент может быть одним или несколькими лигандами для рецептора, экспрессируемого плазматической клеткой, или одной или несколькими неплазматическими клетками. Примеры лигандов для рецептора, экспрессируемого плазматическими клетками, пригодных для увеличения выживания культивируемых плазматических клеток, включают, без ограничений, цитокины,хемокины и другие лиганды. В одном варианте исполнения лиганд представляет собой IL-5, IL-6, фактор стромальных клеток-1 (SDF-1), TNF-, или лиганд для CD44, например иалуроновую (ialuronic) кислоту. В другом варианте исполнения экзогенный компонент содержит один или несколько лигандов, выбранных из группы, состоящей из IL-5, IL-6, фактора стромальных клеток-1 (SDF-1), TNF-, лигандов дляCD44, например иалуроновой кислоты, и их комбинаций, и является пригодным для увеличения выживания культивируемых плазматических клеток на короткий период времени или на длительный период времени. Примеры неплазматических клеток, пригодных для увеличения выживания культивируемых плазматических клеток, включают, без ограничений, мезенхимальные стромальные клетки, фибробласты или остеокласты. В одном варианте исполнения неплазматические клетки представляют собой мезенхимальные стромальные клетки, фибробласты или остеокласты, и являются пригодными для увеличения выживания культивируемых плазматических клеток на короткий период времени или на длительный период времени. В другом варианте исполнения неплазматические клетки представляют собой мезенхимальные стромальные клетки и являются пригодными для увеличения выживания культивируемых плазматических клеток на короткий период времени или на длительный период времени. Мезенхимальные стромальные клетки могут быть мезенхимальными стромальными клетками млекопитающих, включая, без ограничений, человеческие мезенхимальные стромальные клетки. Мезенхимальные стромальные клетки могут, необязательно, быть иммортализованы перед использованием в культуре. В одном варианте исполнения изобретения плазматические клетки культивируются, например, в культуре, полученной из одной клетки, в течение от примерно 3 до примерно 7 или от примерно 5 до примерно 9 дней в культуре, в присутствии одного или нескольких лигандов для рецептора, экспрессируемого плазматической клеткой. В другом варианте исполнения плазматические клетки культивируются, например, в культуре, полученной из одной клетки, в течение от примерно 5 до 7, или примерно 10,или примерно 15, или примерно 20, или примерно 25, или примерно 30, или примерно 35, или примерно 40, или примерно 45, или более 50 дней в культуре, в присутствии одного или нескольких типов неплазматических клеток. В еще одном варианте исполнения плазматические клетки культивируются, например, в культуре, полученной из одной клетки, в течение примерно 5-7, или примерно 10, или примерно 15, или примерно 20, или примерно 25, или примерно 30, или примерно 35, или примерно 40, или примерно 45, или более 50 дней в культуре, в присутствии мезенхимальных стромальных клеток. В еще одном варианте исполнения плазматические клетки культивируются, например, в культуре, полученной из одной клетки, в течение примерно 5-7, или примерно 10, или примерно 15, или примерно 20, или примерно 25, или примерно 30, или примерно 35 или примерно 40, или примерно 45, или примерно 50, или примерно 55 или примерно 60, или примерно 65, или более 70 дней в культуре, в присутствии одного или нескольких типов неплазматических клеток и одного или нескольких лигандов для рецептора, экспрессируемого плазматической клеткой. В одном варианте исполнения эффективность посева культивируемых клеток может составлять по меньшей мере примерно 30%, в другом варианте исполнения эффективность посева может составлять по меньшей мере примерно 40%, в другом варианте исполнения эффективность посева может составлять по меньшей мере примерно 50%, в другом варианте исполнения эффективность посева может составлять по меньшей мере примерно 55%, в другом варианте исполнения эффективность посева может составлять по меньшей мере примерно 60% или больше. В используемом тут значении термин "эффективность посева" относится к проценту плазматических клеток, выживающих в течение достаточно длительного периода времени для продуцирования детектируемых количеств антитела в супернатанте. Культивируемые плазматические клетки могут быть получены от любого желательного вида. В одном варианте исполнения плазматические клетки являются плазматическими клетками мыши, крысы,кролика, верблюда или обезьяны. В другом варианте исполнения культивируемые плазматические клетки являются человеческими плазматическими клетками, и продуцируемые антитела являются человеческими антителами. В еще одном варианте исполнения человеческие моноклональные антитела продуцируются путем культивации человеческих плазматических клеток в культурах, полученных из одной клетки. Плазматические клетки, например человеческие плазматические клетки, могут быть выделены из периферической крови человека. Такие человеческие плазматические клетки могут быть названы "плазматическими клетками периферической крови" или "циркулирующими плазматическими клетками". Плазматические клетки, например человеческие плазматические клетки, также могут быть выделены из костного мозга, тканей или из биологических жидкостей, включая, без ограничений, синовиальную жидкость, спинномозговую жидкость и экссудаты человека. Подразумевается, что термин "ткань" охватывает любую ткань, присутствующую в организме человека, и может включать сердечную ткань, нервную ткань, мышечную ткань, эпителий, соединительную ткань и лимфоидные органы, такие как вилочковая железа, селезенка и лимфатические узлы. Плазматические клетки обычно характеризуются по экспрессии CD138 и, необязательно, по дополнительной экспрессии CD27, CD38, CD9, CD44 и молекул МНС (главного комплекса гистосовместимости) класса II. В одном варианте исполнения клетки могут быть выделены из периферической крови,ткани, костного мозга или биологических жидкостей в соответствии с экспрессией CD138. Поверхностные маркеры, такие как CD27, CD38, CD9, CD44 и молекулы МНС класса II, также могут быть использованы в дополнение к CD138 для улучшения процедуры выделения и для идентификации подгрупп плазматических клеток (Arce et al., 2004, J. Leukoc Biol, 75:1022-1028). В другом варианте исполнения плазматические клетки могут быть выделены с помощью магнитных микробусин. В еще одном варианте исполнения плазматические клетки могут быть выделены с помощью магнитных микробусин, покрытых иммобилизованными антителами против CD138. В еще одном варианте исполнения обогащение плазматических клеток с помощью магнитных микробусин может быть дополнено сортировкой клеток. В одном варианте исполнения плазматические клетки могут быть выделены из периферической крови человеческого донора после вакцинации. Вакцинация относится к введению любого антигена, способного индуцировать иммунный ответ. Вакцина может быть любой известной в настоящее время вакциной, или стать доступной квалифицированным специалистам в данной области техники позднее, и включает, без ограничений, вакцины столбнячного анатоксина, гриппа, желтой лихорадки, столбнякадифтерии, гепатита В, оспы и рака. В другом варианте исполнения вакцинация может быть бустервакцинацией. Плазматические клетки могут быть выделены у донора через 4, 5, 6, 7, 8, 9, 10 или больше дней после вакцинации. В одном варианте исполнения плазматические клетки могут быть выделены у донора, реагирующего на известный патоген. В другом варианте исполнения плазматические клетки могут быть выделены у донора, реагирующего на неизвестный патоген. В дополнительном варианте исполнения плазматические клетки могут быть выделены у донора с аллергией. В еще одном варианте исполнения плазматические клетки могут быть выделены у донора со стабильным состоянием здоровья. В еще одном варианте исполнения плазматические клетки могут быть выделены у донора с аутоиммунным заболеванием. В другом варианте исполнения плазматические клетки могут быть получены in vitro путем стимулирования В-клеток. Такая стимуляция может быть осуществлена любым способом, известным специалистам, включая поликлональную или антиген-специфическую стимуляцию наивных или В-клеток памяти (Bemasconi et al., 2002, Science, 298:2199-2202). Способ по настоящему изобретению может быть использован для культивации плазматических клеток, секретирующих любые антитела любого изотипа. В одном варианте исполнения плазматические клетки могут быть плазматическими IgG-клетками, в другом варианте исполнения плазматические клетки могут быть плазматическими IgA-клетками, в другом варианте исполнения плазматические клетки могут быть плазматическими IgM-клетками, в другом варианте исполнения плазматические клетки могут быть плазматическими IgD-клетками и в дополнительном варианте исполнения плазматические клетки могут быть плазматическими IgE-клетками. В еще одном варианте исполнения выделенная популяция плазматических клеток может быть смешанной популяцией плазматических клеток, включающей два или больше изотипов. Выделенные человеческие плазматические клетки могут быть подсчитаны с помощью анализа методом ферментно-опосредованного иммуносорбентного ореола (ELISPOT) (Bernasconi et al., 2002, Science, 298:2199-2202). Этот анализ осуществляет визуализацию продукта, секретируемого клеткой, представляющей интерес, причем каждое пятно, продуцируемое при анализе, представляет единичную клетку. В одном варианте исполнения человеческие плазматические клетки могут быть высеяны как единичные клетки путем серийного разведения или путем отбора единичной клетки. В одном аспекте человеческие плазматические клетки могут быть высеяны как единичные клетки в присутствии мезенхимальных стромальных клеток. В другом варианте исполнения человеческие плазматические клетки могут быть высеяны как поликлональная культура. Плазматические клетки могут быть высеяны как культура поликлональных клеток в присутствии мезенхимальных стромальных клеток. Культура поликлональных человеческих плазматических клеток, альтернативно, может быть разделена на культуры, выделенные из одной клетки, методом серийного разведения. В другом аспекте культура поликлональных человеческих плазматических клеток может быть разделена на культуры, выделенные из одной клетки,путем отбора единичной клетки. Мезенхимальные стромальные клетки представляют собой фибробласт-подобные клетки, но обладают большим потенциалом дифференцировки, чем фибробласты, и способны дифференцироваться в остеобласты, хондроциты и жировые клетки. Мезенхимальные стромальные клетки существуют в виде гетерологичных популяций и образуют несущий остов ткани, в которой они обитают. В костном мозге мезенхимальные стромальные клетки необходимы для роста и дифференцировки гематопоэтических клеток и для поддержания лейкемических клеток. Первичные мезенхимальные стромальные клетки могут быть выделены в соответствующей среде и могут культивироваться на протяжении нескольких пассажей, однако только в течение ограниченного периода времени до проявления процессов старения. Трансдукция с помощью теломеразной обратной транскриптазы (TERT) использовалась для иммортализации мезенхимальных стромальных клеток, которые неограниченно растягиваются in vitro, сохраняя свою физиологическую скорость роста и функциональные характеристики. Мезенхимальные стромальные клетки, используемые в культурах, могут быть мезенхимальными стромальными клетками костного мозга. Мезенхимальные стромальные клетки могут быть мезенхимальными стромальными клетками млекопитающих, например человеческими мезенхимальными стромальными клетками. Мезенхимальные стромальные клетки для использования в способах по изобретению могут быть выделены из прилипающих клеток костного мозга путем культивации в пригодной среде. Такая среда может содержать гидрокортизон. Мезенхимальные стромальные клетки также могут быть получены из других тканей. Из практических соображений мезенхимальные стромальные клетки могут быть иммортализованы перед использованием в способах по изобретению. В используемом тут значении, "иммортализованный" означает, что мезенхимальные стромальные клетки обладают повышенной пролиферативнй способностью при сохранении всех характеристик, делающих их способными поддерживать плазматические клетки, включая способность к контакт-зависимому ингибированию роста. В одном варианте исполнения мезенхимальные стромальные клетки могут выживать в течение по меньшей мере примерно 1 недели после достижения стадии слияния. В другом варианте исполнения иммортализованные мезенхимальные стромальные клетки могут выживать в течение по меньшей мере примерно 2 недель после достижения стадии слияния, или в течение по меньшей мере примерно 3 недель после достижения стадии слияния,или в течение по меньшей мере примерно 4 недель или больше после достижения стадии слияния. Мезенхимальные стромальные клетки могут быть иммортализованы любыми средствами, известными специалистам. В одном варианте исполнения мезенхимальные стромальные клетки иммортализуют путем трансдукции геном теломеразной обратной транскриптазы. В другом варианте исполнения мезенхимальные стромальные клетки могут быть иммортализованы путем трансдукции геном TERT в соответствии со способом, описанным Mihara et al., 2003, Br J. Haematol 120: 846-849. Как было описано выше, изобретение предусматривает способ продуцирования антитела или фрагмента антитела. Способ включает культивацию ограниченного числа плазматических клеток, идентификацию культур, продуцирующих антитело с желательной характеристикой, выделение нуклеиновой кислоты, кодирующей продуцируемое антитело, и экспрессию нуклеиновой кислоты в клетке-хозяине. В используемом тут значении термины "фрагмент" и "фрагмент антитела" используются взаимозаменяемо для обозначения любого фрагмента антител по настоящему изобретению. В одном варианте исполнения фрагмент антитела сохраняет антиген-связывающую активность антитела. В другом варианте исполнения фрагмент антитела может включать 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 150, 200, 300, 400,500, 600, 700, 800, 900 или 1000 или больше последовательных аминокислот. Типичные примеры фрагментов антител могут включать один или несколько из фрагментов Fc, Fab, Fab', F(ab')2, Fv, scFv, их тяжелую цепь, легкую цепь, шарнирную область, антигенсвязывающий сайт, одноцепочечные антитела или любой их участок. В используемом тут значении термин "нуклеиновая кислота" охватывает все формы нуклеиновой кислоты, включая, без ограничений, геномную ДНК, кДНК, и мРНК. Клонирование и гетерологичная экспрессия антитела или фрагмента антитела могут быть осуществлены с использованием обычных методов молекулярной биологии и рекомбинантных ДНК, доступных квалифицированным специалистам в данной области техники (Wrammert et al., 2008 Nature 453, 667-671 и Meijer et al., 2006 J. Mol. Biol. 358,764-772). Такие методики полностью описаны в литературе, например в Sambrook, 1989 Molecular Cloning; A Laboratory Manual, Second Edition. Для выделения последовательностей VH/VL и экспрессии может быть использован способ Tiller et al., J. Immunol Methods 2008 329:112-124. В одном варианте исполнения антитело экспрессируют с использованием пригодного вектора или вируса в эукариотической клетке. Эукариотическая клетка может быть клеткой СНО, 293 Т, 293F или дрожжевой клеткой. В другом варианте исполнения антитело экспрессируют с использованием пригодного вектора или фага в прокариотической клетке. Прокариотическая клетка может быть бактериальной клеткой, например клеткой E. coli. В дополнительном варианте исполнения система гетерологичной экспрессии может быть бесклеточной системой. Антитела и фрагменты антител, продуцируемые с помощью способов по изобретению, могут быть легко выделены с использованием хорошо разработанных методологий (Coligan et al., Eds., Current Protocol in Immunology 1:2.7). В одном варианте исполнения антитела или фрагменты антител по изобретению, включая моноклональные антитела или фрагменты антител, могут быть выделены из супернатанта культур путем центрифугирования или методом аффинной хроматографии. В другом варианте исполнения антитела или фрагменты антител могут быть выделены в соответствии с их специфичностью связывания. Например, антитела может быть выделены путем нанесения на твердую подложку, содержащую соответствующий иммобилизованный антиген. В дополнительном варианте исполнения антитела могут быть выделены с использованием анти-IgG, -IgE, -IgA, -IgD или -IgM антитела, которое, в некоторых случаях, может быть иммобилизованным. Плазма, секретирующая Ig или специфические антитела, может быть выделена иммуноаффинным способом. Сначала секретируемый продукт может быть зафиксирован на поверхности секреторной клетки с помощью пригодных ковалентно присоединенных связывающих реагентов. Затем связанные продукты могут быть выявлены с помощью флуоресцентно меченого вторичного антитела или антигена(Manz et al., 1998 Int Immunol 10, 1703-1711). Характеризация антитела. Плазматические клетки не экспрессируют поверхностные иммуноглобулины, и потому не могут селектироваться в соответствии с изотипом или антигенной специфичностью. Поэтому антитела, продуцируемые плазматической клеткой, должны быть выделены для проведения характеризации. В настоящее время, существует два способа, в основном используемых специалистами для получения человеческих моноклональных антител из плазматических клеток. Первым из них является скрининг дисплейных биб-6 024586 лиотек антител, полученных из цельного костного мозга иммунных доноров (Williamson et al., 1993 ProcNatl Acad Sci USA 90, 4141-4145). Однако этот способ ограничен доступностью образцов костного мозга. Второй способ предусматривает выделение циркулирующих плазматических клеток после бустериммунизации с последующим выделением генов Ig из индивидуальных плазматических клеток методом ПЦР единичных клеток (Wrammert et al., 2008 Nature 453, 667-671, и Meijer et al., 2006 J. Mol. Biol. 358,764-772). Этот способ основан на том факте, что через 6-8 дней после бустер-иммунизации существенная часть циркулирующих плазматических клеток являются специфическими к иммунизирующему антигену. Однако этот подход требует проведения большой работы по клонированию и экспрессии гена до того,как можно будет оценить специфичность антитела, и потому является не очень практичным, когда ответ плазматических клеток направлен против множественных антигенов, таких как комплексные патогены. Поэтому разработка системы долговременной культуры для человеческих плазматических клеток является особенно полезной для выделения достаточного количества антитела для проведения in vitro анализов связывания, функциональных анализов и других методов характеризации антител, с целью обеспечения возможности выбора плазматических клеток, продуцирующих представляющие интерес антитела. Альтернативные способы выделения антител из плазматических клеток или других антителосекретирующих клеток основаны на микроманипуляциях и включают первую стадию, на которой клетки высеивают на полутвердую среду (Harriman WD et al., J. Immunol Methods 341; 135-145 2009) или наносят на микроматричные чипы (Jin A et al., Nat Medicine 15; 1088 2009) и секретируемые антитела детектируют in situ с помощью флуоресцентных зондов. После идентификации, плазматическую клетку выделяют путем микроманипулирования и гены VH и VL амплифицируют и секвенируют. Эти способы, основанные на кратковременной культуре и локальном детектировании секретируемого антитела, требуют специального оборудования для микроманипуляций с секретирующими антитела клетками и непригодны для тестирования антител на функциональные свойства, такие как нейтрализация вирусов или токсинов. Способы по настоящему изобретению не основаны на и не требуют каких-либо микроманипуляций и позволяют проводить скрининг продуцируемого антитела во множестве анализов, включая, без ограничений, анализы связывания, функциональные анализы и/или анализы нейтрализации. В одном варианте исполнения предусматривается способ продуцирования антитела из плазматических клеток, включающий культивацию плазматических клеток в ограниченных количествах и характеризацию антитела, причем способ не предусматривает использования микроманипуляций для выделения антителосекретирующих плазматических клеток. Изобретение включает характеризацию антитела или фрагмента антитела, выделенного с помощью способов по изобретению. В одном варианте исполнения характеризация антитела может включать определение специфичности связывания антитела или фрагмента антитела. В другом варианте исполнения характеризация антитела может включать определение эпитопа, распознаваемого антителом или фрагментом антитела. Специфичность связывания выделенного антитела или фрагмента антитела и/или эпитоп, распознаваемый антителом или фрагментом антитела, могут быть определены любыми средствами,известными специалистам. В одном варианте исполнения специфичность связывания и/или распознаваемый эпитоп могут быть определены мечением выделенного антитела или фрагмента антитела, презентацией меченого антитела или фрагмента антитела антигенной библиотеке, и детектированием меченого антитела или фрагмента антитела, связанного родственным с ним антигеном. В другом варианте исполнения меченое антитело или фрагмент антитела могут быть нанесены на колонку для очистки, содержащую иммобилизованные молекулы антигена, и присутствие или отсутствие меченого антитела или фрагментов антител на колонке может быть использовано как указание на специфичность антитела и/или распознаваемый эпитоп. Квалифицированному специалисту будет понятно, что плазматические клетки,выделенные из периферической крови донора, иммунизованного определенным антигеном или экспонированного определенным патогеном, будут продуцировать антитела или фрагменты антител, которые связываются с этим антигеном или патогеном. Тем не менее, патогены, особенно комплексные патогены,будут, вероятно, включать ряд антигенов, благодаря чему может быть установлена специфичность связывания и/или распознавания эпитопа определенного антитела или фрагмента антитела. Способ одноклеточной культуры по изобретению обеспечивает единичную плазматическую клетку,продуцирующую специфическое антитело, из которой может быть легко выделена нуклеиновая кислота,кодирующая антитело, с использованием хорошо отработанных методологий (Wrammert et al., 2008 Nature 453, 667-671 и Meijer et al., 2006 J. Mol. Biol. 358, 764-772). В одном варианте исполнения характеризация антитела может предусматривать секвенирование нуклеиновой кислоты, кодирующей антитело или фрагмент антитела. Секвенирование нуклеиновой кислоты может быть осуществлено любым способом, известным специалистам. В одном варианте исполнения секвенирование нуклеиновой кислоты может быть осуществлено методом обрыва цепи, в котором могут быть использованы радиоактивные, флуоресцентные или другие красители. В другом аспекте секвенирование нуклеиновой кислоты может быть проведено с использованием автоматизированного способа секвенирования. В другом варианте исполнения характеризация может включать секвенирование белка антитела. Белок антитела может быть секвенирован любым способом, известным специалистам. В одном варианте исполнения белок антитела может быть секвенирован путем анализа N-концевых последовательностей,-7 024586 анализа С-концевых последовательностей или расщепления по Эдману. Анализ N-концевых последовательностей может включать: i) проведение реакции белка с реагентом, селективно метящим аминоконцевую аминокислоту; ii) гидролиз белка; и iii) определение аминоконцевой аминокислоты путем хроматографии и сравнения со стандартами. В рамках этого аспекта может быть использован любой реагент для мечения, включая, без ограничений, реагент Сангера, производные дансила, такие как дансилхлорид, и фенилизотиоцианат. Анализ С-концевых последовательностей может включать инкубацию белка с карбоксипептидазой и отбор образцов через равные промежутки времени для построения графика зависимости концентрации аминокислоты от времени. После секвенирования белка антитела изобретение также включает химический синтез связывающего белка на основе последовательности идентифицированного антитела. Химический синтез может проводиться в соответствии с любым способом, известным специалистам. В одном варианте исполнения химический синтез может проводиться путем присоединения карбоксигруппы аминокислоты к нерастворимой твердой подложке, и проведения реакции аминогруппы иммобилизованного антитела с карбоксигруппой следующего антитела последовательности. Эта процедура может затем повторяться до получения требуемой аминокислотной последовательности, после чего полный белок может быть отщеплен от твердой подложки, и ему позволяют осуществить укладку или его индуцируют к укладке в правильную трехмерную структуру белка. Изобретение также включает антитела или фрагменты антител, продуцируемые любыми способами по изобретению. Фармацевтические области применения антитела. Изобретение предусматривает антитело или фрагмент антитела, продуцируемые любыми способами по изобретению, для использования в терапии, например для использования при лечении аллергии,инфекционных состояний или болезней, рака и аутоиммунных состояний или болезней. Термин "аллергия" включает все формы реакции гиперчувствительности, вызываемые непаразитическим антигеном, включая, без ограничений, аллергический дерматит, аллергический ринит, ангионевротический отек, анафилаксию, чувствительность к аспирину, астму, атопический дерматит, аллергию на птиц, аллергию на канареек, аллергию на кошек, химическую чувствительность, аллергию на кур, конъюнктивит, хроническое утомление, контактный дерматит, аллергию на косметику, аллергию на коровье молоко, дерматит, аллергию на собак, реакцию на лекарственные препараты, аллергию на уток, аллергию на пыль, аллергию на пылевых клещей, экзему, аллергию на гусей, аллергию на траву, сенную лихорадку, головные боли, сердечную аритмию (irregularity), крапивницу, гиперактивность у детей, гипогликемию, респираторные и контактные аллергены, лактозную непереносимость, мигреневые головные боли,аллергию на молоко, аллергию на клещей, крапивную лихорадку, аллергию на попугаев (parrot), аллергию на попугайчиков (parakeet), круглогодичный ринит, аллергию на голубей, аллергию на пыльцу, ринит, аллергию на сумах (rhus tree), чувствительность к салицилату, синусит, кожную сыпь, аллергию на ласточек, аллергию на индеек, крапивницу (ucaria) и аллергию на дрожжи. Термин "инфекционные болезни" включает любую клинично проявляющуюся болезнь, вызванную присутствием патогенного микробного агента, включая, без ограничений, вирусы, бактерии, простейшие,паразитов и грибы. Термин "инфекционные болезни" включает, без ограничений, СПИД, СПИДассоциированный комплекс, ветряную оспу, простуду, цитомегаловирусную инфекцию, колорадскую клещевую лихорадку, лихорадку денге, геморрагическую лихорадку эбола, вирусную пузырчатку полости рта и конечностей, гепатит, простой герпес, опоясывающий герпес, HPV (вирус бородавки человека),грипп (flu), лихорадку Ласса, корь, церкопитековую геморрагическую лихорадку, инфекционный мононуклеоз, свинку, норовирус, полиомиелит, прогрессивную мультифокальную лейкоэнцефалопатию, бешенство, краснуху, SARS (тяжлый острый респираторный синдром), оспу (натуральную), вирусный энцефалит, вирусный гастроэнтерит, вирусный менингит, вирусную пневмонию, лихорадку Западного Нила, желтую лихорадку, сибирскую язву, бактериальный менингит, ботулизм, бруцеллез, кампилобактериоз, лихорадку кошачьих царапин, холеру, дифтерию, эпидемический тиф, гонорею, импетигоболезнь легионеров, проказу (болезнь Гансена), лептоспироз, листериоз, болезнь Лайма, мелиоидоз, ревматическую лихорадку; инфекцию MRSA (метициллин-резистентного золотистого стафилококка), нокардиоз, коклюш (судорожный кашель), чуму, пневмококковую пневмонию, пситтакоз, квинслендскую лихорадку, пятнистую лихорадку Скалистых гор (RMSF), сальмонеллез, скарлатину, шителлез, сифилис,столбняк, трахому, туберкулез, туляремию, брюшной тиф, сыпной тиф-инфекции мочевых путей, африканский трипаносомоз, амебиаз, аскаридоз, бабешиоз, болезнь Чагаса, клонорхоз, криптоспоридиоз, цистицеркоз, дифиллоботриоз, дракункулез, эхинококкоз, энтеробиоз, фасциолез, фасциолопсидоз, филяриоз, инфекции, вызываемые свободноживущими амебами, лямблиоз, гнатостомоз, гименолепидоз, изоспороз, кала-азар, лейшманиоз, малярию, метагонимоз, миаз, онхоцеркоз, педикулез, инфекцию острицами, чесотку, шистосомоз, тениоз, токсокароз, токсоплазмоз, трихинеллез, трихиноз, трихиуриаз, трихомоноз, трипаносомоз, аспергиллез, бластомикоз, кандидоз, кокцидиоидоикоз, криптококкоз, гистоплазмоз, эпидермофитию стоп, трансмиссионную спонгиоформную энцефалопатию, коровью губчатую энцефалопатию, болезнь Крейтцфельда-Якоба, куру, смертельную наследственную бессонницу и синдром Альперса. Термин "аутоиммунное заболевание" включает все формы болезни, при которой иммунная система реагирует на собственный антиген, включая, без ограничений, ревматоидный артрит, сахарный диабет типа 1, тиреоидит Хасимото, базедову болезнь, склеродерму, болезнь глютеновой недостаточности, болезнь Крона, неспецифический язвенный колит, синдром Шегрена, рассеянный склероз, синдром Гийена-Барре, синдром Гудпасчера, аддисонову болезнь, гранулематоз Вегенера, первичный билиарный склероз, склерозирующий холангит, аутоиммунный гепатит, ревматоидный артрит, аутоиммунные болезни щитовидной железы, системную красную волчанку, псориаз, псориатический артрит, симпатический офтальмит, аутоиммунные невропатии, аутоиммунный оофорит, аутоиммунный орхит, аутоиммунный лимфопролиферативный синдром, антифосфолипидный синдром, волчанку, синдром полиэндокринной недостаточности, синдром полиэндокринной недостаточности типа 1, синдром полиэндокринной недостаточности типа 2, иммунную тромбоцитопеническую пурпуру, злокачественную анемию, тяжелую псевдопаралитическую миастению, смешанную соединительнотканную болезнь, первичный гломерулонефрит, витилиго, аутоиммунный увеит, аутоиммунную гемолитическую анемию, аутоиммунную тромбоцитопению, глютеновую болезнь, герпетиформный дерматит (aermatitis), пузырчатку (emphigus),пузырчатку вульгарную, пузырчатку листовидную, буллезный пемфигоид, аутоиммунный миокардит,аутоиммунный васкулит, аутоиммунные болезни глаз, гнездную алопецию, аутоиммунный атеросклероз,болезнь Бехчета, аутоиммунную миелопатию, аутоиммунную гемофилию, аутоиммунный интерстициальный цистит, аутоиммунный несахарный диабет, аутоиммунный эндометриоз, рецидивирующий полихондрит, анкилозирующий спондилит, аутоиммунную крапивницу, паранеопластические аутоиммунные синдромы, дерматомиозит, синдром Фишера и IgA-нефропатию. Изобретение также предусматривает антитело или фрагмент антитела, продуцируемые любыми способами по изобретению, для использования в производстве медикамента для лечения аллергии, инфекционного состояния или болезни и аутоиммунного состояния или болезни. Изобретение дополнительно предусматривает способ лечения аллергии, инфекционного состояния или болезни и аутоиммунного состояния или болезни, включающий введение антитела или фрагмента антитела, продуцируемых любыми способами по изобретению. Изобретение также включает составление рецептуры антитела или фрагмента антитела, продуцируемых любыми способами по изобретению, или нуклеиновой кислоты, кодирующей такое антитело или фрагмент антитела, в виде фармацевтически приемлемой композиции. В одном варианте исполнения фармацевтическая композиция может содержать одно или несколько выделенных антител или фрагментов антител, продуцируемых любыми способами по изобретению. В другом варианте исполнения фармацевтическая композиция может содержать 2, 3, 4, 5 или больше выделенных антител или фрагментов антител, продуцируемых любыми способами по изобретению. Фармацевтическая композиция может также содержать фармацевтически приемлемый носитель для обеспечения введения. Носитель сам по себе не должен индуцировать продуцирование антител, вредных для особы, получающей композицию, и не должен быть токсичным. Пригодные носители могут включать большие, медленно метаболизируемые макромолекулы, такие как белки, полипептиды, липосомы,полисахариды, полимолочные кислоты, полигликолевые кислоты, полимерные аминокислоты, сополимеры аминокислот и неактивные вирусные частицы. В определенных вариантах исполнения могут быть использованы фармацевтически приемлемые соли, например соли минеральных кислот, такие как гидрохлориды, гидробромиды, фосфаты и сульфаты, соли органических кислот, такие как ацетаты, пропионаты, малонаты и бензоаты. В некоторых вариантах исполнения фармацевтическая композиция может также содержать жидкости, такие как вода, солевой раствор, глицерин и этанол. Дополнительно, в композиции могут присутствовать вспомогательные вещества, такие как смачивающие или эмульгирующие агенты или буферы для регулировки рН, которые могут обеспечивать приготовление фармацевтических композиций в виде таблеток, пилюль, драже, капсул, жидкостей, гелей, сиропов, дисперсий и суспензий, для приема внутрь пациентом. Фармацевтическая композиция может быть введена любыми путями, включая, без ограничений,пероральный, внутривенный, внутримышечный, интраартериальный, интрамедуллярный, интраперитонеальный, интратекальный, интравентрикулярный, трансдермальный, чрескожный, местный, подкожный, интраназальный, энтеральный, сублингвальный, интравагинальный или ректальный пути. Фармацевтическая композиция может иметь рН в интервале значений от 5,5 до 8,5, в некоторых вариантах исполнения - от 6 до 8 и в других вариантах исполнения примерно 7. Величина рН может поддерживаться с помощью буфера. Композиция может быть стерильной и/или апирогенной. Композиция может быть изотоничной для человека. В другом варианте исполнения выделенное антитело или фрагмент антитела, продуцируемые любыми способами по изобретению, могут быть объединены с диагностическим эксципиентом для получения диагностического реагента. В одном варианте исполнения диагностический реагент может включать один или несколько выделенных антител или фрагментов антител, продуцируемых любыми способами по изобретению. Например, диагностический реагент может включать 2, 3, 4, 5 или больше выделенных антител или фрагментов антител, продуцируемых любыми способами по изобретению. Диагностический эксципиент может включать фармацевтически приемлемый носитель для обеспечения возможности введения диагностического реагента пациенту. Носитель не должен сам по себе индуцировать продуцирование антител, вредных для особы, получающей композицию, и не должен быть токсичным. Пригодные носители могут включать большие, медленно метаболизируемые макромолекулы, такие как белки, полипептиды, липосомы, полисахариды, полимолочные кислоты, полигликолевые кислоты, полимерные аминокислоты, сополимеры аминокислот и неактивные вирусные частицы. В определенных вариантах исполнения могут быть использованы фармацевтически приемлемые соли, например соли минеральных кислот, такие как гидрохлориды, гидробромиды, фосфаты и сульфаты, соли органических кислот, такие как ацетаты, пропионаты, малонаты и бензоаты. В некоторых вариантах исполнения фармацевтический реагент может также содержать жидкости,такие как вода, солевой раствор, глицерин и этанол. Дополнительно, могут присутствовать вспомогательные вещества, такие как смачивающие или эмульгирующие агенты или буферы для регулирования рН. Диагностический реагент может быть использован для проведения диагностики in vivo, in vitro илиex vivo. Для применения in vivo, диагностический реагент может быть введен любыми путями, включая,без ограничений, пероральный, внутривенный, внутримышечный, интраартериальный, интрамедуллярный, интраперитонеальный, интратекальный, интравентрикулярный, трансдермальный, чрескожный,местный, подкожный, интраназальный, энтеральный, сублингвальный, интравагинальный или ректальный пути. Диагностические реагенты могут иметь значение рН в интервале от 5,5 до 8,5, в некоторых вариантах исполнения - от 6 до 8 и в других вариантах исполнения приблизительно 7. Величина рН может поддерживаться с помощью буфера. Композиция может быть стерильной и/или апирогенной. Композиция может быть изотоничной для человека. В одном варианте исполнения диагностический реагент может включать мечение антител. Метка может быть выбрана из флуоресцентной метки, радиоактивной метки, гаптена и биологической метки,включая ферментную метку. Диагностический реагент может быть использован для подтверждения присутствия или отсутствия определенного антигена. Эта информация может быть экстраполирована для определения присутствия или отсутствия определенного патогена и, следовательно, определенного расстройства или болезни. В одном аспекте изобретения болезнь может представлять собой аллергию, инфекционное состояние или болезнь, или аутоиммунное состояние или болезнь. Информация, полученная с использованием диагностического реагента, может быть использована для определения пригодного курса лечения для определенного пациента. В частности, диагностический реагент может быть использован для определения присутствия или отсутствия аллергенов. Термин "аллерген" включает любой непаразитический антиген, способный стимулировать реакцию гиперчувствительности у особы, включая, без ограничений, кошек, мех, перхоть (dander), тараканов, чашечки цветов (calyx), шерсть, пылевых клещей, экскременты пылевых клещей, пенициллин, сульфонамидные препараты, салицилаты, анестезирующие средства, включая местные анестетики, сельдерей, корень сельдерея, зерновые, кукурузу, пшеницу, яйца, яичный белок, фрукты, тыкву, бобовые, бобы, горох,орехи, арахис, соевые бобы, молоко, морепродукты, кунжут, соевый соус, лесной орех (tree nuts), орех пекан, миндаль, укусы насекомых, пчелиный яд, осиный яд, укусы москитов, плесневые споры, латекс,металл, растительную пыльцу, травы, включая плевел и тимофеевку луговую, сорняки, включая амброзию, подорожник, крапиву, полынь обыкновенную (artemisia vuIgaris), марь белую (chenopodium album) и щавель, и деревья, включая березу, ольху, лещину, граб, дуб, иву, тополь, платан, липу, оливу, можжевельник Эша (Ashe juniper). Использование выделенных антител для очистки белка. Изобретение также включает способ иммобилизации выделенного антитела или фрагмента антитела, продуцируемых любыми способами по изобретению, на твердой подложке. Термин "твердая подложка" включает как твердые, так и полутвердые подложки, и охватывает любые подложки, которые могут быть использованы для иммобилизации выделенного антитела или фрагмента антитела. Твердая подложка может содержать гель, сетку, бусины, включая стеклосферы или магнитные бусины, колонку,пробирку (tube), стенку микротитровального планшета или пластиковый листовой материал. Иммобилизованное антитело или фрагмент антитела, продуцируемые любыми способами по изобретению, могут быть использованы для очистки белка. В одном варианте исполнения иммобилизованное антитело может быть использовано для иммуноаффинной хроматографии. Раствор, содержащий представляющий интерес белок, может быть нанесен на твердую подложку с иммобилизованными антителами или фрагментами антител, продуцируемыми любыми способами по изобретению, и обладающими специфичностью к представляющему интерес белку. Антитело или фрагменты антител могут, например, быть иммобилизованы на бусинах, которые, в некоторых вариантах исполнения, могут находиться в колонке. Общие положения. Термин "содержащий" охватывает "включающий", а также "состоящий из", например композиция,"содержащая" X, может состоять исключительно из X или может включать что-то дополнительно, например X+Y. Слово "по существу" не исключает "полностью" например композиция, которая "по существу не содержит" Y, может совершенно не содержать Y. При необходимости, слово "по существу" может быть опущено в формулировках изобретения. Термин "приблизительно" по отношению к численной величине х означает, например, х+10%. Термин "болезнь", в используемом тут значении, следует понимать как в общем синонимичный и используемый взаимозаменяемо с терминами "расстройство" и "состояние" (в значении медицинского состояния) в том смысле, что все они относятся к аномальному состоянию человеческого или животного организма или одной из его частей, которое нарушает нормальное функционирование, типично проявляется в отличительных признаках и симптомах и приводит к снижению продолжительности или качества жизни человека или животного. В используемом тут значении подразумевается, что ссылка на "лечение" пациента включает предотвращение и профилактику, а также терапию. Термин "пациент" обозначает всех млекопитающих,включая людей. Обычно пациент является человеком. Примеры Типичные варианты исполнения настоящего изобретения описаны в следующих примерах. Приведенные ниже примеры представлены только с целью иллюстрации и в помощь рядовым специалистам при использовании изобретения. Примеры никоим образом не должны ограничивать объем изобретения. Пример 1. Плазматические клетки в культуре мезенхимальных стромальных клеток. Авторы изобретения заметили, что первичные культуры человеческих мезенхимальных стромальных клеток, приготовленные из нормального костного мозга в соответствии со стандартными способами(Pittenger et al., 1999, Science 284:143-147; Bieback et al., 2004 Stem Cells 22:625-634; Dominici et al., 2006,Cytotherapy 8:315-317; Sotiropoulou et al., 2006, Stem Cells 24:462-471), содержат антителосекретирующие клетки. Такие клетки были обнаружены с помощью метода ELISPOT и идентифицированы как плазматические клетки. Плазматические клетки в культуре мезенхимальных стромальных клеток продолжали детектироваться после 3 недель in vitro (данные не приведены). Пример 2. Культивация человеческих плазматических клеток на протяжении до 50 дней. Для получения системы культуры, в которой индивидуальные плазматические клетки могут поддерживаться живыми, чтобы продуцируемое антитело могло накапливаться как функция времени культивации, авторы изобретения протестировали разные источники первичных мезенхимальных стромальных клеток, приготовленных в соответствии со стандартными способами. Вкратце, колбы для тканевых культур предварительно покрывали FCS (сыворотка плода коровы) в течение 1 ч. Клеткам костного мозга позволяли прикрепиться в течение ночи в полной среде IMDM (среда DMEM (модифицированная по Дульбекко среда Игла) в модификации Искова) с добавкой 30% FCS и 10-8 М дексаметазона. Неприлипшие клетки смывали и прилипшие клетки культивировали в полной среде DMEM-10% FCS. Три из семи протестированных линий поддерживали выживание человеческих плазматических клеток, но пролиферация прекращалась после нескольких пассажей. В последующих экспериментах были использованы мезенхимальные стромальные клетки, иммортализованные путем трансдукции геном теломеразной обратной транскриптазы (MSC-TERT). Эти клетки были выделены Mihara et al. (Br J. Haematol 2003, 120,846-849). Мононуклеарные клетки периферической крови окрашивают РЕ-меченым анти-CD138 моноклональным антителом, обогащают с помощью анти-РЕ микробусин (Miltenyi) и дополнительно очищают путем сортировки клеток с целью выделения CD138-положительных клеток. Число выделенных IgGсекретирующих плазматических клеток определяют методом изотип-специфического ELISPOT. Разные количества CD138-положительных клеток высеивают на монослой мезенхимальных стромальных клеток в 96-луночных культуральных планшетах с RPMI 1640 с добавкой 10% сыворотки плода коровы (Hyclone), заменимых аминокислот, пирувата и препарата Glutamax (GIBCO). По результатам анализа методом ELISPOT, проведенного во время посева, культура, представленная на фиг. 1, содержала семь IgGсекретирующих клеток. Половину супернатанта культуры отбирают в разные моменты времени и заменяют на свежую среду. Кроме того, в дни 18 и 34 среду полностью удаляют и заменяют на свежую. Определяют суточный показатель продуцирования IgG в культуре и расчетный суточный показатель продуцирования IgG на плазматическую клетку. Как показано на фиг. 1, количество IgG, продуцируемого популяцией культуры по настоящему изобретению, составляющей приблизительно 7 клеток, линейно возрастает со временем культивации в течение 50 дней, что соответствует скорости продуцирования,равной 676 пг/день, и расчетному продуцированию, равному 96 пг/клетку/день. Пример 3. Культивация индивидуальных плазматических клеток в течение 3 недель. Плазматические клетки из периферической крови или костного мозга выделяют с помощью РЕконъюгированного анти-CD138 антитела, а затем анти-РЕ микробусин и сортировки клеток, и высеивают на монослои мезенхимальных стромальных клеток в количестве 0,5 клеток/лунку в 96-луночных план- 11024586 шетах. IgG-содержащие культуры контролируют в течение периода 22-23 дней путем регулярного отбора проб. Среду заменяют в день 16. Скорость продуцирования IgG в моноклональных культурах была постоянной, составляя от 72 до 134 пг/клетку/день на протяжении всего периода культивации (фиг. 2 а, выделенные из периферической крови (4 культуры); фиг. 2b, выделенные из костного мозга (5 культур. В пяти экспериментах с серийным разведением эффективность посева плазматических клеток крови и костного мозга составляла от 30 до 65% (данные не приведены). Кроме того, плазматические клетки,выделенные из поликлональных культур, могут быть повторно высеяны в культурах, выделенных из одной клетки, где они поддерживают постоянную скорость секреции Ig (данные не приведены). Линейное накопление IgG согласуется с сохранением постоянно высокого количества индивидуальных клеток,секретирующих IgG. На продуцирование IgG культивируемыми плазматическими клетками не влияло облучение на уровне, который полностью прекращал пролиферацию и дифференцировку В-клеток памяти, стимулируемую TLR-агонистами (данные не приведены). Пример 4. Культура плазматических клеток, продуцирующих IgG, IqA, IgM и IgE.CD138-положительные клетки периферической крови, продуцирующие IgG, IgA, IgM и IgE, выделяют у здорового донора и высеивают по 5 клеток/лунку на 384-луночные планшеты, содержащие монослои мезенхимальных стромальных клеток, в количестве 617 параллельных культур. Супернатанты 10 дневных культур тестируют на присутствие IgG, IgA, IgM и IgE методом изотип-специфической ELISA. Измеряют общее количество четырех изотипов в супернатантах культур (см. фиг. 3). Медианное значение продуктивности IgG, IgA, IgM и IgE плазматическими клетками составляло 860, 770, 1100 и 1800 пг за 10 дней, т.е. 86, 77, 110 и 180 пг/клетку/день соответственно. Пример 5. Эффективность выживания плазматических клеток in vitro. Человеческие плазматические клетки периферической крови выделяют у семи доноров в соответствии с результатами определения экспрессии CD138 и высеивают в количестве 1 или 25 клеток/лунку. Число клеток, секретирующих IgG-, IgA- и IgM-антитела в начале культивации, рассчитывают методом изотип-специфического ELISPOT. Рассчитанная методом анализа распределения Пуассона эффективность посева клеток, секретирующих IgG-, IgA- и IgM-антитела, составляет от 50 до 74% для IgG, от 31 до 78% для IgA и от 0 до 26% для IgM (см. фиг. 4). Кроме того, плазматические клетки, полученные из поликлональных культур, могут быть повторно высеяны в культурах, выделенных из одной клетки, где они поддерживают постоянную скорость секреции Ig (данные не приведены). Пример 6. Выделение редких моноклинальных антител IsE. Плазматические клетки выделяют из периферической крови аллергического пациента и высеивают по 1 клетке/лунку на монослои hMSC-TERT в десяти 384-луночных микропланшетах. Пять супернатантов культур оказались положительными по продуцированию IgE. IgE-положительные культуры были подвергнуты RT-PCR (ПЦР с обратной транскриптазой) и два спаренных гена VH/VL были выделены и секвенированы (табл. 1). V-гены клонируют в векторы экспрессии для экспрессии легкой цепи (каппа или лямбда) или тяжелой цепи человеческого IgG1 или IgE в соответствии со способом, описанным Wardemann et al. (Science 301, 1374-1377, 2003). IgG- или IgE-антитела продуцируют путем транзиентной трансфекции клеток 293 Т. Этот пример иллюстрирует возможность выборки редких плазматических клеток и выделения характерных моноклинальных антител IgE. Таблица 1 Два моноклональных антитела IgE, выделенных из циркулирующих плазматических клеток Пример 7. Выделение антиген-специфических моноклональных антител из плазматических клеток,культивируемых в присутствии мезенхимальных стромальных клеток. Плазматические клетки выделяют из периферической крови донора через 7 дней после бустервакцинации столбнячным анатоксином (ТТ) и высеивают в клональных условиях на монослои MSCTERT в 384-луночных микропланшетах. Супернатанты 10-дневных культур анализируют на присутствие общего IgG (нг/культуру), а также ТТ-специфических IgG-антител (OD405), в результате чего были идентифицированы моноклональные культуры, продуцирующие ТТ-специфические антитела (см. фиг. 5). Этот пример иллюстрирует возможность идентификации больших количеств антиген-специфических плазматических клеток после бустер-иммунизации. Пример 8. Выделение сильнодействующего нейтрализующего антитела гриппа А с широким спектром реакционной способности из плазматических клеток, культивируемых в присутствии IL-6.CD138-положительные клетки донора, иммунизованного 7 днями ранее вакциной сезонного гриппа,высеивают на шестнадцать 384-луночных планшетов в количестве 0,5 клеток/лунку в присутствии 10 нг/мл IL-6. В дни 6 и 8 супернатанты культур тестируют путем проведения трех параллельных анализов методом ELISA с использованием в качестве антигенов рекомбинантных Н 5 или Н 9 бакуловирусных рекомбинантных гемагглютининов (НА) и иррелевантного антигена столбнячного анатоксина (ТТ). Из 4928 подвергнутых скринингу супернатантов культур, 12 связывались с НА Н 5, 25 - с НА Н 9 и 54 - с обоими Н 5 и Н 9. Некоторые из последних, имеющие наибольшие сигналы OD (оптической плотности),были подвергнуты RT-PCR, в результате чего были выделены два спаренных гена VH/VL. Два моноклональных антитела, FI6 и FI28, имели большинство совпадающих V, D и J генных фрагментов (IGHV33001, IGHD3-901, IGHJ402 и IGKV4-101), но различались в N-областях по частоте использованияIGKJ-сегментов и по характеру соматических мутаций и потому не были клонально родственными.V-гены FI6 и FI28 клонируют в вектора экспрессии и продуцируют рекомбинантные антитела путем трансфекции клеток 293 Т. Их специфичность исследуют методом ELISA с использованием панели рекомбинантных НА, принадлежащих к разным субтипам (табл. 2). FI6 связывался со всеми протестированными субтипами НА гриппа А, включая группу 1 (Н 1, Н 5 и Н 9) и группу 2 (Н 3 и Н 7), но не связывал НА гриппа В. В отличие от него, FI28 связывался только с НА группы 1. Таблица 2 Связывание человеческих моноклональных антител плазматических клеток с НА гриппа Мы затем протестировали FI6 и FI28 на их способность нейтрализовать субтипы гриппа А группы 1 и группы 2, используя псевдовирусы, а также инфекционные вирусы. Примечательно, что FI6 нейтрализовал все протестированные псевдовирусы, включая шесть изолятов Н 5, принадлежащих к антигенно дивергентным кладам 0, 1, 2.1, 2.2 и 2.3, и два птичьих изолята Н 7 (табл. 3). Кроме того, FI6 нейтрализовал все протестированные инфекционные вирусы, включая два вируса H3N2 и четыре вируса H1N1 за 70-летний период времени, вплоть до недавнего пандемического свиного изолята H1N1 A/Cal/04/09(табл. 4). В отличие от него, FI28 нейтрализовал все псевдовирусы Н 5, но не нейтрализовал псевдовирусы Н 7, а также все протестированные инфекционные вирусы (табл. 3 и 4). Таблица 3 Нейтрализация псевдотипов Н 5 и Н 7 человеческими моноклональными антителами Таблица 4 Нейтрализация вирусов гриппа человеческими моноклональными антителами; nd - не проводилось Следует отметить, что описанный выше способ позволяет получить 50 мкл моноклонального антитела в концентрации приблизительно 8-16 нг/мл за 5-10 дней. Такой объем и концентрация антитела являются достаточными для проведения множественных анализов. Такие анализы включают не только анализы связывания, такие как ELISA (которые могут быть проведены в стандартном формате неглубокого (shallow) 384-луночного планшета с использованием 5 мкл), но также и функциональные анализы,такие как нейтрализация псевдотипированных вирусов, попадающих в диапазон чувствительности (см. табл. 3). Важно, что способность проведения множества параллельных анализов является существенной для быстрой идентификации редких плазматических клеток, которые секретируют антитела, способные связываться с множеством вариантов антигена. Пример 9. Выделение столбнячный анатоксин-специфического моноклонального антитела из культивируемых плазматических клеток, полученных из периферической крови через десять лет после вакцинации.CD138+ HLA-DR+ CD62L+ плазматические клетки были выделены путем сортировки клеток периферической крови донора через 10 лет после вакцинации столбнячным анатоксином (ТТ). В общей сложности 1700 клеток высеивают по 0,5 клеток/лунку на 384-луночные микропланшеты и супернатанты клеточных культур подвергают скринингу в день 7 методом ELISA на присутствие столбнячный анатоксин-специфических антител IgG. Была идентифицирована одна столбнячный анатоксин-специфическая культура и в день 8 гены VH/VL были выделены путем RT-PCR и секвенированы (см. табл. 5). Гены клонируют в векторы экспрессии и рекомбинантное антитело (ТТ 14) продуцируют путем транзиентной трансфекции клеток 293 Т. Антитело тестируют в разных концентрациях на связывание со столбнячным анатоксином или с неродственным антигеном (отрицательный контроль) методом ELISA (см. фиг. 6). Таблица 5 Столбнячный анатоксин-специфическое моноклональное антитело, выделенное из циркулирующих плазматических клеток через 10 лет после вакцинации Следует отметить, что существуют альтернативные способы реализации настоящего изобретения и что разные модификации могут быть выполнены без выхода за пределы объема и сущности изобретения. Соответственно представленные варианты исполнения должны рассматриваться как иллюстративные и неограничивающие, и изобретение не должно ограниваться приведенными тут деталями, но может быть модифицировано в пределах объема и эквивалентов приложенной формулы изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ продуцирования антитела, включающий стадии, на которых:(i) культивируют CD138-положительные плазматические клетки в ограниченных количествах и поддерживают живыми по меньшей мере 30% указанных плазматических клеток в течение по меньшей мере 5 дней;(ii) получают указанное антитело из указанных культивируемых плазматических клеток,где число культивируемых плазматических клеток составляет 25 или меньше и при этом плазматические клетки культивируют в культуральной среде, содержащей экзогенный компонент, увеличивающий выживание плазматических клеток. 2. Способ по п.1, отличающийся тем, что число культивируемых плазматических клеток составляет 1. 3. Способ по п.1 или 2, отличающийся тем, что антитело представляет собой человеческое антитело и плазматические клетки являются человеческими плазматическими клетками. 4. Способ по любому из пп.1-3, отличающийся тем, что выживание плазматических клеток увеличивают на короткий период времени и в котором короткий период времени составляет от примерно 5 до примерно 7 дней. 5. Способ по любому из пп.1-3, отличающийся тем, что выживание плазматических клеток увеличивают на длительный период времени и в котором длительный период времени составляет по меньшей мере 10 дней. 6. Способ по любому из пп.1-3 или 5, отличающийся тем, что выживание плазматических клеток увеличивают по меньшей мере на 20 дней или по меньшей мере на 30 дней. 7. Способ по любому из пп.1-4, отличающийся тем, что экзогенный компонент, увеличивающий выживание плазматических клеток, содержит лиганд рецептора, экспрессируемого плазматической клеткой. 8. Способ по любому из пп.1-4 или 7, отличающийся тем, что экзогенный компонент содержит один или несколько лигандов, выбранных из группы, состоящей из IL-5, IL-6, фактора стромальных клеток-1(SDF-1), TNF-, лигандов CD44 и их комбинаций. 9. Способ по любому из пп.1-7, отличающийся тем, что экзогенный компонент содержит неплазматическую клетку и в котором неплазматическая клетка представляет собой мезенхимальную стромальную клетку, фибробласт или остеокласт. 10. Способ продуцирования антитела или фрагмента антитела, включающий стадии, на которых:a) культивируют ограниченное число плазматических клеток в соответствии со способом по любому из пп.1-9;d) экспрессируют указанную нуклеиновую кислоту в клетке-хозяине. 11. Способ по любому из пп.1-10, отличающийся тем, что дополнительно включает проведение функциональных анализов для определения функции антитела или фрагмента антитела, анализов связывания для определения специфичности связывания антитела или фрагмента антитела или эпитопа, распознаваемого антителом или фрагментом антитела, и/или анализов нейтрализации для определения способности антитела или фрагмента антитела нейтрализовать токсин или патоген.
МПК / Метки
МПК: C07K 16/12, C07K 16/00, C12N 5/0781, C07K 16/10
Метки: клеток, продуцирования, антител, плазматических, способы
Код ссылки
<a href="https://eas.patents.su/18-24586-sposoby-producirovaniya-antitel-iz-plazmaticheskih-kletok.html" rel="bookmark" title="База патентов Евразийского Союза">Способы продуцирования антител из плазматических клеток</a>
Предыдущий патент: Композиции, одновалентные в отношении связывания cd28, и способы их применения
Следующий патент: Система и способ для измерения температуры
Случайный патент: Ингибитор bcrp/abcg2