Способ получения кристаллической формы 1-хлор-4-(β-d-глюкопираноз-1-ил)-2-[4-((s)-тетрагидрофуран-3-илокси)бензил]бензола
Номер патента: 20798
Опубликовано: 30.01.2015
Авторы: Вебер Дирк, Реннер Свенья, Фидлер Тобиас, Орлих Зимоне
Формула / Реферат
1. Способ получения кристаллической формы соединения 1-хлор-4-(β-D-глюкопираноз-1-ил)-2-[4-((S)-тетрагидрофуран-3-илокси)бензил]бензола, включающий следующие стадии:
(а) растворение соединения в смеси по крайней мере двух растворителей с целью получения раствора, где первый растворитель выбран из группы растворителей, включающей толуол и тетрагидрофуран, а второй растворитель выбран из группы растворителей, включающей метанол, этанол, 1-пропанол и 2-пропанол, или первый растворитель является этанолом, а второй растворитель выбран из группы растворителей, включающей этилацетат, н-пропилацетат и метилэтилкетон;
(б) хранение раствора с целью осаждения кристаллической формы соединения из раствора;
(в) выделение кристаллической формы соединения из раствора.
2. Способ по п.1, в котором первый растворитель является толуолом или тетрагидрофураном.
3. Способ по п.2, в котором второй растворитель является этанолом, 1-пропанолом или 2-пропанолом.
4. Способ по п.1, в котором смесь по крайней мере двух растворителей выбрана из группы комбинаций, включающей толуол/этанол, толуол/1-пропанол, толуол/2-пропанол, тетрагидрофуран/этанол, тетрагидрофуран/1-пропанол, тетрагидрофуран/2-пропанол, этанол/н-пропилацетат и этанол/этилацетат.
5. Способ по п.1, в котором кристаллическая форма характеризуется рентгеновской порошковой дифрактограммой, содержащей пики при 18,84, 20,36 и 25,21° 2θ (±0,1° 2θ), где упомянутая рентгеновская порошковая дифрактограмма получена с помощью излучения CuKα1.
6. Кристаллическая форма соединения 1-хлор-4-(β-D-глюкопираноз-1-ил)-2-[4-((S)-тетрагидрофуран-3-илокси)бензил]бензола, получаемая с помощью способа по пп.1-5, охарактеризованная с помощью рентгеновской порошковой дифрактограммы, содержащей пики при 18,84, 20,36 и 25,21° 2θ (±0,1° 2θ), где упомянутая рентгеновская порошковая дифрактограмма получена с помощью излучения CuKα1, и характеризуемая чистотой свыше 99% по данным ВЭЖХ.
7. Кристаллическая форма согласно п.6, характеризуемая содержанием соединения формулы IMP.1
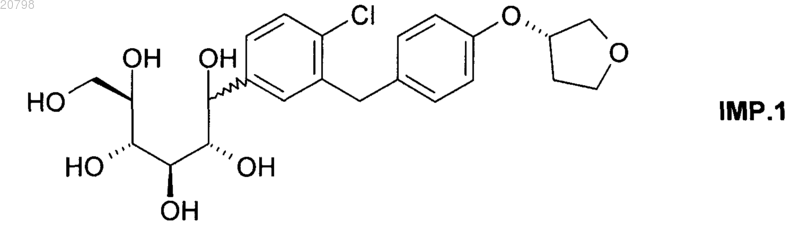
равным или меньшим 1% по данным ВЭЖХ.
8. Кристаллическая форма согласно п.6 или 7, характеризуемая содержанием соединения формулы IMP.2
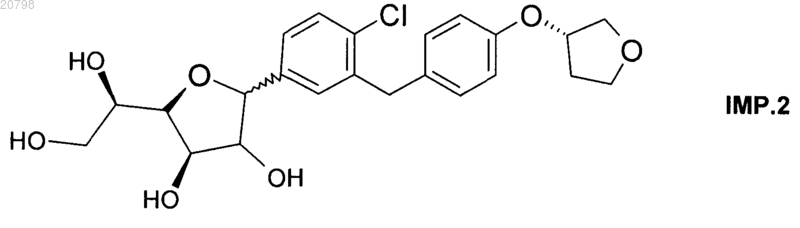
равным или меньшим 0,15% по данным ВЭЖХ.
9. Фармацевтическая композиция, применимая для лечения или профилактики метаболических расстройств, содержащая кристаллическую форму по одному или нескольким из пп.6-8.
10. Применение кристаллической формы по одному или нескольким из пп.6-8 для получения фармацевтической композиции, применимой для лечения или профилактики метаболических расстройств, в частности метаболического расстройства, выбранного из группы, включающей сахарный диабет типа 1 и типа 2, осложнения диабета, метаболический ацидоз или кетоз, реактивную гипогликемию, гиперинсулинемию, нарушения метаболизма глюкозы, резистентность к инсулину, метаболический синдром, дислипидемии различного происхождения, атеросклероз и родственные заболевания, ожирение, высокое кровяное давление, хроническую сердечную недостаточность, отек и гиперурикемию.
Текст
СПОСОБ ПОЛУЧЕНИЯ КРИСТАЛЛИЧЕСКОЙ ФОРМЫ 1-ХЛОР-4-(-D-ГЛЮКОПИРАНОЗ-1-ИЛ)-2-[4-S)-ТЕТРАГИДРОФУРАН-3 ИЛОКСИ)БЕНЗИЛ]БЕНЗОЛА Изобретение относится к способу получения кристаллической формы 1-хлор-4-(-D-глюкопираноз-1-ил)-2-[4-S)-тетрагидрофуран-3-илокси)бензил]бензола. Кроме того, изобретение относится к кристаллической форме, получаемой с помощью данного способа, к фармацевтической композиции и к их применению для изготовления лекарственных средств.(71)(73) Заявитель и патентовладелец: БРИНГЕР ИНГЕЛЬХАЙМ ИНТЕРНАЦИОНАЛЬ ГМБХ (DE) Настоящее изобретение относится к способу получения кристаллической формы 1-хлор-4-(-D-глюкопираноз-1-ил)-2-[4-S)-тетрагидрофуран-3-илокси)бензил]бензола. Помимо этого,настоящее изобретение относится к получаемой подобным способом кристаллической форме и к применению кристаллической формы для изготовления лекарственных средств. Предпосылки к созданию изобретения Соединение 1-хлор-4-(-D-глюкопираноз-1-ил)-2-[4-S)-тетрагидрофуран-3-илокси)бензил]бензол(в дальнейшем именуемое "соединение A") описано в международной заявке на изобретениеWO 2005/092877 и характеризуется химическим строением согласно формуле А Описанные в цитируемом документе соединения обладают ценным ингибирующим эффектом в отношении натрийзависимого котранспортера глюкозы SGLT, в особенности SGLT2. В международной заявке на изобретение WO 2006/120208 описаны различные способы синтеза ингибиторов SGLT2 и, среди прочих, соединения A. Кристаллическая форма соединения A и способ ее получения описаны в международной заявке на изобретение WO 2006/117359. В качестве предпочтительных растворителей для процесса кристаллизации описаны, например, метанол, этанол, изопропанол, этилацетат, диэтиловый эфир, ацетон, вода и их смеси. При синтезе соединения A, например, согласно международной заявке на изобретениеWO 2006/120208 обнаруживается, что в конечном веществе могут быть найдены некоторые примеси. Более того, выясняется, что процесс кристаллизации, как он описан в международной заявке на изобретение WO 2006/117359, снижает содержание примесей и повышает чистоту соединения, но не вполне удовлетворительным образом. Специалисту в соответствующей области хорошо известно, что в области фармацевтики желательны высокочистые соединения. Очень высокая чистота может улучшить устойчивость при длительном хранении. С другой стороны, с примесями могут быть связаны нежелательные физико-химические свойства, например гигроскопичность, или побочные фармакологические эффекты. Цель изобретения Целью настоящего изобретения является нахождения предоставляющего преимущества способа получения кристаллической формы соединения 1-хлор-4-(-D-глюкопираноз-1-ил)-2-[4-S)тетрагидрофуран-3-илокси)бензил]бензола, в частности надежного способа, с помощью которого кристаллическая форма может быть получена с высокой чистотой и с низким содержанием некоторых примесей и/или который позволяет осуществить изготовление кристаллической формы в коммерческом масштабе с низкими техническими издержками и высоким выходом за один проход в единицу времени. Другой целью настоящего изобретения является получение кристаллической формы 1-хлор-4-(-D-глюкопираноз-1-ил)-2-[4-S)-тетрагидрофуран-3-илокси)бензил]бензола, в частности, с высокой чистотой. Еще одной целью настоящего изобретения является создание фармацевтической композиции, содержащей кристаллическую форму. Еще одной целью настоящего изобретения является применение кристаллической формы. Другие цели настоящего изобретения будут очевидны специалисту в соответствующей области непосредственно из вышеизложенного и нижеприведенного описания. Объект изобретения В первом варианте осуществления настоящего изобретения его объектом является способ получения кристаллической формы соединения 1-хлор-4-(-D-глюкопираноз-1-ил)-2-[4-S)-тетрагидрофуран-3 илокси)бензил]бензола, включающий следующие стадии:(а) растворение соединения в смеси по крайней мере двух растворителей с целью получения раствора, где первый растворитель выбран из группы растворителей, включающей толуол и тетрагидрофуран, а второй растворитель выбран из группы растворителей, включающей метанол, этанол, 1-пропанол и 2-пропанол, или первый растворитель является этанолом а второй растворитель выбран из группы растворителей, включающей этилацетат, н-пропилацетат и метилэтилкетон;(б) хранение раствора с целью осаждения кристаллической формы соединения из раствора;(в) выделение кристаллической формы соединения из раствора. Было обнаружено, что с помощью способа согласно настоящему изобретению кристаллическая форма может быть получена с высокой чистотой и с высоким выходом, в частности, в коммерчески пригодных масштабах. Данный способ демонстрирует низкие технические издержки и высокий выход за один проход в единицу времени. Несмотря на возможные вариации в чистоте исходного вещества, способ приводит к получению кристаллической формы с высокой чистотой. В частности, в существенной степени могут быть устранены примеси формул IMP.1 и IMP.2: В другом варианте осуществления настоящего изобретения его объектом является кристаллическая форма соединения 1-хлор-4-(-D-глюкопираноз-1-ил)-2-[4-S)-тетрагидрофуран-3 илокси)бензил]бензола, получаемая с помощью способа, как он описан здесь выше и далее. Еще в одном варианте осуществления настоящего изобретения его объектом является кристаллическая форма кристаллическая форма соединения 1-хлор-4-(-D-глюкопираноз-1-ил)-2-[4-S)тетрагидрофуран-3-илокси)бензил]бензола, характеризуемая рентгеновской порошковой дифрактограммой, содержащей пики при 18,84, 20,36 и 25,21 2 (0,1 2), где упомянутая рентгеновская порошковая дифрактограмма получена с использованием излучения CuK1 и характеризуемая чистотой свыше 99% по данным высокоэффективной жидкостной хроматографии (ВЭЖХ). Еще в одном варианте осуществления настоящего изобретения его объектом является фармацевтическая композиция, содержащая кристаллическую форму, как она описана здесь выше и далее. Еще в одном варианте осуществления настоящего изобретения его объектом является применение кристаллической формы, как она описана здесь выше и далее, для получения фармацевтической композиции, подходящей для лечения или профилактики метаболических расстройств, в частности метаболического расстройства, выбранного из группы, включающей сахарный диабет типа 1 и типа 2, осложнения диабета, метаболический ацидоз или кетоз, реактивную гипогликемию, гиперинсулинемию, нарушения метаболизма глюкозы, резистентность к инсулину, метаболический синдром, дислипидемии различного происхождения, атеросклероз и родственные заболевания, ожирение, высокое кровяное давление, хроническую сердечную недостаточность, отек и гиперурикемию. Дальнейшие варианты осуществления настоящего изобретения будут очевидны специалисту в соответствующей области из нижеприведенного подробного описания изобретения и примеров. Краткое описание фигур На фиг. 1 представлена рентгеновская порошковая дифрактограмма кристаллической формы соединения A с поправленной базовой линией. На фиг. 2 представлены результаты термического анализа методом дифференциальной сканирующей калориметрии (ДСК) кристаллической формы соединения A. Подробное описание изобретения Данная кристаллическая форма соединения A может быть идентифицирована на основании своих характеристических рентгеновских порошковых дифрактограмм, в частности, как это описано в международной заявке на изобретение WO 2006/117359. Кристаллическая форма характеризуется рентгеновской порошковой дифрактограммой, содержащей пики при 18,84, 20,36 и 25,21 2 (0,1 2), где упомянутая рентгеновская порошковая дифрактограмма получена с помощью излучения CuK1. В частности, упомянутая рентгеновская порошковая дифрактограмма содержит пики при 14,69,18,84, 19,16, 19,50, 20,36 и 25,21 2 (0,1 2), где упомянутая рентгеновская порошковая дифрактограмма получена с помощью излучения CuK1. Упомянутая рентгеновская порошковая дифрактограмма более полно характеризуется пиками при 14,69, 17,95, 18,84, 19,16, 19,50, 20,36, 22,71, 23,44, 24,81 и 25,21 2 (0,1 2), где упомянутая рентгеновская порошковая дифрактограмма получена с помощью излучения CuK1. Более конкретно, кристаллическая форма соединения A характеризуется рентгеновской порошковой дифрактограммой, получаемой с помощью излучения CuK1, которая содержит пики при величинах угла 2 (0,1 2), как они представлены в табл. 1 международной заявки на изобретениеWO 2006/117359, или как они представлены в табл. 1 эксперимента А настоящего изобретения, или как они показаны на фиг. 1 международной заявки на изобретение WO 2006/117359, или как они показаны на фиг. 1 настоящего описания. Помимо этого кристаллическая форма соединения A характеризуется температурой плавления около 1515C (определенной с помощью ДСК; оценена как пороговая температура, скорость нагревания 10 К/мин). В объеме настоящего изобретения рентгеновские порошковые дифрактограммы зарегистрированы с помощью дифрактометра STADI Р компании в геометрии на пропускание, оснащенного позиционночувствительным детектором (OED) и медным анодом в качестве источника рентгеновского излучения(излучение CuK1, =1,54056 , 40 кВ, 40 мА). Для учета ошибки эксперимента вышеприведенным величинам углов 2 следует приписать точность 0,1 2, в частности 0,05 2. Иными словами, при анализе того, является ли данный образец кристаллов соединения A кристаллической формой согласно настоящему изобретению, экспериментально наблюдаемую для образца величину угла 2 следует считать идентичной описанному выше характеристическому значению, если она находится в пределах 0,1 2, в частности 0,05 2 от характеристического значения. Температуру плавления определяют посредством ДСК (дифференциальной сканирующей калориметрии) с помощью установки DSC 821 (Mettler Toledo). Объектом настоящего изобретения является способ получения кристаллической формы соединения(а) растворение соединения A в смеси по крайней мере двух растворителей с целью получения раствора, где первый растворитель выбран из группы растворителей, включающей толуол и тетрагидрофуран, а второй растворитель выбран из группы растворителей, включающей метанол, этанол, 1-пропанол и 2-пропанол, или первый растворитель является этанолом, а второй растворитель выбран из группы растворителей, включающей этилацетат, м-пропилацетат и метилэтилкетон;(б) хранение раствора с целью осаждения кристаллической формы соединения A из раствора;(в) выделение кристаллической формы соединения A из раствора. Первый растворитель предпочтительно выбирают из группы растворителей, включающей толуол и тетрагидрофуран. Второй растворитель предпочтительно выбирают из группы растворителей, включающей метанол,этанол, 1-пропанол и 2-пропанол, еще более предпочтительно из группы растворителей, включающей этанол, 1-пропанол и 2-пропанол. Согласно предпочтительному варианту осуществления настоящего изобретения первый растворитель является этанолом, а второй растворитель является н-пропилацетатом или этилацетатом. Примерами смесей по крайней мере двух растворителей являются толуол/метанол, толуол/этанол,толуол/1-пропанол, толуол/2-пропанол, тетрагидрофуран/метанол, тетрагидрофуран/этанол, тетрагидрофуран/1-пропанол, тетрагидрофуран/2-пропанол, этанол/н-пропилацетат, этанол/этилацетат, этанол/метилэтилкетон. Предпочтительными примерами смесей по крайней мере двух растворителей являются толуол/этанол,толуол/1-пропанол,толуол/2-пропанол,тетрагидрофуран/этанол,тетрагидрофуран/1-пропанол, тетрагидрофуран/2-пропанол, этанол/н-пропилацетат, этанол/этилацетат. Массовое соотношение первого растворителя и второго растворителя предпочтительно составляет от примерно 1:10 до 10:1, более предпочтительно от примерно 1:5 до 5:1, еще более предпочтительно от примерно 1:2 до 2:1, наиболее предпочтительно примерно 1:1. В отношении предпочтительных примеров толуол/этанол, толуол/1-пропанол, толуол/2-пропанол,этанол/н-пропилацетат, этанол/этилацетат массовое соотношение первого растворителя и второго растворителя предпочтительно составляет от примерно 1:5 до 5:1, более предпочтительно от примерно 1:2 до 2:1, наиболее предпочтительно примерно 1:1. В отношении предпочтительных примеров тетрагидрофуран/этанол, тетрагидрофуран/1-пропанол,тетрагидрофуран/2-пропанол массовое соотношение первого растворителя и второго растворителя предпочтительно составляет от примерно 1:10 до 2:1, более предпочтительно от примерно 1:5 до 1:1, еще более предпочтительно от примерно 1:4 до 1:2. На стадии (а) соединение А может быть задействовано в аморфной или кристаллической форме или в виде раствора, например, получаемого при синтезе соединения A. Предпочтительно получаемый на стадии (а) раствор является насыщенным или почти насыщенным при данной температуре раствором. Термины "насыщенный" или "почти насыщенный" относятся к исходному веществу соединения A,как оно используется на стадии (а). Например, раствор, насыщенный относительно исходного вещества соединения A, может быть пересыщен относительно его кристаллической формы Массовое соотношение соединения A по отношению к смеси растворителей предпочтительно составляет от 1:8 до 1:2, более предпочтительно от 1:6 до 1:3, еще более предпочтительно от 1:5 до 1:4. На стадии (а) раствор может быть нагрет до температуры кипения раствора или до температуры в пределах от примерно 60 до 120C, например приблизительно 100C. Получаемый на стадии (а) раствор может быть профильтрован, например, через активированный уголь. В начале стадии (б) к получаемому на стадии (а) раствору предпочтительно добавляют затравочные кристаллы соединения A, необязательно после стадии фильтрования. Количество затравочных кристаллов по отношению к полному количеству соединения A может составлять примерно до 5 мас.%, более предпочтительно от примерно 0,001 до 1 мас.%. Затравочные кристаллы могут быть получены, например, с помощью способа, описанного в международной заявке на изобретение WO 2006/117359. Затравочные кристаллы предпочтительно добавляют при температуре в пределах от примерно 30 до 80C,наиболее предпочтительно примерно от 60 до 75C. Альтернативно, кристаллизация может быть вызвана с помощью известных в соответствующей области способов, например посредством царапания или потирания. На стадии (б) температуру предпочтительно понижают с целью достижения высокого выхода осажденной кристаллической формы соединения A. Температура может понижаться непрерывно или по заранее заданному профилю охлаждения. Примером профиля охлаждения является, например, охлаждение в продолжение примерно 30 мин до температуры 605C, затем в продолжение примерно 90 мин до температуры 505C, затем в продолжение примерно 60 мин до температуры 405C, затем в продолжение примерно 60 мин до температуры 255C. Предпочтительная конечная температура в конце стадии (б) составляет от примерно -10 до 40C, более предпочтительно от примерно 0 до 35C, наиболее предпочтительно от примерно 10 до 30C. Продолжительность стадии (б) может находиться в пределах от примерно 30 мин до 48 ч, предпочтительно от примерно 3 до 6 ч. Стадия (б) может быть осуществлена при перемешивании или в его отсутствие. Как известно специалисту в соответствующей области, размер, форма и качество получаемых кристаллов могут варьироваться под влиянием продолжительности и разницы температур на стадии (б). На стадии (в) получаемые кристаллы выделяют, например, посредством центрифугирования или фильтрования. Получаемые кристаллы предпочтительно промывают растворителем или смесью растворителей, где растворитель предпочтительно выбирают из группы, включающей метанол, этанол,1-пропанол, 2-пропанол или трет-бутилметиловый эфир. Наиболее предпочтительным растворителем является этанол. Достигаются преимущества, если остаточный растворитель (растворители) предпочтительно удаляют из кристаллов на стадии сушки, предпочтительно при температуре от примерно 0 до 100C, например от примерно 50 до 80C. Температура, давление и продолжительность для данной стадии сушки могут быть выбраны таким образом, чтобы уменьшить содержание одного или более растворителей ниже заданной величины. Например, содержание толуола в кристаллической форме может быть выбрано на уровне, равном или меньшем 890 миллионных долей (м.д.), предпочтительно ниже 500 м.д.,еще более предпочтительно ниже 300 м.д. Содержание этанола в кристаллической форме может быть выбрано на уровне, равном или меньшем 5000 м.д., предпочтительно ниже 2000 м.д., еще более предпочтительно ниже 1000 м.д. Соединение A может быть синтезировано с помощью способов, описанных или процитированных конкретно и/или в общем в международной заявке на изобретение WO 2005/092877. Кроме того, могут быть исследованы биологические свойства соединения A, как это описано в международной заявке на изобретение WO 2005/092877, которая включена в настоящее описание в качестве ссылки во всей своей полноте и составляет ее часть. Кристаллическую форму согласно настоящему изобретению предпочтительно задействуют в качестве активного лекарственного вещества в химически чистом виде, т.е. в виде, в существенной степени свободном от других кристаллических форм соединения A. Тем не менее, в объем настоящего изобретения также включена кристаллическая форма, как она определена в контексте, в смеси с другой кристаллической формой или формами. В том случае, если активное лекарственное вещество представляет собой смесь кристаллических форм, является предпочтительным, если вещество содержит по крайней мере 50% кристаллической формы, как она определена в контексте. Согласно еще одному варианту осуществления настоящего изобретения кристаллическая форма соединения A, характеризуемая рентгеновской порошковой дифрактограммой, содержащей пики при 18,84,20,36 и 25,21 2 (0,1 2), где упомянутая рентгеновская порошковая дифрактограмма получена с помощью излучения CuK1, характеризуется чистотой свыше 99% согласно данным ВЭЖХ. Предпочтительно чистота превышает 99,5%, еще более предпочтительно превышает 99,7%, наиболее предпочтительно превышает 99,8%. В предпочтительном варианте осуществления настоящего изобретения кристаллическая форма, как она определена в контексте выше, характеризуется содержанием соединения формулы IMP.1 равным или меньшим 1% по данным ВЭЖХ. Предпочтительно содержание соединения формулы IMP.1 равно или ниже 0,15%, еще более предпочтительно равно или ниже 0,05% по данным ВЭЖХ. В другом предпочтительном варианте осуществления настоящего изобретения кристаллическая форма, как она определена в контексте выше, характеризуется содержанием соединения формулы IMP.2 равным или меньшим 0,15% по данным ВЭЖХ. Предпочтительно содержание соединения формулы IMP.2 равно или ниже 0,05% по данным ВЭЖХ. Согласно более предпочтительному варианту осуществления настоящего изобретения кристаллическая форма характеризуется таким содержанием соединений формул IMP.1 и IMP.2, как оно определено выше. Чистота и примеси, упоминаемые в контексте выше и далее, могут быть определены с помощью известных специалисту в соответствующей области способов. Предпочтительно чистоту и примеси определяют с помощью ВЭЖХ. Чистоту предпочтительно определяют как 100% минус сумма всех количественно охарактеризованных примесей. Предпочтительно установку для ВЭЖХ оснащают колонкой С 18, в частности колонкой с заполнением микрогранулятом С 18, используемым для обращенно-фазовой ВЭЖХ, например, приготовленным путем химического связывания стерически защищенной неподвижной фазы С 18 (например, диизобутилн-октадецилсилана) с пористыми сферическими микрочастицами оксида кремния (например, с размером пор около 80 ). Достигаются преимущества при размерах колонки и сферических микрочастиц 4,6 мм(внутренний размер)50 мм для колонки и 1,8 мкм. Предпочтительным является детектирование с помощью УФ-детектора, например, при длине волны 224 нм. Типичными параметрами для подобного ВЭЖХ-анализа являются: Предпочтительным растворителем для образцов или в качестве холостого раствора является смесь 50/50 (об./об.) ацетонитрил/вода. Все растворители, включая воду, предпочтительно характеризуются степенью чистоты "для ВЭЖХ". Ввиду своей способности к ингибированию активности SGLT кристаллическая форма согласно настоящему изобретению пригодна для изготовления фармацевтических композиций для лечения и/или профилактического лечения всех тех состояний или заболеваний, на которые может повлиять ингибирование активности SGLT, в частности активности SGLT-2. Таким образом, кристаллическая форма особенно применима для изготовления фармацевтических композиций для профилактики или лечения заболеваний, в частности метаболических расстройств, или состояний, таких как сахарный диабет типа 1 и типа 2, осложнения диабета (такие как, например, ретинопатия, нефропатия или невропатии, диабетическая стопа, язвы, макроангиопатии), метаболический ацидоз или кетоз, реактивная гипогликемия,гиперинсулинемия, нарушения метаболизма глюкозы, резистентность к инсулину, метаболический синдром, дислипидемии различного происхождения, атеросклероз и родственные заболевания, ожирение,высокое кровяное давление, хроническая сердечная недостаточность, отек и гиперурикемия. Кристаллическая форма также применима для изготовления фармацевтических композиций для профилактики де-5 020798 генерации бета-клеток, такой как, например, апоптоз или некроз бета-клеток поджелудочной железы. Кристаллическая форма также применима для изготовления фармацевтических композиций для улучшения или восстановления функции клеток поджелудочной железы, а также повышения числа и размера бета-клеток поджелудочной железы. Кристаллическая форма согласно настоящему изобретению также может быть использована для изготовления фармацевтических композиций, применимых в качестве диуретиков или средств против повышенного давления, а также применимых для профилактики и лечения острой почечной недостаточности. Посредством введения кристаллической формы согласно настоящему изобретению аномальное накопление жира в печени может быть снижено или ингибировано. Вследствие этого согласно еще одному варианту осуществления настоящего изобретения его объектом является способ, профилактики, замедления, задержки или лечения заболеваний или состояний, относящихся к аномальному накоплению печеночного жира, у нуждающегося в том пациента, отличающийся тем, что осуществляется введение фармацевтической композиции согласно настоящему изобретению. Заболевания или состояния, относящиеся к аномальному накоплению печеночного жира, выбраны, в частности, из группы, включающей общий жировой гепатоз, неалкогольный жировой гепатоз (NAFL), неалкогольный стеатогепатит (NASH),индуцированный гипералиментацией жировой гепатоз, диабетический жировой гепатоз, индуцированный алкоголем жировой гепатоз или токсический жировой гепатоз. В частности, кристаллическая форма согласно настоящему изобретению применима для изготовления фармацевтических композиций для профилактики или лечения диабета, в частности сахарного диабета типа 1 и типа 2, и/или диабетических осложнений. Кроме того, кристаллическая форма согласно настоящему изобретению особенно применима для профилактики или лечения избыточного веса, ожирения (включая ожирение класса I, класса II и/или класса III), висцеральное ожирение и/или абдоминальное ожирение. Дозировка, необходимая для достижения соответствующей активности для лечения или профилактики, обычно зависит от пациента, природы и тяжести болезни или состояния, а также способа и частоты введения и относится на усмотрение лечащего врача пациента. Уместная дозировка может составлять от 1 до 100 мг пероральным путем, вводимая в каждом случае от 1 до 4 раз в сутки. Для этой цели фармацевтические композиции согласно настоящему изобретению предпочтительно содержат кристаллическую форму совместно с одним или несколькими инертными общепринятыми носителями и/или разбавителями. Подобные фармацевтические композиции могут быть применены в виде общепринятых галеновых препаратов, таких как обычные таблетки или таблетки с покрытием, капсулы, порошки, суспензии или суппозитории. Нижеследующий пример синтеза служит для иллюстрации способа получения соединения A и его кристаллической формы. Его следует рассматривать лишь в качестве возможного способа, описанного в качестве примера, не ограничивающего изобретение своим содержанием. Определение чистоты и примесей с помощью ВЭЖХ. Данный способ применяют для определения органических примесей в соединении А. Количественную характеристику осуществляют с помощью растворов внешнего стандарта. Используют реагенты(ацетонитрил, воду, трифторуксусную кислоту (ТФУК степени чистоты "для ВЭЖХ". Термин "соединение AXX" обозначает кристаллическую форму соединения A, как та получена с помощью способа согласно настоящему изобретению. Подвижная фаза. Растворы. Растворитель: ацетонитрил/вода (50/50 (об./об Холостой раствор: растворитель. Раствор 1. Приготавливают раствор соединения IMP.2 с концентрацией 0,5 мг/мл. Например, взвешивают 25 мг вещества, растворяют в 2 мл метанола и разбавляют растворителем до общего объема 50 мл. Раствор для проверки пригодности системы (SST). Приготавливают раствор соединения AXX с концентрацией 0,5 мг/мл, содержащий около 0,5%IMP.2. Например, 25 мг соединения AXX взвешивают, растворяют в 2 мл метанола (с помощью ультразвуковой обработки) и после добавления 250 мкл раствора 1 разбавляют растворителем до общего объема 50 мл. Может быть необязательно добавлено около 0,5% следующих возможных примесей: IMP.1. Раствор для выяснения предела обнаружения (0,05%). Приготавливают раствор, содержащий 0,05% от номинальной концентрации. Для этого разбавляют растворителем 50 мкл маточного раствора до общего объема 100 мл. Растворы образцов. Приготавливают раствор предназначенного к анализу вещества с концентрацией 0,8 мг/мл. Для этого, например, взвешивают 40 мг вещества, растворяют в 2 мл метанола и разбавляют растворителем до общего объема 50 мл. Раствор приготавливают дважды. Маточные растворы. Приготавливают раствор соединения AXX с концентрацией 0,8 мг/мл. Для этого, например, взвешивают 40 мг вещества, растворяют в 2 мл метанола и разбавляют растворителем до общего объема 50 мл. Раствор приготавливают дважды. Раствор сравнения (0,5%). Приготавливают раствор соединения AXX с концентрацией 4 мкг/мл по отношение к номинально взвешенному образцу. Для этого, например, 250 мкл маточного раствора разбавляют 50 мл растворителя. Данный раствор приготавливают дважды (по одному разу из каждого маточного раствора). Хроматографические параметры: Типичные времена удерживания. Порядок элюирования пиков на хроматограмме раствора для проверки пригодности системы должен соответствовать хроматограмме сравнения. Отнесение пиков осуществляют с помощью хроматограммы сравнения или с помощью относительных времен удерживания (RRT). Оценка результатов. Расчет содержания примесей осуществляют согласно следующей формуле:VX - объем, до которого осуществлялось разбавление;VF - фактор разбавления. Степень разведения: известная степень разведения в % вещества сравнения соединения AXX. Чистоту образца соединения A рассчитывают как 100% минус сумма всех количественно охарактеризованных примесей. Получение соединения A. Термины "комнатная температура" или "температура внешней среды" обозначают температуру около 20C. ГХ - газовая хроматография; ч - часы;TMS - триметилсилил. Пример 1. Синтез фторида VIII.1. Добавляют ангидрид щавелевой кислоты (176 кг, 1386 моль, 1,14 экв.) к смеси 2-хлор-5-йодбензойной кислоты (343 кг, 1214 моль) (соединение IX.1), фторбензола (858 кг) иN,N-диметилформамида (2 кг) в продолжение 3 ч при температуре от примерно 25 до 30C (образование газа). После завершения добавления реакционную смесь перемешивают в течение дополнительных 2 ч при температуре примерно от 25 до 30C. Отгоняют растворитель (291 кг) при температуре между 40 и 45C (р=200 мбар). После этого реакционный раствор (911 кг) добавляют к хлориду алюминия AlCl3(181 кг) и фторбензолу (192 кг) при температуре между примерно 25 и 30C в продолжение 2 ч. Перемешивают реакционный раствор при той же температуре в течение примерно еще 1 ч. Затем реакционную смесь добавляют к 570 кг воды в продолжение примерно 2 ч при температуре между примерно 20 и 30C и перемешивают еще в течение 1 ч. После разделения фаз делят органическую фазу (1200 кг) на две половины (600 кг каждая). Из первой половины органической фазы отгоняют растворитель (172 кг) при температуре от примерно 40 до 50C (р=200 мбар). После этого добавляют 2-пропанол (640 кг). Нагревают раствор до температуры примерно 50C, а затем фильтруют через картридж с активированным углем (марки clear filtration). Картридж может быть заменен в ходе фильтрования и промыт после фильтрования смесью фторбензол/2-пропанол (1:4, 40 кг). Отгоняют растворитель (721 кг) при температуре примерно от 40 до 50C и р=200 мбар. После этого добавляют 2-пропанол (240 кг) при температуре в диапазоне между примерно 40 и 50C. Если содержание фторбензола превышает 1% по данным ГХ, отгоняют еще 140 кг растворителя и добавляют 2-пропанол (140 кг). После этого раствор охлаждают от примерно 50 до 40C в продолжение 1 ч и добавляют затравочные кристаллы (50 г). Раствор дополнительно охлаждают от примерно 40 до 20C в продолжение 2 ч. Добавляют воду (450 кг) при температуре примерно 20C в продолжение 1 ч и перемешивают суспензию при температуре примерно 20C в течение еще 1 ч,после чего фильтруют суспензию. Осадок на фильтре промывают смесью 2-пропанол/вода (1:1, 800 кг). Продукт сушат до достижения уровня содержания воды 0,06% мас./мас. Вторую половину органической фазы обрабатывают идентичным образом. Всего получают 410 кг (выход 94%) продукта цветом от белого до грязно-белого в кристаллическом виде. Продукт идентифицируют с помощью инфракрасной спектроскопии. Пример 2. Синтез кетона VII.1. К раствору фторида VIII.1 (208 кг), тетрагидрофурана (407 кг) и (S)-3-гидрокситетрагидрофурана(56 кг) добавляют в продолжение 3 ч при температуре от 16 до 25C раствор трет-бутилата калия (20%) в тетрагидрофуране (388 кг). После завершения добавления смесь перемешивают в течение 60 мин при температуре 20C. После этого определяют степень превращения с помощью ВЭЖХ-анализа. Добавляют в продолжение 20 мин воду (355 кг) при температуре 21C (разложение остатков реагентов водной средой). Реакционную смесь перемешивают в течение 30 мин (температура: 20C). Выключают мешалку и оставляют смесь стоять в течение 60 мин (температура: 20C). Разделяют фазы и отгоняют растворитель из органической фазы при температуре от 19 до 45C и при пониженном давлении. Добавляют к остатку при температуре от 40 до 46C 2-пропанол (703 кг) и отгоняют растворитель при температуре от 41 до 50C и при пониженном давлении. Добавляют к остатку при температуре 47C 2-пропанол (162 кг) и отгоняют растворитель при температуре от 40 до 47C и при пониженном давлении. После этого смесь охлаждают до температуры 0C в продолжение 1 ч 55 мин. Продукт собирают на центрифуге, промывают смесью 2-пропанола (158 кг) и затем трет-бутилметиловым эфиром (88 кг) и сушат при температуре от 19 до 43C и при пониженном давлении. Получают 227 кг продукта (91,8%) в виде бесцветного твердого вещества. Продукт идентифицируют с помощью инфракрасной спектроскопии. Пример 3. Синтез йодида V.1. К раствору кетона VII.1 (217,4 кг) и хлорида алюминия (AlCl3, 81,5 кг) в толуоле (366,8 кг) добавляют в продолжение 1 ч 30 мин 1,1,3,3-тетраметилдисилоксан (TMDS, 82,5 кг) (температура: 18-26C). После завершения добавления смесь перемешивают в течение еще 1 ч при температуре 24C. После этого определяют степень превращения с помощью ВЭЖХ-анализа. Затем обрабатывают реакционную смесь ацетоном (15,0 кг), перемешивают в течение 1 ч 5 мин при температуре 27C и анализируют остаточное содержание TMDS с помощью ГХ. После этого добавляют к реакционной смеси смесь воды(573 кг) и концентрированной HCl (34 кг) при температуре от 20 до 51C (разложение остатков реагентов водной средой). Реакционную смесь перемешивают в течение 30 мин (температура: 51C). Выключают мешалку и оставляют смесь стоять в течение 20 мин (температура: 52C). Разделяют фазы и отгоняют растворитель из органической фазы при температуре 53-73C и при пониженном давлении. Добавляют к остатку при температуре от 61 до 70C толуол (52,8 кг) и этанол (435,7 кг). Охлаждают реакционную смесь до температуры 36C и добавляют затравочные кристаллы (0,25 кг). Продолжают перемешивание при данной температуре в течение 35 мин. После этого охлаждают смесь до температуры от 0 до 5C и перемешивают в течение дополнительных 30 мин. Продукт собирают на центрифуге, промывают этанолом (157 кг) и сушат при температуре от 15 до 37C при пониженном давлении. Получают 181 кг (82,6%) продукта в виде бесцветного твердого вещества. Продукт идентифицируют по времени удерживания в ВЭЖХ. Пример 4. Синтез лактона IV.1. Суспензию D-(+)-глюконо-дельта-лактона IVa.1 (42,0 кг), тетрагидрофурана (277,2 кг),4-метилморфолина (НММ, 152,4 кг) и 4-диметиламинопиридина (ДМАП, 1,44 кг) обрабатывают хлортриметилсиланом (TMSCl, 130,8 кг) в продолжение 50 мин при температуре от 13 до 19C. После завершения добавления продолжают перемешивание в течение 1 ч 30 мин при температуре от 20 до 22C и определяют степень превращения с помощью ВЭЖХ-анализа. После этого добавляют н-гептан (216,4 кг) и охлаждают смесь до температуры 5C. Добавляют при температуре от 3 до 5C воду (143 кг) в продолжение 15 мин. После завершения добавления смесь нагревают до температуры 15C и перемешивают в течение 15 мин. Выключают мешалку и оставляют смесь стоять в течение 15 мин. После этого разделяют фазы и последовательно дважды промывают органический слой водой (по 143 кг). Затем отгоняют растворитель при температуре 38C и при пониженном давлении и добавляют к остатку н-гептан (130 кг). Получаемый таким образом раствор фильтруют и промывают фильтр н-гептаном (63 кг) (раствор продукта и раствор от фильтра объединяют). После этого отгоняют растворитель при температуре от 39 до 40C и при пониженном давлении. Содержание воды в остатке определяют с помощью анализа по Карлу Фишеру (результат: 0%). Получают 112,4 кг продукта в виде маслянистого вещества (содержащего остаточный н-гептан, который объясняет выход 100%). Продукт идентифицируют с помощью инфракрасной спектроскопии. Пример 5 а. Синтез гликозида II.1. К раствору йодида V.1 (267 кг) в тетрагидрофуране (429 кг) добавляют раствор "Турбогриньяр"LiCl:iPrMgCl = 0,9-1,1 моль/моль) (472 кг) при температуре от -21 до -15C в продолжение 1 ч 50 мин. По завершении добавления определяют степень превращения с помощью ВЭЖХ-анализа. Взаимодействие считается завершенным, когда площадь пика, соответствующего йодиду V.1 меньше 5% от общей площади обоих пиков, йодида V.1 и соответствующего деиодированного производного йодида V.I. Если взаимодействие не завершено, добавляют дополнительное количество раствора "Турбогриньяр" до достижения указанного критерия. В данном конкретном случае результат составил 3,45%. После этого добавляют при температуре от -25 до -18C лактон IV.1 (320 кг) в продолжение 1 ч 25 мин. Получаемую таким образом смесь перемешивают в течение еще 1 ч 30 мин при температуре от -13 до -18C. По завершении определяют степень превращения с помощью ВЭЖХ-анализа (для сведения). По завершении добавляют при температуре от -13 до 19C в продолжение 1 ч 25 мин к реакционной смеси объемом примерно 2500 л раствор лимонной кислоты в воде (938 л, концентрация: 10 мас.%). Растворитель частично отгоняют из реакционной смеси (остаточный объем: 1816-1905 л) при температуре от 20 до 30C и при пониженном давлении и добавляют 2-метилтетрагидрофуран (532 кг). Затем выключают мешалку и разделяют фазы при температуре 29C. После разделения фаз величину рН органической фазы измеряют с помощью рН-электрода (Mettler Toledo MT НА 405 DPA SC) или, альтернативно, с помощью рН-чувствительной индикаторной бумаги (такой как pH-Fix 0-14, Macherey and Nagel). Измеренная величина рН находится в пределах от 2 до 3. После этого отгоняют из органической фазы растворитель при температуре от 30 до 33C и при пониженном давлении и добавляют метанол(1202 кг), после чего добавляют при температуре 20C 1,25 н. раствор HCl в метаноле (75 кг) (рН 0). Полноты преобразования в ацеталь III.1 достигают в результате последующей перегонки при температуре от 20 до 32C и при пониженном давлении и добавления метанола (409 кг). Завершение взаимодействия достигается при выполнении двух критериев: 1) соотношение суммы площадей на хроматограмме ВЭЖХ для альфа-формы и бета-формы промежуточного соединения III.1 по отношению к площади, отвечающей промежуточному соединению IIIa.1,больше или равно 96:4%; 2) соотношение площади на хроматограмме ВЭЖХ для альфа-формы промежуточного соединенияIII.1 и для бета-формы III.1 больше или равно 97:3%. В данном конкретном случае оба критерия выполнены. Добавляют триэтиламин (14 кг) (рН 7,4) и отгоняют растворитель при пониженном давлении, затем добавляют ацетонитрил (835 кг) и снова отгоняют при пониженном давлении. Эти действия повторяют (добавление ацетонитрила: 694 кг) и добавляют к получаемой таким образом смеси хлористый метилен (640 кг) с целью получения смеси ацеталяIII.1 в ацетонитриле и хлористом метилене. Содержание воды в смеси определяют с помощью титрования по Карлу Фишеру (результат: 0,27%). После этого добавляют реакционную смесь в продолжение 1 ч 40 мин при температуре от 10 до 19C к заранее приготовленной смеси AlCl3 (176 кг), хлористого метилена (474 кг), ацетонитрила (340 кг) и триэтилсилана (205 кг). Получаемую таким образом смесь перемешивают при температуре от 18 до 20C в течение 70 мин. После завершения взаимодействия добавляют при температуре от 20 до 30C в продолжение 1 ч 30 мин воду (1263 л), частично перегоняют смесь при температуре от 30 до 53C и при атмосферном давлении и разделяют фазы. Добавляют к органической фазе толуол (698 кг) и отгоняют растворитель при пониженном давлении при температуре от 22 до 33C. После этого кристаллизуют продукт посредством добавления затравочных кристаллов (0,5 кг) при температуре 31C и добавляют после охлаждения до температуры 20C воду (267 кг). Реакционную смесь охлаждают до температуры 5C в продолжение 55 мин и перемешивают при температуре от 3 до 5C в течение 12 ч. Наконец, собирают продукт на центрифуге в виде бесцветного кристаллического твердого вещества, промывают толуолом (348 кг) и сушат при температуре от 22 до 58C. Получают 211 кг (73%) продукта. Продукт идентифицируют по времени удерживания в ВЭЖХ. Пример 5 б. Синтез гликозида II.1. К раствору йодида V.1 (30 г) в тетрагидрофуране (55 мл) добавляют при температуре от-14 до -13C в продолжение 35 мин раствор "Турбогриньяр" (раствор изопропилмагнийхлорида/хлорида лития, 14 мас.% iPrMgCl в ТГФ, мольное соотношение LiCl:iPrMgCl = 0,9-1,1 моль/моль) (53 г). По завершении добавления определяют степень превращения с помощью ВЭЖХ-анализа. Взаимодействие считается завершенным, если площадь пика, соответствующего йодиду V.1, составляет меньше 5% от общей площади обоих пиков, йодида V.1 и соответствующего деиодированного производного йодидаV.I. Если взаимодействие не завершено, добавляют дополнительное количество раствора "Турбогриньяр" до достижения указанного критерия. В данном конкретном случае результат составил 0,35%. После этого добавляют при температуре от -15 до -6C лактон IV.1 (36 г) в продолжение 15 мин. Получаемую таким образом смесь перемешивают в течение еще 1 ч при температуре от -6 до -7C. По завершении определяют степень превращения с помощью ВЭЖХ-анализа (для сведения). По завершении добавляют при температуре от -13 до 10C в продолжение 30 мин к реакционной смеси раствор лимонной кислоты в воде (105 мл, концентрация: 10 мас.%). Растворитель частично отгоняют из реакционной смеси (остаточный объем: 200 мл) при температуре от 20 до 35C и при пониженном давлении и добавляют 2-метилтетрагидрофуран (71 мл). После этого перемешивают смесь в течение 25 мин при температуре 30C. Затем выключают мешалку и разделяют фазы при температуре 30C. После разделения фаз величину рН органической фазы измеряют с помощью рН-электрода (Mettler Toledo MT НА 405 DPA SC) или, альтернативно, с помощью рН-чувствительной индикаторной бумаги (такой как pH-Fix 0-14,Macherey and Nagel). Измеренная величина рН равна 3. После этого отгоняют из органической фазы растворитель при температуре 35C и при пониженном давлении и добавляют метанол (126 мл), после чего добавляют при температуре 25C 1,25 н. раствор НС 1 в метаноле (10,1 мл) (рН 1-2). Полноты преобразования в ацеталь III.1 достигают в результате последующей перегонки при температуре 35C и при пониженном давлении и добавления метанола (47 мл). Завершение взаимодействия достигается при выполнении двух критериев: 1) соотношение суммы площадей на хроматограмме ВЭЖХ для альфа-формы и бета-формы промежуточного соединения III.1 по отношению к площади, отвечающей промежуточному соединению IIIa.1,больше или равно 96:4%. В данном конкретном случае соотношение составляет 99,6:0,43%; 2) соотношение площади на хроматограмме ВЭЖХ для альфа-формы промежуточного соединенияIII.1 и для бета-формы III.1 больше или равно 97:3%. В данном конкретном случае соотношение составляет 98,7:1,3%. Добавляют триэтиламин (2,1 мл) (рН 9) и отгоняют растворитель при температуре 35C и при пониженном давлении, затем добавляют ацетонитрил (120 мл) и снова отгоняют при пониженном давлении и при температуре от 30 до 35C. Эти действия повторяют (добавление ацетонитрила: 102 мл) и добавляют к получаемой таким образом смеси хлористый метилен (55 мл) с целью получения смеси ацеталяIII.1 в ацетонитриле и хлористом метилене. Содержание воды в смеси определяют с помощью титрования по Карлу Фишеру (результат: 0,04%). После этого добавляют реакционную смесь в продолжение 1 ч 5 мин при температуре 20C к заранее приготовленной смеси AlCl3 (19,8 г), хлористого метилена (49 мл), ацетонитрила (51 мл) и триэтилсилана (23 г). Получаемую таким образом смесь перемешивают при температуре от 20 до 30C в течение 60 мин. После завершения взаимодействия добавляют при температуре от 20C в продолжение 25 мин воду (156 мл), частично перегоняют смесь при температуре 55C и при атмосферном давлении и разделяют фазы при температуре 33C. Нагревают смесь до температуры 43C, добавляют толуол (698 кг) и отгоняют растворитель при пониженном давлении при температуре от 41 до 43C. После этого добавляют ацетонитрил (10 мл) при температуре 41C и определяют процентное содержание ацетонитрила с помощью ГХ. В данном конкретном случае процентное содержание ацетонитрила составляет 27 мас.%. После этого кристаллизуют продукт посредством добавления затравочных кристаллов (0,1 г) при температуре 44C и продолжают перемешивание смеси при температуре 44C в течение 15 мин. Затем охлаждают смесь до температуры 20C в продолжение 60 мин и добавляют при температуре 20C воду(142 мл) в продолжение 30 мин. Реакционную смесь охлаждают до температуры от 0 до 5C в продолжение 60 мин и перемешивают при температуре от 3C в течение 16 ч. Наконец, собирают продукт на фильтре в виде бесцветного кристаллического твердого вещества, промывают толуолом (80 мл) и сушат при температуре от 20 до 70C. Получают 20,4 г (62,6%) продукта. Продукт идентифицируют по времени удерживания в ВЭЖХ. Получение кристаллической формы. Эксперимент А. Раствор соединения A (79,0 кг) в смеси толуола (186,6 кг) и этанола (187,2 кг) нагревают до температуры кипения с обратным холодильником до полного растворения и фильтруют (горячая фильтрация). Фильтр промывают толуолом (19,6 кг) и объединяют раствор от промывания с раствором продукта. После этого охлаждают раствор продукта до температуры 66C и добавляют затравочные кристаллы(0,1 кг). Затем охлаждают раствор продукта до температуры 22C по заранее заданному профилю охлаждения: в продолжение 30 мин до температуры 57C, затем в продолжение 90 мин до температуры 50C,затем в продолжение 60 мин до температуры 41C, затем в продолжение 60 мин до температуры 22C. После этого дополнительно перемешивают суспензию при температуре 21C в течение 1 ч, собирают вещество на центрифуге, промывают этанолом (124,8 кг) и сушат при температуре около 70C. Получают 65,5 кг продукта (82,9%) в виде кристаллов белого цвета с чистотой по данным ВЭЖХ 99,9%. С помощью дифференциальной сканирующей калориметрии (ДСК), как это описано здесь выше,определяют температуру плавления 151C (фиг. 2). С помощью рентгеновской дифракции с использованием излучения CuK1, как это описано здесь выше, характеризуют кристаллическую форму и получают дифрактограмму, как то представлено на фиг. 1. Показанная на фиг. 1 интенсивность дана в единицах числа отсчетов в секунду при поправленной базовой линии. Кроме того, кристаллическая форма характеризуется следующими параметрами решетки: орторомбическая симметрия, пространственная группа P212121 с параметрами ячейки: а=5,70(1) q, b=9,25(2) ,с=39,83(1)и объемом элементарной ячейки=2101(1) 3, что может быть получено посредством индицирования рентгеновской порошковой дифрактограммы, которую следует регистрировать при комнатной температуре с использованием излучения CuK1, которая содержит пики при величинах углов 2(0,1 2), представленных в табл. 1. В табл. 1 величины "2 []" обозначают угол рассеяния (в градусах), а величины "d []" обозначают указанные расстояния (в ангстремах) между плоскостями решетки. Кроме того, приведены индексы h, k, l и различия между экспериментальными и рассчитанными величинами d (в ангстремах). Таблица 1 Проиндицированная рентгеновская порошковая дифрактограмма кристаллической формы (представлены только пики в диапазоне угла 2 до 30) В качестве исходных величин для индицирования используют параметры решетки из анализа монокристалла. Уточненные параметры ячейки из рентгеновской порошковой дифрактограммы: проиндицированы все пики (35) в диапазоне угла от 2 до 30; симметрия: орторомбическая; пространственная группа: P212121;V=2101(1) 3. Показатель достоверности: 118. Эксперимент Б. В следующем эксперименте исследуют, насколько способ согласно настоящему изобретению способен устранять примесь формулы IMP.1, как она описана выше. Соединение формулы IMP.1 добавляют к кристаллической форме соединения A, получаемой согласно эксперименту А, таким образом, чтобы были получены количества согласно табл. 2. Например,чтобы получить смесь с содержанием 0,5 мас.%, объединяют смесь 6,96 г кристаллической формы соединения A, получаемой согласно эксперименту А, и 0,04 г соединения IMP.1. После этого половину данной смеси соединений перекристаллизовывают согласно методике эксперимента А в лабораторных масштабах. Получают кристаллическую форму соединения A в виде кристаллического вещества белого цвета. Содержание соединения формулы IMP.1 анализируют с помощью ВЭЖХ. Другую половину данной смеси соединений перекристаллизовывают из смеси метанола и воды согласно следующей методике. Примерно 7 г смеси кристаллической формы соединения A, получаемой согласно эксперименту А,и соединения IMP.1 добавляют к смеси метанола (7,1 г) и воды (7,3 г) и нагревают до температуры 60C до полного растворения. Прозрачный раствор перемешивают в течение 15 мин. Затем добавляют к раствору воду (11,9 г), охлаждают раствор после завершения добавления до температуры 57C и добавляют затравочные кристаллы. После этого раствор дополнительно перемешивают при температуре 57C в течение 30 мин. Затем охлаждают раствор продукта до температуры 25C в продолжение 2 ч 20 мин. После этого дополнительно перемешивают суспензию при температуре 25C в течение 15 мин, собирают на фильтре, промывают смесью метанола (1,66 г) и воды (9,5 г) и сушат при температуре около 45C. Получают 6,5 г продукта (93,1%) в виде кристаллов белого цвета. Соединение А получают в виде кристаллического вещества белого цвета. Содержание соединения формулы IMP.1 анализируют с помощью ВЭЖХ. Таблица 2 Обнаружено, что при использовании способа кристаллизации из смеси толуола и этанола может быть достигнуто лучшее устранение примеси IMP.1 по сравнению со способом, использующим смесь метанол/вода. Эксперимент В. В следующем эксперименте исследуют, насколько способ согласно настоящему изобретению способен устранять примесь формулы IMP.2, как она описана выше. Различные образцы неочищенного вещества соединения A, например, получаемые по неоптимизированной методике в лабораторных масштабах согласно примеру 5 а или 5 б, анализируют с помощью ВЭЖХ в отношении содержания в них IMP.2. После этого каждый из образцов перекристаллизовывают согласно методике эксперимента А в лабораторных масштабах из смеси толуола и этанола с целью получения кристаллической формы соединения A. Содержание IMP.2 и общую чистоту кристаллической формы соединения A анализируют с помощью ВЭЖХ. Таблица 3 Эксперимент Г. В следующем эксперименте исследуется, насколько способ согласно настоящему изобретению способен очищать неочищенное вещество соединения A. Различные образцы неочищенного вещества соединения A, например, получаемые по неоптимизированной методике в лабораторных масштабах согласно примеру 5 а или 5 б, анализируют с помощью ВЭЖХ в отношении их чистоты. После этого каждый из образцов перекристаллизовывают согласно методике эксперимента А в лабораторных масштабах из смеси толуола и этанола с целью получения кристаллической формы соединения A. Общую чистоту кристаллической формы соединения A анализируют с помощью ВЭЖХ. Другую половину каждого из образцов перекристаллизовывают из смеси метанола и воды согласно методике, описываемой в эксперименте Б. Чистота образцов неочищенного вещества и кристаллизованного вещества представлена в табл. 4. Обнаружено, что при использовании способа кристаллизации из смеси толуола и этанола может быть достигнута более высокая чистота соединения A по сравнению со способом, использующим смесь метанол/вода. Эксперимент Д. В следующем эксперименте исследуется влияние смеси и соотношения растворителей на чистоту и выход методики перекристаллизации согласно эксперименту А. Для этого образец неочищенного вещества соединения A, например, получаемый согласно примеру 5 а или 5 б, анализируют с помощью ВЭЖХ в отношении его чистоты и получают результат 95,16%. После этого данный образец перекристаллизовывают согласно методике эксперимента А в лабораторных масштабах (соединение А: 35 г, общее количество первого и второго растворителей: 162 г) с тем изменением, что при получении кристаллической формы соединения A два растворителя, этанол и толуол, заменяют смесями, указанными в табл. 5. Общую чистоту кристаллической формы соединения A анализируют с помощью ВЭЖХ. Таблица 5 Эксперимент Е. В следующем эксперименте исследуется, насколько способ согласно настоящему изобретению способен очищать неочищенное вещество соединения A по сравнению со способом, использующим смесь этанола и воды (см., например, эксперимент "вариант 2" в международной заявке на изобретениеWO 2006/117359). Образец неочищенного вещества соединения A, например, получаемый по неоптимизированной методике в лабораторных масштабах согласно примеру 5 а или 5 б, анализируют с помощью ВЭЖХ в отношении его чистоты. После этого образец перекристаллизовывают согласно методике эксперимента А в лабораторных масштабах из смеси толуола и этанола с целью получения кристаллической формы соединения A. Общую чистоту кристаллической формы соединения A анализируют с помощью ВЭЖХ. Другую половину образца перекристаллизовывают из смеси этанола и воды согласно следующей методике. Растворяют 40 г соединения A в 200 мл смеси вода/этанол (объемное соотношение 2:3) при нагревании до температуры примерно 50C. Добавляют в диапазоне температур от 45 до 50C 320 мл воды и дают раствору охладиться до температуры примерно 20C в течение от 1 до 3 ч. По прошествии 16 ч выделяют посредством фильтрования кристаллическую форму в виде кристаллов бежевого цвета. Продукт сушат при повышенной температуре (от 40 до 50C) в течение примерно от 4 до 6 ч. Чистота образцов неочищенного вещества и кристаллизованного вещества представлена в табл. 6. Таблица 6 Обнаружено, что при использовании способа кристаллизации из смеси толуола и этанола может быть достигнута более высокая чистота соединения A по сравнению со способом, использующим смесь метанол/вода. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения кристаллической формы соединения 1-хлор-4-(-D-глюкопираноз-1-ил)-2-[4S)-тетрагидрофуран-3-илокси)бензил]бензола, включающий следующие стадии:(а) растворение соединения в смеси по крайней мере двух растворителей с целью получения раствора, где первый растворитель выбран из группы растворителей, включающей толуол и тетрагидрофуран, а второй растворитель выбран из группы растворителей, включающей метанол, этанол, 1-пропанол и 2-пропанол, или первый растворитель является этанолом, а второй растворитель выбран из группы растворителей, включающей этилацетат, н-пропилацетат и метилэтилкетон;(б) хранение раствора с целью осаждения кристаллической формы соединения из раствора;(в) выделение кристаллической формы соединения из раствора. 2. Способ по п.1, в котором первый растворитель является толуолом или тетрагидрофураном. 3. Способ по п.2, в котором второй растворитель является этанолом, 1-пропанолом или 2-пропанолом. 4. Способ по п.1, в котором смесь по крайней мере двух растворителей выбрана из группы комбинаций, включающей толуол/этанол, толуол/1-пропанол, толуол/2-пропанол, тетрагидрофуран/этанол,тетрагидрофуран/1-пропанол, тетрагидрофуран/2-пропанол, этанол/н-пропилацетат и этанол/этилацетат. 5. Способ по п.1, в котором кристаллическая форма характеризуется рентгеновской порошковой дифрактограммой, содержащей пики при 18,84, 20,36 и 25,21 2 (0,1 2), где упомянутая рентгеновская порошковая дифрактограмма получена с помощью излучения CuK1. 6. Кристаллическая форма соединения 1-хлор-4-(-D-глюкопираноз-1-ил)-2-[4-S)тетрагидрофуран-3-илокси)бензил]бензола, получаемая с помощью способа по пп.1-5, охарактеризованная с помощью рентгеновской порошковой дифрактограммы, содержащей пики при 18,84, 20,36 и 25,21 2 (0,1 2), где упомянутая рентгеновская порошковая дифрактограмма получена с помощью излучения CuK1, и характеризуемая чистотой свыше 99% по данным ВЭЖХ. 7. Кристаллическая форма согласно п.6, характеризуемая содержанием соединения формулы IMP.1 равным или меньшим 1% по данным ВЭЖХ. 8. Кристаллическая форма согласно п.6 или 7, характеризуемая содержанием соединения формулы равным или меньшим 0,15% по данным ВЭЖХ. 9. Фармацевтическая композиция, применимая для лечения или профилактики метаболических расстройств, содержащая кристаллическую форму по одному или нескольким из пп.6-8. 10. Применение кристаллической формы по одному или нескольким из пп.6-8 для получения фармацевтической композиции, применимой для лечения или профилактики метаболических расстройств, в частности метаболического расстройства, выбранного из группы, включающей сахарный диабет типа 1 и типа 2, осложнения диабета, метаболический ацидоз или кетоз, реактивную гипогликемию, гиперинсулинемию, нарушения метаболизма глюкозы, резистентность к инсулину, метаболический синдром, дислипидемии различного происхождения, атеросклероз и родственные заболевания, ожирение, высокое кровяное давление, хроническую сердечную недостаточность, отек и гиперурикемию. Рентгеновская порошковая дифрактограмма кристаллической формы Фиг. 1 Диаграмма ДСК кристаллической формы
МПК / Метки
МПК: C07H 15/203, A61K 31/7048, A61P 3/10
Метки: 1-хлор-4-(β-d-глюкопираноз-1-ил)-2-[4-((s)-тетрагидрофуран-3-илокси)бензил]бензола, кристаллической, формы, способ, получения
Код ссылки
<a href="https://eas.patents.su/18-20798-sposob-polucheniya-kristallicheskojj-formy-1-hlor-4-beta-d-glyukopiranoz-1-il-2-4-s-tetragidrofuran-3-iloksibenzilbenzola.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения кристаллической формы 1-хлор-4-(β-d-глюкопираноз-1-ил)-2-[4-((s)-тетрагидрофуран-3-илокси)бензил]бензола</a>
Предыдущий патент: Способ получения полиэтилена со сверхвысокой молекулярной массой
Следующий патент: Сборно-разборный кассетный павильон для круглогодичного содержания пчел (срп-1)
Случайный патент: Устройство для присоединения линии подачи охлаждающей среды к валку












