Промотор для экспрессии генов в вирусах осповакцины и/или в клетках, инфицированных вирусом осповакцины, и способы его применения
Формула / Реферат
1. Промотор, состоящий из нуклеотидной последовательности или содержащий нуклеотидную последовательность, выбранную из группы, включающей:
(i) любую нуклеотидную последовательность SEQ ID NO: 2-4, 6 и 8-12,
(ii) нуклеотидную последовательность длиной по меньшей мере 15 нуклеотидов любой последовательности SEQ ID NO: 2-4 и 6 и
(iii) производные любой последовательности SEQ ID NO: 8-12, причем в производном не более 10 нуклеотидов являются замененными, делетированными и/или встроенными по сравнению с любой соответствующей последовательностью SEQ ID NO: 8-12,
причем промотор является активным в качестве промотора вирусов осповакцины и/или активен в клетках, инфицированных вирусом осповакцины.
2. Экспрессионная кассета, содержащая промотор по п.1, а также кодирующую последовательность, где экспрессия кодирующей последовательности находится под контролем указанного промотора.
3. Экспрессионная кассета по п.2, в которой кодирующая последовательность кодирует терапевтические белки или пептиды, антигены, антигенные эпитопы, антисмысловую РНК или рибозимы.
4. ДНК, содержащая промотор по п.1 или экспрессионную кассету по любому из пп.2 или 3.
5. Вектор, содержащий промотор по п.1 или экспрессионную кассету по любому из пп.2 или 3.
6. Вектор по п.5, выбранный из плазмидных векторов и вирусных векторов.
7. Вектор по п.6, где вирусный вектор представляет собой вирус осповакцины.
8. Вектор по п.7, где вирус осповакцины представляет собой модифицированный вирус осповакцины штамма Анкара (MVA), предпочтительно штамм MVA-BN, депонированный в Европейской коллекции клеточных культур (ECACC) под номером V00083008, или его производное, штамм MVA 572, депонированный в ECACC под номером VA94012707, или штамм MVA 575, депонированный в ECACC под номером V00120707.
9. Вектор по п.8, в котором промотор по п.1 или экспрессионная кассета по любому из пп.2 или 3 встроены в природный делеционный сайт генома MVA.
10. Вектор по п.9, в котором промотор по п.1 или экспрессионная кассета по любому из пп.2 или 3 встроены либо в несущественную часть вирусного генома, либо в межгенную область вирусного генома.
11. Применение вектора по любому из пп.5-10 в качестве вакцины или лекарственного средства для индукции иммунного ответа против чужеродного антигена.
12. Вакцина или лекарственное средство для индукции иммунного ответа против чужеродного антигена, содержащая экспрессионную кассету по любому из пп.2 или 3, ДНК по п.4 или вектор по любому из пп.5-10.
13. Вакцина или лекарственное средство по п.12, содержащая по меньшей мере 102 TCID50 (инфекционная доза для тканевой культуры) вирусного вектора по любому из пп.7-10.
14. Способ вакцинации, включающий введение вакцины по п.12 или 13 при первой иммунизации ("первичная вакцинация") и при второй иммунизации ("ревакцинация").
15. Фармацевтическая композиция, содержащая экспрессионную кассету по любому из пп.2 или 3, ДНК по п.4 или вектор по любому из пп.5-10.
16. Фармацевтическая композиция по п.15, содержащая по меньшей мере 102 TCID50 (инфекционная доза для тканевой культуры) вирусного вектора по любому из пп.7-10.
17. Способ индукции иммунного ответа против чужеродного антигена, включающий введение фармацевтической композиции по п.15 или 16, где фармацевтическую композицию вводят в терапевтически эффективном количестве при первой иммунизации ("первичная вакцинация") и при второй иммунизации ("ревакцинация").
18. Применение экспрессионной кассеты по любому из пп.2 или 3 для получения вакцины или лекарственного средства индукции иммунного ответа против чужеродного антигена.
19. Применение ДНК по п.4 для получения вакцины или лекарственного средства для индукции иммунного ответа против чужеродного антигена.
20. Применение вектора по любому из пп.5-10 для получения вакцины или лекарственного средства для индукции иммунного ответа против чужеродного антигена.
21. Способ введения кодирующей последовательности в клетку-мишень, предусматривающий введение вектора по любому из пп.5-10, экспрессионной кассеты по любому из пп.2 или 3 или ДНК по п.4 в клетку-мишень.
22. Способ получения пептида, белка и/или вируса, предусматривающий инфицирование клетки-хозяина вирусным вектором по любому из пп.6-10, культивирование инфицированной клетки-хозяина в подходящих условиях, и выделение и/или обогащение пептида, и/или белка, и/или вируса, продуцированного указанной клеткой-хозяином.
23. Способ получения пептида, белка и/или вируса, предусматривающий трансфекцию клеток экспрессионной кассетой по любому из пп.2 или 3, ДНК по п.4или плазмидным вектором по п.6 и инфицирование указанных клеток вирусом осповакцины, культивирование инфицированных клеток в подходящих условиях и выделение и/или обогащение пептида, и/или белка, и/или вирусов, продуцированных указанными клетками, где стадию инфицирования клеток вирусом осповакцины можно осуществлять до или после стадии трансфекции.
24. Клетка, содержащая экспрессионную кассету по любому из пп.2 или 3 или вирусный вектор по любому из пп.6-10.
25. Применение промотора по п.1 для экспрессии кодирующей последовательности, где кодирующая последовательность не является последовательностью, которая обычно присоединена к промотору в вирусе осповакцины.
26. Способ получения вектора по любому из пп.5-10, предусматривающий стадию встраивания экспрессионной кассеты по любому из пп.2 или 3 в векторный геном.
Текст
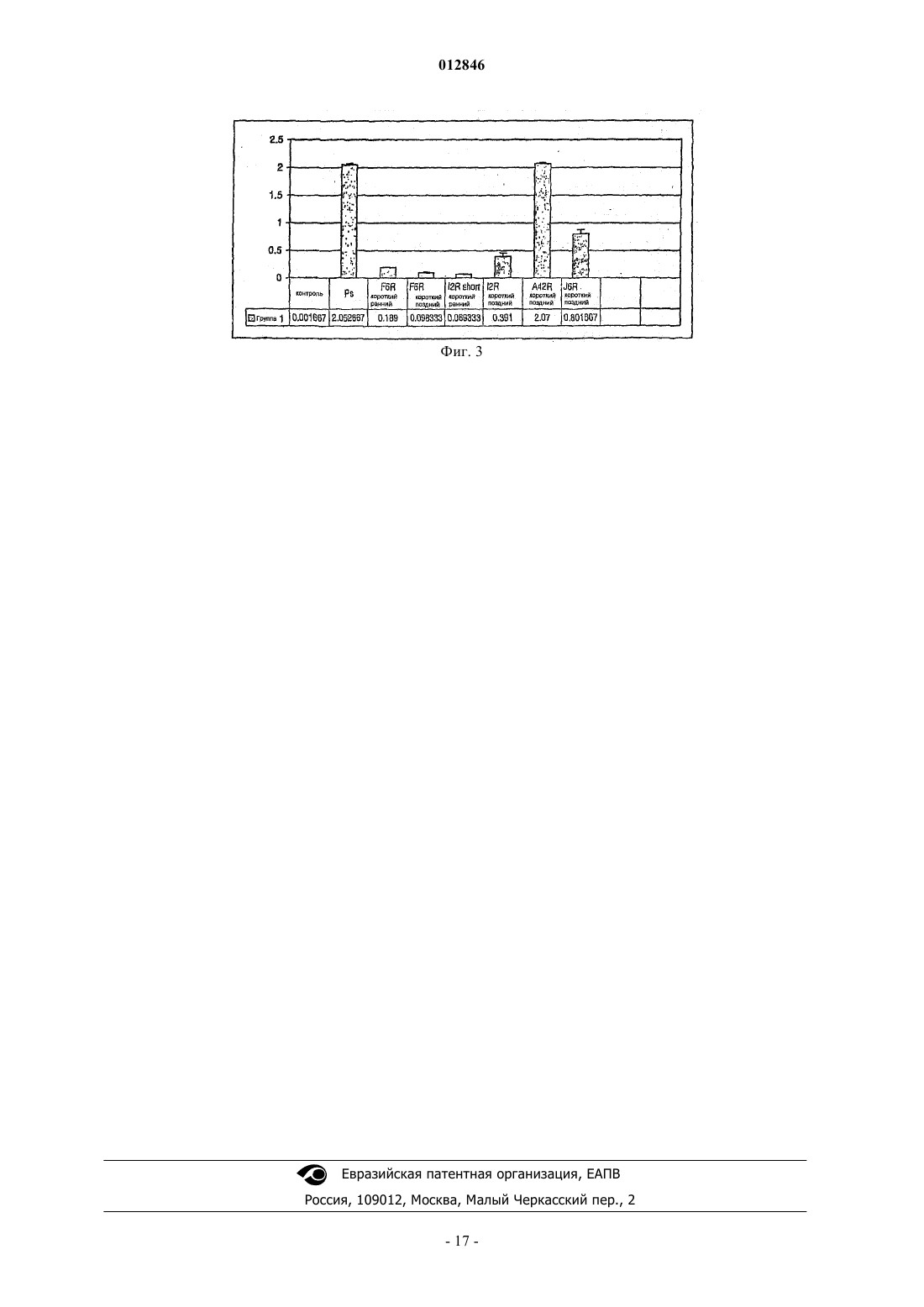
012846 Настоящее изобретение относится к промоторам, в частности промоторам для экспрессии генов и/или кодирующих последовательностей в вирусах осповакцины, таких как модифицированный вирус осповакцины штамма Анкара (MVA). Кроме того, настоящее изобретение относится к экспрессионным кассетам, содержащим указанный промотор, к векторам, содержащим указанные экспрессионные кассеты, а также к фармацевтическим композициям и вакцинам. Известный уровень техники Рекомбинантные поксвирусы широко используются для экспрессии чужеродных антигенов в инфицированных клетках. Более того, рекомбинантные поксивирусы постоянно исследуют в качестве необычайно перспективных вакцин для индукции иммунного ответа на чужеродный антиген, экспрессируемый в соответствующем поксвирусном векторе. Наиболее известными являются, с одной стороны, авипоксвирусы (вирусы оспы птиц) и, с другой стороны, вирусы осповакцины, в частности модифицированный вирус осповакцины штамма Анкара (MVA). MVA близок вирусу осповакцины, представителю рода ортопоксвирусов семейства поксвирусов (Poxviridae). MVA был получен в результате серии из 516 пассажей штамма Анкара вируса осповакцины (CVA) в эмбриональных фибробластах цыпленка (см. обзорMayr A., et al., Infection 3, 6-14 [1975]). В результате столь длительных пассажей в полученном MVA вирусе произошла делеция около 31 тыс. оснований геномной последовательности, и, следовательно, он был описан как высокоблагоприятный хозяин, ограниченный клетками птиц (Meyer H. et al., J. Gen. Virol,72, 1031-1038 [1991]). На различных животных моделях, которые получали MVA, было показано, что он является практически авирулентным (Mayr A.Danner K. [1978] Dev. Biol. Stand. 41:225-34). Кроме того, данный штамм MVA проходил клиническую проверку в качестве вакцины для иммунизации против оспы человека (Mayr et al., Zbl. Bakt. Hyg. I, Abt. Org. В 167, 375-390 [1987], Stickl и et al., Dtsch. med.Wschr. 99, 2386-2392 [1974]). В патентах США 5736368 и 6051410 раскрыт рекомбинантный штамм вируса осповакциныWyeth, который экспрессирует антигены и белки ВИЧ. В патенте США 5747324 раскрыт рекомбинантный штамм вируса осповакцины NYCBH, экспрессирующий гены лентивируса. В патенте EP О 243029 раскрыт рекомбинантный штамм вируса осповакцины Western Reserve, экспрессирующий гены ретровируса человека. В патенте WO 02/42480 раскрыты, в частности, безопасные и аттенуированные штаммы MVA. Рекомбинантный MVA раскрыт, в частности, в патентах WO 98/13500 и WO 03/048184. Для экспрессии гетерологичных генов в поксвирусах специалистам в данной области известны лишь несколько промоторов, такие как промоторы 30K и 40K (см., например, патент США 5747324),сильный синтетический ранний/поздний промотор (см., например, Sutter et al., Vaccine (1994) 12, 103240), промотор Р 7.5 (см., например, Endo et al., J. Gen. Virol. (1991) 72, 699-703), а также промотор, полученный из гена А-типа инклюзии (ATI) (Li et al., J. Gen. Virol. (1998) 79, 613). Все эти промоторы используют в рекомбинантных вирусах осповакцины для экспрессии гетерологичных генов и, как было показано, для экспрессии указанных генов, что приводит к продукции белка, кодируемого гетерологичными генами. Поскольку для экспрессии генов в экспрессионных системах вируса осповакцины доступны лишь немногие промоторы, существует общая необходимость в других промоторах для вирусов осповакцины. Кроме того, все известные до сих пор промоторы представляют собой достаточно сильные поздние промоторы, т.е. промоторы, которые можно применять для экспрессии генов после репликации вектора вируса осповакцины. В некоторых случаях желательно иметь промоторы, делающие возможной экспрессию генов сразу же после инфицирования ими клетки, т.е. существует необходимость в ранних промоторах вируса осповакцины. Кроме того, как указано выше, из-за улучшенной безопасности MVA является весьма перспективным вирусом для экспрессии гетерологичных генов. Вместе с тем, все известные до сих пор промоторы для экспрессии гетерологичных генов в MVA были получены из других вирусов осповакцины либо представляют собой синтетические промоторы для экспрессии в других вирусах осповакцины. Следовательно, существует также необходимость в промоторах, оптимизированных для экспрессии в MVA. Подробное описание настоящего изобретения Настоящее изобретение относится к промоторам, полученным из генома модифицированного(штамма Анкара) вируса коровьей оспы (MVA). MVA-промоторы не известны в данной области. В частности, настоящее изобретение относится к промоторам, содержащим или состоящим из нуклеотидной последовательности, выбранной из группы, включающей:(i) любую нуклеотидную последовательность из нижеприведенных SEQ ID NO: 1-6(ii) субпоследовательности любой последовательности SEQ ID NO: 1-6;(iii) последовательности с одной или несколькими нуклеотидными заменами, делециями и/или вставками в последовательностях, определенных в (i) или (ii). Последовательности SEQ ID NO: 1-6 представляют собой природную часть генома MVA и расположены в направлении 3'-5' от рамок считывания A42R, J6R, F6R, I2R, C7L и B9R соответственно. Промоторы по настоящему изобретению являются предпочтительно активными в качестве промоторов вируса осповакцины или же активными в качестве промоторов в инфицированных вирусом осповакцины клетках. Используемый вирус осповакцины предпочтительно представляет собой MVA, в частности один из штаммов MVA, как указано ниже. "Активный в качестве промотора вируса осповакцины" означает, что промотор способен направлять экспрессию гена, к которому он функционально присоединяется в вирусе осповакцины после инфицирования клеток указанным вирусом. Клетки представляют собой предпочтительно клетки, которые обеспечивают позднюю и/или раннюю экспрессию вируса осповакцины. "Промотор, активный в клетках, инфицированных вирусом осповакцины" включает также ситуацию, когда промотор не является частью генома вируса осповакцины, а, например, является частью плазмиды или вирусного генома, не принадлежащего вирусу осповакцины; в такой ситуации промотор по настоящему изобретению будет активен в том случае, если клетка, содержащая промотор, также содержит геном вируса осповакцины, например, если клетка инфицирована вирусом осповакцины. В этих обстоятельствах РНК-полимераза вируса узнает промотор по настоящему изобретению, и активируется экспрессия гена/кодирующей последовательности, который(ая) присоединена к промотору. В соответствии с настоящим изобретением также возможно использовать любой промотор, определенный как последовательность SEQ ID NO: 1-6. Промотор, который обычно используют для направления экспрессии гена/кодирующей последовательности, может состоять из любой последовательностиSEQ ID NO: 1-6, либо обычно используемым промотором может быть большая структура, которая содержит любую последовательность SEQ ID NO: 1-6. Также в рамках настоящего изобретения находится применение производного этих промоторов, которое может представлять собой субпоследовательность любой последовательности SEQ ID NO: 1-6. Термин "субпоследовательность любой последовательностиSEQ ID NO: 1-6" относится к более коротким фрагментам любой последовательности SEQ ID NO: 1-6,которые также активны в качестве промотора, в частности в качестве промотора вируса осповакцины,либо в инфицированных вирусом осповакцины клетках. Снова, вирус осповакцины предпочтительно представляет собой MVA, такой как один из указанных ниже штаммов. Характерная субпоследовательность любой последовательности SEQ ID NO: 1-6 имеет длину по меньшей мере 15 нуклеотидов, более предпочтительно по меньшей мере 20 нуклеотидов, еще более предпочтительно по меньшей мере 25 нуклеотидов, наиболее предпочтительно по меньшей мере 30 нуклеотидов любой последовательностиSEQ ID NO: 1-6. Предпочтительной субпоследовательностью SEQ ID NO: 1 является SEQ ID NO: 7. Предпочтительной субпоследовательностью SEQ ID NO: 2 является SEQ ID NO: 8. Предпочтительными субпоследовательностями и/или производными указанных субпоследовательностей SEQ ID NO: 3 являются SEQ IDNO: 11 и SEQ ID NO: 12. Последовательности SEQ ID NO: 6-12 представлены в разделе "Примеры". Производное промотора, содержащего или состоящее из нуклеотидной последовательности любойSEQ ID NO: 1-6 или их субпоследовательностей, в частности производное нуклеотидной последовательности SEQ ID NO: 7-12, также может быть последовательностью с одной или несколькими нуклеотидными заменами, делециями и/или вставками в любой последовательности SEQ ID NO: 1-6 или в их субпоследовательностях, в особенности в нуклеотидных последовательностях из числа SEQ ID NO: 7-12. Производные по настоящему изобретению также активны в качестве промотора, в частности в качестве промотора вируса осповакцины, или в инфицированных вирусом осповакцины клетках, более предпочтительно в качестве MVA промотора MVA или в инфицированных MVA клетках. Последовательность с одной или несколькими нуклеотидными заменами представляет собой последовательность, в которой один или несколько нуклеотидов любой последовательности SEQ ID NO: 1-6 или их субпоследовательностей, таких как любая субпоследовательность SEQ ID NO: 7-12, заменены другими нуклеотидами. Последовательность с одной или несколькими нуклеотидными вставками представляет собой последовательность, в которой один или несколько нуклеотидов встроены в одну или несколько областей любой SEQ ID NO: 1-6 или их субпоследовательностей, в частности нуклеотидных последовательностейSEQ ID NO: 7-12. Последовательность с одной или несколькими нуклеотидными делециями представляет собой последовательность, в которой делетирован один или несколько нуклеотидов любой последовательности SEQ ID NO: 1-6 или их субпоследовательностей, в частности нуклеотидных последовательностей SEQ ID NO: 7-12. В производных по настоящему изобретению делеции, замены или вставки могут быть объединены в одной последовательности. Примером производной субпоследовательности по настоящему изобретению является SEQ ID NO: 10, которая представляет собой субпоследовательность SEQ ID NO: 3 с одной дополнительной нуклеотидной заменой по сравнению с соответствующей нуклеотидной последовательностью SEQ ID NO: 3. Предпочтительно производное по меньшей мере на 40%, более предпочтительно по меньшей мере на 60%, еще более предпочтительно по меньшей мере на 80%, наиболее предпочтительно по меньшей мере на 90% гомологично любой последовательности SEQ ID NO: 1-6 или их субпоследовательностям, в частности любой последовательности SEQ ID NO: 7-12. В соответствии с наиболее предпочтительным вариантом осуществления настоящего изобретения в любой последовательности SEQ ID NO: 7-12 заменены, удалены и/или встроены не более 10 нуклеотидов, еще более предпочтительно не более 5 нуклеотидов. Документы уже известного уровня техники позволяют специалистам в данной области прогнозировать, какие производные или субпоследовательности любой SEQ ID NO: 1-12 будут обладать биологической активностью, будучи активными в качестве промотора вируса коровьей оспы, в частности, в качестве активного промотора MVA. В этой связи можно сделать ссылку на Chakrarbarti et al., Biotechniques(1997) 23, 1094-1097, and Davison and Moss. J. Mol. Biol. (1989) 210, 771-784. Кроме того, специалист в данной области легко оценит, будет ли фрагмент активным в качестве промотора вируса коровьей оспы,в частности в качестве промотора MVA. В частности, производное последовательности можно клонировать в плазмидную конструкцию в направлении 3'-5' от репортерного гена. Такая конструкция может быть трансфецирована в клеточную линию или в эукариотическую клетку, такую как клетки CEF илиBHK, которые инфицированы MVA. Определяют экспрессию репортерного гена и сравнивают с экспрессией репортерного гена, находящегося под контролем промотора любой SEQ ID NO: 1-6. Производное по настоящему изобретению представляет собой производное с промоторной активностью в указанной тест-системе, которая составляет по меньшей мере 10%, предпочтительно по меньшей мере 30%,более предпочтительно по меньшей мере 50%, еще более предпочтительно по меньшей мере 70%, наиболее предпочтительно по меньшей мере 90% активности промоторной последовательности любой SEQID NO: 1-6. Также в рамках настоящего изобретения находятся производные любой последовательностиSEQ ID NO: 1-12 с большей промоторной активностью. Промоторы по настоящему изобретению особенно подходят для экспрессии кодирующих последовательностей в MVA. Промотор, основанный на SEQ ID NO: 1, обладает очень высокой активностью, особенно в качестве позднего промотора, хотя его также можно использовать и в качестве раннего промотора. Такие же соображения применимы в отношении соответствующих субпоследовательностей, таких как последовательность SEQ ID NO: 7, которая, однако, особенно подходит в качестве позднего промотора. Промотор, основанный на SEQ ID NO: 2, также обладает весьма сильной активностью, особенно в качестве позднего промотора. Также его можно использовать в качестве раннего промотора. Такие же соображения применимы в отношении соответствующих субпоследовательностей, как последовательность SEQ ID NO: 8, которая, однако, особенно подходит в качестве позднего промотора. Промотор, основанный на SEQ ID NO: 3, особенно подходит в качестве раннего промотора и из всех проверенных промоторов обладает наибольшей активностью раннего промотора. Однако его также можно использовать в качестве позднего промотора. Те же соображения применимы в отношении соответствующих субпоследовательностей, таким как последовательности SEQ ID NO: 9 и 10, соответственно. Из этих субпоследовательностей SEQ ID NO: 9 особенно подходит в качестве раннего промотора, aSEQ ID NO: 10 особенно подходит в качестве позднего промотора. Промотор, основанный на SEQ ID NO: 4, является особенно подходящим, если он предназначен для ранней и поздней экспрессии присоединенной кодирующей последовательности, так как этот промотор обладает весьма высокой активностью в раннем, а также в позднем состоянии. Те же соображения применимы в отношении соответствующих субпоследовательностей, таких как последовательности SEQ IDNO: 11 и 12 соответственно. Из этих субпоследовательностей SEQ ID NO: 11 особенно подходит в качестве раннего промотора, a SEQ ID NO: 12 особенно подходит в качестве позднего промотора. Промоторы, основанные на SEQ ID NO: 5 и 6, являются особенно эффективными, если они предназначены для экспрессии присоединенных кодирующих последовательностей в относительно небольших малых количествах. Это иногда желательно, если присоединяемая кодирующая последовательность гена кодирует продукт токсичного гена и/или если промоторы предназначены для индукции иммунного ответа с высоким уровнем авидности. Термин "ранний промотор" относится к промоторам, которые активны в вирусе осповакцины или же в клетках, инфицированных вирусом осповакцины, перед репликацией вирусной ДНК. Специалистам в данной области известны способы проверки, является ли тот или иной промотор ранним промотором. В частности, интересующий промотор можно встроить в направлении 3'-5' от репортерного гена. Конструкцию, содержащую промотор и репортерный ген, вводят в клетки, инфицированные вирусом осповакцины. Для определения его активности в качестве раннего промотора клетки инкубируют вместе с веществом, которое ингибирует репликацию ДНК, таким как AraC. Репликация ДНК необходима как предварительное условие для активности позднего промотора. Таким образом, любая промоторная активность,измеряемая в этой системе исследования, должна быть обусловлена элементами, активными в качестве раннего промотора. Следовательно, термин "поздний промотор" относится к любому промотору, который проявляет свою активность после репликации ДНК. Позднюю активность также можно измерить способами, известными специалистам в данной области. Для простоты термин "поздний промотор", как он используется в настоящем изобретении, относится к активности промотора, которая определяется в отсутствие добавления вещества, которое блокирует репликацию ДНК. В соответствии с еще одним вариантом осуществления настоящее изобретение относится к экспрессионной кассете, содержащей промотор по настоящему изобретению и кодирующую последовательность, где экспрессия кодирующей последовательности находится под контролем указанного промотора. Экспрессионная кассета предпочтительно не является природной экспрессионной кассетой генома вируса осповакцины. Таким образом, если промотор по настоящему изобретению представляет собой природный промотор генома вируса осповакцины, то последовательность, к которой указанный промотор присоединен, предпочтительно отличается от последовательности, к которой обычно присоединен промотор в геноме вируса осповакцины. Другими словами, если промотор по настоящему изобретению идентичен природному промотору, то кодирующая последовательность, экспрессия которой находится под контролем промотора, и/или последовательности, расположенные между промотором и кодирующей последовательностью, отличаются от соответствующих последовательностей, к которым обычно присоединен указанный промотор. Термин "отличается" в контексте настоящего описания относится к последовательностям, которые отличаются по меньшей мере по одному нуклеотиду в указанной последовательности. Предпочтительно последовательность представляет собой кодирующую последовательность, которая отличается по меньшей мере по одному нуклеотиду. В соответствии с другими вариантами гомология между кодирующей последовательностью в экспрессионной кассете и последовательностью, к которой обычно присоединен промотор, составляет менее 90, менее 80, менее 70, менее 60, менее 50, менее 40 или даже менее 20%. Наиболее предпочтительно, когда кодирующая последовательность,которая находится под контролем промотора, по настоящему изобретению кодирует пептид/белок, отличающийся по меньшей мере по одной аминокислоте от природного белка, кодируемого указанной кодирующей последовательностью. В качестве примера экспрессионная кассета не является экспрессионной кассетой, содержащей природный промотор C7L вируса осповакцины, направляющий экспрессию природного С 7L-гена, например, экспрессионная кассета не является экспрессионной кассетой, описанной вWO 2004/015118, содержащей промотор C7L и кодирующую последовательность C7L. С другой стороны, если последовательность, которая должна экспрессироваться, является природной последовательностью вируса осповакцины, то промотор, который используется для экспрессии указанной последовательности, отличается от промотора, который направляет экспрессию этой кодирующей последовательности в природной ситуации. В соответствии с этим вариантом нуклеотидная последовательность промотора отличается по меньшей мере одним нуклеотидом от природной последовательности промотора вируса осповакцины. В соответствии с еще одним вариантом гомология между промотором по настоящему изобретению, который контролирует экспрессию последовательности вируса осповакцины и природным промотором, присоединенным к последовательности вируса осповакцины,составляет менее 90, менее 80, менее 70, менее 60, менее 50 или даже менее 40%. Предпочтительно кодирующая последовательность может кодировать по меньшей мере один антигенный эпитоп или антиген, терапевтические пептиды или белки, антисмысловую РНК или рибозимы.-4 012846 Если кодирующая последовательность кодирует антигенный эпитоп или антиген, то экспрессионную кассету можно использовать для экспрессии указанного антигена после введения указанной экспрессионной кассеты в клетки организма, например в клетки животного, в том числе в клетки человека. Презентация указанного антигена/эпитопа может вызывать иммунный ответ организма, что может приводить к вакцинации организма против агента, из которого получен этот антиген/эпитоп. Более конкретно,эпитоп/антиген может быть частью большой аминокислотной последовательности, такой как полипептид, пептид или белок. Предпочтительно, кодирующая последовательность кодирует по меньшей мере один антигенный эпитоп или антиген, терапевтические пептиды или белки, антисмысловую РНК или рибозимы, которые не кодируются в геноме вируса осповакцины. Примерами таких полиэпитопов, пептидов или белков могут быть полиэпитопы, пептиды и белки,полученные (i) из вирусов, в частности из вирусов, отличных от вирусов осповакцины, таких как ВИЧ,HTLV, герпесвирус, вирус Денге, полиовирус, вирус кори, вирус свинки, вирус краснухи, вирус гепатита и т.д., (ii) из бактерий, (iii) из грибов, (iv) из полипептидов/белков злокачественных опухолей, таких как антигены злокачественных опухолей. Кроме того, кодирующая последовательность может кодировать терапевтическое соединение, такое как интерлейкины, интерфероны, рибозимы или ферменты. В общих чертах, настоящее изобретение относится к любой последовательности нуклеиновых кислот, содержащей промотор по настоящему изобретению и/или экспрессионную кассету по настоящему изобретению. Нуклеиновая кислота может представлять собой РНК, например, если промотор является частью ретровирусного генома. Более предпочтительно нуклеиновая кислота представляет собой ДНК. Такая ДНК может быть ДНК любого типа, например линейной, кольцевой, одноцепочечной или двухцепочечной ДНК. В соответствии с еще одним вариантом осуществления настоящего изобретения промотор и/или экспрессионная кассета по настоящему изобретению может быть частью вектора. Термин "вектор" относится к любому вектору, известному специалистам в данной области. Вектор может быть плазмидным вектором, таким как pBR322 или вектором серии pUC. Более предпочтительно вектор представляет собой вирусный вектор. В контексте настоящего изобретения термин "вирусный вектор" или "вектор на основе вируса" относится к инфекционному вирусу, содержащему вирусный геном. В этом случае ДНК по настоящему изобретению является частью вирусного генома соответствующего вирусного вектора. Рекомбинантный вирусный геном является упакованным, и полученные рекомбинантные векторы можно использовать для инфицирования клеток и клеточных линий, в частности, для инфицирования животных,включая человека. Обычные векторы на основе вирусов, которые могут использоваться по настоящему изобретению, представляют собой аденовирусные векторы, ретровирусные векторы или векторы на основе аденоассоциированного вируса 2 (AAV2). Наиболее предпочтительными являются поксвирусные векторы. Поксвирус может быть предпочтительно поксвирусом канареек, поксвирусом домашней птицы или вирусом осповакцины. Более предпочтительным является модифицированный вирус осповакцины штамма Анкара (MVA)"MVA", используемый в настоящем изобретении, относится к любому штамму MVA, известному в данной области. Примером штамма MVA является депонированный штамм VR-1508, депонированный вAmerican Type Culture collection (ATCC), Manassa, VA 20108, США. Другими примерами вирусных штаммов MVA, используемых по настоящему изобретению, являются штаммы MVA 572 и 575, задепонированные в European Collection of Animal Cell Cultures (ECACC), Salisbury (UK) с депозитными номерами ECACC V94012707 и ЕХАСС V00120707, соответственно и MVA-BN с депозитным номеромMVA-штамм штаммом MVA-BN или его производным, а также способы получения MVA-BN или его производное, раскрыты в WO 02/42480. Содержание этой заявки приведено в настоящем изобретении в качестве ссылки. В частности, ссылка сделана для определения свойств вируса осповакцины по настоящему изобретению, как описано в WO 02/42480, таких как свойства MVA, а также свойства и определение производных MVA-BN. Кроме того, в указанной ссылке раскрыто, каким образом MVA и другие вирусы осповакцины могут размножаться. Вкратце, эукариотические клетки инфицируют вирусом. Эти эукариотические клетки представляют собой клетки, которые восприимчивы к инфицированию соответствующим поксвирусом, а также у которых возможна репликация и продукция инфекционного вируса. Для MVA примером такого типа клеток являются фибробласты эмбриона цыпленка (CEF) и BHL-клеткиprimary cells" J. Gen. Virol. (1998), 79, 347-352). CEF-клетки можно культивировать в условиях, известных специалисту в данной области. Предпочтительно, клетки CEF культивируют в бессывороточной среде в неподвижных колбах или во вращающихся бутылях. Инкубирование предпочтительно осуществляют в течение 48-96 ч при-5 012846 372 С. Для инфицирования MVA предпочтительно используют множественность заражения (MOI) со значением от 0,05 до 1 TCID50, и инкубирование предпочтительно осуществляют 48-72 ч при 372 С. Специалистам в данной области известны способы введения в вирусный геном экспрессионную кассету или промотор по настоящему изобретению, в частности в геном вируса осповакцины, наиболее предпочтительно в геном MVA. В качестве примера экспрессионную кассету, или промотор, или его производное по настоящему изобретению можно встроить в геном MVA путем гомологичной рекомбинации. С этой целью пермиссивную клеточную линию, такую как, например, как CEF или ВНК-клетки,трансфицируют нуклеиновой кислотой, где нуклеиновая кислота содержит экспрессионную кассету или промотор, или его производное по настоящему изобретению, фланкированные нуклеотидными участками, которые гомологичны области генома MVA, в которую необходимо встроить экспрессионную кассету или промотор, или его производное по настоящему изобретению. Клетки инфицируют MVA, и в инфицированных клетках происходит гомологичная рекомбинация между нуклеиновой кислотой и вирусным геномом. В другом варианте, также возможно вначале инфицировать клетки MVA, а затем трансфицировать инфицированные клетки нуклеиновой кислотой. И опять в клетках происходит рекомбинация. Затем способами, известными в данной области, отбирают рекомбинантный MVA. Конструирование рекомбинантного MVA не ограничивается этим конкретным способом. Кроме него, для этой цели можно использовать любой подходящий способ, известный специалистам в данной области. Экспрессионную кассету или промотор по настоящему изобретению можно вводить в любую подходящую часть вектора, в частности в вирусный геном. В случае вирусов осповакцины встраивание можно осуществлять в несущественные участки вирусного генома или в межгенную область генома вируса. Термин "межгенная область" относится предпочтительно к тем участкам вирусного генома, которые располагаются между двумя соседними генами, которые не содержат кодирующих последовательностей. Если вектор представляет собой MVA, то встраивание можно также осуществлять в природный делеционный сайт вирусного генома. Термин "природный делеционный сайт" относится к тем частям вирусного генома, которые делетированы по сравнению с геномом штамма Copenhagen вируса осповакцины. Однако сайты встраивания не ограничиваются этими предпочтительными инсерционными сайтами в геноме вируса осповакцины и в геноме MVA, поскольку в рамках настоящего изобретения экспрессионная кассета может быть встроена в любом месте вирусного генома при условии, что возможно получить рекомбинанты, которые можно амплифицировать и размножить по меньшей мере в одной системе клеточной культуры, такой как фибробласты эмбрионы цыпленка (клетки CEF). Промотор по настоящему изобретению можно использовать для экспрессии гена, который уже является частью вектора, например геном MVA. Такой ген может представлять собой природный ген вирусного генома или чужеродный ген, который встроен в вектор. В этих случаях промотор по настоящему изобретению встраивают в направлении 3'-5' от гена в векторе, экспрессия которого должна находиться под контролем этого промотора. MVA-вектор, содержащий экспрессионную кассету по настоящему изобретению, можно также создать путем замены любой открытой рамки считывания A42R, J6R, F6R, I2R,C7L и B9R на кодирующую последовательность, экспрессия которой должна находится под контролем промотора, которая является природным промотором экспрессии указанной открытой рамки считывания. Так, в качестве примера, кодирующую последовательность A42R или ее части можно заменить кодирующей последовательностью, которую необходимо экспрессировать. В полученной конструкции указанная кодирующая последовательность находится под контролем промотора по настоящему изобретению, а именно под контролем промоторной последовательности SEQ ID NO: 1 и SEQ ID NO: 7. Эти экспрессионные кассеты также входят в состав настоящего изобретения. В соответствии с еще одним вариантом осуществления настоящее изобретение относится к вектору,используемому в соответствии с настоящим изобретением в качестве вакцины или лекарственного средства. В общем смысле, изобретение относится к вакцине или к фармацевтической композиции, содержащей экспрессионную кассету, ДНК или вектор по настоящему изобретению. Специалистам в данной области известны способы введения в организм животного или человека вакцины или фармацевтической композиции. В случае ДНК и плазмидных векторов, ДНК и вектор можно просто вводить путем инъекции. Если вектор представляет собой вирусный вектор, такой как вектор вируса осповакцины, в частности MVA-вектор, то его также можно вводить в организм животного или человека на основании знаний специалиста в данной области, например, путем внутривенного, внутримышечного, интраназального,интрадермального или подкожного введения. Дополнительные подробности о количестве вводимого вируса даны ниже. Фармацевтическая композиция или вакцина может обычно содержать кроме промотора, экспрессионной кассеты или вектора по настоящему изобретению один или несколько фармацевтически приемлемых и/или одобренных носителей, добавок, антибиотиков, консервантов, адъювантов, разбавителей и/или стабилизаторов. Такими вспомогательными веществами могут быть вода, физиологический раствор, глицерин, этанол, увлажняющие или эмульгирующие средства, изменяющие рН вещества или тому подобное. Подходящими носителями, как правило, являются большие, медленно метаболизируемые молекулы, такие как белки, полисахариды, полимолочные кислоты, полигликолевые кислоты, полимерные аминокислоты, аминокислотные сополимеры, липидные комплексы и т.п.-6 012846 Для получения фармацевтических композиций или вакцин, ДНК, экспрессионную кассету или вектор по настоящему изобретению, в частности рекомбинантный вирус осповакцины, такой как рекомбинантный MVA, преобразуют в физиологически приемлемую форму. В случае вирусов осповакцины, в частности MVA, это можно осуществить на основе опыта получения поксвирусных вакцин, используемых для вакцинации против вируса натуральной оспы (как описано у Syickl H. et al. [1974] Dtsch. med.Wschr. 99, 2386-2392). Например, очищенный вирус хранят при -80C с титром 5108 TCID50/мл препарата в около 10 мМ Tris, 140 мМ NaCl рН 7,4. Для получения доз вакцины, к примеру, 101109 частиц рекомбинантного вируса по настоящему изобретению, лиофилизуют в фосфатно-солевом буферном растворе (PBS) в присутствии 2% пептона и 1% альбумина человека в ампуле, предпочтительно в стеклянной ампуле. В другом варианте дозы вакцин можно получать постадийным высушиванием замораживанием препарата вируса. Такой препарат может содержать дополнительные добавки, такие как маннит,декстран, сахар, глицин, лактозу или поливинилпирролидон, или любые добавки, такие как антиоксиданты или инертный газ, стабилизаторы или рекомбинантные белки (например, альбумин сыворотки крови человека), подходящие для введения in vivo. Типичная композиция, содержащая вирус, подходящая для высушивания замораживанием, содержит 10 мМ Tris-буфер, 140 мМ NaCl, 18,9 г/л декстрана (MW 36000-40000), 45 г/л сахарозы, 0,108 г/л моногидрата монокалиевой соли L-глутаминовой кислоты, рН 7,4. Стеклянную ампулу затем герметизируют и хранят в течение нескольких месяцев при температуре в диапазоне от 4C до комнатной температуры. Однако при отсутствии необходимости в ампулах препарат хранят предпочтительно при температурах ниже -20C. Для вакцинации или лечения лиофилизат или высушенный замораживанием продукт можно растворить в 0,1-0,5 мл водного раствора, предпочтительно в воде, физиологическим растворе или Trisбуфере, и вводить либо системно, либо местно, т.е. парентерально, внутримышечно или любым другим путем введения, известным практикующему специалисту. Специалист в данной области может подобрать режим введения, дозу и число введений известным способом. Таким образом, в соответствии с сопутствующим вариантом осуществления, настоящее изобретение относится к способу воздействия, предпочтительно, к индукции иммунного ответа в организме животного, в том числе человека, предусматривающему введение экспрессионной кассеты, ДНК, вектора,фармацевтической композиции или вакцины по настоящему изобретению для лечения животного или человека. Если вакцина представляет собой вирус осповакцины, в частности MVA, то обычная доза вакцины для человека содержит по меньшей мере 102, предпочтительно по меньшей мере 104, более предпочтительно по меньшей мере 106, еще более предпочтительно 107 или 108 TCID50 (инфекционная доза для тканевой культуры) вируса. Если вакцина представляет собой рекомбинантный MVA, в частности рекомбинантный MVA-BN, и его производные, то вирус можно использовать для первичной иммунизации. Таким образом, настоящее изобретение также относится к способу, в котором вектор представляет собой MVA, в частности MVABN, и его производные, и в котором указанный вектор, или композицию, или вакцину, содержащую указанный вектор, вводят животному, в том числе человеку, при необходимости такого введения в терапевтически эффективных количествах для первой иммунизации ("первичная вакцинация") и для второй иммунизации ("ревакцинация"). Настоящее изобретение также относится к способу введения кодирующей последовательности в мишеневую клетку, предусматривающему введение вектора, экспрессионной кассеты или ДНК по настоящему изобретению в мишеневую клетку. Если вектор представляет собой вирус осповакцины, в частности MVA, такой как MVA-BN, то мишеневая клетка может представлять собой клетку, в которой вирус способен реплицироваться, такую как клетки CEF или BHK, или клетку, которую можно инфицировать MVA, но в которой вирус не может реплицироваться (такую, например, как все типы клеток человека, инфицируемые штаммом MVA-BN). Настоящее изобретение также относится к способу получения пептида, белка и/или вируса, предусматривающему инфицирование клетки-хозяина вирусным вектором по настоящему изобретению, с последующим культивированием инфицированной клетки-хозяина в подходящих условиях, а также с последующим выделением и/или обогащением пептида, и/или белка, и/или вирусов, продуцируемых указанной клеткой-хозяином. Если предполагается получение, т.е. амплификация вируса по настоящему изобретению, то клетка должна представлять собой клетку, в которой вирус способен реплицироваться. В случае вирусов осповакцины, в частности MVA, подходящими клетками являются клетки CEF илиBHK. Если предполагается получение пептида/белка, кодируемого вирусным вектором по настоящему изобретению, то клетка может быть любой клеткой, которую можно инфицировать вирусным вектором,и в которой возможна экспрессия белков/пептидов, кодируемых вирусом. Настоящее изобретение также относится к способу получения пептида, белка и/или вируса, предусматривающему трансфекцию клетки с экспрессионной кассетой, ДНК или плазмидным вектором по настоящему изобретению, с последующим инфицированием клетки вирусом осповакцины. Инфицированную клетку-хозяин культивируют в подходящих условиях. Дополнительная стадия предусматривает выделение и/или обогащение пептида, и/или белка, и/или вирусов, продуцируемых клеткой-хозяином.-7 012846 Стадию инфицирования клетки-хозяина с помощью вируса осповакцины осуществляют до или после стадии трансфекции клеток. Настоящее изобретение также относится к клеткам, содержащим промотор, ДНК, экспрессионную кассету или вектор по настоящему изобретению. В частности, настоящее изобретение относится к клеткам, инфицированным вирусным вектором по настоящему изобретению. Краткое описание фигур Фиг. 1: активность GUS после экспрессии под контролем разных промоторов. Клетки инфицировали MVA-BN и трансфецировали соответствующими плазмидами. Через 48 ч клетки экстрагировали и определяли активность GUS непосредственно путем измерения экстинкции при 415 нм после ферментативной реакции, которая вызывает развитие желтой окраски. Zex=негативный контроль (клетки, инфицированные MVA-BN). Фиг. 2: активность GUS после ранней и ранней/поздней экспрессии. Клетки инфицировали MVA-BN и трансфицировали соответствующими плазмидами. Через 24 ч клетки экстрагировали и активность GUS непосредственно определяли путем измерения экстинкции при 415 нм после ферментативной реакции, которая вызывает развитие желтой окраски. Zex=негативный контроль (клетки, инфицированные MVA-BN). Что касается этой ферментативной реакции, то образцы без AraC (ранняя+поздняя) экспрессии должны быть инкубированы в течение 5 ч, а образцы с AraC (ранняя экспрессия) должны быть инкубированы в течение ночи для получения цветной реакции. Фиг. 3: активность GUS после экспрессии под контролем различных промоторов. Клетки инфицировали с помощью MVA-BN и трансфецировали соответствующими плазмидами. Через 24 ч клетки экстрагировали и активность GUS непосредственно определяли путем измерения экстинкции при 415 нм после ферментативной реакции, которая вызывает развитие цветной реакции. Контроль=негативный контроль (клетки, инфицированные MVA-BN). Примеры Нижеследующий(е) пример(ы) дополнительно иллюстрирует(ют) настоящее изобретение. Специалистам в данной области очевидно, что представленный(е) пример(ы) ни в коей мере не могут быть интерпретированы так, что ограничивают применимость способа по настоящему изобретению этим(и) примером(ами). Пример 1. Анализ промоторов для экспрессии кодирующих последовательностей в геноме MVABN. 1.1. Цель эксперимента. Целью приведенного здесь анализа является идентификация промоторов, подходящих для экспрессии кодирующих последовательностей в геноме MVA, предпочтительно кодирующих последовательностей, которые гетерологичны природному геному MVA. В частности, встраивание двух или большего числа генов в единственный сайт встраивания является преимуществом применения различных промоторов для экспрессии единичных генов для снижения риска рекомбинационных событий, которые могут привести к делеции одного из чужеродных генов. Кроме того, желательно иметь промоторы разной силы для возможности экспрессировать чужеродные гены, встроенные в рекомбинантный штамм MVA-BN в разном количестве, в зависимости от силы данного промотора. Всего было выделено 11 вероятных промоторов. Эти вероятные промоторные последовательности клонируют в плазмидную конструкцию(pBSKS+). Для того чтобы проанализировать возможную активность промоторов, их сливают с репортерным геном GUS (-глюкуронидаза E. coli). Клетки BHK (почки хомячка) инфицируют MVA-BN и трансфецируют плазмидами, содержащими вероятные промоторы, слитые с геном GUS. Если промотор функционален, то GUS экспрессируется и может быть количественно определен путем ферментативной реакции с GUS. В качестве положительного контроля и в качестве эталона используют известные и охарактеризованные промоторы р 7.5 и Ps вируса осповакцины, которые сливают с GUS и параллельно анализируют. Измеряя экспрессию GUS вероятные промоторы скринируют на активность, силу и/или раннюю/позднюю экспрессию. Раннюю/позднюю экспрессию проверяют путем добавления в культуральную среду AraC (арабинозид-цитозин). Функционально активные промоторы, а именно Ps, р 7.5, 7.5L иATI-промотор, которые были известны из уровня техники, а также идентифицированные промоторные последовательности, которые обычно участвуют в контроле экспрессии открытых рамок считыванияMVA, A42L, B9R, C7L, F6R, I2R, J6R, предпочтительно могут использоваться для экспрессии чужеродных генов в рекомбинантных MVA-конструкциях (recMVA-BN). 1.2. Материал. Клетки: ВНК-клетки Вирус: стандартный исходный штамм MVA-BN (7,5107 TCID50) ДНК: pAB-GUS (Ps-промотор+GUS)pBNX85 (pBluescript+MVA-J6R-промотор (SEQ ID NO: 2+GUS) Набор для трансфекции: Effectene transfection kit (Qiagen) Среда и добавки: DMEM (Gibco BRL) и 10% FCS Химические реагенты и буферы: Буфер для лизиса (PBS+0,1% тритона+1 мМ протеазного ингибитора)AraC (Sigma, Cat. No. C1768) Субстрат GUS: 1 мМ (пара-нитрофенил-бета-(D)-глюкуронид; Sigma, Cat. No. N1627) Стоп-раствор: 2,5 M (2-амино-2-метил-1,3-пропандиол; Sigma, Cat. No. A9754) 1.3. Методы. Посев клеток. В лунку 6-луночного планшета высевают 5105 клеток BHK для реакции трансфекции и поддерживают их в DMEM/10%FCS в течение ночи при 37 С и 5% CO2. Инфицирование/трансфецирование. Клетки инфицируют MVA-BN (moi 0,1) в 0,5 мл DMEM/10%FCS на лунку и инкубируют в течение 1 ч при комнатной температуре на шейкере. Трансфекцию осуществляют, как описано в протоколе производителей. В буфере EB (общий объем 100 мкл) разбавляют 2 мкг плазмиды. После добавления 3,2 мкл энхансерного раствора раствор перемешивают и инкубируют в течение 5 мин при комнатной температуре. Затем добавляют 10 мкл реактива Effectene, суспензию перемешивают и инкубируют в течение 10 мин при комнатной температуре. Суспензию вируса отделяют от клеток и добавляют 1,6 млDMEM/10%FCS. K ДНК-Effectene-смеси добавляют 0,6 мл DMEM/10%FCS и по каплям добавляют на клетки при вращении культурального планшета. Затем клетки инкубируют 7, 24 или 48 ч в зависимости от анализа. Для анализа ранней/поздней экспрессии в культуральную среду во время инфицирования и трансфекции добавляют AraC (40 мкг/мл). Сбор культивированных клеток. Среду отделяют от клеток и добавляют 0,5 мл буфера для лизиса. После встряхивания в течение 15 мин при комнатной температуре клетки соскабливают в литический буфер, переносят их 1,5-мл реакционную пробирку и энергично встряхивают. Лизированные клетки центрифугируют в течение 1 мин при 500 об/мин и прозрачный супернатант с температурой 4C переносят в чистую пробирку и хранят при-20C перед использованием. Определение GUS-активности. В 1 мл предварительно нагретого раствора субстрата (37C) добавляют 10 мкл клеточного экстракта(=белку из 2104 клеток) и инкубируют при 37C до появления желтой окраски. Затем образцы сразу помещают на лед и добавляют 0,4 мл стоп-раствора. Определяют экстинкцию при 415 нм и сравнивают с активностью GUS, как экстинкцию, значение находит линейный ряд от 0,05 до 2,0. Раствор субстрата используют в качестве стандарта, а клеточный экстракт из клеток, инфицированных MVA-BN, используют в качестве негативного контроля. 1.4. Эксперименты и результаты. Эксперимент 1. Определение функции условных промоторов. В первом эксперименте анализируют все плазмиды, которые содержат вероятный MVA-промотор или охарактеризованный промотор слитый с геном GUS. Клетки инфицируют MVA-BN (moi 0.1) и трансфецируют соответствующей плазмидой. Через 48 ч клетки собирают, лизируют и определяют активность GUS. Эксперимент осуществляют для определения, какие промоторы являются функциональными. Результаты представлены на фиг. 1. Негативный контроль (экстракт клеток, инфицированныхMVA-BN) ясно свидетельствует об отсутствии активности GUS (Zex; экстинкция 0,001). Показано, что известный сильный синтетический промотор Ps весьма эффективен (Ps; экстинкция 0,87), поскольку через 48 ч экспрессии определяется высокий уровень GUS. Кроме того, известный природный промотор pr 7.5 вируса коровьей оспы также проявляет весьма высокую активность (р 7.5; экстинкция 0,41). Поздняя часть pr 7.5 (7.5L; экстинкция 0,25) тоже демонстрирует четко определяемую активность. ATI-промотор вируса осповакцины ясно демонстрирует весьма эффективную экспрессию чужеродных генов под MVABN (ATI; экстинкция 0,76). Что касается областей вероятных промоторов генома MVA-BN, было показано, что A42R (А 42; экстинкция 0,48), B9R (В 9; экстинкция 0,06), C7L (С 7; экстинкция 0,055), F6R (F6;-9 012846 экстинкция 0,208), I2R (I2; экстинкция 0,130) и J6R (J6; экстинкция 0,290) представляют собой функциональные промоторы. Промоторы, которые четко проявляют активность (экстинкция 0,05) в первом предварительном эксперименте, затем были охарактеризованы более подробно (эксперимент 2). Эксперимент 2. Характеристика экспрессии промоторов. Промоторы, которые проявили активность в эксперименте 1, были охарактеризованы в отношении параметров их экспрессии. С этой целью клетки, инфицированные с помощью MVA-BN и трансфецированные соответствующей плазмидой, инкубируют с AraC. AraC ингибирует репликацию ДНК, что является существенной предпосылкой для поздней экспрессии генов в течение репликационного цикла MVA. Параллельно такой же эксперимент осуществляют без добавления AraC. Инфицированные и трансфецированные клетки собирают через 24 ч и активность GUS определяют в трех повторениях. На фиг. 2 показана средняя экстинкция каждого образца. После инкубирования без AraC (-AraC) в течение 24 ч для всех промоторов четко определяется суммарная экспрессия GUS (ранняя+поздняя) (фиг. 2: правые колонки). Активность идентифицированных промоторов образует непрерывный снижающийся ряд: I2R (I2)A42R (А 42)F6R (F6)J6R (J6)B9R (В 9) = C7L (С 7). Показано, что промоторы В 9, С 7 и J6 участвуют, в основном, в поздней экспрессии на протяжении жизненного цикла MVA, в то время как инкубация с AraC (+AraC), который подавляет позднюю экспрессию, приводит к уровню экспрессии GUS, сравнимому с уровнем экспрессии в негативном контроле (Zex). Хотя промотор C7L, по-видимому, проявляет относительно слабую активность и признаки того, что он играет существенную роль во время ранней экспрессии. Промоторы A42R, I2R и F6R четко демонстрируют очень эффективную раннюю экспрессию. Что касается определения ранней экспрессии, то образцы инкубируют в течение ночи для получения визуализируемой цветной реакции. Данные результаты не могут быть напрямую сравнены с величинами ранней+поздней экспрессии (фиг. 2: -AraC), поскольку инкубацию проводили лишь в течение 5 ч. Промоторы, которые не показали ранней экспрессии, вновь анализируют через 7 ч экспрессии, и результаты, полученные через 24 ч, могут подтвердиться (данные не представлены). 1.5. Заключение. Было ясно показано, что можно получать промоторы разной силы, и что в настоящее время имеется спектр доступных промоторов, которые демонстрируют примеры различных параметров экспрессии в зависимости от продолжительности инкубации и возможности репликации MVA-BN. Когда ранняя+поздняя экспрессия является предпочтительной, тогда, предпочтительно, используют промоторыA42R, I2R и F6R. Если раннюю экспрессию необходимо исключить (например, для чужеродных генов,которые содержат стоп-сигнал TTTTTNT для ранней экспрессии), предпочтительно, использовать промоторы B9R, J6R или C7L. Пример 2. Анализ минимальных промоторных элементов, получаемых из SEQ ID NO: 1-4. В примере 1 идентифицировано несколько последовательностей, которые, в частности, могут использоваться для экспрессии чужеродных генов в MVA-геноме. Чтобы проверить, удовлетворяют ли более короткие фрагменты этой же цели, осуществляют дополнительные эксперименты. Более короткие фрагменты SEQ ID NO: 1-4 выделяют с помощью ПЦР и клонируют в плазмидную конструкцию(pBSKS+). Всего протестировано 6 вероятных минимальных промоторов. Для анализа их возможной активности, данные промоторы сливают с репортерным геном GUS. ВНК-клетки инфицируют MVA-BN и трансфецируют плазмидами, содержащими вероятные минимальные промоторы, слитые с геном GUS. Измеряя экспрессию GUS условные промоторы скринируют на активность и силу экспрессии (см. пример 1). В качестве положительного контроля и в качестве стандарта известный как поздний промотор Ps вируса осповакцины сливают с GUS и анализируют параллельно. Минимальные промоторные элементы размером около 30 п.н. можно использовать для экспрессии чужеродных генов в рекомбинантных MVAконструкциях (recMVA-BN) без риска гомологичной рекомбинации между гомологичными последовательностями основного и дополнительного клонируемого промотора. 2.1. Материал и метод. Материалы и методы, используемые в примере 2, соответствуют методам из примера 1, если не указано иначе. ПЦР осуществляют в соответствии со стандартными методами. 2.2. Эксперименты и результаты. Слияние промоторов с геном GUS с помощью ПЦР. Методы ПЦР позволяют сливать нижеследующие минимальные промоторные последовательности с GUS-геном: Все условные минимальные промоторы, слитые с геном GUS, клонируют в pBSKS+ и секвенируют. Определяют функцию данных условных минимальных промоторов. Для того чтобы проанализировать активность условных минимальных промоторных элементов,клетки BHK инфицируют MVA-BN (moi 1.0) и трансфецируют соответствующей плазмидой. Через 24 ч клетки собирают, лизируют и определяют GUS-активность (фиг. 3). Негативный контроль (экстракт из клеток, инфицированных MVA-BN) ясно свидетельствует об отсутствии активности GUS (контроль; средняя экстинкция 0,00167). Показано, что известный как сильный синтетический промотор Ps весьма эффективен (Ps; средняя экстинкция 2,05267), поскольку через 24 ч определяется большое количество GUS. Что касается минимальных промоторных элементов условного промотора MVA-BN-генома, то было показано, что короткий ранний F6R, короткий поздний F6R, короткий ранний I2R, короткий поздний I2R, короткий поздний A42R и короткий поздний J6R - все они являются функциональными промоторами. Всего было выделено шесть функциональных минимальных промоторных элементов. Два подходящих для более слабой ранней транскрипции (короткий ранний I2R: средняя экстинкция 0,06933; короткий ранний F6R: средняя экстинкция 0,189), а четыре пригодны для поздней экспрессии разного уровня (короткий поздний F6R: средняя экстинкция 0,09833; короткий поздний I2R: средняя экстинкция 0,391; короткий поздний J6R: средняя экстинкция 0,80167, и короткий поздний A42R: средняя экстинкция 2,07). 2.3. Заключение. Четко показано, что можно выделять промоторы разной силы и что в настоящее время доступны самые разнообразные промоторы. Если предпочтительной является ранняя экспрессия, то предпочтительно использовать минимальный промотор короткий ранний F6R или короткий ранний I2R. Если же предпочтителен поздний промотор, а раннюю экспрессию следует исключить (например, для чужеродных генов, которые содержат стоп-сигнал TTTTTNT для ранней экспрессии), то предпочтительно использовать минимальные промоторные элементы, короткий поздний F6R, короткий поздний J6R и короткий поздний A42R. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Промотор, состоящий из нуклеотидной последовательности или содержащий нуклеотидную последовательность, выбранную из группы, включающей:(i) любую нуклеотидную последовательность SEQ ID NO: 2-4, 6 и 8-12,(ii) нуклеотидную последовательность длиной по меньшей мере 15 нуклеотидов любой последовательности SEQ ID NO: 2-4 и 6 и(iii) производные любой последовательности SEQ ID NO: 8-12, причем в производном не более 10 нуклеотидов являются замененными, делетированными и/или встроенными по сравнению с любой соответствующей последовательностью SEQ ID NO: 8-12,причем промотор является активным в качестве промотора вирусов осповакцины и/или активен в клетках, инфицированных вирусом осповакцины. 2. Экспрессионная кассета, содержащая промотор по п.1, а также кодирующую последовательность,где экспрессия кодирующей последовательности находится под контролем указанного промотора. 3. Экспрессионная кассета по п.2, в которой кодирующая последовательность кодирует терапевтические белки или пептиды, антигены, антигенные эпитопы, антисмысловую РНК или рибозимы. 4. ДНК, содержащая промотор по п.1 или экспрессионную кассету по любому из пп.2 или 3. 5. Вектор, содержащий промотор по п.1 или экспрессионную кассету по любому из пп.2 или 3. 6. Вектор по п.5, выбранный из плазмидных векторов и вирусных векторов. 7. Вектор по п.6, где вирусный вектор представляет собой вирус осповакцины. 8. Вектор по п.7, где вирус осповакцины представляет собой модифицированный вирус осповакцины штамма Анкара (MVA), предпочтительно штамм MVA-BN, депонированный в Европейской коллекции клеточных культур (ECACC) под номером V00083008, или его производное, штамм MVA 572, депонированный в ECACC под номером VA94012707, или штамм MVA 575, депонированный в ECACC под номером V00120707. 9. Вектор по п.8, в котором промотор по п.1 или экспрессионная кассета по любому из пп.2 или 3 встроены в природный делеционный сайт генома MVA. 10. Вектор по п.9, в котором промотор по п.1 или экспрессионная кассета по любому из пп.2 или 3 встроены либо в несущественную часть вирусного генома, либо в межгенную область вирусного генома. 11. Применение вектора по любому из пп.5-10 в качестве вакцины или лекарственного средства для индукции иммунного ответа против чужеродного антигена. 12. Вакцина или лекарственное средство для индукции иммунного ответа против чужеродного антигена, содержащая экспрессионную кассету по любому из пп.2 или 3, ДНК по п.4 или вектор по любому из пп.5-10. 13. Вакцина или лекарственное средство по п.12, содержащая по меньшей мере 102 TCID50 (инфекционная доза для тканевой культуры) вирусного вектора по любому из пп.7-10. 14. Способ вакцинации, включающий введение вакцины по п.12 или 13 при первой иммунизации("первичная вакцинация") и при второй иммунизации ("ревакцинация"). 15. Фармацевтическая композиция, содержащая экспрессионную кассету по любому из пп.2 или 3,ДНК по п.4 или вектор по любому из пп.5-10.- 15012846 16. Фармацевтическая композиция по п.15, содержащая по меньшей мере 102 TCID50 (инфекционная доза для тканевой культуры) вирусного вектора по любому из пп.7-10. 17. Способ индукции иммунного ответа против чужеродного антигена, включающий введение фармацевтической композиции по п.15 или 16, где фармацевтическую композицию вводят в терапевтически эффективном количестве при первой иммунизации ("первичная вакцинация") и при второй иммунизации("ревакцинация"). 18. Применение экспрессионной кассеты по любому из пп.2 или 3 для получения вакцины или лекарственного средства индукции иммунного ответа против чужеродного антигена. 19. Применение ДНК по п.4 для получения вакцины или лекарственного средства для индукции иммунного ответа против чужеродного антигена. 20. Применение вектора по любому из пп.5-10 для получения вакцины или лекарственного средства для индукции иммунного ответа против чужеродного антигена. 21. Способ введения кодирующей последовательности в клетку-мишень, предусматривающий введение вектора по любому из пп.5-10, экспрессионной кассеты по любому из пп.2 или 3 или ДНК по п.4 в клетку-мишень. 22. Способ получения пептида, белка и/или вируса, предусматривающий инфицирование клеткихозяина вирусным вектором по любому из пп.6-10, культивирование инфицированной клетки-хозяина в подходящих условиях, и выделение и/или обогащение пептида, и/или белка, и/или вируса, продуцированного указанной клеткой-хозяином. 23. Способ получения пептида, белка и/или вируса, предусматривающий трансфекцию клеток экспрессионной кассетой по любому из пп.2 или 3, ДНК по п.4 или плазмидным вектором по п.6 и инфицирование указанных клеток вирусом осповакцины, культивирование инфицированных клеток в подходящих условиях и выделение и/или обогащение пептида, и/или белка, и/или вирусов, продуцированных указанными клетками, где стадию инфицирования клеток вирусом осповакцины можно осуществлять до или после стадии трансфекции. 24. Клетка, содержащая экспрессионную кассету по любому из пп.2 или 3 или вирусный вектор по любому из пп.6-10. 25. Применение промотора по п.1 для экспрессии кодирующей последовательности, где кодирующая последовательность не является последовательностью, которая обычно присоединена к промотору в вирусе осповакцины. 26. Способ получения вектора по любому из пп.5-10, предусматривающий стадию встраивания экспрессионной кассеты по любому из пп.2 или 3 в векторный геном.
МПК / Метки
МПК: A61K 39/275, C12N 15/86
Метки: вирусом, экспрессии, вирусах, промотор, инфицированных, применения, генов, осповакцины, способы, клетках
Код ссылки
<a href="https://eas.patents.su/18-12846-promotor-dlya-ekspressii-genov-v-virusah-ospovakciny-i-ili-v-kletkah-inficirovannyh-virusom-ospovakciny-i-sposoby-ego-primeneniya.html" rel="bookmark" title="База патентов Евразийского Союза">Промотор для экспрессии генов в вирусах осповакцины и/или в клетках, инфицированных вирусом осповакцины, и способы его применения</a>
Предыдущий патент: Фармацевтическая композиция, содержащая зофеноприл и hctz, для лечения гипертензии
Следующий патент: Сложные моноэфиры пробукола для лечения сердечно-сосудистых и воспалительных заболеваний, опосредованных vcam-1
Случайный патент: Состав для порошковых покрытий на основе модифицированного акриловыми соединениями (со) полимера винилиденфторида, способ его получения и применение.