Получение рекомбинантных генов в прокариотических клетках с применением двух внехромосомных элементов
Номер патента: 12070
Опубликовано: 28.08.2009
Авторы: Родригес-Гомес Ана, Радман Мирослав, Матич Иван, Пети Мари-Аньес, Галич Татьяна
Формула / Реферат
1. Способ получения и детектирования рекомбинантных последовательностей ДНК у прокариот, включающий в себя стадии:
a) получения первичной прокариотической клетки, содержащей внехромосомную реципиентную молекулу ДНК, содержащую первую последовательность ДНК для рекомбинации и способную автономно реплицироваться в прокариотической клетке, и внехромосомную донорную молекулу ДНК, содержащую вторую последовательность ДНК для рекомбинации и, по меньшей мере, первую маркерную последовательность, кодирующую генный продукт и не способную к автономной репликации в прокариотической клетке,
b) культивирования первичной прокариотической клетки в селективных условиях, стимулирующих образование коинтеграта или гибридной молекулы между реципиентной и донорной молекулами ДНК, и рекомбинацию этих двух последовательностей ДНК для рекомбинации, и позволяющих рост и/или размножение клеток только в том случае, если экспрессирован генный продукт первой маркерной последовательности, и
c) выделения вторичной прокариотической клетки, растущей и/или размножающейся в селективных условиях и содержащей гибридную молекулу ДНК, по меньшей мере, с первой маркерной последовательностью и образованной из первой и второй последовательностей рекомбинантной последовательности ДНК, полученной вследствие рекомбинации между первой и второй последовательностями ДНК,
где прокариотическая клетка транзиторно или постоянно дефицитна по системе репарации ошибочного спаривания и
где донорная молекула ДНК и реципиентная молекула ДНК являются отличными друг от друга линейными или кольцевыми плазмидами.
2. Способ по п.1, где донорная молекула ДНК не имеет участка инициации репликации.
3. Способ по п.1, где донорная молекула ДНК имеет нефункциональный участок инициации репликации.
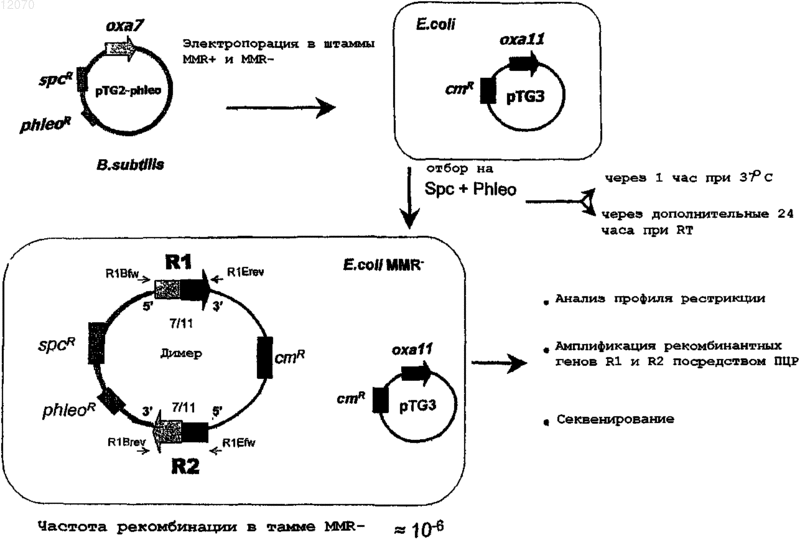
4. Способ по любому из пп.1-3, где донорная молекула ДНК представляет собой плазмиду Bacillus subtilis, не способную реплицироваться в Е. coli.
5. Способ по п.4, где донорная молекула ДНК представляет собой плазмиду В. subtilis pMIX91, содержащую маркер specR и маркер phleoR, или плазмиду В. subtilis pMIX101, содержащую маркер tcR.
6. Способ по любому из пп.1-5, где первая маркерная последовательность структуры донорной ДНК выбрана из группы, состоящей из пищевого маркера, маркера устойчивости к антибиотику и последовательности, кодирующей субъединицу фермента.
7. Способ по п.6, где генный продукт первой маркерной последовательности обеспечивает устойчивость к антибиотику клетки, чувствительной к этому антибиотику.
8. Способ по п.6 или 7, где первая маркерная последовательность представляет собой specR, генный продукт которого обеспечивает устойчивость клетки к спектиномицину, или phleoR, генный продукт которого обеспечивает устойчивость клетки к флеомицину, или tcR, генный продукт которого обеспечивает устойчивость клетки к тетрациклину.
9. Способ получения и детектирования рекомбинантных последовательностей ДНК у прокариот, включающий в себя стадии:
d) получения первичной прокариотической клетки, содержащей внехромосомную реципиентную молекулу ДНК, содержащую первую последовательность ДНК для рекомбинации и способную автономно реплицироваться в прокариотической клетке, и внехромосомную донорную молекулу ДНК, содержащую вторую последовательность ДНК для рекомбинации и, по меньшей мере, первую маркерную последовательность, кодирующую генный продукт и не способную к автономной репликации в прокариотической клетке,
e) культивирования первичных прокариотических клеток в селективных условиях, стимулирующих образование коинтеграта или гибридной молекулы между реципиентной и донорной молекулами ДНК и рекомбинацию двух последовательностей ДНК для рекомбинации и позволяющих рост и/или размножение клеток только в том случае, если экспрессирован генный продукт первой маркерной последовательности, и
f) выделения вторичных прокариотических клеток, растущих и/или размножающихся в селективных условиях и содержащих гибридную молекулу ДНК, по меньшей мере, с первой маркерной последовательностью и образованной из первой и второй последовательностей рекомбинантной последовательности ДНК, полученной вследствие рекомбинации между первой и второй последовательностями ДНК,
где донорная молекула ДНК представляет собой плазмиду В. subtilis pMIX91, содержащую маркер specR и маркер phleoR, или плазмиду В. subtilis pMIX101, содержащую маркер tcR.
10. Способ по п.9, где реципиентная молекула ДНК является линейной или кольцевой структурой ДНК, в частности плазмидой или бактериофагом.
11. Способ по п.9 или 10, где прокариотическая клетка имеет функциональную систему репарации ошибочного спаривания.
12. Способ по п.9 или 10, где прокариотическая клетка транзиторно или постоянно дефицитна по системе репарации ошибочного спаривания.
13. Способ по любому из пп.1-12, где реципиентная молекула ДНК представляет собой плазмиду, способную реплицироваться в Escherichia coli.
14. Способ по п.13, где реципиентная молекула ДНК представляет собой плазмиду Е. coli
pACYC184, или плазмиду Е. coli pMIX100, или их производное.
15. Способ по любому из пп.1-14, где донорная молекула ДНК и/или ее участок инициации репликации происходят из вида прокариота, отличного от прокариотического вида, в клетки которого вводят молекулу донорной ДНК.
16. Способ по любому из пп.1-15, где функционирование участка инициации репликации донорной ДНК нарушено мутацией.
17. Способ по любому из пп.1-16, где донорная молекула ДНК содержит вторую маркерную последовательность.
18. Способ по любому из пп.1-17, где реципиентная молекула ДНК содержит третью маркерную последовательность и, необязательно, четвертую маркерную последовательность.
19. Способ по п.17 или 18, где вторая, третья и четвертая маркерные последовательности представляют собой кодирующие или не кодирующие белки последовательности, выбранные из группы, состоящей из пищевых маркеров, пигментных маркеров, маркеров устойчивости к антибиотикам, маркеров чувствительности к антибиотикам, участков распознавания ферментов рестрикции, участков распознавания праймеров и последовательностей, кодирующих субъединицу фермента.
20. Способ по п.19, где генные продукты третьей и четвертой маркерных последовательностей реципиентной молекулы ДНК обеспечивают устойчивость к антибиотику клетки, которая чувствительна к этому антибиотику.
21. Способ по п.20, где генный продукт третьей маркерной последовательности обеспечивает устойчивость к тетрациклину.
22. Способ по п.20, где генный продукт четвертой маркерной последовательности обеспечивает устойчивость клетки к хлорамфениколу.
23. Способ по любому из пп.1-22, где первая и вторая последовательности ДНК для рекомбинации отличаются по меньшей мере двумя нуклеотидами.
24. Способ по любому из пп.1-23, где первая и вторая последовательности ДНК для рекомбинации являются встречающимися в природе последовательностями.
25. Способ по п.24, где первая и/или вторая последовательности ДНК для рекомбинации происходят из вирусов, бактерий, растений, животных и/или человеческих существ.
26. Способ по любому из пп.1-25, где первая и/или вторая последовательности ДНК для рекомбинации являются искусственными последовательностями.
27. Способ по любому из пп.1-26, где каждая из первой и второй последовательностей ДНК для рекомбинации содержит одну или несколько кодирующих белок последовательностей и/или одну или несколько некодирующих последовательностей.
28. Способ по любому из пп.1-27, где первичную прокариотическую клетку получают посредством одновременного или последовательного введения в прокариотическую клетку молекулы реципиентной ДНК и молекулы донорной ДНК.
29. Способ по п.28, где молекулы реципиентной и донорной ДНК вводят в прокариотическую клетку посредством трансформации, конъюгации, трансдукции, сексдукции и/или электропорации.
30. Способ по любому из пп.1-29, где первичную прокариотическую клетку культивируют в присутствии яю меньшей мере одного антибиотика, к которому генный продукт первой маркерной последовательности обеспечивает устойчивость.
31. Способ по п.30, где первичную прокариотическую клетку дополнительно культивируют в присутствии второго, третьего и/или четвертого антибиотиков, к которым генные продукты второй маркерной последовательности, третьей маркерной последовательности и четвертой маркерной последовательности, соответственно, обеспечивают устойчивость.
32. Способ по любому из пп.1-31, где прокариотическая клетка представляет собой клетку архебактерии или эубактерии.
33. Способ по п.32, где эубактерия представляет собой грамотрицательную бактерию, грамположительную бактерию или цианобактерию.
34. Способ по п.33, где грамотрицательная бактерия представляет собой Escherichia coli.
35. Способ по пп.1-8 и 12, где транзиторный или постоянный дефицит системы репарации ошибочного спаривания происходит вследствие мутации, делеции и/или индуцируемой экспрессии или репрессии одного или нескольких генов, вовлеченных в систему репарации ошибочного спаривания, обработки средством, насыщающим систему репарации ошибочного спаривания, и/или обработки средством, глобально нокаутирующим репарацию ошибочного спаривания.
36. Способ по пп.1-8, 12 и 35, где прокариотическая клетка несет мутантный ген mutS и/или мутантный ген mutL.
37. Способ по любому из пп.1-36, где первую и вторую рекомбинантные последовательности ДНК, содержащиеся в гибридной молекуле ДНК вторичной прокариотической клетки, отбирают, и/или выделяют, и/или анализируют.
38. Способ по п.37, где первую и вторую рекомбинантные последовательности ДНК выделяют посредством расщепления рестрикционными ферментами.
39. Способ по п.37, где первую и вторую рекомбинантные последовательности ДНК амплифицируют посредством ПЦР.
40. Способ по любому из пп.37-39, где выделенные первую и вторую рекомбинантные последовательности ДНК вставляют в донорную молекулу ДНК и реципиентную молекулу ДНК, соответственно, и подвергают другому циклу рекомбинации.
41. Применение плазмид В. subtilis pMIX91 и pMIX101 в качестве донорных молекул ДНК в способе по любому из пп.1-40 для получения и/или детектирования рекомбинантных последовательностей ДНК в прокариотической клетке-хозяине, предпочтительно в клетке Е. coli.
42. Применение плазмид Е. coli pACYC184 или pMIX100 или их производных в качестве реципиентной молекулы ДНК в способе по любому из пп.1-40 для получения и/или детектирования рекомбинантных последовательностей ДНК в прокариотической клетке-хозяине, предпочтительно в клетке Е. coli.
43. Способ получения в прокариотической клетке гибридного гена и/или кодируемого гибридным геном белка, где осуществляют способ по любому из пп.1-40, и в прокариотической клетке получают гибридный ген или кодируемый гибридным геном белок, и гибридный ген и/или кодируемый белок отбирают в прокариотической клетке и/или выделяют из нее после экспрессии.
Текст
012070 Настоящее изобретение в основном относится к способам in vivo для получения и детектирования рекомбинантных последовательностей ДНК в прокариотических клетках, в частности в бактериях, с применением двух различных внехромосомных элементов и внехромосомных элементов, в частности плазмид, которые можно применять для осуществления способов согласно изобретению. Последовательности ДНК, для которых подходят данные способы, включают в себя кодирующие и не кодирующие белки последовательности. Эволюция представляет собой непрерывный процесс наследственной изменчивости и фенотипической селекции. Генетическое разнообразие популяции можно увеличить созданием новых мутантных сочетаний, улучшающих характеристики индивидуумов в популяции. Направленную эволюцию микроорганизмов традиционно осуществляют в ходе процесса классического усовершенствования штамма посредством последовательных неспецифического мутагенеза и скрининга. До настоящего времени направленную эволюцию применяли почти исключительно как инструмент для белковой инженерии. Посредством способов создания мутаций, таких как сайт-специфический мутагенез, кассетный мутагенез, неспецифический мутагенез и вносящая ошибки ПЦР, получены варианты функций белков, и полученные таким образом библиотеки подвергнуты скринингу на предмет их способности осуществлять конкретную функцию. Рекурсивное применение данной процедуры успешно использовали для модификации физических и каталитических свойств ферментов, таких как оптимум рН,термостабильность, стабильность в растворах, стереоселективность, каталитическая активность и субстратная специфичность, а также механизмы токсической устойчивости у бактерий и диапазон хозяев, и стабильность вирусов. Подходы традиционного мутагенеза для получения новых свойств у ферментов имеют ряд ограничений. Данные подходы применимы только к генам или последовательностям, которые клонированы и функционально охарактеризованы и которые обладают отдельной функцией. Также с подходами традиционного мутагенеза можно исследовать только очень ограниченный ряд общего количества перестановок, даже для одного гена. Однако при определенных обстоятельствах для экспрессии белка с новыми свойствами может быть необходимо модифицировать не только один ген, но и дополнительные гены. Такие дополнительные гены могут представлять собой, например, гены, которые совместно обеспечивают единый фенотип, или гены, играющие роль в одном или нескольких клеточных механизмах, таких как транскрипция, трансляция, посттрансляционные модификации, секреция или протеолитическое разрушение генного продукта. Попытка индивидуальной оптимизации всех генов, обладающих такой функцией, посредством подходов традиционного мутагенеза была бы практически неосуществимой задачей. Подходы традиционного мутагенеза для получения новых свойств у ферментов имеют ряд ограничений. Данные подходы применимы только к генам или последовательностям, которые клонированы и функционально охарактеризованы и которые обладают отдельной функцией. Также с подходами традиционного мутагенеза можно исследовать только очень ограниченный ряд общего количества перестановок, даже для одного гена. Однако при определенных обстоятельствах для экспрессии белка с новыми свойствами может быть необходимо модифицировать не только один ген, но и дополнительные гены. Такие дополнительные гены могут представлять собой, например, гены, которые совместно обеспечивают единый фенотип, или гены, играющие роль в одном или нескольких клеточных механизмах, таких как транскрипция, трансляция, посттрансляционные модификации, секреция или протеолитическое разрушение генного продукта. Попытка индивидуальной оптимизации всех генов, обладающих такой функцией, посредством подходов традиционного мутагенеза была бы практически неосуществимой задачей. Большинство проблем, связанных с подходами традиционного мутагенеза, можно преодолеть посредством рекомбинационных подходов, включающих в себя случайную рекомбинацию различных последовательностей функциональных генов, обеспечивая молекулярное смешивание от природы сходных или случайным образом мутировавших генов. По сравнению с традиционным мутагенезом, вероятность получения мутантов с улучшенным фенотипом с применением рекомбинации значительно выше. Основные преимущества рекомбинационных подходов по сравнению с традиционными технологиями манипуляций с ДНК представляют собой, в частности, простоту экспериментирования и свободу от продиктованных последовательностью ДНК ограничений. Большинство из того, что известно о процессах рекомбинации, стало известно из исследований простых одноклеточных организмов, таких как бактерии. Изучение рекомбинации у таких организмов обладает преимуществом простоты манипуляции последовательностями ДНК и возможностью изучения событий специфической рекомбинации, индуцированных синхронно в большой части клеток. В равной степени важным является растущая убежденность в том, что изучаемые у микроорганизмов процессы в большинстве аспектов идентичны или сходны с путями, которыми клетки млекопитающих, например человеческие клетки, образуют генетическое разнообразие. Кроме того, определение этих механизмов приобрело дополнительную важность в поисках разработки более эффективных механизмов целенаправленного воздействия на гены и замещения генов в клетках млекопитающих. Хотя существует множество различных систем для осуществления рекомбинации в прокариотических клетках, большинство из них не обеспечивают простого и надежного детектирования новой, полученной в результате рекомбинации, последовательности ДНК. Таким образом, в данной области все еще-1 012070 существует необходимость в эффективных прокариотических тестовых системах, которые, в частности,обеспечивают быструю и простую детекцию рекомбинантов и/или отбор рекомбинантов под селективным давлением. Таким образом, технической проблемой, лежащей в основе настоящего изобретения, является предоставление улучшенных способов и средств для простого и эффективного получения рекомбинантных мозаичных генов в прокариотических клетках, в частности, для скрининга и детектирования таких рекомбинантных последовательностей. В настоящем изобретении данную лежащую в его основе техническую проблему решают посредством предоставления способа получения и детектирования рекомбинантных последовательностей ДНК у прокариот, включающего в себя следующие стадии:a) получение первичной прокариотической клетки, содержащей реципиентную молекулу ДНК, содержащую первую последовательность ДНК, для рекомбинации и способную автономно реплицироваться в прокариотической клетке, и донорную молекулу ДНК, содержащую вторую последовательность ДНК для рекомбинации и по меньшей мере первую маркерную последовательность, кодирующую генный продукт и не способную к автономной репликации в прокариотической клетке,b) культивирование первичных прокариотических клеток в селективных условиях, позволяющих рост и/или размножение клеток только в случае, если экспрессирован генный продукт первой маркерной последовательности, иc) выделение вторичных прокариотических клеток, растущих и/или размножающихся в селективных условиях и содержащих гибридную молекулу ДНК по меньшей мере с первой маркерной последовательностью и образованной из первой и второй последовательностей рекомбинантной последовательности ДНК, полученной вследствие рекомбинации между первой и второй последовательностями ДНК. Настоящее изобретение относится к прокариотической системе для скрининга событий рекомбинации по меньшей мере между двумя отличающимися, или гетерологичными, последовательностями ДНК или субстратами рекомбинации in vivo. Система согласно изобретению позволяет получить новые полезные последовательности ДНК с улучшенными свойствами быстрым и эффективным способом по меньшей мере из двух отличающихся последовательностей ДНК, способом, включающим в себя обмен invivo ДНК из двух внехромосомных элементов, содержащих две последовательности ДНК для рекомбинации. Два внехромосомных элемента с отсутствием гомологии в их нуклеотидных последовательностях вводят в прокариотическую клетку-хозяин в виде реципиентной молекулы ДНК и донорной молекулы ДНК. Реципиентная молекула может автономно реплицироваться у хозяина, тогда как донорная молекула не способна к репликации. Однако донорная молекула содержит по меньшей мере одну уникальную кодирующую белок маркерную последовательность, такую как маркер устойчивости к антибиотику или пищевой маркер, не присутствующий ни в геноме клетки-хозяин, ни в реципиентной молекуле. После введения обоих внехромосомных элементов прокариотическим клеткам-хозяевам клетки культивируют в условиях, стимулирующих рекомбинацию между двумя гетерологичными генами. Эти условия могут включать в себя, например, культивирование клеток в присутствии антибиотика, к которому клетки обычно чувствительны, или культивирование клеток в среде с отсутствием незаменимого питательного вещества, которое клетка не может синтезировать самостоятельно и которое, следовательно, необходимо добавлять извне. В применяемых условиях культивирования клетки могут расти и размножаться, т.е. делиться только в том случае, если экспрессирован генный продукт соответствующего маркера. Однако необходимым условием для экспрессии маркерной последовательности является то, что нереплицирующаяся донорная молекула и реплицирующаяся реципиентная молекула образуют коинтеграт, который может реплицироваться с участка инициации репликации реципиентной молекулы и, таким образом,обеспечивать наличие маркерной последовательности. Образование этого коинтеграта происходит в результате рекомбинации между двумя субстратами рекомбинации, приводящей к образованию новых молекул ДНК, последовательности которых отличаются от последовательностей исходных последовательностей ДНК. Таким образом, клетки-хозяева, растущие и размножающиеся в применяемых селективных условиях, содержат новые рекомбинантные последовательности ДНК. Таким образом, способ согласно изобретению обеспечивает простую и быструю систему селекции для идентификации рекомбинантных последовательностей ДНК. С применением способа согласно изобретению можно легко получать большие библиотеки рекомбинантных, мутантных последовательностей ДНК, и варианты, приобретшие желательную функцию, можно затем идентифицировать посредством применения подходящей системы селекции и скрининга. Изучение процессов рекомбинации в простом одноклеточном организме, таком как прокариотический организм, обладает очевидным преимуществом простоты манипуляции последовательностями ДНК и возможностью изучения событий специфической рекомбинации, индуцированных синхронно в большей части клеток. Кроме того, в течение последних нескольких десятилетий накоплено множество знаний и в ферментационной технологии, и в общей генетике прокариотических организмов. Другое большое преимущество прокариотических клеток-хозяев относится к их очень короткому времени удвоения. Таким образом, при применении прокариотических клеток-хозяев возможно провести множество циклов клеточного деления и, таким образом, множество циклов рекомбинации и получить множество новых-2 012070 рекомбинантных последовательностей ДНК в течение короткого периода. Способ согласно изобретению можно проводить или в прокариотических клетках дикого типа, или в прокариотических клетках, дефективных в отношении репарации ошибочного спаривания. Процессы,посредством которых происходит репарация поврежденной ДНК, и механизмы генетической рекомбинации тесно связаны, и известно, что система репарации ошибочного спаривания оказывает ингибирующее действие на частоту рекомбинации между отличающимися последовательностями, т.е. гомологичной рекомбинации. Таким образом, мутации в системе репарации ошибочного спаривания значительно увеличивают общую частоту рекомбинационных событий в прокариотических клетках. С другой стороны,известно, что прокариотические клетки дикого типа обладают зависимым от репарации ошибочного спаривания механизмом рекомбинации, основанным на расположенных на расстоянии друг от друга ошибочных спариваниях в двух субстратах рекомбинации. В зависимости от последовательностей ДНК для рекомбинации, для получения рекомбинантных последовательностей можно использовать или прокариотические клетки дикого типа, или прокариотические клетки, дефективные в отношении репарации ошибочного спаривания. Способ согласно изобретению для получения и детектирования последовательностей рекомбинантных ДНК обладает тем преимуществом, что можно подвергнуть рекомбинации значительно отличающиеся последовательности ДНК. Авторы изобретения неожиданно обнаружили, что можно вызвать рекомбинацию последовательностей с высокой степенью общего несоответствия и обладающих только очень короткими участками гомологии или идентичности. Анализ рекомбинантных последовательностей выявил, что наиболее протяженные участки идентичности, в которых происходила рекомбинация, содержали только 18-22 нуклеотидов. Большинство из событий рекомбинации происходило в гомологичных участках длиной 10-15 нуклеотидов. В некоторых случаях рекомбинация происходила на участках длиной только 4-5 нуклеотидов. Таким образом, способ согласно изобретению допускает рекомбинацию последовательностей ДНК,происходящих из различных прокариотических видов или различных прокариотических родов для получения рекомбинантных последовательностей ДНК с выгодными свойствами. Способ согласно изобретению для получения и детектирования последовательностей рекомбинантных ДНК обладает тем преимуществом, что можно рекомбинировать более двух отличающихся последовательностей, где две отличающиеся последовательности для рекомбинации могут представлять собой или предварительно отобранные, или неотобранные последовательности. Например, множество отличающихся последовательностей ДНК вплоть до полной геномной библиотеки можно вставлять в реципиентные, а также донорные молекулы ДНК. Потом отдельные отличающиеся последовательности ДНК можно самих с собой рекомбинировать случайным образом. Также возможно вставлять первый набор отличающихся последовательностей ДНК вплоть до полной геномной библиотеки только в реципиентные молекулы ДНК, а второй набор отличающихся последовательностей ДНК вплоть до полной геномной библиотеки вставлять в донорные молекулы ДНК, или наоборот, а затем рекомбинировать два набора друг с другом случайным образом. В обоих случаях не происходит селекции в отношении того, какая пара отличающихся последовательностей ДНК будет подвергнута рекомбинации. Однако также возможно по стадиям рекомбинировать несколько предпочтительных предварительно отобранных отличающихся последовательностей, где на каждой стадии проводят отбор в отношении того, какую пару отличающихся последовательностей необходимо рекомбинировать. Например, если необходимо рекомбинировать три отличающихся последовательности ДНК, то на первой стадии получают первые прокариотические клетки, где, например, в бактериальные клетки данного вида вводят реципиентную молекулу ДНК с первой последовательностью ДНК для рекомбинации и донорную молекулу ДНК со второй последовательностью ДНК для рекомбинации. Данные прокариотические клетки культивируют в селективных условиях так, что растут и размножаются только те клетки, в которых соответствующие реципиентные и донорные молекулы ДНК сформировали гибридную молекулу, обеспечивающую экспрессию маркерной последовательности донорной молекулы и рекомбинацию между двумя последовательностями ДНК для рекомбинации. Таким образом, получают вторичные прокариотические клетки, содержащие гибридную молекулу с первой и второй рекомбинантными вследствие рекомбинации последовательностями ДНК. Первую и вторую рекомбинантные последовательности выделяют и одну из них вставляют, например, в реципиентную молекулу, тогда как в донорную молекулу вставляют третью последовательность ДНК для рекомбинации. Затем, на следующей стадии, реципиентную молекулу, содержащую одну из рекомбинантных последовательностей, и донорную молекулу, содержащую третью последовательность ДНК для рекомбинации, снова вводят прокариотическим клеткам-хозяевам и подвергают еще одному циклу рекомбинации. Например, если необходимо рекомбинировать четыре отличающиеся последовательности ДНК, тогда на первой стадии получают два различных набора первичных прокариотических клеток. Например,первый набор первичных прокариотических клеток можно получать посредством введения в прокариотические клетки реципиентной молекулы ДНК с первой последовательностью ДНК для рекомбинации и донорной молекулы ДНК со второй последовательностью ДНК для рекомбинации. Подобным образом-3 012070 второй набор первичных прокариотических клеток можно получать посредством введения в клетки того же вида реципиентной молекулы ДНК с третьей последовательностью ДНК для рекомбинации и донорной молекулы ДНК с четвертой последовательностью ДНК для рекомбинации. Каждый набор прокариотических клеток культивируют в селективных условиях для осуществления рекомбинации. Таким образом, получают первый набор прокариотических клеток, содержащих гибридную молекулу с первой и второй рекомбинантными последовательностями ДНК, рекомбинантными вследствие рекомбинации между первой и второй последовательностями ДНК для рекомбинации. Также получают другой набор прокариотических клеток, содержащих гибридную молекулу с третьей и четвертой рекомбинантными последовательностями ДНК, рекомбинантными вследствие рекомбинации между третьей и четвертой последовательностями ДНК для рекомбинации. Затем полученные таким образом первую, вторую, третью и четвертую рекомбинантные последовательности ДНК выделяют из их соответствующих клеток-хозяев. На следующей стадии первую или вторую рекомбинантную последовательность можно вставлять в донорную молекулу ДНК, а третью и четвертую рекомбинантную последовательность - в реципиентную молекулу ДНК. Затем полученные таким образом донорную и реципиентную молекулы ДНК вводят в прокариотическую клетку-хозяина и подвергают еще одному циклу рекомбинации. Таким способом также можно рекомбинировать пять, шесть или более отличающихся последовательностей ДНК. В предпочтительном варианте осуществления изобретения донорная молекула ДНК и реципиентные молекулы ДНК представляют собой различные линейные или кольцевые структуры ДНК. Термин"структура ДНК" означает молекулу ДНК, например, вектор, такой как плазмида или бактериофаг, которая отличается тем, что при введении в прокариотическую клетку-хозяина присутствует в виде внехромосомного элемента. Таким образом, в контексте настоящего изобретения "внехромосомный элемент" представляет собой молекулу ДНК, не интегрирующуюся в хромосому(ы) прокариотической клеткихозяина. Донорная молекула ДНК должна быть способна гибридизоваться с реципиентной молекулой ДНК,так, чтобы могла образоваться гибридная молекула. Предпочтительно донорная молекула ДНК и реципиентная молекула ДНК в основном не обладают гомологией, за исключением последовательностей ДНК для рекомбинации. В соответствии с изобретением реципиентная молекула ДНК должна быть способна к автономной репликации в прокариотической клетке-хозяине при введении в эту клетку. Таким образом, реципиентная молекула ДНК должна обладать по меньшей мере одним участком инициации репликации, позволяющим реципиентной молекуле ДНК реплицироваться независимо от генетического материала хозяина. В контексте настоящего изобретения "участок инициации репликации", или "ori", представляет собой область молекулы ДНК, используемую клеточными ферментами для инициации репликации этой молекулы ДНК. В участке инициации репликации две цепи ДНК размыкаются с формированием репликационного глазка, что создает область одноцепочечных ДНК на каждой стороне глазка. Затем может присоединяться комплекс ДНК-полимеразы и начинать синтез новых цепей ДНК с использованием старых цепей в качестве матрицы. Как правило, малые ДНК, включающие в себя бактериальные плазмиды или бактериофаги, имеют один участок инициации репликации. В одном из вариантов осуществления изобретения реципиентная молекула ДНК представляет собой плазмиду, а именно двухцепочечную кольцевую молекулу ДНК. "Плазмида" представляет собой внехромосомный элемент, способный реплицироваться независимо от генетического материала хозяина. В другом варианте осуществления изобретения реципиентная молекула ДНК представляет собой бактериофаг, а именно фаг, ДНК которого присутствует в прокариотической клетке в виде внехромосомного элемента. В предпочтительном варианте осуществления изобретения реципиентная молекула ДНК представляет собой плазмиду, способную реплицироваться в клетке-хозяине Е. coli. Предпочтительно реципиентная молекула ДНК представляет собой плазмиду Е. coli pACYC184 или ее производное. ПлазмидаpACYC184 является TetR и CamR. В соответствии с изобретением донорная молекула ДНК представляет собой молекулу ДНК, не способную реплицироваться в прокариотической клетке-хозяине, но способную формировать гибридную молекулу с реципиентной ДНК. Таким образом, в качестве донорной молекулы ДНК можно использовать любую молекулу ДНК, при условии, что она содержит, по меньшей мере, маркерную последовательность и не может независимо реплицироваться в данной прокариотической клетке-хозяине. Примеры пригодных донорных молекул включают в себя в качестве неограничивающих примеров способные к замыканию в кольцо линейные двухцепочечные ДНК, например, полученные посредством ПЦР и содержащие соответствующую маркерную последовательность, плазмиды и бактериофаги. В случае применения в качестве донорной молекулы ДНК плазмиды или бактериофага, данная молекула или не имеет функционального участка(ов) инициации репликации совсем, или имеет участок(ки) инициации репликации, который(ые) у используемых прокариотических клеток-хозяев не функционален, т.е. не активен. Таким образом, в одном из вариантов осуществления донорная молекула ДНК не содержит участка инициации репликации. Это означает, что донорная молекула ДНК не содержит никакой последовательности, способной функционировать в какой-либо прокариотической клетке-хозяине в качестве участка-4 012070 инициации репликации, т.е. последовательности, с которой могут связываться белковые факторы, вовлеченные в инициацию репликации. Участок инициации репликации может отсутствовать вследствие делеции последовательностей нуклеиновых кислот, функционирующих в качестве участка инициации репликации. В другом варианте осуществления изобретения функционирование участка инициации репликации донорной молекулы ДНК нарушают посредством одной или нескольких мутаций, нарушающих или функционирование самого участка инициации репликации, или функционирование вовлеченных в репликацию белков, в частности белков, связывающихся с последовательностью нуклеиновой кислоты участка инициации репликации, посредством чего инициируется репликация. Например, известно, что у Е.coli ключевой белок инициации репликации, DnaA, связывается со специфическими последовательностями, так называемыми DnaA-боксами, на участке инициации репликации на хромосоме и расплавляет три АТ-богатых, 13-мерных прямых повтора. Полагают, что дополнительное связывание белка DnaA с одноцепочечными 6-мерными участками в открытой области стабилизирует открытый комплекс (для обзора см. Jiang et al., PNAS, 100 (2003), 8692-8697). DnaA-боксы и АТ-богатые области, как правило,находятся на участке инициации репликации множества прокариотических репликонов, и показано, что белок DnaA играет ключевую роль в инициации репликации в этих участках инициации репликации. Таким образом, определенные мутации DnaA-боксов и/или АТ-богатых областей или соответствующих участков в последовательности участка инициации репликации, такие как замещения, делеции и т.п. соответствующих оснований, могут предотвращать связывание белков, необходимых для инициации репликации, и, таким образом, ингибировать функционирование участка инициации репликации внехромосомного элемента. Таким образом, в предпочтительном варианте осуществления изобретения функционирование участка инициации репликации донорной молекулы ДНК можно нарушить посредством одной или нескольких мутаций в последовательности нуклеиновой кислоты участка инициации репликации донорной молекулы ДНК, в частности, в DnaA-боксах и/или АТ-богатых областях участка инициации репликации. Кроме того, известно, что одного белка DnaA недостаточно для формирования открытого комплекса в участке инициации репликации плазмид, таких как RK2, P1, F, pSC101 или R6K. В этих случаях для эффективного формирования открытого комплекса необходимо связывание плазмидного белка Rep, хотя и в сочетании с белком DnaA и белком HU или IHF (фактор интеграции хозяина) хозяина. Необходимость специфичного для плазмиды инициаторного белка для формирования открытого комплекса представляет собой ключ к способности плазмиды к осуществлению контроля над частотой событий инициации в ее участке инициации репликации (для обзора см. Jiang et al., PNAS, 100 (2003), 8692-8697). Это означает, что мутации плазмидных последовательностей нуклеиновых кислот, кодирующих белковые факторы с необходимыми для репликации плазмиды функциями, также могут нарушить функционирование участка инициации репликации внехромосомного элемента. Таким образом, в другом предпочтительном варианте осуществления изобретения функционирование участка инициации репликации донорной молекулы ДНК можно нарушать посредством одной или нескольких мутаций в последовательностях нуклеиновых кислот, кодирующих белковые факторы с необходимыми для репликации донорной молекулы ДНК функциями. В еще одном предпочтительном варианте осуществления изобретения донорная молекула ДНК содержит участок инициации репликации, активный только в определенных прокариотических клеткаххозяевах, но не в той прокариотической клетке, в которую вводят донорную молекулу ДНК для осуществления рекомбинации между двумя последовательностями ДНК для рекомбинации. Существует множество сообщений о том, что участок инициации репликации, активный в конкретных бактериальных видах, не функционирует в других видах бактерий. Например, известно, что участок инициации репликации Klebsiella pneumoniae (oriC) не активен в Caulobacter crescentus, Pseudomonas putida или Rhodobactersphaeroides (O'Neill and Bender, J. Bacteriol., 170 (1988), 3774-3777). Также известно, что плазмиды Bacillus subtilis не могут реплицироваться в клетках Е. coli. Таким образом, в предпочтительном варианте осуществления донорная молекула ДНК и/или ее участок инициации репликации происходят из прокариотического вида, отличного от прокариотического вида, в клетки которого вводят донорную молекулу ДНК. В особенно предпочтительном варианте осуществления донорная молекула ДНК представляет собой плазмиду В. subtilis pMIХ 91, являющуюся производной плазмиды pIL253 и способную реплицироваться в В. subtilis, но не в Е. coli, и содержащую маркер specR, маркер phleoR и рестрикционные участкиScaI, PpuMI и EcoO109I для вставки чужеродной последовательности ДНК. В другом особенно предпочтительном варианте осуществления донорная молекула ДНК представляет собой плазмиду В. subtilispMIX101, являющуюся производной плазмиды pIL253 и способную реплицироваться в В. subtilis, но не в Е. coli, и содержащую маркерную последовательность tcR и рестрикционные участки XhoI и PstI для вставки чужеродной последовательности ДНК. В другом варианте осуществления изобретения участок инициации репликации донорной молекулы ДНК функционален только в определенном температурном диапазоне, например при температуре, ниже чем 45 С. Если донорная молекула ДНК содержит такой чувствительный к температуре участок инициа-5 012070 ции репликации, она не будет способна к репликации при непермиссивных условиях, т.е. при температуре выше 45 С, которая еще позволяет рост прокариотической клетки-хозяина. В контексте настоящего изобретения термин "маркерные последовательности" относится к последовательностям ДНК, которые являются уникальными в данной прокариотической клетке и которые расположены или на донорной молекуле ДНК, или на реципиентной молекуле, предпочтительно выше или ниже субстрата рекомбинации или на уже рекомбинантной последовательности ДНК. Присутствие маркерной последовательности на той же молекуле ДНК, что и субстрат рекомбинации или на уже рекомбинантной последовательности ДНК, предпочтительно в сочетании с другой маркерной последовательностью, которая может находиться на другой стороне субстрата рекомбинации, делает возможным распознавание и отбор субстрата рекомбинации или уже рекомбинантной последовательности молекулярными или генетическими способами. В соответствии с изобретением, донорная молекула ДНК содержит первую маркерную последовательность, позволяющую отбор кроссоверов, содержащих субстраты рекомбинации. Первая маркерная последовательность предпочтительно в сочетании с дополнительными маркерными последовательностями, присутствующими или на донорной молекуле ДНК, или на реципиентной молекуле ДНК, также позволяет проведение дополнительных циклов рекомбинации повторяющимся способом. В соответствии с изобретением "первая маркерная последовательность" представляет собой кодирующую белок последовательность ДНК, генный продукт которой необходим для роста и размножения прокариотической клетки-хозяина в применяемых селективных условиях. Первая маркерная последовательность выбрана из группы, состоящей из пищевого маркера, маркера устойчивости к антибиотику и последовательности, кодирующей субъединицу фермента, функционирующего только в том случае, если в одной и той же клетке экспрессированы две или более субъединицы."Пищевой маркер" представляет собой маркерную последовательность, кодирующую генный продукт, способный компенсировать ауксотрофность организма или клетки, и, таким образом, обуславливает прототрофность этого ауксотрофного организма или клетки. В контексте настоящего изобретения термин "ауксотрофность" означает, что организму или клетке необходимо расти в среде, содержащей необходимое питательное вещество, которое ауксотрофный организм самостоятельно синтезировать не может. Генный продукт пищевого маркера обеспечивает синтез необходимого питательного вещества,отсутствующего у акусотрофной клетки. Таким образом, при экспрессии гена пищевого маркера добавлять данное необходимое питательное вещество в среду, в которой растет организм, не обязательно, так как организм стал прототрофным."Маркер устойчивости к антибиотику" представляет собой маркерный ген, чей генный продукт при экспрессии в клетке, в которой происходит экспрессия маркерного гена антибиотика, обеспечивает ей способность роста в присутствии данного антибиотика при данной концентрации, тогда как клетка без маркера устойчивости к антибиотику расти не может."Кодирующую субъединицу фермента последовательность" можно применять в качестве маркерной последовательности в том случае, если клетка не может синтезировать все субъединицы фермента,необходимые для сборки структуры полного фермента и, таким образом, для достижения полной активности фермента, и если наличие или отсутствие ферментативной активности можно контролировать генетическими и/или молекулярными средствами. Например, если активность фермента необходима для жизненно важного биохимического пути в клетке, позволяющего рост и/или размножение клетки в конкретной среде, и клетка не может синтезировать все компоненты структуры полного фермента, тогда клетка не может выжить в этой среде. Таким образом, "кодирующая субъединицу фермента последовательность", используемая в качестве маркерной последовательности, обеспечивает при экспрессии сборку полного фермента и выживание клетки. Предпочтительно генный продукт первой маркерной последовательности обуславливает устойчивость к антибиотику клетки, которая чувствительна к этому антибиотику. В частности, первая маркерная последовательность представляет собой specR, генный продукт которого обуславливает устойчивость клетки к спектиномицину, phleoR, генный продукт которого обуславливает устойчивость клетки к флеомицину, или tcR, генный продукт которого обуславливает устойчивость клетки к тетрациклину. В другом варианте осуществления изобретения донорная молекула ДНК содержит вторую маркерную последовательность. В еще одном варианте осуществления изобретения реципиентная молекула ДНК содержит третью маркерную последовательность и, необязательно, четвертую маркерную последовательность. Это означает, что в одном варианте осуществления изобретения донорная молекула ДНК может содержать, по меньшей мере, первую и вторую маркерную последовательность, необязательно,даже более маркерных последовательностей, которые могут располагаться, например, или выше, или ниже субстрата рекомбинации. В другом варианте осуществления реципиентная последовательность ДНК может содержать третью и четвертую маркерную последовательность, необязательно, даже более маркерных последовательностей, которые могут располагаться, например, или выше, или ниже субстрата рекомбинации. Данный дополнительный маркер позволяет увеличить строгость отбора последовательностей рекомбинантных ДНК, так как гибридная молекула, сформированная во вторичной прокариотической клетке и содержащая две различных последовательности рекомбинантных ДНК, может содержать в-6 012070 общей сложности по меньшей мере четыре различных маркерных последовательности. В соответствии с изобретением "вторая, третья и четвертая маркерные последовательности" являются кодирующими или не кодирующими белки последовательностями, выбранными из группы, состоящей из пищевых маркеров, пигментных маркеров, маркеров устойчивости к антибиотикам, маркеров чувствительности к антибиотикам, участков распознавания праймеров, границ интронов/экзонов, последовательностей, кодирующих конкретную субъединицу фермента, промоторных последовательностей,регулируемых ниже генных последовательностей и участков ферментов рестрикции."Пигментный маркер" представляет собой маркерный ген, генный продукт которого вовлечен в синтез пигмента, который при экспрессии окрашивает клетку, в которой экспрессирован пигментный маркер. Клетка без пигментного маркера не синтезирует пигмент и, таким образом, не окрашивается. Таким образом, пигментный маркер позволяет быстрое выявление содержащей пигментный маркер клетки по фенотипу."Маркер чувствительности к антибиотику" представляет собой маркерный ген, генный продукт которого при экспрессии нарушает способность клетки расти в присутствии данного антибиотика в данной концентрации."Участки распознавания праймеров" представляют собой участки отжига для сайт-специфических праймеров для ПЦР, позволяющие быструю идентификацию соответствующих маркерных последовательностей посредством ПЦР. В предпочтительном варианте осуществления изобретения вторая маркерная последовательность донорной молекулы ДНК и третья и четвертая маркерные последовательности реципиентной молекулы ДНК являются кодирующими белок последовательностями, генные продукты которых обуславливают устойчивость к антибиотику клетки, чувствительной к этому антибиотику. Предпочтительно генный продукт третьей маркерной последовательности обуславливает устойчивость клетки к тетрациклину, а генный продукт четвертой маркерной последовательности обуславливает устойчивость клетки к хлорамфениколу. В контексте настоящего изобретения термины "последовательности ДНК для рекомбинации" и"субстрат рекомбинации" означают две любых последовательности ДНК, способные к рекомбинации в результате процессов гомологичной или негомологичной рекомбинации. События гомологичной рекомбинации различных типов характеризуются спариванием оснований поврежденной цепи ДНК с гомологичным партнером, где область взаимодействия может включать в себя сотни почти полностью соответствующих пар оснований. Напротив, незаконная или негомологичная рекомбинация характеризуется связыванием концов ДНК, не обладающих или обладающих небольшим количеством комплементарных пар оснований. В прокариотических клетках, события негомологичных репарации и рекомбинации происходят со значительно меньшей частотой, чем события гомологичной рекомбинации. В предпочтительном варианте осуществления изобретения два субстрата рекомбинации, т.е. первая и вторая последовательности ДНК для рекомбинации, являются отличающимися последовательностями,т.е. последовательностями, не являющимися идентичными, но имеющими определенную степень гомологии. В контексте изобретения термин "гомология" означает степень идентичности, существующую между последовательностями двух молекул нуклеиновой кислоты, тогда как "отличие" означает степень неидентичности между последовательностями двух молекул нуклеиновой кислоты. В соответствии с изобретением, последовательности ДНК для рекомбинации отличаются друг от друга в двух или более позициях по отношению к их общему выравниванию. В одном варианте осуществления изобретения общее отличие между двумя субстратами рекомбинации относительно их общей длины составляет более чем 0,1%, в частности более чем 5% и предпочтительно более чем 25%. Это означает, что последовательности ДНК для рекомбинации могут отличаться более чем на 30%, более чем на 40% и даже более чем на 50%. В особенно предпочтительном варианте осуществления изобретения две последовательности ДНК для рекомбинации обладают по меньшей мере одной или несколькими гомологичными или идентичными областями, которые, однако, могут быть очень короткими. В соответствии с изобретением гомологичные или идентичные области могут содержать менее чем 25 нуклеотидов, в частности менее чем 20 или менее чем 15 нуклеотидов и даже менее чем 10 нуклеотидов, например 4, 5, 6, 7, 8 или 9 нуклеотидов. Субстраты рекомбинации или последовательности ДНК для рекомбинации могут обладать естественными или синтетическими участками инициации репликации. Таким образом, в одном из вариантов осуществления первая и вторая последовательности ДНК для рекомбинации являются встречающимися в природе последовательностями. Встречающиеся в природе последовательности можно выделять из любого природного источника, включая вирусы, живые или мертвые прокариотические организмы, такие как бактерии, живые или мертвые эукариотические организмы, такие как грибы, животные, растения и люди, или из его частей посредством подходящих способов выделения, или их можно синтезировать химическими способами. Встречающиеся в природе последовательности также могут содержать такие последовательности, которые после выделения из природного источника подвергали мутагенезу. В другом варианте осуществления изобретения первая и вторая последовательности ДНК для рекомбинации-7 012070 представляют собой искусственные последовательности, которые не находятся в природном источнике Искусственные последовательности можно синтезировать любыми известными химическими способами. В предпочтительном варианте осуществления изобретения последовательности ДНК для рекомбинации представляют собой кодирующие белки последовательности, например последовательности, кодирующие ферменты, которые можно применять для промышленного производства природных или неприродных соединений. Ферменты или соединения, получаемые при помощи ферментов, можно применять для производства лекарственных средств, косметики, продуктов питания и т.д. Кодирующие белки последовательности также могут представлять собой последовательности, кодирующие белки, обладающие терапевтическим применением в областях здоровья человека и животных. Важные классы важных с медицинской точки зрения белков включают в себя цитокины и факторы роста. Рекомбинация кодирующих белки последовательностей позволяет получать новые мутантные последовательности, кодирующие белки с измененными, предпочтительно улучшенными, функциями и/или вновь приобретенными функциями. Например, таким образом, можно достичь улучшенной термостабильности белка, изменения субстратной специфичности белка, увеличить его активность, включить новые каталитические участки и/или слить домены двух разных ферментов. Кодирующие белки последовательности ДНК для рекомбинации могут включать в себя последовательности из различных видов, кодирующие одни и те же или сходные белки, которые в их природном окружении обладают сходными или идентичными функциями. Кодирующие белки последовательности ДНК для рекомбинации могут включать в себя последовательности из одного семейства белков или ферментов. Кодирующие белки последовательности для рекомбинации также могут представлять собой последовательности, кодирующие белки с различными функциями, например последовательности, кодирующие ферменты, катализирующие различные стадии данного метаболического пути. В предпочтительном варианте осуществления изобретения первая и вторая последовательности ДНК для рекомбинации выбраны из группы генных последовательностей суперсемейства бета-лактамаз Оха. В другом предпочтительном варианте осуществления изобретения последовательности ДНК для рекомбинации представляют собой некодирующие последовательности, такие как последовательности,которые, например, в их природном клеточном окружении вовлечены в регуляцию экспрессии кодирующей белок последовательности. Примеры некодирующих последовательностей включают в себя в качестве неограничивающих примеров промоторные последовательности, последовательности, содержащие связывающие рибосому участки, интронные последовательности, последовательности полиаденилирования и т.д. Посредством рекомбинации таких некодирующих последовательностей возможно получить мутантные последовательности, которые в клеточном окружении приведут к измененной регуляции клеточного процесса, например измененной экспрессии гена. В соответствии с изобретением субстрат рекомбинации или последовательность ДНК для рекомбинации может, разумеется, содержать более одной кодирующей белок последовательности и/или более чем одной некодирующей последовательности. Например, субстрат рекомбинации может содержать одну кодирующую белок последовательность плюс одну некодирующую последовательность или сочетание разных кодирующих белки последовательностей и различных некодирующих последовательностей. Таким образом, в другом варианте осуществления изобретения последовательности ДНК для рекомбинации могут состоять из одного или нескольких участков кодирующих последовательностей с промежуточными и/или фланкирующими некодирующими последовательностями. Это означает, что последовательность ДНК для рекомбинации может представлять собой, например, генную последовательность с регуляторными последовательностями на ее 5'-конце и/или в нетранслируемой 3'-области, или последовательность гена млекопитающего с экзон/интронной структурой. В еще одном варианте осуществления изобретения последовательности ДНК для рекомбинации могут состоять из больших непрерывных участков ДНК, содержащих более одной кодирующей последовательности, необязательно с промежуточными некодирующими последовательностями, таких как оперон. Последовательности ДНК для рекомбинации могут представлять собой последовательности, уже испытавшие одно или несколько событий рекомбинации, например события гомологичной и/или негомологичной рекомбинации. Субстраты рекомбинации могут содержать немутировавшие последовательности ДНК дикого типа и/или мутантные последовательности ДНК. Таким образом, в предпочтительном варианте осуществления можно рекомбинировать последовательности дикого типа с уже существующими мутантными последовательностями для получения новых мутантных последовательностей. В соответствии с изобретением прокариотическую клетку используют в качестве клетки-хозяина для введения реципиентной и донорной молекул ДНК. Термины "прокариотическая клетка" и "прокариотическая клетка-хозяин" включают в себя любую клетку, у которой геном свободно присутствует в цитоплазме в виде кольцевой структуры, т.е. клетку, геном которой не окружен ядерной мембраной. Прокариотическая клетка дополнительно отличается тем, что она не обязательно зависит от кислорода, и ее рибосомы меньше, чем рибосомы эукариотических клеток. Прокариотические клетки включают в себя архебактерии и эубактерии. В зависимости от состава клеточной стенки, эубактерии можно разделить на грамположительные бактерии, грамотрицательные бактерии и цианобактерии. Таким образом, согласно настоящему изобретению прокариотическая клетка представляет собой-8 012070 клетку архебактерии или эубактерии, где в предпочтительном варианте осуществления изобретения прокариотическая клетка представляет собой грамотрицательную бактерию, грамположительную бактерию или цианобактерию. Предпочтительно грамотрицательная бактерия представляет собой Escherichia coli,например штамм Е. coli АВ 1157 или его мутант MutS-, штамм Е. coli MXP1. В соответствии с изобретением для способа согласно изобретению может быть предпочтительно использовать прокариотические клетки-хозяева с функциональной системой репарации. Система репарации ошибочного спаривания (MMR) представляет собой один из мощнейших действующих факторов предотвращения мутаций вследствие ошибок ДНК-полимеразы при репликации. Однако репарация ошибочного спаривания содействует генетической стабильности, обеспечивая также точность генетической рекомбинации. В то время как у бактерий, а также у дрожжей и в клетках млекопитающих рекомбинация между гомологичными субстратами ДНК, содержащими небольшое количество несоответствий (1%),происходит значительно менее эффективно, чем между идентичными последовательностями, частота рекомбинации (генной конверсии и/или кроссинговера) у дефицитных по MMR линий значительно увеличена. Это означает, что высокая точность рекомбинации вызвана не только внутренними характеристиками ферментов рекомбинации, но также и редактированием рекомбинации системой репарации ошибочного спаривания. Таким образом, система репарации ошибочного спаривания оказывает ингибирующий эффект на рекомбинацию между отличающимися последовательностями. У Е. coli для этой сильной антирекомбинационной активности необходимы два белка управляемой метилированием системы MMR, т.е. MutS и MutL, тогда как действие других белков системы MMR, MutH и UvrD, менее выражено. Кроме их ролей в MMR и гомологичной рекомбинации, белки MMR также играют важную роль в удалении негомологичной ДНК во время генной конверсии. В другом предпочтительном варианте осуществления изобретения применяют прокариотические клетки, дефицитные по системе репарации ошибочного спаривания. В контексте настоящего изобретения термин "дефицитный по системе репарации ошибочного спаривания" означает, что система MMR прокариотической клетки транзиторно или постоянно ослаблена. Дефицита MMR клетки или организма можно добиться любым способом, транзиторно или постоянно повреждающим систему MMR, включая в качестве неограничивающих примеров мутацию одного или нескольких вовлеченных в MMR генов, обработку таким средством, как УФ-излучение, приводящим к глобальному повреждению MMR, обработку таким средством, как 2-аминопурин или гетеродуплекс, содержащий избыточное количество несоответствий для транзиторного насыщения или инактивации системы MMR, и индуцируемую экспрессию или репрессию одного или нескольких вовлеченных в MMR генов, например, посредством регулируемых промоторов, что могло бы позволить транзиторную инактивацию. В предпочтительном варианте осуществления изобретения дефицит репарации ошибочного спаривания прокариотической клетки-хозяина происходит вследствие мутации по меньшей мере одного из вовлеченных в MMR генов. В предпочтительном варианте осуществления прокариотические клетки несут мутантный ген mutS, мутантный ген mutL, мутантный ген mutH и/или мутантный ген UvrD. В другом варианте осуществления у прокариотической клетки-хозяина повреждены или ингибированы один или несколько главных белков рекомбинации. Показано, например, что клетка с поврежденными генами AddAB демонстрирует высокую частоту гомологичной и негомологичной рекомбинации. В другом варианте осуществления у прокариотической клетки-хозяина сверхэкспрессирован один из главных белков рекомбинации, такой как recA. Этот белок вовлечен в гомологичную рекомбинацию, обеспечивая ренатурацию одноцепочечной ДНК, с формированием гетеродуплексной молекулы, необходимой для события рекомбинации, и инициирует обмен цепей ДНК. В соответствии с изобретением первичную прокариотическую клетку получают посредством одновременного или последовательного введения реципиентной молекулы ДНК и донорной реципиентной молекулы в прокариотическую клетку-хозяина. Таким образом, в одном из вариантов осуществления первичную прокариотическую клетку можно получать введением на первой стадии реципиентной молекулы ДНК в конкретную прокариотическую клетку-хозяина. На второй стадии после восстановления несущей реципиентную молекулу прокариотической клетки-хозяина в несущую реципиентную молекулу клетку вводятдонорную молекулу ДНК. В другом варианте осуществления изобретения и реципиентную, и донорную молекулы ДНК в прокариотическую клетку-хозяина можно вводить одновременно. В соответствии с изобретением введение и реципиентной, и донорной молекулы ДНК в прокариотическую клетку-хозяина можно проводить любым известным подходящим способом, включающим в себя в качестве неограничивающих примеров трансформацию, конъюгацию, трансдукцию, сексдукцию,инфекцию и/или электропорацию. В контексте настоящего изобретения термин "трансформация" означает захват клеткой, например микробной клеткой, из окружающей среды выделенной, предпочтительно очищенной, молекулы нуклеиновой кислоты. Клетки некоторых прокариотических видов, таких как Bacillus или Diplococcus, компетентны от природы, тогда как клетки других прокариотических видов, таких как Е. coli, для того, чтобы сделать их компетентными, т.е. для индукции переноса молекулы нуклеиновой кислоты через клеточную мембрану, необходимо подвергать специальной обработке. Некоторые бактерии известны по способности обменивать ДНК посредством трансформации."Конъюгация" означает опосредованный плазмидами перенос бактериальной плазмиды из одной бактериальной клетки в другую бактериальную клетку посредством контакта клетки с клеткой. Механизм переноса, как правило, кодируется плазмидами или конъюгативными транспозонами. Примеры таких плазмид включают в себя конъюгативные плазмиды или плазмиды-помощники. Конъюгативные плазмиды представляют собой самопередающиеся плазмиды, несущие гены, стимулирующие образование контакта клетки с клеткой (гены мобилизации). Они содержат гены для образования конъюгационных мостиков. После образования мостика также могут передаваться другие плазмиды и даже хромосомная ДНК (конъюгационные транспозоны). Мобилизуемые плазмиды содержат гены мобилизации, но для перемещения между клетками требуют "помощи" конъюгативных плазмид. Конъюгация представляет собой один из главных путей генетического обмена между различными филогенетическими группами прокариотических клеток и между прокариотами и эукариотами."Сексдукция" представляет собой процесс, посредством которого генетический материал переносится из прокариотической клетки с F-фактором или F-плазмидой в клетку, не содержащую этот Fфактор (Fклетка). F-фактор, как правило, находится в цитоплазме бактериальной клетки, но иногда может интегрироваться в различные участки бактериальной хромосомы, что ведет к формированию клетокHfr. Интеграция F-фактора обратима, где при неправильном выщеплении плазмиды возникают так называемые замещенные F-факторы (F'), содержащие генетический материал, фланкирующий в бактериальной хромосоме исходный участок интеграции F-фактора. F'-Плазмида с высокой частотой может передаваться в Fклетки."Трансдукция" означает перенос молекулы нуклеиновой кислоты из одной бактериальной клетки в другую бактериальную клетку бактериофагом, что включает в себя высвобождение бактериофага из одной клетки и последующее заражение другой клетки. Существует два типа трансдукции. Специфическая трансдукция может происходить во время лизогенного жизненного цикла умеренного бактериофага, когда генетический материал бактерий может замещать часть генома бактериофага. Эта часть бактериальной ДНК реплицируется как часть фагового генома и фаг может ее перенести в другую реципиентную клетку. В случае неспецифической трансдукции бактериальной ДНК может быть замещен целый геном литического фага. Когда этот фаг инфицирует другую бактерию, он инъецирует ДНК реципиенту, где она может быть заместить часть ДНК реципиентной клетки."Электропорация" представляет собой процесс, в котором клетки смешивают с молекулами нуклеиновой кислоты, а затем кратковременно воздействуют импульсами высокого электрического напряжения. Клеточная мембрана клетки-хозяина становится проницаемой, тем самым, позволяя чужеродным нуклеиновым кислотам проникать в клетку-хозяина. В особенно предпочтительном варианте осуществления изобретения донорную молекулу ДНК до введения в прокариотическую клетку-хозяина подвергают УФ-облучению, так как известно, что это облучение приводит к увеличению частоты рекомбинации. В соответствии с изобретением первичную прокариотическую клетку, содержащую реципиентную и донорную молекулы ДНК, культивируют в таких условиях, которые стимулируют образование коинтеграта или гибридной молекулы между реципиентной и донорной молекулами ДНК и рекомбинацию,предпочтительно негомологичную рекомбинацию, между двумя субстратами рекомбинации, т.е. в условиях, позволяющих отбор последовательностей рекомбинантных ДНК. Если первая маркерная последовательность донорной молекулы ДНК представляет собой маркер устойчивости к антибиотику, первичную прокариотическую клетку, содержащую реципиентную и донорную молекулы ДНК, культивируют в присутствии антибиотика, к которому клетка-хозяин чувствительна и к которому генный продукт первой маркерной последовательности обуславливает устойчивость. В особенно предпочтительном варианте осуществления, если находящаяся на донорной молекуле ДНК первая маркерная последовательность представляет собой specR, генный продукт которого обуславливает устойчивость клетки к спектиномицину, первичный прокариотический организм культивируют в присутствии спектиномицина. В другом особенно предпочтительном варианте осуществления, если находящаяся на донорной молекуле ДНК первая маркерная последовательность представляет собой phleoR,генный продукт которого обуславливает устойчивость клетки к флеомицину, первичный прокариотический организм культивируют в присутствии флеомицина. В другом особенно предпочтительном варианте осуществления, если находящаяся на донорной молекуле ДНК первая маркерная последовательность представляет собой tcR, генный продукт которого обуславливает устойчивость клетки к тетрациклину,первичный прокариотический организм культивируют в присутствии тетрациклина. Если первая маркерная последовательность донорной молекулы ДНК представляет собой пищевой маркер, первичную прокариотическую клетку, содержащую реципиентную и донорную молекулы ДНК,культивируют в среде с отсутствием конкретного необходимого питательного вещества, которое клеткахозяин самостоятельно синтезировать не может и снабжение которым клетки-хозяина происходит при введении донорной молекулы и экспрессии первого маркерного гена, содержащегося в донорной молекуле. При экспрессии гена первого пищевого маркера добавлять необходимое питательное вещество к среде, в которой растет прокариотическая клетка, не обязательно. Если вторая маркерная последовательность, третья маркерная последовательность и/или четвертая- 10012070 маркерная последовательность представляют собой маркеры устойчивости к антибиотикам, тогда в предпочтительном варианте осуществления первичную прокариотическую клетку можно дополнительно культивировать в присутствии второго, третьего и/или четвертого антибиотика, к которым генные продукты второй маркерной последовательности, третьей и четвертой маркерной последовательности, соответственно, обуславливают устойчивость. Предпочтительно первичную прокариотическую клетку культивируют не только в присутствии флеомицина, или спектиномицина, или тетрациклина, но также дополнительно и в присутствии хлорамфеникола. Наиболее предпочтительно, чтобы первичная прокариотическая клетка росла и размножалась в присутствии флеомицина, спектиномицина, хлорамфеникола и тетрациклина. После культивирования прокариотических клеток в селективных условиях выделяют вторичные прокариотические клетки, содержащие коинтеграт или гибридную молекулу, сформированные реципиентной и донорной молекулами ДНК. Данный коинтеграт содержит рекомбинантные последовательности ДНК. Присутствие коинтеграта и/или рекомбинантных последовательностей ДНК можно проверять и выявлять несколькими способами, такими как анализ профиля рестрикции, амплификация ПЦР и/или секвенирование. Например, если вторая маркерная последовательность донорной молекулы и третья или четвертая маркерная последовательность реципиентной молекулы представляют собой уникальные последовательности распознавания праймеров, тогда специфические фрагменты коинтеграта для выявления присутствия соответствующего сочетания маркеров можно амплифицировать в ПЦР с применением соответствующих праймеров, распознающих эти маркерные последовательности. Если коинтеграт не образовался, т.е. рекомбинация не произошла, эти фрагменты выявить нельзя. Например, если вторая маркерная последовательность донорной молекулы и третья или четвертая маркерная последовательность реципиентной молекулы представляют собой уникальные участки расщепления рестрикционных ферментов, тогда коинтеграт для выявления специфических фрагментов ДНК можно подвергнуть анализу рестрикционными ферментами. Если коинтеграт не образовался, т.е. рекомбинация не произошла, эти фрагменты выявить нельзя. В соответствии с изобретением первую и вторую последовательности рекомбинантных ДНК, содержащиеся в гибридной молекуле ДНК вторичной прокариотической клетки, можно выделять, и/или анализировать, и/или отбирать. Полученные первую и вторую последовательности рекомбинантных ДНК можно выделять, например, посредством амплификации ПЦР или расщепления соответствующими рестрикционными ферментами. Анализ содержащихся в гибридной молекуле ДНК первой и второй последовательностей рекомбинантных ДНК можно проводить, например, посредством способов секвенирования. В соответствии с изобретением выделенные первая и вторая последовательности рекомбинантных ДНК можно снова вставлять в донорную молекулу ДНК и реципиентную молекулу ДНК, соответственно, и подвергать новому циклу рекомбинации с применением способа согласно изобретению. Другой аспект настоящего изобретения относится к способу получения новых белков, ферментов и некодирующих последовательностей с новыми или улучшенными функциями и свойствами, где известные кодирующие белки последовательности или известные некодирующие последовательности подвергают одному или нескольким циклам рекомбинации с применением способа согласно изобретению для получения и детектирования рекомбинантных последовательностей ДНК в прокариотической клеткехозяине. Настоящее изобретение также относится к белкам, ферментам и некодирующим последовательностям, полученным любым из способов согласно изобретению. Настоящее изобретение также относится к плазмиде В. subtilis pMIX91, являющейся производным плазмиды pIL253 и способной реплицироваться В. subtilis, но не в Е. coli, и содержащей маркер specR и маркер phleoR и рестрикционные участки ScaI, PpuMI и EcoO109I для вставки чужеродной последовательности ДНК. Настоящее изобретение также относится к плазмиде В. subtilis pMIX101, являющейся производным плазмиды pIL253 и способной реплицироваться В. subtilis, но не в Е. coli, и содержащей маркерную последовательность tcR и рестрикционные участки XhoI и PstI для вставки чужеродной последовательности ДНК. Настоящее изобретение также относится к штамму В. subtilis DSM17158, содержащему плазмиду В.Zellkulturen GmbH, Braunschweig, Germany on 21 февраля 2005 г., 1 А 423 рМIХ 101). Другой аспект настоящего изобретения относится к применению плазмид В. subtilis рМ 1 Х 91 иpMIX101, соответственно, в качестве донорных молекул ДНК в способе согласно изобретению, т.е. применению плазмид pMIX91 или pMIX101 для получения и/или детектирования рекомбинантных последовательностей ДНК в прокариотической клетке-хозяине, предпочтительно в клетке Е. coli. Другой аспект настоящего изобретения относится к применению плазмид Е. coli pACYC184 илиpMIX100 или их производных в качестве реципиентной молекулы ДНК в способе согласно изобретению,т.е. применению плазмид pACYC184 или pMIX100 для получения и/или детектирования рекомбинант- 11012070 ных последовательностей ДНК в прокариотической клетке-хозяине, предпочтительно в клетке Е. coli. Другой аспект настоящего изобретения относится к набору, который можно применять для проведения способа согласно изобретению для получения и детектирования в прокариотической клеткехозяине последовательностей рекомбинантных ДНК. В первом варианте осуществления набор содержит,по меньшей мере, первый контейнер, содержащий клетки штамма Е. coli AB1157 в качестве прокариотической клетки-хозяина, второй контейнер, содержащий клетки штамма Е. coli AB1157, содержащие плазмиду Е. coli pACYC184 или плазмиду Е. coli pMIX100, которые можно применять в качестве реципиентной молекулы ДНК, и третий контейнер, содержащий клетки штамма В. subtilis DSM4393, содержащие плазмиду В. subtilis pMIX91, или клетки штамма В. subtilis 1 А 423, содержащие плазмиду В. subtilis pMIX101, которые можно применять в качестве донорной молекулы ДНК. Во втором варианте осуществления изобретения набор содержит, по меньшей мере, первый контейнер, содержащий клетки штамма Е. coli MXP1, являющегося мутантом MutS- штамма АВ 1157, в качестве прокариотической клетки-хозяина, второй контейнер, содержащий клетки штамма Е. coli AB1157, содержащие плазмиду pACYC184 или pMIX100, и третий контейнер, содержащий клетки штамма В. subtilis DSM4393, содержащие плазмиду pMIX91, или клетки штамма В. subtilis 1 А 423, содержащие плазмиду pMIX101. В другом варианте осуществления набор содержит, по меньшей мере, первый контейнер, содержащий или клетки штамма Е. coli AB1157, или штамм Е. coli МХР 1, второй контейнер, содержащий ДНК плазмиды Е. colipACYC184 или pMIX100, и третий контейнер, содержащий ДНК плазмиды В. subtilis pMIX91 или плазмиды В. subtilis pMIX101. Другой аспект настоящего изобретения относится к способу получения в прокариотической клетке гибридного гена и/или кодируемого гибридным геном белка. Способ получения гибридного гена и/или кодируемого белка включает в себя стадию проведения способа согласно изобретению для получения и детектирования рекомбинантных последовательностей ДНК, где в прокариотической клетке получают гибридный ген и/или кодируемый гибридным геном белок. После экспрессии гибридный ген и/или кодируемый белок отбирают в прокариотической клетке и/или выделяют из нее. Настоящее изобретение также относится к гибридному гену, который можно получить способом согласно изобретению для получения гибридного гена или способом согласно изобретению для получения и детектирования рекомбинантных последовательностей ДНК. Настоящее изобретение также относится к кодируемому гибридным геном белку, который можно получить способом согласно изобретению для получения гибридного гена или способом согласно изобретению для получения и детектирования рекомбинантных последовательностей ДНК и/или который можно получить способом согласно изобретению для получения кодируемого геном белка. Настоящее изобретение проиллюстрировано следующим списком последовательностей, фигурами и примерами. На фиг. 1 схематически проиллюстрирован способ согласно изобретению для осуществления и/или детектирования рекомбинации между двумя последовательностями ДНК. Первая последовательность,ген оха 7, находится на плазмиде В. subtilis pTG2-phleo в качестве донорной молекулы ДНК. pTG2-phleo несет маркеры specR и phleoR, обуславливающие устойчивость к спектиномицину и флеомицину. Посредством электропорации pTG2-phleo вводят в клетку-хозяин Е. coli, содержащую плазмиду pTG3 в качестве реципиентной молекулы ДНК. pTG3 содержит вторую последовательность ДНК, ген oxa11 и маркерcmR, обуславливающий устойчивость к хлорамфениколу. После введения pTG2-phleo клетки культивируют в присутствии спектиномицина и флеомицина, которые стимулируют формирование коинтеграта между двумя плазмидами и параллельно рекомбинацию между генами. Таким образом, при культивации получают клетки Е. coli, содержащие димерную плазмиду, содержащую новые последовательности рекомбинантных ДНК R1 и R2. Последовательности рекомбинантных ДНК можно анализировать посредством анализа рестрикционных профилей, амплификации ПЦР рекомбинантных генов R1 и R2 и/или секвенирования R1 и R2. На фиг. 2 показаны физические карты плазмид pUC19-phleo, pic156, pACYC184 и pIL253, применяемых для конструирования подходящих плазмид для проведения способа согласно изобретению. На фиг. 3 показаны физические карты плазмид, сконструированных для проведения способа согласно изобретению. Плазмиды pMIX96 и pMIX97 не показаны, так как они являются такими же, как иpMIX95, но содержат оха 5 и oxa1, соответственно, вместо oxa11. pMIX99 является такой же, как иpMIX98, но содержит oxa1 вместо oxa11. На фиг. 4 показана структура генов, полученных in vivo в процессе рекомбинации согласно изобретению между отличающихся на 22% генов оха. Участки идентичности последовательностей, в которых происходил кроссинговер, показаны подробно. На фиг. 5 показана структура плазмиды Е. coli pMIX100, которую можно применять в качестве реципиентной молекулы ДНК в клетке-хозяине Е. coli. pMIX100 несет участок инициации репликации плазмиды pACYC184, а также ген устойчивости к хлорамфениколу из нее. pMIX100 также несет ген lacZ из pBluescript SK+. На фиг. 6 показана структура плазмиды В. subtilis pMIX101, являющейся производной плазмиды В.subtilis pIL253 и которую можно использовать в качестве донорной молекулы ДНК в клетке-хозяине Е.coli. pMIX101 несет маркер ErmR, обуславливающий устойчивость к эритромицину, и TcR, обуславливающий устойчивость к тетрациклину. Ген устойчивости к тетрациклину амплифицирован из плазмидыpACYC184. На фиг. 7 показана структура плазмиды для контроля эффективности трансформации pMIX102.pMIX102, производная pBluescript SK+, содержит ген TcR, амплифицированный из плазмиды pACYC184. В pMIX102 ген TcR находится под контролем промотора plac. На фиг. 8 показана структура плазмиды для контроля эффективности трансформации pMIX103.pMIX103, производная pBluescript SK+, содержит ген TcR, амплифицированный из плазмиды pACYC184. В pMIX103 ген TcR клонирован в противоположном направлении, чем plac. Таким образом, ген экспрессируется со своего собственного промотора. На фиг. 9 схематически проиллюстрирована стратегия для клонирования генов оха 7, оха 11 и оха 5 в плазмиду Е. coli pMIX100 и в плазмиду В. subtilis pMIX101. Для клонирования генов оха 7, оха 11 и оха 5 вpMIX100 гены амплифицировали с применением праймеров, содержащих на своих 5'-концах участки PstI или XhoI. После расщепления этими ферментами амплифицированные фрагменты ДНК независимо лигировали в pMIX100, которую предварительно расщепляли с применением PstI+XhoI. Компетентные клетки Е. coli DH810 подвергали электропорации с использованием смесей после лигирования, а колонии, несущие положительные клоны, фенотипически отбирали по устойчивости к хлорамфениколу/белой окраске на планшетах с LB, содержащих Cm (30 мкг/мл) + X-Gal (80 мкг/мл) + IPTG (0,5 мМ). Выделяли плазмидные ДНК и анализировали посредством рестрикционного картирования. Результаты подтверждали, что pMIX104 несет оха 7, pMIX106 несет oxa11, а pMIX107 несет оха 5. Для клонирования в плазмиду В. subtilis pMIX101 oxa7 получали в виде фрагмента длиной 0,9 т.п.н. из pMIX104 посредством рестрикции с применением PstI и XhoI и лигировали в pMIX101, которую предварительно расщепляли теми же ферментами. После трансформации продуктом лигирования компетентных клеток В. subtilis 1A423 клетки отбирали в LB, содержащей 0,5 мкг/мл эритромицина (Erm). В SEQ ID1 и 2 приведены последовательности праймеров OLG1 и OLG2, соответственно, для амплификации oxa7 и введения рестрикционных участков ScaI и PpuMI на 5'- и 3'-концах соответственно. В SEQ ID3 и 4 приведены последовательности праймеров OLG3 и OLG4, соответственно, для амплификации oxa11 и введения рестрикционных участков BamHI и ЕсоО 109I на 5'- и 3'-концах соответственно. В SEQ ID5 и 6 приведены последовательности праймеров OLG5 и OLG6, соответственно, для амплификации оха 5 и введения рестрикционных участков BamHI EcoO109I на 5'- и 3'-концах соответственно. В SEQ ID7 и 8 приведены последовательности праймеров OLG7 и OLG8, соответственно, для амплификации oxa1 и введения рестрикционных участков BamHI EcoO109I на 5'- и 3'-концах соответственно. В SEQ ID9 и 10 приведены последовательности праймеров OLG9 и OLG10, соответственно, для амплификации oxa11 и введения рестрикционных участков ScaI EcoO109I на 5'- и 3'-концах соответственно. В SEQ ID11 приведена последовательность праймера OLG11, применяемого вместе с праймеромOLG8 (SEQ ID8) для амплификации oxa1 и введения рестрикционных участков ScaI EcoO109I на 5'- и 3'-концах соответственно. В SEQ ID12 и 13 приведены последовательности праймеров OLG12 и OLG13, соответственно,для амплификации рекомбинантного гена R1, содержащегося в гибридной плазмиде pMIX93. В SEQ ID14 приведена последовательность праймера OLG14, применяемого вместе с праймеромOLG12 (SEQ ID12) для амплификации рекомбинантного гена R1, содержащегося в одной из гибридных плазмид pMIX95, pMIX96 и pMIX97. В SEQ ID15 приведена последовательность праймера OLG15, применяемого вместе с праймеромOLG17 (SEQ ID17) для амплификации рекомбинантного гена R2, содержащегося в гибридной плазмиде pMIX93. В SEQ ID16 приведена последовательность праймера OLG16, применяемого вместе с праймеромOLG17 (SEQ ID17) для амплификации рекомбинантного гена R2, содержащегося в одной из гибридных плазмид pMIX95, pMIX96 и pMIX97. В SEQ ID17 приведена последовательность праймера OLG17. Пример 1. Рекомбинация in vivo гетерологичных генов системы из двух плазмид (Е. coli/B. subtilis),где рекомбинантные последовательности ДНК отбирают по устойчивости к спектиномицину и/или флеомицину. 1. Материалы и методы. 1.1. Бактериальные штаммы и плазмиды. Применяемые в этом примере бактериальные штаммы и плазмиды показаны в табл. 1 и 2 соответственно. 1.2. Условия выращивания и среды для культивирования. Штаммы Е. coli и В. subtilis культивировали при 37 С в среде LB (Difco Laboratories, Detroit, USA). Когда среду применяли в планшетах (LBA), на литр добавляли 15 г агара (Difco). Когда было необходимо, среду дополняли антибиотиками, где конечные концентрации были следующими: тетрациклин(Sigma-Aldrich Chimie, St. Quentin Fallavier, France), 12,5 мкг/мл; хлорамфеникол (Sigma-Aldrich Chimie),30 мкг/мл; ампициллин (Sigma-Aldrich Chimie), 100 мкг/мл; эритромицин (Sigma-Aldrich Chimie), 0,5 мкг/мл; спектиномицин (Sigma-Aldrich Chimie), 75 мкг/мл; флеомицин (Euromedex, Strasbourg, France), 2 мкг/мл. Когда LBA дополняли спектиномицином плюс флеомицином, конечные концентрации составляли 60 и 1 мкг/мл соответственно. 1.3. Манипуляции с ДНК и микроорганизмами. Трансдукция. Штамм Е. coli MIXP1 конструировали с применением опосредованной Р 1 трансдукции (3). Трансформация. Плазмиды were вводили в штаммы Е. coli посредством электропорации с применением EppendorfElectroporator 2510 (Eppendorf AG, Hamburg, Germany) и по инструкциям поставщика. Получали компетентные клетки В. subtilis и трансформировали, как описано у Yasbin et al. (9). Манипуляции с ДНК. Для молекулярно-биологических способов применяли установленные протоколы (4). Ферменты для манипуляций с ДНК приобретали из New England Biolabs (Beverly, MA, USA), MBI Fermentas (Vilnius,Lithuania), Promega (Madison, Wis.) или Stratagene (La Jolla, CA, USA) и применяли, как рекомендовано производителем. Когда было необходимо расщепленную рестрикционными эндонуклеазами ДНК очищали от агарозного геля с применением набора NucleoSpin Extract Kit (Machery-Nagel). Плазмидную ДНК выделяли из Е. coli с применением набора NucleoSpin Kit (Machery-Nagel GmbH- 14012070Co., Duren, Germany) по инструкциям производителя. Для выделения плазмидной ДНК из В. subtilis использовали тот же набор, но первую стадию лизиса проводили посредством инкубации клеток с 2 мг мл-1 лизоцима 30 мин при 37 С. Используемые праймеры синтезировали в Proligo France SAS (Paris, France). Нуклеотидные последовательности определяли в обоих направлениях посредством Genome Express(Meylan, France). Последовательности анализировали с применением пакета Infobiogen (Genopole d'Evry,Evry, France). Для сравнения последовательностей использовали программу ClustalW. Амплификация посредством ПЦР. Реакции ПЦР проводили с применением Mastercycler Gradient (Eppendorf AG, Hamburg, Germany). Реакции проводили в объеме 50 мкл с применением высокоточной ДНК-полимеразы Herculase EnhancedDNA polymerase (Strategene) в следующих условиях: 96 С в течение 3 мин, 35 циклов, состоящих из 96 С в течение 30 с, температуры отжига в течение 30 с, 72 С в течение 1 мин и конечная стадия элонгации при 72 С в течение 10 мин. Температуру отжига определяли посредством вычитания 5 С из нижней температуры Tm используемых праймеров. Когда было необходимо, продукты ПЦР очищали с применением набора NucleoSpin Extract (Machery-Nagel). Продукты амплификации анализировали посредством электрофореза в 0,7% агарозных гелях (Sigma). 2. Общий принцип. Данный эксперимент проводили для получения новых проявляющих выгодные свойства молекул посредством рекомбинации двух исходных генов, обладающих различными степенями идентичности последовательностей, in vivo. Применяемый принцип является таким, как указано далее. Гены для рекомбинации находились на двух различных плазмидах, не обладающих гомологией их нуклеотидных последовательностей. Первая плазмида представляет собой репликативную плазмиду Е.coli, обуславливающую устойчивость или к хлорамфениколу (Cm), или тетрациклину (Тс). Она основывается на стандартном клонирующем векторе pACYCl84, низкокопийной плазмиде, полученной из NewEngland Biolabs. Вторая плазмида представляет собой плазмиду Bacillus subtilis, полученную из pIL253 (Simon andChopin, 1988). Она не способна реплицироваться в Е. coli и несет два маркера устойчивости к антибиотикам для спектиномицина (Spc) и флеомицина (Phleo) соответственно. Для рекомбинации пар гетерологичных генов, находящихся на этих двух векторах, плазмиду В. subtilis посредством электропорации вводят в штаммы Е. coli, несущие репликативную плазмиду. Это схематически показано на фиг. 1. Такие штаммы или полноценны (+), или дефицитны (-) по системе репарации ошибочного спаривания (MMR), контролирующей и мутагенез, и рекомбинацию. После электропорации, трансформантов отбирали с применением антибиотиков, к которым плазмида В. subtilis обеспечивает устойчивость (Spc и Phleo). Такое селективное давление стимулирует рекомбинацию между гетерологичными генами, так как в этих условиях могут расти только клетки, несущие коинтеграт, формируемый плазмидами В. subtilis и Е. coli. Гибридная плазмида обуславливает устойчивость к Spc и Phleo и реплицируется с участка инициации репликации Е. coli, так как участок инициации репликации В. subtilis не функционален. Кроме того, она несет два рекомбинантных гена R1 иR2. Первая стадия представляла собой клонирование исходно выбранных в качестве цели для оценки эффективности рекомбинации генов в векторы Е. coli и В. subtilis. Эксперимент по рекомбинации между генами оха проводили и в штаммах дикого типа, и в штаммах, дефицитных по репарации ошибочного спаривания. Эксперименты проводили или между парами идентичных генов, или между парами отличающихся генов. Плазмидные ДНК до электропорации подвергали УФ-облучению, так как было показано, что это облучение ведет к 10-кратному увеличению частот рекомбинации. Рекомбинацию также проводили в штаммах, временно являющихся мутантными, посредством обработки 2-аминопурином. 2-Аминопурин представляет собой аналог аденина, встраивающийся в ДНК во время роста бактерий и насыщающий систему MMR. Таким образом, образуется транзиторный мутантный фенотип, так как после удаления 2-аминопурина восстанавливается состояние дикого типа. Данный временный контроль активности репарации ошибочного спаривания обеспечивает стабильный фон для используемых в рекомбинации штаммов, позволяя избегать накопления мутаций в их геномах. 3. Результаты. Конструирование вектора В. subtilis. Для конструирования вектора В. subtilis с тем, чтобы он нес гены для рекомбинации, два генных маркера, обуславливающих устойчивость к антибиотикам спектиномицину (specR) и флеомицину(phleoR), соответственно, клонировали в плазмиду pIL253, следуя принципу двухстадийного клонирования. Сначала из плазмиды pic156 получали ген specR в виде фрагмента SacI длиной 1294 п.н. Фрагмент очищали, а затем лигировали в расщепленную SacI pIL253. Компетентные клетки В. subtilis DS4393 трансформировали смесью после лигирования, а трансформанты отбирали на планшетах с LBA, содержащих 75 мкг мл-1 спектиномицина. Рестрикционные анализы полученной из трансформантов плазмид- 15012070 ной ДНК подтверждал, что она содержала производные pILF253, несущие ген specR. На второй стадии ген phleoR клонировали в pIL253-spec. Плазмиду pUC19-phleo расщепляли рестрикционными ферментами EcoRI и SalI и фрагмент длиной 574 п.н., соответствующий phleoR очищали от геля и лигировали в pIL253-spec, предварительно расщепленную теми же ферментами. Компетентные клетки В. subtilis DSM4393 трансформировали смесью после лигирования, а трансформантов отбирали на планшетах с LBA, содержащих 60 мкг мл-1 флеомицина. Рестрикционные анализы полученной из трансформантов плазмидной ДНК показали, что она содержала ожидаемую плазмиду размером 6,69 т.п.н., несущую гены specR и phleoR. Плазмиду обозначили pMIX91 (см. фиг. 3). Конструирование вектора для контроля эффективности трансформации. Для применения в экспериментах по рекомбинации в качестве контроля эффективности трансформации штаммов Е. coli при отборе с спектиномицином и флеомицином сконструирован вектор. Вектор сконструирован так, как указано далее: после расщепления picl56 с применением BamHI и EcoRI получали ген устойчивости к спектиномицину (specR) в виде фрагмента длиной 1,25 т.п.н. Его клонировали по соответствующим сайтам pUC-phleo после гена устойчивости к флеомицину (phleoR). После электропорации компетентных клеток Е. coli DH10B смесью после лигирования устойчивые к спектиномицину и флеомицину колонии отбирали на планшетах с LBA, содержащих оба антибиотика в конечных концентрациях 60 мкг/мл и 1 мкг/мл, соответственно. Рестрикционные анализы выделенной из трансформантов плазмидной ДНК показали, что она соответствует ожидаемой конструкции длиной 4,46 т.п.н., которую обозначили pMIX92 (см. фиг. 3). Клонирование кодирующих -лактамазы генов в векторы Е. coli и В. subtilis. В качестве мишени для оценки эффективности рекомбинации в штаммах Е. coli дикого типа и мутантном MutS- выбрали четыре гена, кодирующих -лактамазы. Такие гены, оха 7 (инвентарный номерX58272) и oxa1 (инвентарный номер GenBank J02967) демонстрируют различные степени отличия их нуклеотидных последовательностей. Последовательность oxa1 и последовательности оха 5, оха 7 и oxa11, соответственно, отличаются на 40%. Последовательность оха 5 и последовательности оха 7 и oxa11, соответственно, отличаются: на 22%. Последовательность oxa7 и последовательность oxa11 отличаются на 5%. Четыре гена оха клонировали в плазмиду Е. coli pACYC184, тогда как oxa7, oxa11 и oxa1 также клонировали в плазмиду В. subtilis pMIX91. Клонирование генов проводили следующим образом: оха 7 амплифицировали посредством ПЦР с применением праймеров, сконструированных для внесения сайтовOLG2 с SEQ ID2). Продукт ПЦР расщепляли этими рестрикционными ферментами и полученный фрагмент длиной 991 п.н. лигировали в pMIX91, предварительно расщепленную теми же ферментами. Компетентные клетки В. subtilis DSM4393 трансформировали смесью после лигирования, а отбор трансформантов проводили на планшетах с LBA, содержащих 75 мкг мл спектиномицина. Рестрикционные анализы полученной из трансформантов плазмидной ДНК показали, что она содержит ожидаемую плазмиду pMIX94 длиной 6,89 т.п.н., несущую оха 7 (см. фиг. 3). Для клонирования оха 7 в вектор Е. coli pACYC184, описанный выше продукт ПЦР, а такжеpACYC184, расщепляли с применением PpuMI и ScaI. С применением фрагмента Кленова ДНКполимеразы I у расщепленных ДНК формировали тупые концы и проводили их лигирование. Компетентные клетки Е. coli DH10B подвергали электропорации со смесью после лигирования, а трансформантов отбирали на планшетах с LBA, содержащих 12,5 мкг мл-1 тетрациклина. Рестрикционные анализы выделенной из трансформантов плазмидной ДНК показали, что она соответствовала ожидаемой конструкции длиной 4,33 т.п.н., которую обозначили pMIX93 (см. фиг. 3). Для клонирования oxa11, оха 5 и oxa1 в pACYC184 гены амплифицировали посредством ПЦР с применением праймеров, сконструированных для внесения сайтов BamHI и ЕсоО 109I на 5'- и 3'-концах амплифицируемой ДНК соответственно. Пары праймеров, применяемых для амплификации oxa11, oxa5 и oxa1 составляли, соответственно, OLG3 (SEQ ID3)/OLG4 (SEQ ID4), OLG5 (SEQ ID5)/OLG6(SEQ ID6) и OLG7 (SEQ ID7)/OLG8 (SEQ ID8). Продукты ПЦР расщепляли с применениемBamHI и ЕсоО 109I и полученные фрагменты длиной 997 п.н. (oxa11), и 830 п.н. (оха 5), и 936 п.н. (oxa1) независимо лигировали в pACYC184, предварительно расщепленную теми же ферментами. Компетентные клетки Е. coli DH10B подвергали электропорации с применением смесей после лигирования, а трансформантов отбирали на планшетах с LBA, содержащих 30 мкг мл-1 хлорамфеникола. Рестрикционные анализы полученной из трансформантов плазмидной ДНК показали, что она соответствует ожидаемым плазмидам 6,89 т.п.н. плазмидам pMIX95 (3,72 т.п.н.), pMIX96 (3,55 т.п.н.) и pMIХ 97 (3,66 т.п.н.)(см. фиг. 3). Для клонирования oxa11 и oxa1 в pMIX91 гены амплифицировали посредством ПЦР с применением праймеров, сконструированных для внесения сайтов ScaI и EcoO109I на 5'- и 3'-концах амплифицируемой ДНК соответственно. Для амплификации oxa11 и oxa1 соответственно использовали пары праймеров OLG9 (SEQ ID9)/OLG10 (SEQ ID10), и 0L11 (SEQ ID11)/OLG8. Продукты ПЦР расщепля- 16012070 ли ScaI и EcoO109I и полученные фрагменты длиной 995 п.н. (oxa11) и 934 п.н. (oxa1) независимо лигировали в pMIX91, предварительно расщепленную теми же ферментами. Компетентные клетки В. subtilisDSM4393 трансформировали смесью после лигирования, а отбор трансформантов проводили на планшетах с LBA, содержащих 75 мкг мл-1 спектиномицина. Рестрикционные анализы полученной из трансформантов плазмидной ДНК показали, что она соответствует ожидаемым плазмидам pMIX98 (6,89 т.п.н.) и pMIX99 (6,83 т.п.н.). См. фиг. 3. Рекомбинация генов оха in vivo у Е. coli дикого типа по сравнению с мутантом MutS-. На первой стадии компетентные клетки Е. coli AB1157 и ее мутанта MutS-, E. coli MXP1 посредством электропорации независимо трансформировали полученными из pACYC184 несущими гены оха плазмидами, pMIX93, pMIX95, pMIX96 или MIX97. Трансформантов отбирали на основе их устойчивости к тетрациклину или хлорамфениколу. Присутствие пригодных плазмид далее подтверждали посредством рестрикционного анализа и/или ПЦР. На второй стадии из содержащей тетрациклин или хлорамфеникол селективной среды получали компетентные клетки штаммов дикого типа и MutS-, несущие репликативные плазмиды. Затем такие компетентные клетки посредством электропорации независимо трансформировали несущими гены оха плазмидами В. subtilis, pMIX94, pMIX98 или pMIX99. После электропорации, трансформантов отбирали на планшетах с LB, содержащих антибиотики для каждой обуславливающей устойчивость плазмиды В. subtilis: спектиномицин и флеомицин, в конечных концентрациях в размере 60 мкг мл-1 и 1 мкг мл-1 соответственно. Такое селективное давление стимулирует рекомбинацию между генами оха, так как в данных условиях могут расти только те клетки, которые несут гибридную плазмиду, сформированную плазмидами В. subtilis и Е. coli. Планшеты в течение ночи инкубировали при 37 С, а затем плазмидную ДНК трансформантов анализировали посредством расщепления рестрикционными ферментами для подтверждения того, что она содержит гибридные плазмиды(длиной приблизительно 10,5 т.п.н.), несущие два рекомбинантных гена R1 и R2. В некоторых случаях рекомбинантные гены амплифицировали посредством ПЦР и секвенировали. Если резидентная плазмида представляла собой pMIX93, то R1 амплифицировали с применением OLG12 (SEQ ID12)/OLG13(SEQ ID13), a R2 с применением OLG15 (SEQ ID15)/OLG17 (SEQ ID17); если резидентная плазмида представляла собой pMIX95, pMIX96 или pMIX97, то R1 амплифицировали с применениемOLG12/OLG14 (SEQ ID14), a R2 с применением OLG16 (SEQ ID16)/OLG17. В экспериментах по рекомбинации плазмиду В. subtilis pMIX91 использовали в качестве отрицательного контроля, тогда как плазмиду Е. coli pMIX92 использовали в качестве контроля эффективности трансформации при отборе на спектиномицине и флеомицине. pMIX92 может реплицироваться в штаммах, несущих плазмиды, производные pACYC184, так как их участки инициации репликации (ColE1 и р 15 соответственно) совместимы. Плазмидные ДНК перед электропорацией подвергали УФ-облучению(200 Дж/м 2), так как показано, что это облучение приводит к 10-кратному увеличению частот рекомбинации. Частоты рекомбинации подсчитывали делением эффективности трансформации, полученной с плазмидами В. subtilis, на эффективность трансформации, полученную с контрольным вектором pMIX92. В свою очередь, эффективность трансформации подсчитывали как количество колониеобразующих единиц (КОЕ), полученных на грамм ДНК в ранее описанных условиях. Полученные результаты обобщены в табл. 3. У штамма дикого типа рекомбинанты в экспериментах получали при использовании идентичных или отличающихся на 5% генов оха, тогда как у мутанта MutSрекомбинация также происходила между отличающимися на 22% генами. Таблица 3 Частоты рекомбинации in vivo, полученные для генов оха у штаммов Е. coli дикого типа и MutS Рекомбинация генов оха in vivo у Е. coli дикого типа по сравнению с обработанной 2 аминопурином (2-АР). На первой стадии компетентные клетки Е. coli AB1157 трансформировали посредством электропорации производными от pACYC184 несущими ген oxa11 плазмидами, pMIX95. Трансформантов отбирали на основе их устойчивости. Присутствие подходящей плазмиды подтверждали рестрикционным анализом и/или ПЦР. На второй стадии получали компетентные клетки данного штамма в присутствии 200 мкг/мл 2-АР и- 17012070 независимо подвергали электропорации плазмидами В. subtilis pMIX94, несущей оха 7, или pMIX98, несущей oxa11. Плазмиду В. subtilis pMIX91 использовали в качестве отрицательного контроля, тогда как плазмиду Е. coli pMIX92, несущую маркеры SpcR и PhleoR, использовали в качестве контроля эффективности трансформации. Плазмидные ДНК перед электропорацией подвергали УФ-облучению для увеличения частоты рекомбинации. Результаты обобщены в табл. 4. У штамма дикого типа рекомбинанты в экспериментах получали при использовании идентичных генов оха, тогда как у обработанного 2-АР штамма, рекомбинация также происходила между отличающимися на 5% генами. Таблица 4 Частоты рекомбинации in vivo, полученные для генов оха у штаммов Е. coli дикого типа и обработанного 2-АР Заслуживало внимания то, что рекомбинация происходила между различающимися на 22% генами,у которых наибольший участок идентичных последовательностей составлял 22 нуклеотида (oxa5/oxa11) и 18 нуклеотидов (оха 5/оха 7) соответственно (см. фиг. 5 и 6). Сообщалось, что рекомбинация становится неэффективной ниже минимальной длины участков гомологии, известных как MEPS (минимальный эффективный участок процессинга). Длина MEPS варьирует в зависимости от пути рекомбинации, но описано, что она находится в интервале от 23 до 90 пар оснований (5). Анализы последовательностей генов R1 и R2, находящихся на полученных 54 гибридных плазмидах, в экспериментах, включающих в себя отличающиеся на 5 или 22% гены, показали, что 46 из этих гибридных плазмид отличались друг от друга. Этот результат означает, что они соответствовали различным событиям рекомбинации, и, следовательно, что посредством рекомбинации in vivo получена высокая степень генетического разнообразия. Большинство из рекомбинантных генов были получены посредством нереципрокных одиночных кроссинговеров в различных участках идентичности последовательностей в интервале от 4 до 101 нуклеотида. В некоторых случаях наблюдали множественные кроссинговеры, с получением мозаичных генов или R1, или R2. Рекомбинантные гены, полученные при скрещивании оха 7/оха 5 и oxa11/оха 5, изображены на фиг. 4. Сравнение последовательностей ДНК и выведенных из них аминокислотных последовательностей рекомбинантных генов также выявило, что 53% из них соответствуют новым генам оха (4). Так как во время рекомбинации не образовывалось сдвигов рамки считывания или стоп-кодонов, они предположительно могут кодировать 38 новых функциональных -лактамаз. Таблица 5 Сравнение нуклеотидных и выведенных из них аминокислотных последовательностей рекомбинантных генов оха, полученных посредством рекомбинации in vivo Пример 2. Рекомбинация in vivo гетерологичных генов системы из двух плазмид (Escherichiacoli/Bacillus subtilis), где рекомбинантные последовательности ДНК отбирают по устойчивости к тетрациклину. Для подтверждения полученных в примере 1 результатов и облегчения клонирования и рекомбинации генов разработали другую систему из двух плазмид. Эта система основана на отборе клеток, устойчивых к тетрациклину. 1. Бактериальные штаммы и плазмиды. Используемые в данном примере бактериальные штаммы и плазмиды приведены в табл. 6 и 7 соответственно. 2. Результаты. 2.1. Конструирование плазмиды Е. coli pMIX100. Плазмида pMIX100 несет участок инициации репликации pACYC184, а также ее ген устойчивости к хлорамфениколу. pMIX100 также несет ген lacZ из pBluescript SK+, облегчающий отбор в экспериментах по клонированию. lacZ кодирует фрагмент -галактозидазы, обуславливая -комплементацию для отбора синих/белых рекомбинантов в среде, содержащей X-Gal и IPTG. Таким образом, колонии, несущие pMIX100, должны быть в этой среде синими, а колонии, несущие плазмиду со вставленным в полилинкер (MCS) геном, должны быть белыми. Физическая карта плазмиды pMIX100 показана на фиг. 5. 2.2. Конструирование плазмиды В. subtilis pMIX101. Плазмида pMIX101 представляет собой производное плазмиды В. subtilis pIL253. Так как маркерpIL253 ErmR, обуславливающий устойчивость к эритромицину, не пригоден в Е. coli, вводили маркер устойчивости к тетрациклину, позволяющий отбор гибридных молекул в экспериментах по рекомбинации. Ген устойчивости к тетрациклину амплифицировали с плазмиды pACYC184. Таким образом,pMIX101 несет два маркера: ErmR в качестве селекционного маркера в В. subtilis для клонирования генов-мишеней и TcR для отбора рекомбинантных гибридных молекул в Е. coli. Физическая карта плазмиды pMIX101 показана на фиг. 6. 2.3. Конструирование плазмид для контроля эффективности трансформации pMIX102 и pMIX103. Так как вектор В. subtilis не способен реплицироваться в E. coli, для оценки частоты рекомбинации необходим контроль эффективности трансформации. Так как рекомбинанты отбирают по устойчивости к тетрациклину, тот же маркер должен присутствовать на контрольном векторе. Плазмида pMIX102, про- 19012070 изводное pBluescript SK+, содержит ген TcR, амплифицированный с pACYC184. В pMIX102 ген TcR находится под контролем промотора plac. Физическая карта плазмиды pMIX102 показана на фиг. 7. Во втором контрольном векторе pMIX103 ген tcR клонирован в противоположном направлении отplac. Таким образом, этот ген экспрессируется со своего собственного промотора. Физическая карта плазмиды pMIX103 показана на фиг. 8. 2.4. Клонирование oxa7, oxa11 и oxa5 в плазмиду Е. coli pMIX100. Для подтверждения результатов экспериментов по рекомбинации между отличающимися на 0, 5 и 22% генами oxa, полученные в примере 1, oxa7, oxa11 и оха 5 клонировали в плазмиду Е. coli pMIX100. Эти гены амплифицировали с применением праймеров, содержащих на своих 5'-концах участки PstI илиXhoI. После расщепления этими ферментами амплифицированные фрагменты ДНК независимо лигировали в pMIX100, предварительно расщепленную PstI+XhoI. Компетентные клетки Е. coli DHB10 подвергали электропорации со смесями после лигирования, а колонии, несущие положительные клоны, отбирали по фенотипу устойчивости к хлорамфениколу/белого цвета на планшетах с LB, содержащих Cm (30 мкг/мл) + X-Gal (80 мкг/мл) + IPTG (0,5 мМ). Для каждого клонирования oxa анализировали пять таких трансформантов. Получали плазмидные ДНК и анализировали посредством рестрикционного картирования. Результаты подтверждали, что pMIX104 несет oxa7, pMIX106 несет oxa11, а pMIX107 несет oxa5. Для клонирования в плазмиду В. subtilis pMIX101 oxa7 получали посредством рестрикции PstI иXhoI в виде фрагмента из pMIX104 длиной 0,9 т.п.н. и лигировали в pMIX101, предварительно расщепленную теми же ферментами. После трансформации компетентных клеток В. subtilis 1A423 продуктом лигирования, клетки отбирали на LB, содержащей 0,5 мкг/мл эритромицина (Erm). Плазмидную ДНК получали из 24 трансформантов и анализировали посредством рестрикции. Результаты подтверждали,что все клоны содержали плазмиду pMIX105 длиной 7 т.п.н. Принцип клонирования генов оха 7, oxa11 и oxa5 в плазмиду Е. coli pMIX100 и в плазмиду В. subtilispMIX101 показан на фиг. 9. 2.5. Рекомбинация генов оха in vivo у Е. coli дикого типа по сравнению с мутантом MutS-. Компетентные клетки Е. coli AB1157 hsdR- и ее мутанта MMR-, Е. coli AB1157 hsdR- CmutS, посредством электропорации независимо трансформировали плазмидами pMIX104 (оха 7), pMIX106 (oxa11) и pMIX107 (оха 5). Для рекомбинации генов оха штаммы Е. coli, несущие эти плазмиды, подвергали электропорацией с применением pMIX105 (оха 7). Плазмиду В. subtilis pMIX101 использовали в качестве отрицательного контроля, тогда как несущий маркер TcR вектор Е. coli pMIX102 при отборе на тетрациклине использовали в качестве контроля эффективности трансформации. Все ДНК до электропорации подвергали УФоблучению для увеличения частоты рекомбинации. Частоты рекомбинации подсчитывали делением эффективности трансформации, полученной с плазмидами В. subtilis, на эффективность трансформации, полученную с контрольным вектором pMIX92. В свою очередь, эффективность трансформации подсчитывали как количество колониеобразующих единиц (КОЕ), полученных на грамм ДНК в ранее описанных условиях. Полученные результаты обобщены в табл. 8. У штамма дикого типа рекомбинанты в экспериментах получали при использовании идентичных или отличающихся на 5% генов оха, тогда как у мутанта MutS-,рекомбинация также происходила между отличающимися на 22% генами. Таблица 8 Частоты рекомбинации in vivo, полученные для генов оха у штаммов Е. coli дикого типа и MutS Частоты рекомбинации согласовывались с частотами рекомбинации, полученными для первой системы из двух плазмид. Для подтверждения рекомбинации трансформанты pMIX105 растили в жидких средах, содержащих тетрациклин (12,5 мкг/мл). Рестрикционные анализы полученной из этих культур плазмидной ДНК показали, что она совместно с резидентными плазмидами (или pMIX104, или pMIX106) содержит димеры,несущие рекомбинантные гены оха. Кроме того, из обеих колоний и плазмидной ДНК с применением специфических праймеров были успешно амплифицированы рекомбинантные гены R1 и R2. Результаты демонстрируют, что рекомбинанты были получены с применением второй системы из двух плазмид с применением устойчивости к тетрациклину в качестве селективного давления.- 20012070 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения и детектирования рекомбинантных последовательностей ДНК у прокариот,включающий в себя стадии:a) получения первичной прокариотической клетки, содержащей внехромосомную реципиентную молекулу ДНК, содержащую первую последовательность ДНК для рекомбинации и способную автономно реплицироваться в прокариотической клетке, и внехромосомную донорную молекулу ДНК, содержащую вторую последовательность ДНК для рекомбинации и, по меньшей мере, первую маркерную последовательность, кодирующую генный продукт и не способную к автономной репликации в прокариотической клетке,b) культивирования первичной прокариотической клетки в селективных условиях, стимулирующих образование коинтеграта или гибридной молекулы между реципиентной и донорной молекулами ДНК, и рекомбинацию этих двух последовательностей ДНК для рекомбинации, и позволяющих рост и/или размножение клеток только в том случае, если экспрессирован генный продукт первой маркерной последовательности, иc) выделения вторичной прокариотической клетки, растущей и/или размножающейся в селективных условиях и содержащей гибридную молекулу ДНК, по меньшей мере, с первой маркерной последовательностью и образованной из первой и второй последовательностей рекомбинантной последовательности ДНК, полученной вследствие рекомбинации между первой и второй последовательностями ДНК,где прокариотическая клетка транзиторно или постоянно дефицитна по системе репарации ошибочного спаривания и где донорная молекула ДНК и реципиентная молекула ДНК являются отличными друг от друга линейными или кольцевыми плазмидами. 2. Способ по п.1, где донорная молекула ДНК не имеет участка инициации репликации. 3. Способ по п.1, где донорная молекула ДНК имеет нефункциональный участок инициации репликации. 4. Способ по любому из пп.1-3, где донорная молекула ДНК представляет собой плазмиду Bacillussubtilis, не способную реплицироваться в Е. coli. 5. Способ по п.4, где донорная молекула ДНК представляет собой плазмиду В. subtilis pMIX91, содержащую маркер specR и маркер phleoR, или плазмиду В. subtilis pMIX101, содержащую маркер tcR. 6. Способ по любому из пп.1-5, где первая маркерная последовательность структуры донорной ДНК выбрана из группы, состоящей из пищевого маркера, маркера устойчивости к антибиотику и последовательности, кодирующей субъединицу фермента. 7. Способ по п.6, где генный продукт первой маркерной последовательности обеспечивает устойчивость к антибиотику клетки, чувствительной к этому антибиотику. 8. Способ по п.6 или 7, где первая маркерная последовательность представляет собой specR, генный продукт которого обеспечивает устойчивость клетки к спектиномицину, или phleoR, генный продукт которого обеспечивает устойчивость клетки к флеомицину, или tcR, генный продукт которого обеспечивает устойчивость клетки к тетрациклину. 9. Способ получения и детектирования рекомбинантных последовательностей ДНК у прокариот,включающий в себя стадии:d) получения первичной прокариотической клетки, содержащей внехромосомную реципиентную молекулу ДНК, содержащую первую последовательность ДНК для рекомбинации и способную автономно реплицироваться в прокариотической клетке, и внехромосомную донорную молекулу ДНК, содержащую вторую последовательность ДНК для рекомбинации и, по меньшей мере, первую маркерную последовательность, кодирующую генный продукт и не способную к автономной репликации в прокариотической клетке,e) культивирования первичных прокариотических клеток в селективных условиях, стимулирующих образование коинтеграта или гибридной молекулы между реципиентной и донорной молекулами ДНК и рекомбинацию двух последовательностей ДНК для рекомбинации и позволяющих рост и/или размножение клеток только в том случае, если экспрессирован генный продукт первой маркерной последовательности, иf) выделения вторичных прокариотических клеток, растущих и/или размножающихся в селективных условиях и содержащих гибридную молекулу ДНК, по меньшей мере, с первой маркерной последовательностью и образованной из первой и второй последовательностей рекомбинантной последовательности ДНК, полученной вследствие рекомбинации между первой и второй последовательностями ДНК,где донорная молекула ДНК представляет собой плазмиду В. subtilis pMIX91, содержащую маркерspecR и маркер phleoR, или плазмиду В. subtilis pMIX101, содержащую маркер tcR. 10. Способ по п.9, где реципиентная молекула ДНК является линейной или кольцевой структурой ДНК, в частности плазмидой или бактериофагом. 11. Способ по п.9 или 10, где прокариотическая клетка имеет функциональную систему репарации ошибочного спаривания.- 21012070 12. Способ по п.9 или 10, где прокариотическая клетка транзиторно или постоянно дефицитна по системе репарации ошибочного спаривания. 13. Способ по любому из пп.1-12, где реципиентная молекула ДНК представляет собой плазмиду,способную реплицироваться в Escherichia coli. 14. Способ по п.13, где реципиентная молекула ДНК представляет собой плазмиду Е. colipACYC184, или плазмиду Е. coli pMIX100, или их производное. 15. Способ по любому из пп.1-14, где донорная молекула ДНК и/или ее участок инициации репликации происходят из вида прокариота, отличного от прокариотического вида, в клетки которого вводят молекулу донорной ДНК. 16. Способ по любому из пп.1-15, где функционирование участка инициации репликации донорной ДНК нарушено мутацией. 17. Способ по любому из пп.1-16, где донорная молекула ДНК содержит вторую маркерную последовательность. 18. Способ по любому из пп.1-17, где реципиентная молекула ДНК содержит третью маркерную последовательность и, необязательно, четвертую маркерную последовательность. 19. Способ по п.17 или 18, где вторая, третья и четвертая маркерные последовательности представляют собой кодирующие или не кодирующие белки последовательности, выбранные из группы, состоящей из пищевых маркеров, пигментных маркеров, маркеров устойчивости к антибиотикам, маркеров чувствительности к антибиотикам, участков распознавания ферментов рестрикции, участков распознавания праймеров и последовательностей, кодирующих субъединицу фермента. 20. Способ по п.19, где генные продукты третьей и четвертой маркерных последовательностей реципиентной молекулы ДНК обеспечивают устойчивость к антибиотику клетки, которая чувствительна к этому антибиотику. 21. Способ по п.20, где генный продукт третьей маркерной последовательности обеспечивает устойчивость к тетрациклину. 22. Способ по п.20, где генный продукт четвертой маркерной последовательности обеспечивает устойчивость клетки к хлорамфениколу. 23. Способ по любому из пп.1-22, где первая и вторая последовательности ДНК для рекомбинации отличаются по меньшей мере двумя нуклеотидами. 24. Способ по любому из пп.1-23, где первая и вторая последовательности ДНК для рекомбинации являются встречающимися в природе последовательностями. 25. Способ по п.24, где первая и/или вторая последовательности ДНК для рекомбинации происходят из вирусов, бактерий, растений, животных и/или человеческих существ. 26. Способ по любому из пп.1-25, где первая и/или вторая последовательности ДНК для рекомбинации являются искусственными последовательностями. 27. Способ по любому из пп.1-26, где каждая из первой и второй последовательностей ДНК для рекомбинации содержит одну или несколько кодирующих белок последовательностей и/или одну или несколько некодирующих последовательностей. 28. Способ по любому из пп.1-27, где первичную прокариотическую клетку получают посредством одновременного или последовательного введения в прокариотическую клетку молекулы реципиентной ДНК и молекулы донорной ДНК. 29. Способ по п.28, где молекулы реципиентной и донорной ДНК вводят в прокариотическую клетку посредством трансформации, конъюгации, трансдукции, сексдукции и/или электропорации. 30. Способ по любому из пп.1-29, где первичную прокариотическую клетку культивируют в присутствии по меньшей мере одного антибиотика, к которому генный продукт первой маркерной последовательности обеспечивает устойчивость. 31. Способ по п.30, где первичную прокариотическую клетку дополнительно культивируют в присутствии второго, третьего и/или четвертого антибиотиков, к которым генные продукты второй маркерной последовательности, третьей маркерной последовательности и четвертой маркерной последовательности, соответственно, обеспечивают устойчивость. 32. Способ по любому из пп.1-31, где прокариотическая клетка представляет собой клетку архебактерии или эубактерии. 33. Способ по п.32, где эубактерия представляет собой грамотрицательную бактерию, грамположительную бактерию или цианобактерию. 34. Способ по п.33, где грамотрицательная бактерия представляет собой Escherichia coli. 35. Способ по пп.1-8 и 12, где транзиторный или постоянный дефицит системы репарации ошибочного спаривания происходит вследствие мутации, делеции и/или индуцируемой экспрессии или репрессии одного или нескольких генов, вовлеченных в систему репарации ошибочного спаривания, обработки средством, насыщающим систему репарации ошибочного спаривания, и/или обработки средством, глобально нокаутирующим репарацию ошибочного спаривания. 36. Способ по пп.1-8, 12 и 35, где прокариотическая клетка несет мутантный ген mutS и/или мутантный ген mutL.- 22012070 37. Способ по любому из пп.1-36, где первую и вторую рекомбинантные последовательности ДНК,содержащиеся в гибридной молекуле ДНК вторичной прокариотической клетки, отбирают, и/или выделяют, и/или анализируют. 38. Способ по п.37, где первую и вторую рекомбинантные последовательности ДНК выделяют посредством расщепления рестрикционными ферментами. 39. Способ по п.37, где первую и вторую рекомбинантные последовательности ДНК амплифицируют посредством ПЦР. 40. Способ по любому из пп.37-39, где выделенные первую и вторую рекомбинантные последовательности ДНК вставляют в донорную молекулу ДНК и реципиентную молекулу ДНК, соответственно, и подвергают другому циклу рекомбинации. 41. Применение плазмид В. subtilis pMIX91 и pMIX101 в качестве донорных молекул ДНК в способе по любому из пп.1-40 для получения и/или детектирования рекомбинантных последовательностей ДНК в прокариотической клетке-хозяине, предпочтительно в клетке Е. coli. 42. Применение плазмид Е. coli pACYC184 или pMIX100 или их производных в качестве реципиентной молекулы ДНК в способе по любому из пп.1-40 для получения и/или детектирования рекомбинантных последовательностей ДНК в прокариотической клетке-хозяине, предпочтительно в клетке Е.coli. 43. Способ получения в прокариотической клетке гибридного гена и/или кодируемого гибридным геном белка, где осуществляют способ по любому из пп.1-40, и в прокариотической клетке получают гибридный ген или кодируемый гибридным геном белок, и гибридный ген и/или кодируемый белок отбирают в прокариотической клетке и/или выделяют из нее после экспрессии.
МПК / Метки
МПК: C12N 1/20, C12N 15/10, C12N 15/65
Метки: внехромосомных, применением, рекомбинантных, генов, двух, получение, элементов, клетках, прокариотических
Код ссылки
<a href="https://eas.patents.su/30-12070-poluchenie-rekombinantnyh-genov-v-prokarioticheskih-kletkah-s-primeneniem-dvuh-vnehromosomnyh-elementov.html" rel="bookmark" title="База патентов Евразийского Союза">Получение рекомбинантных генов в прокариотических клетках с применением двух внехромосомных элементов</a>
Предыдущий патент: Способ получения хлора высокой чистоты
Следующий патент: Селективные агонисты рецептора y4 для терапевтического воздействия
Случайный патент: Светосильный объектив












