Выделенные последовательности днк, кодирующие капсидные белки l1 и l2 папилломавируса человека типа 18, вектор для экспресси последовательностей днк, способ получения вирусоподобных частиц и способ индуцирования иммунного ответа
Номер патента: 1092
Опубликовано: 30.10.2000
Авторы: Джордж Хью А., Джойс Джозеф Г., Хофманн Кетрин Дж., Янзен Кетрин У., Нипер Майкл П.
Формула / Реферат
1. Выделенная последовательность ДНК, кодирующая капсидный белок L1 папилломавируса человека типа 18, имеющего следующую структуру:


2. Выделенная последовательность ДНК, кодирующая капсидный белок L2 папилломавируса человека типа 18, имеющего следующую структуру:


3. Вектор для экспрессии последовательностей ДНК по пп.1 и 2 формулы в клетках-хозяевах, сконструированный на основе дрожжевого челночного вектора, включающего pBR322, ген дрожжей LEU2d и 2a -плазмиду дрожжей, и содержащий SpHI-фрагмент размером 1,4 т.п.о. из плазмиды pUC18, в состав которого входят следующие конструктивные элементы:
- дивергентные промоторы S.cerevisiae GAL1-GAL10 из плазмиды рВМ272, которые фланкированы с каждой стороны копией терминатора транскрипции АDHI;
- BamHI-клонирующий сайт, расположенный между промотором GAL1 и первой копией терминатора транскрипции ADHI, и
- SmaI-клонирующий сайт, расположенный между промотором GAL10 и второй копией терминатора транскрипции ADHI.
4. Вектор экспрессии по п.3, отличающийся тем, что представляет собой вектор р191-6, содержащий последовательность ДНК по п.1 формулы, встроенную в BamHI-клонирующий сайт.
5. Вектор экспрессии по п.3, отличающийся тем, что представляет собой вектор р195-11, содержащий последовательность ДНК по п.1 формулы, встроенную в BamHI-клонирующий сайт, и последовательность ДНК по п.2 формулы, встроенную в Smal-клонирующий сайт.
6. Способ получения вирусоподобных частиц папилломавируса человека типа 18, заключающийся в том, что осуществляют следующие стадии:
- трансформируют клетки дрожжей вектором экспрессии по любому из пп.3-5 формулы;
- культивируют трансформированные клетки в условиях, обеспечивающих экспрессию последовательности ДНК, кодирующих белок L1 и белки L1+L2 папилломавируса человека типа 18; и
- выделяют вирусоподобные частицы, которые спонтанно формируются в клетке после экспрессии в ней указанных белков.
7. Способ индуцирования иммунного ответа на папилломавирусы у млекопитающего, отличающийся тем, что млекопитающему вводят вирусоподобные частицы, полученные в соответствии со способом по п.6.
Текст
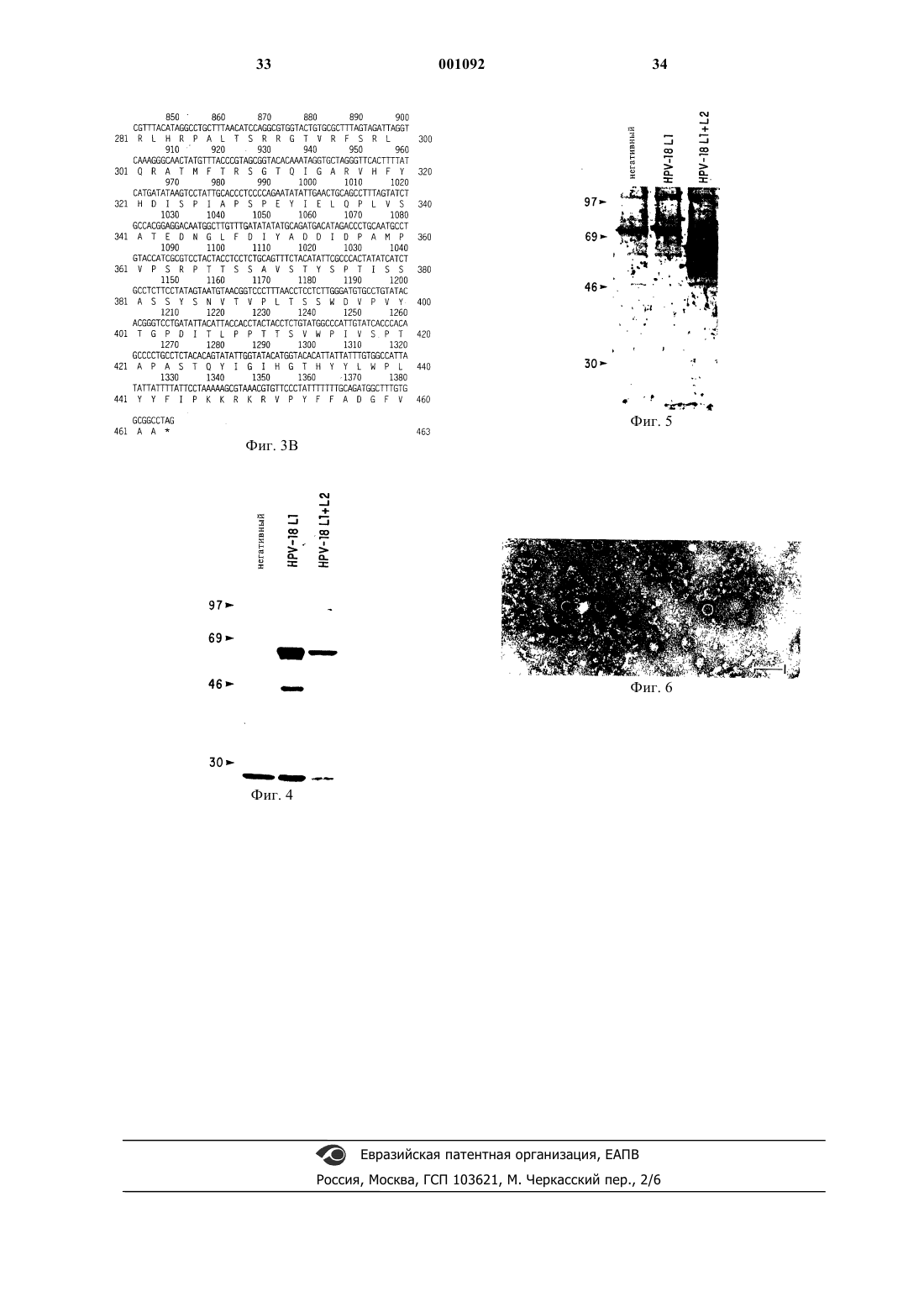
1 Эта заявка является продолжением заявкиUS08/408669, зарегистрированной 22 марта 1995 г., в настоящее время ожидающей рассмотрения, и продолжением заявки US08/409122, зарегистрированной 22 марта 1995 г.,в настоящее время ожидающей рассмотрения. Область изобретения Данное изобретение относится к молекулам ДНК, кодирующим капсидные белки L1 иL2 папилломавируса человека типа 18, и их производным. Краткое описание рисунков Фиг.1 показывает нуклеотидную и выведенную аминокислотную последовательностиL1 HPV18; фиг. 2 - перечень аминокислотных изменений в белке L1 HPV18; фиг. 3 - нуклеотидную и выведенную аминокислотную последовательности L2 HPV18; фиг. 4 - иммуноблот белка L1 HPV18, экспрессируемого в дрожжах; фиг. 5 - иммуноблот белка L2 HPV18, экспрессируемого в дрожжах; фиг. 6 - электронная микрофотография вирусоподобных частиц, образованных белком L1(PV), встречаются у различных животных, в том числе у человека, овец, собак, кошек, кроликов,обезьян, змей и коров. Папилломавирусы инфицируют эпителиальные клетки, как правило,индуцируя доброкачественные эпителиальные или фиброэпителиальные опухоли в месте инфекции. PV являются видоспецифическими инфекционными агентами: папилломавирус человека не инфицирует животных. Папилломавирусы могут быть разделены на различные группы в зависимости от хозяина,которого они инфицируют. Папилломавирусы человека (HPV) подразделяются далее на более 70 типов на основе гомологии последовательности ДНК. По-видимому, различные PV являются типоспецифическими иммуногенами в том смысле, что нейтрализующий иммунитет к инфекции, вызванной одним типом папилломавируса, не создает иммунитета против другого типа вируса папилломы. У человека различные типы HPV вызывают различные заболевания. Типы HPV 1, 2, 3, 4,7, 10 и 26-29 вызывают образование доброкачественных бородавок, как у нормальных индивидуумов, так и у индивидуумов с ослабленным иммунитетом. Типы HPV 5, 8, 9, 12, 14, 15, 17,19-25, 36 и 45-50 вызывают плоские повреждения у индивидуумов с ослабленным иммунитетом. Типы HPV 6, 11, 34, 39, 41-44 и 51-55 вызывают доброкачественные кондиломы слизистой оболочки половых органов или дыхательных путей. Типы HPV 16 и 18 вызывают эпителиальную дисплазию половых органов и связаны с большей частью in situ карцином и инва 001092 2 зивных карцином шейки матки, вагины, вульвы и анального канала. Папилломавирусы являются небольшими(50-60 нм), не имеющими оболочки, икосаэдральными ДНК-вирусами, которые кодируют до восьми ранних и двух поздних генов. Открытые рамки считывания (ORF) геномов этих вирусов обозначаются как Е 1-Е 7 и L1 и L2, где "Е" обозначает ранние (early) и "L" обозначает поздние(late). L1 и L2 кодируют вирусные капсидные белки. Ранние (Е) гены ассоциированы с такими функциями, как репликация вируса и преобразование клеток. Белок L1 является основным капсидным белком и имеет мол. массу 55-60 кДа. Белок L2 является минорным капсидным белком, который имеет предсказанную мол. массу 55-60 кДа и среднюю (кажущуюся) мол. массу 75-100 кДа,как определено при помощи электрофореза в полиакриламидном геле. Иммунологические данные предполагают, что большая часть белкаL2 является внутренней по отношению к белкуL1. ORF L1 является высококонсервативной среди различных папилломавирусов. Белки L2 являются менее консервативными среди различных папилломавирусов. Было обнаружено, что гены L1 и L2 являются хорошими мишенями для иммунопрофилактики. Исследования в системах папилломавируса американского кролика (CRPV) и бычьего папилломавируса (BPV) показали, что иммунизация белками L1 и L2, экспрессированными в бактериях, или с использованием векторов на основе вируса осповакцины защищали животных от вирусной инфекции. Экспрессия геновL1 папилломавируса в бакуловирусных системах или с использованием векторов на основе вируса осповакцины приводила к сборке вирусоподобных частиц (VLP), которые были использованы для индуцирования ответов с высоким титром вируснейтрализующих антител, которые обеспечивают защиту от вирусной инфекции. После типа 16 HPV, HPV18 представляет собой наиболее распространенный тип HPV,обнаруженный в карциномах шейки матки.HPV18 был обнаружен в 5-20% биопсий цервикального рака, собранных из различных частей мира (Ikenberg, H. 1990. Human papillomavirusPapilloma virus Infection. G.Gross et.al., p.85-112). По-видимому, существует географическая зависимость инфекции HPV18, поскольку опухолевые биопсии, взятые у женщин Африки и Южной Америки, несут HPV18 более часто, чем подобные биопсии, взятые у женщин из Европы и Северной Америки. Лежащие в основе этих географических различий причины неизвестны. Разработка вакцины против инфекции HPV18 становится крайне важной, так как HPV18 связан также с более агрессивно растущими раковыми опухолями и редко обнаруживается в бо 3 лее мягких предшествующих повреждениях,CIN I-II. Сущность изобретения Данное изобретение относится к молекулам ДНК, кодирующим капсидные белки L1 иL2 папилломавируса человека типа 18 (HPVtype 18, HPV18), и к использованию этих молекул ДНК. Подробное описание изобретения Данное изобретение относится к молекулам ДНК, кодирующим капсидные белки L1 иL2 папилломавируса человека типа 18 (НPVtype 18, HPV18), и их производным. Такие производные включают (но не ограничены ими) пептиды и белки, кодируемые этой ДНК, антитела к этой ДНК или антитела к белкам, кодируемым этой ДНК, вакцины, содержащие эту ДНК, или вакцины, содержащие белки, кодируемые этой ДНК, иммунологические композиции, содержащие эту ДНК или белки, кодируемые этой ДНК, наборы, содержащие эту ДНК или произведенную из нее РНК, или белки, кодируемые этой ДНК. Фармацевтически применимые композиции, содержащие ДНК или кодируемые этой ДНК белки, могут быть приготовлены в соответствии с известными способами, такими как смешивание с фармацевтически приемлемым носителем. Примеры таких носителей и способы приготовления могут быть найдены в Remington's Pharmaceutical Sciences. Для получения фармацевтически приемлемой композиции,пригодной для эффективного введения, такие композиции должны содержать эффективное количество ДНК, или белка, или VLP. Такие композиции могут содержать ДНК, или белки,или VLP, произведенные из более чем одного типа HPV. Терапевтические или диагностические композиции данного изобретения вводят индивидууму в количествах, достаточных для лечения или диагностики инфекций PV. Эффективное количество может варьировать в зависимости от различных факторов, таких как состояние, вес, пол и возраст индивидуума. Другие факторы включают способ введения. Как правило, композиции следует вводить в дозах от 1 мкг до 1 мг. Фармацевтические композиции могут вводиться индивидууму различными способами,такими как подкожный, местный, пероральный,через слизистую оболочку, внутривенный и внутримышечный. Вакцины данного изобретения содержат ДНК, РНК или белки, кодируемые этими ДНК,которые содержат антигенные детерминанты,необходимые для индуцирования образования нейтрализующих антител у хозяина. Такие вакцины являются также достаточно безопасными для введения без риска клинической инфекции; не имеют токсических побочных действий; яв 001092 4 ляются стабильными; совместимы с носителями вакцин. Вакцины можно вводить различными способами, такими как пероральный, парентеральный, подкожный, через слизистую оболочку,внутривенный или внутримышечный. Вводимая доза может меняться в зависимости от состояния, пола, веса и возраста индивидуума; способа введения; и типа PV вакцины. Вакцину можно использовать в дозированных лекарственных формах, таких как капсулы, суспензии, эликсиры или жидкие растворы. Вакцина может быть приготовлена с иммунологически приемлемым носителем. Вакцины вводят в терапевтически эффективных количествах, т.е. в количествах, достаточных для генерирования иммунного протективного ответа. Терапевтически эффективное количество может меняться в зависимости от типа PV. Вакцину можно вводить в виде одной дозы или в виде множественных доз. ДНК или производные ДНК данного изобретения могут быть использованы для приготовления иммуногенных композиций. Такие композиции при введении в организм подходящего хозяина способны индуцировать иммунный ответ у хозяина. ДНК и ее производные могут быть использованы для генерирования антител. Термин "антитела" в применении здесь включает как поликлональные, так и моноклональные антитела, а также их фрагменты, такие как Fv, Fab и F(ab)2,которые способны связывать антиген или гаптен. ДНК и производные ДНК данного изобретения могут быть использованы для серотипирования инфекции HPV и скрининга HPV. ДНК,рекомбинантные белки, VLP и антитела могут быть использованы для приготовления наборов("китов"), пригодных для обнаружения и серотипирования HPV. Подобный набор мог бы содержать компартментализованный носитель,пригодный для удерживания в ограниченном пространстве, по меньшей мере, одного контейнера. Кроме того, носитель может включать в себя реагенты, такие как ДНК HPV18, рекомбинантный белок HPV или VLP или антитела против HPV, пригодные для обнаружения различных типов HPV. Носитель может также содержать средства для детектирования, например,антиген или субстраты фермента и т.п. ДНК и производные из нее белки применимы также в качестве маркеров молекулярной массы и молекулярного размера. Поскольку генетический код является вырожденным, более чем один кодон может использоваться для кодирования конкретной аминокислоты, и, следовательно, аминокислотная последовательность может кодироваться любым из набора сходных ДНК-олигонуклеотидов. Только один член этого набора будет идентичен последовательностям HPV18, но будет способен 5 гибридизоваться с ДНК HPV18 даже в присутствии ДНК-олигонуклеотидов с неправильными спариваниями оснований при соответствующих условиях. При других условиях неправильно спаренные ДНК-олигонуклеотиды могут все еще гибридизоваться с ДНК HPV18, что позволяет индентифицировать и выделять кодирующую ДНК HPV18. Очищенную ДНК HPV18 по этому изобретению или ее фрагменты можно использовать для выделения и очистки гомологов и фрагментов HPV18 из других источников. Для выполнения этого первую ДНК HPV18 можно смешать с пробой, содержащей ДНК, кодирующую гомологи HPV18, при подходящих условиях гибридизации. Гибридизованный ДНК-комплекс можно выделить и из него можно очистить ДНК, кодирующую эту гомологичную ДНК. Известно, что имеется значительное количество избыточности в различных кодонах, кодирующих специфические аминокислоты. Таким образом, данное изобретение касается также тех последовательностей ДНК, которые содержат альтернативные кодоны, кодирующие возможную при некоторых обстоятельствах трансляцию идентичной аминокислоты. Для целей этой заявки последовательность, несущая один или несколько замененных кодонов, будет называться вырожденной вариацией. В сфере действия данного изобретения находятся также мутации либо в ДНК-последовательности, либо в транслированном белке, которые, по существу, не изменяют конечные физические свойства экспрессируемого белка. Например, замена валина на лейцин, лизина на аргинин, или аспарагина на глутамин может не вызывать изменения в функциональности данного полипептида. Известно, что последовательности ДНК,кодирующие пептид, могут быть изменены таким образом, что они будут кодировать пептид,имеющий свойства, отличающиеся от свойств природно-встречающегося пептида. Способы изменения последовательностей ДНК включают в себя сайт-специфический мутагенез (но не ограничиваются им). В применении здесь "функциональным производным" HPV18 является соединение, которое обладает биологической активностьюHPV18. Термин "фрагмент" относится к любой полипептидной подсерии HPV18. Термин "вариант" относится к молекуле, в основном сходной по структуре и функции либо со всей молекулой HPV18, либо с ее фрагментом. Молекула"в основном сходна" с HPV18, если обе эти молекулы имеют, по существу, сходные структуры или если обе молекулы обладают одинаковой 6 биологической активностью. Таким образом,если две молекулы обладают, по существу, одинаковой активностью, они рассматриваются как варианты, даже если структура одной из этих молекул не обнаружена в другой, и даже если эти две аминокислотные последовательности не являются идентичными. Термин "аналог" относится к молекуле, в основном сходной по функции либо со всей молекулой HPV18, либо с ее фрагментом. Многие способы, известные в данной области, можно применять для молекулярного клонирования ДНК HPV18. К этим способам относится (но не ограничивается этим) прямая функциональная экспрессия генов HPV18 после конструирования библиотеки HPV18, содержащей кДНК или геномную ДНК в подходящей системе экспрессирующего вектора. Другим способом является скрининг библиотекиHPV18, содержащей кДНК или геномную ДНК,сконструированной в бактериофаге или в плазмидном челночном векторе, меченым олигонуклеотидным зондом, построенным на основе аминокислотной последовательности HPV18. Дополнительный способ состоит из скрининга библиотеки HPV18, содержащей кДНК или геномную ДНК, сконструированной в бактериофаге или плазмидном челночном векторе, при помощи частичной ДНК, кодирующей HPV18. Эту частичную ДНК получают амплификацией при помощи специфической полимеразной цепной реакции (ПЦР) ДНК-фрагментов HPV18 посредством конструирования вырожденных олигонуклеотидных праймеров на основе аминокислотной последовательности очищенногоHPV18. Другой способ заключается в выделении РНК из продуцирующих HPV18 клеток и трансляции этой РНК в белок при помощи системы трансляции in vitro или in vivo. Трансляция этой РНК в пептид или белок приведет к образованию, по меньшей мере, части белкаHPV18, который можно идентифицировать, например, по активности белка HPV18 или по иммунологической реактивности с антителами против HPV18. В этом способе пулы РНК, выделенной из продуцирующих HPV18 клеток,могут быть анализированы на присутствие РНК,которая кодирует, по меньшей мере, частьHPV18. Дальнейшее фракционирование этого пула РНК может быть осуществлено для очистки РНК HPV18 от РНК, не относящейся кHPV18. Пептид или белок, продуцируемый по этому способу, можно анализировать для обеспечения аминокислотных последовательностей,которые, в свою очередь, используют для создания праймеров для получения кДНК HPV18,или РНК, используемую для трансляции, можно анализировать для обеспечения нуклеотидных последовательностей, кодирующих HPV18, и получения зондов для скрининга библиотеки кДНК HPV18. Эти способы известны в данной области и их можно найти, например, в Sam 7Harbor, NY,1989. Очевидно, что для выделения HPV18 кодирующей ДНК можно использовать другие типы библиотек, а также библиотеки, сконструированные из других клеток или типов клеток. Другие типы библиотек включают в себя(но не ограничиваются ими) библиотеки кДНК,полученные из других клеток или клеточных линий, содержащих HPV типа 18, и библиотеки геномной ДНК. Получение библиотек кДНК может быть осуществлено различными способами. Способы конструирования библиотек кДНК можно найти, например, в Sambrook J., et al., supra. Очевидно, что ДНК, кодирующую HPV18, можно также выделить из соответствующей библиотеки геномной ДНК. Конструирование библиотек геномных ДНК можно выполнять различными способами. Способы конструирования библиотек геномных ДНК можно найти в Sambrook J.,et al., supra. Клонированные ДНК HPV18 или их фрагменты, полученные описанными здесь способами, могут рекомбинантно экспрессироваться молекулярным клонированием в экспрессирующий вектор, содержащий подходящий промотор и другие подходящие регуляторные элементы транскрипции, и переноситься в прокариотические или эукариотические клеткихозяева для продуцирования рекомбинантногоHPV18. Способы таких манипуляций полно описаны в Sambrook J., et al., supra и известны в этой области. Экспрессирующие векторы определяются здесь как ДНК-последовательности, которые необходимы для транскрипции клонированных копий генов и трансляции их мРНК в соответствующем хозяине. Такие векторы можно использовать для экспрессии эукариотических генов в многочисленных хозяевах, таких как бактерии,сине-зеленые водоросли, клетки растений, клетки насекомых, клетки грибов и клетки животных. Специально сконструированные векторы позволяют перемещать ДНК между такими хозяевами, как бактерии-дрожжи или бактерииклетки животных, или бактерии-клетки грибов,или бактерии-клетки позвоночных животных. Правильно сконструированный экспрессирующий вектор должен содержать: начало репликации для автономной репликации в клеткаххозяевах, селектируемые маркеры, ограниченное число применимых сайтов рестриктаз, потенциал для высокой копийности и активные промоторы. Промотор определяется как ДНКпоследовательность, которая направляет РНКполимеразу на связывание с ДНК и инициирует синтез РНК. Сильным промотором является такой промотор, который обусловливает высокую частоту инициации мРНК. Экспрессирую 001092 8 щие векторы могут быть (но не только) клонирующими векторами, модифицированными клонирующими векторами, специально сконструированными плазмидами или вирусами. Разнообразные экспрессирующие векторы млекопитающих можно использовать для экспрессии ДНК HPV18 или ее фрагментов в клетках млекопитающих. Коммерчески доступные экспрессирующие векторы млекопитающих,которые могут быть пригодными для экспрессии рекомбинантного HPV18, включают (но не ограничиваются ими) pcDNA3 (Invitrogen),pMClneo (Stratagene), pXTl (Stratagene), pSG5(342-12) (ATCC 37224), pRSVgpt (ATCC 37199),pRSVneo (ATCC 37198), pSV2-dhfr (ATCC 37146), pUCTag (ATCC 37460) и ZD35 (ATCC 37565). Множество бактериальных экспрессирующих векторов можно использовать для экспрессии ДНК HPV18 и ее фрагментов в бактериальных клетках. Коммерчески доступные бактериальные экспрессирующие векторы, которые могут быть пригодными для экспрессии рекомбинантного HPV18, включают (но не ограничиваются ими) pET11a (Novagen), gt11(Pharmacia). Множество экспрессирующих векторов грибных клеток можно использовать для экспрессии HPV18 или его фрагментов в грибных клетках. Коммерчески доступные экспрессирующие векторы грибных клеток, которые могут быть пригодными для экспрессии рекомбинантного HPV18, включают (но не ограничиваются ими) pYES2 (Invitrogen), экспрессирующий вектор Pichia (Invitrogen) и экспрессирующий вектор Hansenula (Rhein Biotech, Dusseldorf,Germany). Множество экспрессирующих векторов клеток насекомых можно использовать для экспрессии ДНК HPV18 или ее фрагментов в клетках насекомых. Коммерчески доступные экспрессирующие векторы клеток насекомых, которые могут быть пригодными для рекомбинантной экспрессии HPV18, включают (но не ограничиваются ими) pBlueBacIII (Invitrogen) иpAcUW51 (PharMingen, Inc.). Экспрессирующий вектор, содержащий ДНК, кодирующую HPV18 или его фрагменты,может быть использован для экспрессии белковHPV18 или фрагментов белков HPV18 в клетке,ткани, органе или животном (в том числе в человеке). Клетки-хозяева могут быть прокариотическими или эукариотическими, в том числе 9 том числе (но не только) клеточными линиями,произведенными из Drosophila и тутового шелкопряда. Клеточными линиями, произведенными из видов млекопитающих, которые могут быть пригодными и которые являются коммерчески доступными, являются (но не ограничены ими) L-клетки L-M (ТК-) (АТСС CCL 1.3), Lклетки L-M (АТСС CCL 1.2), 293 (АТСС CRL 1573), Raji (АТСС CCL 86), CV-1 (АТСС CCL 70), COS-1 (АТСС CRL 1650), COS-7 (АТСС(АТСС CCL 92), NIH/3T3 (АТСС CRL 1658),HeLa (АТСС CCL 2), C127I (АТСС CRL 1616),BS-C-1 (АТСС CCL 26) и MRS-5 (АТСС CCL 171). Экспрессирующий вектор может быть введен в клетки-хозяева посредством одного из ряда способов, таких как (но не только) трансформация, трансфекция, липофекция, слияние протопластов и электропорация. Содержащие экспрессирующий вектор клетки клонально размножают и индивидуально анализируют для определения, продуцируют ли они белокHPV18 клонов клеток-хозяев можно осуществлять несколькими способами, в том числе (но не только) по иммунологической реактивности с антителами против HPV18 и по присутствию ассоциированной с клеткой-хозяином активности HPV18, такой как связывание НРV18 специфического лиганда или трансдукция сигнала, определяемая как ответная реакция, опосредованная взаимодействиемHPV18 белками. Экспрессия ДНК-фрагментов HPV18 может также осуществляться с использованием продуцируемой in vitro синтетической мРНК или нативной мРНК. Синтетическая мРНК или мРНК, выделенная из продуцирующих HPV18 клеток, может эффективно транслироваться в различных бесклеточных системах, таких как(но не только) экстракты зародышей пшеницы и экстракты ретикулоцитов, а также может эффективно транслироваться в системах на основе клеток, в том числе (но не только), посредством микроинъекции в ооциты лягушки, причем этот способ является предпочтительным. После экспрессии белка (белков) HPV18 в клетке-хозяине белок HPV18 может быть извлечен для обеспечения HPV18 в очищенном виде. Доступны и пригодны несколько способов очистки HPV18. Как описано здесь, рекомбинантный белок HPV18 может быть очищен из клеточных лизатов и экстрактов различными сочетаниями или отдельным применением солевого фракционирования, ионообменной хроматографии, гель-фильтрации, адсорбционной хроматографии на гидроксилапатите и хроматографии гидрофобного взаимодействия. Кроме того, рекомбинантный HPV18 может быть отделен от других клеточных белков 10 при помощи иммуноаффинной колонки, приготовленной с моноклональными и поликлональными антителами, специфическими для полноразмерного насцентного (строящегося) HPV18 или полипептидных фрагментов HPV18. Моноклональные и поликлональные антитела могут быть получены в соответствии со множеством способов, известных в данной области. Моноклональные или моноспецифические антитела в применении здесь, определяются как молекулы одного антитела или молекулы множественных антител с однородными характеристиками связывания в отношении HPV18. Однородным связыванием здесь называют способность молекул антитела связываться со специфическим антигеном или эпитопом. Очевидно, что способы получения моноспецифических антител могут быть использованы для получения антител, специфических для полипептидных фрагментов HPV или полноразмерных полипептидов HPV. В частности,ясно, что могут быть получены моноспецифические антитела, которые являются специфическими для полностью функциональных белковHPV или их фрагментов. Данное изобретение касается также способов скрининга на соединения, которые модулируют экспрессию ДНК или РНК, кодирующихHPV18, а также функцию (функции) белка (белков) HPV18 in vivo. Соединениями, которые модулируют эти активности, могут быть ДНК,РНК, пептиды, белки или небелковые органические молекулы. Соединения могут модулировать эти активности увеличением или аттенюированием экспрессии ДНК или РНК, кодирующих HPV18, или функции белка HPV18. Соединения, способные модулировать экспрессию ДНК или РНК, кодирующих HPV18, или функцию белка HPV18, могут быть обнаружены различными тестами. Такой тест может быть простым тестом "нет/да" для определения, имеется ли изменение в экспрессии или функции. Тест может быть сделан количественным путем сравнения экспрессии или функции испытуемой пробы с уровнями экспрессии или функции в стандартной пробе. Могут быть приготовлены наборы, содержащие ДНК HPV18, фрагменты ДНК HPV18,антитела к ДНК HPV18 или к белку HPV18,РНК HPV18 или белок HPV18. Такие наборы используют для обнаружения ДНК, которая гибридизуется с ДНК HPV18, или для обнаружения присутствия белка (белков) HPV18 или пептидных фрагментов этих белков в пробе. Такая характеристика является ценной для многочисленных целей, в том числе (но не только) для судебных анализов и эпидемиологических исследований. Нуклеотидные последовательности, комплементарные кодирующей последовательности ДНК HPV18, могут быть синтезированы для терапии при помощи антисмысловых последо 11 вательностей. Такими антисмысловыми молекулами могут быть ДНК, стабильные производные ДНК, такие как фосфоротиоаты или метилфосфонаты, РНК, стабильные производные РНК, такие как 2'-О-алкилРНК, или другие антисмысловые олигонуклеотидные миметикиHPV18. Антисмысловые молекулы HPV18 могут быть введены в клетки микроинъекцией,инкапсулированием в липосомы или экспрессией из векторов, несущих эту антисмысловую последовательность. Терапия при помощи антисмысловых молекул HPV18 может быть, в частности, применима для лечения заболеваний, при которых выгодно уменьшение активностиHPV18. Термин "химическое производное" относится к молекуле, которая содержит дополнительные химические части молекулы, которые в норме не являются частью основной молекулы. Такие части молекулы могут улучшать растворимость, время полужизни, абсорбцию и т.д. основной молекулы. Альтернативно, эти части молекулы могут ослаблять нежелательные побочные эффекты основной молекулы или снижать токсичность основной молекулы. Примеры таких частей молекулы описаны во многих руководствах, таких как Remington's Pharmaceutical Sciences. Соединения, индентифицированные согласно описанным здесь способам, можно использовать отдельно при подходящих дозах,определяемых рутинным тестированием, для получения оптимального ингибирования HPV18 или его активности при минимизации любой потенциальной токсичности. Кроме того, может быть желательным совместное введение или последовательное введение других агентов. Предпочтительно соединения по данному изобретению могут быть введены в виде одной суточной дозы или общая суточная доза может вводиться в виде нескольких разделенных доз. Кроме того, соединения по данному изобретению могут вводиться посредством таких способов, как (но не только) интраназальный, пероральный, трансдермальный способы или при помощи суппозитория. Для комбинированного лечения более чем одним активным агентом, когда активные агенты находятся в раздельных дозированных готовых формах, активные агенты могут вводиться совместно или каждый может быть введен отдельно. Схему введения соединений по данному изобретению выбирают в соответствии с различными факторами, такими как тип, вид, возраст, вес, пол и медицинское состояние пациента; тяжесть состояния, которое должно быть подвергнуто лечению; способ введения; функционирование почек и печени пациента; и конкретное применяемое соединение. Врач с обычной квалификацией может легко определить и прописать эффективное количество лекарства, 001092 12 требующееся для предотвращения, противодействия или остановки прогрессирования данного состояния. Оптимальная точность в достижении концентраций лекарственного средства в пределах, которые дают эффективность без токсичности, требует схемы, основанной на кинетике доступности данного лекарственного средства для сайтов-мишеней. Это включает в себя рассмотрение распределения, равновесия и элиминации лекарственного средства. В способах по данному изобретению описанные здесь подробно соединения могут образовать активный ингредиент и их обычно вводят в смеси с подходящими фармацевтическими разбавителями, наполнителями или носителями(называемыми здесь в общем виде материалами"носителями"), выбранными в соответствии с предполагаемой формой введения, т.е. введения в виде пероральных таблеток, капсул, эликсиров, сиропа, суппозиториев, гелей и т.п., и соответствующими обычной фармацевтической практике. Например, для перорального введения в форме таблетки или капсулы активный лекарственный компонент может комбинироваться с пероральным нетоксичным фармацевтически приемлемым инертным носителем, таким как этанол, глицерин, вода и т.п. Кроме того, при желании или при необходимости, в эту смесь могут быть включены подходящие связующие вещества, дезинтегрирующие агенты и красители. К подходящим связующим веществам (без ограничения) относятся крахмал, желатина,природные сахара, такие как глюкоза или беталактоза, сахаристые вещества из кукурузы, природные и синтетические камеди, такие как аравийская камедь, трагакант или альгинат натрия,карбоксиметилцеллюлоза, полиэтиленгликоль,воски и т.п. К смачивающим веществам, используемым в таких лекарственных формах,относятся (без ограничения) олеат натрия, стеарат натрия, стеарат магния, бензоат натрия,ацетат натрия, хлорид натрия и т.п. Дезинтеграторы включают в себя (без ограничения) крахмал, метилцеллюлозу, агар, бентонит, ксантановую камедь и т.п. Для жидких форм активный лекарственный компонент может комбинироваться с подходящими, содержащими корригент, суспендирующими или диспергирующими агентами,такими как синтетические и природные камеди,например трагакант, аравийская камедь, метилцеллюлоза и т.п. Другими диспергирующими агентами, которые могут применяться, являются глицерин и т.п. Для парентерального введения желательны стерильные суспензии и растворы. В случае внутривенного введения желательно использование изотонических препаратов, которые обычно содержат подходящие консерванты. Препараты для местного нанесения, содержащие активный лекарственный компонент,могут быть смешаны с различными материала 13 ми-носителями, хорошо известными в данной области, такими как, например, спирты, гельAloe vera, аллантоин, глицерин, масла с витаминами А и Е, минеральное масло, PPG2 миристилпропионат и т.п., для образования, например, спиртовых растворов, очищающих средств для местного применения, очищающих кремов,кожных гелей, кожных лосьонов и шампуней в виде крема или геля. Соединения по данному изобретению могут также вводиться в форме липосомных систем доставки, таких как небольшие однослойные везикулы, большие однослойные везикулы и многослойные везикулы. Липосомы могут быть образованы из различных фосфолипидов,таких как холестерин, стериламин или фосфатидилхолины. Соединения по данному изобретению могут также доставляться с использованием моноклональных антител в качестве индивидуальных носителей, с которыми соединены молекулы конкретного соединения. Соединения по данному изобретению могут быть также связаны с растворимыми полимерами в качестве нацеливаемых носителей лекарственного средства. К таким полимерам относятся поливинилпирролидон, сополимер пирана, полигидроксиметакрил-амидфенол,полигидроксиэтиласпартамидфенол или полиэтиленоксидполилизин, замещенный остатками пальмитоила. Кроме того,соединения по данному изобретению могут быть соединены с классом биодеградируемых полимеров, применимых в достижении контролируемого высвобождения лекарственного средства, например с полимолочной кислотой,полиэпсилонкапролактоном, полигидроксимасляной кислотой, полиортоэфирами, полиацеталями, полигидропиранами, полиакрилатами и перекрестно-сшитыми или амфипатическими блок-сополимерами гидрогелей. Следующие далее примеры иллюстрируют данное изобретение без его ограничения только этими примерами. Пример 1. Клонирование генома HPV18. Общую геномную ДНК выделяли из клеточной линии, полученной из злокачественной опухоли шейки матки человека, SW756 (Freedman R.S., et al., 1982, In Vitro, Vol.18, pages 719726), стандартными способами. ДНК расщепляли EcoR 1 и подвергали электрофорезу в 0,8% плавящемся при низкой температуре агарозном препаративном геле. Вырезали кусочек геля,соответствующий фрагментам ДНК с длиной приблизительно 12 т.п.н. Агарозу расщепляли при помощи фермента Agarase (BoeringerMannheim, Inc.) и фракционированную по размеру ДНК осаждали, дефосфорилировали и лигировали с расщепленными EcoR 1 плечамиEMBL4 лямбда (Stratagene, Inc.). Библиотека лямбда была упакована с использованием упаковочного экстракта Gigpack II Gold (Stratagene, Inc.). HPV18-позитивные клоны иденти 001092HPV18 700 п.н., который получали при помощи полимеразной цепной реакции (ПЦР) с использованием ДНК SW756 в качестве матрицы и олигонуклеотидных праймеров, сконструированных на основе опубликованной последовательности ДНК L1 HPV18 (Cole and Danos,1987, J.Mol.Biol., 193: 599-608: Genbank AccessionХ 05015). Выделяли НРV18-позитивный клон лямбда, который содержал вставку фрагмента EcoR 1 12 т.п.н. и был обозначен 187-1. Пример 2. Конструирование дрожжевых экспрессирующих векторов. Открытую рамку считывания L1 HPV18(ORF) амплифицировали при помощи ПЦР с использованием клона 187-1 в качестве матрицы, Vent-polymerase (New England Biolabs,Inc.), 10 циклов амплификации (94 С, 1 мин; 50 С, 1 мин; 72 С, 2 мин) и следующих олигонуклеотидных праймеров, содержащих фланкирующие сайты BglII (подчеркнуты): смысловой праймер,5'-GAAGATCTCACAAAACAAAATGGCTTTGTGG Смысловой праймер вводит дрожжевую нетранслируемую лидерную последовательность (Kniskern, et al., 1986, Gene, Vol.46: 135141) непосредственно против хода транскрипции относительно инициирующего кодона метионина L1 HPV18 (выделенного жирным шрифтом). Продукт ПЦР L1 размером 1,5 т.п.н. расщепляли BglII и очищали на геле. Экспрессирующий вектор дрожжейpGAL1-10 конструировали путем выделения фрагмента SphI 1,4 т.п.н. из плазмидыpUC18/двунаправленный GAL промотор, который содержит дивергентные промоторы GAL1GAL10 из плазмиды рВМ 272 (предоставляемыйMark Johnston, Washington University, St.Louis,МО). Дивергентные промоторы фланкировали на каждой стороне копией терминатора транскрипции ADHI, клонирующим сайтом BamHI,расположенным между промотором GAL1 и первой копией терминатора транскрипцииADHI, и клонирующим сайтом SmaI, расположенным между промотором GAL10 и второй копией терминатора транскрипции ADHI. Дрожжевой челночный вектор, состоящий изpBR322, гена дрожжей LEU2d и 2 мкм плазмиды дрожжей (подарок от Benjamin Hall, University of Washington, Seattle, WA), расщеплялиSphI и лигировали с фрагментом дивергентного промотора GAL SphI 1,4 т.п.н. с получениемpGAL1-10. pGAL1-10 линеаризовали при помощи BamHI, разрезающей между промоторомBglII фрагмент ПЦР L1 HPV18 лигировали и использовали для трансформации клеток DH5pGAL1-10, которая содержит ген L1 HPV18 и которая была названа р 191-6. Конструировали экспрессирующий вектор дрожжей, который коэкспрессирует гены какL1, так и L2 HPV18. Плазмиду р 191-6 (pGAL110+HPV18 L1) расщепляли SmaI, которая разрезает между промотором GAL1 и терминатором транскрипции ADHI. Ген L2 HPV18 1,4 т.п.н. амплифицировали при помощи ПЦР, как описано выше, с использованием следующих олигонуклеотидных праймеров, которые содержат фланкирующие сайты SmaI (подчеркнутые): смысловой праймер,5'-TCCCCCGGGCACAAAACAAAATG Смысловой праймер вводит дрожжевую нетранслируемую лидерную последовательность (Kniskern et аl., 1986, supra) непосредственно против хода транскрипции относительно инициирующего кодона метионина (выделенного жирным шрифтом) L2 HPV18. Фрагмент ПЦР расщепляли SmaI, очищали на геле и лигировали с расщепленной SmaI плазмидой р 191-6. Была выделена плазмида pGAL1-10, содержащая гены как L1, так и L2 HPV18, которая была обозначена р 195-11. Пример 3. Типирование клинических проб. Пробы цервикальной биопсии брали в Административном медицинском центре ветеранов в Индианополисе, IN (разрешение было любезно предоставлено доктором Darron Brown) и в Медицинском центре Альберта Энштейна в Филадельфии, PA (разрешение было любезно предоставлено доктором Joan Adler) и замораживали при -20 С. ДНК выделяли, как описаноBrown et al., 1993, J. Clin.Microbiol., Vol. 31: 2667-2673). Вкратце, клинические образцы обрабатывали при помощи микро-дезинтегратора Брауна II (B.Braun Instruments, Melsungen, Germany) и солюбилизировали в буфере, содержащем 10 мМ ЭДТК и 0,6% (мас./об.) додецилсульфат натрия (ДСН). Пробы доводили до рН 7,4 20 мМ Триса и белок расщепляли 50 мкг/мл протеиназы К в присутствии 0,1 мкг/мл РНКазы А с последующей экстракцией смесью фенол/хлороформ/изоамиловый спирт. ДНК осаждали этанолом и определяли количественно при помощи спектрофотометрии. Эти пробы ДНК подвергали скринингу на присутствие HPV18 при помощи ПЦР и блотанализа по Саузерну. Сегмент 256 п.н. ORF L1HPV18 амплифицировали ПЦР с использованием следующих олигонуклеотидных праймеров: смысловой праймер,5'-CAATCCTTATATATTAAAGGCACAGGTATG-3', антисмысловой праймер, 5-CATCATATTGCCCAGGTACAGGAGACTGTG-3'. Условия ПЦР соответствовали рекомендациям изготовителя для набора AmpliTaq DNAPolymerase/GeneAmp (Perkin Elmer Corp.), за исключением того, что 0,5 мкл ДНК клинической пробы использовали в качестве матрицы и 10 пмолей каждого праймера, 2 мМ dNTP и 2,0 мМ MgCl2 присутствовали в конечной реакционной смеси. После 2 мин стадии денатурации при 94 С следовали 40 циклов амплификации(94 С, 1 мин; 45 С, 1 мин; 72 С, 1 мин). Продукты ПЦР подвергали электрофорезу в 3,0% агарозном геле, переносили блоттингом на найлоновые мембраны и гибридизовали с 32 Рмеченым специфическим для L1 HPV18 олигонуклеотидным зондом. Пример 4. Секвенирование генов L1 и L2. Гены L1 и L2 HPV18 в клонах 187-1,р 191-6 и р 195-11 секвенировали с использованием набора для секвенирования PRIZM и автоматизированного секвенатора ДНК ABI373 А (Applied Biosystems). Для получения консенсусной последовательности HPV18 участки ДНК гена L1 амплифицировали ПЦР из клинических изолятов человека, секвенировали и сравнивали с заявленными и опубликованными последовательностями. Фрагмент 256 п.н. (нуклеотиды 817-1072) амплифицировали из каждого клинического изолята для этой цели с использованием олигонуклеотидов и циклов нагревания, описанных в примере 3. Следующие праймеры,5'-GAAGATCTCACAAAACAAAATGGCTTTGTGGCGGCCTAGTG-3' и 5'-CCTAACGTCCTCAGAAACATTAGAC-3' использовали для амплификации aминoкoнцевого участка размером 432 п.н. ДНК L1(нуклеотиды 1-431) с применением циклов нагревания, описанных в примере 3. Оба продукта ПЦР лигировали раздельно с плазмидой pCRII(Invitrogen Corp.) с использованием реагентов и процедур,рекомендуемых изготовителем. Плазмидную ДНК выделяли из трансформантов и секвенировали ту, которая содержала вставкиEcoRI. Пример 5. Анализ ДНК и выведенные аминокислотные последовательности. Нуклеотидная и выведенная аминокислотная (аа) последовательности L1 HPV18 показаны на фиг. 1. Последовательность ДНК получали из консенсусных клонов 187-1, р 191-6 и р 195-11. Сравнение заявленной нуклеотидной последовательности L1 HPV18 с опубликованной последовательностью L1 HPV18 (GenbankAccessionХ 05015) обнаружило 20 измененных п.н. из 1524 п.н. Пять нуклеотидных изменений (С на G в положении 89, С на А в положении 263, С на G в положении 848, G на А в положении 967 и С на G в положении 1013) приводят к аминокислотным заменам. Пять измененных остатков, отличающихся от опубликованных, таковы: Р заменен на R в положениях 30, 283 и 338, Т заменен на N в положении 88 иV заменен на I в положении 323 (фиг. 2). В по 17 ложениях 88 и 323 замены консервативные, тогда как три замены Р на R могут существенно изменять физические свойства экспрессируемого белка L1. Сравнение аминокислотных последовательностей, полученных из клинических изолятов (номера 354, 556, 755, 695, 795 и 23), с заявленной последовательностью и опубликованной последовательностью показано на фиг. 2. Существуют четыре положения, по которым клинические изоляты и заявленная последовательность отличаются от опубликованной последовательности. Нуклеотиды в положениях 30, 283 и 338 кодируют аргинин (R) во всех обнаруженных до настоящего времени изолятах, в том числе в заявленной последовательности. Это резко противоречит данным об опубликованной последовательности, у которой в каждом из указанных положений находится пролин (Р). Кроме того, в положении 88 изолятов и заявленной последовательности находится аспарагин (N),но в опубликованной последовательности в этом положении находится треонин (T). Последнее различие заключается в том,что в положении 323 находится валин (V) (многие клинические изоляты и опубликованная последовательность), тогда как в заявленной последовательности и одном из изолятов ( 23) в указанном положении находится изолейцин (I). Можно сделать вывод, что заявленная последовательность соответствует преобладающим последовательностям вирусов, которые ассоциированы с клиническими инфекциями, и отсутствие изолятов, содержащих остатки пролина в положениях 30, 283 и 338, как в опубликованной последовательности, предполагает, что опубликованная последовательность является либо артефактом, либо неконсенсусным подтипом. Нуклеотидную и выведенную аминокислотную последовательности L2 HPV18 получали на основе консенсусной последовательности клонов 187-1 и р 195-11, и они показаны на фиг. 3. Сравнение нуклеотидной последовательности L2 с опубликованной последовательностью HPV18 (Genbank AccessionХ 05015) обнаружило 40 измененных п.н. из 1389 п.н. Различия в п.н. приводят к 14 заменам на уровне аминокислот: Р на S в положении 29, Р на N в положении 33, А на S в положении 177, D на Е в положении 266, D на N в положении 270, D на G в положении 346, М на I в положении 355, V на М в положении 359, S на Р в положении 365, F на S в положении 369, F на V в положении 371,F на S в положении 372, К на Т в положении 373 и S на Р в положении 409. Пример 6. Получение антисыворотки против L2 HPV18. Специфические в отношении L2 HPV18 антитела получали в козах с использованием слитого белка trpE-HPV18 L1, экспрессируемого в E.coli. ORF полноразмерного L2 18 амплифицировали ПЦР с применением олигонуклеотидных праймеров, обеспечивающих сайты HindIII и BamHI, фланкирующие 5'- и 3'концы соответственно. Фрагмент L2 встраивали в расщепленную HindIII-BamHI экспрессионную плазмиду рАТН 23 (Koerner et al., 1991,Meth.Enzymol. Vol. 194: 477-490). Слитый белок экспрессировался в клетках RR1 E.coli (GibcoBRL, Inc.) после индукции 3 индолакриловой кислотой. Нерастворимую фракцию анализировали электрофорезом в ПААГ-ДСН окрашиванием Кумасси синим. Слитый белок trpE-L2 составлял большую часть нерастворимой фракции E.coli. Коз иммунизировали слитым белкомtrpE-L2 в соответствии со стандартным протоколом Pocono Rabbit Farm and Laboratory, Inc. для представляющих слитые белки антигенов(Protein Rabbit Farm, Canadensis, PA). Пример 7. Получение штамма U9 дрожжей. Штамм 2150-2-3 (МА Talpha, leu2-04, adel,cir) Saccharomyces cerevisiae был получен от др.Leland Hartwell (University of Washington, Seattle, WA). Клетки штамма 2150-2-3 размножали в течение ночи при 30 С в 5 мл среды YEHD(Carty et al., J.Ind.Micro 2 (1987) 117-121). Клетки промывали 3 раза в стерильной дистиллированной воде, ресуспендировали в 2 мл стерильной дистиллированной воды и 0,1 мл клеточной суспензии высевали на каждую из шести чашек с 5-фтороротовой кислотой (FOA) для отбора на мутанты ura3 (Cold Spring Harbor LaboratoryManual for Yeast Genetics). Чашки инкубировали при 30 С. Среда содержала на 250 мл дистиллированной воды: 3,5 г азотистого основания дрожжей Difco без аминокислот и сульфата аммония; 0,5 г 5-фтороротовой кислоты; 25 мг урацила и 10,0 декстрозы. Среду стерилизовали фильтрованием через мембраны 0,2 мкм и затем смешивали с 250 мл 4% бактоагара (Difco), поддерживаемого при 50 С, 10 мл раствора аденина 1/2 мг/мл и 5 мл раствора L-лейцина (180 мг/50 мл). Полученную среду распределяли по 20 мл на чашку Петри. После 5 дней инкубирования появились многочисленные колонии. Отдельные колонии выделяли путем повторного посева штрихом из исходных чашек с FOA на свежие чашки с FOA,которые затем инкубировали при 30 С. Ряд колоний из второй серии чашек с FOA тестировали на присутствие мутации ura3 при помощи посева методом реплик (отпечатков) как на чашки со средой YEHD, так и на урацил-минус чашки. Желательным результатом был хороший рост на YEHD и отсутствие роста на урацилминус среде. Был получен один изолят (U9),который обнаружил эти свойства. Его хранили в виде замороженного раствора в глицерине 19 Пример 8. Получение вектора для разрыва гена MNN9 дрожжей. Для получения вектора для разрыва генаMNN9 необходимо было сначала клонировать ген МNN9 из геномной ДНК S.cerevisiae. Это достигалось при помощи стандартной технологии полимеразной цепной реакции (ПЦР). 5'смысловой праймер и 3'-антисмысловой праймер для ПЦР полноразмерной кодирующей последовательности MNN9 конструировали на основе опубликованной последовательности для гена дрожжей MNN9 (Zymogenetics: ЕРО PatentApplication88117834.7, Publication0314096-A2). Использовали следующие олигодезоксинуклеотидные праймеры, содержащие фланкирующие сайты HindIII (подчеркнутые): смысловой праймер: 5'-СТТ AAA GCT TAT GTC ACT ТТС ТСТ TGT АТС Инициирующий кодон метионина для генаMNN9 выделен жирными буквами. ПЦР проводили с использованием геномной ДНК из штамма JRY188 S.cerevisiae в качестве матрицы,ДНК-полимеразы Taq (Perkin Elmer) и 25 циклов амплификации (94 С, 1 мин; 37 С, 2 мин; 72 С,3 мин). Полученный ПЦР фрагмент 1,2 т.п.н. расщепляли HindIII, очищали на геле и лигировали с расщепленной HindIII, обработанной щелочной фосфатазой, плазмидой pUC13 (Pharmacia). Полученная плазмида была названа р 1183. Для разрыва гена MNN9 геном дрожжейHindIIIpBR322) расщепляли HindIII и фрагмент ДНК 1,1 т.п.н. очищали на геле, концы затупляли ДНК-полимеразой Т 4 и затем лигировали этот фрагмент в расщеплением PmII плазмидой р 1183 (PmII разрезает внутри кодирующей последовательности MNN9). Полученная плазмида р 1199 содержит разрыв гена MNN9 функциональным геном URA3. Пример 9. КонструированиеU9 производного штамма 1372, содержащего разрыв гена MNN9. Для разрыва гена MNN9 в штамме U9 ( 325) плазмиды р 1199 расщепляли HindIII для создания линейной кассеты с разрывомmnn9URA3. Клетки штамма 325 трансформировали расщепленной HindIII ДНК р 1199 при помощи сферопластного метода (Hinnen et al.,1978, Proc.Natl.Acad.Sci. USA 75: 1929-1933) и трансформанты отбирали на синтетической среде с агаром без урацила, содержащей 1,0 М сорбит. Синтетическая среда содержала на литр дистиллированной воды: агар, 20 г; азотистое основание дрожжей без аминокислот, 6,7 г; аденин, 0,04 г; L-тирозин, 0,05 г; сорбит, 182 г; глюкозу, 20 г; лейцин-минус раствор 2, 10 20 мл. Лейцин-минус раствор 2 содержит на литр дистиллированной воды: L-аргинин, 2 г; Lгистидин, 1 г; L-лейцин, 6 г; L-изолейцин, 6 г;L-лизин, 4 г; L-метионин, 1 г; L-фенилаланин, 6 г; L-треонин, 6 г; L-триптофан, 4 г. Чашки инкубировали при 30 С в течение 5 дней, когда появились многочисленные колонии. Препараты хромосомной ДНК получали из 10 колоний и затем расщепляли EcoRI плюсHindIII. Расщепленный ДНК-продукт оценивали при помощи блотов по Саузерну (J.Sambrook etedition, Cold Spring Harbor Laboratory Press,1989) с использованием фрагмента HindIII 1,2 т.п.н., несущего ген MNN9 (выделенный из плазмиды р 1199), в качестве зонда. Идентифицировали изолят (штамм 1372), который обнаруживал ожидаемые смещения полос ДНК на блоте по Саузерну, а также чрезвычайную агрегацию, обычно обнаруживаемую мутантамиmnn9. Пример 10. Конструирование вектора для разрыва гена HIS3 дрожжей. Для конструирования кассеты с разрывом,в которой ген HIS3 S.cerevisiae разорван геномBamHI и фрагмент BamHI 1,7 т.п.н., несущий ген HIS3, очищали на геле, концы его затупляли ДНК-полимеразой Т 4 и лигировали этот фрагмент с pUC18, которую предварительно расщепляли BamHI и обрабатывали ДНК-полимеразой Т 4. Полученную плазмиду (названную р 1501 или pUC18-HIS3) расщепляли NheI (которая разрезает в кодирующей последовательностиHIS3) и фрагмент вектора очищали на геле,концы затупляли ДНК-полимеразой Т 4 и затем фрагмент обрабатывали щелочной фосфатазой кишечника теленка. Ген URA3 выделяли из плазмиды pBR322-URA3 расщеплением HindIII и фрагмент 1,1 т.п.н., несущий ген URA3, очищали на геле, концы затупляли ДНКполимеразой Т 4 и лигировали фрагмент с описанным выше фрагментом NheIpUC18-HIS3. Полученная плазмидаpUC18His3URA3 или р 1505) содержит кассету с разрывом, в которой ген дрожжей HIS3 разорван функциональным геном URA3. Пример 11. Конструирование вектора для разрыва гена PRB1 геном HIS3. Плазмиду FР 8 Н, несущую ген PRB1S.cerevisiae, получали от др. E.Jones CarnegieMellon Univ. (C.M.Moehle et al.,1987, Genetics,115: 255-263). Ее расщепляли HindIII плюс XhoI и фрагмент ДНК 3,2, т.п.н., несущий ген PRB1,очищали на геле, концы затупляли обработкой ДНК-полимеразой Т 4. Плазмиду pUC18 расщепляли BamHI, очищали на геле и затупляли концы обработкой ДНК-полимеразой Т 4. Полученный векторный фрагмент лигировали с указанным выше фрагментом гена PRB1 с получением плазмиды pUC18-PRB1. Плазмиду Yep6, 21 которая содержит ген HIS3, расщеплялиBAMHI. Полученный фрагмент BamHI 1,7 т.п.н., несущий функциональный ген HIS3,очищали на геле и затем затупляли его концы при помощи ДНК-полимеразы Т 4. ПлазмидуpUC18-PRB1 расщепляли EcoRV плюс NcoI,которые разрезают в кодирующей последовательности PRB1 и удаляют активный сайт протеазы В и фланкирующую последовательность. Фрагмент EcoRV-NcoI 5,7 т.п.н., несущий оставшиеся 5'- и 3'-части кодирующей последовательности PRB1 в pUC18, очищали на геле,концы затупляли обработкой ДНК-полимеразы Т 4, дефосфорилировали фрагмент щелочной фосфатазой кишечника теленка и лигировали с имеющим тупые концы фрагментом HIS3, описанным выше. Полученная плазмида (названнаяpUC18HIS3, группа (штамм)1245 содержит функциональный ген HIS3 вместо части гена PRB1, которая была делетирована, как описано выше. Пример 12. Конструирование родственного U9 штамма дрожжей, содержащего разрывы генов MNN9 и PRB1. Родственный U9 штамм 1372, который содержит разрыв гена MNN9, был описан в примере 9. Клональные изоляты штамма 1372 пассировали на чашках с FOA (как описано в примере 7) для отбора мутантов ura3. Получали ряд изолятов ura3 штамма 1372 и один конкретный изолят (штамм 12930-190-S1-1) был отобран для последующего разрыва гена HIS3. Вектор с разрывом гена pUC18URA3 (p1505) расщеплялиXbaI плюс EcoRI с образованием линейной кассеты с разрывом his3URA3 и использовали ее для трансформации штамма 12930-190-S1-1 по методу с ацетатом лития (Methods in Enzymology, 194: 290 (1991). URA+-трансформанты отбирали на синтетической среде с агаром, не содержащей урацила, пересевали методом штриха для получения клональных изолятов на той же самой среде и затем высевали методом реплик на среду, не содержащую ни урацила, ни гистидина, для скрининга тех изолятов, которые были как Ura+, так и His-. Один изолят (штамм 12930230-1) был отобран для последующего разрыва гена РRВ 1. Вектор с разрывом гена PRB1(pUC18-prblHIS3, группа (штамм)1245 расщепляли SI плюс XbaI для образования линейной кассеты с разрывом prblHIS3 и использовали ее для трансформации штамма 12930230-1 по методу с ацетатом лития. His+трансформанты отбирали на среде с агаром, не содержащей гистидина, и пересевали штрихом на ту же самую среду для получения клональных изолятов. Геномную ДНК получали из ряда полученных His+-изолятов, расщепляли ееEcoRI и затем подвергали электрофорезу на 0,8% агарозных гелях. Затем проводили блоттинг по Саузерну с использованием радиоактивно меченого зонда 617 п. к. для гена PRB1, 001092 22 который был получен с применением следующих олигодезоксинуклеотидных праймеров: 5' TGG ТСА ТСС САА АТС TTG ААА 3' 5' САС CGT AGT GTT TGG AAG CGA 3' Получали 11 изолятов, которые обнаруживали ожидаемую гибридизацию зонда с фрагментом ДНК 2,44 т.п.н. prblHIS3. В противоположность этому, не было гибридизации этого зонда с фрагментом 1,59 т.п.н. для гена PRB1 дикого типа. Один из этих изолятов, содержащий желаемый разрыв prblHIS3, был отобран для дальнейшего использования и назван штаммом 1558. Пример 13. Экспрессия L1 и L2 HPV18 в дрожжах. Плазмиды р 191-6 (pGAL1-10+HPV18 L1) и р 195-11 (pGAL1-10+HPV18 L1+L2) использовали для трансформации штамма 1558(МАТа,leu2-04,prbHIS3,mnn9URA3, adel, cir). Клональные изоляты выращивали при 30 С в среде YEHD, содержащей 2% галактозу, в течение 88 ч. После сбора клеток осадки клеток разбивали стеклянными гранулами и клеточные лизаты анализировали на экспрессию белка L1 HPV18 и/или белка L2HPV18 при помощи иммуноблоттинга. Пробы,содержащие 25 мкг общего клеточного белка,подвергали электрофорезу на 10% трисглициновых гелях (Novex, Inc.) при денатурирующих условиях и переносили электроблоттингом на нитроцеллюлозные фильтры. БелокL1 иммунодетектировали с использованием кроличьей антисыворотки, образованной против слитого белка trpE-HPV18 L1 в качестве первичного антитела (Brown et al., 1994, Virology 201: 46-54) и связанного с пероксидазой хрена(HRP) ослиного антикроличьего IgG (Amersham, Inc.) в качестве второго антитела. Фильтры обрабатывали с использованием хемилюминесцентного набора для детектирования ECL(Amersham, Inc.). Полосу L1 50-55 кДа обнаружили как в экспрессирующем L1, так и в экспрессирующем L1+L2 клонах дрожжей (штаммах 1725 и 1727 соответственно), но не в негативном контроле (pGAL1-10 без генов L1 илиL2) (фиг. 4). Белок L2 HPV18 детектировали Вестернанализом с использованием козьей поликлональной антисыворотки, образованной против слитного белка treE-HPV18 L2, в качестве первичного антитела,и затем(штамма 1725) и L1+L2 HPV18 (штамма 1727). Поверхностную культуру на чашках штаммов 1725 и 1727 асептически переносили 23 на не содержащую лейцина среду, содержащую(на л): 8,5 г Difco дрожжевого азотистого основания без аминокислот и сульфата аммония; 0,2 г аденина; 0,2 г урацила; 10 г янтарной кислоты; 5 г сульфата аммония; 40 г глюкозы; 0,25 г Lтирозина; 0,1 г L-аргинина; 0,3 г L-изолейцина; 0,05 г L-метионина; 0,2 г L-триптофана; 0,05 гL-гистидина; 0,2 г L-лизина; 0,3 г Lфенилаланина; эту среду доводили до рН 5,0-5,3NaOH перед стерилизацией. После роста в течение 25 ч при 28 С, при 250 об/мин на ротационном шейкере готовили флаконы с замороженной культурой путем добавления стерильного глицерина до конечной концентрации 17% (м/об.) перед хранением при -70 С (1 мл на криофлакон). Инокуляты получали в той же самой среде(500 мл 2-литровую колбу) и заквашивали перенесением оттаянного содержимого замороженного культурального флакона и инкубированием при 28 С, при 250 об/мин на ротационном шейкере в течение 29 ч. Для ферментации каждого штамма использовали ферментер NewCarbide UCON LB-625; среду доводили до рН 5,3 перед стерилизацией. Все содержимое (500 мл) 2-литровой колбы с инокулятом переносили в ферментер, который инкубировали при 28 С, 5 л воздуха в минуту, 400 об/мин, давлении 3,5 psi(24131,6 Па). Перемешивание увеличивали по необходимости для поддержания уровней растворенного кислорода более 40% от насыщения. Развитие ферментации подвергали мониторингу посредством автономных измерений глюкозы(Beckman Glucose 2 Analyzer) и неавтономной масс-спектрометрии (Per kin-Elmer 1200). После 66 ч инкубации плотности клеток достигали 9,59,7 г сухого веса клеток на л. Культуры концентрировали при помощи фильтрования через полые волокна (Amicon H5MP01-43 kartridge в системе фильтрования Amicon DC-10) до приблизительно 2 л, диафильтровали с 2 л забуференного фосфатом солевого раствора и концентрировали далее (приблизительно до 1 л) перед разливом в 500-миллилитрoвые центрифужные склянки. Осадки клеток собирали центрифугированием при 8000 об/мин (ротор Sorval GS3) в течение 20 мин при 4 С. После декантации супернатанта осадки (всего 191-208 г сырых клеток) хранили при -70 С до использования. Пример 15. Очистка рекомбинантных капсидных белков LI HPV18. Все стадии проводили при 4 С, если нет других указаний. Клетки хранили в замороженном виде при 24 аз ПМСФ и пепстатин А добавляли до конечных концентраций 2 мМ и 1,7 мкМ соответственно. Суспензию клеток разрушали при давлении приблизительно 16000 psi (11031611 Па) посредством трех проходов в микрофлюидизатореM110 (Microfluidics Corp., Newton, МА). Разрушенную клеточную суспензию центрифугировали при 12000g в течение 40 мин для удаления клеточного дебриса (остатков клеток). Супернатант, содержащий антиген L1, извлекали. Жидкий супернатант разводили 1:5 добавлением Буфера А (20 мМ MOPS, рН 7,0) и наносили на анионообменную улавливающую колонку (9,0 см внутр. диаметр 3,9 см) со смолойFractogelR EMD ТМАЕ-650 (М) (ЕМ Separations,Gibbstown, NJ), уравновешенную в Буфере А. После промывания Буфером А антиген элюировали градиентом 0-1,0 М NaCl в Буфере А. Фракции колонки анализировали на общий белок методом Бредфорда. Затем фракции анализировали при равных нагрузках белка Вестернблоттингом и электрофорезом в ПААГ-ДСН с окрашиванием серебром. ТМАЕ-фракции, обнаруживающие сравнимые чистоту и обогащение белка L1, объединяли. Антиген концентрировали фракционированием при помощи сульфата аммония. Раствор доводили до 35% насыщения путем добавления твердого сульфата аммония при осторожном перемешивании в течение более 10 мин. Пробу помещали на лед и давали образоваться осадку в течение 4 ч. Пробу центрифугировали при 16000g в течение 45 мин. Осадок ресуспендировали в 20,0 мл PBS (забуференного фосфатом солевого раствора) (6,25 мМ фосфата Na, pH 7,2, 150 мМ NaCl). Ресуспендированный осадок хроматографировали на гель-фильтрационной колонке (2,6 см внутр. диаметр 89 см) со смолой Sephacryl 500 HR (Pharmacia, Piscataway, NJ). Подвижным буфером был PBS. Фракции анализировали Вестерн-блоттингом и электрофорезом в ПААГДСН с окрашиванием серебром. Самые чистые фракции объединяли. Полученный пул концентрировали в перемешиваемой ячейке на 50 мл с использованием плоскослойных мембран 43 ммYM-100 (Amicon, Beverly, MA) при давлении N2 4-6 psi (27579-41369 Па). Конечный продукт анализировали Вестерн-блоттингом и электрофорезом в ПААГДСН с окрашиванием коллоидным Кумасси. Белок L1 обнаружил 50-60% гомогенность. Идентичность белка L1 подтверждали Вестернблоттингом. Конечный продукт разделяли на аликвоты и хранили при -70 С. Этот процесс дал в целом 12,5 мг белка. Метод Бредфорда для общего белка Общий белок определяли с применением коммерчески доступного набора CoomassiePlusR kit (Pierce, Rockford, IL). Пробы разводили до подходящих уровней в Milli-Q-H20. Для 25 стандартного протокола и протокола микротеста требовались объемы 0,1 мл и 1,0 мл соответственно. Для обоих протоколов для получения стандартной кривой использовали БСА (Pierce,Rockford, IL). Определение проводили в соответствии с рекомендациями изготовителя. Стандартные кривые строили с применением программного обеспечения CricketGraphR на компьютере Macintosh IIci. Электрофорез в полиакриламидном геле с додецилсульфатом натрия (ПААГ-ДСН) и Вестерн-блоттинг Все гели, буферы и прибор для электрофореза были получены из Novex (San Diego, CA) и электрофорез проводили в соответствии с рекомендациями изготовителя. Вкратце, пробы разводили до равной концентрации белка в Milli-QH2O и смешивали 1:1 с буфером для инкубирования пробы, содержащим 200 мМ ДТТ. Пробы инкубировали 15 мин при 100 С и наносили на предварительно залитые 12% трис-глициновые гели. Пробы подвергали электрофорезу при 125 В в течение 1 ч 45 мин. Гели проявляли с применением либо окрашивания серебром по вариации метода Neukeshoven and Dernick [Electrophoresis, 6 (1985) 1030112], либо окрашивания коллоидным Кумасси с использованием коммерчески полученного набора (IntegratedSeparation System, Natick, MA). Для Вестерн-блотов белки переносили на ПВДФ-мембраны при 25 В в течение 40 мин. Мембраны промывали Milli-Q-Н 2 О и сушили на воздухе. Первичным антителом была поликлональная кроличья антисыворотка, полученная против слитого белка trpE-HPV11 L1 (подарок доктора D.Brown). Предварительные эксперименты показали, что эта антисыворотка перекрестно реагирует с L1 HPV18 на Вестернблотах. Раствор антител готовили разведением антисыворoтки в буфере для блоттинга (5% обезжиренное молоко в 6,25 мМ фосфате Na, pH 7,2, 150 мМ NaCl, 0,02% NaN3). Инкубирование проводили в течение, по меньшей мере, 1 ч при 20-23 С. Блот промывали в течение 1 мин каждый раз в трех сменах ПБС (6,25 мМ фосфат Na,pH 7,2, 150 мМ NaCl). Раствор вторых антител готовили разведением конъюгированной антисыворотки козьего антикроличьего IgG, связанного со щелочной фосфатазой (Pierce, Rockford,IL) в буфере для блоттинга. Инкубирование проводили при тех же условиях в течение, по меньшей мере, 1 ч. Блоты промывали, как описано выше, и детектировали с применением одностадийного субстрата NBT/BCIP (Pierce,Rockford, IL). Пример 16. Электронно-микроскопические исследования. Для электронно-микроскопического анализа (ЭМ) (Structure Probe, West Chester, PA) аликвоту каждой пробы помещали на медную сетку с угольной пленкой 200 меш. Каплю 2% фосфовольфрамовой кислоты (РТА), рН 7,0, 001092 26 помещали на сетку на 20 с. Сеткам давали высохнуть на воздухе перед исследованием при помощи трансмиссионной (просвечивающей) электронной микроскопии (ТЕМ). Вся микроскопия была выполнена с использованием JEOL 100CX трансмиссионного электронного микроскопа (JEOL USA, Inc.) при ускоряющем напряжении 100 кВ. Полученные микрофотографии имеют конечное увеличение 100000 Х. Вирусоподобные частицы (VLP) наблюдали в диапазоне размеров диаметра 50-55 нм во всех пробах дрожжей, несущих LI HPV18 экспрессирующую плазмиду (фиг. 6). В пробах контрольных дрожжей не наблюдали VLP. Пример 17. Субклонирование кДНКHPV18 в экспрессирующие векторы. Кодирующую HPV18 кДНК субклонируют в несколько векторов для экспрессии белкаHPV18 в трансфицированных клетках-хозяевах и для транскрипции/трансляции in vitro. Эти векторы включают pBluescript II SK+n (где экспрессия запускается промоторами Т 7 или Т 3),pcDNA I/Amp (где экспрессия инициируется промотором цитомегаловируса(CMV,pSZ9016-1 (где экспрессия инициируется промотором длинного концевого повтора (LTR)HIV (ВИЧ и бакуловирусным трансфицирующим вектором pAcUW51 (PharMingen, Inc.) (где экспрессия инициируется промотором полиэдрина (РН для получения рекомбинантного бакуловируса, содержащего последовательность ДНК, кодирующую HPV 18.a) pBluescript II SK+:HPV18. Клон кДНК полноразмерного HPV18 получают из бактериофага лямбда ограниченным расщеплениемEco RI и лигированием в разрезанную Eco RI,обработанную CIP pBluescript II SK+. Извлекали отдельные субклоны, в которых смысловая ориентация HPV18 сопровождалась либо промотором Т 7, либо промотором Т 3.b) pcDNA I/Amp:HPV18. Для облегчения направленного клонирования HPV18 вырезают из очищенного плазмидного препаратаpBluescript II SK+:HPV18, в котором ДНКпоследовательность HPV18 находится по ходу транскрипции от промотора Т 7, при помощиI/Amp, так что кодирующая HPV18 ДНК находится по ходу транскрипции от промотораpBluescript II SK+:HPV18 ограниченным расщеплением Eco RI и последующей очисткой фрагмента 1,3 т.п.н. из агарозных гелей. Полученный фрагмент Eco RI HPV18 лигируют в разрезанную Eco RI, обработанную CIP pSZ9016-1. Отбирают субклоны, в которых смысловая ориентация HPV18 находится по ходу транскрипции от промотора LTR HIV.d) pAcUW51:HPV18 L1. ORF полноразмерного L1 HPV18 амплифицировали ПЦР из клона 187-1 с использованием олигонуклеотидных праймеров, обеспечивающих фланкирующие сайты BglII. Ген L1 встраивали в сайт BamHI бакуловирусного трансферного вектора, pAcUW51 (PharMingen, Inc.), под контролем промотора полиэдрина. Рекомбинантные бакуловирусы, содержащие экспрессионную кассету L1 HPV18, получали в соответствии со способами, описанными в Pharmingen Manual. Рекомбинантные клоны очищали путем серийного разведения и дот-блот-гибридизации. Пример 18. Экспрессия полипептидаHPV18 транскрипцией/трансляцией in vitro и трансфекцией в клетки-хозяева. Векторы, содержащие ДНК-последовательности HPV, используют для проведения трансляции полипептида HPV18 в лизатах ретикулоцитов кролика, клетках-хозяевах млекопитающего и в инфицированных бакуловирусом клетках насекомых. Экспериментальные процедуры, в основном, соответствуют описанным в инструкциях изготовителя. а) In vitro транскрипция/трансляция. Плазмидную ДНК pBluescript III SK+:HPV18 (сHPV18 в Т 7 ориентации) линеаризуют расщеплением Ват HI по ходу транскрипции от вставкиHPV18. Линеаризованную плазмиду очищают и используют в качестве матрицы для проведения транскрипции РНК-полимеразой Т 7 в присутствии m7G(5')ррр(5')G. Полученные кэпированные транскрипты HPV18 очищают осаждением LiCl и используют для запуска трансляции HPV18 в предобработанном нуклеазой лизате ретикулоцитов кролика в присутствии L-[35S]метионина.b) Экспрессия в клетках млекопитающего. Белок HPV экспрессируют в клетках-хозяевах млекопитающего после трансфекции либо(pSZ9016-1:HPV18) клетки ко-трансфицируют экспресирующей ТАТ плазмидой pSZ90161:ТАТ. Для обеих экспрессирующих HPV18 плазмид клетки COS-7 трансфицируют с применением либо ДЭАЭ-декстрана, либо липофекции липофектамином (BRL).c) Экспрессия в клетках насекомых. Содержащий L1 HPV18 бакуловирусный трансфицирующий вектор pAcUW51:HPV18 L1 используют для получения рекомбинантного бакуловируса (Autoqrapha californica) гомологочной рекомбинацией in vivo. Затем HPV18 с меченым эпитопом экспрессируют в клетках насекомогоHPV18, можно детектировать различными спо 001092(a) смешивание испытуемого соединения с раствором, содержащим HPV18, с образованием смеси;HPV18, могут быть использованы для приготовления фармацевтических композиций. Такие фармацевтические композиции могут быть использованы для лечения заболеваний или состояний,характеризующихся инфекциейHPV18. Пример 20. ДНК, которая структурно родственна ДНК,кодирующей HPV 18, обнаруживают при помощи зонда. Пригодный для этого зонд может быть получен на основе ДHK, имеющей полную нуклеотидную последовательность, приведенную на фиг. 1 или 3, или ее часть, РНК, кодируемой ДНК, имеющей всю нуклеотидную последовательность, указанную на фиг. 1 или фиг. 3, или ее часть, или вырожденных олигонуклеотидов, сконструированных на основе части последовательности, указанной на фиг. 1 или 3. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Выделенная последовательность ДНК,кодирующая капсидный белок L1 папилломавируса человека типа 18, имеющего следующую структуру: 2. Выделенная последовательность ДНК,кодирующая капсидный белок L2 папилломавируса человека типа 18, имеющего следующую структуру: 3. Вектор для экспрессии последовательностей ДНК по пп.1 и 2 формулы в клеткаххозяевах, сконструированный на основе дрожжевого челночного вектора, включающегоpBR322, ген дрожжей LEU2d и 2-плазмиду дрожжей, и содержащий SpHI-фрагмент размером 1,4 т.п.о. из плазмиды pUC18, в состав которого входят следующие конструктивные элементы:GAL1-GAL10 из плазмиды рВМ 272, которые фланкированы с каждой стороны копией терминатора транскрипции АDHI;- BamHI-клонирующий сайт, расположенный между промотором GAL1 и первой копией терминатора транскрипции ADHI, и- SmaI-клонирующий сайт, расположенный между промотором GAL10 и второй копией терминатора транскрипции ADHI. 4. Вектор экспрессии по п.3, отличающийся тем, что представляет собой вектор р 191-6,содержащий последовательность ДНК по п.1 формулы, встроенную в BamHI-клонирующий сайт. 5. Вектор экспрессии по п.3, отличающийся тем, что представляет собой вектор р 195-11,содержащий последовательность ДНК по п.1 формулы, встроенную в BamHI-клонирующий сайт, и последовательность ДНК по п.2 формулы, встроенную в SmaI-клонирующий сайт. 6. Способ получения вирусоподобных частиц папилломавируса человека типа 18, заключающийся в том, что осуществляют следующие стадии:- трансформируют клетки дрожжей вектором экспрессии по любому из пп.3-5 формулы;- культивируют трансформированные клетки в условиях, обеспечивающих экспрессию последовательности ДНК, кодирующих белок L1 и белки L1+L2 папилломавируса человека типа 18; и- выделяют вирусоподобные частицы, которые спонтанно формируются в клетке после экспрессии в ней указанных белков. 31 7. Способ индуцирования иммунного ответа на папилломавирусы у млекопитающего, отличающийся тем, что млекопитающему вводят 32 вирусоподобные частицы, полученные в соответствии со способом по п.6.
МПК / Метки
МПК: A61P 31/12, C07K 14/025, C12N 15/37, A61K 39/12
Метки: частиц, днк, капсидные, ответа, индуцирования, экспресси, вирусоподобных, выделенные, последовательности, белки, способ, иммунного, типа, папилломавируса, кодирующие, вектор, последовательностей, получения, человека
Код ссылки
<a href="https://eas.patents.su/18-1092-vydelennye-posledovatelnosti-dnk-kodiruyushhie-kapsidnye-belki-l1-i-l2-papillomavirusa-cheloveka-tipa-18-vektor-dlya-ekspressi-posledovatelnostejj-dnk-sposob-polucheniya-virusopodo.html" rel="bookmark" title="База патентов Евразийского Союза">Выделенные последовательности днк, кодирующие капсидные белки l1 и l2 папилломавируса человека типа 18, вектор для экспресси последовательностей днк, способ получения вирусоподобных частиц и способ индуцирования иммунного ответа</a>