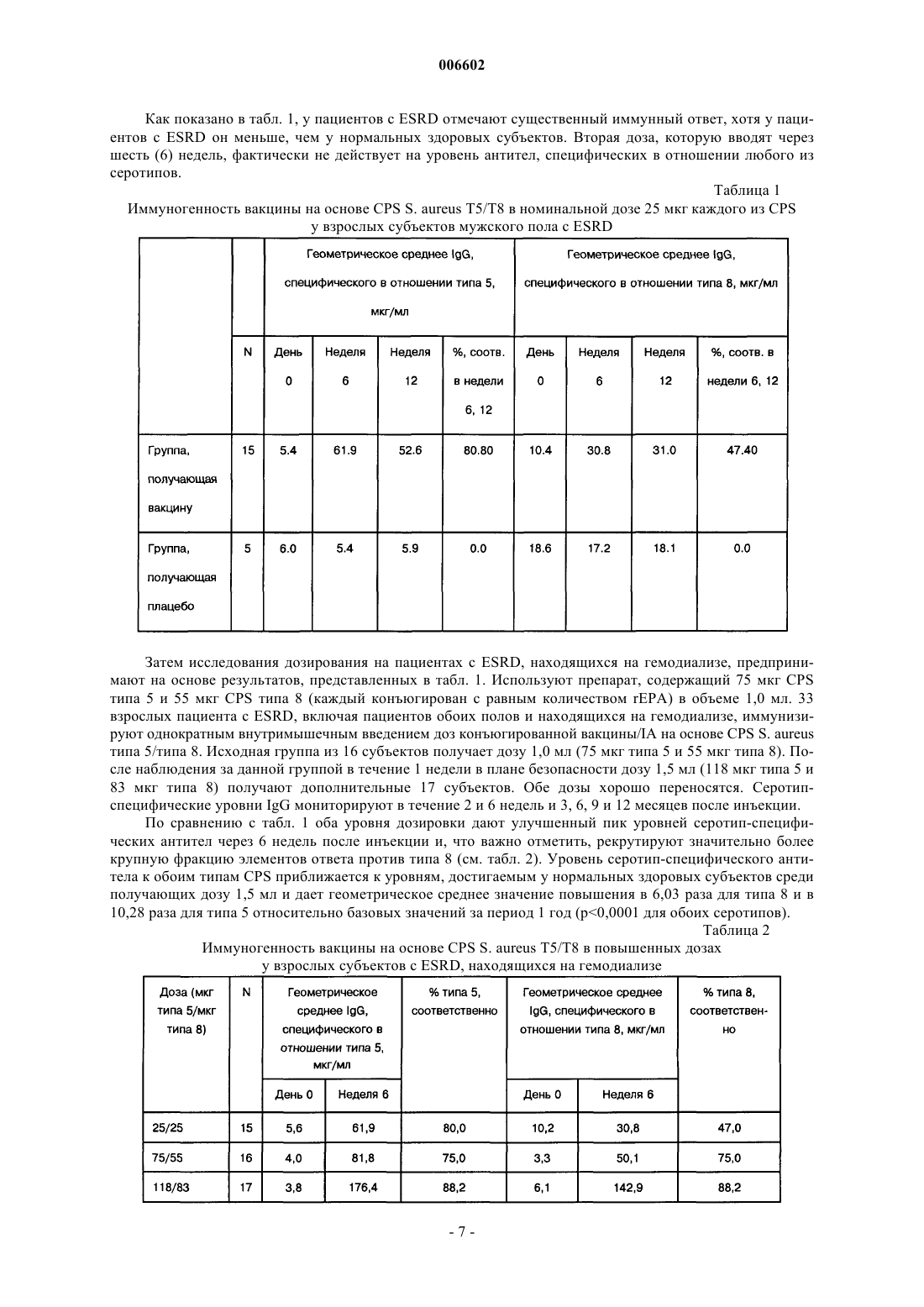
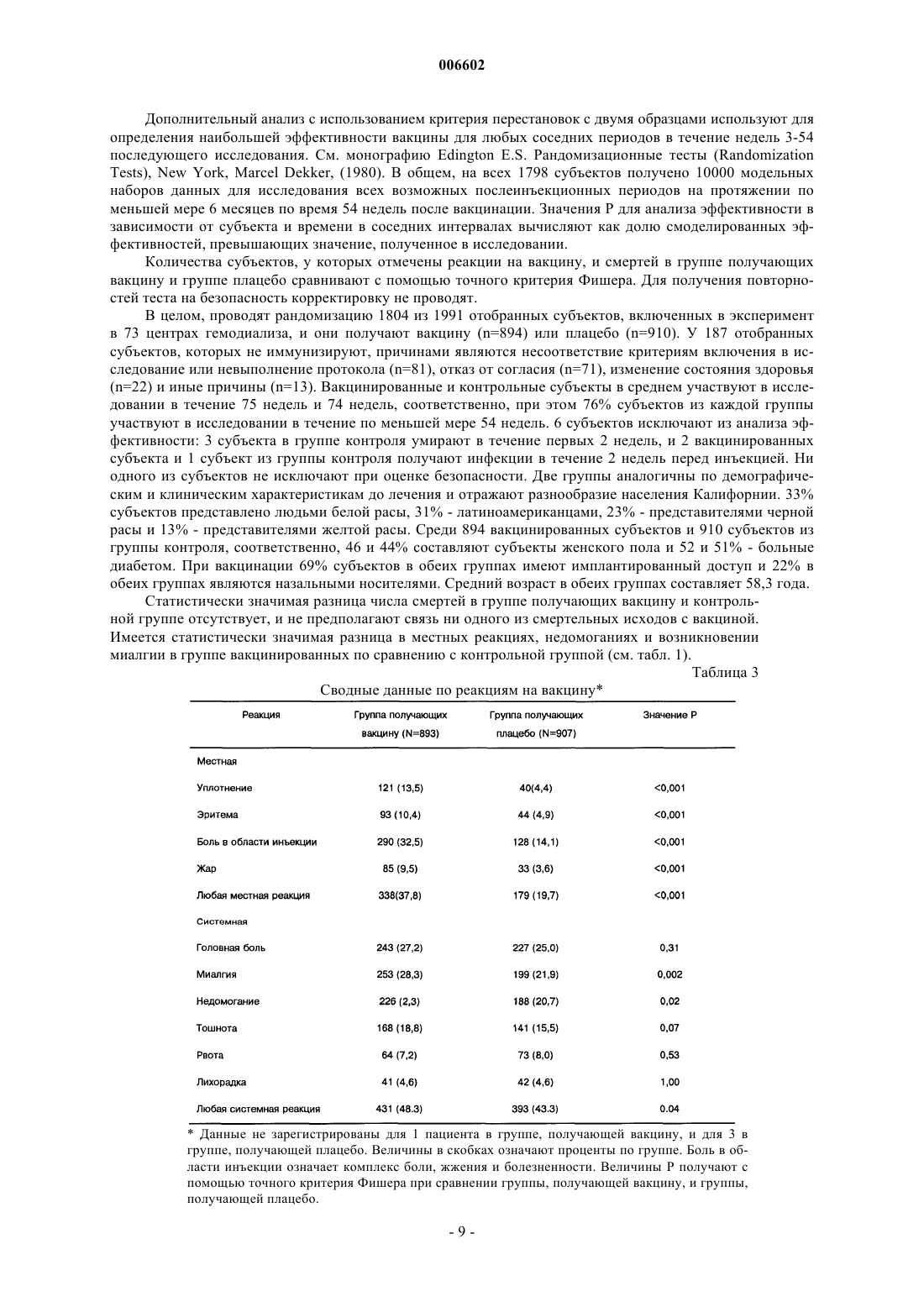
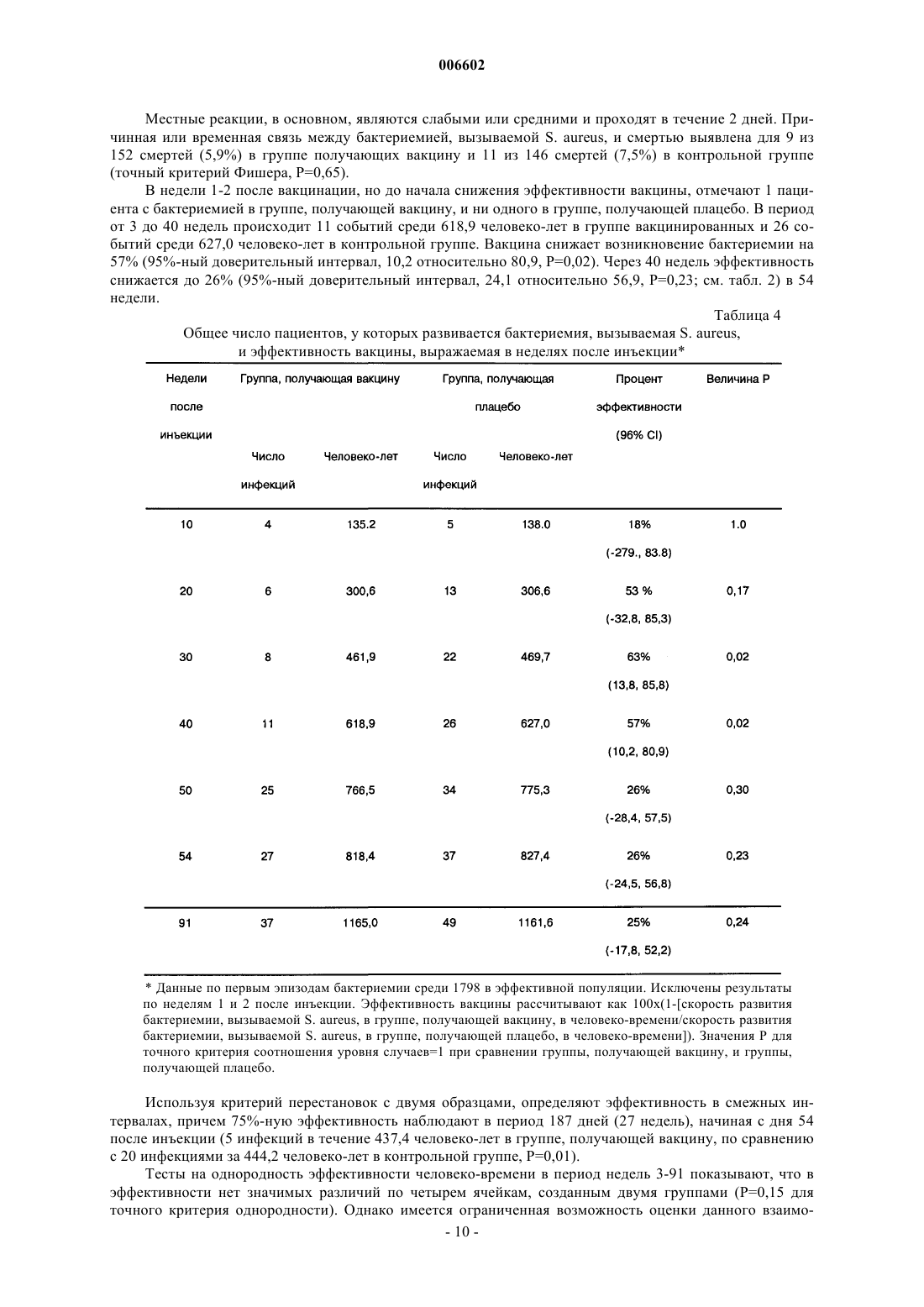
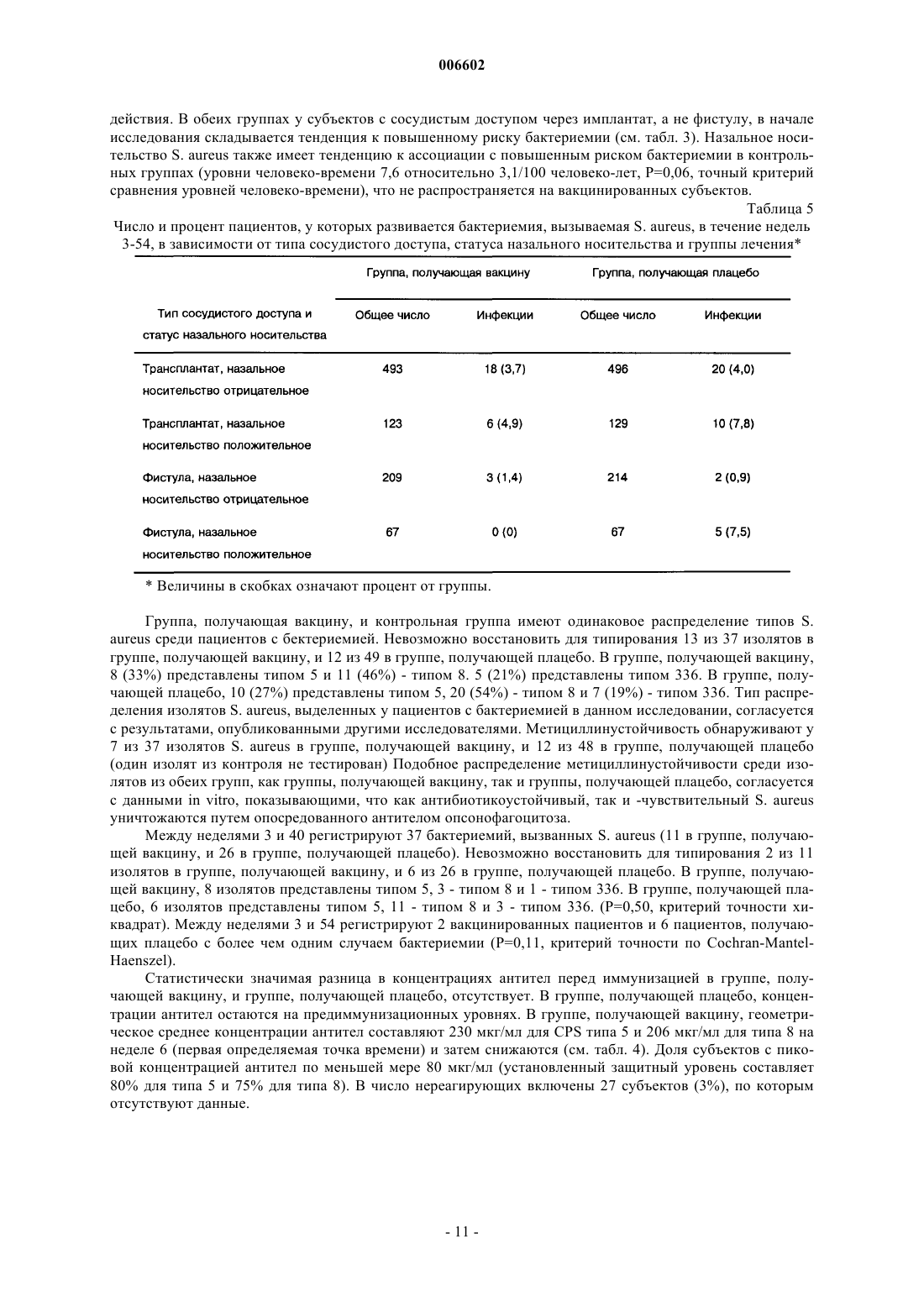
Применение стафилококковых и энтерококковых вакцин для защиты иммунокомпромиссного субъекта от бактериальных инфекций
Формула / Реферат
1. Способ защиты иммунокомпромиссного человека по меньшей мере от одной из стафилококковых и энтерококковых бактериальных инфекций, отличающийся тем, что иммунокомпромиссному человеку вводят вакцину, содержащую иммуноноситель и по меньшей мере один гликоконъюгат полисахаридного или гликопептидного бактериального поверхностного антигена, выбранный из группы, включающей
гликоконъюгат полисахаридного антигена S. aureus типа 5 и/или типа 8,
гликоконъюгат отрицательно заряженного стафилококкового полисахаридного антигена, который содержит b -связанный гексозамин в качестве основного углеводного компонента и не содержит O-ацетильные группы,
гликоконъюгат стафилококкового гликопептидного антигена, который содержит аминокислоты и N-ацетилированный гексозамин в a -конфигурации, не содержащий O-ацетильные группы и не содержащий гексозу,
гликоконъюгат кислого стафилококкового полисахаридного антигена, который получен из изолята S. epidermidis, агглютинирующего антисыворотку к ATCC 55254,
гликоконъюгат антигена E. faecalis, который содержит 2-ацетамидо-2-дезоксиглюкозу и рамнозу в молярном соотношении 1:2,
гликоконъюгат антигена E. faecalis, который содержит трисахаридный повтор, содержащий 6-дезоксисахар,
гликоконъюгат антигена E. faecium, который содержит 2-ацетамидо-2-дезоксигалактозу и галактозу в молярном соотношении 2:1,
гликоконъюгат антигена E. faecium, который реагирует с антителами к ATCC 202016, и
гликоконъюгат антигена E. faecium, который реагирует с антителами к ATCC 202017, в количестве, эффективном для обеспечения защиты от инфекции.
2. Способ по п.1, отличающийся тем, что указанная вакцина содержит гликоконъюгат по меньшей мере одного полисахаридного антигена S. aureus, выбранного из группы, включающей тип 5 и тип 8.
3. Способ по п.1, отличающийся тем, что указанная вакцина содержит гликоконъюгаты полисахаридного антигена S. aureus как типа 5, так и типа 8.
4. Способ по п.1, отличающийся тем, что указанная вакцина содержит полисахаридный антиген, содержащий b -связанный гексозамин, не имеющий O-ацетильных групп, и специфически связывающийся с антителами к Staphylococcus aureus типа 336, депонированному под номером ATCC 55804.
5. Способ по п.4, отличающийся тем, что указанная вакцина дополнительно содержит гликоконъюгаты полисахаридного антигена S. aureus типа 5 и типа 8.
6. Способ по п.1, отличающийся тем, что указанная вакцина содержит кислый полисахаридный антиген, который получен из изолята S. epidermidis, агглютинирующего антисыворотку к ATCC 55254.
7. Способ по п.1, отличающийся тем, что указанная вакцина содержит стафилококковый гликопептидный антиген, содержащий аминокислоты и N-ацетилированный гексозамин в a -конфигурации, не содержащий O-ацетильные группы и не содержащий гексозу.
8. Способ по п.1, отличающийся тем, что указанная вакцина на основе полисахаридного гликоконъюгата содержит антиген E. faecalis, содержащий 2-ацетамидо-2-дезоксиглюкозу и рамнозу в молярном соотношении 1:2.
9. Способ по п.1, отличающийся тем, что указанная вакцина на основе полисахаридного гликоконъюгата содержит антиген E. faecalis, который имеет трисахаридный повтор, содержащий 6-дезоксисахар.
10. Способ по п.1, отличающийся тем, что указанная вакцина на основе полисахаридного гликоконъюгата содержит антиген E. faecium, содержащий 2-ацетамидо-2-дезоксигалактозу и галактозу в молярном соотношении 2:1.
11. Способ по п.1, отличающийся тем, что указанный бактериальный поверхностный антиген является капсулярным полисахаридным антигеном.
12. Способ по п.1, отличающийся тем, что указанный бактериальный поверхностный антиген является антигеном на основе тейхоевой кислоты.
13. Способ по п.1, отличающийся тем, что указанный бактериальный поверхностный антиген является гликопептидным антигеном.
14. Способ по п.1, отличающийся тем, что указанный иммунокомпромиссный человек выбран из группы, состоящей из пациентов с конечной стадией почечного заболевания (ESRD), онкологических больных, проходящих терапию иммунодепрессантами, больных СПИДом, пациентов с диабетом, новорожденных, пожилых людей в лечебных учреждениях для больных, нуждающихся в постоянном уходе, пациентов с аутоиммунным заболеванием, проходящих терапию иммунодепрессантами, больных после трансплантации, пациентов, проходящих инвазивные хирургические процедуры, ожоговых больных и других пациентов в отделениях неотложной помощи.
15. Способ по п.1, отличающийся тем, что указанный иммунокомпромиссный человек страдает от конечной стадии заболевания почек.
16. Способ по п.1, отличающийся тем, что указанный иммунокомпромиссный человек является новорожденным.
17. Способ по п.1, отличающийся тем, что указанный иммуноноситель представлен дифтерийным токсоидом, столбнячным токсоидом, их полученными рекомбинантным путем генетически детоксифицированными вариантами, или полученным рекомбинантным путем нетоксичным мутантом экзотоксина A Pseudomonas aeruginosa, или стафилококковым экзотоксином или токсоидом.
18. Способ по п.1, отличающийся тем, что указанная вакцина дополнительно содержит адъювант или иммуностимулятор.
19. Способ по п.1, отличающийся тем, что указанная вакцина дополнительно содержит b -глюкан или гранулоцитарный колониестимулирующий фактор.
20. Способ по любому из пп.1-3, отличающийся тем, что указанную вакцину вводят в количестве, достаточном для снижения бактериемии по меньшей мере на 57%.
21. Способ по п.2 или 3, отличающийся тем, что указанная вакцина содержит по меньшей мере 75 мкг антигена типа 5.
22. Способ по п.2 или 3, отличающийся тем, что указанная вакцина содержит по меньшей мере 55 мкг антигена типа 8.
23. Способ по п.2 или 3, отличающийся тем, что указанная вакцина содержит по меньшей мере 100 мкг антигена типа 5.
24. Способ по п.2 или 3, отличающийся тем, что указанная вакцина содержит по меньшей мере 100 мкг антигена типа 8.
25. Способ по п.3, отличающийся тем, что указанная вакцина содержит по меньшей мере 75 мкг антигена типа 5 и 55 мкг антигена типа 8.
26. Способ по п.3, отличающийся тем, что указанная вакцина содержит по меньшей мере 100 мкг антигена типа 5 и 100 мкг антигена типа 8.
27. Применение по меньшей мере одного гликоконъюгата полисахаридного или гликопептидного бактериального поверхностного антигена, выбранного из группы, включающей
гликоконъюгат полисахаридного антигена S. aureus типа 5 и/или типа 8,
гликоконъюгат отрицательно заряженного стафилококкового полисахаридного антигена, который содержит b -связанный гексозамин в качестве основного углеводного компонента и не содержит O-ацетильные группы,
гликоконъюгат стафилококкового гликопептидного антигена, который содержит аминокислоты и N-ацетилированный гексозамин в a -конфигурации, не содержащий O-ацетильные группы и не содержащий гексозу,
гликоконъюгат кислого стафилококкового полисахаридного антигена, который получен из изолята S. epidermidis, агглютинирующего антисыворотку к ATCC 55254,
гликоконъюгат антигена E. faecalis, который содержит 2-ацетамидо-2-дезоксиглюкозу и рамнозу в молярном соотношении 1:2,
гликоконъюгат антигена E. faecalis, который содержит трисахаридный повтор, содержащий 6-дезоксисахар,
гликоконъюгат антигена E. faecium, который содержит 2-ацетамидо-2-дезоксигалактозу и галактозу в молярном соотношении 2:1,
гликоконъюгат антигена E. faecium, который реагирует с антителами к ATCC 202016, и
гликоконъюгат антигена E. faecium, который реагирует с антителами к ATCC 202017,
на иммуноносителе и в количестве, эффективном для обеспечения защиты от инфекции, в качестве средства для получения вакцины для защиты иммунокомпромиссных субъектов по меньшей мере от одной из стафилококковых и энтерококковых бактериальных инфекций.
28. Применение по п.27 для получения вакциэы, снижающей бактериемию у иммунокомпромиссных субъектов.
29. Применение по п.27 для получения вакцины, содержащей гликоконъюгат полисахаридного антигена S. aureus типа 5 и/или типа 8.
30. Применение по п.27 для получения вакцины, содержащей гликоконъюгаты полисахаридного антигена S. aureus как типа 5, так и типа 8.
31. Применение по п.29 или 30 для получения вакцины, содержащей по меньшей мере 75 мкг антигена типа 5.
32. Применение по п.28 или 29 для получения вакцины, содержащей по меньшей мере 55 мкг антигена типа 8.
33. Применение по п.28 или 29 для получения вакцины, содержащей по меньшей мере 100 мкг антигена типа 5.
34. Применение по п.28 или 29 для получения вакцины, содержащей по меньшей мере 100 мкг антигена типа 8.
35. Применение по п.29 для получения вакцины, содержащей по меньшей мере 75 мкг антигена типа 5 и 55 мкг антигена типа 8.
36. Применение по п.29 для получения вакцины, содержащей по меньшей мере 100 мкг антигена типа 5 и по меньшей мере 100 мкг антигена типа 8.
37. Применение по п.27 для получения вакцины, содержащей гликоконъюгат отрицательно заряженного стафилококкового полисахаридного антигена, включающего в качестве основного углеводного компонента b -связанный гексозамин и не имеющего O-ацетильных групп.
38. Применение по п.27 для получения вакцины, содержащей кислый полисахаридный антиген, который получен из изолята S. epidermidis, агглютинирующего антисыворотку к ATCC 55254.
39. Применение по п.27 для получения вакцины, содержащей стафилококковый гликопептидный антиген, включающий аминокислоты и N-ацетилированный гексозамин в a -конфигурации, не содержащий O-ацетильные группы и не содержащий гексозу.
40. Применение по п.27 для получения вакцины для защиты иммунокомпромиссного субъекта, имеющего конечную стадию почечного заболевания, СПИД или диабет.
41. Применение по п.27 для получения вакцины для защиты иммунокомпромиссного субъекта, являющегося пациентом, проходящим терапию иммунодепрессантами.
42. Применение по п.27 для получения вакцины для защиты иммунокомпромиссного субъекта, являющегося пожилым человеком, находящимся в лечебном учреждении для больных, нуждающихся в постоянном уходе.
43. Применение по п.27 для получения вакцины для защиты иммунокомпромиссного субъекта, являющегося пациентом после трансплантации или ожоговым больным.
44. Набор, содержащий вакцину, которая содержит иммуноноситель и по меньшей мере один гликоконъюгат полисахаридного или гликопептидного бактериального поверхностного антигена, выбранный из группы, включающей
гликоконъюгат полисахаридного антигена S. aureus типа 5 и/или типа 8,
гликоконъюгат отрицательно заряженного стафилококкового полисахаридного антигена, который содержит b -связанный гексозамин в качестве основного углеводного компонента и не содержит O-ацетильные группы,
гликоконъюгат стафилококкового гликопептидного антигена, который содержит аминокислоты и N-ацетилированный гексозамин в a -конфигурации, не содержащий O-ацетильные группы и не содержащий гексозу,
гликоконъюгат кислого стафилококкового полисахаридного антигена, который получен из изолята S. epidermidis, агглютинирующего антисыворотку к ATCC 55254,
гликоконъюгат антигена E. faecalis, который содержит 2-ацетамидо-2-дезоксиглюкозу и рамнозу в молярном соотношении 1:2,
гликоконъюгат антигена E. faecalis, который содержит трисахаридный повтор, содержащий 6-дезоксисахар,
гликоконъюгат антигена E. faecium, который содержит 2-ацетамидо-2-дезоксигалактозу и галактозу в молярном соотношении 2:1,
гликоконъюгат антигена E. faecium, который реагирует с антителами к ATCC 202016, и
гликоконъюгат антигена E. faecium, который реагирует с антителами к ATCC 202017,
а также инструкции по введению вакцины иммунокомпромиссному субъекту.
45. Набор по п.44, отличающийся тем, что данные инструкции определяют введение первой и второй доз вакцины по указанной схеме.
46. Набор по п.44, отличающийся тем, что указанная вакцина содержит гликоконъюгат полисахаридного антигена S. aureus типа 5 и/или типа 8.
47. Набор по п.44, отличающийся тем, что указанная вакцина содержит гликоконъюгаты полисахаридного антигена S. aureus как типа 5, так и типа 8.
48. Набор по п.44, отличающийся тем, что указанная вакцина содержит по меньшей мере 75 мкг антигена типа 5.
49. Набор по п.44, отличающийся тем, что указанная вакцина содержит по меньшей мере 55 мкг антигена типа 8.
50. Набор по п.44, отличающийся тем, что указанная вакцина содержит по меньшей мере 100 мкг антигена типа 5.
51. Набор по п.44, отличающийся тем, что указанная вакцина содержит по меньшей мере 100 мкг антигена типа 8.
52. Набор по п.44, отличающийся тем, что указанная вакцина содержит по меньшей мере 75 мкг антигена типа 5 и 55 мкг антигена типа 8.
53. Набор по п.44, отличающийся тем, что указанная вакцина содержит по меньшей мере 100 мкг антигена типа 5 и по меньшей мере 100 мкг антигена типа 8.
54. Набор по п.44, отличающийся тем, что указанная вакцина содержит гликоконъюгат отрицательно заряженного стафилококкового полисахаридного антигена, содержащего в качестве основного углеводного компонента b -связанный гексозамин и не имеющего O-ацетильных групп.
55. Набор по п.44, отличающийся тем, что указанная вакцина содержит кислый полисахаридный антиген, который получен из изолята S. epidermidis, агглютинирующего антисыворотку к ATCC 55254.
56. Набор по п.44, отличающийся тем, что указанная вакцина содержит стафилококковый гликопептидный антиген, содержащий аминокислоты и N-ацетилированный гексозамин в a -конфигурации, не содержащий O-ацетильные группы и не содержащий гексозу.
57. Набор по п.44, отличающийся тем, что указанные инструкции определяют применение к субъекту с конечной стадией почечного заболевания, СПИДом или диабетом.
58. Набор по п.44, отличающийся тем, что указанные инструкции определяют применение к пациенту, который проходит терапию иммунодепрессантами.
59. Набор по п.44, отличающийся тем, что указанные инструкции определяют применение к пожилому человеку, находящемуся в лечебном учреждении для больных, нуждающихся в постоянном уходе.
60. Набор по п.44, отличающийся тем, что указанные инструкции определяют применение к пациенту после трансплантации или ожоговому больному.
61. Способ по п.1, отличающийся тем, что указанный иммунокомпромиссный субъект характеризуется назальным носительством.
62. Способ по п.1, отличающийся тем, что указанный иммунокомпромиссный субъект имеет гетерологичный имплантированный доступ.
63. Применение по п.27 для получения вакцины для защиты иммунокомпромиссного субъекта, характеризующегося назальным носительством.
64. Применение по п.27 для получения вакцины для защиты иммунокомпромиссного субъекта, имеющего гетерологичный имплантированный доступ.
65. Набор по п.44, отличающийся тем, что указанные инструкции определяют применение к субъекту с назальным носительством.
66. Набор по п.44, отличающийся тем, что указанные инструкции определяют применение к субъекту с гетерологичным имплантированным доступом.
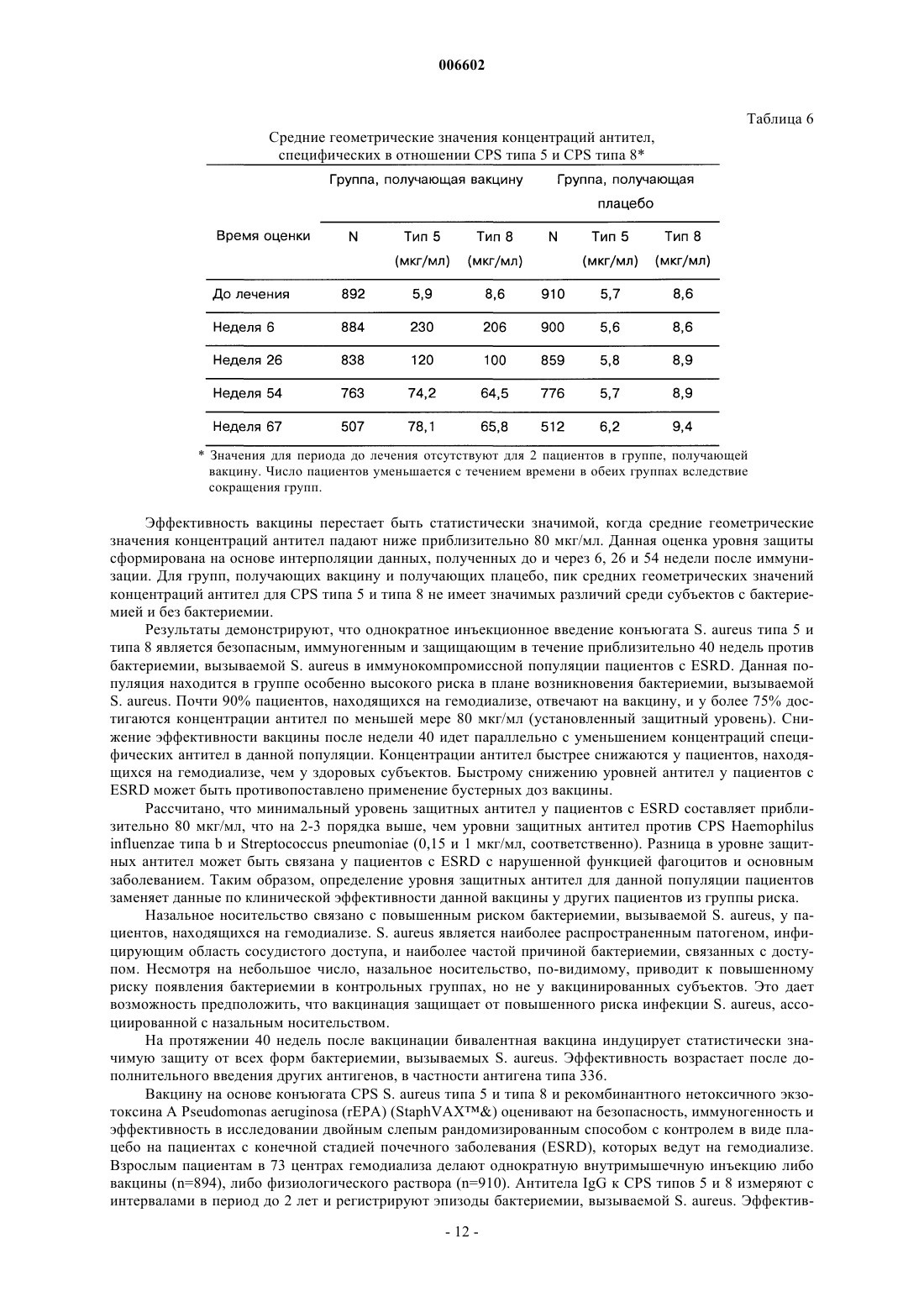
Текст
006602 Область техники, к которой относится изобретение Данное изобретение относится к использованию стафилококковых и энтерококковых гликоконъюгированных вакцин для профилактики или лечения бактериальной инфекции у иммунокомпромиссного субъекта. Предшествующий уровень техники Стафилококки и энтерококки редко вызывают системные инфекции у здоровых в других отношениях субъектов, вследствие чего их рассматривают как оппортунистические патогены. Нормальные взрослые люди и животные с компетентной иммунной системой посредством различных механизмов получают врожденную естественную устойчивость к данным бактериальным инфекциям. Кроме возможных иммунологических механизмов они включают барьеры слизистой оболочки и эпидермиса. Нарушение данных естественных барьеров в результате повреждений, таких как ожоги и травмы, или хирургических процедур с использованием постоянных медицинских устройств повышает риск стафилококковых и энтерококковых инфекций. Кроме того, субъекты с компромиссным иммунным ответом, такие как онкологические больные, проходящие химиотерапию или радиотерапию, пациенты с диабетом и СПИДом, алкоголики, наркоманы, пациенты после трансплантации органов и дети, находятся в группе повышенного риска стафилококковых и энтерококковых инфекций. Стафилококки представляют собой бактерии-комменсалы, населяющие ноздри, кожу и желудочнокишечный тракт человека. Приблизительно подсчитано, что стафилококковые инфекции обусловливают 50% всех госпитальных инфекций. Один S. aureus вызывает 15-25% данных инфекций, и его опережает только S. epidermidis, который является причиной 35% из этих инфекций. Стафилококковые инфекции, в особенности вызываемые S. aureus, связаны с высокой заболеваемостью и смертностью.Staphylococcus и Enterococcus являются основной причиной нозокомиальных и приобретенных обществом инфекций, включая бактериемию, метастатические абсцессы, септический артрит, эндокардит, остеомиелит и раневые инфекции. Например, общая смертность от S. aureus, связанная с бактериемией, составляет приблизительно 25%. Исследование госпитализированных больных в 1995 г. показало, что уровень смертности, длительность пребывания и стоимость лечения при госпитализациях, связанных с инфекциейS. aureus, были в 2 раза выше, чем при госпитализациях по другим причинам. Бактериемия, вызываемаяS. aureus, является ведущей причиной заболеваемости и смертности пациентов, находящихся на гемодиализе,ежегодно составляя 3-4% случаев. Дополнительным аргументом, свидетельствующим о серьезности инфекций S. aureus, является повышение процента изолятов, устойчивых к метициллину, и первые сообщения об устойчивости к ванкомицину. Следовательно, иммунопрофилактика против S. aureus крайне желательна. Капсулярные полисахариды (CPS) S. aureus представляют собой факторы вирулентности при системных инфекциях, вызываемых данным оппортунистическим патогеном. CPS S. aureus обусловливают инвазионность посредством ингибирования опсонофагоцитарного уничтожения полиморфно-ядерными нейтрофилами (PMN) аналогично другим инкапсулированным бактериям, таким как Streptococcus pneumoniae. Это позволяет бактериям существовать в крови, где они вырабатывают ряд различных факторов вирулентности, включая токсины и экстрацеллюларные ферменты. Из 11 известных типов S. aureus типы 5 и 8 составляют приблизительно 85% всех клинических изолятов. Большинство остальных изолятов несет относительно недавно идентифицированный антиген, известный как тип 336. Антитела к типамCPS 5, 8 и 336 индуцируют типоспецифическое опсонофагоцитарное уничтожение человеческими PMNin vitro и обеспечивают защиту в моделях инфекции на животных. У стафилококков появились очень сложные механизмы, вызывающие заболевания у человека,включающие как интрацеллюларные, так и экстрацеллюларные факторы. Например, S. aureus имеет другие поверхностные антигены, которые облегчают его выживание в кровотоке, помогая бактерии избежать фагоцитарного уничтожения лейкоцитами хозяина. Данные поверхностные антигены содержат компоненты клеточной стенки, такие как тейхоевая кислота, белок А и капсулярные полисахариды(CPS). Отчасти вследствие изменчивости данных бактерий и их способности продуцировать экстрацеллюларные продукты, которые усиливают инфекционность и патогенез, стафилококковая бактериемия и ее осложнения, такие как эндокардит, септический артрит и остеомиелит, продолжают оставаться серьезными и часто встречающимися нозокомиальными инфекциями. Антибиотики, такие как пенициллин, успешно применяли против обeих, стафилококковых и энтерококковых, инфекций у человека, но уже давно эффективность данных антибиотиков понизилась вследствие способности бактерий к развитию устойчивости. Например, вскоре после внедрения метициллина,более нового синтетического антибиотика, были выделены штаммы метициллинустойчивого S. aureus. Частота возникновения антибиотикоустойчивости среди изолятов стафилоккока, выделенных из нозокомиальных инфекций, продолжает возрастать, и устойчивые штаммы S. aureus продолжают вызывать эпидемии в больницах, несмотря на разработанные профилактические процедуры и широкие исследования в области бактериальной эпидемиологии и создание антибиотиков. В настоящее время появляются энтерококки, устойчивые к ванкомицину, и в ряде центров идентифицированы метициллинустойчивые организмы S. aureus с промежуточной устойчивостью к ванкомицину. Перекрестный перенос устойчивости в конечном счете приведет к широкому распространению организмов, трудно поддающихся уничтожению. Изначальная эффективность антибиотиков в плане лечения и излечения стафилококковых инфекций уводит внимание от иммунологических подходов к решению проблемы данных инфекций. Несмотря-1 006602 на возникновение множества антибиотикоустойчивых штаммов S. aureus, не были разработаны другие стратегические решения, такие как вакцины. Кроме того, пассивная иммунизация была апробирована для применения у иммунокомпромиссных субъектов, таких как новорожденные, которые находятся в группе повышенного риска заражения данными бактериальными инфекциями. Данных в поддержку основательного заключения в пользу применения пассивной иммунизации данной популяции недостаточно. См. статьи Baker и соавт., New Engl. J. Med., 35:213-219 (1992); Fanaroff и соавт., New Engl. J. Med., 330:11071113 (1994). Применение активной вакцинации как эффективного средства защиты иммунокомпромиссных популяций до сих пор не было реализовано ни с одной из разрешенных к применению вакцин. Обнаружено, что вакцины, иммуногенные для здоровых вакцинируемых субъектов, являются менее иммуногенными или неиммуногенными для иммунокомпромиссных пациентов и при этом обеспечивают недостаточный уровень защиты. Например, показано, что иммунный ответ у пациентов, проходящих гемодиализ, на вакцину против гепатита В понижен на 50-80% от наблюдаемого у здоровых вакцинируемых субъектов. Аналогично иммунный ответ на данную вакцину у пожилых пациентов понижен до 46%. См. статью Pirofski и Casadevall, Clin. Microbiol. Rev., 11:1-26, (1998). Бактериальные капсулярные полисахариды, как правило, являются слабыми иммуногенами. Их иммуногенность для человека, как известно, связана с их молекулярной массой и возрастом вакцинируемого субъекта. Дети в возрасте до 2 лет, пожилые люди и другие иммунокомпромиссные пациенты, как правило, слабо реагируют на CPS-вакцины. Хотя полисахаридные вакцины были разработаны для ряда важных бактериальных патогенов, которые вызывают острые заболевания у нормальных субъектов, а именно Streptococcus pneumoniae, Neisseria meningitidis и Hemophilus influenzae, ни одна из них специально не описана в качестве средства лечения оппортунистических бактерий. Более того, при испытаниях данных вакцин на иммунокомпромиссных субъектах отмечают быстрое снижение иммунного ответа,которое приводит в результате к отсутствию эффективной защиты. В случае S. pneumoniae испытываемая вакцина содержала множество штаммов и действовала у иммунокомпетентных взрослых субъектов,но не действовала у иммунокомпромиссных субъектов со слабым иммунным ответом, таких как пожилые люди и больные СПИДом. В случае конъюгированной вакцины на основе S. aureus типа 5 у пациентов, находящихся на гемодиализе, образовывался более низкий максимальный уровень количества антител по сравнению с данным уровнем у здоровых вакцинируемых субъектов, 180 мкг/мл и 318 мкг/мл,соответственно. Более того, снижение уровня антител у пациентов, находящихся на диализе, происходило быстрее, чем снижение уровней антител у здоровых вакцинированных субъектов. Через 6 месяцев уровень антител у пациентов, находящихся на диализе, снижался на 39% относительно снижения на 14% у здоровых субъектов. См. статью Welch и соавт., J. Am. Soc. Neph., 7:247-253, (1996). Живые вакцины, как правило, более иммуногенны, но при вакцинации иммунокомпромиссных пациентов существует одна проблема. Хотя вирусные и бактериальные штаммы, используемые в таких вакцинах, аттенюированы, некоторые из данных штаммов могут ревертировать и вызывать заболевание. Иммунизация вакциной на основе бактериального компонента является особенно предпочтительной для иммунокомпромиссных пациентов, таких как пациенты, проходящие химиотерапию, пациенты, находящиеся на гемодиализе, дети, пациенты с травматическим шоком, пациенты после хирургических вмешательств и другие субъекты с пониженной резистентностью или частично компромиссными иммунными системами. Полисахаридные антигены в норме генерируют независимый от Т-клеток иммунный ответ, и они индуцируют образование гуморальных антител в отсутствие бустерной иммунной реакции, наблюдаемой при повторной инъекции. При получении полного иммунного ответа конъюгирование полисахарида с белковыми носителями может изменить бактериальные CPS-антигены, делая их иммуногенами, зависимыми от Т-клеток, что повышает таким образом их иммуногенность и потенцирует их действие у детей и иммунокомпромиссных пациентов. Иммунокомпромиссные субъекты часто находятся в группе высокого риска заражения бактериальными инфекциями, например, во время таких процедур, как катетеризация. Вследствие их слабого иммунного ответа, воздействие инфекционного штамма бактерии, по всей вероятности, приведет к высокому уровню инфекции. Тот факт, что у многих бактериальных штаммов развилась устойчивость ко многим или всем имеющимся в настоящее время антибиотикам, повышает вероятность отрицательных последствий развития бактериальной инфекции у иммунокомпромиссного субъекта. Вследствие этого было бы крайне желательным вакцинировать иммунокомпромиссных субъектов против распространенных клинически важных бактериальных штаммов. Однако известно, что бактериальные антигены, такие как стафилококковые и энтерококковые полисахаридные антигены, являются слабыми иммуногенами. Их иммуногенность может быть повышена путем конъюгирования с белками-носителями, но ни для одной из имеющихся в настоящее время конъюгированных вакцин еще не была показана эффективность для иммунокомпромиссных пациентов. При этом широко распространено мнение, что данные вакцины не смогли бы вызвать эффективный иммунный ответ в иммунокомпромиссной популяции. Сущность изобретения Авторами данного изобретении обнаружено, что конъюгаты некоторых стафилококковых и энтерококковых полисахаридных и гликопептидных бактериальных поверхностных антигенов, обозначаемых в данном контексте как "гликоконъюгаты", эффективны в плане защиты против бактериальной инфекции у им-2 006602 мунокомпромиссных субъектов. Например, бивалентные вакцины, содержащие CPS S. aureus типов 5 или 8, связанный с рекомбинантным экзобелком A (rEPA) - нетоксичным вариантом экзотоксина A Pseudomonasaeruginosa, экспрессированным в Escherichia coli, обладают иммуногенностью и хорошо переносятся здоровыми взрослыми субъектами и пациентами с конечной стадией почечного заболевания (ESRD) и,что более важно, способны предупреждать бактериемию у пациентов с ESRD, находящихся на гемодиализе. Данный эффект был совершенно неожиданным в свете принятой теории, предполагающей, что у иммунокомпромиссных субъектов нельзя ожидать появления эффективного иммунного ответа против слабоиммуногенных антигенов, таких как полисахаридные антигены, которые, как известно, обычно обладают низкой иммуногенностью. С иммунологической точки зрения, пациенты с ESRD, находящиеся на гемодиализе, являются пациентами с наиболее тяжелыми состояниями среди популяций взрослых субъектов, находящихся в зоне риска. В большинстве они являются людьми пожилого возраста, многие их них больны диабетом (50%),и они обычно страдают уремией. Уремия и гипергликемия составляют основное ослабляющее воздействие на защитные механизмы хозяина, в особенности на опсонофагоцитоз. Данные условия вызывают основное нарушение иммунной функции посредством нарушения функциональности комплемента или фагоцитов. У пациентов с ESRD, как правило, угнетена функция нейтрофилов и нарушен фагоцитоз,имеется лейкопения, вторичная относительно активации комплемента, понижена активность натуральных киллерных клеток, понижена функция Т- и В-лимфоцитов и понижен ответ Т-лимфоцитов на стандартные антигены. Невозможно было предвидеть способность вакцин, соответствующих изобретению,защищать иммунокомпромиссную в высокой степени целевую популяцию. Данное изобретение охватывает защиту иммунокомпромиссного человека от по меньшей мере одной из стафилококковых и энтерококковых инфекций. Вакцина содержит гликоконъюгат полисахаридного или гликопептидного бактериального поверхностного антигена и иммуноносителя. Предложенный в изобретении подход предусматривает введение вакцины иммунокомпромиссным субъектам в дозе,которая приводит к образованию у иммунокомпромиссного субъекта серотип-специфических антител на уровне, сравнимом с уровнем, достигаемым у нормальных здоровых субъектов в ответ на вакцину. Вакцина содержит(a) гликоконъюгаты полисахаридных антигенов S. aureus как типа 5, так и типа 8,(b) гликоконъюгат отрицательно заряженного стафилококкового полисахаридного антигена, который содержит -связанный гексозамин в качестве основного углеводного компонента и не содержит Oацетильные группы,(c) гликоконъюгат стафилококкового гликопептидного антигена, который содержит аминокислоты и N-ацетилированный гексозамин в -конфигурации, не содержащий O-ацетильные группы и не содержащий гексозу,(d) гликоконъюгат кислого стафилококкового полисахаридного антигена, который получен из изолята S. epidermidis, агглютинирующего антисыворотку к АТСС 55254,(e) гликоконъюгат антигена Е. faecalis, который содержит 2-ацетамидо-2-дезоксиглюкозу и рамнозу в молярном соотношении 1:2,(f) гликококонъюгат антигена Е. faecalis, который содержит трисахаридный повтор, содержащий 6 дезоксисахар,(g) гликоконъюгат антигена Е. faecium, который содержит 2-ацетамидо-2-дезоксигалактозу и галактозу в молярном соотношении 2:1,(h) гликоконъюгат антигена Е. faecium, который реагирует с антителами к АТСС 202016, или(i) гликоконъюгат антигена Е. faecium, который реагирует с антителами к АТСС 202017. Вакцина приводит к достижению у иммунокомпромиссных субъектов такого же уровня серотипспецифического антитела к антигенам, содержащимся в вакцинах (в рамках ожидаемой экспериментальной вариации), как уровень, который достигается у нормальных здоровых субъектов при их иммунизации вакциной, содержащей гликоконъюгаты. Сведения, подтверждающие возможность осуществления изобретения Обнаружено, что иммунокомпромиссных субъектов можно эффективно защитить от бактериальной инфекции путем введения вакцины, которая содержит вместе с иммуноносителем конъюгат полисахаридного или гликопептидного поверхностного антигена из клинически значимого стафилококкового или энтерококкового бактериального штамма. В данном контексте термин "клинически значимый" бактериальный штамм представляет собой штамм, патогенный для человека. Вакцина может быть использована для активной защиты иммунокомпромиссных субъектов, которые могут оказаться в условиях, подвергающих их прямому риску возникновения бактериальной инфекции. Данные условия могли бы, например, включать катетеризацию или хирургическую процедуру. Примечательно, что в данном изобретении обнаружено, что у иммунокомпромиссных субъектов появляется эффективный иммунный ответ при вакцинации вакциной, соответствующей данному изобретению. Иммунокомпромиссные субъекты могут страдать от недостаточности одного из двух или обеих,клеточной и гуморальной, ветвей ответа иммунной системы. Обе этих ветви ответа вносят вклад в борь-3 006602 бу с инфекционными болезнями. В частности, от бактериальных инфекций освобождаются, в основном,с помощью двух механизмов: посредством бактерицидной активности, для которой требуются как антитела, так и комплемент, и посредством опсонофагоцитоза, для которого необходимы фагоциты в дополнение к комплементу и антителам. Каждая из стадий данного процесса может пострадать от дефекта,который будет до определенной степени воздействовать на функциональность всего процесса. При этом любой из таких дефектов в результате приводит к тому, что хозяин становится "иммунокомпромиссным". Пациенты с ESRD представляют собой хорошую модель для предсказания способности вакцины защищать иммунокомпромиссных субъектов, поскольку у данных пациентов очень многие аспекты иммунной системы являются компромиссными. Например, многие из данных пациентов больны диабетом или гипергликемией, которые нарушают связывание комплемента. Неспособность связывать комплемент ограничивает эффективность антител у данных пациентов. Более того, в результате диабета у фагоцитов ослаблено хемотактическое движение, которое, в свою очередь, может привести к их неспособности достигать места инфекции. Пациенты, находящиеся на гемодиализе, страдают также от уремии, которая воздействует на функциональность гранулоцитов и связывание комплемента, вызывая недостаточность опсонофагоцитоза. Диабет и уремия нарушают также функциональность В-клеток, что в результате приводит к более низкому, чем оптимальный, иммунному ответу на вакцинацию. В данном контексте полисахаридный или гликопептидный поверхностный антиген является антигеном, который содержит основную часть углеводных остатков. Антигены, которые содержат только углеводные остатки, называют полисахаридными антигенами. Некоторые бактериальные поверхностные антигены дополнительно содержат уменьшенное количество аминокислот, как правило, меньше, чем 40% от массы антигена. В данном случае их называют гликопептидными антигенами. Бактериальные поверхностные антигены согласно данному изобретению могут быть капсулярными полисахаридами или могут содержать тейхоевую кислоту. Многие из стафилококковых и энтерококковых бактериальных поверхностных антигенов идентифицированы как пригодные для приготовления конъюгированной вакцины, соответствующей данному изобретению. В частности, они включают полисахаридные и гликопептидные антигены, обнаруженные на различных штаммах S. aureus, S. epidermidis, S. haemolyticus или S. hominis, E. faecium и E. faecalis. Антигены для приготовления конъюгированных вакцин, соответствующих данном изобретению,включают антигены S. aureus типа 5 и типа 8. Исследования показали, что приблизительно 85-90% изолятов характеризуются капсулярным полисахаридом типа 5 или типа 8. Нормальные субъекты, вакцинированные вакциной, содержащей капсулярные полисахаридные антигены типа 5 и типа 8, защищены от инфекции 85-90% штаммов S. aureus. Структуры полисахаридных антигенов типов 5 и 8 представлены в статьях Moreau и соавт., Carbohydr. Res., 201:285, (1990), и Fournier и соавт., Infect. Imm., 45:87, (1984). Они обе содержат FucNAcp в своей повторяющейся единице, а также группу ManNAcA, которая может быть использована для введения сульфгидрильной группы. Структуры представляют собой Тип 5:-3)D-ManNAcAp(13)L-FucNAcp(13)D-FucNAcp(1-4)Oac Предпочтительная вакцина, соответствующая данному изобретению, включает конъюгаты обоих антигенов, типа 5 и типа 8. Особенно удивительно, что данная бивалентная вакцина обеспечивает хороший уровень защиты иммунокомпромиссных субъектов. В статье Welch и соавт. (1996), см. выше, описано, что моновалентная вакцина на основе типа 5 вызывает очень ограниченный иммунный ответ у пациентов с ESRD. Невозможно было предвидеть защиту, достигаемую при использовании бивалентной вакцины на основе S. aureus типа 5/типа 8, соответствующей данному изобретению, по слабому результату, описанному в работе Welch и соавт., в особенности в сочетании с имеющимися в области техники материалами о том, что введение в вакцину второго антигенного компонента фактически снижает эффективность каждого отдельного компонента. См. статью Fattom и соавт., 17:126-133, (1999). Другой антиген Staphylococcus, который может быть использован для приготовления конъюгатов,соответствующих данному изобретению, описан в патентах США 5770208 и 6194161. Данный отрицательно заряженный антиген содержит -связанный гексозамин в качестве основного углеводного компонента и не содержит О-ацетильные группы, определяемые с помощью ЯМР-спектроскопии. Антиген специфически связывается с антителами к S. aureus типа 336, депонированного под номером АТСС 55804. Штаммы S. aureus, которые несут данный антиген, составляют практически все клинически значимые штаммы S. aureus, которые не принадлежат к штаммам типа 5 или типа 8. Таким образом, особенно перспективным является использование данного антигена в комбинации с полисахаридным антигеномS. aureus типа 5 и полисахаридными антигенами S. aureus типа 8 для того, чтобы покрыть почти 100% инфекций S. aureus. Имеется также много клинически значимых штаммов S. epidermidis. Для защиты от инфекции или лечения инфекции данных штаммов предпочтительной является конъюгированная вакцина, приготовленная с использованием так называемого антигена типа 1, как описано в патентах США 5961975 и-4 0066025866140. Данный антиген представляет собой кислый полисахаридный антиген, который получают способом, предусматривающим выращивание клеток изолята S. epidermidis, который агглютинирует антисыворотку к АТСС 55254 (изолят типа I); экстракцию полисахаридного антигена из клеток для получения неочищенного экстракта полисахаридного антигена; очистку данного неочищенного экстракта с получением антигена, который содержит менее 1% белка, нанесение очищенного антигена на разделительную колонку, элюирование его градиентом NaCl и идентификацию фракций, содержащих полисахаридный антиген с использованием антител, специфических в отношении изолята типа I. Еще один антиген Staphylococcus для приготовления конъюгированных вакцин, соответствующих данному изобретению, описан в заявке WO 00/56357. Данный антиген содержит аминокислоты и N-ацетилированный гексозамин в -конфигурации, не содержащей O-ацетильные группы, определяемые ЯМР-спектроскопией, и не содержащей гексозу. Он специфически связывается с антителами к штаммуStaphylococcus, депонированному под номером АТСС 202176. Анализ аминокислот антигена показывает присутствие серина, аланина, аспарагиновой кислоты/аспарагина, валина и треонина в молярных соотношениях приблизительно 39:25:16:10:7. Аминокислоты составляют около 32% массы молекулы антигена. Кроме конъюгированных вакцин с данными антигенами Staphylococcus предпочтительными в соответствии с данным изобретением являются конъюгированные вакцины с антигенами Enterococcus, как описано в заявке WO 99/18996. В данной заявке раскрыты пять различных антигенов, два из которых выделены из штаммов Е. faecalis и три из которых выделены из штаммов Е. faecium. Образцы каждого из двух штаммов Е. faecalis и трех штаммов Е. faecium депонированы согласно Будапештскому договору в Американской коллекции типовых культур (American Type Culture Collection (АТСС под регистрационными номерами 202013 (Е. faecalis EFS1), 202014 (Е. faecalis EFS2), 202015 (Е. faecium EFM3), 202016(E. faecium EFM4) и 202017 (E. faecium EFM5), соответственно. Антиген для использования в данном изобретении может быть выделен из депонированных штаммов, или депонированные штаммы могут быть использованы для идентификации других штаммов, которые экспрессируют антиген, соответствующий изобретению, из которых антиген может быть экстрагирован и очищен. Один из антигенов Е.faecalis, EFS1, содержит 2-ацетамидо-2-дезоксиглюкозу, рамнозу, глюкозу и 2-ацетамидо-2-дезоксигалактозу в приблизительно подсчитанном молярном соотношении 1:2:2:2. Другой антиген Е. faecalis,EFS2, имеет трисахаридный повтор, который содержит 6-дезоксисахар, и антиген Е. faecium, EFM3, содержит 2-ацетамидо-2-дезоксигалактозу и галактозу. Каждый из вышеуказанных антигенов может быть получен в выделяемом количестве из некоторых изолятов Staphylococcus и Enterococcus, культивируемых согласно протоколам, описанным в приведенных документах, в практически очищенной форме. В частности, очищенные антигены содержат меньше 1% нуклеиновых кислот. "Выделяемое" количество в данном отношении означает, что выделенное количество антигена определяется менее чувствительными способами, чем способ с использованием радиоактивной метки, например иммуноанализом, и может быть подвергнуто дальнейшим манипуляциям,включающим перенос самого антигена в раствор. Для использования в качестве вакцины в иммунокомпромиссных популяциях в соответствии с данным изобретением антиген конъюгируют с иммуноносителем. Иммуноноситель представляет собой субстанцию, обычно полипептид или белок, который улучшает взаимодействие между Т- и В-клетками для индукции иммунного ответа против антигена и, таким образом, повышает иммуногенность как при активной иммунизации, так и при получении антисыворотки с высоким титром у добровольцев для применения в последующей пассивной иммунизации. Подходящие иммуноносители, соответствующие данному изобретению, включают столбнячный токсоид и дифтерийный токсоид, а также их полученные рекомбинантным образом генетически детоксифицированные варианты, стафилококковый экзотоксин или токсоид, экзотоксин A Pseudomonas aeruginosa или его производные, включая в особенности полученные рекомбинантным образом нетоксичные мутантные штаммы Pseudomonas aeruginosa, образующие экзотоксин А, как описано, например, в статье Fattom и соавт. (см. Inf. and Imm., 61:1023-1032, (1993, а также другие белки, обычно используемые как иммуноносители. Для конъюгирования антигена с белком-носителем антиген сначала дериватизируют. Для дериватизации антигена и ковалентного связывания с иммуноносителем могут быть использованы различные способы. Активированные карбоксилатные группы антигена могут быть дериватизированы ADH, цистамином или PDPH, а затем антиген может быть связан с белком-носителем либо путем опосредованной карбодиимидом реакции частично амидированного антигена с карбоксилатной группой на белке-носителе, либо путем взаимообмена дисульфидом тиолированного антигена с дериватизированным SPDP белком-носителем. Гидроксильные группы на антигене могут быть активированы с использованием цианогенбромида или 1-циано-4-диметиламинопиридиний тетрафторбората, а затем антиген может быть дериватизирован бифункциональным спейсером из шести атомов углерода - дигидразидом адипиновой кислоты (ADH) в соответствии с методиками, известными в области техники согласно способу, описанному в статье Kohn и соавт. (см. FEBS Lett., 154:209-210, (1993. После этого данный материал связывают с дифтерийным токсоидом (Dtd), рекомбинантным экзопротеином А из Pseudomonas aeruginosa (rEPA), столбнячным токсоидом (TTd) или другим подходящим белком-носителем с помощью 1-этил-3-(3-диметиламино-5 006602 пропил)карбодиимида (EDAC). Полученные в результате конъюгаты могут быть отделены от непрореагировавшего антигена с помощью гель-хроматографии. Независимо от способа, используемого для конъюгирования антигена с белком-носителем, ковалентное связывание антигена с белком-носителем значительно повышает иммуногенность антигена и приводит в результате к повышению уровней антител к антигену после как первого, так и второго бустерного введения у мышей. Конъюгат антигена и иммуноносителя, соответствующий данному изобретению, представляет собой активный ингредиент композиции, которая, кроме того, содержит фармацевтически активный носитель активного ингредиента. Композицию используют в качестве вакцины для индукции клеточного иммунного ответа и/или продукции in vivo антител, которые борются с бактериальными инфекциями в иммунокомпромиссных популяциях, в частности с инфекциями Staphylococcus и/или Enterococcus. Что касается фармацевтически приемлемого носителя, то он представляет собой материал, который может быть использован в качестве наполнителя для введения лекарственного препарата, поскольку материал является инертным или в других отношениях приемлемым с медицинской точки зрения, а также совместимым с активным агентом в контексте применения вакцины. Кроме подходящего наполнителя фармацевтически приемлемый носитель может содержать принятые вакцинные дополнительные компоненты, например разбавители, адъюванты и другие иммуностимуляторы, антиоксиданты, консерванты и солюбилизирующие агенты. Вакцина, соответствующая изобретению, может быть введена с адъювантом или без него. Если используют адъювант, его выбирают таким образом, чтобы избежать токсичности, вызываемой адъювантом. Вакцина, соответствующая изобретению, может дополнительно содержать -глюкан или гранулоцитарный колониестимулирующий фактор, в частности -глюкан, как описано в патентной заявке США 09/395360, поданной 14 сентября 1999 г. Предпочтительно, когда композиция конъюгата антигена/иммуноносителя, соответствующего данному изобретению, "в основном, состоит из" конъюгата. В данном контексте выражение "в основном,состоит из" означает, что композиция не содержит никакой другой материал, который нарушает возникновение иммунного ответа на антиген (и на другие антигены при их присутствии), когда композицию вводят субъекту в качестве вакцины. Существует большое число иммунокомпромиссных популяций, которые получат преимущество от введения вакцины, соответствующей данному изобретению. Они включают пациентов с конечной стадией почечного заболевания (ESRD), онкологических больных, проходящих терапию иммунодепрессантами, больных СПИДом, пациентов с диабетом, пожилых людей в лечебных учреждениях для больных,нуждающихся в постоянном уходе, пациентов с аутоиммунным заболеванием, проходящих терапию иммунодепрессантами, больных после трансплантации и ожоговых больных. Иммунная система состоит из двух ветвей - клеточной и гуморальной ветви. Обе данныe ветви участвуют в борьбе с инфекционными заболеваниями. В частности, от бактериальных инфекций освобождаются, в основном, посредством двух механизмов: бактерицидная активность, которая включает антитела и комплемент, и опсонофагоцитоз, в котором кроме комплемента и антител важны фагоциты. Каждая из данных стадий в указанных процессах может пострадать от дефекта, который будет в различной степени воздействовать на функциональность всего процесса. Любой из таких дефектов делает хозяина иммунокомпромиссным субъектом. Примеры таких нефункциональных или компромиссных механизмов могут возникать в результате диабета. Диабет и гипергликемия нарушают связывание комплемента. Вследствие этого, даже если в организме субъекта имеется достаточно антител, их неспособность связывать комплемент ограничивает функцию данных антител. Более того, в результате диабета у фагоцитов может быть ослаблена хемотактическая подвижность, которая, в свою очередь, может в результате сделать их неспособными достигать области инфекции. Пациенты, находящиеся на гемодиализе, страдают от уремии, которая воздействует на функциональность гранулоцитов и связывание комплемента, приводя к недостаточному опсонофагоцитозу. Более того, диабет и уремия действуют на функциональность В-клеток, что в результате дает более низкий, чем оптимальный, ответ на вакцинацию. Данное изобретение далее описано со ссылкой на следующие иллюстративные примеры. Пример 1. Исследования дозирования вакцины на основе полисахаридов S. aureus типа 5/типа 8 у пациентов с ESRD. Среди 20 пациентов мужского пола с конечной стадией почечного заболевания (ESRD), находящихся либо на постоянном амбулаторном перитонеальном диализе, либо на гемодиализе, каждому пациенту одной внутримышечной инъекцией вводят вакцину, приготовленную так, что она содержит целевую дозу 25 мкг CPS S. aureus каждого из типов 5 и 8, которые получены в виде конъюгата с рекомбинантным белком экзопротеина Pseudomonas (rEPA). Данная доза 25 мкг является такой же, как используют для здоровых субъектов. Вторую дозу, 0,5 мл бивалентной вакцины, вводят через шесть (6) недель после первой дозы в связи с ожидаемым более слабым иммунным ответом у данной популяции субъектов с хроническими заболеваниями. Пять (5) дополнительных здоровых взрослых субъектов мужского пола получают равный объем плацебо в виде физиологического раствора. Уровни IgG против CPS типов 5 и 8 определяют перед инъекцией и через 2 и 6 недель после инъекции.-6 006602 Как показано в табл. 1, у пациентов с ESRD отмечают существенный иммунный ответ, хотя у пациентов с ESRD он меньше, чем у нормальных здоровых субъектов. Вторая доза, которую вводят через шесть (6) недель, фактически не действует на уровень антител, специфических в отношении любого из серотипов. Таблица 1 Иммуногенность вакцины на основе CPS S. aureus T5/T8 в номинальной дозе 25 мкг каждого из CPS у взрослых субъектов мужского пола с ESRD Затем исследования дозирования на пациентах с ESRD, находящихся на гемодиализе, предпринимают на основе результатов, представленных в табл. 1. Используют препарат, содержащий 75 мкг CPS типа 5 и 55 мкг CPS типа 8 (каждый конъюгирован с равным количеством rЕРА) в объеме 1,0 мл. 33 взрослых пациента с ESRD, включая пациентов обоих полов и находящихся на гемодиализе, иммунизируют однократным внутримышечным введением доз конъюгированной вакцины/IA на основе CPS S. aureus типа 5/типа 8. Исходная группа из 16 субъектов получает дозу 1,0 мл (75 мкг типа 5 и 55 мкг типа 8). После наблюдения за данной группой в течение 1 недели в плане безопасности дозу 1,5 мл (118 мкг типа 5 и 83 мкг типа 8) получают дополнительные 17 субъектов. Обе дозы хорошо переносятся. Серотипспецифические уровни IgG мониторируют в течение 2 и 6 недель и 3, 6, 9 и 12 месяцев после инъекции. По сравнению с табл. 1 оба уровня дозировки дают улучшенный пик уровней серотип-специфических антител через 6 недель после инъекции и, что важно отметить, рекрутируют значительно более крупную фракцию элементов ответа против типа 8 (см. табл. 2). Уровень серотип-специфического антитела к обоим типам CPS приближается к уровням, достигаемым у нормальных здоровых субъектов среди получающих дозу 1,5 мл и дает геометрическое среднее значение повышения в 6,03 раза для типа 8 и в 10,28 раза для типа 5 относительно базовых значений за период 1 год (р 0,0001 для обоих серотипов). Таблица 2 Иммуногенность вакцины на основе CPS S. aureus T5/T8 в повышенных дозах у взрослых субъектов с ESRD, находящихся на гемодиализе-7 006602 Пример 2. Защита пациентов с ESRD с помощью вакцины на основе полисахаридов S. aureus типа 5/типа 8. Субъектов набирают в 73 центрах гемодиализа Калифорнии. Критериями включения являются возраст 18 лет или старше, ESRD на гемодиализе с использованием нативной фистулы сосудов или синтетического/гетерологичного имплантированного доступа в течение по меньшей мере 8 недель до введения в группу, величина по шкале Karnofsky по меньшей мере 50 при поступлении и ожидаемое выполнение необходимых последующих посещений. Критериями исключения являются симптомы или признаки,связанные с инфекцией в течение 2 недель до вакцинации, наличие в анамнезе ВИЧ-инфекции, аллергическая реакция или предшествующая анафилаксия, вызванные полисахаридными или полисахаридными конъюгированными вакцинами, наркомания в предшествующие годы, применение иммунодепрессантов или иммуномодулирующих лекарственных препаратов и злокачественное новообразование или лечение злокачественного новообразования в течение 6 месяцев до вакцинации. Подходящих субъектов распределяют случайным образом по группам, получающим однократную инъекцию или плацебо. Рандомизацию проводят по группам (1) с сосудистым доступом (нативная фистула сосудов или синтетический/гетерологичный имплантат) и (2) с присутствием или отсутствием назального носительства персистентного S. aureus. Вакцину (StaphVAX, представляемую Nabi, Rockville, MD), состоящую из CPS S. aureus типа 5 и типа 8 (100 мкг/тип/мл), конъюгируют с равной массой рекомбинантного нетоксичного экзотоксина APseudomonas aeruginosa (rEPA) в 0,01% полисорбате 80 и забуференном фосфатом натрия физиологическом растворе, рН 7,4. Данную дозу выбирают на основе исследований пациентов с ESRD (Nabi, неопубликованные данные). Вакцину и плацебо (забуференный фосфатом натрия физиологический раствор) представляют в виде идентичных флаконов, содержащих 1 мл прозрачной жидкости, каждый из которых имеет уникальный код. Во время двух отборочных визитов с интервалом приблизительно в 1 неделю субъектов анализируют на пригодность и культивируют материал из ноздрей на присутствие S. aureus. Носительство определяют по двум положительным культурам. Вакцину или плацебо вводят внутримышечной инъекцией в дельтовидную мышцу или наружную поверхность бедра. Состояние субъектов анализируют через 30 мин после инъекции и инструктируют их относительно регистрации местных (краснота, припухлость, боль, ощущение жжения, болезненность, жар) и системных (лихорадка, общее недомогание, мышечная боль, головная боль, тошнота, рвота) реакций каждый день в течение недели. Через 1 неделю после инъекции субъекты возвращаются в центр диализа и регистрируют реакции на вакцину. У субъектов проводят оценку вредных событий в период до 6 недель после инъекции. Смерти и все бактериемии регистрируют до окончания исследования или выведения субъекта из исследования. Измерение основного результата проводят по первому случаю бактериемии у субъектов, вызванной S. aureus. Культуры из крови получают до начала антибиотикотерапии. Сыворотку получают до и через 6, 26, 54 и 67 недель после вакцинации. Антитела к CPS S. aureus типа 5 и типа 8 измеряют с помощью ELISA (твердофазный иммуноферментный анализ), как описано в статьях Fattom и соавт., Infect. Immun., 58:67-74, (1990) и Fattom и соавт., Infect. Immun., 61:1023-32,(1993). Ответ на вакцину определяют как концентрацию антитела по меньшей мере 25 мг/мл и по меньшей мере в 2 раза превышающий уровень перед вакцинацией. Обследования в США и Европе позволяют предположить уровень случаев бактериемии, вызываемойS. aureus, как 0,03-0,04/пациента, находящегося на гемодиализе в год. См., например, статьи Kessler и соавт.,Nephron, 64:95-100, (1992),Quarles и сoaвт., Am. J. Kidney Dis. 6:412-9, (1985), Roubicek и соавт., Nephrologie,16:229-32, (1995) и Bloembergen и Port, Adv. Ren. Replace Ther., 3:201-7, (1996). При скорректированной ошибке типа I 0,042 (способ Fleming-O'Brien, Biometrics, 35:549-56, (1979 объем выборки из 900 субъектов/ группу определяют как достаточный для определения с точностью 80% снижение на 60% случаев бактериемии, вызываемой S. aureus в группе, получающей вакцину при интервале наблюдения 3-54 недели после вакцинации. Однако поскольку связь антитела с защитой до проведения данного исследования неизвестна и поскольку уровни антител быстрее снижаются у пациентов с ESRD, оценивают другие интервалы времени. Оценка эффективности основана на данных, полученных через 2 недели после вакцинации. Уровень бактериемии, вызываемой S. aureus, сравнивают между группой, получающей вакцину, и контрольной группой путем точного стратифицированного вычисления случаев в единицах человеко-времени с использованием программы StatXact. См. руководство по программе StatXact-4, Cambridge,Massachusetts, Cytel, Inc., (1998) и работу Breslow и Day. Статистические методы в исследовании рака (Statistical methods in cancer research), т. II: Разработка и анализ исследований с использованием когорт (Thedesign and analysis of cohort studies), New York: Oxford University Press, (1987). Создают четыре ячейки с использованием двух групп, определенных базовым назальным носительством и модальностью сосудистого доступа. Время до первого эпизода бактериемии, вызываемой S. aureus, описывают по методуKaplan-Meier и сравнивают с помощью логарифмического рангового критерия. Для описания зависимости от времени случаев инфекции используют повторные измерения на модели логистической регрессии(SAS PROC GENMOD), на основании которых оценивают эффективность по тенденциям во времени. См. статью Zeger и Liang. Анализ данных в продольном временном срезе для дискретных и непрерывных результатов (Longitudinal data analysis for discrete and continuous outcomes), Biometrics, 42:121-30, (1986). Модель включает корректировку по группе, возрасту и полу.-8 006602 Дополнительный анализ с использованием критерия перестановок с двумя образцами используют для определения наибольшей эффективности вакцины для любых соседних периодов в течение недель 3-54 последующего исследования. См. монографию Edington E.S. Рандомизационные тесты (RandomizationTests), New York, Marcel Dekker, (1980). В общем, на всех 1798 субъектов получено 10000 модельных наборов данных для исследования всех возможных послеинъекционных периодов на протяжении по меньшей мере 6 месяцев по время 54 недель после вакцинации. Значения Р для анализа эффективности в зависимости от субъекта и времени в соседних интервалах вычисляют как долю смоделированных эффективностей, превышающих значение, полученное в исследовании. Количества субъектов, у которых отмечены реакции на вакцину, и смертей в группе получающих вакцину и группе плацебо сравнивают с помощью точного критерия Фишера. Для получения повторностей теста на безопасность корректировку не проводят. В целом, проводят рандомизацию 1804 из 1991 отобранных субъектов, включенных в эксперимент в 73 центрах гемодиализа, и они получают вакцину (n=894) или плацебо (n=910). У 187 отобранных субъектов, которых не иммунизируют, причинами являются несоответствие критериям включения в исследование или невыполнение протокола (n=81), отказ от согласия (n=71), изменение состояния здоровья(n=22) и иные причины (n=13). Вакцинированные и контрольные субъекты в среднем участвуют в исследовании в течение 75 недель и 74 недель, соответственно, при этом 76% субъектов из каждой группы участвуют в исследовании в течение по меньшей мере 54 недель. 6 субъектов исключают из анализа эффективности: 3 субъекта в группе контроля умирают в течение первых 2 недель, и 2 вакцинированных субъекта и 1 субъект из группы контроля получают инфекции в течение 2 недель перед инъекцией. Ни одного из субъектов не исключают при оценке безопасности. Две группы аналогичны по демографическим и клиническим характеристикам до лечения и отражают разнообразие населения Калифорнии. 33% субъектов представлено людьми белой расы, 31% - латиноамериканцами, 23% - представителями черной расы и 13% - представителями желтой расы. Среди 894 вакцинированных субъектов и 910 субъектов из группы контроля, соответственно, 46 и 44% составляют субъекты женского пола и 52 и 51% - больные диабетом. При вакцинации 69% субъектов в обеих группах имеют имплантированный доступ и 22% в обеих группах являются назальными носителями. Средний возраст в обеих группах составляет 58,3 года. Статистически значимая разница числа смертей в группе получающих вакцину и контрольной группе отсутствует, и не предполагают связь ни одного из смертельных исходов с вакциной. Имеется статистически значимая разница в местных реакциях, недомоганиях и возникновении миалгии в группе вакцинированных по сравнению с контрольной группой (см. табл. 1). Таблица 3 Сводные данные по реакциям на вакцину Данные не зарегистрированы для 1 пациента в группе, получающей вакцину, и для 3 в группе, получающей плацебо. Величины в скобках означают проценты по группе. Боль в области инъекции означает комплекс боли, жжения и болезненности. Величины Р получают с помощью точного критерия Фишера при сравнении группы, получающей вакцину, и группы,получающей плацебо.-9 006602 Местные реакции, в основном, являются слабыми или средними и проходят в течение 2 дней. Причинная или временная связь между бактериемией, вызываемой S. aureus, и смертью выявлена для 9 из 152 смертей (5,9%) в группе получающих вакцину и 11 из 146 смертей (7,5%) в контрольной группе(точный критерий Фишера, Р=0,65). В недели 1-2 после вакцинации, но до начала снижения эффективности вакцины, отмечают 1 пациента с бактериемией в группе, получающей вакцину, и ни одного в группе, получающей плацебо. В период от 3 до 40 недель происходит 11 событий среди 618,9 человекo-лет в группе вакцинированных и 26 событий среди 627,0 человеко-лет в контрольной группе. Вакцина снижает возникновение бактериемии на 57% (95%-ный доверительный интервал, 10,2 относительно 80,9, Р=0,02). Через 40 недель эффективность снижается до 26% (95%-ный доверительный интервал, 24,1 относительно 56,9, Р=0,23; см. табл. 2) в 54 недели. Таблица 4 Общее число пациентов, у которых развивается бактериемия, вызываемая S. aureus,и эффективность вакцины, выражаемая в неделях после инъекции Данные по первым эпизодам бактериемии среди 1798 в эффективной популяции. Исключены результаты по неделям 1 и 2 после инъекции. Эффективность вакцины рассчитывают как 100 х(1-[скорость развития бактериемии, вызываемой S. aureus, в группе, получающей вакцину, в человеко-времени/скорость развития бактериемии, вызываемой S. aureus, в группе, получающей плацебо, в человеко-времени]). Значения Р для точного критерия соотношения уровня случаев=1 при сравнении группы, получающей вакцину, и группы,получающей плацебо. Используя критерий перестановок с двумя образцами, определяют эффективность в смежных интервалах, причем 75%-ную эффективность наблюдают в период 187 дней (27 недель), начиная с дня 54 после инъекции (5 инфекций в течение 437,4 человеко-лет в группе, получающей вакцину, по сравнению с 20 инфекциями за 444,2 человеко-лет в контрольной группе, Р=0,01). Тесты на однородность эффективности человеко-времени в период недель 3-91 показывают, что в эффективности нет значимых различий по четырем ячейкам, созданным двумя группами (Р=0,15 для точного критерия однородности). Однако имеется ограниченная возможность оценки данного взаимо- 10006602 действия. В обеих группах у субъектов с сосудистым доступом через имплантат, а не фистулу, в начале исследования складывается тенденция к повышенному риску бактериемии (см. табл. 3). Назальное носительство S. aureus также имеет тенденцию к ассоциации с повышенным риском бактериемии в контрольных группах (уровни человеко-времени 7,6 относительно 3,1/100 человеко-лет, Р=0,06, точный критерий сравнения уровней человеко-времени), что не распространяется на вакцинированных субъектов. Таблица 5 Число и процент пациентов, у которых развивается бактериемия, вызываемая S. aureus, в течение недель 3-54, в зависимости от типа сосудистого доступа, статуса назального носительства и группы лечения Величины в скобках означают процент от группы. Группа, получающая вакцину, и контрольная группа имеют одинаковое распределение типов S.aureus среди пациентов с бектериемией. Невозможно восстановить для типирования 13 из 37 изолятов в группе, получающей вакцину, и 12 из 49 в группе, получающей плацебо. В группе, получающей вакцину,8 (33%) представлены типом 5 и 11 (46%) - типом 8. 5 (21%) представлены типом 336. В группе, получающей плацебо, 10 (27%) представлены типом 5, 20 (54%) - типом 8 и 7 (19%) - типом 336. Тип распределения изолятов S. aureus, выделенных у пациентов с бактериемией в данном исследовании, согласуется с результатами, опубликованными другими исследователями. Метициллинустойчивость обнаруживают у 7 из 37 изолятов S. aureus в группе, получающей вакцину, и 12 из 48 в группе, получающей плацебо(один изолят из контроля не тестирован) Подобное распределение метициллинустойчивости среди изолятов из обеих групп, как группы, получающей вакцину, так и группы, получающей плацебо, согласуется с данными in vitro, показывающими, что как антибиотикоустойчивый, так и -чувствительный S. aureus уничтожаются путем опосредованного антителом опсонофагоцитоза. Между неделями 3 и 40 регистрируют 37 бактериемий, вызванных S. aureus (11 в группе, получающей вакцину, и 26 в группе, получающей плацебо). Невозможно восстановить для типирования 2 из 11 изолятов в группе, получающей вакцину, и 6 из 26 в группе, получающей плацебо. В группе, получающей вакцину, 8 изолятов представлены типом 5, 3 - типом 8 и 1 - типом 336. В группе, получающей плацебо, 6 изолятов представлены типом 5, 11 - типом 8 и 3 - типом 336. (Р=0,50, критерий точности хиквадрат). Между неделями 3 и 54 регистрируют 2 вакцинированных пациентов и 6 пациентов, получающих плацебо с более чем одним случаем бактериемии (Р=0,11, критерий точности по Cochran-MantelHaenszel). Статистически значимая разница в концентрациях антител перед иммунизацией в группе, получающей вакцину, и группе, получающей плацебо, отсутствует. В группе, получающей плацебо, концентрации антител остаются на предиммунизационных уровнях. В группе, получающей вакцину, геометрическое среднее концентрации антител составляют 230 мкг/мл для CPS типа 5 и 206 мкг/мл для типа 8 на неделе 6 (первая определяемая точка времени) и затем снижаются (см. табл. 4). Доля субъектов с пиковой концентрацией антител по меньшей мере 80 мкг/мл (установленный защитный уровень составляет 80% для типа 5 и 75% для типа 8). В число нереагирующих включены 27 субъектов (3%), по которым отсутствуют данные.- 11006602 Таблица 6 Средние геометрические значения концентраций антител,специфических в отношении CPS типа 5 и CPS типа 8 Значения для периода до лечения отсутствуют для 2 пациентов в группе, получающей вакцину. Число пациентов уменьшается с течением времени в обеих группах вследствие сокращения групп. Эффективность вакцины перестает быть статистически значимой, когда средние геометрические значения концентраций антител падают ниже приблизительно 80 мкг/мл. Данная оценка уровня защиты сформирована на основе интерполяции данных, полученных до и через 6, 26 и 54 недели после иммунизации. Для групп, получающих вакцину и получающих плацебо, пик средних геометрических значений концентраций антител для CPS типа 5 и типа 8 не имеет значимых различий среди субъектов с бактериемией и без бактериемии. Результаты демонстрируют, что однократное инъекционное введение конъюгата S. aureus типа 5 и типа 8 является безопасным, иммуногенным и защищающим в течение приблизительно 40 недель против бактериемии, вызываемой S. aureus в иммунокомпромиссной популяции пациентов с ESRD. Данная популяция находится в группе особенно высокого риска в плане возникновения бактериемии, вызываемойS. aureus. Почти 90% пациентов, находящихся на гемодиализе, отвечают на вакцину, и у более 75% достигаются концентрации антител по меньшей мере 80 мкг/мл (установленный защитный уровень). Снижение эффективности вакцины после недели 40 идет параллельно с уменьшением концентраций специфических антител в данной популяции. Концентрации антител быстрее снижаются у пациентов, находящихся на гемодиализе, чем у здоровых субъектов. Быстрому снижению уровней антител у пациентов сESRD может быть противопоставлено применение бустерных доз вакцины. Рассчитано, что минимальный уровень защитных антител у пациентов с ESRD составляет приблизительно 80 мкг/мл, что на 2-3 порядка выше, чем уровни защитных антител против CPS Haemophilusinfluenzae типа b и Streptococcus pneumoniae (0,15 и 1 мкг/мл, соответственно). Разница в уровне защитных антител может быть связана у пациентов с ESRD с нарушенной функцией фагоцитов и основным заболеванием. Таким образом, определение уровня защитных антител для данной популяции пациентов заменяет данные по клинической эффективности данной вакцины у других пациентов из группы риска. Назальное носительство связано с повышенным риском бактериемии, вызываемой S. aureus, у пациентов, находящихся на гемодиализе. S. aureus является наиболее распространенным патогеном, инфицирующим область сосудистого доступа, и наиболее частой причиной бактериемии, связанных с доступом. Несмотря на небольшое число, назальное носительство, по-видимому, приводит к повышенному риску появления бактериемии в контрольных группах, но не у вакцинированных субъектов. Это дает возможность предположить, что вакцинация защищает от повышенного риска инфекции S. aureus, ассоциированной с назальным носительством. На протяжении 40 недель после вакцинации бивалентная вакцина индуцирует статистически значимую защиту от всех форм бактериемии, вызываемых S. aureus. Эффективность возрастает после дополнительного введения других антигенов, в частности антигена типа 336. Вакцину на основе конъюгата CPS S. aureus типа 5 и типа 8 и рекомбинантного нетоксичного экзотоксина A Pseudomonas aeruginosa (rEPA) (StaphVAX) оценивают на безопасность, иммуногенность и эффективность в исследовании двойным слепым рандомизированным способом с контролем в виде плацебо на пациентах с конечной стадией почечного заболевания (ESRD), которых ведут на гемодиализе. Взрослым пациентам в 73 центрах гемодиализа делают однократную внутримышечную инъекцию либо вакцины (n=894), либо физиологического раствора (n=910). Антитела IgG к CPS типов 5 и 8 измеряют с интервалами в период до 2 лет и регистрируют эпизоды бактериемии, вызываемой S. aureus. Эффектив- 12006602 ность определяют путем сравнения уровня случаев бактериемии, вызываемой S. aureus, в группе, получающей вакцину, и в контрольных группах. Реакции на вакцину, как правило, слабые до средних, и большинство из них проходит в течение 2 дней. Каждый из типов CPS вызывает значительный ответ антител у 86% пациентов. К 40 неделям после вакцинации частота бактериемии, вызываемой S. aureus, составляет 11/892 в группе, получающей вакцину, и 26/906 в контрольных группах (по критерию человеко-времени эффективность оценивают как 57%,Р=0,02, доверительный интервал 95% составляет 10-81). Эффективность вакцины в более длительные периоды существенно не отличается от нуля. Установленный защитный уровень CPS-специфических IgG составляет приблизительно 80 мкг/мл. Конъюгированная вакцина дает иммунитет против бактериемии,вызываемой S. aureus, у пациентов, находящихся на гемодиализе в течение приблизительно 40 недель,после чего эффективность падает при параллельном снижении уровней антител. Содержание всех ссылок, упомянутых в данном контексте, включено в виде ссылки во всей их полноте. Возможно осуществление множества модификаций и вариаций способов и структур, описанных и проиллюстрированных в данном контексте, которые не выходят за рамки сущности и объема изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ защиты иммунокомпромиссного человека по меньшей мере от одной из стафилококковых и энтерококковых бактериальных инфекций, отличающийся тем, что иммунокомпромиссному человеку вводят вакцину, содержащую иммуноноситель и по меньшей мере один гликоконъюгат полисахаридного или гликопептидного бактериального поверхностного антигена, выбранный из группы, включающей гликоконъюгат полисахаридного антигена S. aureus типа 5 и/или типа 8,гликоконъюгат отрицательно заряженного стафилококкового полисахаридного антигена, который содержит -связанный гексозамин в качестве основного углеводного компонента и не содержит Oацетильные группы,гликоконъюгат стафилококкового гликопептидного антигена, который содержит аминокислоты иN-ацетилированный гексозамин в -конфигурации, не содержащий O-ацетильные группы и не содержащий гексозу,гликоконъюгат кислого стафилококкового полисахаридного антигена, который получен из изолятаS. epidermidis, агглютинирующего антисыворотку к АТСС 55254,гликоконъюгат антигена Е. faecalis, который содержит 2-ацетамидо-2-дезоксиглюкозу и рамнозу в молярном соотношении 1:2,гликоконъюгат антигена Е. faecalis, который содержит трисахаридный повтор, содержащий 6 дезоксисахар,гликоконъюгат антигена Е. faecium, который содержит 2-ацетамидо-2-дезоксигалактозу и галактозу в молярном соотношении 2:1,гликоконъюгат антигена Е. faecium, который реагирует с антителами к АТСС 202016, и гликоконъюгат антигена Е. faecium, который реагирует с антителами к АТСС 202017, в количестве,эффективном для обеспечения защиты от инфекции. 2. Способ по п.1, отличающийся тем, что указанная вакцина содержит гликоконъюгат по меньшей мере одного полисахаридного антигена S. aureus, выбранного из группы, включающей тип 5 и тип 8. 3. Способ по п.1, отличающийся тем, что указанная вакцина содержит гликоконъюгаты полисахаридного антигена S. aureus как типа 5, так и типа 8. 4. Способ по п.1, отличающийся тем, что указанная вакцина содержит полисахаридный антиген, содержащий -связанный гексозамин, не имеющий O-ацетильных групп, и специфически связывающийся с антителами к Staphylococcus aureus типа 336, депонированному под номером АТСС 55804. 5. Способ по п.4, отличающийся тем, что указанная вакцина дополнительно содержит гликоконъюгаты полисахаридного антигена S. aureus типа 5 и типа 8. 6. Способ по п.1, отличающийся тем, что указанная вакцина содержит кислый полисахаридный антиген, который получен из изолята S. epidermidis, агглютинирующего антисыворотку к АТСС 55254. 7. Способ по п.1, отличающийся тем, что указанная вакцина содержит стафилококковый гликопептидный антиген, содержащий аминокислоты и N-ацетилированный гексозамин в -конфигурации, не содержащий O-ацетильные группы и не содержащий гексозу. 8. Способ по п.1, отличающийся тем, что указанная вакцина на основе полисахаридного гликоконъюгата содержит антиген Е. faecalis, содержащий 2-ацетамидо-2-дезоксиглюкозу и рамнозу в молярном соотношении 1:2. 9. Способ по п.1, отличающийся тем, что указанная вакцина на основе полисахаридного гликоконъюгата содержит антиген Е. faecalis, который имеет трисахаридный повтор, содержащий 6-дезоксисахар. 10. Способ по п.1, отличающийся тем, что указанная вакцина на основе полисахаридного гликоконъюгата содержит антиген Е. faecium, содержащий 2-ацетамидо-2-дезоксигалактозу и галактозу в молярном соотношении 2:1.- 13006602 11. Способ по п.1, отличающийся тем, что указанный бактериальный поверхностный антиген является капсулярным полисахаридным антигеном. 12. Способ по п.1, отличающийся тем, что указанный бактериальный поверхностный антиген является антигеном на основе тейхоевой кислоты. 13. Способ по п.1, отличающийся тем, что указанный бактериальный поверхностный антиген является гликопептидным антигеном. 14. Способ по п.1, отличающийся тем, что указанный иммунокомпромиссный человек выбран из группы, состоящей из пациентов с конечной стадией почечного заболевания (ESRD), онкологических больных, проходящих терапию иммунодепрессантами, больных СПИДом, пациентов с диабетом, новорожденных, пожилых людей в лечебных учреждениях для больных, нуждающихся в постоянном уходе,пациентов с аутоиммунным заболеванием, проходящих терапию иммунодепрессантами, больных после трансплантации, пациентов, проходящих инвазивные хирургические процедуры, oжoговых больных и других пациентов в отделениях неотложной помощи. 15. Способ по п.1, отличающийся тем, что указанный иммунокомпромиссный человек страдает от конечной стадии заболевания почек. 16. Способ по п.1, отличающийся тем, что указанный иммунокомпромиссный человек является новорожденным. 17. Способ по п.1, отличающийся тем, что указанный иммуноноситель представлен дифтерийным токсоидом, столбнячным токсоидом, их полученными рекомбинантным путем генетически детоксифицированными вариантами, или полученным рекомбинантным путем нетоксичным мутантом экзотоксинаA Pseudomonas aeruginosa, или стафилококковым экзотоксином или токсоидом. 18. Способ по п.1, отличающийся тем, что указанная вакцина дополнительно содержит адъювант или иммуностимулятор. 19. Способ по п.1, отличающийся тем, что указанная вакцина дополнительно содержит -глюкан или гранулоцитарный колониестимулирующий фактор. 20. Способ по любому из пп.1-3, отличающийся тем, что указанную вакцину вводят в количестве,достаточном для снижения бактериемии по меньшей мере на 57%. 21. Способ по п.2 или 3, отличающийся тем, что указанная вакцина содержит по меньшей мере 75 мкг антигена типа 5. 22. Способ по п.2 или 3, отличающийся тем, что указанная вакцина содержит по меньшей мере 55 мкг антигена типа 8. 23. Способ по п.2 или 3, отличающийся тем, что указанная вакцина содержит по меньшей мере 100 мкг антигена типа 5. 24. Способ по п.2 или 3, отличающийся тем, что указанная вакцина содержит по меньшей мере 100 мкг антигена типа 8. 25. Способ по п.3, отличающийся тем, что указанная вакцина содержит по меньшей мере 75 мкг антигена типа 5 и 55 мкг антигена типа 8. 26. Способ по п.3, отличающийся тем, что указанная вакцина содержит по меньшей мере 100 мкг антигена типа 5 и 100 мкг антигена типа 8. 27. Применение по меньшей мере одного гликоконъюгата полисахаридного или гликопептидного бактериального поверхностного антигена, выбранного из группы, включающей гликоконъюгат полисахаридного антигена S. aureus типа 5 и/или типа 8,гликоконъюгат отрицательно заряженного стафилококкового полисахаридного антигена, который содержит -связанный гексозамин в качестве основного углеводного компонента и не содержит O-ацетильные группы,гликоконъюгат стафилококкового гликопептидного антигена, который содержит аминокислоты иN-ацетилированный гексозамин в -конфигурации, не содержащий O-ацетильные группы и не содержащий гексозу,гликоконъюгат кислого стафилококкового полисахаридного антигена, который получен из изолятаS. epidermidis, агглютинирующего антисыворотку к АТСС 55254,гликоконъюгат антигена Е. faecalis, который содержит 2-ацетамидо-2-дезоксиглюкозу и рамнозу в молярном соотношении 1:2,гликоконъюгат антигена Е. faecalis, который содержит трисахаридный повтор, содержащий 6 дезоксисахар,гликоконъюгат антигена Е. faecium, который содержит 2-ацетамидо-2-дезоксигалактозу и галактозу в молярном соотношении 2:1,гликоконъюгат антигена Е. faecium, который реагирует с антителами к АТСС 202016, и гликоконъюгат антигена Е. faecium, который реагирует с антителами к АТСС 202017,на иммуноносителе и в количестве, эффективном для обеспечения защиты от инфекции, в качестве средства для получения вакцины для защиты иммунокомпромиссных субъектов по меньшей мере от одной из стафилококковых и энтерококковых бактериальных инфекций.- 14006602 28. Применение по п.27 для получения вакцины, снижающей бактериемию у иммунокомпромиссных субъектов. 29. Применение по п.27 для получения вакцины, содержащей гликоконъюгат полисахаридного антигена S. aureus типа 5 и/или типа 8. 30. Применение по п.27 для получения вакцины, содержащей гликоконъюгаты полисахаридного антигена S. aureus как типа 5, так и типа 8. 31. Применение по п.29 или 30 для получения вакцины, содержащей по меньшей мере 75 мкг антигена типа 5. 32. Применение по п.28 или 29 для получения вакцины, содержащей по меньшей мере 55 мкг антигена типа 8. 33. Применение по п.28 или 29 для получения вакцины, содержащей по меньшей мере 100 мкг антигена типа 5. 34. Применение по п.28 или 29 для получения вакцины, содержащей по меньшей мере 100 мкг антигена типа 8. 35. Применение по п.29 для получения вакцины, содержащей по меньшей мере 75 мкг антигена типа 5 и 55 мкг антигена типа 8. 36. Применение по п.29 для получения вакцины, содержащей по меньшей мере 100 мкг антигена типа 5 и по меньшей мере 100 мкг антигена типа 8. 37. Применение по п.27 для получения вакцины, содержащей гликоконъюгат отрицательно заряженного стафилококкового полисахаридного антигена, включающего в качестве основного углеводного компонента -связанный гексозамин и не имеющего O-ацетильных групп. 38. Применение по п.27 для получения вакцины, содержащей кислый полисахаридный антиген, который получен из изолята S. epidermidis, агглютинирующего антисыворотку к АТСС 55254. 39. Применение по п.27 для получения вакцины, содержащей стафилококковый гликопептидный антиген, включающий аминокислоты и N-ацетилированный гексозамин в -конфигурации, не содержащий O-ацетильные группы и не содержащий гексозу. 40. Применение по п.27 для получения вакцины для защиты иммунокомпромиссного субъекта,имеющего конечную стадию почечного заболевания, СПИД или диабет. 41. Применение по п.27 для получения вакцины для защиты иммунокомпромиссного субъекта, являющегося пациентом, проходящим терапию иммунодепрессантами. 42. Применение по п.27 для получения вакцины для защиты иммунокомпромиссного субъекта, являющегося пожилым человеком, находящимся в лечебном учреждении для больных, нуждающихся в постоянном уходе. 43. Применение по п.27 для получения вакцины для защиты иммунокомпромиссного субъекта, являющегося пациентом после трансплантации или ожоговым больным. 44. Набор, содержащий вакцину, которая содержит иммуноноситель и по меньшей мере один гликоконъюгат полисахаридного или гликопептидного бактериального поверхностного антигена, выбранный из группы, включающей гликоконъюгат полисахаридного антигена S. аurеus типа 5 и/или типа 8,гликоконъюгат отрицательно заряженного стафилококкового полисахаридного антигена, который содержит -связанный гексозамин в качестве основного углеводного компонента и не содержит O-ацетильные группы,гликоконъюгат стафилококкового гликопептидного антигена, который содержит аминокислоты иN-ацетилированный гексозамин в -конфигурации, не содержащий O-ацетильные группы и не содержащий гексозу,гликоконъюгат кислого стафилококкового полисахаридного антигена, который получен из изолятаS. epidermidis, агглютинирующего антисыворотку к АТСС 55254,гликоконъюгат антигена Е. faecalis, который содержит 2-ацетамидо-2-дезоксиглюкозу и рамнозу в молярном соотношении 1:2,гликоконъюгат антигена Е. faecalis, который содержит трисахаридный повтор, содержащий 6 дезоксисахар,гликоконъюгат антигена Е. faecium, который содержит 2-ацетамидо-2-дезоксигалактозу и галактозу в молярном соотношении 2:1,гликоконъюгат антигена Е. faecium, который реагирует с антителами к АТСС 202016, и гликоконъюгат антигена Е. faecium, который реагирует с антителами к АТСС 202017,а также инструкции по введению вакцины иммунокомпромиссному субъекту. 45. Набор по п.44, отличающийся тем, что данные инструкции определяют введение первой и второй доз вакцины по указанной схеме. 46. Набор по п.44, отличающийся тем, что указанная вакцина содержит гликоконъюгат полисахаридного антигена S. aureus типа 5 и/или типа 8.- 15006602 47. Набор по п.44, отличающийся тем, что указанная вакцина содержит гликоконъюгаты полисахаридного антигена S. aureus как типа 5, так и типа 8. 48. Набор по п.44, отличающийся тем, что указанная вакцина содержит по меньшей мере 75 мкг антигена типа 5. 49. Набор по п.44, отличающийся тем, что указанная вакцина содержит по меньшей мере 55 мкг антигена типа 8. 50. Набор по п.44, отличающийся тем, что указанная вакцина содержит по меньшей мере 100 мкг антигена типа 5. 51. Набор по п.44, отличающийся тем, что указанная вакцина содержит по меньшей мере 100 мкг антигена типа 8. 52. Набор по п.44, отличающийся тем, что указанная вакцина содержит по меньшей мере 75 мкг антигена типа 5 и 55 мкг антигена типа 8. 53. Набор по п.44, отличающийся тем, что указанная вакцина содержит по меньшей мере 100 мкг антигена типа 5 и по меньшей мере 100 мкг антигена типа 8. 54. Набор по п.44, отличающийся тем, что указанная вакцина содержит гликоконъюгат отрицательно заряженного стафилококкового полисахаридного антигена, содержащего в качестве основного углеводного компонента -связанный гексозамин и не имеющего O-ацетильных групп. 55. Набор по п.44, отличающийся тем, что указанная вакцина содержит кислый полисахаридный антиген, который получен из изолята S. epidermidis, агглютинирующего антисыворотку к АТСС 55254. 56. Набор по п.44, отличающийся тем, что указанная вакцина содержит стафилококковый гликопептидный антиген, содержащий аминокислоты и N-ацетилированный гексозамин в -конфигурации, не содержащий O-ацетильные группы и не содержащий гексозу. 57. Набор по п.44, отличающийся тем, что указанные инструкции определяют применение к субъекту с конечной стадией почечного заболевания, СПИДом или диабетом. 58. Набор по п.44, отличающийся тем, что указанные инструкции определяют применение к пациенту, который проходит терапию иммунодепрессантами. 59. Набор по п.44, отличающийся тем, что указанные инструкции определяют применение к пожилому человеку, находящемуся в лечебном учреждении для больных, нуждающихся в постоянном уходе. 60. Набор по п.44, отличающийся тем, что указанные инструкции определяют применение к пациенту после трансплантации или ожоговому больному. 61. Способ по п.1, отличающийся тем, что указанный иммунокомпромиссный субъект характеризуется назальным носительством. 62. Способ по п.1, отличающийся тем, что указанный иммунокомпромиссный субъект имеет гетерологичный имплантированный доступ. 63. Применение по п.27 для получения вакцины для защиты иммунокомпромиссного субъекта, характеризующегося назальным носительством. 64. Применение по п.27 для получения вакцины для защиты иммунокомпромиссного субъекта,имеющего гетерологичный имплантированный доступ. 65. Набор по п.44, отличающийся тем, что указанные инструкции определяют применение к субъекту с назальным носительством. 66. Набор по п.44, отличающийся тем, что указанные инструкции определяют применение к субъекту с гетерологичным имплантированным доступом.
МПК / Метки
МПК: A61P 37/04, A61K 39/085, A61K 39/116, A61K 39/385
Метки: субъекта, стафилококковых, защиты, вакцин, применение, энтерококковых, инфекций, бактериальных, иммунокомпромиссного
Код ссылки
<a href="https://eas.patents.su/17-6602-primenenie-stafilokokkovyh-i-enterokokkovyh-vakcin-dlya-zashhity-immunokompromissnogo-subekta-ot-bakterialnyh-infekcijj.html" rel="bookmark" title="База патентов Евразийского Союза">Применение стафилококковых и энтерококковых вакцин для защиты иммунокомпромиссного субъекта от бактериальных инфекций</a>
Предыдущий патент: Растворимый рецептор т- клетки
Следующий патент: Пептиды, эффективные в лечении опухолей и других заболеваний, требующих удаления или разрушения клеток
Случайный патент: Растягивающийся зажим