Применение альфа-кетоглутаровой кислоты и ее солей для улучшения эластичности кровеносных сосудов
Формула / Реферат
1. Применение по меньшей мере одного вещества, выбираемого из группы, состоящей из:
a) альфа-кетоглутаровой кислоты и
b) фармацевтически приемлемых солей альфа-кетоглутаровой кислоты,
для изготовления фармацевтического препарата, или продукта питания, или пищевой добавки для улучшения эластичности кровеносных сосудов у нуждающегося в этом субъекта.
2. Применение по п.1, при котором кровеносным сосудом является артерия.
3. Применение по любому из вышеприведенных пунктов, при котором субъект нуждается в лечении и/или профилактике гипертензии, легочной гипертензии, заболевания сосудов сетчатки глаза, желудочковой гипертрофии или артериальной аневризмы.
4. Применение по любому из вышеприведенных пунктов, при котором субъект подвергался хирургической операции на желудке.
5. Применение по п.4, при котором операция на желудке представляет собой шунтирование желудка, резекцию желудка, частичную резекцию желудка или бандажирование желудка.
6. Применение по любому из вышеприведенных пунктов, при котором субъект страдает от состояний, включающих нарушение питания.
7. Применение по любому из вышеприведенных пунктов, при котором субъект является пожилым.
8. Применение по любому из вышеприведенных пунктов, при котором применяют альфа-кетоглутаровую кислоту или ее соли щелочного или щелочно-земельного металла или их комбинацию.
9. Применение по п.8, где указанная соль альфа-кетоглутаровой кислоты представляет собой альфа-кетоглутарат натрия или альфа-кетоглутарат кальция.
10. Способ улучшения эластичности кровеносных сосудов у нуждающегося в этом субъекта, который включает введение эффективного количества по меньшей мере одного вещества, выбираемого из группы, состоящей из:
a) альфа-кетоглутаровой кислоты и
b) фармацевтически приемлемых солей альфа-кетоглутаровой кислоты.
11. Способ по п.10, в котором кровеносным сосудом является артерия.
12. Способ по п.10, в котором субъект нуждается в лечении и/или профилактике гипертензии, легочной гипертензии, заболевания сосудов сетчатки глаза, желудочковой гипертрофии или артериальной аневризмы.
13. Способ по п.10, в котором субъект подвергался хирургической операции на желудке.
14. Способ по п.13, в котором операция на желудке представляет собой шунтирование желудка, резекцию желудка, частичную резекцию желудка или бандажирование желудка.
15. Способ по п.10, в котором субъект страдает от состояний, включающих нарушение питания.
16. Способ по п.10, в котором субъект является пожилым.
17. Способ по любому из пп.10-16, в котором вводят альфа-кетоглутаровую кислоту или ее соли щелочного или щелочно-земельного металла или их комбинацию.
18. Способ по п.17, в котором применяют альфа-кетоглутарат натрия или альфа-кетоглутарат кальция.
19. Способ по п.10, в котором вводимая доза находится в интервале от 1 до 1000 мг вещества/кг массы тела в день.
20. Способ по п.19, в котором вводимая доза находится в интервале от 10 до 400 мг вещества/кг массы тела в день.
21. Способ по п.20, в котором вводимая доза находится в интервале от 10 до 100 мг вещества/кг массы тела в день.
Текст
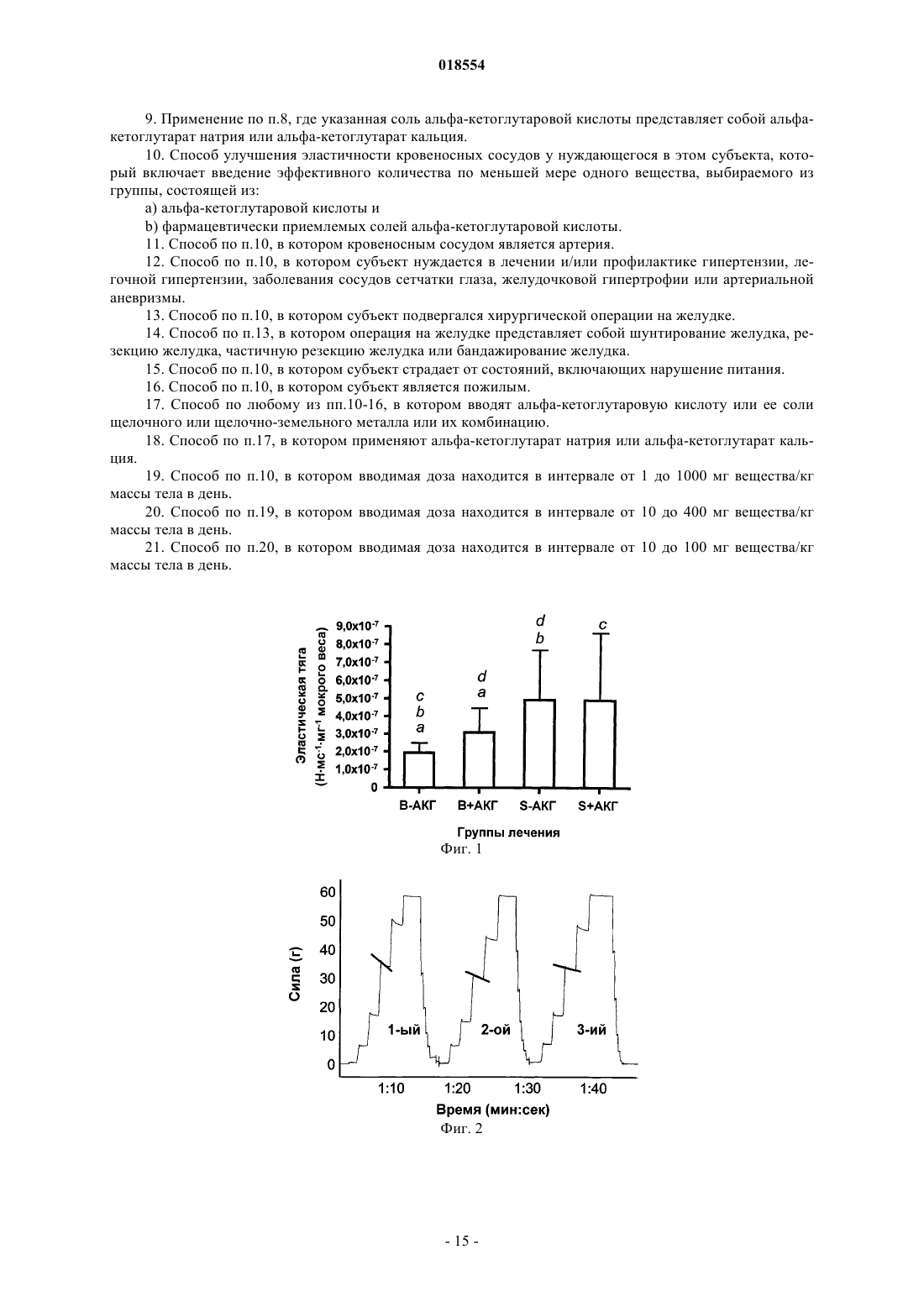
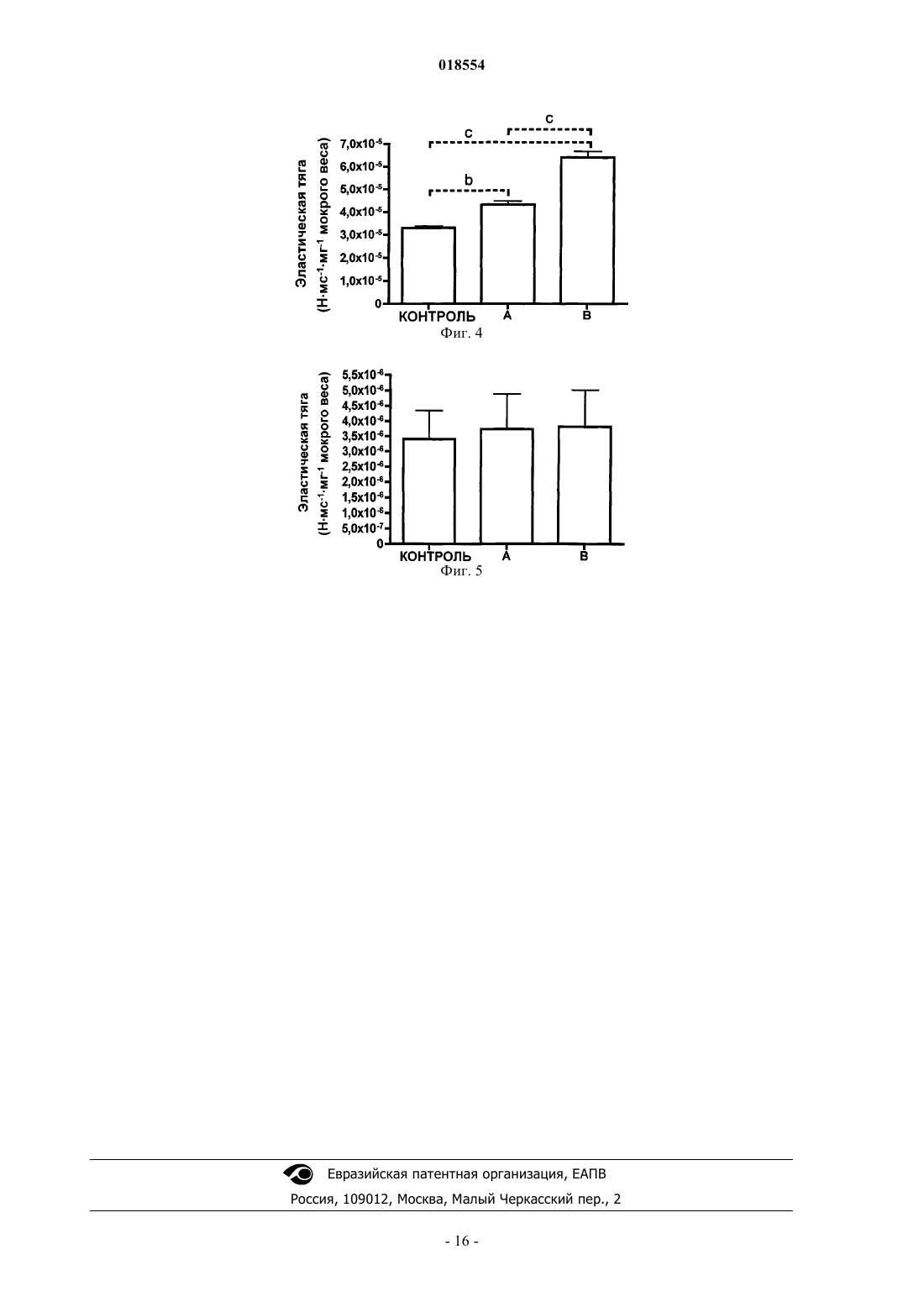
ПРИМЕНЕНИЕ АЛЬФА-КЕТОГЛУТАРОВОЙ КИСЛОТЫ И ЕЕ СОЛЕЙ ДЛЯ УЛУЧШЕНИЯ ЭЛАСТИЧНОСТИ КРОВЕНОСНЫХ СОСУДОВ Изобретение относится к новому применению альфа-кетоглутарата и его солей для изготовления фармацевтического препарата, или продукта питания, или пищевой добавки для терапевтического улучшения in vivo эластичности кровеносного сосуда, в частности эластичности артерий у нуждающегося в этом субъекта. Улучшение эластичности кровеносного сосуда можно использовать для лечения и/или профилактики гипертензии, легочной гипертензии, сердечнососудистого заболевания, заболевания сосудов сетчатки глаза, сердечной недостаточности,атеросклероза, желудочковой гипертрофии, инсульта, артериальной аневризмы, почечной недостаточности, нефросклероза и болезней, связанных с гипертензией. Область изобретения Настоящее изобретение относится к новому применению известных фармакологически активных химических соединений. Более конкретно, настоящее изобретение относится к новому применению альфа-кетоглутаровой кислоты, ее фармацевтически приемлемых солей или их комбинации для изготовления фармацевтического препарата, или продукта питания, или пищевой добавки, чтобы достигнуть invivo терапевтического улучшения эластичности кровеносных сосудов, в частности эластичности артерий, у нуждающегося в этом субъекта. Уровень техники Операции на желудке. В связи с устойчивым ростом ожирения в западном мире все более привлекательными становятся перспективы инвазивных способов снижения веса в качестве средства сокращения смертности и улучшения сопутствующих состояний. В действительности, некоторые являются сторонниками такого способа как единственного приемлемого способа снижения веса на основании опубликованного в 1992 г. Национальным институтом здравоохранения (NIH) сообщения, утверждающего, что степень успеха нехирургических подходов у пациентов с ожирением составляет 5% или меньше. Указывается, что операции по шунтированию желудка приводят к снижению излишней массы тела на 70% при долгосрочной потере веса на протяжении 10-14 лет. Согласно недавним сообщениям Coates и ее коллег предполагается, что инвазивные процедуры, например шунтирование желудка, оказывают влияние на состояние скелета. В исследовании 25 пациентов,перенесших операцию по шунтированию желудка, было выявлено значительное повышение уровня маркеров ремоделирования кости и уменьшение минеральной плотности костной ткани вертела бедренной кости. Также известно, что операция по шунтированию желудка обладает полезным эффектом в плане снижения гипертензии, обычно выявляемой у пациентов с патологическим ожирением. При наблюдении 67 пациентов с патологическим ожирением, у которых диагностирована гипертензия (артериальное давление (АД) 160/90 мм рт. ст.), было обнаружено, что у 44 человек (66%) хирургическое шунтирование желудка устраняло гипертензию, выявленную перед операцией. Эластичность кровеносных сосудов при заболевании. Достаточно давно обнаружено, что эластичность кровеносных сосудов, в частности эластичность артерий, вовлечена в патологическое состояние гипертензии и связанные с ней состояния. Было показано, что аортальная ригидность является независимым прогностическим фактором развития гипертензии у субъектов, не страдающих повышенным артериальным давлением, а именно, что аортальная ригидность является фактором риска развития гипертензии и не зависит от других известных факторов риска(Dernellis and Panaretou, Hypertension, 2005; 45:426-431). Заболевание сосудов сетчатки глаза может развиваться по причине гипертензической ретинопатии, в свою очередь вызванной системной гипертензией. Легочной гипертензией (ЛГ) является повышение кровяного давления в легочной артерии, легочной вене или в легочных капиллярах, в совокупности называемых легочной сосудистой системой, и такое повышение приводит к одышке, головокружению, обморокам и другим симптомам, все из которых усиливаются при физической нагрузке. В зависимости от причины легочная гипертензия может представлять собой тяжелое заболевание со значительным снижением толерантности к физической нагрузке и может приводить к правосторонней сердечной недостаточности. Легочная артериальная гипертензия(группа I по классификации ВОЗ) охватывает вазоконстрикцию или сжатие кровеносных сосудов, связанных с легкими и входящих в легочную сосудистую систему. Сердцу становится тяжелее прокачивать кровь через легкие. С течением времени кровеносные сосуды, вовлеченные в процесс, известный как фиброз, одновременно становятся ригидными и утолщаются. Это приводит к дополнительному повышению кровяного давления в легких и нарушению циркуляции крови. Дополнительно, увеличенная функциональная нагрузка на сердце может вызывать гипертрофию правого желудочка, что может прогрессировать до правожелудочковой недостаточности. Аневризма (или расширение сосуда) представляет собой локальное расширение кровеносного сосуда (выпячивание, подобное надутому шарику), наполненное кровью, причиной которого является заболевание или ослабление стенки сосуда. Аневризмы обычно обнаруживаются в артериях основания мозга(Вилизиев круг) и в аорте (основная артерия, выходящая из сердца), так называемая аневризма аорты. Выпячивание в кровеносном сосуде в любой момент может разорваться и привести к болезни или смерти. По мере увеличения аневризмы возрастает вероятность ее разрыва. Существуют способы (консервативные и хирургические) лечения гипертензии, легочной гипертензии, желудочковой гипертрофии и аневризмы, но остается потребность в улучшенных способах лечения,имеющих более высокую эффективность, и/или меньше побочных эффектов, и/или лучшие показатели стоимости. Сущность изобретения Автор настоящего изобретения показал изменения свойств эластичности артерий у людей с ожирением после проведения у них хирургической операции на желудке. Операция шунтирования изменяет усвоение питательных веществ, что влияет на структуру артерий, и отмечено подобное влияние на кост-1 018554 ную систему при неблагоприятных последствиях для эластичности и прочности артерий. Вместе с тем,отсутствуют сообщения о каком-либо эффективном лечении указанных отрицательных эффектов. Следовательно, выявлена неудовлетворенная потребность в предотвращении указанных отрицательных эффектов операции на желудке. Кроме того, также было выявлено, что такое же лечение можно применять у других субъектов, нуждающихся в улучшении эластичности кровеносных сосудов, например у пожилых субъектов. Таким образом, настоящее изобретение относится к применению по меньшей мере одного вещества, выбираемого из группы, состоящей из нижеперечисленного:b) фармацевтически приемлемые соли альфа-кетоглутаровой кислоты,для изготовления фармацевтического препарата, или продукта питания, или пищевой добавки для улучшения эластичности кровеносного сосуда у нуждающегося в этом субъекта. Кровеносным сосудом предпочтительно является артерия. В некоторых вариантах осуществления субъект нуждается в лечении и/или профилактике гипертензии, легочной гипертензии, сердечно-сосудистого заболевания, заболевания сосудов сетчатки глаза, сердечной недостаточности, атеросклероза, желудочковой гипертрофии, инсульта, артериальной аневризмы,почечной недостаточности, нефросклероза или болезней, связанных с гипертензией. В одном варианте осуществления настоящее изобретение относится к применению по меньшей мере одного вещества, выбираемого из группы, состоящей из альфа-кетоглутаровой кислоты (АКГ) и фармацевтически приемлемых солей альфа-кетоглутаровой кислоты, для изготовления фармацевтического препарата, или продукта питания, или пищевой добавки для лечения отрицательного влияния на эластичность и прочность кровеносных сосудов у людей при состояниях, включающих в себя нарушение питания, у людей после операции на желудке или у пожилых людей. Согласно дополнительным вариантам осуществления операции на желудке представляют собой шунтирование желудка, резекцию желудка, частичную резекцию желудка или бандажирование желудка. Согласно дополнительным вариантам осуществления применяют альфа-кетоглутаровую кислоту или ее соль щелочных или щелочно-земельных металлов либо их комбинации. Согласно одному варианту осуществления настоящего изобретения используется альфакетоглутарат натрия. Согласно другому варианту осуществления используется альфа-кетоглутарат кальция. Согласно дополнительным вариантам осуществления доза, которую в способе настоящего изобретения вводят пациенту, находится в интервале от 1 до 1000 мг/кг, от 10 до 400 мг/кг или от 10 до 100 мг вещества на 1 кг массы тела в день. В другом аспекте настоящего изобретения представлен способ лечения для улучшения эластичности кровеносных сосудов у нуждающегося в этом субъекта, при этом способ предусматривает введение нуждающемуся в этом субъекту эффективного количества по меньшей мере одного вещества, выбираемого из группы, состоящей из нижеперечисленного:b) фармацевтически приемлемые соли альфа-кетоглутаровой кислоты. Кровеносным сосудом предпочтительно является артерия. Субъект, которому назначают лечение, может нуждаться в лечении и/или профилактике гипертензии, легочной гипертензии, сердечно-сосудистого заболевания, заболевания сосудов сетчатки глаза, сердечной недостаточности, атеросклероза, желудочковой гипертрофии, инсульта, артериальной аневризмы,почечной недостаточности, нефросклероза или болезней, связанных с гипертензией. Согласно настоящему изобретению было неожиданно выявлено, что альфа-кетоглутаровая кислота(АКГ) и фармацевтически приемлемые соли альфа-кетоглутаровой кислоты можно использовать для терапевтического лечения in vivo отрицательного влияния на эластичность и прочность кровеносных сосудов у людей после хирургической операции на желудке. Согласно дополнительным вариантам осуществления операции на желудке представляют собой шунтирование желудка, резекцию желудка, частичную резекцию желудка или бандажирование желудка. В дополнительном варианте осуществления настоящее изобретение относится к способу лечения отрицательного влияния на эластичность и прочность кровеносных сосудов у людей после хирургической операции на желудке, при этом способ предусматривает введение субъекту, нуждающемуся в таком лечении или профилактике, эффективного количества по меньшей мере одного вещества, выбираемого из группы, состоящей из альфа-кетоглутаровой кислоты (АКГ) и фармацевтически приемлемых солей альфа-кетоглутаровой кислоты. Согласно дополнительным вариантам осуществления операции на желудке представляют собой шунтирование желудка, резекцию желудка, частичную резекцию желудка или бандажирование желудка. В дополнительном варианте осуществления настоящее изобретение относится к способу лечения отрицательного влияния на эластичность и прочность кровеносных сосудов у людей при состояниях,включающих в себя нарушение питания или у пожилых людей, при этом способ предусматривает введение субъекту, нуждающемуся в таком лечении или профилактике, эффективного количества по меньшей мере одного вещества, выбираемого из группы, состоящей из альфа-кетоглутаровой кислоты (АКГ) и фармацевтически приемлемых солей альфа-кетоглутаровой кислоты. Согласно дополнительным вариантам осуществления применяют альфа-кетоглутаровую кислоту или ее соль щелочных или щелочно-земельных металлов либо их комбинации. Согласно одному варианту осуществления настоящего изобретения используется альфакетоглутарат натрия. Согласно другому варианту осуществления используется альфа-кетоглутарат кальция. Согласно дополнительным вариантам осуществления доза, которую в способе настоящего изобретения вводят пациенту, находится в интервале от 1 до 1000 мг/кг, от 10 до 400 мг/кг или от 10 до 100 мг вещества на 1 кг массы тела в день. Краткое описание чертежей Далее приведено описание настоящего изобретения с дополнительным объяснением при помощи предпочтительных вариантов осуществления, примеров исследований и прилагаемых чертежей. Фиг. 1 показывает регистрацию эластической тяги участков аорты у крыс после шунтирования (В) и после мнимой операции (S) при введении АКГ (+АКГ) или носителя (-АКГ). Регистрацию осуществляли с датчиком силы, присоединенным к аналого-цифровому преобразователю (АЦП) со скоростью осуществления выборки 1000 замеров в 1 с. Каждая точка представляет среднее значениестандартная ошибка SE. Приведены значительные отличия между значениями: а и d=p0,05 и b=р 0,01, с=р=0,01. Животных разделяли на четыре группы следующим образом: В-АКГ, количество животных n=6, В+АКГn=11, S-АКГ n=12 и S+АКГ n=12. Фиг. 2 показывает типичную экспериментально зарегистрированную кривую для участка аорты, на которую воздействовали серией циклов растяжения и расслабления. Максимальное применяемое растяжение, измеренное на аорте крысы, составляло около 0,14% (диапазон 13-14 кПа). Обращает на себя внимание наклон кривой в 1-м цикле растяжения/расслабления по сравнению с наклоном кривых 2-го и 3-го циклов. Указанный наклон обозначает эластическую тягу(примерно 16% прилагаемого вручную усилия), естественную для участка аорты. Четко повторяемые циклы растяжения/расслабления в этом диапазоне приводят к сниженной эластичности. Фиг. 3 не показана. Фиг. 4 показывает первую серию растяжения: регистрацию эластической тяги участков аорты у мышей КОНТРОЛЯ и мышей после введения (А) Na-АКГ, а также (В) Са-АКГ. Регистрацию осуществляли с датчиком силы, присоединенным к аналого-цифровому преобразователю (АЦП) со скоростью осуществления выборки 1000 замеров/с. Каждая точка представляет собой среднее значение SE. Приведены значительные отличия между значениями: а=Р 0,05 и b=Р 0,01, с=Р 0,001. Животных разделяли на три группы с количеством n=6 для всех групп. Фиг. 5 показывает вторую серию растяжения: регистрацию эластической тяги участков аорты у контрольных мышей (КОНТРОЛЬ) и мышей после введения (А) Na-АКГ, а также (В) Са-АКГ. Регистрацию осуществляли с датчиком силы, присоединенным к аналого-цифровому преобразователю (АЦП) со скоростью осуществления выборки 1000 замеров/с. Каждая точка представляет собой среднее значениеSE. Приведены значительные отличия между значениями: а=Р 0,05 и b=Р 0,01, с=Р 0,001. Животных разделяли на три группы с количеством n=6 для всех групп. Подробное описание Задачей настоящего изобретения является обеспечение эффективного и безопасного лечения, которое можно применять для улучшения эластичности кровеносных сосудов у нуждающегося в этом субъекта. В предпочтительном варианте осуществления кровеносные сосуды, эластичность которых улучшают, являются артериями, но также согласно настоящему изобретению можно улучшать эластичность вен,капилляров, венул и артериол. Поскольку установлена связь между эластичностью кровеносных сосудов и, в частности, эластичностью артерий с гипертензией и легочной артериальной гипертензией, можно использовать представленный в настоящем изобретении способ лечения, улучшающий эластичность кровеносных сосудов, при изготовлении лекарства для лечения и/или профилактики гипертензии и легочной гипертензии. В свою очередь, известно, что гипертензия является этиологическим фактором сердечно-сосудистого заболевания, заболевания сосудов сетчатки глаза, сердечной недостаточности, атеросклероза, желудочковой гипертрофии, инсульта, артериальной аневризмы, почечной недостаточности, нефросклероза и других болезней. Аналогично, известно, что легочная артериальная гипертензия является этиологическим фактором гипертрофии правого желудочка. Таким образом, представленный способ лечения, улучшающий эластичность кровеносных сосудов, можно использовать при изготовлении лекарства для лечения и/или профилактики указанных болезней и состояний, для которых гипертензия и легочная артериальная гипертензия являются этиологическими факторами или факторами риска, а также при других болезнях и состояниях, для которых этиологическими факторами или факторами риска являются гипертензия и легочная артериальная гипертензия. Представленный способ лечения также можно использовать для изготовления лекарства для лечения и/или профилактики других состояний, при которых выявлено снижение эластичности кровеносных сосудов. Дополнительной задачей настоящего изобретения является обеспечение эффективного и безопасного лечения отрицательных эффектов операции на желудке на эластичность и прочность кровеносных сосудов. Термин "лечение" в разных грамматических формах согласно настоящему изобретению относится к предотвращению, излечению, изменению, уменьшению, облегчению, улучшению, устранению, сведению к минимуму, подавлению или прекращению отрицательных эффектов состояния, которое лечат. Выражение "отрицательные эффекты" в отношении хирургических операций на желудке в контексте настоящего изобретения относится к неблагоприятному влиянию на характеристики кровеносного сосуда, например на артериальную эластичность и/или прочность, которое выявляют после операции на желудке. Например, после операций по шунтированию желудка отмечено уменьшение эластичности артерий. Термин "нарушение питания" означает клиническое состояние, вызванное неподходящим или недостаточным рационом, обычно вследствие неадекватного потребления, плохого усвоения пищи или чрезмерной потери питательных веществ. Несмотря на надлежащую диету, возникают некоторые состояния, связанные с нарушением питания. Например, функция желудочно-кишечного тракта может ухудшаться по причине старческого возраста или другого заболевания. В таких случаях нарушение пищеварения может быть результатом, например, недостаточной или неправильной продукции в организме пищеварительных ферментов в желудке, кишечнике, поджелудочной железе и т.д.; неадекватной продукции желчи; неадекватным уровнем рН желудка (снижение выработки HCl) или обусловлено другими причинами. Атрофия ворсинок, обусловленная их разрушением, старческим возрастом, рационом (например, непереносимостью клейковины) или заболеванием, может быть прямой причиной нарушения питания из-за уменьшенного усвоения. Причиной нарушения питания также могут быть состояния, включающие в себя чрезмерное развитие микрофлоры или недостаточное количество кишечных бактерий. Существует ряд дополнительных причин нарушения питания, например раковые заболевания кишечника, хирургическое вмешательство, токсины, генетические, циркуляторные нарушения (кровеносной и лимфатической систем), анорексия и т.д. Нарушение питания и состояния, связанные с нарушением питания, в любом случае приводят к кахексии и снижению жизненных функций. Термин "пожилой" в контексте настоящего изобретения означает биологический возраст, когда возникает очевидность возрастной дегенерации организма (например, человека). У людей пожилой возраст можно определить как возраст старше 40 лет, предпочтительно возраст старше 50 лет, более предпочтительно возраст старше 60 лет или наиболее предпочтительно возраст старше 65 лет. Выражение "улучшение эластичности кровеносных сосудов" означает, что эластичность кровеносных сосудов возрастает, то есть сосуды становятся менее ригидными. Указанное выражение также охватывает увеличенный предел прочности сосудов. Примеры операций на желудке, входящих в объем настоящего изобретения, включают в себя без ограничения шунтирование желудка, резекцию желудка, частичную резекцию желудка и бандажирование желудка. Таким образом, согласно одному аспекту настоящего изобретения представлено новое применение по меньшей мере одного вещества, выбираемого из группы, состоящей из альфа-кетоглутаровой кислоты и ее фармацевтически приемлемой соли, фармацевтически приемлемых физических смесей альфакетоглутаровой кислоты или ее фармацевтически приемлемой соли для изготовления фармацевтического препарата, или продукта питания, или пищевой добавки для улучшения эластичности кровеносных сосудов в целях лечения и/или профилактики гипертензии, легочной гипертензии, сердечно-сосудистого заболевания, заболевания сосудов сетчатки глаза, сердечной недостаточности, атеросклероза, желудочковой гипертрофии, инсульта, артериальной аневризмы, почечной недостаточности, нефросклероза и болезней, связанных с гипертензией. В предпочтительном варианте осуществления действие фармацевтического препарата направлено на улучшение эластичности артерий. В одном варианте осуществления фармацевтический препарат действует на субъекты, которые подверглись операции на желудке. В одном варианте осуществления фармацевтический препарат действует на субъекты, страдающие состояниями, включающими в себя нарушение питания. В одном варианте осуществления фармацевтический препарат действует на субъекты пожилого возраста. Согласно одному варианту осуществления используют альфа-кетоглутаровую кислоту настоящего изобретения или ее соли щелочных или щелочно-земельных металлов либо их комбинации. Предпочтительно используют альфа-кетоглутарат натрия. Наиболее предпочтительно используют альфа-кетоглутарат кальция. Альфа-кетоглутарат натрия обеспечивает более быстрое усвоение после приема внутрь при более высоких максимальных уровнях в крови, тогда как альфа-кетоглутарат кальция имеет замедленное усвоение при более продолжительном эффекте после приема внутрь. Пример 2 пока-4 018554 зывает, что при некоторых состояниях альфа-кетоглутарат кальция дает лучший эффект по сравнению с альфа-кетоглутаратом натрия. В дополнительном аспекте настоящее изобретение относится к способу улучшения эластичности кровеносных сосудов в целях лечения и/или профилактики гипертензии, легочной гипертензии, сердечно-сосудистого заболевания, заболевания сосудов сетчатки глаза, сердечной недостаточности, атеросклероза, желудочковой гипертрофии, инсульта, артериальной аневризмы, почечной недостаточности,нефросклероза и болезней, связанных с гипертензией, при этом указанный способ предусматривает введение нуждающемуся в таком лечении или профилактике субъекту эффективного количества по меньшей мере одного вещества, выбираемого из группы, состоящей из альфа-кетоглутаровой кислоты и ее фармацевтически приемлемой соли, фармацевтически приемлемых физических смесей альфакетоглутаровой кислоты или ее фармацевтически приемлемой соли и по меньшей мере одной аминокислоты или ее фармацевтически приемлемой соли. Согласно некоторым вариантам осуществления субъект подвергался хирургической операции на желудке, страдает от состояния, связанного с нарушением питания, или находится в пожилом возрасте. Согласно некоторым вариантам осуществления указанных аспектов вводят альфа-кетоглутаровую кислоту или ее соли щелочных или щелочно-земельных металлов либо их комбинации. Предпочтительно вводят альфа-кетоглутарат натрия. Более предпочтительно вводят альфа-кетоглутарат кальция. Фармацевтические препараты действующего агента или агентов, используемых согласно настоящему изобретению, можно вводить позвоночным животным, включающим в себя млекопитающих и птиц, таких как грызуны, например мышь, крыса, морская свинка или кролик; птиц, таких как индейка,курица или цыпленок и других сельскохозяйственных и диких птиц; корова, лошадь, свинья или поросенок и другие сельскохозяйственные животные, собака, кошка и другие домашние животные, и, в частности, людям. Введение можно осуществлять разными способами в зависимости от вида позвоночного животного,которое лечат, при условии, что это позвоночное нуждается в указанных способах, и в зависимости от конкретных показаний к лечению. В одном варианте осуществления введение проводят в виде продукта питания или пищевой добавки, такой как диетическая добавка и/или ингредиент в виде твердого продукта питания и/или в виде напитка. Дополнительные варианты осуществления могут представлять собой суспензии или растворы,такие как напиток, дополнительно описанный ниже. Также возможен формат капсул или таблеток, таких как жевательные или растворимые, например шипучие таблетки, а также порошок и другие сухие формы, известные специалисту в данной области техники, такие как гранулы, например микрогранулы, и зерна. Введение можно осуществлять парентеральным, ректальным путем или приемом внутрь продукта или пищевой добавки, как указано выше. Парентеральные носители включают в себя раствор натрия хлорида, декстрозу Рингера, декстрозу и натрия хлорид, раствор Рингера с лактатом или жирные масла. Продукты питания или пищевые добавки также можно эмульгировать. Действующий терапевтический компонент или компоненты затем можно смешивать с наполнителями, которые являются фармацевтически приемлемыми и совместимыми с активным компонентом. Подходящими наполнителями являются, например, вода, солевой раствор, декстроза, глицерин, этанол или подобные вещества и их комбинации. Дополнительно, если желательно, композиция может содержать незначительное количество вспомогательных веществ, например увлажняющих или эмульгирующих агентов, рН, буферных агентов,которые увеличивают эффективность действующего компонента. Можно получать разные формы исходного продукта питания или пищевой добавки, такие как твердый пищевой продукт, жидкости или лиофилизированные или иным способом высушенные рецептуры. Они могут включать в себя разбавители разных буферов (например, Трис-HCl, ацетат, фосфат), уровня рН и ионной силы, добавки, такие как альбумин или желатин, для предотвращения поверхностной абсорбции, детергенты (например, Твин 20, Твин 80, Плуроник F68, соли желчной кислоты), солюбилизирующие агенты (например, глицерин, полиэтиленглицерол), антиокислители (например, аскорбиновая кислота, метабисульфит натрия), консерванты (например, тимеросал, бензиловый спирт, парабены), объемообразующие вещества или модификаторы тоничности (например, лактоза, маннит), ковалентное присоединение к композиции полимеров, таких как полиэтиленгликоль, комплексообразование с ионами металлов, или включение материала внутрь или на дисперсные рецептуры полимерных соединений, таких как полимолочная кислота, полигликолевая кислота, гидрогели и т.д., или на липосомы, микроэмульсии, мицеллы, однослойные или многослойные пузырьки, призраки эритоцитов или сферопласты. В одном варианте осуществления продукт питания или пищевая добавка употребляется в виде их напитка или сухой композиции любым из способов согласно изобретению. Напиток содержит эффективное количество их действующего компонента или компонентов вместе с приемлемым для употребления растворимым в воде носителем, таким как минералы, витамины, углеводы, жир и белки. Если напиток представлен в сухой форме, все из указанных компонентов поставляются в высушенном виде. Готовый к употреблению напиток дополнительно содержит воду. Конечный раствор напитка также может иметь регулируемую тоничность и кислотность, например, как буферный раствор, согласно общим предложениям вышеприведенного параграфа. Уровень рН находится предпочтительно в диапазоне примерно от 2 до 5 и, в частности, примерно от 2 до 4 для предотвращения бактериального и грибкового роста. Также можно использовать стерилизованный напиток с уровнем рН примерно от 6 до 8. Напиток может поставляться единственным или в комбинации с одной или больше терапевтически эффективной композицией. Согласно дополнительному варианту осуществления фармацевтические препараты в качестве лекарства для перорального и ректального применения могут быть в виде таблеток, пастилок, капсул, порошков, водных или масляных суспензий, сиропов, эликсиров, водных растворов и тому подобного, содержащих действующий компонент или компоненты в смеси с фармацевтически приемлемым носителем и/или добавками, такими как разбавители, консерванты, солюбилизаторы, эмульгаторы, адъюванты и/или носители, полезные для способов и применения, раскрытого в настоящем изобретении. Далее, используемые в настоящем изобретении "фармацевтически приемлемые носители" известны специалистам в данной области техники и могут включать в себя без ограничения 0,01-0,05 М фосфатный буфер или 0,8% солевой раствор. Дополнительно, такие фармацевтически приемлемые носители могут представлять собой водные или неводные растворы, суспензии и эмульсии. Примерами неводных растворителей являются пропиленгликоль, полиэтиленгликоль, растительные масла, такие как оливковое масло, и органические сложные эфиры для инъекций, такие как этилолеат. Водные носители включают в себя воду, спиртовые/водные растворы, эмульсии или суспензиии, включающие в себя солевые и буферные среды. Парентеральные носители включают в себя раствор натрия хлорида, декстрозу Рингера, декстрозу и натрия хлорид, раствор Рингера с лактатом или жирные масла. Также могут присутствовать консерванты и другие добавки, такие как, например, антибактериальные препараты, антиокислители,хелирующие агенты, инертные газы и тому подобное. В фармацевтически приемлемых физических смесях альфа-кетоглутаровой кислоты или ее соли по меньшей мере с одной аминокислотой указанная аминокислота или аминокислоты могут представлять собой любую из аминокислот, встречающихся в природе как компоненты в пептидах. То же самое относится к фармацевтически приемлемым физическим смесям альфа-кетоглутаровой кислоты или ее солям по крайней мере с одной аминокислотой. Предпочтительно аминокислоту или кислоты выбирают из группы, состоящей из аргинина, орнитина, лейцина, изолейцина и лизина. Указанные аминокислоты предпочтительно используют в их L-конфигурации. Примеры физических смесей альфа-кетоглутаровой кислоты или ее солей по меньшей мере с одной аминокислотой включают в себя без ограничения физические смеси по меньшей мере одного вещества,выбираемого из группы, состоящей из альфа-кетоглутаровой кислоты и ее натриевых, калиевых, кальциевых и магниевых солей с любым из глутамина, глутаминовой кислоты, аргинина, орнитина, лейцина,изолейцина, лизина и пролина и любыми комбинациями указанных аминокислот. Молярное соотношение альфа-кетоглутаровой кислоты или ее солей с аминокислотой или аминокислотами в указанных физических смесях обычно будет в диапазоне от 1:0,01 до 1:2, предпочтительно от 1:0,1 до 1:1,5 и наиболее предпочтительно от 1:0,2 до 1:1,0. Вводимая доза будет варьировать в зависимости от используемого действующего агента или агентов, состояния, которое будут лечить, возраста, пола, веса и т.д. пациента, которого будут лечить, но обычно будет в диапазоне от 1 до 1000 мг/кг массы тела в день или от 10 до 400 мг/кг массы тела в день,предпочтительно от 10 до 100 мг/кг массы тела в день. Упомянутые выше варианты осуществления можно свободно комбинировать друг с другом. Таким образом, детали и конкретные характеристики, описанные выше и в формуле изобретения, применяютmutatis mutandis к любым другим вариантам осуществления настоящего изобретения. Приведено описание настоящего изобретения в отношении некоторых раскрытых вариантов осуществления, но вместе с тем специалист в данной области техники может предвидеть другие варианты осуществления, изменения или комбинации, которые не упоминаются конкретно, но, тем не менее, входят в объем прилагаемой формулы изобретения. Все цитируемые в настоящем изобретении ссылки включены в него путем ссылки во всей их полноте. Предполагается, что выражение "содержащее", используемое в настоящем изобретении, необходимо понимать как включающее в себя без ограничения указанные позиции. Далее настоящее изобретение будет дополнено посредством примеров, которые не должны рассматриваться как ограничение объема изобретения. Примеры Пример 1. Целью настоящего исследования является 1) влияние на эластичность артерий операции шунтирования желудка у крыс, соединение пищевода с двенадцатиперстной кишкой, 2) отдаленные последствия указанной операции на артериальное давление и 3) какой-либо положительный эффект усвоения АКГ в отношении устранения любого изменения эластичности артерий, ставшего результатом операции шунтирования желудка. Подготовка животных и аорты. Использовались взрослые самцы крыс линии Sprague Dawley, размещенные в виварии Отдела сравнительной физиологии Лундского университета. Животные содержались при одинаковых условиях с циклом света и темноты 12/12 и имели массу тела 4795 г. Крыс кормили гранулами для грызунов adlibitum (алтромин 1314 Spezialfutterwerke, Lage, Германия) при свободном доступе к питьевой воде. Крыс разделяли на группы следующим образом: с операцией шунтирования без АКГ (В-АКГ) (n=6), с операцией шунтирования с АКГ (В+АКГ) (n=11), с мнимой операцией без АКГ (S-АКГ) (n=12), с мнимой операцией с АКГ (S+АКГ) (n=12). Крыс анестезировали воздействием 95% СО 2 и умерщвляли смещением шейных позвонков. Крыс забивали в соответствии с местными и национальными руководящими принципами. Иссеченный участок брюшной аорты, проксимальнее правой и левой общих подвздошных артерий,тщательно зачищали для удаления прилегающих тканей. Аорту нарезали примерно на 6-9-мм образцы с диаметром в покое 3-4 мм и каждый образец затем аккуратно прикрепляли к датчику силы с одного конца и с другого конца к металлической шпильке на элементе крепления, как частично описано в публикациях Harrison et al. Reprod Fertil Dev., 1997; 9(7):731-40, Harrison and Flatman Am J Physiol., 1999 Dec.; 277(6 Pt 2):R1646-53). Образцы аорты имели вес в диапазоне 8-25 мг (в среднем 14,32 мг) со средним диаметром 3,750,08 мм. Срезы аорты погружали в камеры с насыщенной кислородом атмосферой и регулируемой температурой (37 С) с внутренними размерами глубины и диаметра 5,5 и 3,2 см соответственно, содержащие 44 мл 0,15 М фосфатно-буферного раствора (ФБР с уровнем рН 7,4), содержащего, мМ: NaCl 136,91, KCl 2,68, Na2HPO4 8,08 и NaH2PO4 1,66. Силу измеряли с применением датчика перемещения силы FT03(Grass Instrument, West Warwick, RI), соединенного с мостовым усилителем собственного изготовления,который соединялся с аналого-цифровым преобразователем 8S PowerLab (AD Instruments, Chalgrove,Oxfordshire, Великобритания). Рабочий диапазон преобразователя составлял 0-0,05 кг с достоверной силой 2 мг, эквивалентной 0,004% функционального диапазона. АЦП PowerLab 8S был связан с программным обеспечением iBook G4 running Chart5 v.5.4 (AD Instruments, Австралия). Регистрацию данных проводили со скоростью осуществления выборки данных 40000 в 1 с (40 кГц), и входной импеданс усилителя составлял дифференциал 200 M. Измерения силы. Срезы аорты суспендировали вертикально и три раза. Регистрированный сигнал регулировали до нуля для нерастянутых участков аорты с помощью смещенной шкалы, установленной на узле перед усилителем. Затем каждый срез аорты подвергали примерно 5-кратному пошаговому увеличению натяжения(каждый шаг составлял около 0,09 Н) до достижения конечного максимального натяжения 0,49 Н (измеряемого с применением датчика силы FT03 Grass Force). Указанный конечный уровень натяжения ни в коем случае не был близок к физиологическому максимальному усилию, зарегистрированному в срезах аорты. Затем срезы аорты оставляли для полного расслабления перед дополнительным повторным воздействием пошагового увеличения натяжения еще дважды. После этого срезы аорты удаляли и взвешивали. Использовали скорость регистрации выборки данных 1000 в 1 с. Сразу после пошагового увеличения натяжения отмечали очень незначительное падение зарегистрированной кривой, поскольку ткань аорты проявляла степень эластической тяги. Это падение зарегистрированной кривой измеряли по отношению к единице времени. Вычисления натяжения. Уравнение Лапласа предполагает, что натяжение (Т) в стенке полого цилиндра непосредственно пропорционально радиусу цилиндра (r) и давлению (р) в стенке, создаваемому потоком в цилиндре, таким образом, что Т=рr. Если предполагается, что натяжение в стенке участка аорты эквивалентно натяжению, зарегистрированному датчиком силы как результат растяжения вручную, то давление, которое будет вызывать такое увеличение натяжения, можно вычислить, используя уравнение Лапласа и значения радиуса каждого участка аорты. Статистический анализ. Данные представлены как среднее значение SE. Различия между средними значениями проверяли на статистическую значимость с применением двустороннего критерия Стьюдента с дополнительным тестом на нормальное распределение Гаусса. Полученные данные имели нормальное распределение и равные дисперсии. Различия, показывающие значения Р 0,05, считались несущественными. Результаты. Измерения натяжения и давления. Обычно срезы аорты подвергали натяжению около 0,034 Н на 1 мг влажного веса при полном растяжении (максимальное натяжение 0,49 Н/средний вес ткани 14,32 мг). Таким образом, используя уравнение Лапласа и средний радиус аорты 1,87 мм, получали создаваемое давление, составлявшее порядка 0,018 кПа. Такое увеличение давления составляет 0,18% от обычного давления в человеческих артериях(10 кПа) и около 0,14% от измеренного давления у крыс (13-14 кПа) (Carroll et al., 2006; Duka et al., 2006). Среднее пошаговое увеличение натяжения вручную развивало 0,09 Н (4,9510-3 Н/мг влажного ве-7 018554 са), и обычно выявляли сокращение срезов аорты до показателя 0,015 Н, который составляет около 16% натяжения, приложенного вручную. Контрольные крысы с мнимой операцией. Эластичность аорты в контроле была значительно выше, чем у крыс с операцией шунтирования(Р=0,007; 1,910-70,210-7 Нмс-1 мг-1 влажного веса по сравнению с 4,910-70,8 10-7 Нмс-1 мг-1 влажного веса для групп В-АКГ и S-АКГ соответственно). Введение АКГ не имело какого-либо эффекта на указанное явление в группе контроля (Р=0,44). Крысы с операцией шунтирования. И с введением АКГ, и без него, у крыс с операцией шунтирования обнаружена более низкая эластичность аорты, чем у контрольных крыс (Р=0,037; 3,110-70,410-7 Нмс-1 мг-1 влажного веса по сравнению с 4,910-70,810-7 Нмс-1 мг-1 влажного веса для групп В+АКГ и S-АКГ соответственно). Введение АКГ имело значительный эффект у крыс с операцией шунтирования, увеличивая эластичность артерий до уровня между контрольными крысами и шунтированными крысами (В-АКГ); Р=0,047; 1,910-70,210-7 Нмс-1 мг-1 влажного веса по сравнению 3,110-70,410-7 Нмс-1 мг-1 влажного веса для групп В-АКГ и В+АКГ соответственно (см. фиг. 1). Серия растяжений. Во всех изученных артериях начальная серия растяжения (например, воздействие натяжения с последующим расслаблением) приводила к уменьшению эластичности при последующем воздействии натяжения. Этот эффект можно сравнить с видом повреждения, возникновение которого можно ожидать при внезапном повышении кровяного давления (см. фиг. 2). Обсуждение. Результаты этого исследования отчетливо показывают, что операция шунтирования желудка оказывает неблагоприятное влияние на эластичность артерий. Кроме того, насколько нам известно, это впервые полученные данные о возникновении серьезных изменений эластичности артерий в результате такой хирургической операции. Также показано, что подобное изменение происходит с растяжением и сопоставимо с внезапным повышением кровяного давления. Операция шунтирования желудка. Крысы с операцией шунтирования в этом эксперименте не страдали ожирением или не отличались чем-либо от группы контроля с мнимой операцией. Обе группы подвергали хирургическому вмешательству, таким образом любой стресс, связанный с хирургическими процедурами, был одинаковым в обеих группах. При этом группы отличались в отношении хирургической операции шунтирования желудка, соединяющей пищевод с двенадцатиперстной кишкой. Этот тип операции шунтирования можно сравнить с операцией шунтирования желудка по Ру (Roux-en-Y), когда накладывается обходной анастамоз между большей частью желудка и двенадцатиперстной кишкой, и при этом до некоторой степени сохраняется желудочная (их проксимальной части), панкреатическая, желчная и дуоденальная секреция. В настоящее время это является наиболее распространенным способом, при этом бариатрическая хирургия представляет собой лечение выбора при морбидном ожирении (Adrian et al., 2003). Предполагается, что операция шунтирования желудка ограничивает прием пищи и таким образом предотвращает ожирение. Этот эффект достаточно очевиден (Coates et al., 2004, Cowan and Buffington, 1998, Fernstrom et al., 2006), но также нужно рассматривать физиологические последствия. Желудок, имеющий функции резервуара для пищи и механического расщепления пищи, также является местом пищеварения и секреции. При попадании пищи в желудок существует фаза, где продолжают действовать пищеварительные ферменты слюны. Отсутствие этой фазы в пищеварении может особенно нарушать расщепление крахмала. Несмотря на меньший выход энергии, это не должно быть жизненно важным или серьезно влиять на пищеварение. То же самое относится к механическому расщеплению частиц пищи в целом. Более серьезный аспект представляет собой недостаточная желудочная секреция. Важными компонентами здесь являются ферменты пепсин и липаза, желудочный мукопротеид и соляная кислота. Пепсин жизненно важен для расщепления белка, и для указанного фермента необходима HCl, которая будет активироваться из секретируемого пепсиногена до пепсина. Поэтому отсутствие желудка может иметь серьезные последствия для поступления аминокислот и вызывать дефицит аминокислот. Другим аспектом этого является высвобождение минералов и витаминов, связанных с ферментами. Если не происходит высвобождение микропитательных веществ, дальше по ходу пищеварительного тракта они не могут усваиваться. Липаза из желудка будет расщеплять триглицериды, но даже если это не происходит, триглицериды, тем не менее, будут встречаться с липазами из поджелудочной железы, и должна удовлетворяться потребность в жирных кислотах. Таким образом, регуляция панкреатической секреции или желчи без желудка будет происходить в меньшей степени, поскольку указанная секреция регулируется кислотностью раствора, поступающего в двенадцатиперстную кишку. Желудок также регулирует количество пищи, проходящее в двенадцатиперстную кишку в то или иное время. Транспорт зависит от содержания углеводов, белков или жиров, при этом в любой момент времени наименьшее количество составляют жиры и наибольшее количество - углеводы. Этот механизм обеспечивает эффективное пищеварение и регулирует скорость продвижения через кишечник. Указанный механизм при операции шунтирования желудка отсутствует, и пищеварение в целом нарушается. С изменением кислотности и изменением скорости продвижения может возникать мальабсорбция или уменьшенная абсорбция некоторых компонентов. Витамин В 12 высвобождается из белков, и желудочный мукопротеид секретируется в желудке. Желудочный мукопротеид является жизненно важным для усвоения В 12 в подвздошной кишке. Витамин В 12 обычно присутствует в изобилии, но непосредственно после операции он может не обнаруживаться. Также сообщается, что дефицит витамина В 12 отмечен у 70% людей после операции шунтирования желудка при наблюдении их в послеоперационном периоде (Lynch et al., 2006, Shah et al., 2006). Те же авторы сообщают об анемии, которая частично тоже может быть обусловлена дефицитом железа, вызванным снижением его высвобождения, в особенности из белков, при уменьшении кислотности окружающей среды, и частично происходить из-за дефицита витаминов. Также сообщается о дефиците Са и фолата после операция шунтирования (Lynch, 2006, Parkes, 2006, Shah, 2006). Не ясно, обусловлено ли это плохой абсорбцией без двенадцатиперстной кишки или меньшей доступностью Са и фолата. В настоящем исследовании на крысах двенадцатиперстная кишка должна функционировать, но изменение потоков и уровень рН может влиять на расщепление питательных веществ на всем протяжении остальной части кишечника и показывать разные характеристики абсорбции. Поток может в значительной степени нарушаться притоком гиперосмолярного материала в кишечник. Это соответствует предположению, что поток гиперосмолярной пищи в тонкую кишку может быть причиной "демпинг-синдрома" у некоторых пациентов после шунтирования желудка (Lynch et al., 2006), которые могут реагировать рвотой. В нашем исследовании рассматривается эффект хирургического стресса с вовлечением контрольных крыс с мнимой операцией в качестве нашей группы контроля. Кроме того, ни одна из крыс не страдала ожирением или гипертензией перед операцией, и мы можем предположить наличие нормальной эластичности артерий перед операцией шунтирования. У людей отмечено падение кровяного давления после операции шунтирования (Coates, Buffington,1998, Fernstrom et al., 2006, Foley et al., 1992). Главным образом это, вероятно, обусловлено потерей веса,но частично также может происходить в силу изменений метаболизма и гормонального баланса. Поэтому очень вероятно, что изменение эластичности артерий, отмеченное в наших крысах после операции шунтирования, не вызвано гипертензией, так как необходимо ожидать небольшого снижения кровяного давления или стабильного нормального давления. После операции наши измерения показывают явно уменьшенную эластичность артерий. Возникают вопросы о том, что происходит после операции И что может влиять на стенки артерий Авторы Gokce et al. (2005) сообщают о продолжительном улучшении эндотелий-зависимой опосредованной потоком вазодилатации с потерей веса, и это улучшение было значительно больше у пациентов после шунтирования желудка при сравнении с потерей веса от медикаментозной терапии. У наших крыс,вес которых перед операцией был не больше нормы, автор рассматривает только эффекты изменений доступности для организма питательных веществ и возможных изменений метаболического и гормонального баланса. Катионы, такие как кальций и калий, которые способны влиять на кровяное давление, имеют высокий уровень связи с заряженными белками, и наиболее вероятно присутствуют в концентрациях меньше нормальных. Возможно, объяснение необходимо искать в другом. Если белки не разрушены, или только частично разрушены, будут отсутствовать достаточно многие аминокислоты, проходящие через кишечник. Это должно затронуть обмен белка. В стенке артерии эластичность частично создается соединительной тканью в стенках. Эта ткань постоянно реконструируется и при повреждении будет восстановлена. При отсутствии достаточного количества аминокислот, доступных для реконструкции или восстановления, с течением времени стенка потеряет свою эластичность. Другим дополнительным фактором может быть разный гормональный баланс, обусловленный различием сигналов, посылаемых пищеварительным трактом. Это может произойти из-за тех же причин, которые приводят к повышению ремоделирования костей с увеличением резорбцией кости и с последующим уменьшением костной массы, выявляемой у людей после шунтирования желудка. Частичной причиной может быть то, что у крысы с шунтированным желудком не могут расщепляться белки, необходимые для здорового метаболизма. Более высокое ремоделирование кости также говорит о вновь заданном гормонально регулируемом цикле. При уменьшении эластичности к изменению в целом приводит или структура, или процент эластичных волокон. Эффект растяжения. Давление жидкости Р в пределах сосудистой стенки находится в равновесии с натяжением Т стенки, деленной на радиус искривления r и внешнего давления pn, таким образом, что Р=pn+Т(1/r), что определено согласно закону Лапласа. Если выбирается не учитывать внешнее давление и какую-либо поддержку окружающих тканей и рассматривается только цилиндрическая вена или артерия разумного размера, то уравнение может быть упрощено до Р=Т/r. Кроме того, известно, что натяжение возрастает в зависимости от толщины стенки сосуда, то есть совокупность мембран и мышечной ткани составляет стенку кровеносного сосуда. Таким образом, если поддерживается постоянное давление, то согласно сокращенному уравнению можно предположить, что толщина стенки сосуда должна изменяться в зависимости от радиуса сосуда. Однако в действительности давление в системе кровообращения не является постоянным, фактически оно уменьшается из-за потерь на трение. Все же, несмотря на это, некоторое время большие и малые сосуды следуют правилу, установленному упрощенным уравнением при толщине стенки, пропорциональной размеру сосуда. Эффект АКГ. Известно, что некоторые аминокислоты метаболизируются в стенке кишечника, и это указывает на предпочтительное применение АКГ до аминокислот (АК) и, таким образом, можно увеличивать абсорбцию АК с добавлением АКГ у шунтированных крыс по сравнению с шунтированными без АКГ. Заключение. Результаты данного исследования указывают, что операция шунтирования этого типа в значительной степени влияет на эластичность артерий. Введение АКГ обладает положительным эффектом на эластичность артерий у шунтированных крыс в отличие от контрольных крыс. Неожиданно высокое пассивное натяжение имеет постоянный эффект на эластичность артерий и в контроле и у шунтированных крыс, и снижает способность сосудов к быстрой реакции на внезапные изменения давления. Пример 2. Способы. Цель исследования состояла в объяснении, был ли эффект, наблюдаемый в исследовании примера 1, ограниченным для субъекта, которому провели хирургическую операцию на желудке. В данном случае экспериментально исследовались субъекты, которые нуждались в повышении эластичности артерий по более общей распространенной причине, а именно по причине пожилого возраста. Разрешение местным этическим комитетом. Исследование было одобрено Этическим наблюдательным комитетом по экспериментам на животных в Лундском университете (пособие по этике М 14-05) и проводилось согласно инструкциям Европейского экономического сообщества в отношении защиты экспериментальных животных. Подготовка животных и аорты. Самки мышей NMRI в возрасте 50 недель на начало исследования размещались в виварии кафедры биологии клетки и организма Лундского Университета, Швеция. Животные содержались при одинаковых условиях с циклом света и темноты 12/12. Крыс кормили гранулами для грызунов ad libitum (алтромин 1314 Spezialfutterwerke, Lage, Германия) при свободном доступе к питьевой воде. Крыс рандомизированно разделяли на группы и кормили в течение 182 дней, пока они не достигали возраста 76 недель,и к этому времени их масса тела составляла 287 г. Мышей группы 1 кормили гранулами для грызунов плюс (2% вес./об.) Na2-АКГ 2 H2O (n=6), при этом мышей группы 2 кормили гранулами для грызунов плюс (2% вес./об.) Са-АКГ H2O (n=6). Мышей, выделенных в группу 3, кормили только гранулами для грызунов, и они считались контрольной группой (n=6). Количество АКГ, даваемого в виде пищевой добавки, составляло 2% приема свободного потребления мышей, что составляло около 10-15% массы тела в день. Крыс анестезировали воздействием 95% СО 2 и умерщвляли смещением шейных позвонков. Иссеченный участок брюшной аорты, проксимальнее правой и левой общих подвздошных артерий, тщательно зачищали для удаления прилегающих тканей. Аорту нарезали примерно на образцы размером 4,5 мм с диаметром в покое около 1 мм и каждый образец затем аккуратно прикрепляли к датчику силы с одного конца и с другого конца к металлической шпильке на элементе крепления, как частично описано в публикациях Harrison et al. Reprod Fertil Dev., 1997; 9(7):731-40, Harrison and Flatman, Am J. Physiol., 1999Dec.; 277(6 Pt 2):R1646-53). Вес образцов аорты определяли с применением шкалы с возможностью определения веса близко к 0,01 мг и в среднем вес составлял 2,75 мг. Срезы аорты погружали в камеры с насыщенной кислородом атмосферой и регулируемой температурой (37 С) с внутренними размерами глубины и диаметра 5,5 и 3,2 см соответственно, содержащие 44 мл 0,15 М фосфатно-буферного раствора (ФБР с уровнем рН 7,4), содержащего, мМ: NaCl 136,91, KCl 2,68, Na2HPO4 8,08 и NaH2PO4 1,66. Силу измеряли с применением датчика перемещения силы FT03(Grass Instrument, West Warwick, RI), соединенного с мостовым усилителем собственного изготовления,который соединялся с аналого-цифровым преобразователем 8S PowerLab (AD Instruments, Chalgrove,Oxfordshire, Великобритания). Рабочий диапазон преобразователя составлял 0-0,05 кг с достоверной силой 2 мг, эквивалентной 0,004% функционального диапазона. АЦП PowerLab 8S был связан с программным обеспечением iBook, G4 running Chart5 v.5.4 (AD Instruments, Австралия). Регистрацию данных проводили со скоростью осуществления выборки данных 40000 в 1 с (40 кГц), и входной импеданс усилителя составлял дифференциал 200 M. Измерения силы. Срезы аорты суспендировали вертикально и дважды. Регистрированный сигнал регулировали до нуля для нерастянутых участков аорты с помощью смещенной шкалы, установленной на узле перед усилителем. Затем каждый срез аорты подвергали примерно 5-кратному пошаговому увеличению натяжения(каждый шаг составлял около 0,09 Н), до достижения конечного максимального натяжения 0,49 Н (измеряемого с применением датчика силы FT03 Grass Force). Указанный конечный уровень натяжения ни в коем случае не был близок к физиологическому максимальному усилию, зарегистрированному в срезах аорты. Затем срезы аорты оставляли для полного расслабления перед дополнительным повторным воздействием пошагового увеличения натяжения еще дважды, близко по времени. После этого срезы аорты удаляли и взвешивали. Сразу после пошагового увеличения натяжения отмечали очень незначительное падение зарегистрированной кривой, поскольку ткань аорты проявляла степень эластической тяги. Это падение зарегистрированной кривой измеряли во времени, используя расчет среднего уклона, доступный как часть программного обеспечения Chart v.5.4 Software (AD Instruments, Australia). Средний наклон (мкгмс-1) является производной от значений времени точек данных в выборе кривой и вычисляется из линии наименьших квадратов, наиболее подходящей. Вычисления натяжения. Уравнение Лапласа предполагает, что натяжение (Т) в стенке полого цилиндра непосредственно пропорционально радиусу цилиндра (r) и давлению (р) в стенке, создаваемому потоком в цилиндре, таким образом, что Т=рr. Если предполагается, что натяжение в стенке участка аорты эквивалентно натяжению, зарегистрированному датчиком силы как результат растяжения вручную, то давление, которое будет вызывать такое увеличение натяжения, можно вычислить, используя уравнение Лапласа и значения радиуса каждого участка аорты. Таким образом, показатели среднего наклона (мкгмс-1), полученные для каждого образца аорты,были преобразованы в Ньютоны (Нмс-1) перед подбором веса образца, чтобы получить конечное значение эластической тяги в Нмс-1 мг-1 влажного веса. Статистический анализ. Данные представлены как среднее значение SE. Различия между средними значениями проверяли на статистическую значимость с применением однофакторного дисперсионного анализа ANOVA с дополнительным тестом на нормальное распределение Гаусса. Полученные данные имели нормальное распределение и равные дисперсии. Различия, показывающие значения Р 0,05, считались несущественными. Результаты. Измерения натяжения. Обычно срезы аорты подвергали натяжению около 0,178 Н на 1 мг влажного веса при полном растяжении (максимальное натяжение 0,49 Н/средний вес ткани 2,75 мг). Таким образом, используя уравнение Лапласа и средний радиус аорты 1,0 мм, получали создаваемое давление, составлявшее порядка 0,178 кПа. Среднее пошаговое увеличение натяжения вручную развивало 0,09 Н (4,9510-3 Н/мг влажного веса), и обычно выявляли сокращение срезов аорты до показателя 0,015 Н, который составляет около 16% натяжения, приложенного вручную. Контрольные крысы. Эластичность аорты в контроле составляла 3,310-57,810-7 Нмс-1 мг-1 влажного веса и 3,410-69,410-7 Нмс-1 мг-1 влажного веса для первой и второй серии растяжений соответственно. В повторном протоколе растяжения было получено примерно 90% уменьшения эластической тяги; вторая по сравнению с первой серией (фиг. 5). Мыши Na-АКГ (А). При введении Na-АКГ эластичность образцов аорты составляла 4,310-51,610-6 Нмс-1 мг-1 влажного веса и 3,710-61,110-6 Нмс-1 мг-1 влажного веса для первой и второй серии растяжений соответственно. Введение Na-АКГ также обладало значительным эффектом на артериальную эластичность по сравнению с мышами контроля (см. фиг. 4). В повторном протоколе растяжения было получено примерно 91% уменьшения эластической тяги; вторая по сравнению с первой серией (фиг. 5). Мыши Са-АКГ (В). При введении Са-АКГ эластичность образцов аорты составляла 6,410-52,710-6 Нмс-1 мг-1 влажного веса и 3,810-61,210-6 Нмс-1 мг-1 влажного веса для первой и второй серии растяжений соответственно. Кроме того, введение Са-АКГ обладало значительным эффектом на эластичность артерий по сравнению с контрольными мышами (см. фиг. 4). В повторном протоколе растяжения было получено примерно 94% уменьшения эластической тяги; вторая по сравнению с первой серией (фиг. 5). Серии растяжений и выносливость артерий. Во всех изученных артериях исходная серия растяжения (например, воздействие натяжения с последующим расслаблением) приводила к уменьшению эластичности после воздействия натяжения. Этот эффект можно сравнить с видом повреждения, возникновение которого предполагается при внезапном увеличении кровяного давления (см. фиг. 5). Выносливость образцов аорты на растяжение Приведено количество успешных растяжений (трехкратных) для изолированных срезов, подвергаемых максимальному пошаговому натяжению 0,49 Н, без возникновения разрыва. Обсуждение. Результаты этого исследования отчетливо показывают благоприятное действие лечения альфакетоглутаратом на артериальную эластичность у старых мышей. Кроме того, насколько известно, здесь впервые сообщается о лечении, способном направленно действовать на ригидность крупных артерий. Животные. В это исследование отбирали взрослых животных, имевших сопоставимый возраст с субъектом пожилым человеком. После иссечения аорты у мышей в этом исследовании становилось очевидным наличие артериальных отложений, таким образом, что аорты казались почти белыми до прозрачных и даже после иссечения сохранили свою трубчатую форму. Артериальное давление и натяжение. У крыс в возрасте 6 месяцев и старше регистрировали артериальное давление, полученное канюлированием брюшной аорты или подвздошной артерии либо каротидной артерии, со средним значением 119 мм рт. ст. (верхняя граница 150 и нижняя граница 92 мм рт. ст.) (Durant, 1927). Этот автор также упоминает корреляцию между возрастом и артериальным давлением до возраста 6 месяцев, после которого не было зарегистрировано какого-либо дополнительного повышения артериального давления, несмотря на дальнейшее увеличение массы тела. Указанное артериальное давление у мелких грызунов очень близко к АД отдыхающего человеческого субъекта, где систолическое давление обычно составляет 120 мм рт. ст. (16 кПа). Кроме того, повышение давления, выявленное в образцах артерий в данном исследовании, отражает 1,8% повышения, обычно выявляемого в человеческих артериях, и около 1,4% повышения, измеренного у крыс (13-14 кПа) (Carroll et al., 2006; Duka et al., 2006). В структуру аорты входят слои гладких мышечных клеток, которые по касательной соединены с эластичными ламеллами; изменяя распределение силы между эластичными и коллагеновыми волокнами,изменение тонуса гладкой мускулатуры обеспечивают динамическую или функциональную регуляцию ригидности (McEmery et al., 2007). В действительности на нижних уровнях артериального давления возникающее напряжение стенки аорты преимущественно воспринимается эластичными волокнами, при этом на верхних уровнях артериального давления напряжение обычно воспринимается более ригидными коллагеновыми волокнами. Таким образом, один из эффектов старения должен затрагивать коллагеновые волокна на нижних уровнях артериального давления и в результате сопутствующим образом повышать пульсовое давление. Напряжение, возникающее в артерии, зависит от толщины сосудистой стенки, то есть от количества соединительной и мышечной ткани, составляющей стенку. Таким образом, если поддерживается постоянное давление, то с уравнением Лапласа можно будет прогнозировать изменение толщины сосудистой стенки в зависимости от радиуса сосуда. Однако в действительности давление в системе кровообращения не является постоянным, фактически оно уменьшается из-за потерь на трение. Все же, несмотря на это, некоторое время большие и малые сосуды отвечают правилу Лапласа, установленному упрощенным уравнением. Уравнение Лапласа говорит о том, что давление жидкости Р в пределах сосудистой стенки пропорционально натяжению Т стенки, деленному на радиус кривой r, и внешнее давление pn, таким образом,что Р=pn+Т(1/r). Если предполагается пренебречь внешним давлением и какую-либо поддержку окружающих тканей и рассматривается только цилиндрическая вена или артерия разумного размера, то уравнение может быть упрощено до Р=Т/r. В данном исследовании срезы аорты получали из брюшной аорты,проксимальней правой и левой общих подвздошных артерий, они имели такой диаметр, что соответствовали требованиям, необходимым для выполнения закона Лапласа. Стареющие артерии. Старение, которое затрагивает органы, ткани и клетки, накладывает разный отпечаток в организме и с разных точек зрения его можно считать дифференциальным показателем функционального ухудшения (Calabresi et al., 2007). В сосудистой стенке больших артерий наблюдаются возрастные структурные изменения, включающие в себя ригидность и утолщение ткани, а также расширение диаметра просвета(MarinRodriguez-Martinez, 1999; Dao et al., 2005), и очень часто на протяжении артериального дерева эти изменения гетерогенны (Hajdu et al., 1990; Moreau et al., 1998; Laurant et al., 2004). Характерными признаками аорты старых крыс являются модификации числа гладкомышечных клеток, повышенное отложение коллагена и структурные изменения эластина (Jacob, 2003; Dao et al., 2005). Действительно многие исследования сообщают об уменьшении с возрастом числа гладкомышечных клеток (Cliff, 1970;Orlandi et al., 1993), увеличение в артериях коллагена I и III типа и об относительном сокращении плотности эластина (Jacob, 2003; Dao et al., 2005; Marin, 1995). Необходимо отметить, что подход с растяжением, выбранный в данном исследовании, показал намного более слабую степень эластической тяги во второй серии по сравнению с первой серией повторных растяжений. Этот момент выдвигает на первый план и подчеркивает способность или отсутствие способности срезов стареющей аорты выдержать период относительно умеренного растяжения, эквивалентного повышению артериального давления на 0,178 кПа. Поэтому второе растяжение можно рассматривать как индекс выносливости, который в рассматриваемых обстоятельствах оказался отсутствующим в срезах стареющей аорты мыши. У человека в возрасте 60 лет в среднем происходит более 2 млрд циклов напряжения аорты (средняя частота сердечных сокращенийвозраст) (McEniery et al., 2007), и повреждение, возникающее в результате таких циклов напряжения, требует немедленной регуляции и восстановления, в которое вовлекаются эластин, коллаген и компоненты гладкой мускулатуры сосудистой стенки. В данном исследовании не было какой-либо возможности регуляции тонуса гладкой мускулатуры или какого-либо шанса репарации эластиновых и коллагеновых волокон, следовательно факты потери после первой серии растяжения почти 90% эластической тяги (Нмс-1 мг-1 влажного веса) в контрольных аортах и факты выявления сходного уровня эластической тяги во время второй серии у мышей, получавших АКГ, указывают только на то, что эластическая тяга, чувствительная у крупных сосудов, должна повреждаться у старых мышей. Артериальная эластическая тяга и ДКГ. Поскольку известно, что традиционные противогипертензические средства уменьшают артериальную ригидность главным образом посредством непрямого действия понижения артериального давления в среднем, относительную возрастную устойчивость к напряжению периферийных артерий обычно приписывают намного более низкому соотношению эластина в гладкой мускулатуре и коллагена, хотя здесь также могут отражаться другие биологические процессы, например способность артерий к ремоделированию (McEniery et al., 2007). Альфа-кетоглутарат как промежуточное звено, определяющее скорость процесса в цикле Кребса,играет решающую роль в клеточном энергетическом обмене. Он также действует как источник глутамата и глутамина, а также стимулирует синтез белка и ингибирует распад белка (Hammarqvist et al., 1991). В плане метаболизма коллагена АКГ действует не только как кофактор для пролил-4-гидролазы, которая катализирует образование 4-гидроксипролина, необходимого для образования тройной спирали коллагена, АКГ также способствует синтезу коллагена посредством увеличение пула пролина из глутамата (Sonet al., 2007). Лучшие эффекты в группе Са-АКГ по сравнению с группами Na-АКГ можно объяснить более продолжительной доступностью АКГ, находящейся в соли Са-АКГ. Соль Са действует как медленное высвобождение для иона АКГ, регулируя его появление в просвете кишечника, поскольку его растворимость составляет 2 г в 100 мл, тогда как растворимость Na-АКГ в 50 раз выше. Таким образом, анион АКГ имеет ускоренную доступность в форме Na-АКГ. В таком случае большая часть АКГ просто преобразуется в энергию при уровне в крови выше около 10 мкг/мл. После приема внутрь Na-АКГ уровень АКГ в крови может легко превысить 10 мкг/мл. Этого не наблюдается никогда или редко после энтерального введения Са-АКГ. Когда АКГ представлена в форме Са-АКГ, она высвобождается медленно и в течение более продолжительного периода времени, и таким образом возникает больше времени для превращения в пролин и другие аминокислоты вместо энергии. Недавно обнаружено, что АКГ является естественным лигандом для соединенного с рецептором Gбелка (CPR99), который, как известно в настоящее время, экспрессируется в почке, яичке и гладкой мускулатуре (Не et al., 2004). Как лиганд соединенного с рецептором G-белка, АКГ может образовывать связь между промежуточными продуктами цикла ТКК (трикарбоновых кислот) и состоянием метаболизма и синтеза белка/коллагена, и в действительности это может быть хорошим доказательством основной причины наблюдаемых в данном исследовании благоприятных эффектов на эластичность стенки аорты. Заключение. Результаты настоящего исследования указывают, что АКГ эффективен в улучшении артериальной эластичности не только у субъектов, которые подверглись операции на желудке (пример 1), но также у других субъектов со сниженной артериальной эластичностью. В данном случае субъектами были старые грызуны, которые считаются соответствующей моделью также для субъектов-людей со сниженной артериальной эластичностью, обычно также находящиеся в пожилом возрасте. Ссылки.topical application on the dorsal skin of hairless mice, Biol. Pharm. Bull., 30: 1395-1399, 2007. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение по меньшей мере одного вещества, выбираемого из группы, состоящей из:b) фармацевтически приемлемых солей альфа-кетоглутаровой кислоты,для изготовления фармацевтического препарата, или продукта питания, или пищевой добавки для улучшения эластичности кровеносных сосудов у нуждающегося в этом субъекта. 2. Применение по п.1, при котором кровеносным сосудом является артерия. 3. Применение по любому из вышеприведенных пунктов, при котором субъект нуждается в лечении и/или профилактике гипертензии, легочной гипертензии, заболевания сосудов сетчатки глаза, желудочковой гипертрофии или артериальной аневризмы. 4. Применение по любому из вышеприведенных пунктов, при котором субъект подвергался хирургической операции на желудке. 5. Применение по п.4, при котором операция на желудке представляет собой шунтирование желудка, резекцию желудка, частичную резекцию желудка или бандажирование желудка. 6. Применение по любому из вышеприведенных пунктов, при котором субъект страдает от состояний, включающих нарушение питания. 7. Применение по любому из вышеприведенных пунктов, при котором субъект является пожилым. 8. Применение по любому из вышеприведенных пунктов, при котором применяют альфа-кетоглутаровую кислоту или ее соли щелочного или щелочно-земельного металла или их комбинацию. 9. Применение по п.8, где указанная соль альфа-кетоглутаровой кислоты представляет собой альфакетоглутарат натрия или альфа-кетоглутарат кальция. 10. Способ улучшения эластичности кровеносных сосудов у нуждающегося в этом субъекта, который включает введение эффективного количества по меньшей мере одного вещества, выбираемого из группы, состоящей из:b) фармацевтически приемлемых солей альфа-кетоглутаровой кислоты. 11. Способ по п.10, в котором кровеносным сосудом является артерия. 12. Способ по п.10, в котором субъект нуждается в лечении и/или профилактике гипертензии, легочной гипертензии, заболевания сосудов сетчатки глаза, желудочковой гипертрофии или артериальной аневризмы. 13. Способ по п.10, в котором субъект подвергался хирургической операции на желудке. 14. Способ по п.13, в котором операция на желудке представляет собой шунтирование желудка, резекцию желудка, частичную резекцию желудка или бандажирование желудка. 15. Способ по п.10, в котором субъект страдает от состояний, включающих нарушение питания. 16. Способ по п.10, в котором субъект является пожилым. 17. Способ по любому из пп.10-16, в котором вводят альфа-кетоглутаровую кислоту или ее соли щелочного или щелочно-земельного металла или их комбинацию. 18. Способ по п.17, в котором применяют альфа-кетоглутарат натрия или альфа-кетоглутарат кальция. 19. Способ по п.10, в котором вводимая доза находится в интервале от 1 до 1000 мг вещества/кг массы тела в день. 20. Способ по п.19, в котором вводимая доза находится в интервале от 10 до 400 мг вещества/кг массы тела в день. 21. Способ по п.20, в котором вводимая доза находится в интервале от 10 до 100 мг вещества/кг массы тела в день.
МПК / Метки
МПК: A61K 31/198, A61P 9/14, A61K 31/194
Метки: применение, сосудов, кровеносных, кислоты, улучшения, альфа-кетоглутаровой, солей, эластичности
Код ссылки
<a href="https://eas.patents.su/17-18554-primenenie-alfa-ketoglutarovojj-kisloty-i-ee-solejj-dlya-uluchsheniya-elastichnosti-krovenosnyh-sosudov.html" rel="bookmark" title="База патентов Евразийского Союза">Применение альфа-кетоглутаровой кислоты и ее солей для улучшения эластичности кровеносных сосудов</a>
Предыдущий патент: Способ ведения плавки в стеклоплавильной печи
Следующий патент: Определение вариаций количества копий, способы и системы
Случайный патент: Защитное приспособление для контейнеров