Определение вариаций количества копий, способы и системы
Формула / Реферат
1. Способ определения относительного количества копий полинуклеотидной последовательности-мишени в геноме субъекта, включающий
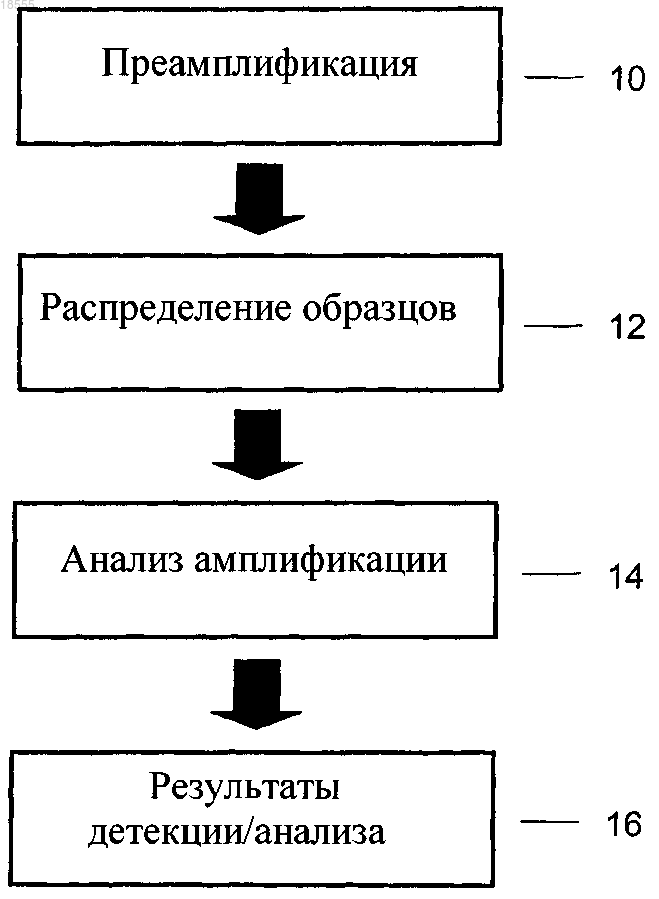
преамплификацию полинуклеотидной последовательности-мишени и эталонной полинуклеотидной последовательности в образце, содержащем геномную ДНК субъекта;
анализ полинуклеотидной последовательности-мишени и эталонной полинуклеотидной последовательности преамплифицированного образца посредством цифровой ПЦР;
определение (a) количества амплифицированных полинуклеотидных молекул, содержащих полинуклеотидную последовательность-мишень, и (b) количества амплифицированных полинуклеотидных молекул, содержащих эталонную полинуклеотидную последовательность, и определение отношения (a):(b).
2. Способ по п.1, где образец получают у человека.
3. Способ по п.1, где (i) отношение (a):(b) составляет приблизительно 0,5 и существует делеция полинуклеотидной последовательности-мишени на одной хромосоме или (ii) отношение (a):(b) составляет приблизительно 1,5 и существует дупликация полинуклеотидной последовательности-мишени на одной хромосоме.
4. Способ по п.1, где
эталонная полинуклеотидная последовательность имеет предопределенное количество копий N в геноме;
определение количества амплифицированных полинуклеотидных молекул, содержащих полинуклеотидную последовательность-мишень, включает определение количества реакционных объемов, в которых присутствует полинуклеотидная последовательность-мишень или ее подпоследовательность A;
определение количества амплифицированных полинуклеотидных молекул, содержащих полинуклеотидную последовательность-мишень, включает определение количества реакционных объемов, в которых присутствует эталонная полинуклеотидная последовательность или ее подпоследовательность B;
относительное количество копий полинуклеотида-мишени в геноме составляет приблизительно (А)/(В)´N.
5. Способ по п.4, в котором проведение преамплификации включает комбинирование образца с композицией, содержащей праймеры, специфичные для полинуклеотидной последовательности-мишени, и праймеры, специфичные для эталонной полинуклеотидной последовательности, и проведение полимеразной цепной реакции (ПЦР) так, чтобы раздельно амплифицировать полинуклеотид-мишень и эталонный полинуклеотид, по существу, в равном соотношении.
6. Способ по п.4, где реакционные объемы расположены в микрожидкостном устройстве и преамплификацию проводят в реакционном объеме отдельно от микрожидкостного устройства.
7. Способ по п.4, где до анализа полинуклеотидной последовательности-мишени и эталонной полинуклеотидной последовательности преамплифицированного образца посредством цифровой ПЦР весь преамплифицированный образец или его часть комбинируют с реагентами, выбранными для количественной амплификации полинуклеотидной последовательности-мишени и эталонной полинуклеотидной последовательности.
8. Способ по п.5, где праймеры, специфичные для эталонной полинуклеотидной последовательности, используемые на стадии преамплификации, также используют при анализе эталонной полинуклеотидной последовательности преамплифицированного образца посредством цифровой ПЦР.
9. Способ по п.8, где праймеры, специфичные для полинуклеотидной последовательности-мишени, используемые на стадии преамплификации, также используют при анализе полинуклеотидной последовательности-мишени преамплифицированного образца посредством цифровой ПЦР.
10. Способ по п.7, где реагенты включают первый зонд, селективно гибридизующийся с полинуклеотидной последовательностью-мишенью, и второй зонд, селективно гибридизующийся с эталонной полинуклеотидной последовательностью, в условиях, пригодных для амплификации полинуклеотидов.
11. Способ по п.10, где первый и второй зонды содержат различные детектируемые метки и где связывание первого или второго зонда или разрушение первого или второго зонда при полимеризации на основе полимеразной цепной реакции (ПЦР) приводят к изменению детектируемой флуоресценции соответствующей детектируемой метки.
12. Способ по п.1, где эталонная полинуклеотидная последовательность содержит полинуклеотидную последовательность, по меньшей мере, частично кодирующую фермент РНКазу Р, β-актин или GAPDH.
13. Способ по п.1 или 2, где отношение полинуклеотидной последовательности-мишени к эталонной полинуклеотидной последовательности, существенно отклоняющееся от значения 1, указывает на аномальное количество копий полинуклеотидной последовательности-мишени в геноме пациента.
Текст
ОПРЕДЕЛЕНИЕ ВАРИАЦИЙ КОЛИЧЕСТВА КОПИЙ, СПОСОБЫ И СИСТЕМЫ Изобретение относится к способам и системам для определения вариации количества копий полинуклеотида-мишени в геноме индивидуума, включающим основанные на амплификации способы. Способы могут включать преамплификацию образца с последующим распределением образца во множество реакционных объемов, количественное определение полинуклеотидамишени и эталонного полинуклеотида и анализ для определения относительного количества копий полинуклеотидной последовательности-мишени в геноме индивидуума. Перекрестные ссылки на связанные заявки По заявке на данное изобретение испрашивается приоритет на основании 35 U.S.С. 119 (е) предварительной патентной заявки США 60/967897, поданной 7 сентября 2007 г., полное описание которой включено в настоящий документ в качестве ссылки. Область изобретения Изобретение относится к способу определения вариации количества копий в геноме малых популяций или индивидуумов и находит применение в биологии и медицине. Предпосылки изобретения"Цифровая ПЦР" относится к способу, в котором индивидуальная молекула нуклеиновой кислоты,представленная в образце, до амплификации ПЦР одной или нескольких последовательностей-мишеней распределяется по нескольким отдельным реакционным объемам (например, камерам или аликвотам). Концентрацию индивидуальных молекул в образце устанавливают так, что после распределения каждый реакционный объем содержит менее одной отдельной полинуклеотидной молекулы (или агрегата сцепленных полинуклеотидных молекул), и большинство камер не содержит молекул или содержит одну молекулу. Амплификация последовательности-мишени приводит к бинарному цифровому выходу, при котором каждую камеру идентифицируют или как содержащую, или как не содержащую продукт ПЦР, что указывает на присутствие соответствующей последовательности-мишени. Подсчет реакционных объемов, содержащих детектируемые уровни конечного продукта ПЦР, представляет собой непосредственную меру абсолютного количества нуклеиновых кислот. В одном из вариантов цифровой ПЦР полинуклеотидные молекулы распределены посредством разделения их в отдельные реакционные объемы. В одном из способов разделения применяют цифровой чип 12.765 BioMark (BioMark 12.765 Digital Array)(Fluidigm Corp., South San Francisco, СА). В этом чипе используют интегрированные каналы и клапаны,которые разделяют смесь образцов и реагентов на реакционные камеры объемом 765 нл. Молекулы ДНК в каждой смеси случайным образом разделяют по 765 камерам каждой панели. Затем чип подвергают тепловой циклической обработке и визуализации на системе ПЦР с детекцией в реальном времениFluidigm's BioMark и с помощью программного обеспечения для анализа цифровых чипов можно подсчитывать камеры с положительным сигналом, которые исходно содержали 1 или несколько молекул. Обсуждение цифровой ПЦР см., например, в Vogelstein and Kinzler, 1999, Proc. Natl. Acad. Sci. USA. 96:9236-41; McBride et al., публикация патентной заявки США 20050252773, особенно пример 5. Вариации количества копий (CNV) представляют собой прибавления или потери геномных областей в диапазоне размеров, начиная от 500 оснований (часто между пятью тысячами и пятью миллионами оснований). Полногеномные исследования выявили у человека наличие большого количества областейCNV и широкий диапазон генетического разнообразия в общей популяции. CNV попали в фокус многих недавних исследований вследствие их роли в генетических нарушениях у человека. См., например Iafrateet al., 2004, Detection of large-scale variation in the human genome. Nat. Genet. 36:949-951; Sebat et al., 2004,Large-scale copy number polymorphism in the human genome. Science. 305:525-528; Redon et al., 2006,Global variation in copy number in the human genome. Nature. 444:444-454; Wong et al., 2007,A comprehensive analysis of common copy-number variations in the human genome. Am. J. Hum. Genet. 80:91-104; Ropers, 2007, New perspectives for the elucidation of genetic disorders. Am. J. Hum. Genet. 81:199207; Lupski, 2007, Genomic rearrangements and sporadic disease. Nat. Genet. 39:S43-S47, каждая из которых включена в качестве ссылки. Анеуплоидия, такая как трисомия или делеция целой хромосомы, представляет собой ограниченный тип вариации количества копий, ассоциированный с множеством заболеваний человека. Краткая сущность изобретения Изобретение относится к способу определения вариации количества копий в геноме у малых популяций или индивидуумов. Способ предусматривает преамплификацию представляющего интерес гена в образце до анализа посредством цифровой ПЦР. Этап преамплификации обеспечивает распределение отдельных копий гена, подлежащих распределению в отдельные образцы для реакции ПЦР для детекции,таким образом, который более репрезентативен в отношении фактического количества копий, чем при определении посредством цифровой ПЦР без преамплификации. Основанные на цифровой ПЦР способы по изобретению позволяют с высокой точностью различать менее чем двукратные различия количества копий гена. Например, в различных образцах можно различить 1, 2, 3 и 4 копии генов. Для того чтобы подтвердить, что видимые различия в количестве копий генов в различных образцах являются истинными и не искажены различиями в количествах образцов, авторы изобретения используют термин, называемый относительное количество копий. Относительное количество копий гена (на геном человека) можно выражать как отношение количества копий генамишени к количеству копий однокопийного эталонного гена в образце ДНК, который, как правило, является 1. Например, ген РНКазы P представляет собой однокопийный ген, кодирующий РНК-группу для фермента РНКазы Р, и его можно использовать в качестве эталонного гена в анализе количества копий. Для проведения количественного определения ДНК в образце использовали коммерчески доступный цифровой матричный чип, такой как проиллюстрированный на фиг. 3, для проведения цифровой ПЦР. Чип содержит 12 входных отверстий для образцов для введения смеси образца. Каждая смесь об-1 018555 разца разделяется на 765 реакционных камер в каждой из 12 панелей. Как описано в литературе (см., например, McBride et al., публикация патентной заявки США 20050252773), способность к количественному определению ДНК в образце основана на том факте, что, когда вводят подходящее количество ДНК, отдельные молекулы ДНК случайным образом распределяются в камерах. Используя два анализа для двух генов (например, РНКаза P и другой представляющий интерес ген) с двумя флуоресцентными носителями на одном чипе, в одном и том же образце ДНК возможно одновременно количественно определить и РНКазу P, и другой ген и получить хорошую оценку соотношения этих двух генов и количество копий представляющего интерес гена. Однако при дупликации множественные копии одного гена могут быть близко связаны на одной хромосоме и, таким образом, не могут отделиться друг от друга даже на цифровом чипе. В результате несколько копий будут вести себя как одна молекула и общее количество копий гена может быть сильно недооценено. Настоящее изобретение решает эту проблему, включая в способ этап преамплификации. Преамплификация представляет собой реакцию ПЦР с праймерами для представляющего интерес гена и эталонного гена (например, ген РНКазы Р). Как правило, ее проводят при ограниченном количестве термальных циклов (например, 10 циклов), предполагая равные эффективности ПЦР, количества копий обоих генов на этапе амплификации пропорционально увеличиваются. При использовании этого способа, даже если несколько копий гена в геноме сцеплены вместе, после преамплификации каждая копия представляющего интерес гена будет амплифицирована раздельно и будет раздельно распределяться в различные камеры на цифровом чипе. Так как вновь получаемые молекулы обоих генов отражают исходное соотношение и они больше никак не связаны, анализ на цифровом чипе может точно количественно определять молекулы двух генов и измерять соотношение этих двух генов (следовательно, количество копий представляющего интерес гена). Таким образом, настоящее изобретение относится к системам и связанным способам для проведения генетического анализа. Более конкретно, способы и системы по настоящему изобретению, как правило, относятся к определению вариации количества копий представляющего интерес полинуклеотида в образце, взятом у субъекта. В одном из аспектов изобретение относится к способу определения относительного количества копий полинуклеотидной последовательности-мишени в геноме индивидуума, включающему следующие этапы:a) преамплификация последовательности гена-мишени и последовательности эталонного гена в образце, содержащем геномную ДНК индивидуума, получая, таким образом, амплифицированный образец;b) проведение цифровой ПЦР, распределяя продукт из (a) в несколько изолированных реакционных объемов, амплифицируя последовательности мишени и эталонного гена в каждом реакционном объеме и определяя относительные количества последовательностей мишени и эталонного гена в амплифицированном образце, где относительные количества последовательностей мишени и эталонного гена в амплифицированном образце соответствуют относительным количествам последовательностей мишени и эталонного гена в геноме. В связанном аспекте изобретение относится к способу определения относительного количества копий полинуклеотидной последовательности-мишени в геноме индивидуума, включающему следующие этапы: преамплификация последовательности гена-мишени и последовательности эталонного гена в образце, содержащем геномную ДНК индивидуума; анализ последовательности гена-мишени и последовательности эталонного гена преамплифицированного образца посредством цифровой ПЦР; определение (a) количества амплифицированных полинуклеотидных молекул, содержащих последовательность гена-мишени, и (b) количества амплифицированных полинуклеотидных молекул, содержащих последовательность эталонного гена, и определение соотношения между (a) и (b). В связанном аспекте изобретение относится к способу определения количества копий полинуклеотидной последовательности-мишени в геноме индивидуума, включающему следующие этапы: проведение первой амплификации полинуклеотидов ДНК образца, полученного у индивидуума, где амплифицируют и полинуклеотидную последовательность-мишень, и эталонную полинуклеотидную последовательность, где указанная эталонная последовательность содержит предопределенное количество копий в геноме N, получая, таким образом, амплифицированный образец; распределение всего или части амплифицированного образца в несколько отдельных реакционных объемов; проведение в каждом реакционном объеме второй амплификации полинуклеотидов, в которой амплифицируется, если она присутствует, полинуклеотидная последовательность-мишень или ее подпоследовательность и амплифицируется, если она присутствует, эталонная полинуклеотидная последовательность или ее подпоследовательность; определение (a) количества реакционных объемов, в которых присутствует полинуклеотидная последовательность-мишень или ее подпоследовательность А, и определение (b) реакционных объемов, в которых присутствует эталонная полинуклеотидная последовательность или ее подпоследовательность В, где количество копий полинуклеотида-мишени в геноме приблизительно составляет (А)/(В)N. В некоторых вариантах осуществления образец получают у человека. В конкретных вариантах осуществления отношение (a) к (b) составляет приблизительно 0,5 и на одной из хромосом существует делеция (a) или отношение (a) к (b) составляет приблизительно 1,5 и на одной из хромосом существует дупликация (a). В некоторых вариантах осуществления отношение последовательности гена-мишени к последовательности эталонного гена, в значительной степени отклоняющееся от значения 1, указывает на аномальное количество копий последовательности гена-мишени в геноме пациента. В некоторых вариантах осуществления проведение первой амплификации полинуклеотидов включает комбинирование биологического образца с композицией, содержащей праймеры, специфичные для полинуклеотидной последовательности-мишени, и праймеры, специфичные для эталонной полинуклеотидной последовательности, и проведение анализа полимеразной цепной реакцией (ПЦР) так, чтобы раздельно амплифицировать полинуклеотид-мишень и эталонный полинуклеотид, по существу, в равной пропорции. В некоторых вариантах осуществления первая амплификация полинуклеотидов состоит из количества термоциклов от 4 до 15. В некоторых вариантах осуществления реакционные объемы помещают в микрожидкостное устройство и первую амплификацию полинуклеотидов проводят в реакционном объеме отдельно от микрожидкостного устройства. В некоторых вариантах осуществления перед этапом распределения весь или часть амплифицированного образца комбинируют с реагентами, выбранными для амплификации последовательности генамишени и последовательности эталонного гена. Как правило, используют часть, а амплифицированный образец до распределения части можно разбавить до реакционных объемов. В некоторых вариантах осуществления амплификация представляет собой амплификацию ПЦР. В некоторых вариантах осуществления праймеры для амплификации последовательности эталонного гена, используемые на этапе первой амплификации полинуклеотидов, являются такими же, как праймеры, используемые на этапе второй амплификации полинуклеотидов. В некоторых вариантах осуществления праймеры для амплификации последовательности гена-мишени, используемые на этапе первой амплификации полинуклеотидов, являются такими же, как праймеры, используемые на этапе второй амплификации полинуклеотидов. В некоторых вариантах осуществления реагенты включают первый зонд,специфически гибридизующийся с последовательностью гена-мишени, и второй зонд, специфически гибридизующийся с последовательностью эталонного гена в условиях, пригодных для амплификации полинуклеотидов. В некоторых вариантах осуществления первый и второй зонды содержат различные детектируемые метки, где связывание первого или второго зонда или деградация первого или второго зонда при полимеразной цепной реакции (ПЦР) на основе полимеризации приводит к изменению детектируемой флуоресценции соответствующей детектируемой метки. В некоторых вариантах осуществления последовательность эталонного гена содержит полинуклеотидную последовательность, по меньшей мере, частично кодирующую фермент РНКазу P, -актин илиGAPDH. В некоторых вариантах осуществления определение относительного количества копий последовательности гена-мишени включает детекцию потери гетерозиготности в геноме индивидуума. В некоторых вариантах осуществления отношение последовательности гена-мишени к последовательности эталонного гена со значением, значительно большим или меньшим 1, указывает на потерю гетерозиготности в геноме пациента. Для более полного понимания содержания и преимуществ настоящего изобретения следует дать указание на последующее подробное описание, взятое в сочетании с сопровождающими рисунками. Рисунки представляют варианты осуществления настоящего изобретения посредством иллюстрации. Изобретение можно модифицировать в различных отношениях без отклонения от изобретения. Таким образом, рисунки/фигуры и описание этих вариантов осуществления являются по своему характеру иллюстративными, а не ограничивающими. Краткое описание чертежей Фиг. 1 представляет собой логическую схему, иллюстрирующую общие этапы способа по изобретению, как описано в настоящем документе. На фиг. 2 А-2 В показаны иллюстративные устройства каналов микрожидкостного устройства в соответствии с вариантами осуществления настоящего изобретения. Фиг. 3 представляет собой упрощенную схему микрожидкостного устройства в соответствии с вариантами осуществления настоящего изобретения. На фиг. 4 А-4 С изображены части микрожидкостного устройства, проиллюстрированного, например, на фиг. 1. На фиг. 5 показаны иллюстративные результаты анализа вариации количества копий, проводимого с применением микрожидкостного устройства. На фиг. 6 показаны иллюстративные результаты анализа потери гетерозиготности, проводимого с применением микрожидкостного устройства. Фиг. 7 представляет собой график, отображающий детекцию потери гетерозиготности в соответствии с вариантом осуществления настоящего изобретения. Фиг. 8 представляет собой схему, отображающую частичные результаты воображаемого эксперимента, в котором определяли количество копий последовательности-мишени Т. Представлена матрица реакционных объемов 6464, в которой с применением меченых VIC (желтый) зондов амплифицирована и детектирована последовательность-мишень и с применением меченых FAM (зеленый) зондов амплифицирована и детектирована однокопийная эталонная последовательность. Выявлено 19 реакционных объемов, меченых желтым, и 12 реакционных объемов, меченых зеленым, что указывает на отношение приблизительно 1,5 (19/12=1,581,5), указывающим, что в диплоидном геноме присутствует три копии последовательности-мишени. Подробное описание изобретения Настоящее изобретение относится к способам и системам для определения количества копий полинуклеотидной последовательности-мишени в геноме пациента, включая вариации количества копий, ассоциированные с генетическими заболеваниями. В частности, способы и системы, описываемые в настоящем документе, можно использовать для детекции вариации количества копий полинуклеотидамишени в геноме пациента с применением геномного материала, присутствующего в образце, полученном у пациента. В способах по настоящему изобретению для определения относительного количества копий полинуклеотидной последовательности-мишени и эталонной полинуклеотидной последовательности в образце, как правило, применяют основанные на амплификации полинуклеотидов анализы. Количество копий в геноме для эталонной последовательности известно. По существу, количество копий полинуклеотида-мишени можно анализировать относительно эталонного полинуклеотида так, чтобы определять относительное количество копий полинуклеотида-мишени. Полинуклеотидную последовательность-мишень и/или эталонную полинуклеотидную последовательность иногда обозначают как "гены". Однако следует понимать, что термин "ген" не означает последовательность, обязательно кодирующую белок (или РНК). В способах детекции и анализа количества копий можно применять различные высокопроизводительные устройства, пригодные для так называемого "цифрового анализа" или "цифровой ПЦР", такие как микрожидкостные устройства, содержащие большое количество или высокую плотность участков для реакции в малом объеме (например, ячейки или реакционные объемы с нанообъемом). Таким образом, способы детекции и анализа вариации количества копий по настоящему изобретению могут включать распределение или разделение образца по сотням или тысячам реакционных объемов, расположенных в платформе или микрожидкостном устройстве для реакции/анализа, включая иллюстративные устройства, описываемые в настоящем документе. Способы по настоящему изобретению включают этап преамплификации, в котором ДНК (например, геномную ДНК) из биологического образца амплифицируют с применением полимеразной цепной реакции (ПЦР) или других количественных способов амплификации. Иллюстративные биологические образцы включают клетки (включая лизированные клетки и клеточные гомогенаты), сыворотку и биологические жидкости. Хотя способы в настоящем документе описаны, как правило, по отношению к ДНК человека (например, с определением вариации количества копий в геноме пациента-человека), понятно,что эти способы можно модифицировать/применять для любого образца с вариациями количества генетического материала. Например, способы можно использовать для генетического анализа животных,растений, бактерий и грибов, а также для генетического анализа человеческих индивидуумов. Способы сбора и обработки биологических образцов, содержащих ДНК, хорошо известны, и нет необходимости обсуждать их в этом документе. Для анализов по изобретению ДНК можно выделять из клеток или биологических жидкостей или анализ можно проводить с применением, например, клеточного лизата, содержащего ДНК. Таким образом, в настоящем документе "образец ДНК" может относиться к ДНК, особенно геномной ДНК, в очищенной, полуочищенной или неочищенной форме. В настоящем документе этап "получения образца ДНК у субъекта" просто относится к тому факту, что образец ДНК представляет собой исходное вещество для последующих аналитических этапов (например, этап преамплификации)."Получение образца ДНК" не означает процесс, например, забора клеток у субъекта или выделения ДНК,но может просто представлять собой получение пробирки, содержащей предварительно полученную ДНК. На фиг. 1 представлены общие этапы осуществления способов, описываемых в настоящем документе. В одном иллюстративном варианте осуществления этапы способа включают предоставление основной смеси для преамплификации, содержащей праймеры для анализа, подходящую буферную систему, нуклеотиды и фермент ДНК-полимеразу (такую как фермент полимераза, модифицированный для условий "горячего старта"), добавление геномной ДНК к основной смеси для преамплификации, преамплификацию представляющей интерес последовательности(ей) и эталонной последовательности и оценку преамплифицированных последовательностей посредством анализа цифровой ПЦР (или в анализе конечной точки, или в анализе с детекцией в реальном времени) и сравнение частоты последовательности-мишени(ей) относительно частоты эталонной последовательности. Понятно, что фиг. 1 предоставле-4 018555 на для облегчения понимания изобретения и не предназначена для ограничения изобретения. На начальном этапе (фиг. 1) проводят преамплификацию, первую амплификацию полинуклеотидов образца ДНК, полученного у индивидуума. На этапе преамплификации амплифицируют и полинуклеотидную последовательность-мишень, и эталонную полинуклеотидную последовательность. Способы амплификации ПЦР хорошо известны, и нет необходимости их обсуждения в данном документе. В некоторых вариантах осуществления последовательность-мишень представляет собой последовательность, для которой делеция или дупликация ассоциированы с представляющим интерес фенотипом. В некоторых вариантах осуществления последовательность-мишень представляет собой последовательность, для которой делеция или дупликация не ассоциированы с известным представляющим интерес фенотипом, но для которой желательна информация о распределении или корреляции вариации в конкретных популяциях. Эталонная последовательность представляет собой последовательность с известным (или предполагаемым) количеством копий в геноме. Таким образом, эталонная последовательность представляет собой последовательность, для которой вероятность амплификации или делеции в геноме низка. Эмпирически определять количество копий эталонной последовательности в каждом анализе не обязательно. Предпочтительнее количество копий можно предположить на основе нормального количества копий в представляющем интерес организме. Например, одной из подходящих эталонных последовательностей в геноме человека является последовательность гена РНКазы P, однокопийного гена, представленного в диплоидном геноме двумя копиями (и с количеством копий 1 на гаплоидный геном). Для иллюстрации, другие пригодные эталонные последовательности включают -актин и глицеральдегид-3-фосфатдегидрогеназу(GAPDH); однако следует понимать, что изобретение не ограничено конкретной эталонной последовательностью. Преамплификацию можно проводить в виде реакции ПЦР с праймерами для РНКазы P (эталонный ген) и представляющего интерес гена-мишени. Как правило, реакции проводят в ограниченном количестве термальных циклов (например, 5 или 10 циклов). В некоторых вариантах осуществления оптимальное количество циклов зависит от эффективности ПЦР для эталонного гена и гена-мишени. В определенных вариантах осуществления количество термальных циклов при анализе преамплификации может находиться в диапазоне приблизительно 4-15 термальных циклов или приблизительно 4-10 термальных циклов. В определенных вариантах осуществления количество термальных циклов может составлять 3,4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15 или более 15. Реакции преамплификации предпочтительно являются количественными или пропорциональными. Т.е. относительное количество (соотношение) ампликонов последовательностей мишени и эталона должно отражать относительное количество (соотношение) последовательностей мишени и эталона в геномной (или другой) ДНК, подвергаемой амплификации. Способы количественной амплификации известны в данной области. См., например, Arya et al., 2005, Basic principles of real-time quantitative PCR, Expert RevMol Diagn. 5(2):209-19. В случае дуплицированных генов праймеры следует выбирать так, чтобы каждая дуплицированная копия представляющего интерес гена-мишени амплифицировалась раздельно. Таким образом, после селективной преамплификации и распределения образца на отдельные реакционные объемы в реакционные объемы распределяется пропорциональное количество ампликонов, соответствующих каждой последовательности. Так как вновь синтезированные молекулы обоих генов отражают исходное соотношение, посредством последующего анализа количества копий можно подсчитать количество молекул гена-мишени и эталонного гена. В результате можно точно измерить соотношение двух генов. Так как количество копий эталонной последовательности известно, можно определить количество копий представляющей интерес последовательности. Желательно, чтобы эффективность амплификации последовательностей мишени и эталона являлась сходной или приблизительно равной, для того чтобы не вносить каких-либо отклонений в соотношение количества копий двух генов. Поэтому для получения этого результата следует подбирать пары праймеров и условия амплификации. Эффективность амплификации любой пары праймеров можно легко определить с применением стандартных способов (см., например, Furtado et al. "Application of real-timequantitative PCR in the analysis of gene expression". DNA amplification: Current Technologies and Applications. Wymondham, Norfolk, UK: Horizon Bioscience, p. 131-145 (2004. Хотя желательно, чтобы эффективность амплификации последовательностей мишени и эталона была приблизительно равной, ограниченное количество термальных циклов преамплификации (как правило, менее 15, как правило, 10 или менее 10, наиболее часто приблизительно 5) значительно сглаживает любые различия в эффективности так, что вероятно, что обычные различия оказывают недостоверный эффект на результаты авторов изобретения. Как указано, способы амплификации известны в данной области. Для иллюстрации, реакционная смесь, используемая для способа преамплификации (состав или смесь для преамплификации), как правило, содержит подходящий буфер, источник ионов магния (Mg2+) в диапазоне приблизительно от 1 до приблизительно 10 мМ, предпочтительно в диапазоне приблизительно от 2 до приблизительно 8 мМ,нуклеотиды и, необязательно, детергенты и стабилизаторы. Пример одного из подходящих буферов представляет собой буфер TRIS в концентрации приблизительно от 5 до приблизительно 85 мМ, с пред-5 018555 почтительной концентрацией от 10 до 30 мМ. В одном из вариантов осуществления концентрация буфера TRIS в форме двукратной (2) реакционной смеси составляет 20 мМ. рН реакционной смеси может составлять приблизительно от 7,5 до приблизительно 9,0, с типичным диапазоном рН приблизительно от 8,0 до приблизительно 8,5. Концентрация нуклеотидов может находиться в диапазоне приблизительно от 25 до приблизительно 1000 мМ, как правило, в диапазоне приблизительно от 100 до приблизительно 800 мМ. Примеры концентраций dNTP составляют 100, 200, 300, 400, 500, 600, 700 и 800 мМ. Также в реакционную смесь можно включать детергенты, такие как Tween 20, Triton X 100 и Nonidet P40. Также можно включать стабилизаторы, такие как дитиотреитол (DTT, реактив Клеланда) или меркаптоэтанол. Реакционная смесь для преамплификации содержит праймеры для реакции преамплификации. Последовательность праймеров, как правило, является такой же, как последовательность праймеров для использования в последующем анализе ПЦР, для которого получают образец, хотя, как правило, концентрация праймеров является более низкой. Концентрация праймеров может быть более высокой, равной или более низкой, чем концентрация праймеров, используемая для анализа ПЦР. Варианты осуществления включают применение праймеров, концентрация которых приблизительно в 50, 25, 20, 10 или 5 раз выше, равна или в 10, 20, 35, 50, 65, 75, 100, 125, 150, 175 и 200 раз ниже, чем концентрация праймеров в анализе ПЦР. Праймеры, используемые при преамплификации, могут включать случайные праймеры,поли-А хвосты и специфические праймеры, сконструированные для представляющего интерес анализа ПЦР. Реакционная смесь может необязательно содержать эталонный краситель для нормализации фактических результатов последующего количественного анализа ПЦР. Примером стандартного коммерчески доступного эталонного красителя является ROX. Коммерчески доступная реакционная смесь, содержащая краситель ROX, представляет собой 2 реакционную смесь, CellsDirect с каталожными 11754-100 и 11754-500, доступную в Invitrogen Corporation. Также в реакционную смесь добавляют фермент ДНК-полимеразу (например, полимеразу Taq). В одном из вариантов осуществления полимераза Taq, такая как Platinum Taq DNA, представляет собой рекомбинантную ДНК-полимеразу Taq в комплексе с антителом, которое ингибирует полимеразную активность при температурах окружающей среды. Полная полимеразная активность восстанавливается после этапа денатурации при ПЦР, обеспечивая "горячий старт". Преамплифицированные образцы, полученные способами по настоящему изобретению, особенно подходят для анализов цифровой ПЦР и для распознавания хромосомной дупликации генов. В частности, преамплифицированный образец анализируют во множестве экспериментов с ПЦР в малом объеме. В цифровой ПЦР на образце геномной ДНК проводят идентичные (или в значительной мере сходные) анализы. Количество отдельных реакций для данного геномного образца может варьировать приблизительно от 2 до более чем 1000000. Предпочтительно количество анализов, проводимых на образце, составляет 100 или более, более предпочтительно 200 или более, более предпочтительно 300 или более. Также можно проводить более масштабную цифровую ПЦР, в которой количество анализов, проводимых на образце, составляет 500 или более, 700 или более, 765 или более, 1000 или более, 2500 или более,5000 или более, 7500 или более или 10000 или более. Количество проводимых анализов также может быть значительно большим, таким как приблизительно до 25000, приблизительнодо 50000, приблизительно до 75000, приблизительно до 100000, приблизительно до 250000, приблизительно до 500000, приблизительно до 750000, приблизительно до 1000000 или более чем 1000000 анализов на геномный образец. Количество ДНК, используемой в анализе цифровой ПЦР, как правило, выбирают так, чтобы в каждой отдельной реакции цифровой ПЦР присутствовал один фрагмент нуклеиновой кислоты или менее. Как проиллюстрировано на фиг. 1, после этапа преамплификации образец (или его часть), содержащий продукт преамплификации с пропорционально амплифицированным генетическим материалом(например, ампликоны, соответствующие полинуклеотидным последовательностям мишени и эталона),распределяют в отдельные ячейки или реакционные объемы так, что каждая реакционная лунка содержит, например, в среднем не более чем приблизительно один ампликон на объем. Таким образом, большинство реакционных объемов не содержат ампликонов, содержат один ампликон последовательностимишени, ампликон или один ампликон эталонной последовательности. Как правило, удобно разбавлять преамплифицированный образец (как правило, 1:10-1:20) и/или использовать небольшую часть амплифицированного образца с тем, чтобы отрегулировать концентрацию ампликонов так, чтобы на реакционный объем приходилось только (в среднем) ни одного или один ампликон. Хотя в некоторых случаях продукт этапа преамплификации можно использовать без добавления дополнительных реагентов для амплификации (например, полимеразы), как правило, удобно добавлять новые реагенты для амплификации, необязательно включающие другие праймеры. Таким образом, биологический образец до распределения или после него можно комбинировать с реагентами, выбранными для количественной или неколичественной амплификации полинуклеотидной последовательности-мишени и эталонного полинуклеотида 12 (этап 2). Кроме того, хотя этап преамплификации, как правило, представляет собой амплификацию по типу ПЦР, вторую амплификацию (т.е. амплификацию последовательностей ампликонов, полученных при преамплификации) можно проводить с применением любого способа амплификации, например и без ограничения, такого как Nasba (Compton, 1991. Nucleic Acid Sequence-based Amplification, Nature. 350:9191, 1991) и протокол Эбервайна (Van Gelder et al., Amplified RNA synthesized from limited quantities ofheterogeneous cDNA. Proc. Natl. Acad. Sci. USA. 1990). Как указано выше, следует понимать, что для достижения желательного распределения количество матриц ДНК и ампликонов (функция количества исходной геномной ДНК, количества циклов амплификации, эффективности амплификации и размера реакционных объемов) можно регулировать. Специалист в данной области может определить концентрацию ампликонов в продуктах преамплификации и рассчитать соответствующее количество для введения. Более удобно можно тестировать набор серийных разведений продукта преамплификации. Например, устройство, представленное на фиг. 3 (коммерчески доступное в Fluidigm Corp. как цифровой биочип 12.765 BioMark (BioMark 12.765 Digital Array позволяет производить для одновременного тестирования 12 разбавлений. Необязательно оптимальное разбавление можно определить, получая график линейной регрессии. Для оптимального разбавления линия должна быть прямой и проходить через начало координат. Затем концентрацию исходных образцов можно рассчитать из графика. После распределения геномный материал, содержащийся во множестве реакционных камер, можно амплифицировать для дальнейшего проведения анализов образца с тем, чтобы определить количество реакционных объемов, в которых изолированы ампликоны, соответствующие последовательности мишени или эталона (фиг. 1, этап 14). Вторую амплификацию можно проводить с применением тех же праймеров, что использовались для преамплификации, или других праймеров (например, вложенный набор). Можно проводить дифференциальные детекцию и анализ образца так, чтобы различить сигнал,идущий от полинуклеотида-мишени по сравнению с эталонным полинуклеотидом (фиг. 1, этап 16). Например, для расчета отношения количества реакционных объемов, содержащих полинуклеотидные последовательности-мишени, и количества реакционных объемов, содержащих эталонные полинуклеотидные последовательности, можно использовать анализ отдельных реакционных ячеек. Способы могут дополнительно включать детекцию и анализ генетически зависимой информации о последовательностяхмишенях в геноме индивидуума, включая детекцию генетических делеций или дупликаций, потери гетерозиготности и т.п., таких как анеуплоидия (например, трисомия) и другие многочисленные генетические аномалии. Ниже предоставлены дополнительные подробности об этапах способа, включая различные способы дифференциальных детекции и анализа. Как описано выше, образец, содержащий продукт преамплификации или неамплифицированный генетический материал, можно распределить в отдельные ячейки или реакционные объемы платформы для детекции и анализа. Распределение образца можно проводить с применением различных способов и устройств, например, таких как проточное распределение в микрожидкостных устройствах, содержащих множество реакционных ячеек/камер малого объема. Как правило, этап распределения в способах, описываемых в настоящем документе, применяют для разделения представляющего интерес материала образца, например последовательностей мишени и эталона, в отдельные реакционные ячейки для дальнейшей детекции и анализа. В каждых из множества реакционных ячеек или объемов можно проводить один или несколько анализов амплификации, включая количественный анализ/амплификацию полинуклеотидной последовательности-мишени и выбранной эталонной полинуклеотидной последовательности с детекцией мультиплексных реакций. Соотношение детектируемых последовательностей в образце можно рассчитывать с применением таких способов детекции, как анализ цифровой ПЦР, мониторинг кривых ПЦР с детекцией в реальном времени и/или сравнение конечных картин камер с положительной реакцией для одного анализа в сравнении с другим анализом. Альтернативно, концентрацию любой последовательности в образце ДНК (копий/мкл) можно рассчитывать с использованием камер с положительной реакцией в устройстве, содержащем по меньшей мере одну копию этой последовательности, а для расчета количества копий можно определять отношение концентраций последовательностей мишени и эталона. См. совместно рассматриваемую патентную заявку США 12/170414 "Method and Apparatus for Determining CopyNumber Variation Using Digital PCR", включенную в качестве ссылки для всех целей. Также см. Dube etNanofluidic Device", PLoS ONE, 3(8):e2876. doi:10,1371/journal.pone.0002876, включенную в качестве ссылки для всех целей. Как описано выше, настоящее изобретение относится к способам и основанным на амплификации способам определения вариации количества копий полинуклеотида-мишени, например, в геноме пациента, и в некоторых случаях до распределения образца в микрожидкостном устройстве можно проводить этап преамплификации для последующей количественной амплификации и анализа. Преамплификация может быть желательна, например, когда несколько копий одного гена-мишени близко расположены на одной и той же хромосоме и, таким образом, последовательности-мишени нельзя оптимальным образом отделить друг от друга при количественном анализе, например, в виде распределения в микрожидкостном устройстве. В таких случаях несколько копий гена-мишени можно недосчитать или количественно определить как одну молекулу, а не как две. Таким образом, общее количество копий гена может остаться недооцененным. По настоящему изобретению расчеты CNV, как правило, включают расчет "относительного количества копий" с тем, чтобы успешно отличать выраженные отличия в количествах копий гена в различных образцах от искажений или шума/ошибок анализа, таких как искажения, вызываемые различием в количестве образцов. Относительное количество копий гена (на геном) можно выражать в виде отношения количества копий гена-мишени к количеству копий однокопийного эталонного гена в образце ДНК с известной концентрацией (количеством копий) в геноме пациента, которое, как правило, равно 1. Применяя два анализа для двух генов (полинуклеотид-мишень и эталонный полинуклеотид) с двумя различными метками (например, флуоресцентные носители) на том же цифровом чипе, способы, описываемые в настоящем документе, можно использовать для одновременного количественного анализа обоих генов в одном и том же образце ДНК. Альтернативно и менее удобно, амликоны-мишени (после преамплификации) можно амплифицировать на одном чипе из набора реакционных объемов и тестовые ампликоны(после преамплификации) можно анализировать в другом наборе ампликонов, а данные сравнивать. Отношение этих двух генов представляет собой относительное количество копий полинуклеотидной последовательности-мишени или представляющего интерес гена в образце ДНК. В одном из подходов этот способ можно обобщить как определяющий количество реакционных объемов, в которых представлена полинуклеотидная последовательность-мишень или ее подпоследовательность (А), и определяющий количество реакционных объемов, в которых представлена эталонная полинуклеотидная последовательность или ее подпоследовательность (В), и определяющий, что количество копий полинуклеотидамишени в геноме приблизительно составляет (А)/(В)N, где N представляет собой предопределенное количество копий эталонной последовательности в геноме. Следует понимать, что (А)/(В)N представляет количество копий приблизительно, так как плоидность в большинстве организмов является низкой(например, у людей в норме содержится две копии соматических хромосом), тогда как количество детектируемых по настоящему изобретению ампликонов, по существу, подвержено экспериментальным ошибкам. Например, (А) можно экспериментально определить как 936, а (В) можно экспериментально определить как 596 и N может представлять собой 1 на гаплоидный геном. (А)/(В)N равно 1,57 (приблизительно 1,5), что можно понимать, что представлено приблизительно 1,5 копий А на гаплоидный геном(т.е. трисомия А). См. фиг. 8 и пример ниже. В практическом осуществлении изобретения можно использовать множество платформ для детекции или микрожидкостных устройств и способов. В некоторых вариантах осуществления устройства можно конструировать с применением широкого разнообразия материалов, таких как стекло, пластик,силикон, эластомерные полимеры (например, полидиметилсилоксан, полиуретан или другие полимеры). В определенных вариантах осуществления настоящего изобретения микрожидкостные устройства, используемые для осуществления аспектов по настоящему изобретению, как правило, конструируют, по меньшей мере частично, из эластомерных материалов и конструируют способами одно- или многослойной мягкой литографии (MSL) и/или способами инкапсуляции временных слоев (см., например, Unger etal., 2000, Science. 288:113-116 и публикацию РСТ WO 01/01025, которые обе в полном объеме включены в настоящий документ в качестве ссылки для всех целей). С применением этих способов можно конструировать микрожидкостные устройства, в которых контролируется поток раствора через каналы устройства, по меньшей мере частично, с одним или несколькими контрольными каналами, которые отделены от проточного канала эластомерной мембраной или сегментом. Эту мембрану или сегмент можно отклонять в проточный канал или втягивать из проточного канала, с которым связан контрольный канал,прикладывая управляющее усилие к контрольным каналам. Контролируя степень, с которой мембрана отклонена в проточный канал или втянута из проточного канала, поток раствора через проточный канал можно замедлить или полностью блокировать. Используя сочетание контрольных и проточных каналов этого типа, можно получать множество различных типов клапанов и нагнетателей для регуляции потока раствора, как описано более подробно в Unger et al., выше, публикациях РСТ WO 02/43615 иWO 01/01025. Распределение образца в микрожидкостные устройства, описываемые в настоящем документе,можно проводить частично вследствие определенных свойств эластомерных материалов, которые, как правило, общепризнанны в данной области. Например, в Allcock et al. (Contemporary Polymer Chemistry,2nd Ed.) "эластомеры" или "эластомерный материал" описаны в основном как полимеры, существующие при температуре от их температуры стеклования до температуры плавления. Эластомерные материалы демонстрируют эластические свойства потому, что полимерные цепи быстро претерпевают торсионное движение, обеспечивая раскручивание основных цепей в ответ на усилие со скручиванием основных цепей с восстановлением прежней формы в отсутствие усилия. В основном эластомеры деформируются при приложении усилия, но они восстанавливают свою исходную форму, когда усилие устраняют. Эластичность, демонстрируемую эластомерными материалами, можно охарактеризовать модулем Юнга. Эластомерные материалы, применяемые в микрожидкостных устройствах, описываемых в настоящем документе, как правило, имеют модуль Юнга приблизительно от 1 Па до 1 ТПа, в других случаях приблизительно от 10 Па до 100 гПа, в других случаях приблизительно от 20 Па до 1 гПа, в других случаях приблизительно от 50 Па до 10 мПа, а в некоторых случаях приблизительно от 100 Па до 1 мПа. В зависимости от конкретного применения также можно использовать эластомерные материалы с модулем Юнга вне этих диапазонов. При наличии огромного разнообразия химического состава, предшественников, способов синтеза,условий реакции и возможных добавок для полимеров, для определенных применений и приложений можно выбрать широкий диапазон свойств. Таким образом, в отношении настоящего изобретения существует большое количество возможных эластомерных систем, которые можно использовать для получения монолитных эластомерных микроклапанов и нагнетателей. Некоторые из микрожидкостных устройств, описываемых в настоящем документе, получают из такого эластомерного полимера, как GE RTV 615 (состав), сшитого винилсиланового (тип) силиконового эластомера (семейство). Однако современные микрожидкостные системы не ограничены одним этим составом, типом или даже этим семейством полимеров; вернее, что подходит почти любой эластомерный полимер. Выбор материалов, как правило,зависит от конкретных свойств материала (например, устойчивость к растворителям, прочность, газопроницаемость и/или термостабильность), необходимых для осуществления применения. Дополнительные подробности о типе эластомерных материалов, которые можно использовать при изготовлении компонентов микрожидкостных устройств, описываемых в настоящем документе, приведены в Unger et al.(2000), Science. 288:113-116 и публикациях РСТ WO 02/43615 и WO 01/01025, которые включены в настоящий документ в качестве ссылки в полном объеме для всех целей. Изготовление устройства и термоциклирование. Как указано, способы по настоящему изобретению могут включать применение широкого разнообразия платформ для детекции, включая высокопроизводительные микрожидкостные устройства, пригодные для цифрового анализа или цифровой ПЦР. Аспекты изготовления устройства, компоненты системы и аспекты термоциклирования более подробно описаны ниже. В одном из вариантов осуществления микрожидкостные устройства, пригодные для использования в настоящем изобретении, можно конструировать с использованием способов одно- и многослойной мягкой литографии (MSL) и/или способов инкапсуляции временных слоев. Один из основных подходовMSL включает отливку ряда эластомерных слоев на полученной на микромашине форме, удаление слоев из формы, а затем сплавление слоев вместе. В подходе с инкапсуляцией временных слоев там, где желательны каналы, наносят шаблоны фоторезиста. Эти способы и их применение для получения микрожидкостных устройств подробно обсуждаются, например, в Unger et al. (2000), Science. 288:113-116 и в Chou,et al. (2000), "Integrated Elastomer Fluidic Lab-on-a-chip-Surface Patterning and DNA Diagnostics", вProceedings of the Solid State Actuator and Sensor Workshop, Hilton Head, S.C. и в публикации РСТ WO 01/01025, каждая из которых включена в настоящий документ в качестве ссылки в полном объеме для всех целей. В кратком изложении, указанные выше иллюстративные способы изготовления исходно включают изготовление материнских форм для верхних слоев (например, эластомерный слой с контрольными каналами) и нижних слоев (например, эластомерный слой с проточными каналами) на силиконовых пластинах посредством фотолитографии с фоторезистом (Shipley SJR 5740). Высоту каналов можно точно контролировать посредством скорости получаемого центрифугированием покрытия. Фоторезистивные каналы получают, воздействуя на фоторезист УФ-излучением с последующим расширением. Процесс теплового плавления и защитная обработка, как правило, осуществляют, как описано в М.А. Unger, H.-P.Chou, Т. Throsen, A. Scherer and S.R. Quake, Science (2000), 288:113, включенный в настоящий документ в качестве ссылки в полном объеме. Затем смешанный состоящий из двусоставного силикона эластомер(GE RTV 615) центрифугируют в нижнюю форму и вливают в верхнюю форму соответственно. Полученное центрифугированием покрытие можно использовать для контроля толщины нижнего слоя полимерной жидкости. Частично высушенный верхний слой снимают с его формы после термообработки в печи при 80C в течение 25 мин, выравнивают и объединяют с нижним слоем. Для окончательного скрепления этих двух слоев используют конечную термическую обработку в течение 1,5 ч при 80C. После снятия с нижней силиконовой материнской формы это RTV-устройство, как правило, обрабатывают HCl(0,1 Н, 30 мин при 80C). Эту обработку применяют для разрушения некоторых связей Si-O-Si, таким образом экспонируя гидроксигруппы, что делает каналы более гидрофильными. Затем устройство можно необязательно герметично прикреплять к подложке. Подложку можно изготавливать, по существу, из любого вещества, хотя поверхность должна быть гладкой для обеспечения хорошего прикрепления, так как формируемое прикрепление осуществляет в основном за счет сил адгезии. Примеры подходящих подложек включают стекло, пластики и т.п. Устройства, получаемые указанным выше способом, приводят к получению субстрата (например,стеклянной пластины), образующей одну стенку проточного канала. Альтернативно, устройство после снятия с материнской формы прикрепляют к тонкой эластомерной мембране так, чтобы проточный канал полностью находился в эластомерном материале. Полученное эластомерное устройство затем можно необязательно скреплять с опорной подложкой. Получение слоев. В одном из вариантов осуществления микрожидкостные устройства, включая микрожидкостные устройства, в которых реагенты распределяются по реакционным ячейкам при производстве, получают из трех слоев. Нижний слой представляет собой слой, на котором расположены реагенты. Нижний слой можно получать из различных эластомерных материалов, как описано в цитируемых выше ссылках о способах MLS. Как правило, материал представляет собой полидиметилсилоксановый (PDMS) эластомер. В зависимости от расстановки и расположения реакционных ячеек, которые желательны для конкретного устройства, можно определить расположение на нижнем слое, на котором нужно разместить соответствующие реагенты. Так как PDMS гидрофобен, наносимая капля водного раствора уменьшается с образованием очень маленького пятна. Необязательно наносимые реагенты наносят так, чтобы между реагентом и поверхностью эластомера не формировалась ковалентная связь, так, как описано ранее, реагенты предназначены для растворения в растворе образца после внесения его в реакционную ячейку. Другие два слоя устройства представляют собой слой, в котором формируют проточные каналы, и слой, в котором формируют контрольные и необязательные защитные каналы. Эти два слоя получают обычными способами, указанными в этом разделе ранее. Затем полученную двухслойную структуру помещают на верх первого слоя, на котором нанесены реагенты. Конкретный пример состава трех слоев представляет собой следующее (отношение компонента А к компоненту В): первый слой (слой образца) 30:1 (по массе); второй слой (слой проточных каналов) 30:1 и третий слой (контрольный слой) 4:1. Однако понятно, что также можно использовать другие составы и соотношения эластомерных компонентов. В течение этого процесса реакционные ячейки выравнивают с нанесенными реагентами так, чтобы реагенты располагались в соответствующих реакционных ячейках. В соответствии с настоящим изобретением термоциклирование можно проводить на микрожидкостных устройствах. В частности, термоциклирование можно использовать для проведения реакций амплификации, которые облегчают анализ образца, распределенного в реакционных камерах. Для контроля температуры в выбранных областях микрожидкостного устройства или всего устройства доступен ряд различных оснащений различной сложности. Таким образом, в настоящем документе термин "контроллер температуры" в широком смысле относится к устройству или элементу, который может регулировать температуру всего микрожидкостного устройства или внутри части микрожидкостного устройства (например, в конкретной температурной области или на одном или нескольких контактах в матрице микрожидкостного устройства с каналами слепого типа). Как правило, устройства помещают на термоциклическую плату для термоциклирования устройства. Множество таких плат легкодоступны в коммерческих источниках, включающих, например, ThermoHybaid Px2 (Franklin, MA), MJ Research PTC-200 (South San Francisco, CA), Eppendorf PartE5331(Westbury, NY), Techne Part205330 (Princeton, NJ). Для обеспечения точности стадий термоциклирования в некоторые устройства, в различные области устройств удобно встраивать сенсоры, детектирующие температуру. Одним из устройств детекции температуры является термопара. Такую термопару можно получать в виде тонкослойных проводов, нанесенных на подлежащий материал подложки, или как провода, встроенные непосредственно в сам микротехнологически полученный эластомерный материал. В систему/устройство по настоящему изобретению можно включать различные средства детекции/мониторинга температуры. Например, температуру также можно измерять по изменению электрического сопротивления. Другим типом структуры, доступной для детекции температуры в областях устройства для амплификации, являются термохроматические вещества. Другим подходом к детекции температуры является применение инфракрасной камеры. Еще одним подходом к детекции температуры является использование пироэлектрических датчиков. Для детекции температуры в соответствии с вариантами осуществления настоящего изобретения можно применять другие электрические явления, такие как емкость и индуктивность. С применением известных уравнений для коэффициента теплопроводности и соответствующих значений для эластомеров и стекла, применяющихся в устройстве, можно рассчитать время, необходимое для достижения температуры в реакционной ячейке, той температуры, которую должен поддерживать контроллер. В дополнение к различным потенциально подходящим составам и свойствам материалов, подходящие для применения по настоящему изобретению микрожидкостные устройства могут включать множество элементов, конструкций, структур каналов и т.п. Устройства, как правило, содержат множество"проточных каналов", которые, как правило, относятся к пути протока, по которому может течь раствор. Дополнительно, устройства могут содержать "контрольные каналы" или каналы, сконструированные для взаимодействия с проточными каналами так, что их можно использовать для запуска потока через проточные каналы. Устройства могут дополнительно включать элементы для дополнительной регулировки тока жидкости, такие как "клапан", которые могут включать конфигурацию, в которой проточный канал и контрольный канал пересекаются и разделены эластомерной мембраной, которую можно отклонять в проточный канал или втягивать из проточного канала в ответ на управляющее усилие. Также определенные варианты осуществления могут включать "сквозное соединение", которое означает канал, форми- 10018555 руемый в эластомерном устройстве для обеспечения жидкости доступа от внешнего порта устройства к одному или нескольким проточным каналам. Таким образом, сквозное соединение может служить, например, в качестве устройства ввода или вывода образца. В настоящем изобретении можно применять множество типов структуры или строения каналов. Как проиллюстрировано на фиг. 2 А, один из типов структуры каналов, который можно включать в устройство по настоящему изобретению, относится к структуре открытых каналов. "Открытые каналы" или"каналы с открытыми концами" относятся к проточному каналу, расположенному между отдельными сквозными соединениями так, что проточный канал имеет вход (например, входное отверстие), отдельно от выхода (например, выходное отверстие). В основном структура сети открытых каналов включает по меньшей мере два противоположных сквозных соединения или входных отверстий проточных каналов,которые могут соединять, приблизительно один или множество разветвленных проточных каналов с образованием сети открытых каналов. Для изоляции отдельных областей разветвленных каналов можно приводить в действие один или несколько клапанов, образуемых смежным/перекрывающим контрольным каналом, с образованием реакционных ячеек. Такие клапаны обеспечивают механизм для переключаемой изоляции множества реакционных ячеек. Как описано в настоящем документе, устройства могут включать один или несколько открытых проточных каналов, из которых один или несколько каналов разветвляются. Одна или несколько реакционных областей или реакционных ячеек могут располагаться в любом месте по длине проточного канала. Для изоляции реакционной ячейки(ек), расположенной вдоль канала, можно приводить в действие клапан, образуемый перекрывающимся проточным каналом,обеспечивая, таким образом, механизм для переключаемой изоляции реакционных ячеек. Таким образом,каждое устройство может включать большое количество реакционных ячеек (например, 10000+) и в нем можно достигать большой плотности реакционных ячеек, обеспечивая, таким образом, значительное уменьшение размеров этих устройств по сравнению с традиционными микрожидкостными устройствами. Структура открытых каналов может, например, обладать разветвленными проточными каналами,которые можно регулировать более чем из одного положения/сквозного соединения. Этот аспект структуры может быть особенно выгоден, например, если конкретный канал/разветвленный проточный канал перекрыт или блокирован (например, вследствие варианта изготовления, дефекта и т.д.), так как жидкость может входить с различных направлений и заполнять канал до противоположных сторон конкретного заграждения или препятствия. В отличие от этого, канал, доступный только с одного конца при наличии заграждения, можно наполнить только до точки заграждения или препятствия, и, если существуют реакционные ячейки после заграждения, эти ячейки могут оказаться неиспользованными. Как отображено на фиг. 2 В, в микрожидкостных устройствах, пригодных для использования по настоящему изобретению, можно использовать "слепой канал" или структуру с "односторонним наполнением". Такие устройства частично характеризуются наличием одного или нескольких слепых каналов или проточных каналов с глухим концом или изолированным концом так, что раствор может входить в слепой канал или выходить из слепого канала только на одном конце (т.е. для слепого канала нет отдельного входного и выходного отверстий). Этим устройствам для изоляции области слепого канала с образованием изолированной реакционной ячейки необходим только один клапан для каждого слепого канала. При производстве этого типа устройства на реакционные ячейки можно необязательно наносить один или несколько реагентов для проведения анализа, что, таким образом, приводит к значительному уменьшению количества входов и выходов. Таким образом, сеть проточных каналов в сочетании со слепыми каналами можно сконфигурировать так, что многие реакционные ячейки можно заполнить из одного или ограниченного количества входных отверстий (например, менее чем 5 или менее чем 10). Возможность наполнения слепого проточного канала становится осуществимой, так как устройства делают из эластомерного материала, достаточно пористого, чтобы воздух в проточных каналах и слепых каналах мог выходить через эти поры по мере того, как в каналы вводят раствор. Отсутствие пористости материалов,используемых в других микрожидкостных устройствах, препятствует применению структуры со слепыми каналами, так как воздух в слепом канале не имеет возможности выйти при введении раствора. В еще одном варианте осуществления микрожидкостные устройства по настоящему изобретению в дополнение к проточным каналам и клапанам или контрольным каналам могут дополнительно необязательно включать защитные каналы. Для уменьшения испарения образца и реагентов из эластомерных микрожидкостных устройств, которые предоставлены по настоящему документу, в устройствах можно формировать защитные каналы. Защитные каналы подобны контрольным каналам в том, что, как правило, их формируют в слое эластомера, который покрывает проточные каналы и/или реакционную ячейку. Таким образом, подобно контрольным каналам, защитные каналы отделены от подлежащих проточных каналов и/или реакционных ячеек мембраной или сегментом эластомерного материала. Однако в отличие от контрольных каналов, площадь поперечного сечения защитных каналов значительно меньше. Как правило, при одинаковом приложенном давлении мембрана с меньшей площадью деформируется меньше, чем мембрана с большей плотностью. Защитные каналы конструируют так, чтобы они выдерживали высокое давление, чтобы позволить раствору (как правило, воде) протечь в защитный канал. Водяной пар, образующийся в защитном канале, может диффундировать в поры эластомера, прилежащего проточного канала или реакционной ячейки, таким образом увеличивая концентрацию водяного пара в при- 11018555 лежащих проточном канале или реакционной ячейке и снижая испарение из них раствора. Для дальнейшего обсуждения защитных каналов, располагающихся в микрожидкостных устройствах и пригодных для использования по настоящему изобретению, см., McBride et al., публикация патентной заявки США 20050252773, включенная в настоящий документ в качестве ссылки в полном объеме для всех целей. Устройства дополнительно включают множество реакционных ячеек или реакционных объемов, в которых взаимодействуют реагенты, и устройство может включать различные средства (например, нагнетатели и клапаны) для селективной изоляции реакционных ячеек. Реакционные ячейки могут быть расположены в любом из ряда различных расположений в устройстве. Так как устройства могут включать эластомерные материалы, которые относительно оптически прозрачны, реакции можно легко контролировать с применением множества различных систем детекции,по существу, при любом расположении на микрожидкостном устройстве. Когда используют устройстваMSL-типа, детекцию наиболее часто осуществляют в самой реакционной ячейке. Тот факт, что такие устройства изготавливают, по существу, из прозрачных материалов, также означает, что с данными устройствами можно использовать определенные системы детекции, которые непригодны для традиционных основанных на силиконе микрожидкостных устройств. Детекцию можно обеспечивать с применением детекторов, которые встроены в устройство или которые отделены от устройства, но выровнены с детектируемой областью устройства. В определенных вариантах осуществления настоящего изобретения реакции в реакционных объемах проводят с применением смесей или реагентов, которые сначала смешивают (например, смешивают с образцом) в растворе отдельно от чипа и других компонентов системы, а затем вводят в раствор. Устройства, как правило, конструируют и конфигурируют для проведения реакций с контролируемой температурой, таких как термоциклические реакции амплификации. Таким образом, устройство можно конфигурировать/конструировать для применения в реакциях с контролируемой температурой(например, термоциклические реакции) в реакционных объемах. Устройство или его часть, например эластомерное устройство, можно фиксировать на подложке (например, предметное стекло). Затем полученную структуру можно помещать на терморегулирующую плату, например, с контролем температуры в различных реакционных ячейках. В случае термоциклических реакций устройство можно помещать на любой ряд планшетов для термоциклирования. Как проиллюстрировано выше, необязательное применение микрожидкостных устройств для осуществления способов по настоящему изобретению можно проводить с применением широкого множества элементов и конструкций устройств. В последующем описании подробно описаны иллюстративные конфигурации, которые можно применять для проведения множества анализов, включая анализы с необходимостью контроля температуры (например, реакции амплификации нуклеиновых кислот). Однако следует понимать, что эти конфигурации являются иллюстративными и специалистам в данной области очевидны модификации данных систем. Фиг. 3 представляет собой упрощенную схему микрожидкостного устройства по иллюстративному варианту осуществления настоящего изобретения. Как проиллюстрировано на фиг. 3, микрожидкостное устройство, также обозначаемое как цифровой чип, может включать носитель 20, который можно производить из материалов, обеспечивающих подходящую механическую опору для различных элементов микрожидкостного устройства. Как пример, устройство изготавливают с применением эластомерного полимера. Наружная часть устройства имеет такое же основание, как и стандартный 384-луночный микропланшет, и обеспечивает автономную работу клапанов. Как описано ниже, присутствуют 12 входных отверстий, соответствующих 12 отдельным входным отверстиям образца в устройство. Устройство может содержать 12 панелей 22, и каждая из 12 панелей может содержать 765 6-нл реакционных камер общим объемом 4,59 мкл на панель. Микрожидкостные каналы 24 могут соединять различные реакционные камеры на панелях с источниками жидкостей, как более подробно описано ниже. Для открытия или закрытия клапанов, соединяющих реакционные камеры с источниками жидкостей к аккумулятору 26, можно прикладывать давление. Как проиллюстрировано на фиг. 3, для введения смеси реагентов образца можно предоставить 12 входных отверстий 28. Для обеспечения источника реагентов, которые в одинаковых применениях доставляются в биочип при приложении давления к аккумулятору 26, используют 48 входных отверстий 28. В применениях, где не используют реагенты, входные отверстия 28 и аккумулятор со стороны реагентов можно не использовать. Дополнительно, в иллюстративном варианте осуществления предоставлены два входных отверстия 30, проиллюстрированных на фиг. 3, для обеспечения гидратации биочипа. Входные отверстия для гидратации 30 обеспечивают гидравлическое соединение с устройством для облегчения контроля влажности, связанной с реакционными камерами. Как хорошо понятно специалисту в данной области, некоторые эластомерные материалы,применяемые при изготовлении устройств, являются газопроницаемыми, позволяя газам или пару испаряться из реакционных камер, проходя через эластомерный материал в окружающую атмосферу. В конкретном варианте осуществления трубки для жидкости, расположенные по периферийным частям устройства, обеспечивают защиту гидратирующей жидкости, например буфера или основной смеси, на периферических частях биочипа, окружающих панель реакционных камер, таким образом снижая или предотвращая испарение жидкостей, находящихся в реакционных камерах. Таким образом, влажность по периферическим частям устройства можно увеличить, добавляя легкоиспаряемую жидкость, например воду, для гидратации входных отверстий 30. В конкретном варианте осуществления первое входное отверстие находится в гидравлическом соединении с трубками гидратирующей жидкости, окружающими панели на первой стороне биочипа, а второе входное отверстие находится в гидравлическом соединении с трубками гидратирующей жидкости, окружающими панели на другой стороне биочипа. Хотя устройства и распределение образцов, описанные выше, представляют собой одну из иллюстративных систем для осуществления способов по настоящему изобретению, специалисту в данной области очевидны множество вариаций, модификаций и альтернатив для конструирования микрожидкостных устройств, описываемых в настоящем документе. Например, хотя микрожидкостное устройство,проиллюстрированное на фиг. 3, содержит 12 панелей, каждая с 765 реакционными камерами с объемом 6 нл на реакционную камеру, это не является необходимым по настоящему изобретению. Конкретная геометрия цифрового чипа зависит от конкретных приложений. Таким образом, например, область настоящего изобретения не ограничена цифровыми чипами с 12 панелями с 765 реакционными камерами, а в объем настоящего изобретения включены другие комбинации. Дополнительное описание, относящееся к цифровым чипам, пригодным для применения в вариантах осуществления настоящего изобретения,предоставлено в публикации патентной заявки США 2005/0252773, включенной в настоящий документ в качестве ссылки. Проведение анализа большого количества реплицированных образцов может требовать значительных количеств реагентов. В варианте осуществления настоящего изобретения цифровую ПЦР проводят в микрообъемах. Реакционные камеры для проведения ПЦР в малом объеме могут составлять приблизительно от 2 до приблизительно 500 нл. Чем меньше объем реакционной камеры, тем больше количество отдельных анализов, которые можно запустить (или с использованием различных наборов праймеров и зондов, или как репликатов одинаковых наборов зондов и праймеров, или любые комбинации количества реплик и количества различных анализов). В одном из вариантов осуществления реакционная камера составляет приблизительно от 2 до приблизительно 50 нл, предпочтительно от 2 до приблизительно 25 нл,более предпочтительно приблизительно от 4 до приблизительно 15 нл. В некоторых вариантах осуществления объем реакционной камеры составляет приблизительно 4 нл, приблизительно 5 нл, приблизительно 6 нл, приблизительно 7 нл,приблизительно 8 нл, приблизительно 9 нл, приблизительно 10 нл, приблизительно 11 нл или приблизительно 12 нл. Камеры для образцов можно конструировать из стекла, пластика, силикона, эластомерных полимеров, таких как полидиметилсилоксан, полиуретан или других полимеров. Образцы,обрабатываемые способом по изобретению, хорошо подходят для применения в различных анализах количества копий с применением системы BioMark (Fluidigm Corporation, South San Francisco, CA). В системе BioMark используют полидиметилсилоксановое микрожидкостное устройство, которое обеспечивает проведение множества анализов для множества образцов. Микрожидкостные устройства Fluidigm (цифровые чипы) изготавливают в Fluidigm Corporation(South San Francisco, CA). Чипы изготавливают способом многослойной мягкой литографии (MSL)multilayer soft lithography, Science. 2000; 288:113-116). Чип содержит каналы для образцов с полуэллиптической формой со средней глубиной 10 мкм, шириной 70 мкм с параллельным расположением с расстоянием между осями 200 мкм. Жидкостные устройства для образцов изготавливают способом двухслойного формования с получением разделенных камер 265(глубина)150150 мкм, расположенных вдоль каждого канала для образцов. На отдельном силиконовом слое перпендикулярно каналам для образцов проводят контрольные каналы чипа. Пересечения каналов образуют отклоняющиеся клапаны для направления жидкостей. При подаче давления в контрольные каналы тонкая мембрана между слоями закрывает каналы для образцов, изолируя индивидуальные разделенные камеры. Глубина контрольных каналов составляет 15 мкм, ширина - 50 мкм с параллельным расположением с расстоянием между осями 300 мкм. Реакционные смеси, так и как смеси для ПЦР, смеси образцов, смеси продуктов преамплификации образцов помещают в каждую панель, и отдельные молекулы ДНК случайным образом распределяются в различные реакционные камеры. После заполнения панелей и реакционных камер цифровой чип можно подвергать термоциклированию, а затем визуализировать в подходящем устройстве считывания, например, устройстве BioMark, доступном у правообладателя настоящего изобретения. Получаемые данные анализируют с применением программного обеспечения анализа цифровой ПЦР, доступного у правообладателя настоящего изобретения, или другого подходящего программного обеспечения для анализа. Дополнительное описание иллюстративных способов детекции и/или анализа, пригодных для использования в вариантах осуществления настоящего изобретения, предоставлено в публикации патентной заявки СШАUS Application No. 12/170414, озаглавленной "Copy Number Variation Determination by DigitalPCR", находящейся на совместном рассмотрении и принадлежащей одному и тому же правообладателю и включенной, таким образом, в качестве ссылки для всех целей. Фиг. 4 А-4 С представляют собой упрощенные схемы части устройства/биочипа, представленного на фиг. 3. На фиг. 4 А проиллюстрированы 12 панелей 22, где каждая из панелей содержит ряд реакционных камер. На фиг. 4 В проиллюстрирована геометрия ряда реакционных камер 40, содержащихся в панели. Реакционные камеры 40 расположены на расстояниях 200 мкм между центрами, как проиллюстрировано. На фиг. 4 С проиллюстрировано флуоресцентное отображение части панели. Левая часть иллюстрации представляет собой контрольную секцию, где все реакционные камеры изображены как затемненные. Правая сторона иллюстрации выглядит как в типичном эксперименте, множество реакционных камер затемнены 42, не образуя значимого флуоресцентного излучения. Однако часть реакционных камер обладает флуоресцентным излучением, указывая на "положительную" реакционную камеру 44. Как описано выше на фиг. 2 В, каналы для образцов проходят слева направо, соединяя индивидуальные реакционные камеры, а контрольные каналы проходят сверху вниз в нижний слой. После приложения давления к контрольным каналам тонкослойная мембрана между слоями закрывает каналы для образцов, изолируя индивидуальные реакционные камеры. Клапаны разделяют индивидуальные камеры, которые остаются закрытыми при эксперименте ПЦР. Как более полно описано в настоящем описании, чип подвергали термоциклированию и визуализации на системе ПЦР с детекцией в реальном времени BioMark, доступной у правообладателя настоящего изобретения, и для подсчета количества положительных камер в каждой панели использовали программное обеспечение для анализа цифровой ПЦР, такое как анализ цифровой ПЦР BioMark, доступного у правообладателя настоящего изобретения. Когда использовали два анализа с двумя флуоресцентными носителями в реакции мультиплексной цифровой ПЦР, проводили независимый количественный анализ двух генов. Как описано в настоящем документе, эту возможность независимого количественного анализа использовали для изучения вариации количества копий с применением цифрового чипа. Количество генов, которые можно подвергать независимому количественному анализу в одной реакции ПЦР,зависит от количества доступных флуоресцентных носителей и фильтров. Как описано в стадиях общих способов выше, после распределения образца дополнительные этапы включают этап амплификации с последующей детекцией и анализом результатов. В некоторых вариантах осуществления настоящего изобретения амплификацию и детекцию/анализ можно проводить способами, которые объединяют эти два этапа вместе, например, посредством количественной ПЦР. Как правило, полинуклеотиды, которые изолированы в каждой реакционной ячейке, можно амплифицировать,детектировать и анализировать с применением ряда возможных стратегий. Одна из возможных стратегий включает амплификацию полинуклеотидов мишени и эталона так, что амплифицированный продукт можно использовать для определения концентрации полинуклеотида-мишени и концентрации эталонного полинуклеотида. Для проведения амплификации реагенты, необходимые для амплификации, комбинируют с образцом, и они могут включать первый зонд, который селективно гибридизуется с полинуклеотидом-мишенью, и второй зонд, который селективно гибридизуется с эталонным полинуклеотидом в условиях, пригодных для амплификации полинуклеотидов. Первый и второй зонды могут включать различные детектируемые метки так, чтобы различить продукты амплификации полинуклеотидов мишени и эталона. Кроме того, различение полинуклеотидов мишени и эталона может обеспечить дальнейший расчет концентрации нуклеотидной молекулы-мишени в виде соотношения с эталонной нуклеотидной молекулой так, чтобы определить относительное количество копий полинуклеотидной последовательности-мишени в геноме индивидуума. Основные этапы амплификации с последующей детекцией и анализом можно проводить с использованием ряда способов. Для увеличения понимания способов и систем, описанных в данном описании, ниже приведены общие описания терминов в данной области. Термин "реагент" в широком смысле относится к любому агенту, используемому в реакции. Реагенты могут включать одно вещество, которое можно подвергать мониторингу самостоятельно (например, вещество, которое можно контролировать по мере нагревания),или смесь двух или более веществ. Реагент может быть живым (например, клетка) или не живым. Иллюстративные реагенты для реакции амплификации нуклеиновых кислот включают в качестве неограничивающих примеров буфер, ионы металлов, полимеразу, праймеры, матричную нуклеиновую кислоту,нуклеотиды, метки, красители, нуклеазы и т.п. Реагенты для ферментативных реакций включают, например, субстраты, кофакторы, связывающие ферменты, буфер, ионы металлов, ингибиторы и активаторы. Реагенты для клеточных реакций включают в качестве неограничивающих примеров клетки, клеточноспецифичные красители и лиганды (например, агонисты и антагонисты), которые связываются с клеточными рецепторами. Реагенты можно включать в раствор образца или необязательно можно различными способами иммобилизовать (например, ковалентно, нековалентно, посредством подходящих линкерных молекул). Например, в реакции амплификации нуклеиновых кислот на чипе в каждую из реакционных ячеек при изготовлении устройства можно наносить (например, посредством точечного нанесения) один или несколько реагентов, используемых для проведения реакций достройки. Термин "метка" относится к молекуле или свойству молекулы, которые можно детектировать физическими, химическими, электромагнетическими и другими связанными аналитическими способами. Примеры детектируемых меток, которые можно использовать, включают в качестве неограничивающих примеров радиоактивные изотопы, флуорофоры, хромофоры, массовые метки, электронно-плотные частицы, магнитные частицы, спиновые метки, молекулы, испускающие хемилюминесценцию, электрохимически активные молекулы, ферменты, кофакторы, ферменты, связанные с зондами нуклеиновой кислоты и субстраты ферментов. Термин "детектируемо меченый" означает, что агент конъюгирован с меткой или что агент обладает некоторыми свойственными характеристиками (например, размер, форма или цвет), которые позволяют детектировать его без конъюгации с отдельной меткой. Термины "нуклеиновая кислота", "полинуклеотид" и "олигонуклеотид" используют в настоящем документе для обозначения полимерной формы нуклеотидов любой длины, включая в качестве неограничивающих примеров рибонуклеотиды или дезоксирибонуклеотиды. Четкого разграничения по длине между этими терминами нет. Кроме того, эти термины относятся только к первичной структуре молекулы. Таким образом, в определенных вариантах осуществления эти термины могут включать трех-, двухи одноцепочечную ДНК, а также трех-, двух- и одноцепочечную РНК. Они также включают модификации, такие как посредством метилирования и/или кэпирования, и немодифицированные формы полинуклеотида. Более конкретно, термины "нуклеиновая кислота", "полинуклеотид" и "олигонуклеотид" включают полидезоксирибонуклеотиды (содержащие 2-дезокси-D-рибозу), полирибонуклеотиды (содержащие D-рибозу), любой другой тип полинуклеотида, который представляет собой N- или С-гликозид пуринового или пиримидинового основания, и другие полимеры, содержащие ненуклеотидные каркасы,например полиамид (например, пептидные нуклеиновые кислоты (PNA, и полиморфолино полимеры(коммерчески доступные из Anti-Virals, Inc., Corvallis, Oregon, как Neugene) и другие синтетические сиквенс-специфические полимеры нуклеиновых кислот, при условии, что полимеры содержат нуклеиновые основания в конфигурации, позволяющей спаривание оснований и стэкинг оснований такой, как выявлен в ДНК и РНК."Зонд" представляет собой нуклеиновую кислоту, способную к связыванию с нуклеиновой кислотой-мишенью комплементарной последовательности посредством одного или нескольких типов химических связей, как правило, посредством комплементарного спаривания оснований, как правило, посредством образования водородных связей, таким образом образуя дуплексную структуру. Зонд связывается или гибридизуется с "участком связывания зонда". Зонд можно метить детектируемой меткой, обеспечивая легкую детекцию зонда, особенно после гибридизации зонда с его комплементарной мишенью. Метка, прикрепленная к зонду, может включать любую из множества различных меток, известных в данной области, которые можно детектировать, например, химическими или физическими средствами. Подходящие метки, которые можно прикреплять к зондам, включают в качестве неограничивающих примеров радиоактивные изотопы, флуорофоры, хромофоры, массовые метки, электронно-плотные частицы, магнитные частицы, спиновые метки, молекулы, испускающие флуоресценцию, электрохимически активные молекулы, ферменты, кофакторы и субстраты ферментов. Размер зондов может значительно варьировать. Некоторые зонды являются относительно короткими. Как правило, длина зондов составляет по меньшей мере от 7 до 15 нуклеотидов. У других зондов длина составляет по меньшей мере 20, 30 или 40 нуклеотидов. Другие зонды являются немного более длинными, и их длина составляет по меньшей мере 50, 60,70, 80, 90 нуклеотидов. Другие зонды являются еще более длинными, и их длина составляет по меньшей мере 100, 150, 200 или более нуклеотидов. Также зонды могут быть любой конкретной длины, которая попадает в указанные выше диапазоны."Праймер" представляет собой одноцепочечный полинуклеотид, способный действовать как точка инициации матричного синтеза ДНК в подходящих условиях (т.е. в присутствии четырех различных нуклеозидтрифосфатов и агента для полимеризации, такого как, ДНК- или РНК-полимераза или обратная транскриптаза) в соответствующем буфере и при подходящей температуре. Подходящая длина праймера зависит от планируемого применения праймера, но, как правило, составляет по меньшей мере 7 нуклеотидов в длину, а более конкретно - диапазон от 10 до 30 нуклеотидов в длину. Другие праймеры могут быть немного длиннее, такими как от 30 до 50 нуклеотидов в длину. Молекулам коротких праймеров для формирования достаточно стабильных гибридных комплексов с матрицей, как правило, необходимы более низкие температуры. Праймеру нет необходимости точно отражать последовательность матрицы, но он должен быть достаточно комплементарен для гибридизации с матрицей. Термин "праймерный участок" или "участок связывания праймера" относится к сегменту ДНК-мишени, с которым гибридизуется праймер. Термин "пара праймеров" означает набор праймеров, включающий 5' "восходящий праймер",гибридизующийся с комплементарным участком 5'-конца последовательности ДНК для амплификации, и 3' "нисходящий праймер", гибридизующийся с комплементарным участком 5'-конца последовательности для амплификации. Последовательность праймера, который "полностью комплементарен", полностью комплементарна по всей длине праймера и не содержит несоответствий. Праймер, как правило, полностью комплементарен части (подпоследовательности) последовательности-мишени. "Несоответствие" относится к участку,в котором нуклеотид в праймере и нуклеотид в нуклеиновой кислоте-мишени, с которой он выровнен, не являются комплементарными. Термин "по существу комплементарный", когда его применяют по отно- 15018555 шению к праймеру, означает, что праймер не полностью комплементарен с его последовательностьюмишенью; а вместо этого праймер только в достаточной степени комплементарен, чтобы селективно гибридизоваться с его соответствующей цепью в желаемом участке связывания праймера. Термин "комплементарный" означает, что одна нуклеиновая кислота идентична другой молекуле нуклеиновой кислоты или селективно гибридизуется с ней. Селективность гибридизации существует,когда происходит гибридизация, которая более селективна, чем полное отсутствие специфичности. Как правило, селективная гибридизация происходит, когда существует по меньшей мере приблизительно 55% идентичности на участке по меньшей мере из 14-25 нуклеотидов, предпочтительно по меньшей мере 65%, более предпочтительно по меньшей мере 75%, а наиболее предпочтительно по меньшей мере 90%. Предпочтительно одна нуклеиновая кислота гибридизуется с другой нуклеиновой кислотой специфически. См. М. Kanehisa, Nucleic Acids Res. 12:203 (1984). Детекция происходит в "участке детекции" или "области детекции". Эти термины и другие связанные термины относятся к части микрожидкостного устройства, в котором происходит детекция. Как указано выше, для устройств с использованием определенных структур (например, структура с открытыми каналами, структура со слепыми каналами и т.д.) участок детекции, как правило, представляет собой реакционную ячейку, изолированную клапаном, связанным с каждой реакционной ячейкой. Участок детекции для матричного устройства, как правило, находится в областях проточных каналов, которые прилежат к пересечению, в самом пересечении или в области, включающей пересечение и окружающую область. Как указано выше, иллюстративные анализы вариации количества копий можно проводить с применением способов количественной ПЦР на чипе. В частности, количественная ПЦР может включать и амплификацию полинуклеотидов, и детекцию/анализ амплифицированных продуктов. В дополнение к кПЦР, для определения количества нуклеиновой кислоты-мишени, находящейся в образце, также можно использовать множество так называемых способов "амплификации с детекцией в реальном времени",способы или "количественную ПЦР с детекцией в реальном времени", измеряя количество самого продукта амплификации, образующегося в течение процесса амплификации или после него. Конкретным примером количественного способа с детекцией в реальном времени являются анализы с флуорогенной нуклеазой, которые успешно можно использовать с устройствами, описываемыми в настоящем документе. Этот способ контроля образования продукта амплификации включает непрерывное измерение накопления продукта ПЦР с применением меченного двойной меткой флуорогенного олигонуклеотидного зонда - подход, часто обозначаемый в литературе как способ "TaqMan". Используемый в таких анализах зонд, как правило, является коротким (например, приблизительно 20-25 оснований) полинуклеотидом, меченным двумя различными флуоресцентными носителями. 5'-конец зонда, как правило, прикреплен к репортерному красителю, а 3'-конец прикреплен к гасителю,хотя красители также могут прикрепляться в других положениях. Зонд сконструирован так, чтобы содержать, по меньшей мере, существенную комплементарность последовательности с участком связывания зонда на нуклеиновой кислоте-мишени. В реакционную смесь также включают восходящий и нисходящий праймеры для ПЦР, которые связываются с областями, фланкирующими участок связывания зонда. Когда зонд находится в неизменном виде, существует энергия переноса между двумя флуорофорами и гаситель заглушает эмиссию из репортера. Во время фазы достройки ПЦР зонд расщепляется вследствие 5'-нуклеазной активности полимеразы нуклеиновых кислот, такой как Taq-полимераза, тем самым освобождая репортер от полинуклеотида-гасителя и приводя к увеличению интенсивности эмиссии репортера, которую можно измерять соответствующим детектором. Одним из детекторов, который специально адаптирован для измерения флуоресценции, такой как флуоресценция, образуемая при флуорогенном анализе, является ABI 7700, производимый AppliedBiosystems, Inc. в Foster City, CA. Предоставляемое с устройством программное обеспечение способно записывать интенсивность флуоресценции репортера и гасителя в течение амплификации. Эти записанные значения затем можно использовать для подсчета увеличения нормализованной интенсивности эмиссии репортера на постоянной основе и в конечном итоге подсчета количества амплифицируемой мРНК. Дополнительные подробности относительно теории и проведения флуорогенных способов для осуществления определения концентрации продукта амплификации в реальном времени описаны, например, в патентах США 5210015, выданном Gelfand, 5538848, выданном Livak, et al., и 5863736, выданном Haaland, а также в Heid, С.A., et al., Genome Research, 6:986-994 (1996); Gibson, U.E.M, et al.,Genome Research, 6:995-1001 (1996); Holland, P.M., et al., Proc. Natl. Acad. Sci. USA, 88:7276-7280, (1991) и Livak, K.J., et al., PCR Methods and Applications, 357-362 (1995), каждая из которых в полном объеме включена в качестве ссылки. Таким образом, по мере развития реакции амплификации, увеличивающееся количество красителя становится связанной, и это сопровождается сопутствующим увеличением сигнала. При проведении анализов амплификации на чипе в одной реакционной ячейке можно проводить множество амплификаций, например используя в течение термоциклического процесса несколько прай- 16018555 меров, каждой специфичной для конкретной представляющей интерес нуклеиновой кислоты-мишени(например, полинуклеотидная последовательность-мишень и эталонная полинуклеотидная последовательность). Присутствие различных амплифицируемых продуктов можно детектировать с применением дифференциально меченых зондов для проведения количественной реакции ПЦР-РВ или с применением дифференциально меченых молекулярных беконов (см. выше). В таких подходах каждый дифференциально меченый зонд сконструирован так, чтобы гибридизоваться только с конкретной амплифицируемой мишенью. При продуманном выборе различных используемых меток можно проводить анализы, в которых различные метки в одной реакции возбуждаются и/или детектируются при различных длинах волн. Дополнительное руководство по выбору соответствующих флуоресцентных меток, которые подходят для таких подходов, включает: Fluorescence Spectroscopy (Pesce et al., Eds.) Marcel Dekker, New York,(1971); White et al., Fluorescence Analysis: A Practical Approach, Marcel Dekker, New York (1970); Berlman,Handbook of Fluorescence Spectra of Aromatic Molecules, 2nd ed., Academic Press, New York (1971);Chemicals, Molecular Probes, Eugene (1992). Когда для проведения реакции амплификации нуклеиновых кислот используют такие микрожидкостные устройства, устройства со структурой открытых каналов или слепых каналов, реагенты, которые можно вносить в реакционные ячейки, представляют собой реагенты, необходимые для проведения желаемого типа реакции амплификации. Как правило, это означает, что вносят некоторые или все из указанного далее, например праймеры, полимеразу, нуклеотиды, ионы металлов, буфер и кофакторы. Образец, в таком случае вводимый в реакционную ячейку, представляет собой матричную нуклеиновую кислоту. Однако альтернативно матрицу можно вносить, а реагенты для амплификации вливать в реакционные ячейки. Когда для проведения реакции амплификации используют матричное устройство, образцы, содержащие матричную нуклеиновую кислоту, можно вливать через вертикальные проточные каналы, а реагенты для амплификации - через горизонтальные проточные каналы, или наоборот. Как правило, анализы множественного генотипирования и экспрессии можно проводить, например,в каждой ячейке. Образец, содержащий ДНК-мишень, можно вводить в реакционные ячейки на микрожидкостном устройстве. Для способов количественной ПЦР, таких как TaqMan, праймеры для амплификации различных областей ДНК-мишени, представляющей интерес, находятся в одной реакционной ячейке. Для различения продукта, который образован, например, полинуклеотидами мишени и эталона,для каждой области используют дифференциально меченые зонды. Если аллель, которому комплементарен зонд, присутствует в ДНК-мишени, тогда происходит амплификация, таким образом приводя к возникновению детектируемого сигнала. В зависимости от того, какой получен дифференциальный сигнал,можно определить идентичность нуклеотида в полиморфном участке. Если детектируют оба сигнала,тогда присутствуют оба аллеля. Термоциклирование в течение реакции проводят, как описано в разделе о контроле температуры выше. В некоторых вариантах осуществления настоящего изобретения дифференциально меченые зонды,комплементарные каждой из аллельных форм, можно включать в качестве реагентов совместно с праймерами, нуклеотидами и полимеразой. Однако реакции можно проводить только с единственным зондом, хотя это может создать неопределенность относительно того, является ли отсутствие сигнала следствием отсутствия конкретного аллеля или просто не прошедшей реакции. Для типичного биаллельного случая, в котором в полимерном участке возможны два аллеля, в реакционную смесь вместе с праймерами для амплификации, нуклеотидами и полимеразой, как правило, включают два дифференциально меченых зонда, каждый полностью комплементарный одному из аллелей. Как указано на фиг. 4 С, сигнал из каждой реакционной ячейки можно детектировать и анализировать далее с определением информации об образце. Например, образцы, обработанные способами по изобретению, хорошо подходят для применения в различных анализах количества копий с применением системы BioMark (Fluidigm Corporation, South San Francisco, CA) и системы термоциклера с флуоресцентной визуализацией BioMark. В системе BioMark применяют полидиметилсилоксановое микрожидкостное устройство, обеспечивающее проведение множества анализов для множества образцов. Как более полно описано в настоящем описании, чип в некоторых вариантах осуществления можно термоциклировать и визуализировать на системе ПЦР с детекцией в реальном времени BioMark, доступной у правообладателя настоящего изобретения, и для подсчета количества положительных камер в каждой панели использовали программное обеспечение для анализа цифровой ПЦР, такого как анализ цифровой ПЦР BioMark, доступного у правообладателя настоящего изобретения. Когда в реакции мультиплексной цифровой ПЦР используют два анализа с двумя флуоресцентными носителями, можно проводить независимый количественный анализ двух генов. Как описано в настоящем документе, эту возможность независимого количественного анализа генов используют для исследования вариаций количества копий с применением цифрового чипа. Как в общих чертах описано выше, в каждую панель можно вводить реакционные смеси, такие как смеси для ПЦР, и отдельные молекулы ДНК могут случайным образом распределяться в различные ре- 17018555 акционные камеры. После введения в панели и реакционные камеры цифровой чип подвергают термоциклированию, а затем визуализации на соответствующем считывающем устройстве, например устройстве BioMark, доступной у правообладателя настоящего изобретения. Полученные данные анализируют с применением программного обеспечения для анализа цифровой ПЦР, доступного у правообладателя настоящего изобретения, или другого подходящего программного обеспечения для анализа. Как описано выше, для проведения определенных вариантов осуществления настоящего изобретения можно использовать количественную ПЦР на чипе. Хотя можно использовать ряд различных стратегий детекции с микрожидкостными устройствами, описанными выше. Выбор соответствующей системы частично зависит от типа устройства, задачи и/или вещества для детекции. Детекторы можно сконструировать для детекции ряда различных типов сигналов, включая в качестве неограничивающих примеров сигналы от радиоактивных изотопов, флуорофоров, хромофоров, электронно-плотных частиц, магнитных частиц, спиновых меток, испускающих хемилюминесценцию молекул, электрохимически активных молекул, ферментов, кофакторов, ферментов, связанных с зондами нуклеиновой кислоты, и субстратов ферментов. Иллюстративные способы детекции включают в качестве неограничивающих примеров светорассеяние, многоканальную детекцию флуоресценции, поглощение УФ и видимых длин волн, люминесценцию, дифференциальную отражательную способность и конфокальное лазерное сканирование. Дополнительные способы детекции, которые можно использовать в определенных приложениях, включают способы анализа сцинтилляционной близости, радиохимическую детекцию, флуоресцентную поляризацию,флуоресцентную корреляционную спектроскопию (FCS), перенос энергии с временным разрешением(TRET), резонансный перенос энергии флуоресценции (FRET) и вариации, такие как резонансный перенос энергии биолюминесценции (BRET). Дополнительные возможности детекции включают измерение электрического сопротивления, удельного электрического сопротивления, полного электрического сопротивления и напряжения. Секция детекции может находиться в соединении с одним или несколькими микроскопами, диодами, излучающими свет устройствами (например, лазерами), фотоумножителями, процессорами и сочетаниями указанного выше, которые взаимодействуют для детекции сигнала, связанного с конкретным событием и/или веществом. Часто сигнал для детекции представляет собой оптический сигнал, который детектируют в секции детекции посредством оптического детектора. Оптический детектор может включать один или несколько фотодиодов (например, лавинные фотодиоды), оптоволоконный световод, например к фотоумножителю, микроскоп и/или видеокамеру (например, CCD-камеру). Детекторы можно микротехнологически встраивать в микрожидкостное устройство или они могут представлять собой отдельный элемент. Если детектор представлен в виде отдельного элемента и микрожидкостное устройство включает множество секций детекции, детекция в любой конкретный момент может происходить в одной секции детекции. Альтернативно, можно использовать сканирующие системы. Например, некоторые автоматизированные системы сканируют источник света, относящийся к микрожидкостному устройству; другие системы сканируют испускаемый в сторону детектора свет или включают многоканальный детектор. В качестве конкретного иллюстративного примера микрожидкостное устройство можно присоединять к переносному устройству и сканировать под объективом микроскопа. Затем полученный таким образом сигнал направляют в процессор для интерпретации и обработки сигнала. Также можно использовать матрицы фотоумножителей. Дополнительно, можно использовать оптические системы, которые при определении сигнала из каждой секции имеют способность накапливать сигналы из всех различных секций детекции одновременно. Внешние детекторы пригодны потому, что предоставляемые устройства полностью или в основном изготавливают из материалов, которые оптически прозрачны при измеряемой длине волны. Это свойство позволяет использовать для устройств, описываемых в настоящем документе, ряд оптических систем детекции, которые невозможны для традиционных силиконовых микрожидкостных устройств. В одном из вариантов осуществления в детекторе используют CCD-камеру и световод, который обеспечивает большое поле зрения и высокую числовую апертуру с максимизацией количества света,получаемого из каждой реакционной камеры. В этом отношении CCD используют как матрицу фотодетекторов, где каждый пиксель или группа пикселей соответствуют реакционной камере, вместо того,чтобы использовать ее для получения изображения чипа. Таким образом, оптические устройства можно изменять так, чтобы снизить качество изображения или расфокусировать изображение для того, чтобы увеличить глубину резкости оптической системы для получения большего количества света из каждой реакционной камеры. Детектор может включать источник света для стимуляции репортера, который генерирует детектируемый сигнал. Тип используемого источника света частично зависит от природы активируемого репортера. Подходящие источники света включают в качестве неограничивающих примеров лазеры, лазерные диоды и лампы с высокой интенсивностью свечения. Если используют лазер, лазер можно использовать для сканирования набора детектируемых секций или одной детектируемой секции. Лазерные диоды можно с применением микротехнологии встраивать в само микрожидкостное устройство. Альтернативно, лазерные диоды можно собирать в другом устройстве, которое помещают рядом с микрожидкостным устройством, используемым для осуществления термоциклической реакции так, чтобы свет лазера из диода направлялся в детектируемую секцию. Детекция также может включать ряд неоптических подходов. В частности, детектор также может включать, например, температурный датчик, датчик электропроводности, потенциометрический датчик(например, рН-электрод) и/или амперометрический датчик (например, для контроля реакций окисления и восстановления). Можно использовать ряд коммерчески доступных внешних детекторов. Большинство из них представляют собой флуоресцентные детекторы вследствие простоты получения флуоресцентно меченых реагентов. Конкретные примеры доступных детекторов включают в качестве неограничивающих примеров Applied Precision ArrayWoRx (Applied Precision, Issaquah, WA). В некоторых вариантах осуществления используют основанные на FRET способы детекции. Способы детекции этого типа включают детекцию изменения флуоресценции из донорного (репортер) и/или акцепторного (гаситель) флуорофора в донорно/акцепторной паре флуорофоров. Пару донорного и акцепторного флуорофоров выбирают так, чтобы спектр эмиссии донора перекрывал спектр возбуждения акцептора. Таким образом, когда пару флуорофоров приводят в достаточно тесную близость друг с другом, может происходить перенос энергии с донора на акцептор. Этот перенос энергии можно детектировать. См. патент США 5945283 и публикацию РСТ WO 97/22719. Молекулярные маяки обеспечивают особенно пригодный подход. С применением молекулярных маяков изменение конформации зонда при его гибридизации с комплементарной областью амплифицированного продукта приводит к формированию детектируемого сигнала. Сам зонд включает два участка: один участок на 5'-конце, а другой участок на 3'-конце. Эти участки фланкируют участок зонда, который отжигается с участком связывания зонда, и комплементарны друг другу. Один концевой участок, как правило, присоединен к репортерному красителю, а другой концевой участок, как правило, присоединен к гасителю. В растворе два концевых участка могут гибридизоваться друг с другом с образованием петли шпильки. В этой конформации репортерный краситель и гаситель находятся в достаточно тесной близости так, что флуоресценция из репортерного красителя эффективно тушится гасителем. Напротив, гибридизация зонда приводит к линеаризованной конформации, в которой степень тушения снижена. Таким образом, наблюдая за изменениями эмиссии этих двух красителей, можно косвенно следить за образованием продукта амплификации. Зонды этого типа и способы их использования дополнительно описаны,например, в Piatek, A.S., et al., Nat. Biotechnol. 16:359-63 (1998); Tyagi, S. and Kramer, F.R., NatureBiotechnology. 14:303-308 (1996) и Tyagi, S. et al., Nat. Biotechnol. 16:49-53 (1998), каждая из которых включена в настоящий документ в качестве ссылки в полном объеме для всех целей. Другие хорошо известные способы амплификация/детекции (для иллюстрации, а не для ограничения) включают Invader (см. Neri, В.P., et al., Advances in Nucleic Acid and Protein Analysis. 3826:117-125,2000); Nasba (см., например, Compton, J. Nucleic Acid Sequence-based Amplification, Nature. 350:91-91,1991); Scorpion (см. Thelwell N., et al. Nucleic Acids Research, 28:3752-3761, 2000) и емкостную детекцию ДНК (см., например, Sohn, et al., 2000, Proc. Natl. Acad. Sci. U.S.A. 97:10687-10690). Каждая из этих ссылок включена в настоящий документ в качестве ссылки для всех целей. Как указано выше, способы по настоящему изобретению включают проведение различных реакций/анализов амплификации, которым необходимы различные реагенты, композиции, буферы, добавки и т.п. Реакционные смеси можно получать, по меньшей мере, частично или отдельно от аналитической платформы или микрожидкостного чипа/устройства или в реакционных ячейках самого устройства (например, посредством точечного нанесения). Определенные реакционные смеси или композиции можно получать и включать как часть набора или системы. Например, система может включать смесь/композицию для преамплификации, композицию для анализа амплификации и микрожидкостное устройство для проведения амплификации и анализа детекции количества копий. Как часть набора или системы можно собирать и предоставлять два или более компонентов системы. Реакции, проводимые с применением микрожидкостных устройств, описываемых в настоящем документе, можно проводить с различными реагентами, буферами, композициями, добавками и т.п., которые можно включать в состав для проведения реакций по настоящему изобретению (например, преамплификации, количественной амплификации и т.д.). Так, например, в случае устройств, в которые реагенты наносят, можно, например, точечно наносить реагенты с получением в реакционной ячейке одного или нескольких реагентов. В других вариантах осуществления, например, когда не происходит точечного нанесения на чип, реагенты можно предоставлять в смесях или реакционных объемах, отдельно от чипа или других компонентов системы. Одним из наборов добавок являются блокирующие реагенты, которые блокируют участки связывания белка на эластомерном субстрате. Можно использовать широкое множество таких соединений, включая ряд различных белков (например, желатин и различные альбуминовые белки, такие как бычий сывороточный альбумин) и глицерин. Также можно использовать детергентную добавку. Использовать можно любой ряд различных детергентов. Примеры в качестве неограничивающих примеров включают SDS и различные детергенты на основе Triton. В конкретном случае реакций амплификации нуклеиновых кислот можно включать ряд различных реагентов и/или добавок. Одной из категорий являются энхансеры, которые способствуют реакции амплификации. Такие добавки включают в качестве неограничивающих примеров реагенты, которые уменьшают вторичную структуру у нуклеиновой кислоты (например, бетаин), и средства, которые уменьшают проявления неправильного спаривания (например, хлорид тетраметиламмония). Как правило, расчет CNV можно производить на основе "относительного количества копий" так,чтобы видимые различия в количестве копий генов в различных образцах не были искажены различиями в количествах образцов. Относительное количество копий гена (на геном) можно выражать в виде отношения количества копий гена-мишени к количеству копий однокопийного эталонного гена в образце ДНК, которое, как правило, составляет 1. Используя два анализа для двух генов (полинуклеотидная последовательность-мишень и эталонная полинуклеотидная последовательность) с двумя различными флуоресцентными носителями в одном и том же устройстве, можно одновременно проводить количественный анализ в одном и том же образце ДНК. Таким образом, отношение двух генов представляет собой относительное количество копий нуклеотидной последовательности-мишени в образце ДНК. В одном из вариантов осуществления настоящего изобретения преамплификацию можно проводить с использованием эталонного гена, такого как РНКаза Р, который представляет собой однокопийный ген,кодирующий РНК-группу для фермента РНКазы Р, рибонуклеопротеина. Проведение анализа большого количества реплицированных образцов может потребовать значительных количеств реагентов. В варианте осуществления настоящего изобретения цифровую ПЦР проводят в микрообъемах. Реакционные камеры для проведения ПЦР в малом объеме могут составлять приблизительно от 2 до приблизительно 500 нл. Чем меньше объем реакционной камеры, тем большее количество отдельных анализов, которые можно проводить (или с применением различных наборов праймеров и зондов, или как реплик тех же наборов зондов и праймеров, или любые комбинации количества реплик и количества различных анализов). В одном из вариантов осуществления реакционная камера составляет приблизительно от 2 до приблизительно 50 нл, предпочтительно от 2 до приблизительно 25 нл,более предпочтительно приблизительно от 4 до приблизительно 15 нл. В некоторых вариантах осуществления объем реакционной камеры составляет приблизительно 4 нл, приблизительно 5 нл, приблизительно 6 нл, приблизительно 7 нл,приблизительно 8 нл, приблизительно 9 нл, приблизительно 10 нл, приблизительно 11 нл или приблизительно 12 нл. Камеры для образцов можно конструировать из стекла, пластика, силикона, эластомерных полимеров, таких как полидиметилсилоксан, полиуретан или других полимеров. Образцы,обрабатываемые способом по изобретению, хорошо подходят для применения в различных анализах количества копий с применением системы BioMark (Fluidigm Corporation, South San Francisco, CA). В системе BioMark используют полидиметилсилоксановое микрожидкостное устройство, которое обеспечивает проведение множества анализов для множества образцов. Устройства/наножидкостные чипы (цифровые чипы) Fluidigm и систему термоциклера с флуоресцентной визуализацией BioMark изготавливают в Fluidigm Corporation (South San Francisco, CA). Как проиллюстрировано на фиг. 5, иллюстративный чип содержит 12 панелей, а каждая из 12 панелей содержит 765 6-нл камер с общим объемом 4,59 мкл на панель. Чипы изготавливают способом многослойной мягкой литографии (MSL). Unger M.A., Chou H.P., Thorsen T., Scherer A., Quake S.R., Monolithicmicrofabricated valves and pumps by multilayer soft lithography, Science. 2000; 288:113-116. Чип содержит каналы для образцов с полуэллиптической формой со средней глубиной 10 мкм, шириной 70 мкм с параллельным расположением с расстоянием между осями 200 мкм. Жидкостные устройства для образцов изготавливают способом двухслойного формования с получением разделенных камер 265(глубина)150150 мкм, расположенных вдоль каждого канала для образцов. На отдельном силиконовом слое перпендикулярно каналам для образцов проводят контрольные каналы чипа. Пересечения каналов образуют отклоняющиеся клапаны для направления жидкостей. При подаче давления в контрольные каналы тонкая мембрана между слоями закрывает каналы для образцов, изолируя индивидуальные разделенные камеры. Глубина контрольных каналов составляет 15 мкм, ширина - 50 мкм с параллельным расположением с расстоянием между осями 300 мкм. Наружная часть имеет такое же основание, как и стандартный 384-луночный микропланшет, и обеспечивает автономную работу клапанов. Присутствуют 12 входных отверстий, соответствующих 12 отдельным входным отверстиям образца в устройство. Используемые чипы могут содержать 765 6-нл разделенных камер на входное отверстие для образца, в совокупности до 14400 камер на чип. В данном конкретном варианте осуществления каналы для образцов проходят слева направо, соединяя индивидуальные реакционные камеры, а контрольные каналы проходят сверху вниз в нижний слой. После приложения давления к контрольным каналам тонкослойная мембрана между слоями закрывает каналы для образцов, изолируя индивидуальные реакционные камеры. Клапаны разделяют индивидуальные камеры, которые остаются закрытыми при эксперименте ПЦР. Для проведения реакций ПЦР с детекцией в реальном времени основную смесь для амплификации(например, "основная смесь") комбинируют с образцом, содержащим продукт анализа преамплификации. Основные смеси содержат соответствующий буфер, источник ионов магния (Mg2+) в диапазоне при- 20018555 близительно от 1 до приблизительно 10 мМ, предпочтительно в диапазоне приблизительно от 2 до приблизительно 8 мМ, нуклеотиды и, необязательно, детергенты и стабилизаторы. Пример одного из подходящих буферов представляет собой буфер TRIS в концентрации приблизительно от 5 до приблизительно 85 мМ, с предпочтительной концентрацией от 10 до 30 мМ. В одном из вариантов осуществления концентрация буфера TRIS в форме двукратной (2) реакционной смеси составляет 20 мМ. Диапазон рН реакционной смеси может составлять приблизительно от 7,5 до приблизительно 9,0, с типичным диапазоном рН приблизительно от 8,0 до приблизительно 8,5. Концентрация нуклеотидов может находиться в диапазоне приблизительно от 25 до приблизительно 1000 мМ, как правило, в диапазоне приблизительно от 100 до приблизительно 800 мМ. Примеры концентраций dNTP составляют 100, 200, 300, 400, 500, 600,700 и 800 мМ. Также в реакционную смесь можно включать детергенты, такие как Tween 20, Triton X 100 и Nonidet P40. Также можно включать стабилизаторы, такие как дитиотреитол (DTT, реактив Клеланда) или меркаптоэтанол. Кроме того, основные смеси могут необязательно содержать dUTP, а также урацил-ДНКгликозилазу (урацил-N-гликозилазу, UNG). UNG представляет собой продукт гена ung Escherichia coli и клонирован, секвенирован и экспрессирован в Е.coli. Урацил-ДНК-N-гликозилаза (UNG) удаляет остатки урацила из ДНК (одно- и двухцепочечной) без разрушения сахаро-фосфодиэфирного каркаса ДНК; таким образом предотвращая его использование в качестве мишени для гибридизации или в качестве матрицы для ДНК-полимеразы. Полученные участки с удаленными основаниями чувствительны к гидролитическому расщеплению при повышенных температурах. Таким образом, удаление урациловых оснований, как правило, сопровождается фрагментацией ДНК. Duncan, В.K., and Chambers, J.A. (1984), GENE 28, 211, Varshney, U., Hutcheon, Т., and van de Sande, J.H. (1988). J. Biol. Chem. 263, 7776. Основная смесь коммерчески доступна из Applied Biosystems, Foster City, CA (TaqMan Universal Master Mix, каталожные номера 4304437, 4318157 и 4326708). Применение UNG, как правило, ограничено анализом цифровой ПЦР, и ее не используют в анализе преамплификации. Для множественных применений для количественного анализа различных генов для мечения различных праймеров или зондов используют различные флуоресцентные репортерные красители. Для исследований относительной экспрессии с применением мультиплексной ПЦР количество праймеров для эталонного гена (например, -актина или GAPDH) должно быть ограниченным во избежание конкуренции эталонного гена и гена образца. Как правило, конечная концентрация праймера для эталонного гена должна составлять от 25 и 100 нМ, для оптимизации может быть полезным титрование праймеров. Пример. В одном иллюстративном варианте осуществления настоящего изобретения определяли количество копий CYP2D6 с преамплификацией и без нее. С применением преамплификации в одном из образцов выявлено, что CYP2D6 имеет дупликацию (количество копий составляло 3), тогда как без преамплификации в том же образце выявили, что количество копий составляет 2. Основную смесь, пригодную для проведения анализов ПЦР для полученных образцов способом по изобретению, можно приготавливать со следующим составом: 20 мМ Tris, pH 8,0, 100 мМ KCl, 1% глицерин, 0,04% Tween, 5 мМ MgCl2, 400 мМ dNTP, 0,08 U/мкл фермента AmpliTaq Gold (AppliedBiosystems, Foster City, CA). ДНК-полимераза AmpliTaq представляет собой рекомбинантную форму ДНК-полимеразы Taq. Ее получают, экспрессируя ген ДНК-полимеразы Taq в хозяине Е.coli. Подобно природной ДНК-полимеразе Taq у нее отсутствует эндонуклеазная и 3'-5' экзонуклеазная активность, но присутствует 5'-3' экзонуклеазная активность. Преамплификацию в одном из примеров проводили на системе для ПЦР GeneAmp PCR system 9700Biosystems, CA), 225 нМ праймеры (для РНКазы P в качестве эталонного полинуклеотида и представляющей интерес последовательности-мишени) и 1 мкл образца ДНК. Условия термоциклирования представляли собой 95C, 10 мин горячий старт и 10 циклов 95 С в течение 15 с и 60 С в течение 1 мин. В каждую реакционную смесь после преамплификации добавляли 20 мкл воды и образцы анализировали на цифровом чипе. На цифровом чипе анализировали пять образцов ДНК Coriell. Количество молекул CYP2D6 и РНКазы P в одном и том же объеме (4,59 мкл) каждого образца подсчитывали с применением программного обеспечения для анализа цифровой ПЦР BioMark с применением коррекции Пуассона, а также алгоритма Симанта (см. Dube et al., выше). Иллюстративная тепловая карта представлена в упрощенном черно-белом изображении на фиг. 5. Хотя с целью иллюстрации сигналы показаны белым, черным и серым, сигналы можно записывать и графически отображать в цвете, таком как желтый, зеленый или красный, соответственно гену РНКазы P (VIC, желтый), гену CYP2D6 (FAM, красный) и отсутствию гена соответственно. На панелях 1 и 12 контроля матрицы (NTC) нет. Для пяти образцов получали отношения количеств молекул гена CYP2D6 к гену РНКазы Р. Два из отношений составляли приблизительно 0,5, означая, что в каждой клетке этих двух образцов находится только одна копия гена CYP2D6 (РНКаза P представляет собой однокопийный ген и в каждой клетке всегда присутствуют две копии гена). Таким образом, у индивидуумов, у которых получали образцы ДНК, существует делеция гена CYP2D6 на хромосоме. В других трех образцах отношение составляло приблизительно 1, но возможности исключить дупликации нельзя, так как две близкосцепленные копии могут находиться в одной молекуле и могут не разделиться. Для этих пяти образцов проводили реакцию преамплификации и преамплифицированные продукты анализировали на числовых чипах (табл. 1). Таблица 1 Применение преамплификации для различения хромосомных дупликаций генов Образец NA11994 содержит дупликацию гена CYP2D6 на одной хромосоме. Как показано в табл. 1, два образца с отношением CYP2D6 к РНКазе P приблизительно 0,5, когда использовали геномную ДНК, все еще давали отношение приблизительно 0,5, когда использовали способ преамплификации по изобретению. Отношение 0,5 указывает на делецию. Два образца с отношением приблизительно 1, когда использовали геномную ДНК, также давали отношения приблизительно 1 при использовании продуктов преамплификации, что означает нормальный аллельный статус. Но один образец с отношением приблизительно 1, когда анализировали геномную ДНК, давал отношение 1,5, когда применяли способ преамплификации. Это указывает на то, что образец содержит дупликацию генаCYP2D6. Детекция потери гетерозиготности. Одно из практических применений описываемых способов определения вариации количества копий конкретного представляющего интерес гена включает детекцию потери гетерозиготности (LOH). Описываемые в настоящем документе способы могут обеспечивать новый уровень чувствительности и гибкости при определении потери гетерозиготности. Иллюстративные применения включают детекцию и/или изучение аномального количества копий Х-хромосомы или анеуплоидии. Потеря гетерозиготности (LOH) относится к изменению из гетерозиготного состояния в нормальном геноме к гомозиготному состоянию в парном опухолевом геноме. Исследования показывают, что в ряд злокачественных опухолей вовлечена потеря целой X-хромосомы.(1994). Кроме того, показано, что при лейкозах и лимфомах относительно часто происходит приобретение Х-хромосомы. Sandberg A.A. "The X chromosome in human neoplasia, including sex chromatin and congenital conditions with X-chromosome anomalies. In: Sandberg A.A., editor. Cytogenetics of the mammalian Xchromosome, part B: X chromosome anomalies and their clinical manifestations. New York: Alan R. Liss, 45998 (1983). Для проведения экспериментов по LOH можно предоставить микрожидкостные устройства, описанные в настоящем документе. На фиг. 3 показано устройство иллюстративного устройства, использованного для определения потери гетерозиготности в одном из примеров (см., для больших подробностей об устройстве, например, обсуждение выше). В кратком изложении, устройство содержит интегрированный жидкостной контур (IFC) с 12 панелями, каждая с входным отверстием для жидкости для смеси образца или аналитической смеси. В одном из примеров образец переносили на чип для загрузки и загружали, помещая цифровой чип на контроллер IFC и с применением программного интерфейса нагнетая компоненты анализа в отдельные панели с 765 реакционными объемами. Каждый из 12 образцов, которые предварительно смешивали с основной смесью и набором праймеров-зондов, распределяли в отдельные входные отверстия на рамке чипа. В каждой панели единый образец разделяли на 765 индивидуальных объемов по 6 нл для реакции ПЦР с детекцией в реальном времени. Для образца проводили ПЦР. Цифровой чип помещали в систему для ПЦР с детекцией в реальном времени для термоциклирования и детекции флуоресценции. Результаты эксперимента визуализировали и анализировали с применением прикладного программного обеспечения BioMark. Кривые ПЦР с детекцией в реальном времени или изображения конечной точки реакции камер с положительным результатом записывали для сравнения одного анализа с другим, например, рассчитывали отношение любых двух последовательностей в образце ДНК. Цифровые чипы для анализа обеспечивают увеличенную линейность, чувствительность и простоту применения. В описанном примере из клеточных линий, содержащих 1, 2, 3, 4 или 5 копий Х-хромосомы (CoriellInstitute for Medical Research, Camden, NJ), получали ДНК. Использовали цифровые чипы для тестирова- 22018555 ния каждого образца с тремя отдельными наборами праймеров-зондов TaqMan для Х-хромосомы - меченными FAM 123 В, SMS и YY2 (BioSearch Technologies, Novato, CA) - которые совместно амплифицировали в присутствии выявляющейся как однокопийная меченой VIC "эталонной" последовательности. На фиг. 6 представлена черно-белая диаграмма, иллюстрирующая основанные на цветовой метке результаты, тестирующие потерю гетерозиготности, как описано, и дополнительно иллюстрирующая каждый тестовый запуск в парных панелях в цифровых чипах. На фиг. 6 также показан подробный вид панели 4 устройства. В каждой панели подсчитывали количество камер с положительным результатом для мишени (светло-серый, соответствующий одному цвету, например желтому) и положительным результатом для эталона (темно-серый, соответствующий другому цвету, например красному) и корректировали на несколько красителей на камеру. Из этих результатов определяли исходное отношение мишени к эталону. На панелях 1 и 12 контроля матрицы (NTC) не использовали. Следует понимать, что в практических экспериментах можно записывать различные цвета и иллюстрировать результаты в цветном виде, таком как красный и желтый, которые изображены на фиг. 6 на черно-белой иллюстрации в виде серого. Для определения количества копий использовали простое линейное выравнивание. На фиг. 7 показано среднее трех отдельных аналитических отношений (ось Y), нанесенных в зависимости от известного количества копий Х-хромосомы (ось X), включая полосы ошибок, отображающие стандартную ошибку среднего. Отношения давали угловые коэффициенты для образцов ДНК с известным содержанием 1, 2,3, 4 или 5 копий Х-хромосомы. Индивидуальные измерения исходных отношений умножали на 2 и усредняли с получением количества копий на диплоидный геном. Средним результатом для всех анализов из вариантов с количеством копий от 1 до 5 явилось значение r, равное 0,994, означающее высокую линейность анализа. В табл. 3 перечислены исходные отношения для наборов праймеров-зондов TaqMan для отдельных тестов Х-хромосомы, проводимых на микрожидкостных устройствах. Среднее количество копий Ххромосомы на геном определяли, умножая среднее отношение на 2. В последней колонке справа приведена стандартная ошибка среднего (SEM). Как показано в табл. 2, среднее количество копий на геном хорошо соответствовало известному количеству копий Х-хромосом в образце. Таблица 2 Исходные отношения для отдельных тестов Х-хромосомы Эти результаты иллюстрируют, что способы и устройства, описываемые в настоящем документе,позволяют детекцию и различение малых, но биологически значимых различий в количестве копий генов в очень сложных образцах ДНК. Выбранные для этих тестов образцы сходны или идентичны образцам,тестируемым в анализах CGH и исследованиях на основе микрочипов MIP, как описано в Visakorpi et al.,1994, Am. J. Pathol., 145:624-630 и Pinkel et al., 1998, Nat. Genet. 20:207-211. Настоящие результаты, полученные способами по настоящему изобретению с цифровыми чипами, могут давать оценку количества копий, по меньшей мере, также специфично, как известные способы CGH и MIP, в то же время снижая ручные технические манипуляции и таким образом требуя меньших трудовых ресурсов и увеличенной эффективности. Кроме того, способность проводить несколько анализов TaqMan в формате цифровой ПЦР обеспечивает биологическую надежность и вырожденность анализа, компенсируя различия в амплификации от анализа к анализу. Если целью одновременно являются несколько локусов, состоятельными являются все результаты анализа, даже если существуют единичные мутации или делеции на локализованных участках связывания праймеров-зондов. Кроме того, эффективность можно увеличить, используя до переноса образца на микрожидкостные устройства для анализа, этап преамплификации. Хотя изобретение описано по отношению к приведенным выше примерам, следует понимать, что в смысл и объем изобретения включены модификации и вариации. Таким образом, изобретение ограничено только следующей далее формулой изобретения вместе с ее полной областью эквивалентов. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ определения относительного количества копий полинуклеотидной последовательностимишени в геноме субъекта, включающий преамплификацию полинуклеотидной последовательности-мишени и эталонной полинуклеотидной последовательности в образце, содержащем геномную ДНК субъекта; анализ полинуклеотидной последовательности-мишени и эталонной полинуклеотидной последовательности преамплифицированного образца посредством цифровой ПЦР; определение (a) количества амплифицированных полинуклеотидных молекул, содержащих полинуклеотидную последовательность-мишень, и (b) количества амплифицированных полинуклеотидных молекул, содержащих эталонную полинуклеотидную последовательность, и определение отношения(a):(b). 2. Способ по п.1, где образец получают у человека. 3. Способ по п.1, где (i) отношение (a):(b) составляет приблизительно 0,5 и существует делеция полинуклеотидной последовательности-мишени на одной хромосоме или (ii) отношение (a):(b) составляет приблизительно 1,5 и существует дупликация полинуклеотидной последовательности-мишени на одной хромосоме. 4. Способ по п.1, где эталонная полинуклеотидная последовательность имеет предопределенное количество копий N в геноме; определение количества амплифицированных полинуклеотидных молекул, содержащих полинуклеотидную последовательность-мишень, включает определение количества реакционных объемов, в которых присутствует полинуклеотидная последовательность-мишень или ее подпоследовательность A; определение количества амплифицированных полинуклеотидных молекул, содержащих полинуклеотидную последовательность-мишень, включает определение количества реакционных объемов, в которых присутствует эталонная полинуклеотидная последовательность или ее подпоследовательность B; относительное количество копий полинуклеотида-мишени в геноме составляет приблизительно(А)/(В)N. 5. Способ по п.4, в котором проведение преамплификации включает комбинирование образца с композицией, содержащей праймеры, специфичные для полинуклеотидной последовательности-мишени,и праймеры, специфичные для эталонной полинуклеотидной последовательности, и проведение полимеразной цепной реакции (ПЦР) так, чтобы раздельно амплифицировать полинуклеотид-мишень и эталонный полинуклеотид, по существу, в равном соотношении. 6. Способ по п.4, где реакционные объемы расположены в микрожидкостном устройстве и преамплификацию проводят в реакционном объеме отдельно от микрожидкостного устройства. 7. Способ по п.4, где до анализа полинуклеотидной последовательности-мишени и эталонной полинуклеотидной последовательности преамплифицированного образца посредством цифровой ПЦР весь преамплифицированный образец или его часть комбинируют с реагентами, выбранными для количественной амплификации полинуклеотидной последовательности-мишени и эталонной полинуклеотидной последовательности. 8. Способ по п.5, где праймеры, специфичные для эталонной полинуклеотидной последовательности, используемые на стадии преамплификации, также используют при анализе эталонной полинуклеотидной последовательности преамплифицированного образца посредством цифровой ПЦР. 9. Способ по п.8, где праймеры, специфичные для полинуклеотидной последовательности-мишени,используемые на стадии преамплификации, также используют при анализе полинуклеотидной последовательности-мишени преамплифицированного образца посредством цифровой ПЦР. 10. Способ по п.7, где реагенты включают первый зонд, селективно гибридизующийся с полинуклеотидной последовательностью-мишенью, и второй зонд, селективно гибридизующийся с эталонной полинуклеотидной последовательностью, в условиях, пригодных для амплификации полинуклеотидов. 11. Способ по п.10, где первый и второй зонды содержат различные детектируемые метки и где связывание первого или второго зонда или разрушение первого или второго зонда при полимеризации на основе полимеразной цепной реакции (ПЦР) приводят к изменению детектируемой флуоресценции соответствующей детектируемой метки. 12. Способ по п.1, где эталонная полинуклеотидная последовательность содержит полинуклеотидную последовательность, по меньшей мере, частично кодирующую фермент РНКазу Р, -актин илиGAPDH. 13. Способ по п.1 или 2, где отношение полинуклеотидной последовательности-мишени к эталонной полинуклеотидной последовательности, существенно отклоняющееся от значения 1, указывает на аномальное количество копий полинуклеотидной последовательности-мишени в геноме пациента.
МПК / Метки
МПК: G01N 33/48
Метки: определение, вариаций, способы, системы, копий, количества
Код ссылки
<a href="https://eas.patents.su/28-18555-opredelenie-variacijj-kolichestva-kopijj-sposoby-i-sistemy.html" rel="bookmark" title="База патентов Евразийского Союза">Определение вариаций количества копий, способы и системы</a>
Предыдущий патент: Применение альфа-кетоглутаровой кислоты и ее солей для улучшения эластичности кровеносных сосудов
Следующий патент: Емкость с функцией предотвращения утери и свободного проворачивания крышки
Случайный патент: Способ нанесения покрытия на металлическую ленту погружением и установка для его осуществления












