Способ и генная конструкция для высокоспецифичного ингибирования нежелательного роста клеток
Номер патента: 16223
Опубликовано: 30.03.2012
Авторы: Коробко Елена Владимировна, Коробко Игорь Викторович, Шепелев Михаил Валентинович, Свердлов Евгений Давидович, Георгиев Георгий Павлович
Формула / Реферат
1. Генная конструкция для ингибирования нежелательного роста клеток-мишеней, содержащая:
а) 3'-нетранслируемую область транскрипта гена, выбранного из гена ДНК-топоизомеразы II альфа (ТОР2А) человека и гена ДНК-(цитозин-5)-метилтрансферазы 1 (DNMT1) человека;
б) кДНК по меньшей мере одного белка, ингибирующего рост клеток;
в) промотор, транскрипционная активность которого является специфичной для клеток-мишеней.
2. Генная конструкция по п.1, причем клетки-мишени представляют собой опухолевые клетки.
3. Генная конструкция по п.1, причем клетки-мишени представляют собой неопухолевые клетки, подверженные аномальной пролиферации.
4. Генная конструкция по п.1, причем белок, ингибирующий рост клеток, представляет собой супрессор опухолевого роста.
5. Генная конструкция по п.1, причем белок, ингибирующий рост клеток, представляет собой индуктор апоптоза.
6. Генная конструкция по п.1, причем белок, ингибирующий рост клеток, представляет собой цитотоксический белок.
7. Генная конструкция по п.6, причем цитотоксический белок представляет собой фермент, конвертирующий субстрат в токсичное соединение, вызывающее клеточную гибель.
8. Генная конструкция по п.7, причем цитотоксический белок представляет собой тимидинкиназу вируса простого герпеса первого типа.
9. Генная конструкция по п.1, в которой промотор, транскрипционная активность которого является специфичной для клеток-мишеней, представляет собой промотор гена обратной транскриптазы теломеразы человека (hTERT).
10. Генная конструкция по п.1, в которой промотор, транскрипционная активность которого является специфичной для клеток-мишеней, представляет собой гибридный промотор, состоящий из промотора гена hTERT и минимального раннего CMV-промотора или синтетического ТАТА-бокса.
11. Генная конструкция по п.1, в которой промотор, транскрипционная активность которого является специфичной для клеток-мишеней, представляет собой промотор гена сурвивина человека (BIRC5).
12. Способ увеличения специфичности ингибирования нежелательного роста клеток-мишеней, предусматривающий доставку в клетки-мишени генной конструкции по любому из пп.1-11.
13. Способ по п.12, согласно которому клетки-мишени представляют собой опухолевые клетки.
14. Способ по п.12, согласно которому клетки-мишени представляют собой неопухолевые клетки, подверженные аномальной пролиферации.
15. Способ высокоспецифичного ингибирования нежелательного роста клеток-мишеней, предусматривающий:
а) доставку в клетки-мишени генной конструкции по любому из пп.1-11;
б) при необходимости для осуществления цитотоксического действия доставку к клеткам-мишеням субстрата, конвертируемого белком, кодируемым кДНК, содержащейся в составе конструкции по любому из пп.1-11, в токсичное соединение, вызывающее клеточную гибель.
16. Способ по п.15, согласно которому клетки-мишени представляют собой опухолевые клетки.
17. Способ по п.15, согласно которому клетки-мишени представляют собой неопухолевые клетки, подверженные аномальной пролиферации.
18. Способ по п.15, согласно которому белок, кодируемый кДНК, содержащейся в составе конструкции по любому из пп.1-11, представляет собой тимидинкиназу вируса простого герпеса первого типа, а субстрат, конвертируемый в токсичное соединение, представляет собой ганцикловир.
Текст
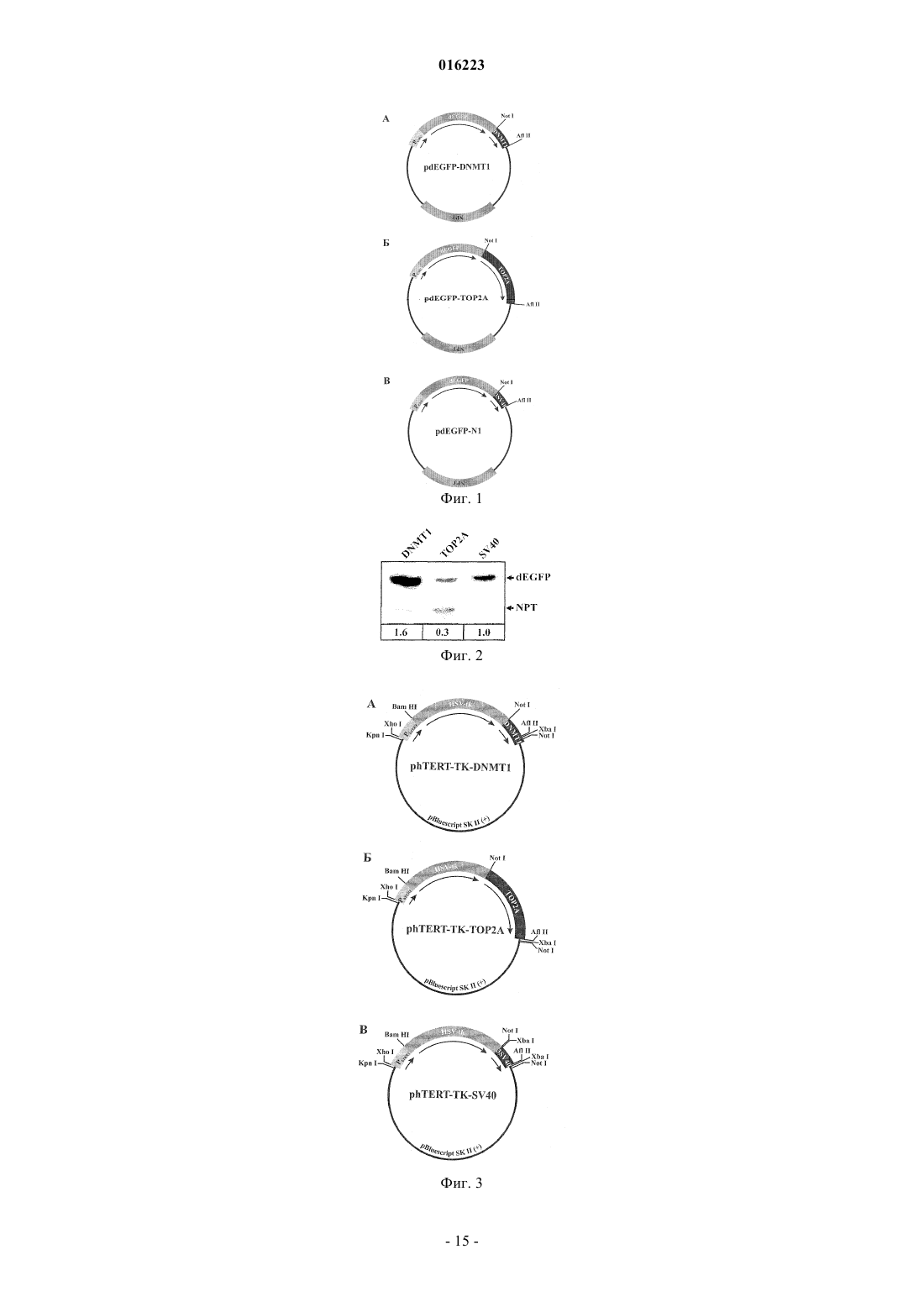
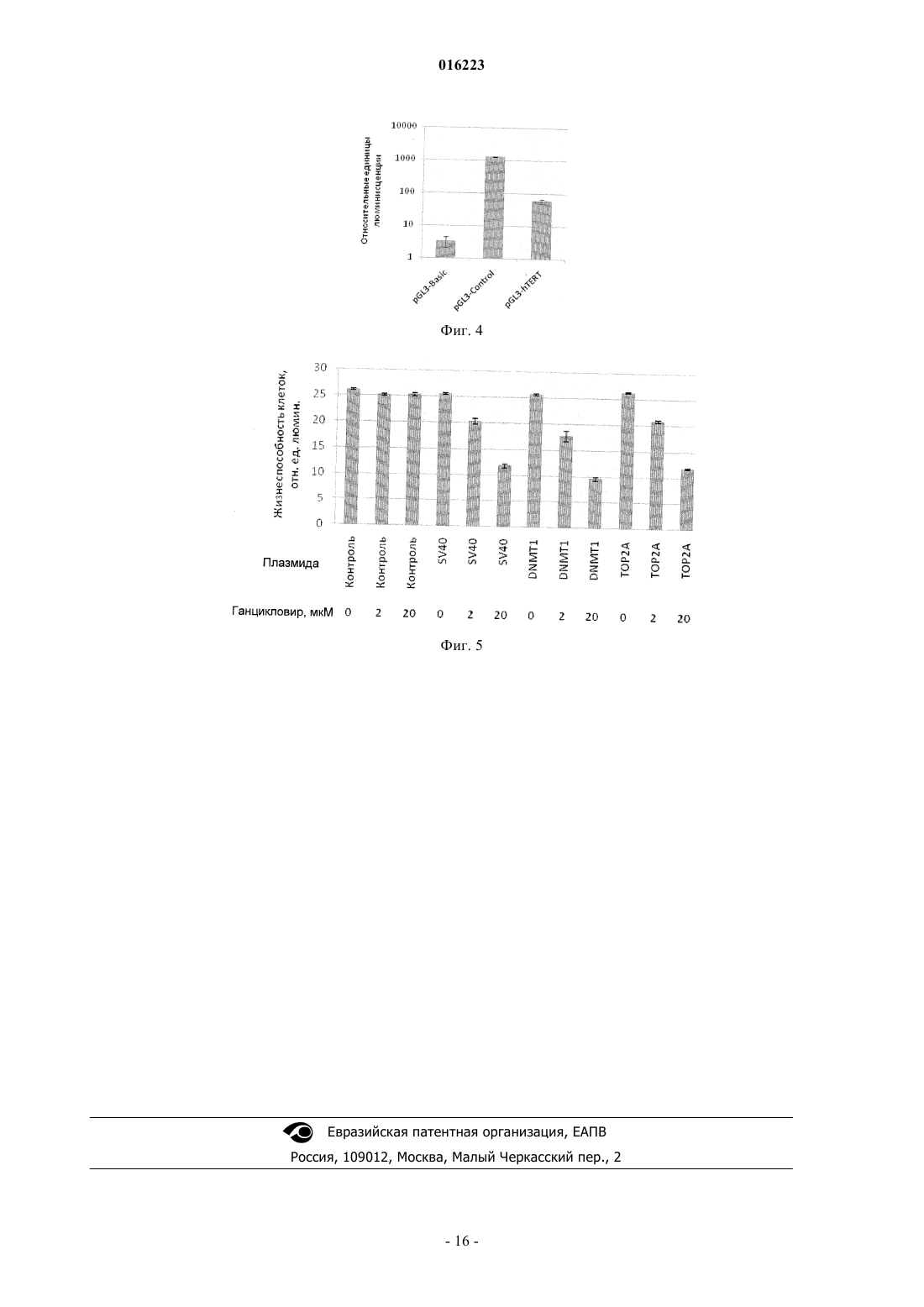
СПОСОБ И ГЕННАЯ КОНСТРУКЦИЯ ДЛЯ ВЫСОКОСПЕЦИФИЧНОГО ИНГИБИРОВАНИЯ НЕЖЕЛАТЕЛЬНОГО РОСТА КЛЕТОК Настоящее изобретение относится к области молекулярной биологии и генной терапии заболеваний, при которых имеет место нежелательная пролиферация клеток. Настоящее изобретение относится к генной конструкции, содержащей 3'-нетранслируемую область транскрипта гена, выбранного из гена ДНК-топоизомеразы II альфа (ТОР 2 А) человека и гена ДНК-(цитозин-5)-метилтрансферазы 1 (DNMT1) человека; кДНК по меньшей мере одного белка,ингибирующего рост клеток; и промотор, транскрипционная активность которого является специфичной для клеток-мишеней. Клетками-мишенями для введения указанной конструкции являются избыточно пролиферирующие опухолевые или неопухолевые клетки. Настоящее изобретение также относится к способу увеличения специфичности ингибирования и способу собственно ингибирования нежелательного роста клеток-мишеней путем введения в них указанной генной конструкции. Коробко Игорь Викторович, Коробко Елена Владимировна, Шепелев Михаил Валентинович, Георгиев Георгий Павлович, Свердлов Евгений Давидович (RU) Малахов С.В. (RU)(71)(73) Заявитель и патентовладелец: УЧРЕЖДЕНИЕ РОССИЙСКОЙ АКАДЕМИИ НАУК ИНСТИТУТ МОЛЕКУЛЯРНОЙ ГЕНЕТИКИ РАН; РОССИЙСКАЯ ФЕДЕРАЦИЯ, ОТ ИМЕНИ КОТОРОЙ ВЫСТУПАЕТ МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ (RU) 016223 Область техники, к которой относится настоящее изобретение Настоящее изобретение относится к области молекулярной биологии и генной терапии заболеваний, при которых имеет место нежелательная пролиферация клеток. Предшествующий уровень техники настоящего изобретения Ряд заболеваний характеризуется нежелательной пролиферацией клеток. В случае новообразований аномальная пролиферация клеток вызвана приобретенной клетками способностью к автономному росту. Новообразования могут быть доброкачественными, предраковыми и злокачественными. Патологическая пролиферация клеток может не являться опухолевым процессом, а относиться к гиперплазиям, при которой происходит патологическая пролиферация нормальных, неизмененных клеток под воздействием внешних стимулов (например, синдром Кушинга, неоангиогенез, являющийся одной из причин возрастной дистрофии сетчатки глаза, и др.). Препятствие аномальной пролиферации клеток является основной задачей при лечении таких патологий. Так, действие большинства противоопухолевых препаратов направлено на ингибирование неконтролируемой пролиферации и уничтожение опухолевых клеток. Другим примером является лечение возрастной дистрофии сетчатки, в основе которого лежит ингибирование ростовых сигналов для клеток эндотелия. Для ингибирования роста клеток можно использовать различные способы, в частности обеспечивать в них продукцию экзогенного белка, присутствие которого приводит к ингибированию их роста. В частности, ингибирования роста клеток можно достичь за счет индукции их гибели благодаря продукции в них специфического экзогенного белка. Примерами таких белков, продукция которых в опухолевых клетках приводит к супрессии их пролиферативной активности и/или к их гибели, являются супрессоры опухолевого роста, индукторы апоптоза, а также цитотоксические белки. Супрессоры опухолевого роста представляют собой белки, продукция которых часто снижена или отсутствует в опухолевых клетках, или они мутированы, что способствует процессам возникновения и прогрессии опухоли. Восстановление продукции функциональных супрессоров опухолевого роста в дефектных по ним опухолевых клетках позволяет ингибировать процесс прогрессии опухоли. В качестве одного из наиболее наглядных примеров использования восстановления функций супрессоров опухолевого роста в качестве противоопухолевой терапии можно привести стратегию, основанную на восстановлении экспрессии нормального (немутированного) супрессора опухолевого роста р 53 в опухолевых клетках. р 53 является транскрипционным фактором, регулирующим экспрессию генов, индуцирующих остановку клеточного цикла, апоптоз, процессы репарации ДНК и др. Присутствие функционально активного белка р 53 может быть необходимым для апоптотической клеточной гибели. р 53 часто мутирован или его экспрессия супрессирована в опухолевых клетках, и восстановление экспрессии белка р 53 дикого типа в дефектных по р 53 опухолевых клетках позволяет подавить их рост, сенсибилизировать к действию других противоопухолевых агентов и приводить к супрессии опухолевого фенотипа и даже регрессии опухоли у мышей (Levine, A. J. p53, the cellular gatekeeper for growth and division. Cell. 1997; 88:32331; Harris C.C., Hollstein M. Clinical implications of the p53 tumor-suppressor gene. New Eng. J. Med. 1993; 329:1318-27; Chen, P.-L., Chen Y., Bookstein R., Lee W.-H. Genetic mechanisms of tumor suppression by theradiation. J. Gastroenterol. 2007; 42:140-5 и др.). Поэтому восстановление функций р 53 рассматривается как перспективный способ противоопухолевой терапии (Bouchet B.P., de Fromentel C.C., Puisieux A.,Galmarini C.M. p53 as a target for anti-cancer drug development. Crit. Rev. Oncol. Hematol. 2006; 58:190-207). В настоящее время препарат на основе рекомбинантного репликативно-дефектного аденовируса для продукции р 53 (ING201, Introgen) проходит различные фазы (включая фазу III) клинических испытаний для терапии различных видов опухолей. Помимо р 53, в многочисленных работах был продемонстрирован положительный эффект восстановления экспрессии ряда других супрессоров опухолевого роста, некоторые из которых рассматриваются в настоящее время как основа для создания генно-терапевтических противоопухолевых препаратов. Запуск процесса апоптотической клеточной гибели является одним из механизмов контроля клеточной пролиферации. Поэтому индукция апоптотической клеточной гибели посредством продукции белков, способных активировать апоптотическую клеточную смерть, - индукторов апоптоза - является одним из экспериментально подтвержденных способов элиминации нежелательных популяций клеток. Примером использования индукторов апоптоза для уничтожения опухолевых клеток является подход,основанный на экзогенной продукции индуктора апоптоза TRIAL, продукция которого способна эффективно вызывать апоптоз опухолевых клеток (Carlo-Stella С., Lavazza С., Locatelli A., Vigan L.,Gianni A.M., Gianni L. Targeting TRAIL agonistic receptors for cancer therapy. Clin. Cancer. Res. 2007; 13:2313-7).-1 016223 Другим типом белков, экзогенная экспрессия которых в клетках-мишенях может быть использована для их уничтожения, являются цитотоксические белки. Примерами таких белков, использование которых возможно для проведения генной терапии, являются тимидинкиназа вируса простого герпеса 1-го типа и цитидиндезаминаза Е.coli. Эти ферменты, отсутствующие в клетках млекопитающих, способны конвертировать специфичные нетоксичные вещества (пролекарства) в токсичные вещества, присутствие которых в клетке приводит к их гибели (Aghi M., Hochberg F., Breakefield Х.О. Prodrug activation enzymes incancer gene therapy. J. Gene Med. 2000; 2:148-64). Тимидинкиназа вируса простого герпеса 1-го типа(HSV-tk) является в 1000 раз более активной, чем тимидинкиназа млекопитающих, в реакции монофосфорилирования ганцикловира. Последующее фосфорилирование ганцикловирмонофосфата приводит к появлению в клетке ганцикловиртрифосфата, являющегося токсичным аналогом тимидинтрифосфата,включение которого в ДНК при репликации приводит к остановке репликации и гибели клеток, продуцирующих HSV-tk, а также близлежащих клеток (bystander effect). Использование цитозиндезаминазы основано на том же принципе, но в качестве субстрата используют 5-фторцитозин, конвертируемый в цитотоксичный 5-фторурацил. Для продукции экзогенного белка в клетках-мишенях с целью ингибирования их пролиферации используют генные конструкции, которые содержат кДНК экзогенного белка в совокупности с другими элементами, необходимыми для экспрессии, а именно с промотором, обеспечивающим транскрипцию, и 3'-нетранслируемой областью, обеспечивающей терминацию транскрипции и полиаденилирование транскрипта. Генная конструкция, обеспечивающая продукцию экзогенного белка, должна быть доставлена к клеткам-мишеням и попасть в них. Для доставки генных конструкций используют различные методы,включая электропорацию генной конструкции в виде плазмидной ДНК, доставку генной конструкции в виде плазмидной ДНК в составе полиплексов, доставку генной конструкции в виде плазмидной ДНК с помощью поликатионных липидов, доставку генной конструкции в составе генома рекомбинатных вирусов (например, аденовируса) и др. Однако доставка генной конструкции любым способом в организме сопряжена с проблемой специфичности доставки именно к клеткам-мишеням, т.е. обеспечения попадания генной конструкции только в клетки-мишени, но не в другие клетки. В настоящее время используется несколько подходов, призванных обеспечить специфичность доставки генной конструкции к клеткаммишеням, заключающихся, например, в модификации капсида рекомбинантного аденовируса, содержащего генную конструкцию, что обеспечивает его инфекционность только по отношению к опухолевым клеткам-мишеням за счет взаимодействия со специфически высокопредставленными только на клеткахмишенях белками. Однако с помощью селективной доставки генной конструкции к клеткам-мишеням в настоящее время не удается обеспечить высокую специфичность экспрессии генной конструкции в клетках-мишенях, что может быть обусловлено, например, присутствием, хотя и в меньших количествах,таких белков на нормальных клетках. Поэтому для обеспечения специфичности продукции экзогенного белка в клетках-мишенях в составе генной конструкции используют промоторные элементы, транскрипционная активность которых аномально высока и/или присутствует только в клетках-мишенях. В случае,когда клетки-мишени являются опухолевыми клетками, используют промоторные области генов, транскрипционная активность которых в подавляющем большинстве нормальных клеток в организме отсутствует или очень низка и часто активирована в опухолевых клетках. Примерами таких промоторных элементов, позволяющих обеспечить специфичность транскрипции в опухолевых клетках, являются фрагменты промоторных областей генов обратной транскриптазы теломеразы человека hTERT и гена сурвивина BIRC5. Транскрипция гена hTERT отсутствует в подавляющем большинстве нормальных клеток человека. При этом в опухолевых клетках транскрипция hTERT наблюдается часто (около 85%) (Gu J., Fang В.Telomerase promoter-driven cancer gene therapy. Cancer. Biol. Ther. 2003; 2:S64-70). Проведенный анализ транскрипционной активности фрагментов промотора гена hTERT показал, что фрагмент промотора размером около 200 п.н. выше сайта инициации транскрипции является активным и достаточным для обеспечения специфичной транскрипции в hTERT-позитивных, но не в hTERT-негативных клеткахencountered with constitutive promoters. Gene Ther. 2001; 8:568-78). Этот факт позволяет использовать фрагмент промотора гена hTERT для обеспечения специфичной экзогенной транскрипции в hTERTпозитивных опухолевых клетках (Gu J., Fang В. Telomerase promoter-driven cancer gene therapy. CancerBiol. Ther. 2003; 2:S64-70). В большом числе экспериментальных работ было продемонстрировано, что промотор гена hTERT действительно позволяет обеспечивать экспрессию различных белков в опухолевых hTERT-позитивных, но не в hTERT-негативных нормальных клетках (Song J.S., Kim H.P., Yoon W.S.,Lee K.W., Kim M.H., Kim K.T., Kim H.S., Kim Y.T. Adenovirus-mediated suicide gene therapy using thetelomerase reverse transcriptase promoter causes tumor-selective tumor lysis. Cancer Res. 2003; 63:7936-41). В частности, в ряде работ была продемонстрирована эффективность использования гена тимидинкиназы вируса простого герпеса 1-го типа (HSV-tk) под контролем промотора гена hTERT как способа ганцикловир-зависимого специфического уничтожения опухолевых клеток in vitro и in vivo. Промотор генаhTERT является G/C-богатым и не содержит канонических ТАТА-и СААТ-мотивов (Cong Y.S., Wen J.,Bacchetti S. The human telomerase catalytic subunit hTERT: organization of the gene and characterization ofthe promoter. Hum. Mol. Genet. 1999; 8:137-42). Добавление синтетического ТАТА-бокса к фрагменту промотора гена hTERT позволяет увеличить его активность без потери специфичности по отношению кcancer. Cancer. Res. 2003; 63:3181-8). Аналогичный эффект достигается и введением минимального раннего промотора вируса цитомегаловируса (CMV) (Davis J.J., Wang L., Dong F., Zhang L., Guo W.,Teraishi F., Xu K., Ji L., Fang B. Oncolysis and suppression of tumor growth by a GFP-expressing oncolyticadenovirus controlled by an hTERT and CMV hybrid promoter. Cancer Gene Ther. 2006; 13:720-3). Встраивание в промоторную область небольшого (40 п.н.) фрагмента гена hTERT сразу после сайта инициации транскрипции не оказывало влияния на специфичность промотора, однако существенно увеличивало его активность в клетках, содержащих белок Е 6 вируса папилломы человека (HPV) типа 16 (Veldman T.,Horikawa I., Barrett J.C., Schlegel R. Transcriptional activation of the telomerase hTERT gene by humanpapillomavirus type 16 E6 oncoprotein. J. Virol. 2001; 75:4467-72), что, учитывая его онкогенность, позволяет ожидать повышенной эффективности генно-терапевтических конструкций на основе промотораhTERT в HPV-позитивных опухолях. Другим примером опухоль-специфического промотора, использование которого является перспективным для обеспечения экспрессии экзогенных терапевтических белков в опухолевых клетках, является промотор гена BIRC5, кодирующего белок сурвивин. Сурвивин часто экспрессируется на высоком уровне в опухолевых, но не в нормальных тканях (Ambrosini G., Adida С., Altieri D.C. A novel anti-apoptosisgene, survivin, expressed in cancer and lymphoma. Nat. Med. 1997; 3:917-21), и промотор сурвивина способен успешно управлять экспрессией трансгена специфично в опухолевых клетках (Bao R., Connolly D.C.,Murphy M., Green J., Weinstein J.K., Pisarcik D.A., Hamilton T.C. Activation of cancer-specific gene expression by the survivin promoter. J. Natl. Cancer. Inst. 2002; 94:522-8), что делает возможным его использование, подобно промотору гена hTERT, при разработке противоопухолевых генно-терапевтических подходов. Однако, несмотря на высокую специфичность транскрипционной активности специфических для клеток-мишеней промоторов, эти промоторы могут проявлять транскрипционную активность, хотя и существенно более низкую, в клетках, отличных от клеток-мишеней (Kamizono J., Nagano S.,Murofushi Y., Komiya S., Fujiwara H., Matsuishi T., Kosai K. Survivin-responsive conditionally replicatingadenovirus exhibits cancer-specific and efficient viral replication. Cancer Res. 2005; 65:5284-91). Так, фрагмент промотора гена hTERT в hTERT-негативных неопухолевых нормальных клетках в составе генных конструкций все же обладает, хотя и в малой степени, транскрипционной активностью (Majumdar A.S.,Hughes D.E., Lichtsteiner S.P., Wang Z., Lebkowski J.S., Vasserot A.P. The telomerase reverse transcriptaseconstitutive promoters. Gene Ther. 2001; 8:568-78). Это может определяться как присутствием в определенных типах клеток набора транскрипционных факторов, достаточного для обеспечения транскрипции с этого промотора, так и неспецифической транскрипционной активностью других последовательностей ДНК в составе генной конструкции, могущих выполнять функции эктопического промотора. Таким образом, несмотря на выраженную активность в hTERT-позитивных клетках-мишенях, промотор генаhTERT не обеспечивает абсолютной специфичности транскрипции в клетках-мишенях, и, в общем, использование промоторов, специфически активных только в клетках-мишенях, не позволяет достичь абсолютной специфичности в силу вышеприведенных причин. В результате фоновой активности промотора в нормальных клетках может продуцироваться белок, наличие которого в них может иметь нежелательные последствия. В связи с этим возникает необходимость дальнейшего увеличения специфичности продукции экзогенного белка в клетках-мишенях, что позволит минимизировать продукцию экзогенного белка в клетках, отличных от клеток-мишеней, и снизить вероятность и потенциальную тяжесть побочных эффектов, возникающих в результате продукции экзогенного белка в клетках, отличных от клетокмишеней.-3 016223 Раскрытие настоящего изобретения Увеличение специфичности продукции экзогенного белка в клетках-мишенях может достигаться различными способами за счет увеличения специфичности на любом этапе "жизненного цикла" генной конструкции, используемой с целью продукции экзогенного белка, включая доставку генной конструкции, ее транскрипцию, время жизни транскрипта, эффективность трансляции белка и его стабилизацию. Известно, что время жизни транскрипта в клетке может регулироваться. Специфические последовательности в составе транскрипта могут определять его время жизни в клетке, например, обусловливая быструю деградацию транскрипта. Очевидно, что при селективном увеличении времени жизни транскрипта в клетках-мишенях по сравнению с другими клетками (или его сокращении в клетках, отличных от клетокмишеней) количество транскрипта в клетках-мишенях будет специфически увеличено (или уменьшено в клетках, отличных от клеток-мишеней), что будет иметь соответствующий эффект на уровень экзогенного белка в клетках, трансляция которого зависит от количества транскрипта в клетке. Одним из общих отличий аномально пролиферирующих клеток независимо от причины, вызывающей эту пролиферацию, от большинства других клеток организма является их частое деление. Поэтому одним из способов увеличения специфичности продукции может являться селективная стабилизация транскрипта, транскрибируемого с генной конструкции в делящихся клетках, и соответственно его относительная дестабилизация в неделящихся клетках. Известно, что в процессе деления клеток ряд белков необходим только в определенных фазах клеточного цикла. Клетка использует различные механизмы для контроля присутствия различных белков в определенных фазах клеточного цикла. В частности, такими белками являются ДНК-метилтрансфераза 1, кодируемая геном DNMT1 (Szyf М., Bozovic V., Tanigawa G. Growth regulation of mouse DNAexpression of DNA topoisomerases I and II during the eukaryotic cell cycle. Proc. Natl. Acad. Sci. USA. 1988; 85:1086-90). Их присутствие в делящихся клетках, как минимум частично, контролируется за счет селективной стабилизации соответствующих транскриптов соответственно в S-фазе и S- и G2/М-фазах клеточного цикла (фазах клеточного цикла, сопряженных с делением клеток) и дестабилизацией транскриптов в других фазах клеточного цикла. Стабилизация транскриптов DNMT1 и ТОР 2 А в процессе клеточного деления опосредована их 3'-нетранслируемыми областями. Более того, добавление 3'-нетранслируемой области транскрипта DNMT1 или ТОР 2 А к гетерологичной кДНК (соответственно к кДНК -глобина или -галактозидазы) приводит, как и в случае с эндогенными транскриптами, к стабилизации их транскриптов в определенных стадиях клеточного цикла в делящихся клетках по сравнению с неделящимися клетками (Detich N., Ramchandani S., Szyf M. A conserved 3'-untranslated element mediatesgrowth regulation of DNA methyltransferase 1 and inhibits its transforming activity. J. Biol. Chem. 2001; 276:24881-90; Goswami P.C., Sheren J., Albee L.D., Parsian A., Sim J.E., Ridnour L.A., Higashikubo R.,Gius D., Hunt C.R., Spitz D.R. Cell cycle-coupled variation in topoisomerase IIalpha mRNA is regulated by the 3'-untranslated region. Possible role of redox-sensitive protein binding in mRNA accumulation. J. Biol. Chem. 2000; 275:38384-92). Этот факт является основанием для использования фрагментов 3'-нетранслируемых областей транскриптов DNMT1 и ТОР 2 А в составе генных конструкций для селективной стабилизации экзогенных транскриптов в активно делящихся клетках и их дестабилизации в неделящихся клетках, что позволит повысить специфичность продукции экзогенного белка в пролиферирующих клетках-мишенях. Фрагменты 3'-нетранслируемой области транскрипта DNMT1 (SEQ ID NO: 1) или ТОР 2A(SEQ ID NO: 2) были использованы в генных конструкциях, содержащих кДНК белка дестабилизированного зеленого флуоресцентного белка (dEGFP) под контролем раннего промотора цитомегаловируса(фиг. 1). Полученными экспрессионными конструкциями pdEGFP-DNMT1 и pdEGFP-TOP2A трансфицировали клетки рака легких линии NCI-H1299. В качестве контроля сравнения использовали плазмидуpdEGFP-N1, содержащую сигнал терминации транскрипции и полиаденилирования вируса SV40, не обладающий способностью селективно стабилизировать транскрипт, в состав которого он входит, в неделящихся клетках (фиг. 1). В результате проведенного анализа уровня экспрессии белка dEGFP в трансфицированных клетках было установлено, что использование транскрипта ТОР 2 А несущественно (в 3 раза) снижает уровень продукции белка, а использование 3'-нетранслируемой области транскриптаDNMT1 не только не снижает уровень продукции белка, но и увеличивает его в 1,6 раз (фиг. 2). Таким образом, введение в экспрессионную конструкцию 3'-нетранслируемых областей транскриптов DNMT1 или ТОР 2 А не оказывает существенного влияния на эффективность экспрессии кодируемого ею белка в активно пролиферирующих клетках, несмотря на их известную из предшествующего уровня техники способность дестабилизировать транскрипт в неделящихся клетках.-4 016223 Фрагменты 3'-нетранслируемой области транскрипта DNMT1 или ТОР 2A использовали в генных конструкциях, содержащих кДНК HSV-tk под контролем фрагмента промотора гена hTERT(SEQ ID NO: 3), комбинация которых используется для селективного уничтожения hTERT-позитивных опухолевых клеток в присутствии ганцикловира (плазмиды phTERT-TK-DNMT1 и phTERT-TK-TOP2A,соответственно; фиг. 3). Присутствие в конструкции 3'-нетранслируемой области транскрипта DNMT1 или транскрипта ТОР 2 А, как следует из предшествующего уровня техники (Detich N., Ramchandani S.,Szyf M. A conserved 3'-untranslated element mediates growth regulation of DNA methyltransferase 1 andprotein binding in mRNA accumulation. J. Biol. Chem. 2000; 275:38384-92), приводит к селективной стабилизации содержащего ее транскрипта в делящихся клетках, чего не обеспечивает часто используемый в экспрессионных конструкциях сигнал терминации транскрипции и полиаденилирования вируса SV40,который использовали в качестве контроля (плазмида phTERT-TK-SV40) (фиг. 3). Поэтому на основании известных данных (Detich N., Ramchandani S., Szyf M. A conserved 3'-untranslated element mediates growthregulation of DNA methyltransferase 1 and inhibits its transforming activity. J. Biol. Chem. 2001; 276:2488190; Goswami P.C., Sheren J., Albee L.D., Parsian A., Sim J.E., Ridnour L.A., Higashikubo R., Gius D.,Hunt C.R., Spitz D.R. Cell cycle-coupled variation in topoisomerase IIalpha mRNA is regulated by the 3'-untranslated region. Possible role of redox-sensitive protein binding in mRNA accumulation. J. Biol. Chem. 2000; 275:38384-92) можно утверждать, что замена сигнала терминации транскрипции и полиаденилирования вируса SV40 на фрагменты 3'-нетранслируемых областей транскриптов DNMT1 или ТОР 2 А приведет к относительной дестабилизации транскрипта HSV-tk в неделящихся (нормальных) клетках по сравнению с активно делящимися (опухолевыми) клетками. Введение фрагментов 3'-нетранслируемых областей транскриптов DNMT1 или ТОР 2A в состав генной конструкции позволяет повысить относительную специфичность продукции экзогенного белка,кодируемого генной конструкцией, в делящихся клетках по сравнению с неделящимися. Однако оставалось неясным, не приведет ли замена 3'-нетранслируемой области к снижению общей эффективности генной конструкции, поскольку в этом случае снижение эффективности продукции экзогенного белка может иметь существенно большее негативное значение, чем положительный эффект от увеличенной специфичности. Результаты анализа продукции белка dEGFP, транскрипт которого содержал 3'-нетранслируемые области транскриптов DNMT1 или ТОР 2 А, позволяют предположить, что эффективность действия генных конструкций существенно не изменится при введении в их состав 3'-нетранслируемых областей транскриптов DNMT1 или ТОР 2 А. Для подтверждения этого предположения был проведен сравнительный анализ эффективности генных конструкций phTERT-TK-SV40,phTERT-TK-DNMT1 и phTERT-TK-TOP2A в способности вызывать ганцикловир-зависимую клеточную гибель клеток рака легких линии NCI-H1299. Клетки линии NCI-H1299 являются hTERTположительными (Lin S.C., Li W.C., Shih J.W., Hong K.F., Pan Y.R., Lin J.J. The tea polyphenols EGCG andLett. 2006; 236:80-8), и, как и ожидалось, использованная в генных конструкциях область промотора генаhTERT (-206 - +37) (SEQ ID NO: 3) является в них транскрипционно активной (фиг. 4). В соответствии с этим трансфекция клеток NCI-H1299 плазмидой phTERT-TK-SV40 приводила к их эффективной гибели в присутствии ганцикловира, в то время как в отсутствие ганцикловира этого эффекта не наблюдалось(фиг. 5). При трансфекции клеток плазмидами phTERT-TK-DNMT1 или phTERT-TK-TOP2A, содержащими в своем составе фрагменты 3'-нетранслируемых областей, приводящих к дестабилизации транскрипта в неделящихся клетках, в присутствии ганцикловира эффективность клеточной гибели не снижалась по сравнению с клетками, трансфицированными плазмидой phTERT-TK-SV40, а в случае с экспрессионной конструкцией, содержащей 3'-нетранслируемую область транскрипта DNMT1, даже несколько увеличилась (фиг. 5), что соотносится с увеличенной экспрессией белка dEGFP при замене в экспрессионной конструкции сигнала терминации транскрипции и полиаденилирования вируса SV40 на 3'-нетранслируемую область транскрипта DNMT1. Этот результат позволяет сделать вывод, что использование фрагментов 3'-нетранслируемых областей транскриптов DNMT1 и ТОР 2 А не приводит к общему снижению эффективности действия генных конструкций в клетках-мишенях. Суммируя, введение в экспрессионную конструкцию фрагмента 3'-нетранслируемой области транскрипта DNMT1 или ТОР 2 А не оказывает существенного влияния на эффективность экспрессии кодируемого ею белка (показано на примере белка dEGFP) и его суммарную активность (показано на примере тимидинкиназы вируса простого герпеса, вызывающего ганцикловир-зависимую клеточную гибель). При этом, как следует из предшествующего уровня техники, введение фрагмента 3'-нетранслируемой области транскрипта DNMT1 или ТОР 2 А позволяет селективно дестабилизировать транскрипт в неделящихся клетках, тем самым ослабляя в них экспрессию экзогенного белка (и, соответственно, его суммарную активность) и повышая специфичность продукции экзогенного белка в делящихся клетках-мишенях.-5 016223 Таким образом, настоящее изобретение относится к генной конструкции для ингибирования нежелательного роста клеток-мишеней, содержащей: а) 3'-нетранслируемую область транскрипта гена, выбранного из гена ДНК-топоизомеразы II(ТОР 2 А) человека и гена ДНК-(цитозин-5)-метилтрансферазы 1 (DNMT1) человека; б) кДНК по меньшей мере одного белка, ингибирующего рост клеток; в) промотор, транскрипционная активность которого является специфичной для клеток-мишеней. Поскольку эффект включения фрагментов 3'-нетранслируемых областей транскриптов DNMT1 или ТОР 2 А состоит в дестабилизации содержащих их транскриптов и обусловлен специфическими особенностями нуклеотидных последовательностей 3'-нетранслируемых областей транскриптов DNMT1 или ТОР 2 А (Detich N., Ramchandani S., Szyf M. A conserved 3'-untranslated element mediates growth regulationregion. Possible role of redox-sensitive protein binding in mRNA accumulation. J. Biol. Chem. 2000; 275:38384-92), то вид (тип) и способ доставки экспрессионной конструкции, конкретная структура промоторного элемента в ее составе и кодируемого ею экзогенного белка не являются существенными для проявления этих свойств. Так, одним из возможных вариантов осуществления промотора, транскрипционная активность которого является специфичной для клеток-мишеней, является промотор гена обратной транскриптазы теломеразы человека (hTERT). Другим вариантом осуществления промотора, транскрипционная активность которого является специфичной для клеток-мишеней, является гибридный промотор, состоящий из промотора гена hTERT и минимального раннего CMV-промотора или синтетического ТАТА-бокса. Еще одним вариантом осуществления промотора, транскрипционная активность которого является специфичной для клеток-мишеней, является промотор гена сурвивина человека (BIRC5). Настоящее изобретение в равной степени относится также к генным конструкциям, кодирующим различные белки, ингибирующие рост клеток. Так, белок, ингибирующий рост клеток, может представлять собой без ограничения супрессор опухолевого роста, и/или индуктор апоптоза, и/или цитотоксический белок. В соответствии с предпочтительным вариантом осуществления цитотоксический белок представляет собой фермент (например, тимидинкиназу вируса простого герпеса 1-го типа), конвертирующий субстрат (например, ганцикловир) в токсичное соединение, вызывающее клеточную гибель. Положительный эффект на специфичность от использования фрагментов 3'-нетранслируемых областей транскриптов DNMT1 или ТОР 2 А в составе экспрессионных конструкций обусловлен деградацией содержащих его транскриптов в нормальных неделящихся клетках и соответственно не зависит от типа пролиферирующих клеток-мишеней, поскольку неразрывно связан с процессом клеточного деления. Одним из предпочтительных воплощений клеток-мишеней являются опухолевые клетки, которые характеризуются аномальной пролиферацией. Другим предпочтительным воплощением клеток-мишеней являются неопухолевые клетки-мишени, подверженные аномальной пролиферации, в которых транскрипты, содержащие фрагменты 3'-нетранслируемых областей транскриптов DNMT1 или ТОР 2 А, также будут стабильны благодаря их активному делению. Кроме того, настоящее изобретение относится к способу увеличения специфичности ингибирования нежелательного роста клеток-мишеней, предусматривающему доставку в клетки-мишени генной конструкции, содержащей: а) 3'-нетранслируемую область транскрипта гена, выбранного из гена ДНК-топоизомеразы II(ТОР 2 А) человека и гена ДНК-(цитозин-5)-метилтрансферазы 1 (DNMT1) человека; б) кДНК по меньшей мере одного белка, ингибирующего рост клеток; в) промотор, транскрипционная активность которого является специфичной для клеток-мишеней. В контексте настоящего изобретения термин "специфичное ингибирование нежелательного роста клеток-мишеней" означает приобретение популяцией таких клеток свойства снижать свою пролиферацию, в том числе погибать, в результате экспрессии ими белков, кодируемых вводимой в них генной конструкцией, которые вызывают снижение пролиферации, достигаемое либо непосредственным снижением пролиферативной активности (т.е. процесса клеточного деления), либо непосредственно запуском процесса клеточной гибели (например, по механизму апоптоза), либо превращением дополнительно вводимого пролекарства в цитотоксическое соединение, либо увеличением чувствительности клеток к воздействию других антипролиферативных агентов, либо ингибированием иных нежелательных свойств клеток, характеризующихся нежелательным ростом, например их подвижность и инвазию в случае опухолевых клеток, причем такое свойство избирательно приобретают только избыточно пролиферирующие клетки.-6 016223 Следовательно, настоящее изобретение также относится и к способу, реализующему описанное выше свойство для борьбы с избыточно пролиферирующими популяциями клеток, а именно к способу высокоспецифичного ингибирования нежелательного роста клеток-мишеней, предусматривающему доставку в клетки-мишени генной конструкции, содержащей 3'-нетранслируемую область транскрипта гена,выбранного из гена ДНК-топоизомеразы II(ТОР 2 А) человека и гена ДНК-(цитозин-5)метилтрансферазы 1 (DNMT1) человека, кДНК по меньшей мере одного белка, ингибирующего рост клеток, и промотор, транскрипционная активность которого является специфичной для клеток-мишеней,и (при необходимости для осуществления цитотоксического действия) доставку к клеткам-мишеням субстрата, конвертируемого белком, кодируемым кДНК, содержащейся в составе указанной генной конструкции, в токсичное соединение, вызывающее клеточную гибель. В контексте настоящего изобретения термин "необходимость для осуществления цитотоксического действия" относится к описанной выше ситуации, когда белок, кодируемый вводимой в клетки-мишени генной конструкцией, не сам непосредственно запускает процесс клеточной гибели, а является ферментом, превращающим дополнительно вводимое пролекарство в цитотоксическое соединение. Одним из предпочтительных вариантов осуществления такой пары "фермент-пролекарство" являются соответственно тимидинкиназа вируса простого герпеса 1-го типа и ганцикловир. Специалисту в данной области будет очевидно, что в зависимости от используемой в составе заявленной генной конструкции кДНК заявленные способ увеличения специфичности ингибирования и способ собственно ингибирования нежелательного роста клеток-мишеней либо будут осуществляться одновременно (например, когда кДНК кодирует белок, непосредственно запускающий процесс клеточной гибели (например, по механизму апоптоза, либо будут разнесены по времени (например, когда кДНК кодирует белок, являющийся ферментом, превращающим дополнительно вводимое пролекарство в цитотоксическое соединение). Специалисту в данной области будет также очевидно, что заявленный способ увеличения специфичности ингибирования и собственно ингибирования нежелательного роста клеток-мишеней в результате продукции экзогенного белка в делящихся клетках-мишенях с использованием фрагментов 3'-нетранслируемых областей транскриптов DNMT1 или ТОР 2 А не ограничен приведенным примером,состоящим в использовании:(1) опухолевых клеток линии NCI-H1299;(2) промотора гена hTERT как элемента, обеспечивающего специфическую транскрипцию в клетках-мишенях;(3) тимидинкиназы вируса простого герпеса 1-го типа как цитотоксического белка;(4) плазмиды в качестве носителя экспрессионной конструкции;(5) трансфекции как способа доставки экспрессионной конструкции в клетки-мишени. Краткое описание чертежей Фиг. 1. Схемы плазмид pdEGFP-DNMT1 (A), pdEGFP-TOP2A (Б) и pdEGFP-N1 (В). Толстыми линиями показаны: светло-серым цветом - ранний промотор цитомегаловируса (PCMV); темно-серым цветом - кДНК dEGFP (dEGFP) и кДНК неомицинфосфотрансферазы II под контролем промотора вируса SV40 (NPT); черным цветом - последовательности фрагментов 3'-нетранслируемых областей транскриптов DNMT1 (DNMT1; А), ТОР 2A (ТОР 2A; Б) и последовательность терминации транскрипции и полиаденилирования вируса SV40 (3SV40; В). Тонкими стрелками обозначено направление фрагментов ДНК в экспрессионных векторах от 5'- к 3'-концу. Также показаны положения сайтов узнавания рестрикционных эндонуклеаз, фланкирующих 3'-нетранслируемые области в экспрессионных конструкциях. Фиг. 2. Анализ продукции белка dEGFP в клетках линии NCI-H1299, транзиторно трансфицированных плазмидами pdEGFP-N1 (SV40), pdEGFP-DNMT1 (DNMT1) или pdEGFP-TOP2A (TOP2A). Показаны результаты Вестерн-блот анализа лизатов клеток с использованием антител против EGFP(dEGFP) и антител против неомицинфосфотрансферазы II (NPT) для контроля количества нанесенных лизатов и нормализации эффективности трансфекции. Внизу приведены данные количественного определения уровня dEGFP, нормированного на количество неомицинфосфотрансферазы в образцах. Фиг. 3. Схемы плазмид phTERT-TK-DNMT1 (A), phTERT-TK-TOP2A (Б) и phTERT-TK-SV40 (В). Вектор pBluescript II SK (+) показан тонкой линией. Толстыми линиями показаны: светло-серым цветом - фрагмент промотора гена hTERT (-206 - +37) (PhTERT); темно-серым цветом - кДНК тимидинкиназы вируса простого герпеса 1-го типа (HSV-tk); черным цветом - последовательности фрагментов 3'нетранслируемых областей транскриптов DNMT1 (DNMT1; А), ТОР 2 А (ТОР 2 А; Б) и последовательность терминации транскрипции и полиаденилирования вируса SV40 (3SV40; В). Тонкими стрелками обозначено направление фрагментов ДНК в экспрессионных векторах от 5'-к 3'-концу. Также показаны положения сайтов узнавания рестрикционных эндонуклеаз, фланкирующих промотор гена hTERT, кДНК тимидинкиназы и 3'-нетранслируемые области в экспрессионных конструкциях.-7 016223 Фиг. 4. Анализ активности промотора гена hTERT (-206 - +37) в клетках линии NCI-Н 1299. Показаны результаты измерения активности люциферазы светлячка, нормированной на активность люциферазы Renilla (в относительных единицах люминесценции) для клеток, трансфицированных плазмидой pRL-CMV совместно с указанными репортерными плазмидами (pGL3-Basic, pGL3-Control иpGL3-hTERT). Данные приведены как среднее значение измерений в 3 лункахстандартное отклонение. Фиг. 5. Анализ ганцикловир-зависимой клеточной гибели клеток линии NCI-H1299, трансфицированных плазмидой pBluescript II SK (-) (Контроль), phTERT-TK-SV40 (SV40), phTERT-TK-DNMT1(DNMT1) или phTERT-TK-TOP2A (TOP2A). Трансфицированные клетки обрабатывали ганцикловиром в указанных концентрациях в течение 6 суток. Жизнеспособность клеток определена с помощью набора CellTiter-Glo Luminescent Cell Viability Assay (Promega, США) и указана в относительных единицах люминесценции, значение которой пропорционально количеству жизнеспособных клеток в лунке. Данные приведены как среднее значение измерений в 3 лункахстандартное отклонение. Примеры предпочтительных вариантов осуществления изобретения Пример 1. Создание плазмид pdEGFP-DNMT1 и pdEGFP-TOP2A. Плазмиды pdEGFP-DNMT1 и pdEGFP-TOP2A созданы на основе плазмиды pdEGFP-N1 (Clontech,США) и содержат кДНК белка dEGFP под контролем раннего промотора цитомегаловируса с фрагментом 3'-нетранслируемой области транскрипта DNMT1 или ТОР 2A на 3'-конце кДНК dEGFP вместо последовательности терминации транскрипции и полиаденилирования вируса SV40 в плазмиде pdEGFP-N1(фиг. 1). Фрагмент 3'-нетранслируемой области транскрипта DNMT1 (GeneBank Acc. No. NM001379, нт 5108-5409) с сайтами узнавания рестрикционных эндонуклеаз NotI на 5'-конце и AflII и XbaI на 3'-конце получали с помощью ПЦР на матрице геномной ДНК периферических лимфоцитов крови человека с праймерами 5'-atgcggccgctgtttctggcaccaggaat-3' и 5'-attctagacttaagtggtttataggagagattta-3'. Фрагмент 3'-нетранслируемой области транскрипта ТОР 2 А размером 1033 нт, начиная с нт 4696 (GeneBank Acc.No. NM001067), с сайтами узнавания рестрикционных эндонуклеаз NotI на 5'-конце и AflII и XbaI на 3'-конце получали с помощью ПЦР на матрице геномной ДНК периферических лимфоцитов крови человека с праймерами 5'-atgcggccgcgagtcagatgaagatgatctgt-3' и 5'-attctagacttaagcattctatgggttgcaatgt-3'. Полученные в результате ПЦР фрагменты клонировали в плазмидные векторы и аутентичность последовательностей клонированных фрагментов 3'-нетранслируемых областей транскриптов DNMT1 и ТОР 2 А подтверждали секвенированием. Клонированные фрагменты 3'-нетранслируемых областей транскриптовDNMT1 и ТОР 2 А вырезали с помощью рестрикционных эндонуклеаз NotI и AflII и клонировали в плазмиду pdEGFP-N1 между сайтами узнавания этих рестрикционных эндонуклеаз, замещая последовательность терминации транскрипции и полиаденилирования вируса SV40. Пример 2. Анализ продукции белка dEGFP в клетках линии NCI-H1299, транзиторно трансфицированных плазмидами pdEGFP-N1, pdEGFP-DNMT1 или pdEGFP-TOP2A. Клетки линии NCI-H1299 рассевали в лунки 24-луночного планшета и трансфицировали плазмидойpdEGFP, pdEGFP-DNMT1 или pdEGFP-TOP2A с помощью реагента для трансфекции Unifectin-56(Unifect Group, Россия). Через 48 ч клетки лизировали и проводили анализ количества белка dEGFP в лизатах методом Вестерн-блоттинга с использованием антител против EGFP. Также проводили Вестернблот анализ с использованием антител против неомицинфосфотрансферазы II, кодируемой той же плазмидой, для нормализации количества белка dEGFP в образце и исключения влияния эффективности трансфекции разными плазмидами на результаты анализа количеств белка dEGFP в лизатах. Визуализацию связавшихся с белками антител проводили с помощью хемилюминесцентного реагента ECL+ (GEAnalysis Software (BioRad, США). В результате анализа было установлено, что экспрессия белка dEGFP существенно не изменяется при замене сигнала терминации транскрипции и полиаденилирования вирусаSV40 на 3'-нетранслируемую область транскрипта DNMT1 или ТОР 2 А и составляет соотвественно 1,6 и 0,3 по отношению к уровню dEGFP при использовании сигнала терминации транскрипции и полиаденилирования вируса SV40 в составе экспрессионной конструкции (фиг. 2). Таким образом, замена сигнала терминации транскрипции и полиаденилирования вируса SV40 на 3'-нетранслируемую область транскрипта DNMT1 или ТОР 2 А в экспрессионной конструкции не оказывает существенного влияния на уровень экспрессии кодируемого ею белка в делящихся клетках.-8 016223 Пример 3. Создание плазмиды phTERT-TK-DNMT1. Плазмида phTERT-TK-DNMT1 была создана на основе вектора pBluescript SKII (+) (Stratagene,США) и содержит кДНК тимидинкиназы вируса простого герпеса 1-го типа под контролем фрагмента промотора гена hTERT с фрагментом 3'-нетранслируемой области транскрипта DNMT1 на 3'-конце кДНК тимидинкиназы (фиг. 3). кДНК тимидинкиназы вируса простого герпеса с сайтами узнавания рестрикционных эндонуклеаз BglII на 5'-конце и NotI на 3'-конце получали с помощью полимеразной цепной реакции (ПЦР) с праймерами 5'-atggtaccgacccgcttaacagcgtcaa-3' и 5'-atgcggccgctattgtctccttccgtgtttc-3' на матрице плазмиды pPNT (Tybulewicz V.L., Crawford С.Е., Jackson P.K., Bronson R.T., Mulligan R.C.Neonatal lethality and lymphopenia in mice with a homozygous disruption of the c-abl proto-oncogene. Cell. 1991 Jun. 28; 65(7):1153-63), содержащей кДНК тимидинкиназы вируса простого герпеса 1-го типа. Фрагмент промотора гена hTERT (-206 - +37) (GeneBank Acc. No. AF128893, нт 110006-11248) амплифицировали на матрице геномной ДНК периферических лимфоцитов крови человека с праймерами 5'-tggattcgcgggcacagacg-3' и 5'-gcagcacctcgcggtagtg-3' с последующей повторной амплификацией с праймерами 5'-catggtacctcgagcacagacgcccaggaccgcgct-3' и 5'-atggatccagatctcccacgtgcgcagcagga-3' для введения сайтов узнавания рестрикционных эндонуклеаз KpnI и XhoI на 5'-конце и BglII и BamHI на 3'-конце фрагмента промотора гена hTERT. Получение фрагмента 3'-нетранслируемой области транскриптаDNMT1 с сайтами узнавания рестрикционных эндонуклеаз NotI на 5'-конце и AflII и XbaI на 3'-конце описано в примере 1. Клонированные фрагменты использовали для последовательного субклонирования в вектор pBluescript SKII (+) между сайтами узнавания рестрикционных эндонуклеаз KpnI и XbaI фрагментов промотора гена hTERT, кДНК тимидинкиназы и фрагмента 3'-нетранслируемой области транскрипта DNMT1 и получения плазмиды phTERT-TK-DNMT1 (фиг. 3) с помощью общеизвестных приемов генной инженерии. Пример 4. Создание плазмиды phTERT-TK-TOP2A. Плазмида phTERT-TK-TOP2A (фиг. 1) была создана на основе вектора pBluescript SKII (+)(Stratagene, США) аналогично плазмиде phTERT-TK-DNMT1 (пример 3) и содержит кДНК тимидинкиназы вируса простого герпеса 1-го типа под контролем фрагмента промотора гена hTERT с фрагментом 3'-нетранслируемой области транскрипта ТОР 2 А на 3'-конце кДНК тимидинкиназы (фиг. 3). Получение фрагмента 3'-нетранслируемой области транскрипта ТОР 2 А с сайтами узнавания рестрикционных эндонуклеаз NotI на 5'-конце и AflII и XbaI на 3'-конце описано в примере 1. Пример 5. Создание плазмиды phTERT-TK-SV40. Плазмида phTERT-TK-TOP2A (фиг. 3) была создана на основе вектора pBluescript SKII (+)(Stratagene, США) и содержит кДНК тимидинкиназы вируса простого герпеса 1-го типа под контролем фрагмента промотора гена hTERT с фрагментом ДНК, содержащим сигналы терминации транскрипции и полиаденилирования вируса SV40 на 3'-конце кДНК тимидинкиназы (фиг. 3). Фрагмент ДНК, содержащий сигналы терминации транскрипции и полиаденилирования вируса SV40, вырезали по сайтам узнавания рестрикционных эндонуклеаз NotI и AflII из вектора pEGFP-N2 (Clontech, США) и клонировали вместо фрагмента 3'-нетранслируемой области транскрипта ТОР 2 А в плазмиду phTERT-TK-TOP2A по сайтам узнавания рестрикционных эндонуклеаз NotI и AflII для получения плазмиды phTERT-TK-SV40(фиг. 3). Пример 6. Анализ транскрипционной активности промотора гена hTERT (-206 - +37) в клетках линии NCI-H1299. Транскрипт hTERT присутствует в клетках линии NCI-H1299 (Lin S.C., Li W.C., Shih J.W.,Hong K.F., Pan Y.R., Lin J.J. The tea polyphenols EGCG and EGC repress mRNA expression of human telomerase reverse transcriptase (hTERT) in carcinoma cells. Cancer Lett. 2006; 236:80-8), что предполагает способность фрагмента промотора гена hTERT в составе рекомбинантной экспрессионной конструкции направлять транскрипцию трансгена. Для подтверждения активности фрагмента промотора гена hTERT (206 - +37) был проведен анализ его транскрипционной активности в клетках линии NCI-H1299. Анализ проводили с использованием репортерного гена люциферазы светлячка. Для этого фрагмент промотора гена hTERT (см. пример 3) клонировали по сайтам узнавания рестрикционных эндонуклеаз BglII и KpnI в вектор pGL3-Basic (Promega, США) для получения плазмиды pGL3-hTERT с кДНК люциферазы светлячка под контролем промотора гена hTERT (-206 - +37). В качестве негативного контроля использовали плазмиду pGL3-Basic, в которой кДНК люциферазы светлячка не содержит промотора. В качестве положительного контроля использовали плазмиду pGL3-Control (Promega, США), в которой транскрипция кДНК люциферазы светлячка управляется промотором и энхансером вируса SV40. Клетки линии NCIH1299 рассевали в лунки 96-луночного планшета и трансфицировали плазмидой pGL3-hTERT, pGL3Basic или pGL3-Control совместно с плазмидой pRL-CMV, кодирующей люциферазу Renilla под контролем раннего промотора цитомегаловируса (Promega, США), в соотношении 50:1 с помощью реагента для трансфекции Unifectin-56 (Unifect Group, Россия). Анализ активности люцифераз светлячка и Renilla проводили через 48 ч после трансфекции с помощью набора Dual-Glo Luciferase Assay System(Promega, США). Результаты измерения активностей люциферазы светлячка, нормированной на активность люциферазы Renilla, представлены на фиг. 4. Видно, что активность люциферазы светлячка в клетках, трансфицированных плазмидой pGL3-hTERT, значительно выше, чем в клетках, трансфицирован-9 016223 ных беспромоторной конструкцией pGL3-Basic, что указывает на активность промотора гена hTERT (206 - +37) в клетках линии NCI-Н 1299. Пример 7. Анализ ганцикловир-зависимой гибели клеток линии NCI-H1299, трансфицированных плазмидами phTERT-TK-DNMT1, phTERT-TK-TOP2A или phTERT-TK-SV40. Сравнительная эффективность экспрессионных конструкций с тимидинкиназой под контролем промотора гена hTERT, отличающихся 3'-нетранслируемыми областями, исследовали на модели клеток линии NCI-H1299, в которых промотор гена hTERT (-206 - +37) способен эффективно активировать транскрипцию в составе экспрессионной конструкции (пример 6). Клетки линии NCI-H1299 транзиторно трансфицировали плазмидами phTERT-TK-DNMT1, phTERT-TK-TOP2A или phTERT-TK-SV40 в одинаковых условиях (трансфекцию проводили с использованием реагента для трансфекции Unifectin-56(Unifect Group, Россия и обрабатывали ганцикловиром в концентрации 2 или 20 мкМ. После 6 суток инкубации клеток с ганцикловиром проводилась количественная оценка жизнеспособности клеток с использованием набора CellTiter-Glo Luminescent Cell Viability Assay (Promega, США). Обработка ганцикловиром клеток, трансфицированных плазмидой pBluescript SK II(-), не содержащей кДНК тимидинкиназы (негативный контроль), не приводила к существенному снижению жизнеспособности клеток, так же как и в случае с клетками, трансфицированными плазмидами, содержащими кДНК тимидинкиназы под контролем промотора гена hTERT (-206 - +37), но не обработанными ганцикловиром (фиг. 5). В то же время трансфекция клеток плазмидами phTERT-TK-DNMT1, phTERT-TK-TOP2A или phTERT-TKSV40 с последующей их обработкой ганцикловиром приводила к значительному снижению жизнеспособности клеток. Существенно, что снижение жизнеспособности клеток было приблизительно одинаковым независимо от 3'-нетранслируемой области в составе экспрессионной конструкции (фиг. 5). Эти данные свидетельствуют о сравнимой эффективности экспрессионных конструкций и позволяют сделать вывод, что использование фрагментов 3'-нетранслируемой области транскрипта DNMT1 или ТОР 2 А вместо их традиционных аналогов не снижает эффективности экспрессионных конструкций. Существенно, что этот факт установлен в модели ганцикловир-зависимой гибели опухолевых клеток при продукции в них тимидинкиназы под контролем промотора гена hTERT (-206 - +37), что является перспективной стратегией для разработки генно-терапевтических противоопухолевых средств. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Генная конструкция для ингибирования нежелательного роста клеток-мишеней, содержащая: а) 3'-нетранслируемую область транскрипта гена, выбранного из гена ДНК-топоизомеразы II альфа(ТОР 2 А) человека и гена ДНК-(цитозин-5)-метилтрансферазы 1 (DNMT1) человека; б) кДНК по меньшей мере одного белка, ингибирующего рост клеток; в) промотор, транскрипционная активность которого является специфичной для клеток-мишеней. 2. Генная конструкция по п.1, причем клетки-мишени представляют собой опухолевые клетки. 3. Генная конструкция по п.1, причем клетки-мишени представляют собой неопухолевые клетки,подверженные аномальной пролиферации. 4. Генная конструкция по п.1, причем белок, ингибирующий рост клеток, представляет собой супрессор опухолевого роста. 5. Генная конструкция по п.1, причем белок, ингибирующий рост клеток, представляет собой индуктор апоптоза. 6. Генная конструкция по п.1, причем белок, ингибирующий рост клеток, представляет собой цитотоксический белок. 7. Генная конструкция по п.6, причем цитотоксический белок представляет собой фермент, конвертирующий субстрат в токсичное соединение, вызывающее клеточную гибель. 8. Генная конструкция по п.7, причем цитотоксический белок представляет собой тимидинкиназу вируса простого герпеса первого типа. 9. Генная конструкция по п.1, в которой промотор, транскрипционная активность которого является специфичной для клеток-мишеней, представляет собой промотор гена обратной транскриптазы теломеразы человека (hTERT). 10. Генная конструкция по п.1, в которой промотор, транскрипционная активность которого является специфичной для клеток-мишеней, представляет собой гибридный промотор, состоящий из промотора гена hTERT и минимального раннего CMV-промотора или синтетического ТАТА-бокса. 11. Генная конструкция по п.1, в которой промотор, транскрипционная активность которого является специфичной для клеток-мишеней, представляет собой промотор гена сурвивина человека (BIRC5). 12. Способ увеличения специфичности ингибирования нежелательного роста клеток-мишеней, предусматривающий доставку в клетки-мишени генной конструкции по любому из пп.1-11. 13. Способ по п.12, согласно которому клетки-мишени представляют собой опухолевые клетки. 14. Способ по п.12, согласно которому клетки-мишени представляют собой неопухолевые клетки,подверженные аномальной пролиферации. 15. Способ высокоспецифичного ингибирования нежелательного роста клеток-мишеней, предусматривающий: а) доставку в клетки-мишени генной конструкции по любому из пп.1-11; б) при необходимости для осуществления цитотоксического действия доставку к клеткам-мишеням субстрата, конвертируемого белком, кодируемым кДНК, содержащейся в составе конструкции по любому из пп.1-11, в токсичное соединение, вызывающее клеточную гибель. 16. Способ по п.15, согласно которому клетки-мишени представляют собой опухолевые клетки. 17. Способ по п.15, согласно которому клетки-мишени представляют собой неопухолевые клетки,подверженные аномальной пролиферации. 18. Способ по п.15, согласно которому белок, кодируемый кДНК, содержащейся в составе конструкции по любому из пп.1-11, представляет собой тимидинкиназу вируса простого герпеса первого типа,а субстрат, конвертируемый в токсичное соединение, представляет собой ганцикловир.
МПК / Метки
МПК: C12N 5/09, A61P 35/00, A61K 38/10, C12N 15/67
Метки: генная, конструкция, клеток, нежелательного, роста, способ, высокоспецифичного, ингибирования
Код ссылки
<a href="https://eas.patents.su/17-16223-sposob-i-gennaya-konstrukciya-dlya-vysokospecifichnogo-ingibirovaniya-nezhelatelnogo-rosta-kletok.html" rel="bookmark" title="База патентов Евразийского Союза">Способ и генная конструкция для высокоспецифичного ингибирования нежелательного роста клеток</a>
Предыдущий патент: Композиция для обработки семян, обладающая рострегулирующим действием
Следующий патент: Сеялка
Случайный патент: Одноразовый гинекологический инструмент, предназначенный для дилатации полостей тела путем ввода текучей среды