Терапевтические соединения
Номер патента: 14425
Опубликовано: 30.12.2010
Авторы: Браун Джайлз, Сейвори Эдвард, Оузман Жаклин, Притчард Мартин
Формула / Реферат
1. Применение соединения формулы (VII) или его фармацевтически приемлемой соли в производстве лекарственного средства для профилактики, лечения или облегчения патологического состояния, которое может быть улучшено или предотвращено агонизмом в отношении аденозиновых рецепторов А2А
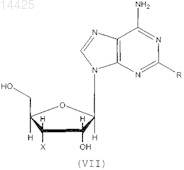
где R представляет собой C1-4 алкокси и X представляет собой Н или ОН.
2. Применение соединения, определенного в п.1, или его фармацевтически приемлемой соли в производстве лекарственного средства для профилактики, лечения или облегчения боли.
3. Применение по п.2, где боль представляет собой гипералгезию.
4. Применение по п.3, где гипералгезия представляет собой невропатическую боль.
5. Применение по п.3, где гипералгезия представляет собой боль при воспалении.
6. Применение по любому из пп.2, 3 или 5, где боль вызвана или связана с воспалительным или иммунным заболеванием, или является результатом комбинированного воспалительного, аутоиммунного и невропатического повреждения тканей.
7. Применение по п.2 в производстве лекарственного средства для профилактики, лечения или облегчения ишемической боли.
8. Применение соединения, определенного в п.1, или его фармацевтически приемлемой соли в производстве лекарственного средства для профилактики, лечения или облегчения макро и микрососудистых осложнений диабета 1 и 2 типа, ретинопатии, невропатии, вегетативной невропатии или повреждения кровеносных сосудов, вызванного ишемией или атеросклерозом.
9. Применение соединения, определенного в п.1, или его фармацевтически приемлемой соли для производства лекарственного средства для профилактики, лечения или облегчения воспаления.
10. Применение соединения, определенного в п.1, или его фармацевтически приемлемой соли в производстве болезнь-модифицирующих (базисных) противоревматических лекарственных средств (DMARD) для замедления развития артропатии.
11. Применение по п.10 в производстве DMARD для замедления развития ревматоидного артрита.
12. Фармацевтическая композиция в единичной дозированной форме, содержащая до 500 мг соединения по п.1, или его фармацевтически приемлемую соль в сочетании с NSAD или DMARD, и физиологически приемлемый носитель, эксципиент или разбавитель.
Текст
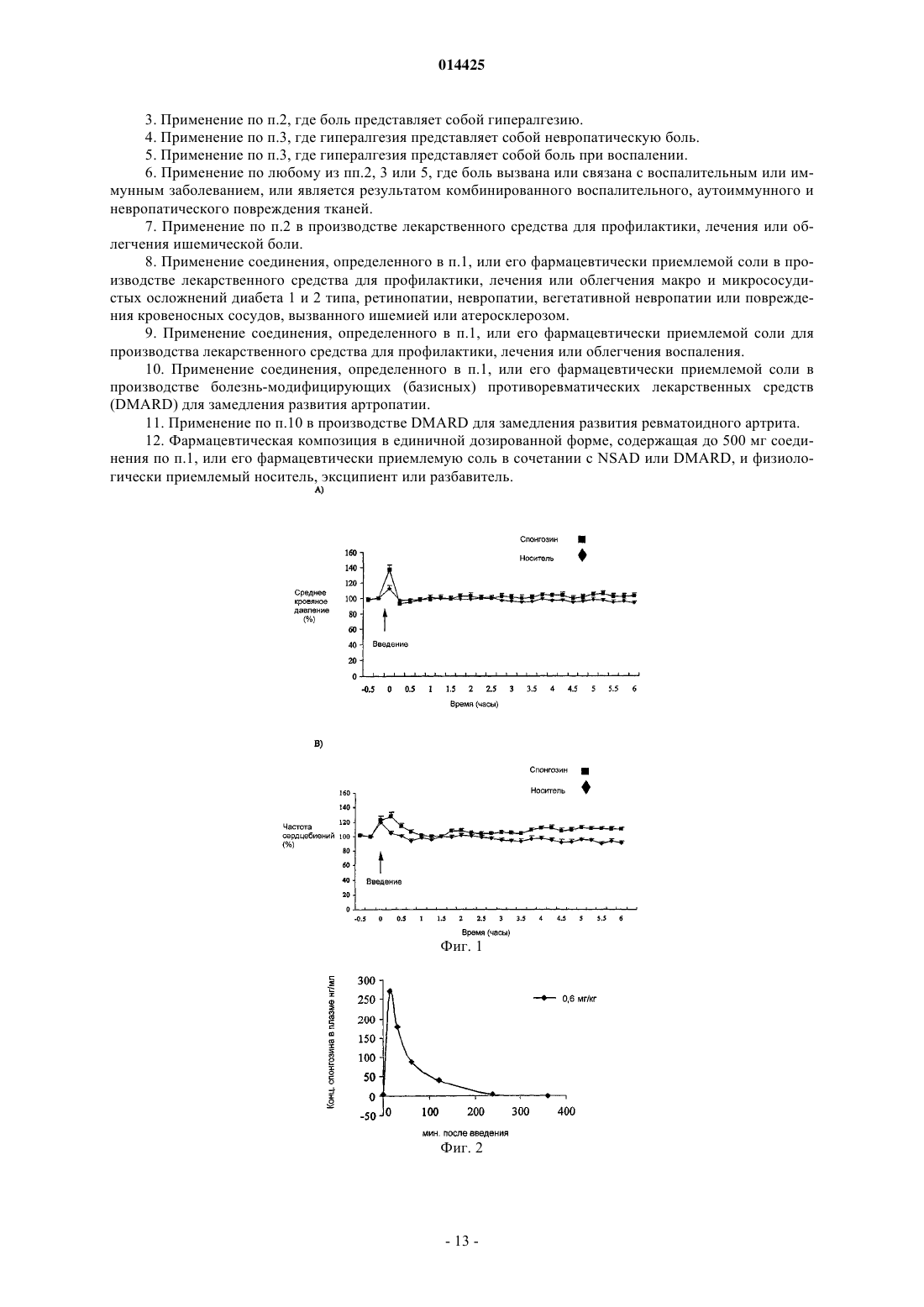
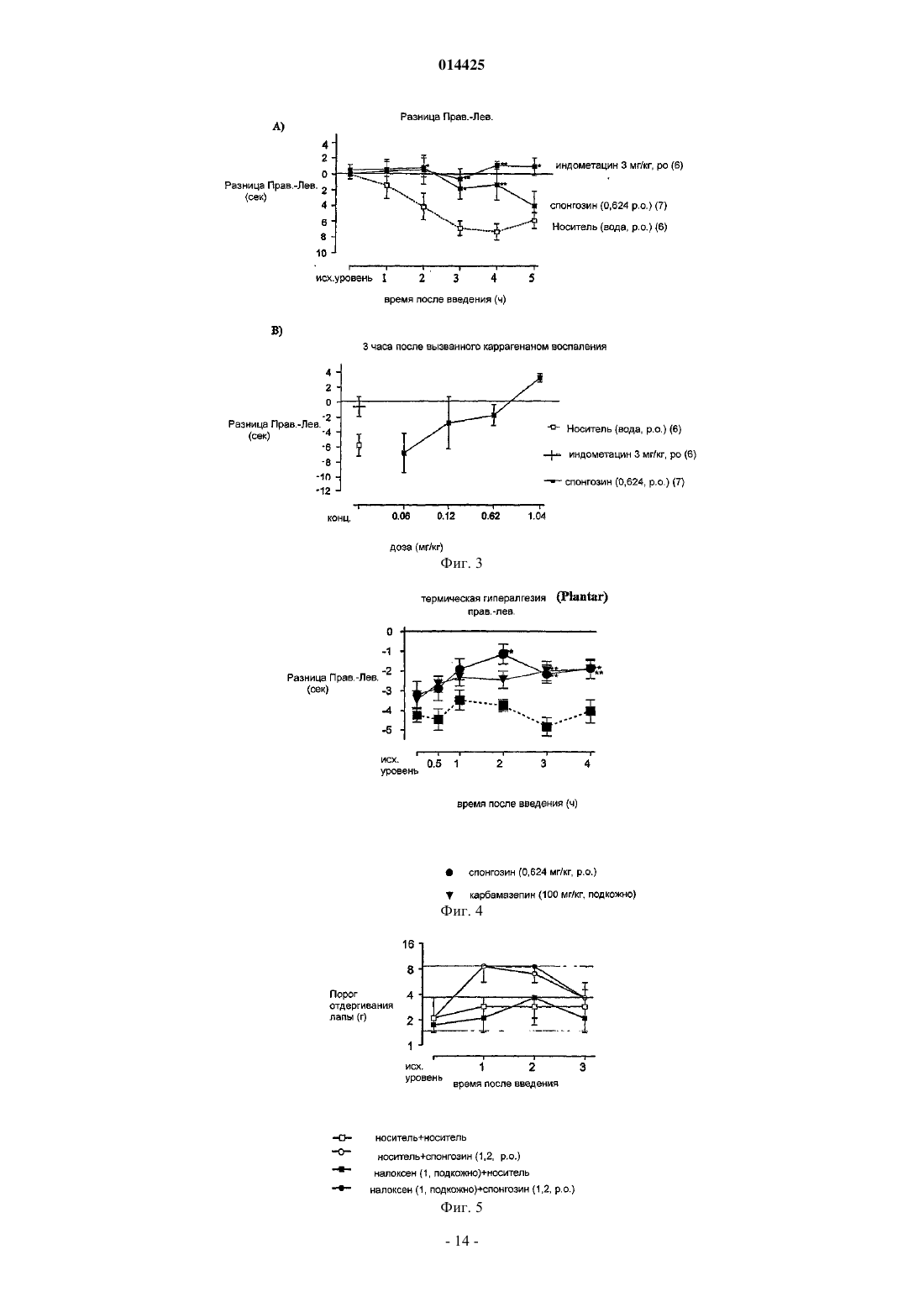
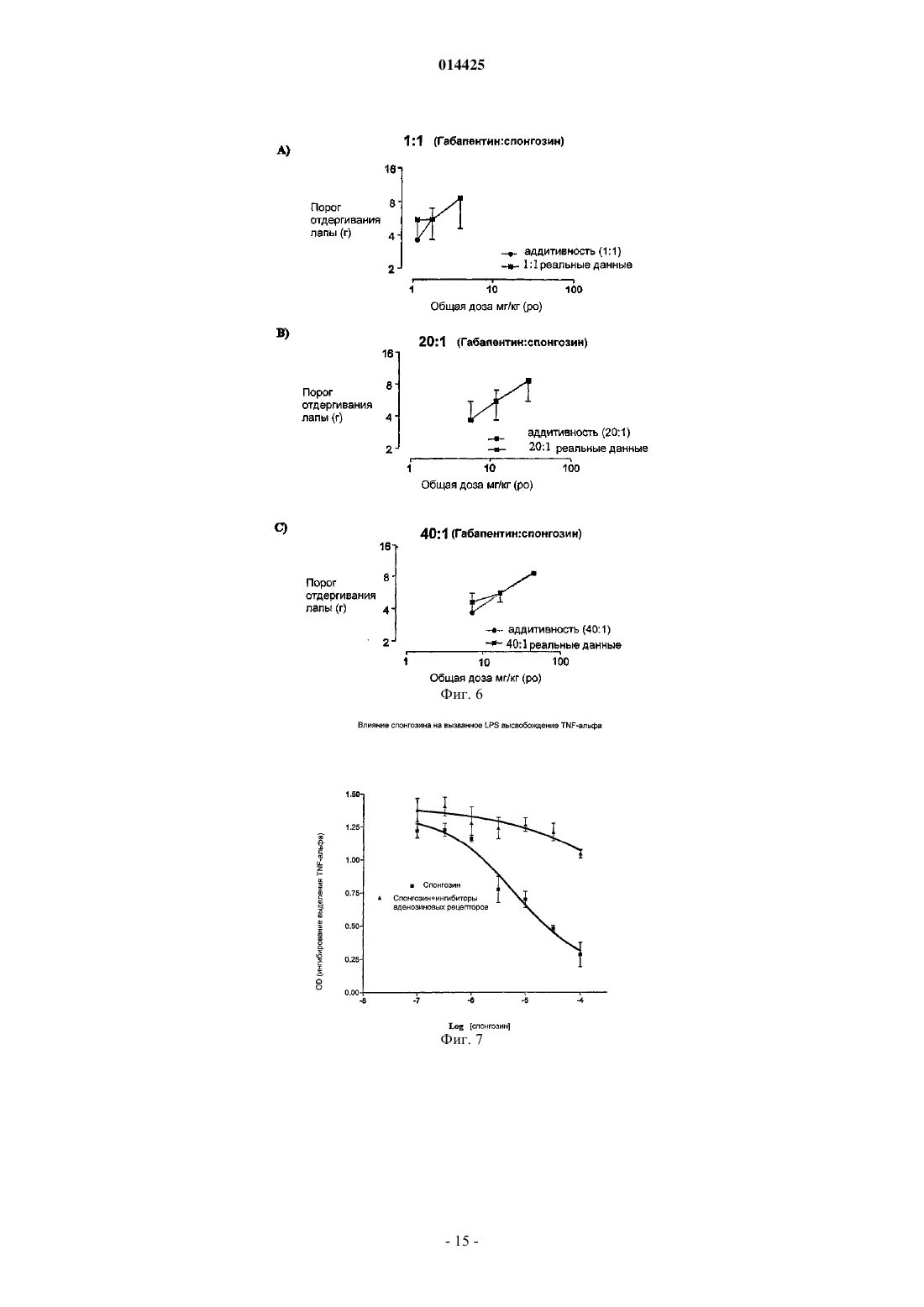
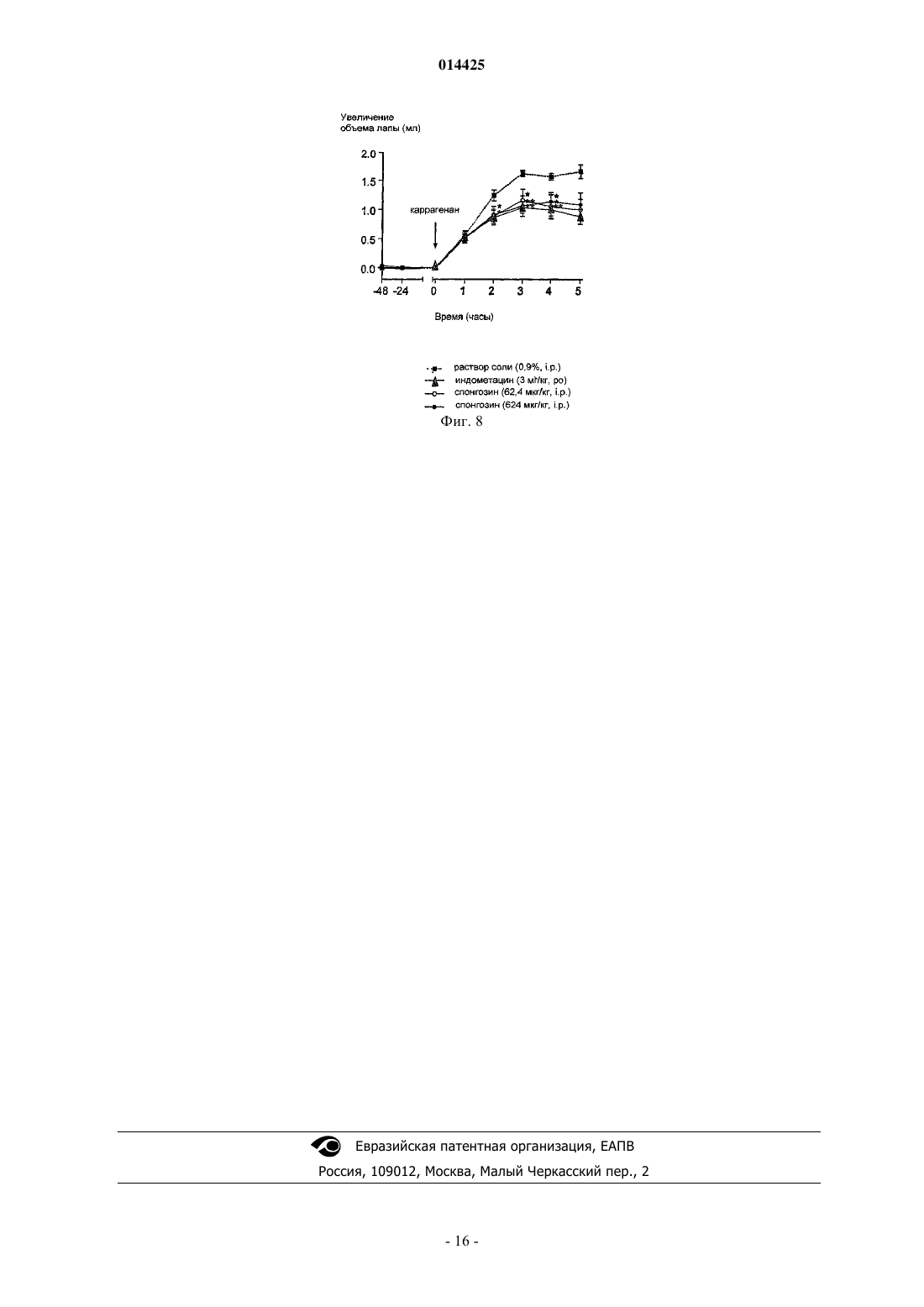
Описано применение соединений общей формулы (VII), где R представляет собой C1-4 алкокси иX представляет собой Н или ОН, или его фармацевтически приемлемой соли в производстве лекарственного средства для профилактики, лечения или облегчения патологического состояния,которое может быть улучшено или предотвращено агонизмом в отношении аденозиновых рецепторов А 2 Ав, в частности, для лечения боли или воспаления.(71)(73) Заявитель и патентовладелец: КЕМБРИДЖ БАЙОТЕКНОЛОДЖИ ЛИМИТЕД (GB) 014425 Настоящее изобретение относится к соединениям, которые являются агонистами аденозиновых рецепторов, и к их применению в качестве терапевтических соединений, в частности, в качестве анальгетиков и противовоспалительных соединений или в качестве болезнь-модифицирующих (базисных) противоревматических лекарственных средств (DMARD), помимо этого изобретение относится к способам профилактики, лечения или облегчения боли или воспаления с применением данных соединений. Аденозин представляет собой повсеместно распространенный локальный гормон/нейротрансмиттер, который действует на четыре известных рецептора, а именно рецепторы аденозина A1, A2A,А 2 В и A3. Аденозин, в основном, служит для сохранения баланса поступления и потребности энергии в тканях. Например, в сердце высвобождение аденозина замедляет сердцебиение за счет опосредованного рецептором А 1 действия в узлах и предсердиях (Belardinelli L.Isenberg, G. Am.J.Physiol. 224, H734H737), наряду с одновременным расширением коронарной артерии для увеличения поступления энергии(т.е. глюкозы, жира и кислорода) (Knabb et al., Circ.Res. (1983) 53, 33-41). Аналогично, в процессе воспаления аденозин служит для подавления воспалительной активности, тогда как в состояниях избыточной нервной активности (например, эпилепсии), аденозин подавляет нервное возбуждение (Klitgaard et al.,Eur J. Pharmacol. (1993) 242, 221-228). Эта система или ее разновидность присутствует во всех тканях. Сам по себе аденозин может применяться для диагностирования и лечения наджелудочковой тахикардии. Известно, что агонисты аденозинового рецептора А 1 действуют как мощные анальгетики(Sawynok, J. Eur J. Pharmacol. (1998) 347, 1-11), также известно, что агонисты аденозинового рецептора А 2 А обладают противовоспалительной активностью (см., например, US 5877180 и WO 99/34804). Было показано, что у подопытных животных агонисты рецептора А 2 А оказываются эффективными против широкого круга состояний, включая сепсис, артрит, а также ишемию/реперфузию, вызванную закупоркой почечной, коронарной или церебральной артерии. При данных состояниях общим фактором является уменьшение воспалительной реакции, вызванной ингибирующим действием этого рецептора на большинство, если не на все нервные клетки. Однако повсеместная распространенность аденозиновых рецепторов означает, что введение агонистов аденозиновых рецепторов вызывает неблагоприятные побочные эффекты. Это, в основном, препятствовало развитию способов лечения, основанных на аденозине. Селективные агонисты рецептора А 1 вызывают брадикардию. Агонисты рецептора А 2 А вызывают системную вазодилатацию с последующей гипотензией и тахикардией. Первый селективный агонист рецептора А 2 А (2-[4-(2-карбоксиэтил)фенилэтиламино]-5'-N-этилкарбоксамидоаденозин или CGS21680) был изучен в фазе 2 А клинического испытания в качестве потенциального противогипертензивного средства. Однако введение этого соединения вызывало значительное падение кровяного давления и последующее увеличение минутного объема сердца. Это помешало применению CGS21680 в качестве лекарственного средства. Webb и сотр.(J.Pharmacol Exp Ther (1991) 259, 1203-1212), Casati и сотр. (J. Pharmacol Exp Ther (1995) 275(2):914-919) и Bonnizone и сотр. (Hypertension. (1995) 25, 564-9) показывают, что селективные агонисты аденозинового рецептора А 2 А вызывают гипотензию и тахикардию. Степень вызванной тахикардии достаточна для того, чтобы воспрепятствовать их применению в качестве лекарственных средств. Alberti и сотр. (J. Cardiovasc Pharmacol. 1997 Sep; 30 (3):320-4) раскрывают, что селективные агонисты аденозинового рецептора А 2 А являются мощными сосудорасширяющими средствами, которые уменьшают давление крови и вызывают заметный прирост частоты сердцебиений, а также активности ренина в плазме. Эти побочные эффекты препятствуют их применению в качестве лекарственных средств.US 5877180 относится к агонистам аденозинового рецептора А 2 А, которые, как установлено, являются эффективными при лечении воспалительных заболеваний. Было выяснено, что предпочтительные агонисты, а именно WRC0090 и SHA 211 (WRC0474), являются более мощными и селективными, чем ранее описанные аналоги аденозина, такие как CGS21680 и CV1808. Введение SHA 211 или WRC0090,как полагают, уменьшает вероятность побочных эффектов, опосредованных связыванием аналогов с другими аденозиновыми рецепторами. Однако в изобретение включены только данные in vitro, относящиеся к активности SHA 211. Не показано, что какое-либо из описанных соединений могло бы быть терапевтически эффективно in vivo без появления серьезных побочных эффектов. Хотя побочные эффекты,опосредованные связыванием мощных и селективных агонистов аденозинового рецептора А 2 А с другими аденозиновыми рецепторами, как ожидается, будут уменьшены за счет применения таких агонистов,повсеместное распространение аденозиновых рецепторов означает, что можно было бы ожидать, что эти соединения активируют аденозиновые рецепторы А 2 А в нормальной ткани и, следовательно, вызовут серьезные побочные эффекты (как, например, гипотензию и рефлекторную тахикардию).US 3936439 раскрывает применение производных 2,6-диаминонебуларина в качестве средств для расширения коронарных сосудов и/или ингибирования агрегации тромбоцитов у млекопитающих. Приведены данные in vivo у собак для подтверждения коронарного сосудорасширяющего действия N2 фенил-2,6-диаминонебуларина,N2-циклогексил-2,6-диаминонебуларина,N2-(п-метоксифенил)-2,62 диаминонебуларина и N -этил-2,6-диаминонебуларина, кроме того данные in vitro подтверждают ингибирующее действие N2-фенил-2,6-диаминонебуларина, N2-циклогексил-2,6-диаминонебуларина, 2,6 диаминонебуларина и N2-этил-2,6-диаминонебуларина в отношении агрегации тромбоцитов. FR 2162128(Takeda Chemical Industries, LTD) раскрывает, что производные аденозина (включая производные 2-1 014425 алкоксиаденозина, содержащие низшую алкильную группу с не менее, чем двумя атомами углерода) обладают гипотензивной и коронарной сосудорасширяющей активностью. Данные in vivo у собак подтверждают коронарную сосудорасширяющую активность 2-н-пентилоксиаденозина, 2-(-гидроксиэтокси)аденозина и 2-феноксиаденозина. Однако в US 3 936 439 или FR 2162128 отсутствует подтверждение того, что какое-либо из описанных соединений могло бы применяться, не вызывая серьезных побочных эффектов. Статья Ribeiro и сотр. (Progress in Neurobiology 68 (2003) 377-392) является обзором аденозиновых рецепторов в нервной системе. В заключительных комментариях этой статьи указано (на стр. 387, правая колонка, строки 4-10 раздела 8), что "как уже давно замечено, активация аденозиновых рецепторов на периферии связана с гипотензией, брадикардией и гипотермией Эти побочные эффекты до сих пор значительно ограничивали клиническую применимость агонистов аденозиновых рецепторов". Следовательно, имеется необходимость разработки агонистов аденозинового рецептора, которые могут применяться с минимальными побочными эффектами. Некоторые аспекты настоящего изобретения относятся к лечению боли. Боль имеет два компонента, причем каждый включает активацию сенсорных нейронов. Первый компонент представляет собой первоначальную или немедленную фазу, когда сенсорный нейрон возбуждается, например, в результате действия тепла или давления на кожу. Второй компонент является следствием повышенной чувствительности сенсорных механизмов, передающих нервные импульсы в ткань, которая до того была повреждена. Этот второй компонент называют гипералгезией, и он вовлечен во все формы хронической боли, возникающей при повреждении тканей, но не в первоначальную или немедленную фазу ощущения боли. Таким образом, гипералгезия представляет собой состояние повышенного ощущения боли, вызванное повреждением ткани. Это состояние является естественной реакцией нервной системы, вероятно предназначенной для стимулирования защиты поврежденной ткани травмированного индивидуума, чтобы дать время на восстановление поврежденной ткани. Существует две основных известных причины такого состояния, а именно увеличение активности сенсорных нейронов и изменение в процессинге нейронами болевой информации, которое имеет место в спинном мозге. Гипералгезия может подрывать силы в состояниях хронического воспаления (например, при ревматоидном артрите) и в случаях, когда имеет место повреждение сенсорного нерва (т.е. невропатическая боль). Известно два основных класса анальгетиков: (i) нестероидные противовоспалительные лекарственные средства (NSAID) и родственные ингибиторы СОХ-2; и (ii) опиаты на основе морфина. Анальгетики обоих классов эффективны при регулировании обычной, немедленной или ноцицептивной боли. Однако они менее эффективны при некоторых типах гипералгезической боли, такой как невропатическая боль. Многие практикующие врачи неохотно назначают опиаты в больших дозах, требуемых для воздействия на невропатическую боль, из-за побочных эффектов, вызываемых введением этих соединений (таких как беспокойные состояния, тошнота и рвота), а также из-за возможности того, что пациент может попасть в зависимость от этих препаратов. NSAID обладают значительно менее сильным действием, чем опиаты,поэтому эти соединения требуются даже в больших дозах. Однако это нежелательно, так как эти соединения вызывают раздражение желудочно-кишечного тракта. Также существует необходимость в разработке анальгетиков, в частности антигипералгетиков, которые в достаточной степени способны регулировать болевые ощущения при невропатических и других гипералгезических синдромах и которые не обладают серьезными побочными эффектами или не вызывают зависимости у пациентов. Спонгозин был впервые выделен из тропической морской губки Cryptotethia crypta в 1945 (Bergmann and Feeney, J.Org.Chem. (1951) 16, 981, Ibid (1956) 21, 226), причем он стал первым метоксипурином, найденным в природе. Также он известен как 2-метоксиаденозин или 9 Н-пурин-6-амин, 9Dарабинофуранозил-2-метокси. Первое описание биологической активности спонгозина было дано Bartlett и сотр. (J.Med.Chem. (1981) 24, 947-954). Спонгозин (и другие соединения) были испытаны в отношении их действия в качестве релаксантов скелетных мышц, а также гипотермического, сердечно-сосудистого и противовоспалительного действия у грызунов после перорального введения (противовоспалительную активность оценивали по ингибированию вызванного каррагенаном отека лапы крысы). Спонгозин вызывал 25% ингибирование вызванного каррагенаном отека у крыс при дозировке 20 мг/кг перорально. Однако кроме этого при введении описываемого соединения в указанной дозе наблюдалось снижение среднего кровяного давления (41%) и частоты сердцебиений (25%). Было определено сродство спонгозина к аденозиновым рецепторам крыс А 1 и А 2 А. Полученные (у крыс) значения Kd составляли 340 нМ для рецептора А 1 и 1,4 мкМ для рецептора А 2 А, в то время как величина ЕС 50 для стимулирования рецептора крысы А 2 А, как было показано, составляет 3 мкМ (Daly et al., Pharmacol. (1993) 46, 91-100). У морских свинок эффективность спонгозина испытывали на препаратах изолированного сердца, и полученные значения ЕС 50 составляли 10 мкМ и 0,7 мкМ для аденозиновых рецепторов А 1 и А 2 А соответственно (Ueeda et al J Med Chem (1991) 34, 1334-1339). Из-за низкой эффективности этого соединения и его плохой селективности к рецепторам, его почти совершенно не принимали во внимание, отдавая предпочтение более эффективным и селективным к рецепторам агонистам аденозиновых рецепторов.-2 014425 Неожиданно было обнаружено, что спонгозин является эффективным анальгетиком при дозах уже в сто раз более низких, чем те, которые могли бы потребоваться с учетом известной аффинности этого соединения к аденозиновым рецепторам. При этих дозах спонгозин не вызывает значительных побочных эффектов, связанных с более высокими дозами этого соединения или других агонистов аденозиновых рецепторов. Таким образом, терапевтический эффект спонгозина может быть отделен от его побочных эффектов. Активность спонгозина в качестве анальгетика является предметом международной патентной заявкиPCT/GB03/05379, и активность соединений, родственных спонгозину, в качестве анальгетиков является предметом международной патентной заявкиPCT/GB 04/00935. Применение спонгозина и родственных соединений для лечения воспаления и других расстройств является предметом международной патентной заявкиPCT/GB 04/00952. Заявитель обнаружил, что спонгозин и родственные соединения, описанные в PCT/GB 04/00935 иPCT/GB 04/00952, обладают повышенной аффиностью к аденозиновым рецепторам при значениях рН ниже 7,4. Полагают, что это свойство объясняет неожиданную активность этих соединений при низких дозах. Заявитель смог идентифицировать некоторые другие соединения, которые также обладают повышенной аффинностью к аденозиновым рецепторам при пониженном рН. Ожидается, что эти соединения могут применяться в качестве лекарственных средств без появления серьезных побочных эффектов. В соответствии с настоящим изобретением разработано применение соединения формулы (VII) или его фармацевтически приемлемой соли в производстве лекарственного средства для профилактики, лечения или облегчения патологического состояния, которое может быть улучшено или предотвращено агонизмом в отношении аденозиновых рецепторов А 2 А, конкретно, в производстве лекарственного средства для профилактики, лечения или облегчения боли или воспаления: где R представляет собой C1-4 алкокси, и X представляет собой Н или ОН. Предпочтительно R представляет собой C1-4 алкокси и X представляет собой ОН, или фармацевтически приемлемые соли указанных соединений. Помимо этого в соответствии с настоящим изобретением разработан способ профилактики, лечения или облегчения боли, в частности, ишемической боли, который включает введение соединения формулы(VII) субъекту, нуждающемуся в такой профилактике, лечении или облегчении. Термин "ишемическая боль" использован в настоящей заявке для обозначения боли, связанной со снижением поступления крови в ту или иную часть тела. Пониженное поступление крови ограничивает поступление кислорода (гипоксия) и энергии в эту часть тела. Причиной ишемии является плохая перфузия крови в тканях, и поэтому ишемическая боль возникает при заболеваниях коронарных артерий, заболеваниях периферических артерий и состояниях, которые характеризуются недостаточным кровотоком,обычно в результате атеросклероза. Другие сосудистые расстройства также могут приводить к ишемической боли. Эти расстройства включают гипертрофию левого желудочка, заболевания коронарных артерий, первичную артериальную гипертензию, острый гипертензивный криз, кардиомиопатию, сердечную недостаточность, переносимость физической нагрузки, хроническую сердечную недостаточность, аритмию, сердечную дисритмию, синкопе, артериосклероз, умеренную хроническую сердечную недостаточность, стенокардию, стенокардию (в варианте) Принцметала, стабильную стенокардию и стенокардию,вызванную физической нагрузкой, реокклюзию при сердечном шунтировании, перемежающуюся хромоту (облитерирующий артериосклероз), артериит, диастолическую дисфункцию и систолическую дисфункцию, атеросклероз, повреждение после ишемии/реперфузии, диабет (как типа I, так и типа II), различные виды тромбоэмболии. Кровотечения также могут приводить к ишемической боли. Кроме этого,плохая перфузия может приводить к невропатической и воспалительной боли, которая возникает из-за вызванного гипоксией повреждения нервных клеток (например, при остановке сердца или операции шунтирования, диабете или неонатальном дистрессе). Соединения формулы (VII), как считают, являются эффективными в профилактике, лечении или облегчении ишемической боли, даже при введении в дозах, которые, как ожидается, дают концентрации веществ в плазме значительно ниже той, которая по известным данным активирует аденозиновые рецепторы. Полагают, что в указанных дозах данные соединения не вызывают заметных побочных эффектов,связанных с введением более высоких доз спонгозина или других агонистов аденозиновых рецепторов. Далее в рамках настоящего изобретения разработано применение соединений по настоящему изобретению формулы (VII) с целью производства лекарственных средств для профилактики, лечения или-3 014425 облегчения воспаления. Кроме этого в соответствии с настоящим изобретением разработан способ профилактики, лечения или облегчения воспаления, который включает введение соединения по настоящему изобретению субъекту, нуждающемуся в такой профилактике, лечении или облегчении. В частности, как считают, соединения по настоящему изобретению формулы (VII) могут применяться для профилактики, лечения или облегчения воспаления, вызванного или связанного с раком (таким как различные разновидности лейкемии, лимфомы, карциномы, раком толстой кишки, раком молочной железы, раком легких, раком поджелудочной железы, гепатоцеллюлярной карциномой, раком почек,меланомой, метастазами в печени, легких, молочной железе и простате и т.д.); аутоиммунными заболеваниями (такими как отторжение трансплантированных органов, красная волчанка, реакция "трансплантат против хозяина", отторжение аллотрансплантатов, рассеянный склероз, ревматоидный артрит, сахарный диабет I типа, включающий разрушение панкреатических островков, ведущее к диабету и воспалительным последствиям диабета); аутоиммунными повреждениями (включая рассеянный склероз, синдром Гийена-Барре, тяжелую миастению); ожирением; сердечно-сосудистыми состояниями, связанными с плохой перфузией тканей и воспалением (как, например, атеромами, атеросклерозом, ударом, повреждением при ишемической реперфузии, перемежающейся хромотой, повреждением спинного мозга, застойной сердечной недостаточностью, васкулитом, геморрагическим шоком, спазмом сосудов, следующим за субарахноидальным кровотечением, спазмом сосудов, следующим за нарушением мозгового кровообращения, плевритом, перикардитом, сердечно-сосудистыми осложнениями диабета); ишемически-реперфузионным повреждением, ишемией и связанным воспалением, рестенозом, следующим за ангиопластикой и воспалительными аневризмами; эпилепсией, дегенерацией нервов (включая болезнь Альцгеймера), усталостью или спазмом мышц (в частности, спазмом у спортсменов), артритом (таким как ревматоидный артрит, остеоартрит, ревматоидный спондилит, подагрический артрит), фиброзом (например, легких, кожи и печени), рассеянным склерозом, сепсисом, септическим шоком, энцефалитом,инфекционным артритом, реакцией Джариша-Герксгеймера, опоясывающим лишаем, токсическим шоком, церебральной малярией, болезнью Лима, эндотоксическим шоком, грамотрицательным шоком, геморрагическим шоком, гепатитом (возникающим как от повреждения ткани, так и от вирусной инфекции), глубоким тромбозом вен, подагрой; состояниями, связанными с затруднениями дыхания (например, хронической обструктивной болезнью легких, заложенными дыхательными путями, бронхоконстрикцией, легочной вазоконстрикцией, затрудненным дыханием, хроническим воспалительным заболеванием легких, силикозом, разрастанием мягких тканей в легких, кистозным фиброзом, легочной гипертонией, легочной вазоконстрикцией, эмфиземой, бронхиальной аллергией и/или воспалением, астмой, аллергией верхних дыхательных путей, ринитом, весенним конъюктивитом и синдромом нарушения дыхания у взрослых); состояниями, связанными с воспалениями кожи (включая псориаз, экзему, язвы, контактный дерматит); состояниями, связанными с воспалением кишечника (включая болезнь Крона, язвенный колит и изжогу, синдром раздраженного кишечника, воспалительное заболевание кишечника); ВИЧ(в частности, ВИЧ-инфекция), церебральной малярией, бактериальным менингитом, усиленной TNF репликацией ВИЧ, ингибированием активности AZT и DDI под действием TNF, остеопорозом и другими заболеваниями, связанными с резорбцией костей, остеоартритом, ревматоидным артритом, бесплодием при эндометриозе, лихорадкой и миалгией вследствие инфекции, кахексией, вызванной раком, кахексией, вызванной инфекцией или злокачественной опухолью, кахексией, вызванной синдромом приобретенного иммунодефицита (СПИД), СПИД-ассоциированным комплексом (ARC), образованием келоида,образованием рубцовой ткани, неблагоприятными результатами лечения амфотерицином В, неблагоприятными результатами лечения интерлейкином-2, неблагоприятными результатами лечения ОКТЗ или неблагоприятными результатами лечения GM-CSF, а также другими состояниями, опосредованными избыточной активностью противовоспалительных клеток (включая нейтрофилы, эозинофилы, макрофаги и Т-клетки). Незначительное хроническое воспаление, как известно, связано с ожирением (при наличии или в отсутствии резистентности к инсулину и диабета типа II) (Browning et al (2004) Metabolism 53, 899-903,увеличенное количество маркеров воспаления в крови женщины с ожирением; Mangge et al (2 004) ExpClin Endocrinol Diabetes 112, 378-382, подростковое ожирение коррелирует с С-реактивным белком маркером воспаления в сыворотке; Maachi et al Int J Obes Relat Metab Disord. 2004 28, 993-997, системное незначительное воспаление у тучных людей). Возможная причина этого заключается в том, что жировые клетки секретируют TNF-альфа и интерлейкины 1 и 6, которые являются провоспалительными. Соединения по настоящему изобретению, которые относятся к селективным агонистам аденозиновых рецепторов А 2 А и/или A3, являются особенно предпочтительными благодаря тому, что такие соединения, как полагают, будут обладать сильной противовоспалительной активностью. Под селективными агонистами аденозиновых рецепторов А 2 А и/или A3 подразумеваются агонисты, которые активируют аденозиновые А 2 А и/или A3 рецепторы при более низких концентрациях (предпочтительно от одной тысячной до одной пятой), чем необходимы для активации аденозиновых рецепторов А 1. Кроме того,рецепторы А 1 обладают провоспалительной активностью, поэтому такие эффекты, как ожидается, будут сведены к минимуму для соединений, которые обладают селективностью в отношении рецепторов А 2 А-4 014425 и/или A3. Следует принять во внимание, что любое патологическое состояние, которое может быть предотвращено или улучшено за счет действия агонистов аденозиновых рецепторов А 2 А и/или A3, может быть предотвращено, излечено или облегчено соединениями формулы (VII). В рамках настоящего изобретения разработано применение соединений формулы (VII) в производстве лекарственного средства для профилактики, лечения или улучшения патологического состояния,которое может быть улучшено или предотвращено агонизмом в отношении аденозиновых рецепторов А 2 А и/или A3. Кроме этого в настоящем изобретении разработан способ профилактики, лечения или улучшения патологического состояния, которое может быть улучшено или предотвращено агонизмом в отношении аденозиновых рецепторов А 2 А и/или A3, включающий введение соединений формулы (VII) субъекту,нуждающемуся в такой профилактике, лечении или улучшении. Специалист в данной области техники может легко проверить, действует или нет патологическое состояние, которое предотвращают, лечат или улучшают соединениями формулы(VII), через аденозиновые рецепторы А 2 А и/или A3. Например, это можно сделать сравнением воздействия соединения в животной модели с патологическим состоянием в присутствии и отсутствии селективного антагониста аденозиновых рецепторов А 2 А и/или A3. Если воздействие соединения в присутствии антагониста снижено или отсутствует по сравнению с воздействием соединения в отсутствии антагониста, делается вывод, что соединение оказывает свое воздействие через аденозиновый рецептор А 2 А и/или A3. Антагонисты аденозиновых рецепторов А 2 А и/или A3 известны специалисту в данной области техники (см., например,Ongini et al., Farmaco. 2001 Jan-Feb; 56 (l-2):87-90; Muller, Curr Top Med Chem. 2003; 3(4):445-62). С другой стороны, можно использовать аденозиновый рецептор А 2 А-нокаутированную мышь (OhtaA and Sitkovsky M, Nature 2001; 414:916-20). Например, воздействие соединения на мышь, у которой имеются симптомы патологического состояния, сравнивают с воздействием на аденозин А 2 Анокаутированную мышь, у которой имеются соответствующие симптомы. Если соединение воздействует только на мышь, которая обладает аденозиновыми А 2 А рецепторами, делают вывод, что соединение оказывает свое воздействие через аденозиновые рецепторы А 2 А. Предполагается, что соединения по настоящему изобретению, формулы (VII) являются значительно более эффективными при низких дозах, чем другие агонисты аденозиновых рецепторов. Так ожидается,что соединения по настоящему изобретению могут эффективно оказывать помощь в дозах, при которых имеется пониженная вероятность и тяжесть побочных эффектов или при которых побочные эффекты не наблюдаются. Такие соединения предоставляют большие преимущества над значительным большинством других агонистов аденозиновых рецепторов, которые обладают противовоспалительным действием лишь в тех же концентрациях, при которых наблюдаются серьезные побочные эффекты. С другой стороны или в дополнение к сказанному, соединения по настоящему изобретению имеют пониженную вероятность и тяжесть побочных эффектов по сравнению с другими агонистами аденозиновых рецепторов. Кроме этого считают, что соединения по настоящему изобретению формулы (VII) могут быть эффективными в качестве базисных противоревматических лекарственных средств (DMARD), в частности для применения в профилактике, лечении или облегчении ревматоидного артрита и, возможно, других заболеваний суставов, таких как остеоартрит. Лекарственные препараты, применяемые для лечения ревматоидного артрита (RA), могут быть разделены на две группы: препараты, которые помогают облегчить симптомы RA; и препараты, которые помогают изменить течение болезни. Препараты, содействующие облегчению симптомов RA, включают нестероидные противовоспалительные лекарственные средства (NSAID), которые облегчают боль и уменьшают воспаление в пораженных суставах, анальгетики (такие как ацетаминофен и наркотические болеутоляющие средства), которые облегчают боль, но не замедляют развитие поражения сустава или не уменьшают воспаление, а также кортикостероиды, которые являются противовоспалительными лекарственными средствами.DMARD помогают облегчить симптомы RA (такие как опухание и болезненность суставов), но кроме этого замедляют развитие повреждения суставов, вызванное RA. Таким образом, хотя не существует средства для лечения RA, DMARD помогают замедлить развитие RA. В прошлом DMARD обычно применялись для лечения RA, после неудовлетворительного результата лечения NSAID. Однако в настоящее время в курсе лечения RA DMARD начинают использовать раньше, т.к. исследования показали,что раннее применение DMARD приносит существенную пользу. DMARD и NSAID часто применяют в сочетании друг с другом. Результаты клинических исследований показали, что известные DMARD замедляют развитие RA. После 6 месяцев лечения скорость разрушения кости и хряща в суставах пациентов уже начала замедляться. Через 1 год у пациентов наблюдалась очень слабое развитие повреждения сустава, и через 2 года рентгеновское исследование показало, что лишь незначительное число пациентов, принявших участие в исследовании, имели новые повреждения суставов в течение второго года лечения. Примеры известных DMARD включают сульфасалазин, пеницилламин, хлорохин, гидроксихлорохин, золото (с помощью внутримышечной инъекции или перорально в виде ауранофина), метотрексат,-5 014425 циклоспорин, азатиоприн, циклофосфамид, лефлуномид. Позднее были разработаны биологическиеDMARD, которые ингибируют фактор некроза опухолей альфа (TNF-альфа). Одним из примеров является Humira, которая показана для уменьшения признаков и симптомов и для замедления развития структурных повреждений у взрослых с RA от умеренного до весьма активного, которые обладают недостаточной реакцией на один или несколько DMARD. Humira представляет собой антитело противTNF-альфа. Многие из известных DMARD вызывают серьезные побочные эффекты. Следовательно, желательно разработать новые DMARD, которые могут применяться с минимальными побочными эффектами. Приведенный ниже по тексту пример 13 демонстрирует способность спонгозина уменьшать вызванное форболовым эфиром высвобождение TNF альфа в человеческих макрофагах U937. На этом основании предполагается, что спонгозин и родственные соединения формулы (VII) также обладают активностью DMARD. В настоящем изобретении разработано применение соединений формулы (VII) в производстве лекарственного средства для замедления развития артропатии. Кроме этого, в рамках настоящего изобретения разработан способ замедления развития артропатии,который включает введение соединений формулы (VII) субъекту, нуждающемуся в этом. Предпочтительно замедляется развитие RA и, в частности, повреждение сустава, вызванное RA. Соединение по настоящему изобретению может вводиться субъекту на любой стадии курса леченияRA. Соединение по настоящему изобретению могут вводиться в сочетании с одним или несколькимиNSAID или другими DMARD. Предполагается, что соединения по настоящему изобретению являются эффективными в качествеDMARD даже при введении в дозах, которые, как ожидается, дают концентрацию в плазме существенно ниже той, которая, как известно, активирует аденозиновые рецепторы. Считают, что при этих дозах соединения не вызывают заметных побочных эффектов, связанных с применением более высоких доз спонгозина или других агонистов аденозиновых рецепторов. Отдельное преимущество применения соединений по настоящему изобретению в качествеDMARD, как полагают, заключается в том, что они действуют при пероральном приеме, в отличие от антител против TNF-альфа, которые следует вводить с помощью инъекции. Кроме этого был принят во внимание тот факт, что соединения формулы (VII) могут быть эффективны при профилактике, лечении или облегчении макро- и микрососудистых осложнений диабета 1 и 2 типов (включая ретинопатию, невропатию, вегетативную невропатию) или повреждения кровеносных сосудов, вызванного ишемией (либо диабетической либо иной) или атеросклерозом (либо диабетическим либо иным). В соответствии с настоящим изобретением разработано применение соединений формулы (VII) в производстве лекарственного средства для профилактики, лечения или облегчения макро- или микрососудистых осложнений диабета 1 или 2 типа, ретинопатии, невропатии, вегетативной невропатии или повреждения кровеносных сосудов, вызванного ишемией или атеросклерозом. Кроме того, в настоящем изобретении разработан способ профилактики, лечения или облегчения макро- или микрососудистых осложнений диабета 1 или 2 типа, ретинопатии, невропатии, вегетативной невропатии или повреждения кровеносных сосудов, вызванного ишемией или атеросклерозом, у субъекта, нуждающегося в такой профилактике, лечении или облегчении, причем способ включает введение субъекту соединений формулы (VII). Предпочтительными соединениями формулы (VII) являются 2-метоксиаденозин (т.е. спонгозин), 2 этоксиаденозин и 2-бутилоксиаденозин. Полагают, что соединения формулы (VII) являются эффективными в профилактике, лечении или облегчении макро- и микрососудистых осложнений диабета 1 и 2 типа, включая ретинопатию, невропатию, вегетативную невропатию, а также повреждения кровеносных сосудов, вызванного ишемией или атеросклерозом (либо диабетическим либо иным), даже при введении в дозе, которая, как ожидается,дает концентрации в плазме значительно меньше тех, о которых известно, что они активируют аденозиновые рецепторы. Вероятно, что при этих дозах соединения не вызывают значительных побочных эффектов, связанных с введением более высоких доз спонгозина или других агонистов аденозиновых рецепторов. Также считают, что соединения формулы (VII) являются эффективными в содействии лечению ран. В рамках настоящего изобретения разработано применение соединений формулы (VII) в производстве лекарственного средства для содействия лечению ран. Также в рамках настоящего изобретения разработан способ содействия лечению ран у субъекта, который включает введение субъекту соединений формулы (VII). Количество вводимых субъекту соединений формулы (VII) предпочтительно представляет собой такое количество, которое вызывает увеличение максимальной концентрации в плазме, меньшее, чем значение ЕС 50 данного соединения для аденозиновых рецепторов (предпочтительно при рН 7,4). Следует принять во внимание, что значение ЕС 50 соединения, по-видимому, является различным-6 014425 для различных аденозиновых рецепторов (т.е. аденозиновых рецепторов A1, А 2 А, А 2 В, A3). Количество соединения, которое следует применять, должно быть рассчитано, исходя из самого низкого значения ЕС 50 данного соединения для различных рецепторов. Таким образом, предпочтительно количество соединения по настоящему изобретению, которое вводят субъекту, должно быть таким количеством, которое дает прирост максимальной концентрации в плазме, меньший чем самое низкое из значений ЕС 50 соединения для аденозиновых рецепторов. Предпочтительно максимальная концентрация соединения в плазме составляет от одной десятитысячной до одной второй (или от одной десятитысячной до одной пятой, или от одной десятитысячной до одной двадцатой, или от одной десятитысячной до одной сотой, или от одной десятитысячной до одной тысячной, или от одной тысячной до одной второй, или от одной тысячной до одной пятой, или от одной тысячной до одной двадцатой, или от одной пятидесятой до одной десятой, или от одной сотой до одной второй, или от одной сотой до одной пятой, или от одной пятидесятой до одной третьей, или от одной пятидесятой до одной второй, или от одной пятидесятой до одной пятой, или от одной десятой до одной второй, или от одной десятой до одной пятой) от наиболее низкого значения EC 50. Предпочтительно количество вводимого соединения по настоящему изобретению дает прирост концентрации в плазме, который сохраняется в течение свыше одного часа от одной десятитысячной до одной второй (или от одной десятитысячной до одной пятой, или от одной десятитысячной до одной двадцатой, или от одной десятитысячной до одной сотой, или от одной десятитысячной до одной тысячной, или от одной тысячной до одной второй, или от одной тысячной до одной пятой, или от одной тысячной до одной двадцатой, или от одной пятидесятой до одной десятой, или от одной сотой до одной второй, или от одной сотой до одной пятой, или от одной пятидесятой до одной второй, или от одной пятидесятой до одной пятой, или от одной десятой до одной второй, или от одной десятой до одной пятой) от самого низкого значения ЕС 50 соединения для аденозиновых рецепторов. Предпочтительно вводимое количество дает прирост концентрации в плазме, который сохраняется свыше одного часа, от одной тысячной до одной второй, или от одной тысячной до одной пятой, или от одной тысячной до одной двадцатой, или от одной сотой до одной второй, или от одной сотой до одной пятой, или от одной пятидесятой до одной второй, или от одной пятидесятой до одной пятой от значения ЕС 50 соединения для аденозиновых рецепторов при рН 7,4. Во избежание сомнений величина ЕС 50 соединения в рамках настоящей заявки определена как концентрация соединения, которая вызывает отклик рецептора, равный средней величине между исходным откликом рецептора и максимальным откликом рецептора (что определяют, например, используя кривую доза-отклик). Величину ЕС 50 следует определять в стандартных условиях (уравновешенные солевые растворы,забуференные при рН 7,4). При использовании для определения ЕС 50 изолированных мембран, клеток и тканей, их следует буферировать солевым раствором при рН 7,4 (например, культуральной клеточной среды), как, например у Daly и сотр., (Pharmacol. (1993) 46, 91-100), или, предпочтительно, как у Tilburg и сотр., (J.Med.Chem. (2002) 45, 91-100). Значение ЕС 50 также можно было бы определять in vivo измерением откликов, опосредованных аденозиновыми рецепторами у нормальных здоровых животных или даже в ткани, в которую подаются питательные вещества при нормальных условиях (т.е. кровь, насыщенная кислородом, или изотоническая среда, насыщенная кислородом, также буферированные при рН 7,4) в нормальном здоровом животном. С другой стороны, количество вводимого соединения по настоящему изобретению может являться таким количеством, которое приводит к максимальной концентрации в плазме, меньшей чем самое низкое или самое высокое значение Kd соединения для аденозиновых рецепторов (т.е. меньше, чем самое низкое или самое высокое значение Kd соединения для аденозиновых рецепторов A1, А 2 А, А 2 В и A3). Предпочтительно максимальная концентрация соединения в плазме составляет от одной десятитысячной до одной второй (или от одной десятитысячной до одной пятой, или от одной десятитысячной до одной двадцатой, или от одной десятитысячной до одной сотой, или от одной десятитысячной до одной тысячной, или от одной тысячной до одной второй, или от одной тысячной до одной третьей, или от одной тысячной до одной пятой, или от одной тысячной до одной двадцатой, или от одной пятидесятой до одной десятой, или от одной сотой до одной второй, или от одной сотой до одной пятой, или от одной пятидесятой до одной второй, или от одной пятидесятой до одной пятой, или от одной десятой до одной второй, или от одной десятой до одной пятой) от самого низкого или самого высокого значения Kd. Предпочтительно количество вводимого соединения является таким количеством, которое приводит к концентрации в плазме, не менее одного часа сохраняющейся в пределах от одной тысячной до одной второй, или от одной тысячной до одной пятой, более предпочтительно, от одной тысячной до одной двадцатой, или от одной сотой до одной второй, или от одной сотой до одной пятой, или от одной пятидесятой до одной второй, или от одной пятидесятой до одной пятой от значения Kd соединения для аденозиновых рецепторов. Предпочтительно количество вводимого соединения является таким количеством, которое приводит к концентрации в плазме, сохраняющейся в течение более одного часа, в пределах от одной десятитысячной до одной второй (или от одной десятитысячной до одной пятой, или от одной десятитысячной-7 014425 до одной двадцатой, или от одной десятитысячной до одной сотой, или от одной десятитысячной до одной тысячной, или от одной тысячной до одной второй, или от одной тысячной до одной пятой, или от одной тысячной до одной двадцатой, или от одной пятидесятой до одной десятой, или от одной сотой до одной второй, или от одной сотой до одной пятой, или от одной пятидесятой до одной второй, или от одной пятидесятой до одной пятой, или от одной пятидесятой до одной трети, или от одной десятой до одной второй, или от одной десятой до одной пятой) от наиболее высокого или низкого значения Kd соединения для аденозиновых рецепторов. Значение Kd соединения для каждого рецептора должно быть определено в стандартных условиях с применением плазменных мембран в качестве источника аденозиновых рецепторов, полученных либо из тканей, либо из клеток, эндогенно экспрессирующих эти рецепторы, или из клеток, трансфицированных векторами ДНК, которые кодируют гены аденозиновых рецепторов. С другой стороны, могут применяться препараты целых клеток, в которых используются клетки, экспрессирующие аденозиновые рецепторы. Меченные лиганды (например, радиоактивно меченные), селективные для различных рецепторов,следует использовать в буферированных (рН 7,4) солевых растворах (см., например, Tilburg et al,J.Med.Chem. (2002), 45, 420-429) для определения аффинности к связыванию и, следовательно, Kd соединения для каждого рецептора. С другой стороны, количество вводимого соединения по настоящему изобретению, может являться таким количеством, которое составляет от одной десятитысячной до одной второй (или от одной десятитысячной до одной пятой, или от одной десятитысячной до одной двадцатой, или от одной десятитысячной до одной сотой, или от одной десятитысячной до одной тысячной или от одной тысячной до одной второй, или от одной тысячной до одной пятой, или от одной тысячной до одной двадцатой, или от одной пятидесятой до одной десятой, или от одной сотой до одной второй, или от одной сотой до одной пятой, или от одной пятидесятой до одной второй, или от одной пятидесятой до одной трети, или от одной пятидесятой до одной пятой, или от одной десятой до одной второй, или от одной десятой до одной пятой) от минимального количества (или дозы) соединения, которая приводит к появлению побочных эффектов в виде брадикардии, гипотензии или тахикардии у животных тех же видов, как и субъект, которому будут вводить соединение. Предпочтительно, введенное количество дает повышение концентрации в плазме, которое более одного часа сохраняется в пределах от одной десятитысячной до одной второй (или от одной десятитысячной до одной пятой, или от одной десятитысячной до одной двадцатой,или от одной десятитысячной до одной сотой, или от одной десятитысячной до одной тысячной или от одной тысячной до одной второй, или от одной тысячной до одной пятой, или от одной тысячной до одной двадцатой, или от одной пятидесятой до одной десятой, или от одной сотой до одной второй, или от одной сотой до одной пятой, или от одной пятидесятой до одной второй, или от одной пятидесятой до одной пятой, или от одной десятой до одной второй, или от одной десятой до одной пятой) от минимального количества соединения, которое вызывает развитие побочных эффектов. Предпочтительно введенное количество дает повышение концентрации в плазме, которое сохраняется более одного часа в пределах от одной тысячной до одной второй, или от одной тысячной до одной двадцатой, или от одной сотой или одной пятидесятой и одной второй, или одной сотой или одной пятидесятой и одной пятой от минимальной дозы, которая дает прирост побочных эффектов. С другой стороны, количество вводимого соединения по настоящему изобретению может являться таким количеством, которое дает прирост концентрации в плазме, составляющий от одной десятитысячной до одной второй (или от одной десятитысячной до одной пятой, или от одной десятитысячной до одной двадцатой, или от одной десятитысячной до одной сотой, или от одной десятитысячной до одной тысячной или от одной тысячной до одной второй, или от одной тысячной до одной пятой, или от одной тысячной до одной двадцатой, или от одной пятидесятой до одной десятой, или от одной сотой до одной второй, или от одной сотой до одной пятой, или от одной пятидесятой до одной второй, или от одной пятидесятой до одной трети, или от одной пятидесятой до одной пятой, или от одной десятой до одной второй, или от одной десятой до одной пятой) от минимальной концентрации соединения в плазме, которая вызывает такие побочные эффекты, как брадикардия, гипотензия или тахикардия, у животных тех же видов, что и субъект, которому будут вводить соединение. Предпочтительно, вводимое количество дает прирост концентрации в плазме, который сохраняется в течение более часа, составляющий от одной десятитысячной до одной второй (или от одной десятитысячной до одной пятой, или от одной десятитысячной до одной двадцатой, или от одной десятитысячной до одной сотой, или от одной десятитысячной до одной тысячной или от одной тысячной до одной второй, или от одной тысячной до одной пятой, или от одной тысячной до одной двадцатой, или от одной пятидесятой до одной десятой, или от одной сотой до одной второй, или от одной сотой до одной пятой, или от одной пятидесятой до одной второй, или от одной пятидесятой до одной пятой, или от одной десятой до одной второй, или от одной десятой до одной пятой) от минимальной концентрации соединения в плазме, которая вызывает побочные эффекты. Предпочтительно введенное соединение дает прирост концентрации в плазме, который сохраняется более часа, в пределах от одной тысячной до одной второй, или от одной тысячной до одной двадцатой,или от одной сотой или одной пятидесятой до одной второй, или от одной сотой или одной пятидесятой до одной пятой от минимальной концентрации в плазме, которая вызывает побочные эффекты.-8 014425 Подходящая дозировка соединения по настоящему изобретению будет меняться с возрастом, полом, массой и состоянием подвергаемого лечению субъекта, эффективностью соединения (как, например, его значением ЕС 50 для аденозинового рецептора), временем его полужизни, его абсорбцией телом и путем введения и т.д. Однако подходящая дозировка легко может быть определена специалистом в данной области техники. Удобным путем определения подходящей дозировки является оценка сердечно-сосудистых изменений (например, с помощью ЭКГ и наблюдения за кровяным давлением) при или вблизи от значения ЕС 50 соединения для аденозинового рецептора (предпочтительно, рецептора, к которому оно имеет наибольшую аффинность) для определения максимальной переносимой дозы. После этого, ожидается, что терапевтически эффективная доза составляет от одной десятитысячной до одной второй (или от одной десятитысячной до одной пятой, или от одной десятитысячной до одной двадцатой, или от одной десятитысячной до одной сотой, или от одной десятитысячной до одной тысячной, или от одной тысячной до одной второй, или от одной тысячной до одной пятой, или от одной тысячной до одной двадцатой, или от одной пятидесятой до одной десятой, или от одной сотой до одной второй, или от одной сотой до одной пятой, или от одной пятидесятой до одной второй, или от одной пятидесятой до одной трети, или от одной пятидесятой до одной пятой, или от одной десятой до одной второй, или от одной десятой до одной пятой) от максимальной переносимой дозы. Пример 31 ниже показывает, что для спонгозина доза у людей должна быть менее 28 мг. Эта доза дает увеличение концентраций в плазме от 0,5 до 0,9 мкМ (близкое к Kd для аденозиновых рецепторов А 2 А при рН 7,4 см. ниже). На основе этого результата предпочтительный диапазон дозировок для спонгозина составляет от 0,03 до 0,3 мг/кг. Минимальная концентрация спонгозина в плазме, дающая максимальное обезболивание у вспомогательной крысиной модели артрита, составляла 0,06 мкМ, т.е. значительно меньше, чем величина ЕС 50 спонгозина для аденозинового рецептора А 2 А, которая составляет приблизительно 1 мкМ. Предпочтительные уровни дозировки у человека дают максимальные концентрации в плазме от 0,005 до 0,5 мкМ,которые значительно ниже, чем те которые, как ожидалось, дают анальгетический или противовоспалительный эффект за счет действия на этот рецептор. С другой стороны, подходящие терапевтические концентрации соединений по настоящему изобретению, как ожидается, составляют приблизительно 10-20 значений Ki для аденозинового рецептора (рецептора, к которому соединение имеет наибольшую аффинность) при рН 5,5. Таким образом, для спонгозина требуется от 15 до 30 нМ, тогда как при использовании Ki при рН 7,4 можно ожидать требуемой концентрации от 20 до 30 мкМ. Ожидается, что количество вводимого соединения по настоящему изобретению должно составлять 0,001-15 мг/кг. Количество может быть менее 6 мг/кг. Количество может быть по крайней мере 0,001,0,01, 0,1 или 0,2 мг/кг. Количество может быть менее 0,1 или 0,01 мг/кг. Предпочтительные диапазоны составляют 0,001-10, 0,001-5, 0,001-2, 0,001-1, 0,001-0,1, 0,001-0,01, 0,01-15, 0,01-10, 0,01-5, 0,01-2, 0,01-1,0,1-10, 0,1-5, 0,1-2, 0,1-1, 0,1-0,5, 0,1-0,4, 0,2-15, 0,2-10, 0,2-5, 0,2-2, 0,2-1,2, 0,2-1, 0,6-1,2 мг/кг. Предпочтительные дозы для человека (например, массой 70 кг) составляют менее 420 мг, предпочтительно, менее 28 мг, более предпочтительно, менее 21 мг и, предпочтительно, не менее 0,07, 0,1, 0,7 или 0,8 мг, более предпочтительно не менее 3,5 или 7 мг. Более предпочтительно 7-70 мг, 14-70 мг или 3,5-21 мг. Считают, что указанные выше дозировки значительно ниже (примерно до 1000 раз ниже), чем, как можно было бы ожидать, основываясь на значениях ЕС 50 соединений для аденозинового рецептора А 2 А,потребуются для анальгетического или противовоспалительного эффекта. Указанные выше предпочтительные дозировки предназначены для получения концентраций в плазме, которые составляют примерно от одной сотой до одной второй от значения ЕС 50 соединения для аденозинового рецептора, в отношении которого соединение имеет наивысшую аффинность. Соединение по настоящему изобретению может вводиться отдельно от других терапевтических средств или вместе с ними, например, с анальгетиками или противовоспалительными средствами (такими, как опиаты, стероиды, NSAID, каннабиноиды, модуляторы тахикинина или модуляторы брадикинина) или антигипералгетиками (такими как габапентин, прегабалин, каннабиноиды, модуляторы натриевых или кальциевых каналов, противоэпилептические средства и антидепрессанты), или DMARD. В основном, соединение по настоящему изобретению может вводиться известными способами, в любой подходящей композиции, любым удобным путем. Соединения по настоящему изобретению предпочтительно вводят перорально, парентерально, сублингвально, трансдермально, интраректально или через слизистые оболочки. Другие подходящие пути включают внутривенный, внутримышечный, подкожный, ингаляцией и местный. Количество введенного лекарственного средства, как правило, будет выше при пероральном введении, чем, например, при внутривенном. Следует принять во внимание, что соединение по настоящему изобретению может вводиться совместно с физиологически приемлемым носителем, эксципиентом или разбавителем. Для поддержания терапевтически эффективной концентрации в плазме в течение продолжительного периода времени соединения по настоящему изобретению могут быть включены в композиции с медленным высвобождением.-9 014425 Подходящие композиции, например для перорального введения, включают твердые единичные дозированные формы и такие же формы, содержащие жидкость, например, для инъекции, такие как таблетки, капсулы, пузырьки и ампулы, в которых действующее начало известными способами включено в композицию с физиологически приемлемым эксципиентом, разбавителем или носителем. Подходящие разбавители и носители известны, и они включают, например, лактозу и тальк, вместе с подходящими связующими средствами и т.д. Единичная доза соединения по настоящему изобретению формулы (VII), как правило, включает до 500 мг (например, от 1 до 500 мг, или (предпочтительно) от 5 до 500 мг) действующего начала. Предпочтительно, действующее начало присутствует в форме фармацевтической композиции, включающей действующее начало и физиологически приемлемый носитель, эксципиент или разбавитель. Предпочтительные диапазоны дозировок (т.е. предпочтительные количества действующего начала в единичной дозе) составляют 0,001-10, 0,001-5, 0,001-2, 0,001-1, 0,001-0,1, 0,001-0,01, 0,01-15, 0,01-10, 0,01-5, 0,01-2,0,01-1, 0,1-10, 0,1-5, 0,1-2, 0,1-1, 0,1-0,5, 0,1-0,4, 0,2-15, 0,2-10, 0,2-5, 0,2-2, 0,2-1,2, 0,2-1, 0,5-1, 0,6-1,2, как правило, около 0,2 или 0,6 мг действующего начала на кг субъекта (человека). Предпочтительные количества действующего начала составляют менее 420 мг, предпочтительно менее 28 мг, более предпочтительно менее 21 мг, и, предпочтительно, по крайней мере 0,07, 0,1, 0,7 или 0,8 мг, более предпочтительно, по краней мере 3,5 или 7 мг. Более предпочтительно от 7 до 70 мг, или от 14 до 70 мг, от 3,5 до 21 мг,0,07-0,7 мг или 0,7-7 мг. Считают, что на этих уровнях можно достичь эффективного лечения, в основном, без сопутствующего падения (например, не более, чем 10%) кровяного давления и/или увеличения компенсирующей частоты сердцебиений. Единичная доза соединения по настоящему изобретению может дополнительно включать одно или несколько других лекарственных средств, например, анальгетиков, противовоспалительных средств, антигипералгетиков или DMARD. Предпочтительно соединение по настоящему изобретению вводят с частотой 2 или 3 раза в день. Соединения по настоящему изобретению также могут служить основой для распознавания более эффективных лекарственных средств или лекарственных средств с еще меньшими побочными эффектами. Примерами фармацевтически приемлемых солей являются аддитивные органические соли, образованные с кислотами, дающими физиологически приемлемый анион, например, тозилат, метансульфонат,малат, ацетат, цитрат, малонат, тартрат, сукцинат, бензоат, аскорбат, -кетоглутарат и -глицерофосфат. Кроме этого можно получать подходящие неорганические соли, включая гидрохлориды, сульфаты, нитраты, бикарбонаты и карбонаты. Фармацевтически приемлемые соли могут быть получены по стандартным методикам, очень хорошо известным в технике, например, взаимодействием достаточно основного соединения, такого как амин, с подходящей кислотой, дающей физиологически приемлемый анион. Также могут быть получены соли карбоновых кислот со щелочным (например, натрием, калием или литием) или щелочно-земельным металлом (например, кальцием). Применение соединения формулы (VII) в производстве лекарственного средства для профилактики,лечения или облегчения ишемической боли может исключать профилактику, лечение или облегчение боли, возникающей из-за повреждения, причиненного органам вследствие реперфузии, следующей за случаем ишемии, например инфарктом миокарда или удара. Применение соединения формулы (VII) в производстве лекарственного средства для профилактики,лечения или облегчения ишемической боли в соответствии с настоящим изобретением может исключать применение 2-пропоксиаденозина, 2-изопропоксиаденозина, 3'-дезокси-2-метоксиаденозина или 3'-дезокси-2-этоксиаденозина. Способ профилактики, лечения или облегчения ишемической боли путем введения соединения формулы (VII) в соответствии с настоящим изобретением может исключать применение 2-пропоксиаденозина, 2-изопропоксиаденозина, 3'-дезокси-2-метоксиаденозина или 3'-дезокси-2-этоксиаденозина. Варианты осуществления настоящего изобретения описаны в следующих примерах со ссылками на сопровождающие чертежи, в которых: на фиг. 1 показано воздействие спонгозина (0,6 мг/кг, перорально) на А: кровяное давление у нормальных крыс; В: частоту сердцебиений; на фиг. 2 показано изменение концентрации в плазме в течение определенного времени после введения спонгозина; на фиг. 3 показано антигипералгетическое действие спонгозина (0,6 мг/кг, п.о.) на вызванную каррагенаном гипералгезию. А:развитие во времени (р 0,05, р 0,01 по сравнению с носителем (Sidak's),р 0,05 по сравнению с BL (baseline) в течение 5 ч для спонгозина и IND(Dunnett's; В:зависимость антигипералгетического эффекта от дозы; на фиг. 4 показано антигипералгетическое действие спонгозина (0,6 мг/кг, п.о.) в модели невропатической боли, вызываемой повреждением за счет постоянного сжатия (р 0,05, р 0,01 по отношению к носителю (ANOVA Sidak's; на фиг. 5 показано действие спонгозина (0,6 мг/кг, п. о.) при наличии или в отсутствии налоксона в- 10014425 модели невропатической боли, вызываемой повреждением за счет постоянного сжатия; на фиг. 6 показан аддитивный эффект спонгозина и габапентина в модели невропатической боли,вызываемой повреждением за счет постоянного сжатия; на фиг. 7 показано воздействие спонгозина на вызванное LPS высвобождение TNF-альфа в клетках клеточной линии U937 человеческого макрофага; и на фиг. 8 показано, что спонгозин (62,4 и 624 мкг/кг, интраперитонеально) ингибирует вызванное каррагенаном (CGN) воспаление с эффективностью, сравнимой с индометацином (3 мг/кг, п.о.) при концентрациях, которые не оказывают влияния на кровяное давление. Структуры соединений по настоящему изобретению даны в примерах далее по тексту. Значения Ki даны для каждого соединения при рН 5,5 и рН 7,4. Для их расчета стриарные мембраны инкубировали в течение 90 мин при 22 С в присутствии 2 нМ [3 Н]-CGS21680, 1 Ед/мл аденозиндеаминазы и увеличивающихся концентраций исследуемых соединений с последующей фильтрацией и подсчетом сцинтилляции в жидкости. Пример 1 Пример 7. Фиг. 1. Спонгозин (0,624 мг/кг, п.о.) не оказывал значительного влияния на давление крови или частоту сердцебиений. Имплантируемое радиотелеметрическое устройство помещали в брюшные полости 6 крыс на группу. Катетер давления устройства помещали в брюшную аорту, и два электрода вводили под кожу в положение lead II (левая сторона брюшной полости/правое плечо). Отдельных крыс помещали в индивидуальные клетки на радиодетектор (DSI) для сбора данных. А: давления крови; В:частоты сердцебиений. Пример 8. Величина ЕС 50 спонгозина для аденозиновых рецепторов (измеренная при рН 7,4) составляет 900 нг/мл (3 мкМ). Фиг. 2 показывает изменение концентрации в плазме по прошествии определенного времени после введения крысе спонгозина в количестве 0,6 мг/кг. Можно видеть, что концентрация в плазме более 3 ч остается выше 2% от величины ЕС 50. Антигипералгетические эффекты наблюдали (без изменения кровяного давления) в том случае, когда максимальная концентрация в плазме составляла от 1 до 30% от величины ЕС 50, определенной in vitro. Если максимальная концентрация в плазме достигает значения ЕС 50, наблюдаются сильные изменения кровяного давления, которые длятся не один час. Пример 9. Фиг. 3. А. Спонгозин (0,624 мг/кг, п.о.) ингибирует вызванную каррагенаном (CGN) термическую гипералгезию (CITH) с эффективностью, сравнимой с индометацином, (3 мг/кг, п.о.). В. Зависимость концентрация-реакция для спонгозина через три часа после введения. Каррагенан (2%, 10 мкл) вводят в правую заднюю лапу. Помещают источники тепла вблизи от обработанной и необработанной задних лап, причем на чертеже приведена разница во времени задержки отдергивания лап. Спонгозин вводят одновременно с каррагенаном. Пример 10. Фиг. 4. Спонгозин (0,624 мг/кг, п.о) подавляет термическую гипералгезию, вызванную повреждением от постоянного сдавления седалищного нерва крысы. Под анестезией вскрывают седалищный нерв на правой задней лапе и вокруг нервного пучка завязывают четыре неплотных лигатуры. Примерно через две недели на оперированных лапах крыс развивается термическая гипералгезия, которую можно оценить с помощью разницы времени задержки отдергивания лапы для правой и левой лап. Введение спонгозина уменьшает гипералгезию, что демонстрируется сокращением разницы между временами задержки отдергивания лап. Спонгозин был также или более эффективен по сравнению с карбамазепином (CBZ, 100 мг/кг, подкожно). Пример 11. Фиг. 5. Спонгозин (1,2 мг/кг, п.о.) ингибирует статическую аллодинию, вызванную повреждением от постоянного сдавления седалищного нерва крысы, как в присутствии, так и в отсутствии налоксена (1 мг/кг, подкожно). Под анестезией вскрывают седалищный нерв на правой задней лапе и вокруг нервного пучка завязывают четыре неплотных лигатуры. Примерно через две недели у крыс раз- 11014425 вивается статическая аллодиния на оперированной лапе, которую можно оценивать по разнице пороговых величин отдергивания лапы для правой и левой лап. Введение спонгозина уменьшает гипералгезию,что демонстрируется увеличением порога отдергивания лапы (PWT) в присутствии и отсутствии налоксена. Veh: носитель. Пример 12. Фиг. 6. Спонгозин и габапентин ингибируют статическую аллодинию, вызванную повреждением от постоянного сдавления седалищного нерва крысы. Спонгозин и габапентин вводили (перорально) в различных соотношениях, как показано на чертеже. Суммарная введенная доза показана на горизонтальной оси и порог отдергивания лапы (PWT) на вертикальной оси. Предсказанный антигипералгезивный эффект (полученный из кривых доза-ответ длякаждого средства в отдельности), в предположении, что результаты воздействия двух соединений являются аддитивными, показан символом. Очевидно, что наблюдаемые результаты незначиНаблюдаемые результаты обозначены символом тельно отличаются от результатов предсказанных в предположении аддитивности. Пример 13. Клетки клеточной линии человеческих макрофагов U937 выращивали в суспензии до 500000 клеток/мл, размещенной в 48 луночном планшете, обрабатывали 20 нг/мл РМА и инкубировали в течение 8 ч. Клетки прилипали ко дну лунок, их смывали и оставляли восстанавливаться в течение 36 ч перед использованием. Планшеты преинкубировали со спонгозином в различных концентрациях и через 10 мин добавляли 100 нг/мл LPS для стимулирования выработки TNF. Через 3 ч клеточный супернатант анализировали на содержание TNF-альфа, применяя наборы для ELISA с флуоресцентной меткой. График, показывающий результаты (ингибирование выделения TNF-альфа по отношению к концентрации спонгозина), представлен на фиг. 7. Результаты демонстрируют, что спонгозин ингибирует вызванноеLPS выделение TNF и что это ингибирование чувствительно к ингибиторам аденозиновых рецепторов. Пример 31. Концентрации спонгозина в плазме определяли после однократного перорального введения у 5 или 6 человек добровольцев. Тахикардию определяли, используя 12-электродную ЭКГ. Минимальная концентрация в плазме, приводящая к анальтезирующему эффекту, составляла у крыс 0,025 мкМ, что предполагало минимальную эффективную дозировку у человека приблизительно 0,8 мг, которая приводила к концентрациям в плазме свыше 0,025 мкМ в течение приблизительно 1,5 ч. Пример 32. Спонгозин (62,4 и 624 мкг/кг, интраперитонеально) ингибирует вызванное каррагенаном (CGN) воспаление с эффективностью, сравнимой с индометацином (3 мг/кг, перорально), при концентрациях, которые не влияют на кровяное давление. Каррагенан (2%, 10 микролитров) вводили в правую заднюю лапу крысы и определяли объем лапы плетизмометрией. Спонгозин вводили одновременно с каррагенаном. Результаты показаны на фиг. 8. Спонгозин был столь же эффективен, как и индометацин(индометацин, 3 мг/кг, п.о.). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение соединения формулы (VII) или его фармацевтически приемлемой соли в производстве лекарственного средства для профилактики, лечения или облегчения патологического состояния,которое может быть улучшено или предотвращено агонизмом в отношении аденозиновых рецепторов А 2 А где R представляет собой C1-4 алкокси и X представляет собой Н или ОН. 2. Применение соединения, определенного в п.1, или его фармацевтически приемлемой соли в производстве лекарственного средства для профилактики, лечения или облегчения боли.- 12014425 3. Применение по п.2, где боль представляет собой гипералгезию. 4. Применение по п.3, где гипералгезия представляет собой невропатическую боль. 5. Применение по п.3, где гипералгезия представляет собой боль при воспалении. 6. Применение по любому из пп.2, 3 или 5, где боль вызвана или связана с воспалительным или иммунным заболеванием, или является результатом комбинированного воспалительного, аутоиммунного и невропатического повреждения тканей. 7. Применение по п.2 в производстве лекарственного средства для профилактики, лечения или облегчения ишемической боли. 8. Применение соединения, определенного в п.1, или его фармацевтически приемлемой соли в производстве лекарственного средства для профилактики, лечения или облегчения макро и микрососудистых осложнений диабета 1 и 2 типа, ретинопатии, невропатии, вегетативной невропатии или повреждения кровеносных сосудов, вызванного ишемией или атеросклерозом. 9. Применение соединения, определенного в п.1, или его фармацевтически приемлемой соли для производства лекарственного средства для профилактики, лечения или облегчения воспаления. 10. Применение соединения, определенного в п.1, или его фармацевтически приемлемой соли в производстве болезнь-модифицирующих (базисных) противоревматических лекарственных средств(DMARD) для замедления развития артропатии. 11. Применение по п.10 в производстве DMARD для замедления развития ревматоидного артрита. 12. Фармацевтическая композиция в единичной дозированной форме, содержащая до 500 мг соединения по п.1, или его фармацевтически приемлемую соль в сочетании с NSAD или DMARD, и физиологически приемлемый носитель, эксципиент или разбавитель.
МПК / Метки
МПК: A61K 31/7076, A61P 29/00
Метки: терапевтические, соединения
Код ссылки
<a href="https://eas.patents.su/17-14425-terapevticheskie-soedineniya.html" rel="bookmark" title="База патентов Евразийского Союза">Терапевтические соединения</a>
Предыдущий патент: Синергетические фунгицидные комбинации биологически активных веществ
Следующий патент: Пиримидинил бензотиофеновые соединения
Случайный патент: Применение 4-[этил(диметил)аммонио]бутаноата для лечения сердечно-сосудистых заболеваний