Ассоциированные с ганглиозидами рекомбинантные антитела и их применение в диагностике и лечении опухолей
Номер патента: 6310
Опубликовано: 27.10.2005
Авторы: Лопес Рекена Алехандро, Ломбардеро Вальядарес Хосефа, Матео Де Акоста Дель Рио Кристина Мария, Роке Наварро Лоурдес Татьяна
Формула / Реферат
1. Химерное моноклональное антитело, полученное из мышиного моноклонального антитела MAb P3, которое узнает ганглиозиды, содержащие N-гликолилированную сиаловую кислоту, и которое продуцируется гибридомной клеточной линией с депозитным номером ECACC 94113026, где гипервариабельные домены его тяжелой и легкой цепей содержат следующие последовательности:

2. Химерное моноклональное антитело по п.1, где области рамки считывания (FR) его тяжелой и легкой цепей содержат следующие последовательности:

3. Моноклональное антитело по пп.1 и 2, где для его гуманизации и сохранения связывающих свойств в отношении антигена оно включает в себя по меньшей мере одну из следующих замен:

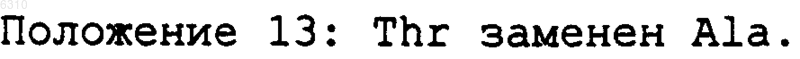
4. Моноклональное антитело по пп.1-3, где константная область тяжелой цепи содержит аминокислотную последовательность гамма-1-цепи, а константная область легкой цепи содержит аминокислотную последовательность каппа-цепи, обе из которых получены из иммуноглобулинов человека.
5. Клеточная линия, продуцирующая любое из моноклональных антител по пп.1-4.
6. Фармацевтическая композиция для лечения злокачественных опухолей молочной железы и меланом, их метастазов и рецидивов, содержащая любое из моноклональных антител по пп.1-4.
7. Фармацевтическая композиция для локализации и идентификации in vivo злокачественных опухолей молочной железы и меланом, их метастазов и рецидивов, содержащая любое из моноклональных антител по пп.1-4.
8. Применение моноклонального антитела по любому из пп.1-4 для приготовления лекарственного средства, применимого для лечения злокачественных опухолей молочной железы и меланом, их метастазов и рецидивов.
9. Химерное моноклональное антитело, полученное из мышиного антиидиотипического моноклонального антитела 1E10, которое узнает мышиное антитело MAb P3 и продуцируется гибридомной клеточной линией с депозитным номером ECACC 97112901, где гипервариабельные домены его тяжелой и легкой цепей содержат следующие последовательности:

10. Моноклональное антитело по п.9, где области рамки считывания (FR) его тяжелой и легкой цепей содержат следующие последовательности:

11. Моноклональное антитело по пп.9 и 10, где для его гуманизации и сохранения связывающих свойств в отношении антигена оно включает в себя по меньшей мере одну из следующих замен:

12. Моноклональное антитело по пп.9-11, где константная область тяжелой цепи содержит аминокислотную последовательность гамма-1-цепи, а константная область легкой цепи содержит аминокислотную последовательность каппа-цепи, обе из которых получены из иммуноглобулинов человека.
13. Клеточная линия, продуцирующая любое из моноклональных антител по пп.9-12.
14. Фармацевтическая композиция для лечения злокачественных опухолей молочной железы и меланом, их метастазов и рецидивов, содержащая любое из моноклональных антител по пп.9-12.
15. Фармацевтическая композиция для локализации и идентификации in vivo злокачественных опухолей молочной железы и меланом, их метастазов и рецидивов, содержащая любое из моноклональных антител по пп.9-12.
16. Применение моноклонального антитела по любому из пп.9-12 для приготовления лекарственного средства, применимого для лечения злокачественных опухолей молочной железы и меланом, их метастазов и рецидивов.
Текст
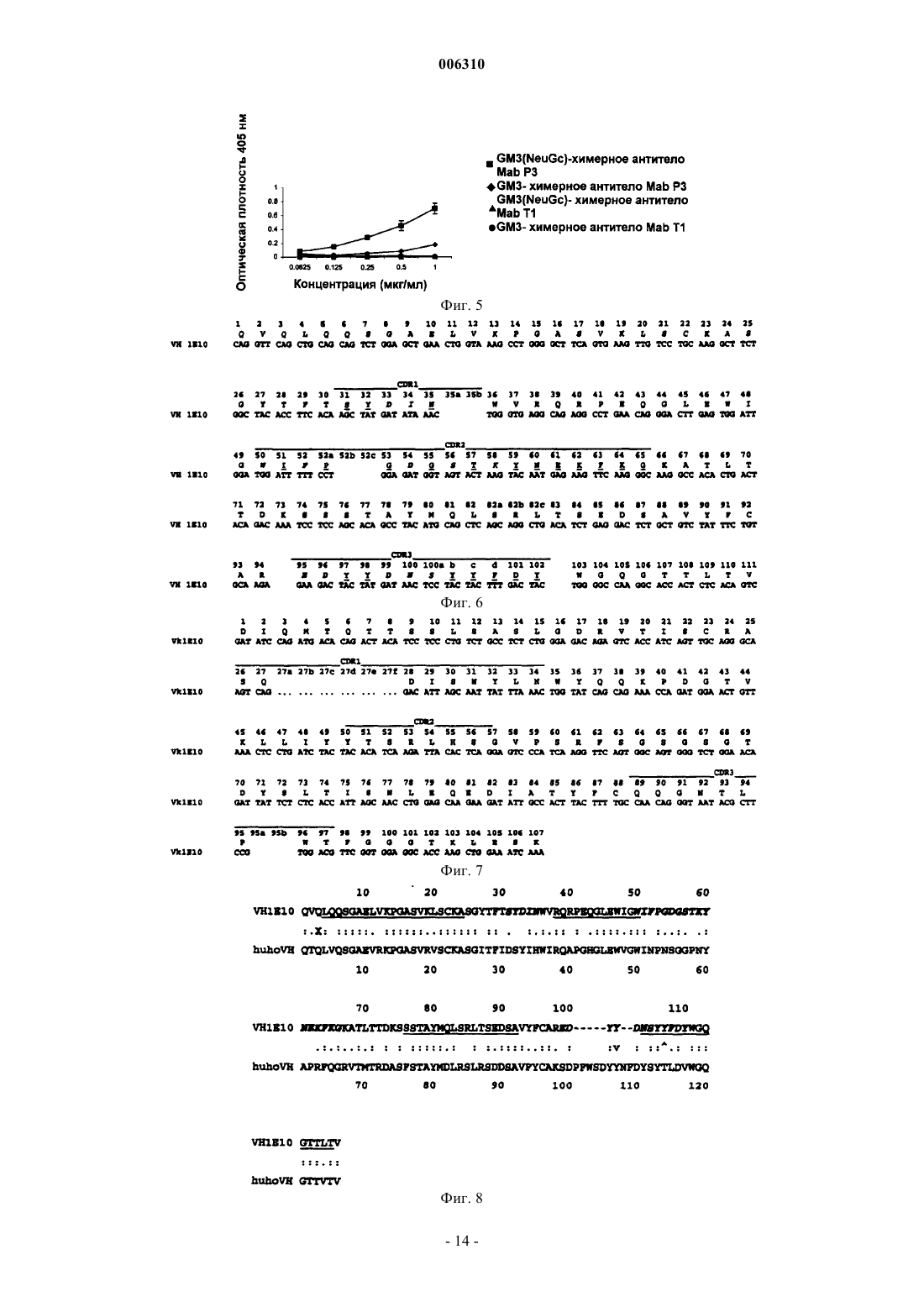
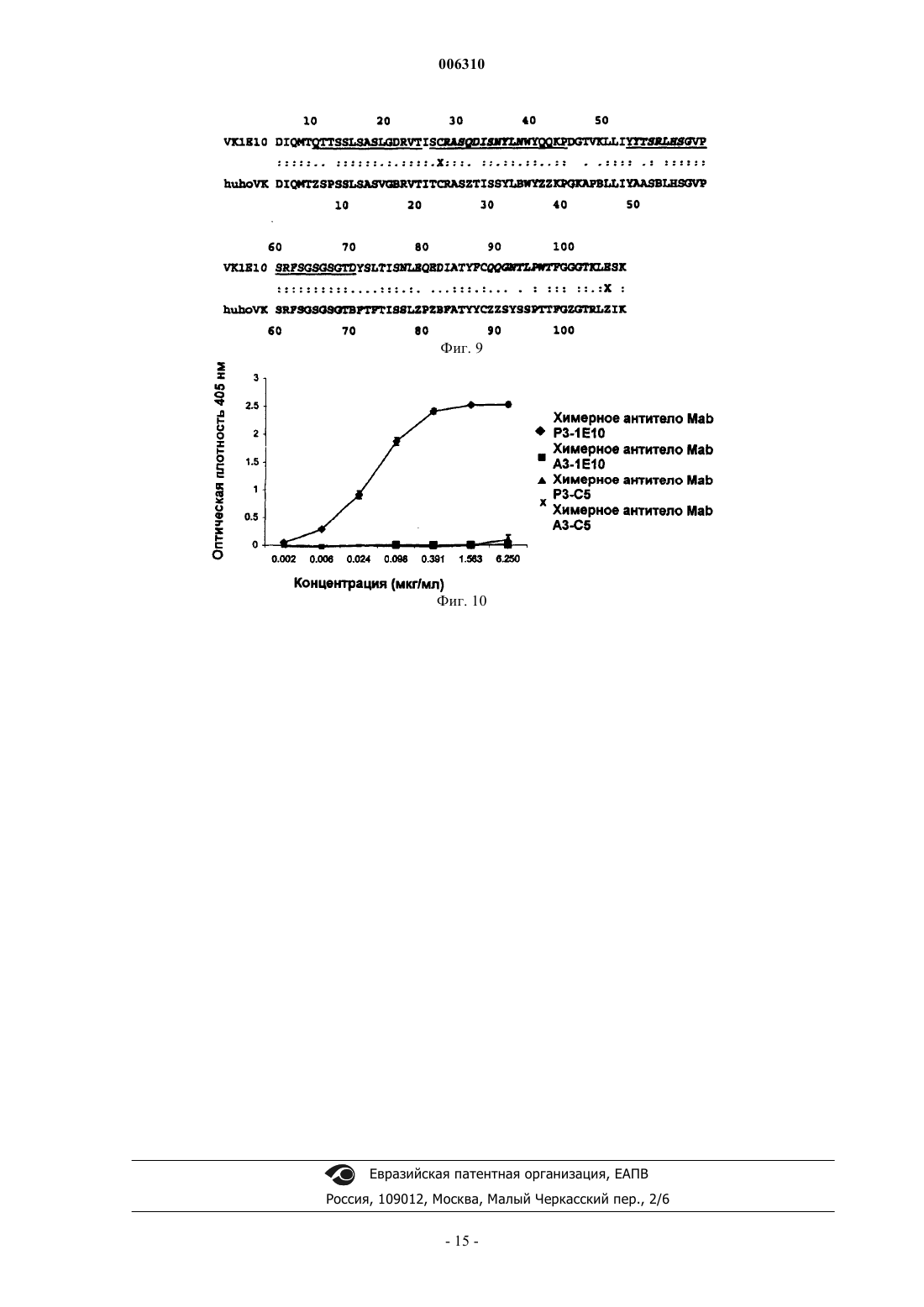
006310 Область техники Данное изобретение относится к области биотехнологии, в частности к новым рекомбинантным антителам, полученным с помощью генной инженерии, конкретно к химерным и гуманизированным антителам, полученным из мышиного моноклонального антитела Р 3 (MAb P3) и его антиидиотипического мышиного моноклонального антитела 1 Е 10 (MAbai 1E10). Более конкретно, данное изобретение относится к антителам, которые связываются с ганглиозидами, содержащими N-гликолилированную сиаловую кислоту, но не с ацетилированными формами ганглиозидов и не с нейтральными гликолипидами. Ганглиозиды, содержащие N-гликолилированную сиаловую кислоту, являются антигенами, экспрессируемыми на высоком уровне при раке молочной железы и меланомах. С другой стороны, противоопухолевое действие MAbai 1E10 было также продемонстрировано на экспериментальных моделях. Данное изобретение относится также к фармацевтическим композициям, которые содержат вышеописанные рекомбинантные антитела, применимым к диагностике и терапии рака, в частности рака молочной железы и меланом. Предпосылки изобретения Ганглиозиды являются гликосфинголипидами, которые содержат сиаловую кислоту, и они присутствуют в плазматической мембране клеток позвоночных. (Stults et al. (1989): Glycosphingolipids: structure,biological source and properties, Methods Enzymology, 179:167-214). О некоторых из этих молекул сообщалось в литературе как об антигенах, ассоциированных с опухолями или опухолевыми маркерами (Hakomori et al. (1991): Possible functions of tumor associated carbohydrate antigens, Curr. Opin. Immunol., 3: 646653), и на основании этого применение антигликозидных антител было описано как применимое в диагностике и терапии рака (Hougton et al. (1985): Mouse monoclonal antibody IgG3 antibody detecting GD3Focus on gangliosides, Int. J. Cancer, 73: 42-49). Сиаловые кислоты, более часто экспрессирующиеся у животных, являются N-ацетилнейраминовой кислотой (NeuAc) и N-гликолилнейраминовой кислотой (NeuGc) (Corfield et al. (1982): Occurence of sialicacids. Cell. Biol. Monogr., 10: 5-50). NeuGc обычно не экспрессируется в нормальных тканях человека и курицы, но широко распространена у других позвоночных (Leeden and Yu, (1976): Chemistry and analysisspectrometry. Cancer Research, 51: 1242-1246). Однако имеются сообщения, которые показывают, что антитела анти-NeuGc узнают некоторые опухоли человека и линии опухолевых клеток (Higashi et al. (1988):Res. Commun., 160: 1149-1154). Повышенные уровни ганглиозидов GM3 (NeuGc) были обнаружены при раке молочной железы человека (Marquina et al. (1996): Gangliosides expressed in human breast cancer. Cancer Research, 1996; 56: 5165-5171), этот результат делает привлекательным применение этой молекулы в качестве мишени при раковой терапии. Моноклональное антитело (MAb) P3, продуцируемое клеточной линией, депонированной с номером доступа ЕСАСС 94113026 (Европейский патент ЕР 0657471 В 1), является мышиным моноклональным антителом IgM-изотипа, которое получали путем слияния спленоцитов мышей Balb/c, иммунизированных липосомами, содержащими GM3(NeuGc) и столбнячный токсоид, с клеточной линией Р 3-Х 63 Аg8.653, которая является мышиной миеломой. Это антитело МАb Р 3 реагирует сильно с ганглиозидами,содержащими N-гликолилированную сиаловую кислоту, но не с ацетилированными формами ганглиозидов и не с нейтральными гликолипидами. Иммуноцитохимическими и иммуногистохимическими исследованиями, проводимыми с клеточными линиями и тканями из доброкачественных и неопластических опухолей, было показано, что антитело МАb Р 3 узнает рак молочной железы (Vazquez et al. (1995): Generation of murine monoclonal antidody specific for N-glycolylneuraminic acid-containing gangliosides that alsorecognizes sulfated glycolipids, Hybridoma, 14: 551-556) и меланому. Антитело MAb Р 3 индуцировало антиидиотипическую иммунную реакцию (Аb2) у мышей Balb/c(сингенная модель), даже без адъюванта и белка-носителя (Vazquez et al. (1998): Syngeneic anti-idiotypicmonoclonal antibodies to an anti-NeuGc-containing ganglioside monoclonal antibody, Hybridoma, 17: 527534). Роль электроотрицательных групп, сиаловой кислоты (для ганглиозидов) и SO3- (для сульфатидов) в свойствах узнавания этого антитела определяли иммунохимическим анализом (Моreno et al., (1998):Delineation of epitope recognized by an antibody specific for N-glycolylneuraminic acid-containing gangliosides, Glycobiology, 8: 695-705). Антиидиотипическое антитело MAb 1 Е 10 (MAbai 1E10) подтипа IgG1 получали у мыши Balb/c,иммунизированной MAb Р 3, связанным с KLH (гемоцианином моллюска) (патент США 6063379, клеточная линия с номером доступа ЕСАСС 97112901). MAbai 1E10 узнавало специфически MAb Р 3 и не-1 006310 связывало другие антигликозидные IgM-антитела. Кроме того, антитело MAbai 1E10 ингибировало специфическое связывание MAb Р 3 с GM3(NeuGc) и с клеточной линией MDA-MB-435, полученной из рака протоков молочной железы (положительной в отношении связывания MAb Р 3). Антитело MAbai 1E10 индуцировало сильную иммунную реакцию антител Аb3 при иммунизации мышей из сингенных и аллогенных моделей, эти антитела Аb3 не проявляли ту же самую специфичность, что и MAb P3, даже когда они несут идиотопы, сходные с идиотопами антитела Abl (Vazquez et al. (1998): Syngeneic anti-idiotypicmonoclonal antibodies to an anti-NeuGc-containing ganglioside monoclonal antibody, Hybridoma, 17: 527534). Антитело MAbai 1E10 индуцировало сильное противоопухолевое действие у сингенных, а также аллогенных мышей. Рост клеточной линии рака молочной железы F3II значимо уменьшался при периодическом введении дозы MAbai 1E10, связанного с KLH, в адъюванте Фрейнда при вакцинации мышейBalb/c. После вакцинации уменьшалось также число спонтанных легочных метастазов. Внутривенное введение MAbai 1E10 мышам C57BL/6 спустя 10-14 дней после внутривенной инокуляции клеток меланомы В 16 вызывало разительное уменьшение числа легочных метастазов в сравнении с мышами, обработанными посторонним IgG. Эти результаты предполагают, что запускается не один механизм противоопухолевого действия (Vazquez et al. (2000): Antitumor properties of an anti-idiotypic monoclonal antibody inrelation to N-glycolyl-containing gangliosides, Oncol. Rep., 7: 751-756, 2000). Даже при том, что гибридомная технология развивается на протяжении 15 лет (Koehler and Millstein(1975): Continuous cultures of fused cells secreting antibody of predefined specifity, Nature, 256: 495-497), и несмотря на то, что моноклональные антитела все еще очень применимы в диагностике, а также в исследованиях, не показана их терапевтическая эффективность у человека. Это обусловлено в основном их коротким периодом полужизни в крови и тем, что мышиные эффекторные функции не пригодны для иммунной системы человека, а также для иммунной реакции человеческих антимышиных антител (НАМА-реакции). С другой стороны, технология генной инженерии революционизировала потенциал применимостиMAb, так как манипуляция генами иммуноглобулинов позволяет получать модифицированные антитела с уменьшенной антигенностью, а также улучшать их эффекторные функции для лечения или диагностики определенных патологий. Способы уменьшения иммуногенности иммуноглобулинов имеют в качестве главной цели уменьшение различий между мышиным антителом и иммуноглобулином человека, без изменения специфичности узнавания антигенов (Morrison et al. (1989): Genetically engineered antibodymolecules, Adv Immunol., 44: 65-92). Недавно было разработано несколько способов гуманизации мышиных и крысиных антител и, таким образом, уменьшения ксеногенной иммунной реакции против чужеродных белков при их инъецировании человеку. Одним из первых подходов к уменьшению антигенности были химерные антитела, в которых вариабельные домены мышиного белка встроены в константные домены молекул человека, которые проявляют ту же самую специфичность, но уменьшенную иммуногенность в сравнении с их мышиными копиями, причем эффекторные функции иммуноглобулинов человека сохраняются химерными антителами (Morrison et al. (1984): Chimeric human antibody molecules: Mouse antigen-binding domains withhuman constant region domains, PNAS USA, 81: 6851-6855). Даже когда химерные антитела имеют ту же самую специфичность, что и мышиная копия, часто наблюдается иммунная реакция на вариабельные области (антител) грызунов. В попытке дополнительного уменьшения иммуногенности химерных антител только CDR (гипервариабельные области) из моноклонального антитела грызуна прививали на каркасные районы человека,и этот гибридный вариабельный район экспрессировался с константными районами человека (Jones et al.(1986): Replacing the complementary-determining regions in a human antibody with those from a mouse. Nature 321: 522-524; Verhoeyen et al. (1988): Reshaping human antibodies: grafting an antilysozyme activity, Science 239, 1534-1536). Однако этот подход имеет несколько недостатков: часто полученное антитело имеет уменьшенную аффинность, и ряд каркасных остатков должны быть обратно мутированы в соответствующие мышиные остатки для восстановления связывания (Rietchmann et al. (1988: Reshaping human antibodies for therapy, Nature, 332: 323-327; Queen et al. (1989): A humanized antibody that binds to the interleukin 2 receptor, PNAS USA, 86: 10029-10033; Tempest et al. (1991): Reshaping a human monoclonal antibodyto inhibit human respiratory syncytial virus infection in vivo, Biotechnology, 9: 266-272). Кроме того, стойкая иммуногенность часто наблюдается в CDR-пришитых антителах.Mateo et al. (патент США с номером 5712120) описали процедуру для уменьшения иммуногенности мышиных антител. Согласно этому способу модификации ограничиваются вариабельными доменами и конкретно мышиными FR (каркасными областями) химерных антител. Кроме того, часто проводят замены в районах FR, которые имеют амфипатические последовательности, и, следовательно, они являются потенциальными эпитопами, узнаваемыми Т-клетками. Этот способ предусматривает разумную замену нескольких аминокислотных остатков, локализованных в потенциально иммуногенных эпитопах, соответствующими остатками из наиболее гомологичной последовательности человека, причем аминокислоты, которые являются в основном ответственными за канонические структуры, а также остатки в непосредственной близости от CDR или в зоне Vernier должны быть сохранены.-2 006310 Полученное антитело сохраняет антигенсвязывающую специфичность и является менее иммуногенным, чем его мышиный или химерный предшественник (Mateo et al. (2000): Removal of T cell epitopesfrom genetically engineered antibodies: Production of modified immunoglobulins with reduced immunogenicity,Hybridoma 19: 463-71), и эти свойства увеличивают их терапевтическую применимость. С использованием этой новой процедуры необходимо только малое число мутаций и, конечно, меньше генетических манипуляций. Подробное описание изобретения Данное изобретение относится к рекомбинантным антителам, полученным с помощью технологий генной инженерии. Конкретно, данное изобретение относится к химерному антителу, произведенному из мышиного моноклонального антитела P3, продуцируемого гибридомной клеточной линией с депозитным номером ЕСАСС 94113026. Антитело MAb P3 узнает антиген, экспрессируемый в опухолевых клетках молочной железы и меланомах. MAb P3 характеризуется следующими последовательностями гипервариабельных областей (CDR) тяжелой и легкой цепей: Предпочтительно, последовательности FR тяжелой и легкой цепи являются следующими: В предпочтительном варианте химерное антитело данного изобретения содержит константную область тяжелой цепи IgG1 человека и константную область легкой цепи Ck человека. В другом аспекте данное изобретение относится к гуманизированному антителу, произведенному из MAb P3, продуцируемого гибридомной клеточной линией с депозитным номером ЕСАСС 94113026, характеризующемуся тем, что оно содержит константную область тяжелой цепи IgGI человека и константную область легкой цепи Ck человека, и районы FR легкой цепи человека содержат любую из следующих точковых мутаций: Положение 13. Thr заменен Ala. В другом аспекте данное изобретение относится к химерному антителу, произведенному из мышиного моноклонального антитела 1E10, продуцируемого гибридомной клеточной линией с депозитным номером ЕСАСС 97112901, и оно является антиидиотипическим антителом, которое узнает MAb P3.MAbai 1E10 характеризуется следующими последовательностями гипервариабельных районов (CDR) тяжелой и легкой цепей:-3 006310 Предпочтительно, последовательности FR тяжелой и легкой цепи являются следующими: В предпочтительном варианте химерное антитело данного изобретения содержит константную область тяжелой цепи IgG1 человека и константную область легкой цепи Ck человека. В другом аспекте данное изобретение относится к гуманизированному антителу, произведенному из MAb 1E10, продуцируемого гибридомной клеточной линией с депозитным номером ЕСАСС 97112901, характеризующемуся тем, что оно содержит константную область тяжелой цепи IgGI человека и константную область легкой цепи Ck человека, и FR тяжелой и легкой цепи человека содержат любую из следующих точковых мутаций: Легкая цепь: Положение 7: Thr заменен Ser Положение 8: Thr заменен Pro Положение 15: Leu заменен Val Тяжелая цепь: Положение 5: Gln заменен Val Положение 40: Arg заменен Ala Положение 42: Glu заменен Gly Положение 87 (83 согласно нумерации Kabat): Thr заменен Arg. В другом аспекте данное изобретение относится к клеточным линиям, которые экспрессируют описанные химерные и гуманизированные антитела; дополнительно данное изобретение относится к фармацевтическим композициям, содержащим описанные антитела. Предпочтительно, оно относится к фармацевтическим композициям для лечения опухолей молочной железы, легкого, пищеварительной системы, мочеполовой системы, меланом, сарком и нейроэктодермальных опухолей, их метастазов и рецидивов, причем эти фармацевтические композиции содержат описанные антитела и подходящий наполнитель. В другой репрезентации данного изобретения эти фармацевтические композиции могут быть использованы для определения местоположения и диагностики in vivo опухолей молочной железы, легкого, пищеварительной системы, мочеполовой системы, меланом, сарком и нейроэктодермальных опухолей, их метастазов и рецидивов, причем эти фармацевтические композиции содержат описанные антитела. Синтез кДНК и амплификация генов при помощи ПЦР (полимеразной цепной реакции) вариабельного района MAb P3 и MAbai 1E10. Цитоплазматическую РНК экстрагировали приблизительно из 106 гибридомных клеток, продуцирующих P3 (мышиное IgM-MAb, которое узнает GM3 N-гликолилированный ганглиозид) или 1E10 (антиидиотипическое анти-P3-антитело). РНК экстрагировали с использованием реагента TRIZOL (GIBCOBRL, Grand Island, NY), в соответствии с инструкциями изготовителя. Реакцию синтеза кДНК проводили, смешивая 5 мкг РНК, 25 пмоль Vh (комплементарной константной области мышиного IgM для VHP3 и константной области мышиного IgG1 для VH 1E10) или Vk(комплементарной константному мышиному району каппа для обоих антител), 2,5 мМ каждого из dNTP,50 мМ Трис-HCl рН 7,5, 75 мМ КСl, 10 мМ ДТТ, 8 мМ MgCl2 и 15 единиц ингибитора РНКаз в реакционной смеси 50 мкл. Смесь прогревали при 70 С в течение 10 мин и медленно охлаждали до 37 С. Затем добавляли 100 единиц фермента обратной транскриптазы MLV, и инкубирование при 42 С продолжали в течение одного часа. кДНК вариабельных областей VK и VH амплифицировали при помощи ПЦР. Вкратце, кДНК VH или VK смешивали с 25 пмоль специфических праймеров, 2,5 мМ каждого из dNTP, 5 мкл компонентов 10 Х буфера для ДНК-полимеразы Taq и 1 единицей этого фермента. Эти пробы подвергали 25 термическим циклам при 94 С, 30 с; 50 С, 30 с; 72 С, 1 мин и последей инкубации в течение 5 мин при 72 С. Клонирование и секвенирование амплифицированной кДНК ПЦР-продукты VH и VK (P3 и 1E10, соответственно) клонировали в вектор ТА (набор для клонирования ТА, Promega, USA). Полученные клоны секвенировали с использованием дидезокси-способа с применением ДНК-полимеразы Т 7 (набор для секвенирования с Т 7, Pharmacia, Sweden).-4 006310 Конструирование химерных генов Гены VH и VK вырезали из ТА-векторов путем ферментативного расщепления и их клонировали в соответствующие экспрессирующие векторы (Coloma et al. (1992): Novel vectors for the expression of antibody molecules using variable regions generated by polymerase chain reaction, J. Immunol. Meth., 152: 89104). Гены VH вырезали из ТА-вектора путем ферментативного расщепления EcoRV и Nhel и клонировали в экспрессирующий вектор (РАН 4604), который включал в себя ген вариабельного района IgGI человека и ген устойчивости к гистидинолу. Были получены конструкции P3VH-PAH4604 и 1E10VHPAH4604. Гены VK вырезали из ТА-вектора ферментативным расщеплением EcoRV и SalI и клонировали в экспрессирующий вектор (PAG4622). Этот вектор включал в себя ген устойчивости к микофеноловой кислоте и ген константного района каппа человека. Были получены конструкции P3VK-PAG4622 и 1E10VK-PAG4622. Экспрессия химерных антител, полученных из MAb P3 и MAbid 1 Е 10 Клетки NS-0 электропорировали с использованием 10 мкг P3VK-PAG4622 или 1E10VK-PAG4622,клоны, экспрессирующие легкие цепи каппа человека, трансфицировали с использованием 10 мкг P3VHPAH4604 и 1E10VH-PAH4604. Эти ДНК линеаризовали расщеплением ферментом PvuI, осаждали этанолом и растворяли в 50 мкл ЗФР. Приблизительно 107 клеток собирали путем центрифугирования и ресуспендировали в 0,5 мл ЗФР вместе с расщепленной ДНК в кювете для электропорации. После 10 мин на льду этим клеткам давали импульс 200 В и 960 мкФ и оставляли на льду в течение дополнительных 10 мин. Клетки распределяли в 96-луночные планшеты с DMEM F12 плюс 10% фетальная телячья сыворотка. Спустя два или четыре дня добавляли селективную среду (DMEM F12 с микофеноловой кислотой, 0,45 мкг/мл, или гистидинолом, 10 мМ, соответственно). Трансфицированные клоны были видны невооруженным глазом спустя 14 дней. Присутствие антитела человека в среде лунок, содержащих трансфицированные клоны, измеряли с использованием ELISA. Лунки микротитрационного планшета покрывали козьими антителами против легкой цепи каппа человека (для клонов, продуцирующих каппа-цепь человека) или против IgG человека(специфическими для гамма-цепи) (для продуцирующих полное антитело клонов). После промывания ЗФРТ (забуференным фосфатом солевым раствором, содержащим 0,05% Твин 20) разведенную культуральную среду лунок, содержащих трансфектанты, добавляли в каждую микротитрационную лунку и выдерживали в течение одного часа при 37 С. Лунки промывали ЗФР-Т, добавляли конъюгированные с пероксидазой хрена козьи антитела против легкой цепи каппа человека или конъюгированные со щелочной фосфатазой козьи антитела против IgG человека (специфические для гамма-цепи) и инкубировали при 37 С один час. Лунки промывали ЗФР-Т и добавляли субстратный буфер, содержащий офенилендиамин или пара-нитрофенилфосфат, соответственно. Спустя полчаса измеряли оптическую плотность при 492 или 405 нм, соответственно. Конструирование гуманизированных антител P3hu и 1E10hu путем гуманизации Т-клеточных эпитопов Предсказание Т-клеточных эпитопов. Последовательности вариабельных доменов P3 и 1 Е 10 анализировали с использованием алгоритмаsequence, J. Immunol., 138: 2213-2229). С его помощью осуществляли поиск на спиральные амфипатические сегменты с 7 или 11 аминокислотными остатками, которые были ассоциированы с Тиммуногенностью. С помощью программы SOHHA также были предсказаны спиральные гидрофобные остатки (Elliot et al. (1987). An hypothesis on the binding of an amphipatic, alpha helical sequence in li(eu) tothe desotope of class II antigen, J. Immunol., 138: 2949-2952). Оба алгоритма помогли предсказать, какие сегменты из последовательностей вариабельной области антител P3 и 1 Е 10 могли бы присутствовать в Тхелперных клетках в контексте молекул МНС класса II. Анализ гомологии с иммуноглобулинами человека Аминокислотные последовательности мышиных вариабельных областей сравнивали с последовательностями иммуноглобулинов, содержащихся в базах данных GenBank и EMBL (доступных в Интернете). Для каждого антитела определяли наиболее гомологичную последовательность из вариабельной области иммуноглобулинов человека. Для поиска гомологии последовательностей использовали программное обеспечение PC-TWO HIBIO PROSIS 06-00 (Hitachi). Анализ на уменьшение иммуногенности Целью этого способа является уменьшение иммуногенности путем разрушения или гуманизации потенциально иммуногенных Т-эпитопов с минимальными изменениями. Этот способ предусматривает разумную замену небольшого числа аминокислотных остатков, расположенных в спиральных амфипатических сегментах. Должны быть сохранены аминокислоты, которые являются в основном ответственными за канонические структуры, а также остатки в непосредственной близости к CDR или в зоне Vernier. Согласно этому способу последовательности мышиной вариабельной области сравнивали с наиболее гомологичной последовательностью человека, и идентифицировали различные аминокислотные ос-5 006310 татки в каждом положении между мышиным MAb и наиболее гомологичной последовательностью человека (Kabat (1991), Sequences of proteins of immunological interest. Fifth Edition, National Institute of Health),ранее определяемые остатки заменяли остатками, присутствующими в наиболее гомологичной последовательности человека. Замены производили с использованием способов направленного мутагенеза. Остатки, участвующие в трехмерной структуре сайта связывания, не мутировали; это могло бы повлиять на узнавание антигена. Дополнительная информация о влиянии замен в третичной структуре может быть получена путем молекулярного моделирования антигенсвязывающего сайта. Следует иметь в виду присутствие остатков пролина в спиральном амфипатическом сегменте и тот факт, что некоторые мышиные остатки не находятся в том же самом положении в наиболее гомологичной последовательности человека, но являются часто встречающимися в других иммуноглобулинах человека. По этой причине нет уникального ансамбля мышиных аминокислот, которые должны быть заменены в рамках считывания. Можно получать различные версии модифицированного антитела с различными числами замен. Мутации проводили посредством перекрывающихся ПЦР. Клонирование и экспрессия гуманизированных антител P3hu и 1E10hu Генетические конструкции, соответствующие P3hu и 1E10hu, клонировали в экспрессирующих векторах в соответствии со способом, описанным для химерных антител. Полученными конструкциями были P3VKhu-PAG4622 или lE10Vkhu-PAG4622 и P3VHhu-PAH4604 и lE10VHhu-PAH4604. Их трансфицировали в клетки NS-0 согласно протоколу, описанному выше для химерных антител. Очистка рекомбинантных антител Рекомбинантные антитела очищали методом аффинной хроматографии с использованием протеинаA (Pharmacia, Upssala, Sweden). Биологическая активность Специфическое связывание с антигеном, измеряемое при помощи ELISA, было тестом на биологическую активность рекомбинантных антител. Для рекомбинантного MAb P3 микротитрационные планшеты покрывали ганглиозидом GM3(NeuGc) в метаноле. После сушки в течение одного часа неспецифическое связывание блокировали 1% бычьим сывороточным альбумином (БСА) в Трис-НСl-буфере с инкубированием в течение одного часа при 37 С. Лунки промывали ЗФР и инкубировали в течение 1 ч при 37 С с очищенным рекомбинантнымMAb P3. Лунки промывали Трис-HCl, добавляли козьи антитела против Ig человека, конъюгированные со щелочной фосфатазой, и инкубировали при 37 С в течение одного часа. Наконец, эти лунки промывали и добавляли субстратный буфер, содержащий пара-нитрофенилфосфат. Через полчаса измеряли оптическую плотность при 405 или 492 нм, соответственно. Для рекомбинантного MAbai 1E10 анализ ELISA был сходным, за исключением того, что лунки покрывали MAb P3, и промывание выполняли с использованием ЗФР-0,005% Твин 20. Примеры В следующих примерах все используемые ферменты, а также реагенты и материалы, получали из коммерческих источников, если нет других указаний. Пример 1. Получение химерного MAb P3. Синтез кДНК выполняли реакцией с ферментом обратной транскриптазой с использованием РНК из гибридомы, продуцирующей MAb P3, в качестве исходного материала, как описано ранее. Последовательности специфических праймеров, используемых в этой реакции, показаны ниже. кДНК VHP3 и кДНК VKP3 амплифицировали при помощи ПЦР с использованием ДНКполимеразы Taq и специфических праймеров. Включенными в праймеры сайтами рестрикции были сайты EcoRV/NheI для VH и EcoRV/SalI для VK. Последовательности используемых праймеров были следующими:-6 006310 Продукты ПЦР клонировали в вектор ТА (набор для клонирования ТА, Invitrogen). Двенадцать независимых клонов секвенировали по дидезокси-способу с использованием ДНК-полимеразы Т 7 (Pharmacia). С использованием анализа поиска гомологии определили группу наиболее гомологичных последовательностей для VHP3 и VKP3. Последовательности VHP3 и VKP3 (фиг. 1 и 2) имеют высокую гомологию с группами IB и V, соответственно, в соответствии с классификацией Кабата. После расщепления рестриктазами EcoRV и NheI для VHP3 и EcoRV и SalI для VKP3 их клонировали в экспрессирующие векторы, предварительно расщепленные теми же самыми ферментами,РАН 4604 и PAG4622 для VH и VK, соответственно. Эти экспрессирующие векторы были предоставленыSherie Morrison (UCLA, California, USA), они пригодны для экспрессии иммуноглобулинов в клетках млекопитающих. Вектор РАН 4604 включал в себя константную область IgG1 человека и PAG4622 человека (Coloma et al. (1992): Novel vectors for the expression of antibody molecules using variable regions generated by polymerase chain reaction, J. Immunol. Meth., 152: 89-104). Были получены конструкции P3VHРАН 4604 и P3VK-PAG4622. Клетки NS-0 трансфицировали 10 мкг P3VK-PAG4622, клон, экспрессирующий легкую цепь,трансфицировали 10 мкг P3VH-РАН 4604, в обоих случаях ДНК линеаризовали с использованием PvuI,осаждали этанолом и растворяли в 50 мкл ЗФР перед трансфекцией. Приблизительно 107 клеток собирали путем центрифугирования в 0,5 мл ЗФР вместе с расщепленной ДНК в кювете для электропорации. После 10 мин на льду клеткам давали импульс 200 Вт и 960 мкФ и оставляли на льду в течение дополнительных 10 мин. Клетки распределяли в 96-луночные планшеты сDMEM F12 плюс 10% фетальная телячья сыворотка. Спустя два или четыре дня добавляли селективную среду (DMEM F12 с микофеноловой кислотой, 0,45 мкг/мл, или гистидинолом, 10 мМ, соответственно). Трансфицированные клоны были видны невооруженным глазом спустя 14 дней. Присутствие антитела человека в среде лунок, содержащих трансфицированные клоны, измеряли с использованием ELISA. Лунки микротитрационного планшета покрывали козьими антителами против легкой цепи каппа человека (для продуцирующих каппа-цепь человека клонов) или против IgG человека(специфическими для гамма-цепи) (для продуцирующих полное антитело клонов). После промывания ЗФРТ (забуференным фосфатом солевым раствором, содержащим 0,05% Твин 20) разведенную культуральную среду лунок, содержащих трансфектанты, добавляли в каждую микротитрационную лунку и выдерживали в течение одного часа при 37 С. Лунки промывали ЗФР-Т, добавляли конъюгированные с пероксидазой хрена козьи антитела против легкой цепи каппа человека или конъюгированные со щелочной фосфатазой козьи антитела против IgG человека (специфические для гамма-цепи) и инкубировали при 37 С один час. Лунки промывали ЗФР-Т и добавляли субстратный буфер, содержащий офенилендиамин или паранитрофенилфосфат, соответственно. Спустя полчаса измеряли оптическую плотность при 492 или 405 нм, соответственно. Пример 2. Получение отличающихся версий гуманизированного антитела P3. Мышиные последовательности VHP3 и VKP3 (фиг. 1 и 2) сравнивали с последовательностями человека. Фиг. 3 и 4 показывают наиболее гомологичные последовательности человека. Спиральные амфипатические районы потенциальных Т-клеточных эпитопов подвергали поиску на предмет последовательности мышиного вариабельного района P3 и в соответствии с этим способом проводили разумную стратегию для замены аминокислот для разрушения или гуманизации потенциальных Т-клеточных эпитопов в этих мышиных последовательностях. Анализ VHP3 дал 2 амфипатических сегмента, первый из которых включает в себя CDR1, FR2 и несколько остатков CDR2, а второй включает в себя конец FR3 и CDR3. Основные отличия мышиной последовательности в сравнении с наиболее гомологичной последовательностью человека были обнаружены в CDR или остатках, участвующих в трехмерной структуре сайта связывания. По этой причине было решено не заменять никаких аминокислот в мышином VHP3. Анализ VKP3 дал 2 амфипатических сегмента (фиг. 4), первый из которых включает в себя FR1, а второй включает в себя CDR2 и несколько остатков FR3. Было решено заменить остатки в положениях 8,9, 10, 11 и 13 остатками, находящимися в тех же самых положениях в наиболее гомологичной последовательности человека. Аминокислоты His, Lys, Phe, Met и Thr были заменены Pro, Ser, Ser, Leu и Ala, соответственно. Эти замены выполняли с использованием перекрывающейся ПЦР (Каmmаnn et al. (1989)Rapid insertional mutagenesis of DNA by polymerase chain reaction (PCR), Nucleic Acids Res., 17: 5404) с использованием праймеров 1 и 2 и 3 и 4, последовательности которых являются следующими:-7 006310 Точковые мутации проверяли секвенированием. Полученной конструкцией была P3VKhu, и ее клонировали в экспрессирующий вектор РАG 4622. Полученной конструкцией была P3VKhu-PAG4622. Для экспрессии гуманизированного антитела P3 клетки NS-0 трансфицировали P3VH-PAH4604 и P3VKhuPAG4622. Антитело P3hu трансфицировали согласно той же самой процедуре электропорации и детектирования, которая описана ранее для химерных антител. Пример 3. Биологическая активность химерного MAb P3. Специфическое связывание с антигеном, измеряемое при помощи ELISA, было тестом на биологическую активность химерногоMAb P3. Для рекомбинантного MAb P3 микротитрационные планшеты покрывали ганглиозидомGM3(NeuGc) в метаноле. После сушки в течение одного часа при 37 С неспецифическое связывание блокировали 1% бычьим сывороточным альбумином (БСА) в Трис-HCl-буфере с инкубированием в течение одного часа при 37 С. Лунки промывали ЗФР и инкубировали в течение 1 ч при 37 С с очищенным рекомбинантным MAb P3. Лунки промывали Трис-HCl, добавляли козьи антитела против Ig человека, конъюгированные со щелочной фосфатазой, и инкубировали при 37 С в течение одного часа. Наконец, эти лунки промывали и добавляли субстратный буфер, содержащий пара-нитрофенилфосфат. После получаса измеряли оптическую плотность при 405 соответственно. Химерное MAb Т 1 использовали в качестве негативного контроля. На фигуре 5 показано специфическое связывание химерного MAb P3 с антигеном. Пример 4. Получение химерного MAb 1E10. Синтез кДНК выполняли реакцией с ферментом обратной транскриптазы с использованием РНК из гибридомы, продуцирующей MAb 1E10, в качестве исходного материала, как описано ранее. Последовательности специфических праймеров, используемых в этой реакции, показаны ниже. Продукты ПЦР клонировали в вектор ТА (набор для клонирования ТА, Invitrogen). Двенадцать независимых клонов секвенировали (фиг. 7 и 8) по дидезокси-способу с использованием ДНК-полимеразы Т 7 (Pharmacia). С использованием анализа поиска гомологии определили группу наиболее гомологичных последовательностей для VH1E10 и VK1E10. Последовательности VH1E10 и VK1E10 имеют высокую гомологию с группами смешанных районов и V, соответственно, в соответствии с классификацией Кабата. После расщепления рестриктазами EcoRV и NheI для VH1E10 и HincII и SalI для VK1E10 их клонировали в экспрессирующие векторы, предварительно расщепленные теми же самыми ферментами,РАН 4604 и PAG4622 для VH и VK, соответственно. Эти экспрессирующие векторы были предоставленыSherie Morrison (UCLA, California, USA), они пригодны для экспрессии иммуноглобулинов в клетках млекопитающих. Вектор РАН 4604 включал в себя константную область IgG1 человека и PAG4622 человека (Coloma et al. (1992): Novel vectors for the expression of antibody molecules using variable regions generated by polymerase chain reaction, J. Immunol. Meth., 152: 89-104). Были получены конструкции 1E10VHPAH4604 и 1E10VK-PAG4622. Клетки NS-0 трансфицировали с использованием 10 мкг 1E10VK-PAG4622, клон, экспрессирующий легкую цепь, трансфицировали с использованием 10 мкг 1E10VH-PAH4604, в обоих случаях ДНК линеаризовали с использованием PvuI, осаждали этанолом и растворяли в 50 мкл ЗФР перед трансфекцией. Приблизительно 107 клеток собирали путем центрифугирования в 0,5 мл ЗФР вместе с расщепленной ДНК в кювете для электропорации. После 10 мин на льду клеткам давали импульс 200 В и 960 мкФ и-8 006310 оставляли на льду в течение дополнительных 10 мин. Клетки распределяли в 96-луночные планшеты сDMEM F12 плюс 10% фетальная телячья сыворотка. Спустя два или четыре дня добавляли селективную среду (DMEM F12 с микофеноловой кислотой, 0,45 мкг/мл, или гистидинолом, 10 мМ, соответственно). Трансфицированные клоны были видны невооруженным глазом спустя 14 дней. Присутствие антитела человека в среде лунок, содержащих трансфицированные клоны, измеряли с использованием ELISA. Лунки микротитрационного планшета покрывали козьими антителами против легкой цепи каппа человека (для продуцирующих каппа-цепь человека клонов) или против IgG человека(специфическими для гамма-цепи) (для продуцирующих полное антитело клонов). После промывания ЗФРТ (забуференным фосфатом солевым раствором, содержащим 0,05% Твин 20), разведенную культуральную среду лунок, содержащих трансфектанты, добавляли в каждую микротитрационную лунку и выдерживали в течение одного часа при 37 С. Лунки промывали ЗФР-Т, добавляли конъюгированные с пероксидазой хрена козьи антитела против легкой цепи каппа человека или конъюгированные со щелочной фосфатазой козьи антитела против IgG человека (специфические для гамма-цепи) и инкубировали при 37 С в течение одного часа. Лунки промывали ЗФР-Т и добавляли субстратный буфер, содержащий о-фенилендиамин или пара-нитрофенилфосфат, соответственно. Спустя полчаса измеряли оптическую плотность при 492 или 405 нм, соответственно. Пример 5. Получение отличающихся версий гуманизированного антитела 1 Е 10. Мышиные последовательности VH1E10 и VK1E10 (фиг. 6 и 7) сравнивали с последовательностями человека. Фиг. 8 и 9 показывают наиболее гомологичные последовательности человека. Спиральные амфипатические районы потенциальных Т-клеточных эпитопов подвергали поиску на последовательности мышиного вариабельного района 1 Е 10, и в соответствии с этим способом проводили разумную стратегию для замены аминокислот для разрушения или гуманизации потенциальных Т-клеточных эпитопов в этих мышиных последовательностях. Анализ VH1E10 дал (фиг. 8) 3 амфипатических сегмента, первый из которых включает в себя FR1,второй включает в себя FR2, третий включает в себя FR3. Было решено заменить остатки в положениях 5, 40, 42 и 87 (83 согласно нумерации Кабата) остатками, находящимися в тех же самых положениях в наиболее гомологичной последовательности человека. Аминокислоты Gln, Arg, Glu и Thr были замененыVal, Ala, Gly и Arg, соответственно. Эти замены выполняли с использованием перекрывающейся ПЦР (Каmmann et al. (1989) Rapid insertional mutagenesis of DNA by polymerase chain reaction (PCR), Nucleic Acids Res., 17: 5404) с использованием другого набора праймеров. Праймеры для мутации в положении 5 были праймерами 1 и 2 и 3 и 4, последовательности которых являются следующими: После проверки секвенированием точковой мутации в положении 5 вводили мутации в положениях 40 и 42. Праймеры для мутаций в положениях 40 и 42 тяжелой цепи: После проверки секвенированием точковой мутации в положениях 40 и 42 вводили мутацию в положение 87 (83 согласно нумерации Кабата). Праймеры для мутаций в положении 87 (83 согласно нумерации Кабата) тяжелой цепи. Другие замены не производили, так как остатки участвовали в трехмерной структуре сайта связывания. Точковые мутации подтверждали секвенированием. Полученной конструкцией была 1E10VHhu, и ее клонировали в экспрессирующий вектор РАН 4604. Полученной конструкцией была 1E10VHPAH4604. Анализ VH1E10 дал также 3 амфипатических сегмента (фиг. 9), первый из которых включает в себяFR1, второй включает в себя CDR1 и третий включает в себя FR3. Было решено заменить остатки в положениях 7, 8 и 15 остатками, находящимися в тех же самых положениях в наиболее гомологичной последовательности человека. Аминокислоты Thr, Thr и Leu были заменены Ser, Pro и Val, соответственно. Эти замены выполняли с использованием перекрывающейся ПЦР (Kammann et al. (1989) Rapid insertionalmutagenesis of DNA by polymerase chain reaction (PCR), Nucleic Acids Res., 17: 5404) с использованием праймеров 1 и 2 и 3 и 4, последовательности которых являются следующими. Праймеры для мутации в положениях 7, 8 и 15 легкой цепи: Точковые мутации подтверждали секвенированием. Полученной конструкцией была 1E10Vkhu, и ее клонировали в экспрессирующий вектор PAG 4622. Полученной конструкцией была 1E10VKhuPAG4622. Для экспрессии гуманизированного антитела 1 Е 10 клетки NS-0 трансфицировали 1E10VHhuPAH4604 и 1E10VKhu-PAG4622. Антитело 1E10hu трансфицировали согласно той же самой процедуре электропорации и детектирования, которая описана ранее для химерных антител. Пример 6. Биологическая активность химерного антитела Mab1 Е 10. Специфическое связывание с антигеном, измеряемое при помощи ELISA, было тестом на биологическую активность химерного MAb 1 Е 10. Для рекомбинантного MAb 1E10 микротитрационные планшеты покрывали антителом MAb P3. После промывания ЗФРТ (забуференным фосфатом солевым раствором, содержащим 0,05% Твин-20),неспецифическое связывание блокировали 1% бычьим сывороточным альбумином (БСА) в ЗФРТ с инкубированием в течение одного часа при 37 С. Лунки промывали и инкубировали в течение 1 ч при 37 С с очищенным рекомбинантным MAb 1E10. Лунки промывали ЗФРТ и добавляли козьи антитела противIg человека, конъюгированные со щелочной фосфатазой, и инкубировали при 37 С в течение одного часа. Наконец, эти лунки промывали ЗФРТ и добавляли субстратный буфер, содержащий паранитрофенилфосфат. После получаса измеряли оптическую плотность при 405 нм, соответственно. Химерное MAb C5 использовали в качестве негативного контроля. На фиг. 10 показано специфическое связывание химерного MAb 1E10 с MAb P3. Краткое описание фигур Фиг. 1 - ДНК VHP3 и расшифрованные аминокислотные последовательности. Последовательности выстроены для сопоставления в соответствии с нумерацией Кабата (Kabat et al. (1991), Sequences of proteins of immunological interest, Fifth edition, National Institute of Health), CDR отмечены пунктирными линиями. Фиг. 2 - ДНК VKP3 и расшифрованные аминокислотные последовательности. Последовательности выстроены для сопоставления в соответствии с нумерацией Кабата (Kabat et al. (1991), Sequences of pro- 10006310teins of immunological interest. Fifth edition, National Institute of Health), CDR отмечены пунктирными линиями. Фиг. 3 - VHP3 сопоставляли с наиболее гомологичной последовательностью человека. Амфипатические сегменты подчеркнуты, а CDR напечатаны жирным шрифтом. Фиг. 4 - VKP3 сопоставляли с наиболее гомологичной последовательностью человека. Амфипатические сегменты подчеркнуты, а CDR напечатаны жирным шрифтом. Фиг. 5 - специфическое связывание GM3 (NeuGc) химерным MAbP3. Различные концентрацииMAb P3 и MAb Т 1 (отрицательный контроль) испытывали с использованием ELISA. Микротитрационные планшеты покрывали ганглиозидами GM3(NeuGc) и GM3(NeuAc) (отрицательный контроль) в метаноле и измеряли специфическое связывание. Фиг. 6 - ДНК VH1E10 и расшифрованные аминокислотные последовательности. Последовательности выстроены для сопоставления в соответствии с нумерацией Кабата (Kabat et al. (1991), Sequences ofproteins of immunological interest. Fifth edition. National Institute of Health), CDR отмечены пунктирными линиями. Фиг. 7 - ДНК VK1E10 и расшифрованные аминокислотные последовательности. Последовательности выстроены для сопоставления в соответствии с нумерацией Кабата (Kabat et al. (1991), Sequences ofproteins of immunological interest. Fifth edition. National Institute of Health), CDR отмечены пунктирными линиями. Фиг. 8 - VH1E10 сопоставляли с наиболее гомологичной последовательностью человека. Амфипатические сегменты подчеркнуты, а CDR напечатаны жирным шрифтом. Фиг. 9 - VK1E10 сопоставляли с наиболее гомологичной последовательностью человека. Амфипатические сегменты подчеркнуты, а CDR напечатаны жирным шрифтом. Фиг. 10 - специфическое связывание мышиного MAb P3 химерным MAb 1 Е 10. Различные концентрации MAb 1 Е 10 и MAb С 5 (отрицательный контроль) испытывали с использованием ELISA. Микротитрационные планшеты покрывали MAb P3 и MAb A3 (отрицательный контроль) и измеряли специфическое связывание. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Химерное моноклональное антитело, полученное из мышиного моноклонального антитела MAbP3, которое узнает ганглиозиды, содержащие N-гликолилированную сиаловую кислоту, и которое продуцируется гибридомной клеточной линией с депозитным номером ЕСАСС 94113026, где гипервариабельные домены его тяжелой и легкой цепей содержат следующие последовательности: 2. Химерное моноклональное антитело по п.1, где области рамки считывания (FR) его тяжелой и легкой цепей содержат следующие последовательности: 3. Моноклональное антитело по пп.1 и 2, где для его гуманизации и сохранения связывающих свойств в отношении антигена оно включает в себя по меньшей мере одну из следующих замен:- 11006310 4. Моноклональное антитело по пп.1-3, где константная область тяжелой цепи содержит аминокислотную последовательность гамма-1-цепи, а константная область легкой цепи содержит аминокислотную последовательность каппа-цепи, обе из которых получены из иммуноглобулинов человека. 5. Клеточная линия, продуцирующая любое из моноклональных антител по пп.1-4. 6. Фармацевтическая композиция для лечения злокачественных опухолей молочной железы и меланом, их метастазов и рецидивов, содержащая любое из моноклональных антител по пп.1-4. 7. Фармацевтическая композиция для локализации и идентификации in vivo злокачественных опухолей молочной железы и меланом, их метастазов и рецидивов, содержащая любое из моноклональных антител по пп.1-4. 8. Применение моноклонального антитела по любому из пп.1-4 для приготовления лекарственного средства, применимого для лечения злокачественных опухолей молочной железы и меланом, их метастазов и рецидивов. 9. Химерное моноклональное антитело, полученное из мышиного антиидиотипического моноклонального антитела 1 Е 10, которое узнает мышиное антитело MAb P3 и продуцируется гибридомной клеточной линией с депозитным номером ЕСАСС 97112901, где гипервариабельные домены его тяжелой и легкой цепей содержат следующие последовательности: 10. Моноклональное антитело по п.9, где области рамки считывания (FR) его тяжелой и легкой цепей содержат следующие последовательности: 11. Моноклональное антитело по пп.9 и 10, где для его гуманизации и сохранения связывающих свойств в отношении антигена оно включает в себя по меньшей мере одну из следующих замен: 12. Моноклональное антитело по пп.9-11, где константная область тяжелой цепи содержит аминокислотную последовательность гамма-1-цепи, а константная область легкой цепи содержит аминокислотную последовательность каппа-цепи, обе из которых получены из иммуноглобулинов человека. 13. Клеточная линия, продуцирующая любое из моноклональных антител по пп.9-12. 14. Фармацевтическая композиция для лечения злокачественных опухолей молочной железы и меланом, их метастазов и рецидивов, содержащая любое из моноклональных антител по пп.9-12. 15. Фармацевтическая композиция для локализации и идентификации in vivo злокачественных опухолей молочной железы и меланом, их метастазов и рецидивов, содержащая любое из моноклональных антител по пп.9-12. 16. Применение моноклонального антитела по любому из пп.9-12 для приготовления лекарственного средства, применимого для лечения злокачественных опухолей молочной железы и меланом, их метастазов и рецидивов.
МПК / Метки
МПК: C07K 16/30
Метки: рекомбинантные, применение, антитела, ассоциированные, лечении, диагностике, опухолей, ганглиозидами
Код ссылки
<a href="https://eas.patents.su/16-6310-associirovannye-s-gangliozidami-rekombinantnye-antitela-i-ih-primenenie-v-diagnostike-i-lechenii-opuholejj.html" rel="bookmark" title="База патентов Евразийского Союза">Ассоциированные с ганглиозидами рекомбинантные антитела и их применение в диагностике и лечении опухолей</a>
Предыдущий патент: Вакцина для профилактики эхинококкоза животных
Следующий патент: Система трансфекции днк для получения инфекционного вируса гриппа
Случайный патент: Устройство управления синхронным приводным электродвигателем