Применение солей тиотропия для лечения персистирующей астмы средней тяжести
Формула / Реферат
1. Применение солей тиотропия 1
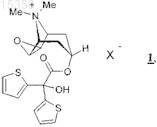
в которой X- обозначает однозарядный анион, предпочтительно анион, выбранный из группы, включающей хлорид, бромид, иодид, сульфат, фосфат, метансульфонат, нитрат, малеат, ацетат, цитрат, фумарат, тартрат, оксалат, сукцинат, бензоат и n-толуолсульфонат, необязательно в виде их гидратов и/или сольватов, для приготовления лекарственного средства, предназначенного для лечения пациентов, страдающих астмой со степенью тяжести 3 по классификации Глобальной стратегии лечения и профилактики бронхиальной астмы (GINA).
2. Применение по п.1 для приготовления лекарственного средства, предназначенного для лечения персистирующей астмы средней тяжести у пациентов, у которых, несмотря на лечение ингалируемыми кортикостероидами, ежедневно проявляются симптомы астмы или наблюдаются ее приступы.
3. Применение по п.1 или 2 для приготовления лекарственного средства, предназначенного для лечения персистирующей астмы средней тяжести у пациентов с генотипом Arg/Arg кодона 16 гена ADRB2 (хромосома 5), у которых, несмотря на лечение ингалируемыми b2-агонистами, постоянно проявляются симптомы астмы.
4. Применение по п.1 или 2 для приготовления лекарственного средства, предназначенного для лечения персистирующей астмы средней тяжести у пациентов с генотипом Arg/Arg кодона 16 гена ADRB2 (хромосома 5), у которых, несмотря на комбинированное лечение ингалируемыми кортикостероидами и длительно действующими b2-агонистами, ежедневно проявляются симптомы астмы или наблюдаются ее приступы.
5. Применение по одному из пп.1-4 для приготовления лекарственного средства, предназначенного для лечения персистирующей астмы средней тяжести у детей-пациентов.
6. Применение по одному из пп.1-5 для приготовления лекарственного средства, предназначенного для поддерживающей терапии при персистирующей астме средней тяжести и для предупреждения проявления бронхо-обструктивных симптомов у пациентов с неадекватной реакцией на поддерживающую регуляторную терапию ингалируемыми кортикостероидами и длительно действующими b2-агонистами.
7. Применение по одному из пп.1-6 для приготовления лекарственного средства, предназначенного для третичной поддерживающей регуляторной терапии персистирующей астмы средней тяжести.
8. Применение по одному из пп.1-7, при котором соли тиотропия вводят в организм в дозировке, которая из расчета на один прием предпочтительно составляет от 1 до 20 мкг тиотропия 1'.
Текст
ПРИМЕНЕНИЕ СОЛЕЙ ТИОТРОПИЯ ДЛЯ ЛЕЧЕНИЯ ПЕРСИСТИРУЮЩЕЙ АСТМЫ СРЕДНЕЙ ТЯЖЕСТИ(71)(73) Заявитель и патентовладелец: БРИНГЕР ИНГЕЛЬХАЙМ ИНТЕРНАЦИОНАЛЬ ГМБХ (DE) В изобретении описано применение солей тиотропия для приготовления лекарственного средства, предназначенного для лечения пациентов, страдающих персистирующей астмой средней тяжести. 015353 Настоящее изобретение относится к применению солей тиотропия для приготовления лекарственного средства, предназначенного для лечения пациентов, страдающих персистирующей астмой средней тяжести. Предпосылки создания изобретения Астма является одним из наиболее распространенных во всем мире хронических заболеваний. Астма представляет собой хроническое воспалительное заболевание дыхательных путей. Астма вызывает периодически повторяющиеся приступы стерторозного дыхания, затрудненности дыхания, одышки и кашля. Приступы (или обострения) астмы наступают эпизодически, тогда как воспаление дыхательных путей носит хронический характер. Известно несколько степеней тяжести астмы. По степени тяжести астма может быть интермиттирующей или же персистирующей легкой, средней тяжести или тяжелой. Степень тяжести астмы варьируется среди индивидуумов, не обязательно связана с частотой или продолжительностью проявления ее симптомов и с течением времени может изменяться у одного и того же индивидуума. Метод лечения астмы выбирают на основании степени ее тяжести и, наоборот, степень тяжести астмы классифицируют на основании фармакотерапии. Согласно общепризнанным в мире рекомендациям Глобальной стратегии лечения и профилактики бронхиальной астмы (сокращенно "GINA", от англ. "Global initiative for asthma") тяжесть астмы можно подразделить на так называемые степени 1-4 по классификации GINA. Степенью тяжести астмы определяются необходимые мероприятия по ее лечению (см. GINA - Pocket guide for asthma management andprevention, пересмотренное издание 2005 г.). Многие пациенты для борьбы с симптомами астмы, для улучшения деятельности легких и для предупреждения приступов астмы должны ежедневно принимать соответствующие противоастматические лекарственные средства. Прием противоастматических средств иногда требуется и для ослабления острых астматических приступов, таких как стерторозное дыхание,затрудненность дыхания и кашель. Астму со степенью тяжести 1 по классификации GINA называют также интермиттирующей. Ее симптомы обычно проявляются реже одно раза в неделю. Астма со степенью тяжести 1 по классификации GINA, как правило, не требует ежедневной лекарственной терапии. При легкой персистирующей астме (степень тяжести 2 по классификации GINA) рекомендуется лечение кортикостероидами в низкой дозе путем их ингаляции. При персистирующей астме средней тяжести (степень тяжести 3 по классификации GINA) рекомендуется применение кортикостероидов в дозах от низких до средних в сочетании с длительно действующими ингалируемыми 2-агонистами. Лечение тяжелой персистирующей астмы(степень тяжести 4 по классификации GINA) обычно заключается в применении ингалируемых кортикостероидов в высоких дозах в сочетании с длительно действующими ингалируемыми 2-агонистами и при необходимости с одним или несколькими средствами из группы, включающей теофиллин пролонгированного действия, модификатор лейкотриена, длительно действующий принимаемый внутрь 2-агонист и принимаемые внутрь кортикостероиды. В основу настоящего изобретения была положена задача предложить альтернативный путь лечения пациентов, страдающих персистирующей астмой средней тяжести (степень тяжести 3 по классификацииGINA). Еще одна задача изобретения состояла в том, чтобы предложить фармацевтические (лекарственные) композиции, пригодные для лечения таких пациентов. Подробное описание изобретения Настоящее изобретение относится к применению солей тиотропия 1 для приготовления лекарственного средства, предназначенного для лечения пациентов, страдающих персистирующей астмой средней тяжести. Соединение тиотропийбромид известно из заявки ЕР 418716 А 1 и имеет следующую химическую структуру: где X" обозначает бромид. Согласно настоящему изобретению под термином "тиотропий" подразумевается свободный катион 1'. Под солями тиотропия 1, которые могут использоваться в предусмотренных настоящим изобретением целях, имеются в виду соединения, которые помимо тиотропия 1' содержат в качестве противоиона однозарядный анион X", предпочтительно анион, выбранный из группы, включающей хлорид, бромид,иодид, сульфат, фосфат, метансульфонат, нитрат, малеат, ацетат, цитрат, фумарат, тартрат, оксалат, сукцинат, бензоат и n-толуолсульфонат, среди которых предпочтительны в качестве противоионов хлорид,бромид, иодид, сульфат, метансульфонат и n-толуолсульфонат. Из числа всех солей особенно предпоч-1 015353 тительны хлорид, бромид, иодид и метансульфонат. Особое значение согласно изобретению имеет тиотропийбромид, предпочтительно в виде его кристаллического моногидрата, описанного в WO 02/30928. В другом предпочтительном варианте предлагается использовать безводный тиотропийбромид, который описан в WO 03/000265 или WO 05/042527. Среди этих двух безводных форм особый интерес представляет та из них, которая описана в WO 05/042527. Согласно настоящему изобретению под выражением "персистирующая астма средней тяжести" имеется в виду астма со степенью тяжести 3 по классификации GINA. Астма со степенью тяжести 3 по классификации GINA характеризуется ежедневными приступами или ежедневным проявлением ее симптомов на протяжении длительного периода времени или ночными приступами астмы чаще одного раза в неделю и характерна для пациентов с исходным показателем максимальной скорости выдоха (МСВ) после предварительного лечения более 60%, но менее 80% от прогнозируемого или личного лучшего показателя и с вариабельностью МСВ в пределах от 20 до 30%. Астма, которая не поддается лечению путем ингаляции глюкокортикостероидов в низкой дозировке (степень тяжести 2), также должна рассматриваться как персистирующая астма средней тяжести. Показатели МСВ можно определять с помощью пневмотахометров, известных в данной области. Для определения так называемой форсированной жизненной емкости легких за 1 с (ФЖЕЛ 1 С) используют спирометры, известные в данной области. Указанные методы определения МСВ и ФЖЕЛ 1 С хорошо зарекомендовали себя в данной области. Изобретение относится также к применению солей тиотропия 1 для приготовления лекарственного средства, предназначенного для лечения пациентов, страдающих астмой со степенью тяжести 3 по классификации GINA. Изобретение относится далее к применению солей тиотропия 1 для приготовления лекарственного средства, предназначенного для лечения астмы у пациентов, страдающих ежедневными приступами астмы или ежедневным проявлением ее симптомов. Изобретение относится, кроме того, к применению солей тиотропия 1 для приготовления лекарственного средства, предназначенного для лечения астмы у пациентов, страдающих ее обострениями. Изобретение относится также к применению солей тиотропия 1 для приготовления лекарственного средства, предназначенного для лечения астмы у пациентов, страдающих симптомами ночной астмы или ночными приступами астмы. Изобретение относится помимо этого к применению солей тиотропия 1 для приготовления лекарственного средства, предназначенного для лечения астмы у пациентов с ограниченной физической активностью. Изобретение относится далее к применению солей тиотропия 1 для приготовления лекарственного средства, предназначенного для лечения астмы у пациентов с показателем МСВ в пределах от 60 до 80%. Изобретение относится также к применению солей тиотропия 1 для приготовления лекарственного средства, предназначенного для лечения астмы у пациентов с показателем ФЖЕЛ 1 С не выше 80%. Изобретение относится, кроме того, к применению солей тиотропия 1 для приготовления лекарственного средства, предназначенного для лечения астмы у пациентов с вариабельностью МСВ в пределах от 20 до 30%. Помимо этого настоящее изобретение относится к способу лечения пациентов, страдающих персистирующей астмой средней тяжести, заключающемуся во введении в их организм соли тиотропия 1 в терапевтически эффективном количестве. Изобретение относится также к способу лечения пациентов,страдающих астмой со степенью тяжести 3 по классификации GINA, заключающемуся во введении в их организм соли тиотропия 1 в терапевтически эффективном количестве. Изобретение относится далее к способу лечения пациентов, страдающих астмой с ежедневными приступами или с ежедневным проявлением ее симптомов, заключающемуся во введении в их организм соли тиотропия 1 в терапевтически эффективном количестве. Изобретение относится, кроме того, к способу лечения пациентов, страдающих астмой с интермиттирующими обострениями, заключающемуся во введении в их организм соли тиотропия 1 в терапевтически эффективном количестве. Изобретение относится также к способу лечения пациентов, страдающих астмой с симптомами ночной астмы или ночными приступами, заключающемуся во введении в их организм соли тиотропия 1 в терапевтически эффективном количестве. Изобретение относится помимо этого к способу лечения астмы у пациентов с ограниченной физической активностью, заключающемуся во введении в их организм соли тиотропия 1 в терапевтически эффективном количестве. Изобретение относится также к способу лечения астмы у пациентов с показателем МСВ не выше 80%, заключающемуся во введении в их организм соли тиотропия 1 в терапевтически эффективном количестве. Изобретение относится далее к способу лечения астмы у пациентов с показателем ФЖЕЛ 1 С не выше 80%, заключающемуся во введении в их организм соли тиотропия 1 в терапевтически эффективном количестве. Изобретение относится также к способу лечения астмы у пациентов с вариабельностью МСВ в пределах от 20 до 30%, заключающемуся во введении в их организм соли тиотропия 1 в терапевтически эффективном количестве. Тиотропий особо полезен при лечении больных астмой, имеющих гомозиготный генотип Arg/Arg кодона 16 гена 2-адренорецептора (ADRB2) в хромосоме 5, поскольку этот бетамиметик менее эффективен в лечении пациентов с генотипом "дикого типа" (например, Gly/Gly). В соответствии с этим изобретение относится также к способу лечения персистирующей астмы средней тяжести (степень тяжести 3 по классификации GINA) у пациентов с гомозиготным генотипом Arg/Arg кодона 16 гена 2-2 015353 адренорецептора (ADRB2) в хромосоме 5. В другом предпочтительном варианте изобретение относится к способу лечения персистирующей астмы средней тяжести (степень тяжести 3 по классификации GINA) у пациентов с полиморфизмом одного нуклеотида Arg/Arg. В следующем предпочтительном варианте изобретение относится к способу лечения персистирующей астмы средней тяжести (степень тяжести 3 по классификации GINA) у пациентов с полиморфизмом одного нуклеотида Arg/Arg в качестве вторичной регуляторной терапии. В следующем предпочтительном варианте изобретение относится к способу лечения персистирующей астмы средней тяжести 3 по классификации GINA у пациентов с генотипомArg/Arg. Выражение "гомозиготный генотип Arg/Arg кодона 16 гена 2-адренорецептора (ADRB2) в хромосоме 5" используется для обозначения популяции пациентов с мутацией одного нуклеотида, на долю которых приходится примерно 15-20% от всей популяции. Результаты целого ряда исследований свидетельствуют о наличии связи полиморфизма гена ADRB2 с астмой. По данным последних исследований было установлено, что для пациентов, гомозиготных (т.е. с идентичными аллелями в локусе) по аргинину в положении 16 аминокислотной последовательности, характерна отрицательная реакция на регулярное применение 2-агонистов. Пациенты, страдающие астмой со степенью тяжести 3 по классификации GINA и имеющие генотипArg/Arg, представляют собой пациентов, которым в соответствии с существующими рекомендациями попрежнему предписывается применение ингалируемых глюкокортикостероидов в дозировке от низкой до средней в сочетании с длительно действующим ингалируемым 2-агонистом. Пациенты с полиморфизмом одного нуклеотида Arg/Arg представляют собой пациентов, у которых вероятна неадекватная реакция на вторичную регуляторную терапию, например, длительно действующими 2-агонистами. Существуют доказательства того, что тиотропийбромид в качестве длительно действующего антихолинергического средства может дополнительно использоваться для лечения пациентов с персистирующей астмой средней тяжести, которым его можно будет назначать в качестве альтернативного лекарственного средства без опасности серьезных побочных эффектов. Выражение "в терапевтически эффективном количестве" означает то количество лекарственного средства или лекарственного вещества, которое вызывает требуемую исследователю или практикующему врачу биологическую или медицинскую реакцию ткани, системы, животного или человека. Персистирующую астму средней тяжести рекомендуется лечить кортикостероидами. Однако у пациентов, страдающих персистирующей астмой средней тяжести, несмотря на лечение ингалируемыми кортикостероидами, часто наблюдается ежедневное проявление симптомов астмы на протяжении длительного периода времени. В соответствии с этим в еще одном варианте изобретение относится к применению солей тиотропия 1 для приготовления лекарственного средства, предназначенного для лечения персистирующей астмы средней тяжести у пациентов, у которых, несмотря на лечение ингалируемыми кортикостероидами, проявляются постоянные симптомы астмы. Персистирующую астму средней тяжести рекомендуется также лечить 2-агонистами, в частности ингалируемыми длительно действующими 2-агонистами. Однако у пациентов, страдающих персистирующей астмой средней тяжести, несмотря на лечение ингалируемыми 2-агонистами часто наблюдается ежедневное проявление симптомов астмы на протяжении длительного периода времени. В соответствии с этим в еще одном варианте изобретение относится к применению солей тиотропия 1 для приготовления лекарственного средства, предназначенного для лечения персистирующей астмы средней тяжести у пациентов, у которых, несмотря на лечение ингалируемыми 2-агонистами, постоянно проявляются симптомы астмы. Для фармакотерапии персистирующей астмы средней тяжести в качестве первичной регуляторной терапии рекомендуется применение кортикостероидов в сочетании с длительно действующими 2 агонистами. Однако у пациентов, страдающих персистирующей астмой средней тяжести, несмотря на лечение ингалируемыми кортикостероидами в сочетании с длительно действующими 2-агонистами,часто наблюдается ежедневное проявление симптомов астмы. В соответствии с этим в еще одном варианте изобретение относится к применению солей тиотропия 1 для приготовления лекарственного средства, предназначенного для лечения персистирующей астмы средней тяжести у пациентов, у которых, несмотря на комбинированное лечение ингалируемыми кортикостероидами и длительно действующими 2-агонистами, ежедневно проявляются симптомы астмы. В следующем предпочтительном варианте изобретение относится к применению солей тиотропия 1 для приготовления лекарственного средства, предназначенного для поддерживающей терапии при персистирующей астме средней тяжести и для предупреждения проявления бронхо-обструктивных симптомов у пациентов с неадекватной реакцией на поддерживающую регуляторную терапию ингалируемыми кортикостероидами и длительно действующими 2-агонистами. В следующем предпочтительном варианте изобретение относится к применению солей тиотропия 1 для приготовления лекарственного средства, предназначенного для поддерживающей терапии при астме со степенью тяжести 3 по классификации GINA и для предупреждения проявления бронхообструктивных симптомов у пациентов с неадекватной реакцией на поддерживающую регуляторную-3 015353 терапию ингалируемыми кортикостероидами и длительно действующими 2-агонистами. В следующем предпочтительном варианте изобретение относится к применению солей тиотропия 1 для приготовления лекарственного средства, предназначенного для вторичной поддерживающей регуляторной терапии при персистирующей астме средней тяжести. В следующем предпочтительном варианте изобретение относится к применению солей тиотропия 1 для приготовления лекарственного средства, предназначенного для поддерживающей терапии при персистирующей астме средней тяжести и для предупреждения проявления бронхо-обструктивных симптомов у пациентов, которые уже проходят курс поддерживающей регуляторной терапии ингалируемыми кортикостероидами. В следующем предпочтительном варианте изобретение относится к применению солей тиотропия 1 для приготовления лекарственного средства, предназначенного для поддерживающей терапии при астме со степенью тяжести 3 по классификации GINA и для предупреждения проявления бронхообструктивных симптомов у пациентов, которые уже проходят курс поддерживающей регуляторной терапии ингалируемыми кортикостероидами. В следующем предпочтительном варианте изобретение относится к применению солей тиотропия 1 для приготовления лекарственного средства, предназначенного для поддерживающей терапии при персистирующей астме средней тяжести и для предупреждения проявления бронхо-обструктивных симптомов у пациентов, которые уже проходят курс поддерживающей регуляторной терапии ингалируемыми кортикостероидами, выбранными из группы, включающей преднизолон, преднизон, бутиксокортпропионат, RPR-106541, флунисолид, беклометазон, триамцинолон, будесонид, флутиказон, мометазон,циклесонид, рофлепонид, ST-126, дексаметазон, (S)-фторметиловый эфир 6,9-дифтор-17-[(2 фуранилкарбонил)окси]-11-гидрокси-16-метил-3-оксоандроста-1,4-диен-17-карботионовой кислоты,(S)-(2-оксотетрагидрофуран-3S-иловый) эфир 6,9-дифтор-11-гидрокси-16-метил-3-оксо-17-пропионилоксиандроста-1,4-диен-17-карботионовой кислоты и этипреднолдихлорацетат (BNP-166), необязательно в виде их рацематов, энантиомеров или диастереомеров и необязательно в виде их солей и производных, их сольватов и/или гидратов. В следующем предпочтительном варианте изобретение относится к применению солей тиотропия 1 для приготовления лекарственного средства, предназначенного для поддерживающей терапии при тяжелой персистирующей астме и для предупреждения проявления бронхо-обструктивных симптомов у пациентов, которые уже проходят курс поддерживающей регуляторной терапии ингалируемыми кортикостероидами, выбранными из группы, включающей флунисолид, беклометазон, триамцинолон, будесонид, флутиказон, мометазон, циклесонид, рофлепонид, ST-126, дексаметазон, (S)-фторметиловый эфир 6,9-дифтор-17-[(2-фуранилкарбонил)окси]-11-гидрокси-16-метил-3-оксоандроста-1,4-диен-17 карботионовой кислоты, (S)-(2-оксотетрагидрофуран-3S-иловый) эфир 6,9-дифтор-11-гидрокси-16 метил-3-оксо-17-пропионилоксиандроста-1,4-диен-17-карботионовой кислоты и этипреднолдихлорацетат, необязательно в виде их рацематов, энантиомеров или диастереомеров и необязательно в виде их солей и производных, их сольватов и/или гидратов. В следующем предпочтительном варианте изобретение относится к применению солей тиотропия 1 для приготовления лекарственного средства, предназначенного для поддерживающей терапии при персистирующей астме средней тяжести и для предупреждения проявления бронхо-обструктивных симптомов у пациентов, которые уже проходят курс поддерживающей регуляторной терапии ингалируемыми кортикостероидами, выбранными из группы, включающей будесонид, флутиказон, мометазон, циклесонид, (S)-фторметиловый эфир 6,9-дифтор-17-[(2-фуранилкарбонил)окси]-11-гидрокси-16-метил-3 оксоандроста-1,4-диен-17-карботионовой кислоты и этипреднолдихлорацетат, необязательно в виде их рацематов, энантиомеров или диастереомеров и необязательно в виде их солей и производных, их сольватов и/или гидратов. При любом упоминании в настоящем описании стероидов подразумеваются также их возможно существующие соли или производные, гидраты или сольваты. В качестве примеров возможных солей и производных стероидов можно назвать соли с щелочными металлами, такие, например,как натриевые или калиевые соли, сульфобензоаты, фосфаты, изоникотинаты, ацетаты, пропионаты, дигидрофосфаты, пальмитаты, пивалаты или же фуроаты. В следующем предпочтительном варианте изобретение относится к применению солей тиотропия 1 для приготовления лекарственного средства, предназначенного для поддерживающей терапии при персистирующей астме средней тяжести и для предупреждения проявления бронхо-обструктивных симптомов у пациентов с генотипом Arg/Arg кодона 16 (хромосома 5), которые уже проходят курс поддерживающей регуляторной терапии ингалируемыми кортикостероидами и длительно действующими 2 агонистами, выбранными из группы, включающей албутерол, бамбутерол, битолтерол, броксатерол, карбутерол, кленбутерол, фенотерол, формотерол, гексопреналин, ибутерол, изоэтарин, изопреналин, левосалбутамол, мабутерол, мелуадрин, метапротеренол, оркипреналин, пирбутерол, прокатерол, репротерол,TD 3327, ритодрин, салметерол, салмефамол, сотеренот, сульфонтерол, тиарамид, тербуталин, толубутерол, CHF-4226 (ТА 2005 или кармотерол), HOKU-81, KUL-1248, 3-(4-6-[2-гидрокси-2-(4-гидрокси-3 гидроксиметилфенил)этиламино]гексилоксибутил)бензолсульфонамид, 5-[2-(5,6-диэтилиндан-2-илами-4 015353 но)-1-гидроксиэтил]-8-гидрокси-1H-хинолин-2-он,4-гидрокси-7-[2-[2-[3-(2-фенилэтокси)пропил] сульфонилэтил]аминоэтил]-2(3 Н)-бензотиазолон,1-(2-фтор-4-гидроксифенил)-2-[4-(1-бензимидазолил)-2-метил-2-бутиламино]этанол, 1-[3-(4-метоксибензиламино)-4-гидроксифенил]-2-[4-(1-бензимидазолил)-2-метил-2-бутиламино]этанол,1-[2 Н-5-гидрокси-3-оксо-4 Н-1,4-бензоксазин-8-ил]-2-[3-(4-N,Nдиметиламинофенил)-2-метил-2-пропиламино]этанол,1-[2 Н-5-гидрокси-3-оксо-4 Н-1,4-бензоксазин-8 ил]-2-[3-(4-метоксифенил)-2-метил-2-пропиламино]этанол, 1-[2 Н-5-гидрокси-3-оксо-4 Н-1,4-бензоксазин 8-ил]-2-[3-(4-н-бутилоксифенил)-2-метил-2-пропиламино]этанол, 1-[2 Н-5-гидрокси-3-оксо-4 Н-1,4-бензоксазин-8-ил]-2-4-[3-(4-метоксифенил)-1,2,4-триазол-3-ил]-2-метил-2-бутиламиноэтанол, 5-гидрокси-8(1-гидрокси-2-изопропиламинобутил)-2 Н-1,4-бензоксазин-3-(4 Н)-он, 1-(4-амино-3-хлор-5-трифторметилфенил)-2-трет-бутиламино)этанол, 1-(4-этоксикарбониламино-3-циано-5-фторфенил)-2-(трет-бутиламино)этанол и N-[2-гидрокси-5-(1-гидрокси-2-2-[4-(2-гидрокси-2-фенилэтиламино)фенил]этиламино этил)фенил]формамид, необязательно в виде их рацематов, энантиомеров, диастереомеров и необязательно в виде фармакологически приемлемых кислотно-аддитивных солей и гидратов. В следующем предпочтительном варианте изобретение относится к применению солей тиотропия 1 для приготовления лекарственного средства, предназначенного для поддерживающей терапии при тяжелой персистирующей астме и для предупреждения проявления бронхо-обструктивных симптомов у пациентов с генотипом Arg/Arg кодона 16 (хромосома 5), которые уже проходят курс поддерживающей регуляторной терапии ингалируемыми кортикостероидами и длительно действующими 2-агонистами,выбранными из группы, включающей бамбутерол, битолтерол, карбутерол, кленбутерол, фенотерол,формотерол, гексопреналин, ибутерол, пирбутерол, прокатерол, репротерол, TD 3327, салметерол, сульфонтерол, тербуталин, толубутерол, CHF-4226 (ТА 2005 или кармотерол), 3-(4-6-[2-гидрокси-2-(4 гидрокси-3-гидроксиметилфенил)этиламино]гексилоксибутил)бензолсульфонамид, 5-[2-(5,6-диэтилиндан-2-иламино)-1-гидроксиэтил]-8-гидрокси-1 Н-хинолин-2-он, 4-гидрокси-7-[2-[2-[3-(2-фенилэтокси) пропил]сульфонилэтил]аминоэтил]-2(3 Н)-бензотиазолон,1-(2-фтор-4-гидроксифенил)-2-[4-(1-бензимидазолил)-2-метил-2-бутиламино]этанол,1-[3-(4-метоксибензиламино)-4-гидроксифенил]-2-[4-(1 бензимидазолил)-2-метил-2-бутиламино]этанол, 1-[2 Н-5-гидрокси-3-оксо-4 Н-1,4-бензоксазин-8-ил]-2-[3(4-N,N-диметиламинофенил)-2-метил-2-пропиламино]этанол, 1-[2 Н-5-гидрокси-3-оксо-4 Н-1,4-бензоксазин-8-ил]-2-[3-(4-метоксифенил)-2-метил-2-пропиламино]этанол,1-[2 Н-5-гидрокси-3-оксо-4 Н-1,4 бензоксазин-8-ил]-2-[3-(4-н-бутилоксифенил)-2-метил-2-пропиламино]этанол, 1-[2 Н-5-гидрокси-3-оксо 4 Н-1,4-бензоксазин-8-ил]-2-4-[3-(4-метоксифенил)-1,2,4-триазол-3-ил]-2-метил-2-бутиламиноэтанол,5-гидрокси-8-(1-гидрокси-2-изопропиламинобутил)-2 Н-1,4-бензоксазин-3-(4 Н)-он, 1-(4-амино-3-хлор-5 трифторметилфенил)-2-трет-бутиламино)этанол,1-(4-этоксикарбониламино-3-циано-5-фторфенил)-2(трет-бутиламино)этанол и N-[2-гидрокси-5-(1-гидрокси-2-2-[4-(2-гидрокси-2-фенилэтиламино)фенил]этиламиноэтил)фенил]формамид, необязательно в виде их рацематов, энантиомеров, диастереомеров и необязательно в виде фармакологически приемлемых кислотно-аддитивных солей и гидратов. В следующем предпочтительном варианте изобретение относится к применению солей тиотропия 1 для приготовления лекарственного средства, предназначенного для поддерживающей терапии при персистирующей астме средней тяжести и для предупреждения проявления бронхо-обструктивных симптомов у пациентов с генотипом Arg/Arg кодона 16 (хромосома 5), которые уже проходят курс поддерживающей регуляторной терапии ингалируемыми кортикостероидами и длительно действующими 2 агонистами, выбранными из группы, включающей фенотерол,формотерол, салметерол, CHF-4226 (ТА 2005 или кармотерол), 3-(4-6-[2-гидрокси-2-(4-гидрокси-3-гидроксиметилфенил)-этиламино]гексилоксибутил)бензолсульфонамид,5-[2-(5,6-диэтилиндан-2-иламино)-1-гидроксиэтил]-8-гидрокси-1Hхинолин-2-он,1-[3-(4-метоксибензиламино)-4-гидроксифенил]-2-[4-(1-бензимидазолил)-2-метил-2 бутиламино]этанол,1-[2 Н-5-гидрокси-3-оксо-4 Н-1,4-бензоксазин-8-ил]-2-[3-(4-N,N-диметиламинофенил)-2-метил-2-пропиламино]этанол, 1-[2 Н-5-гидрокси-3-оксо-4 Н-1,4-бензоксазин-8-ил]-2-[3-(4-метоксифенил)-2-метил-2-пропиламино]этанол,1-[2 Н-5-гидрокси-3-оксо-4 Н-1,4-бензоксазин-8-ил]-2-[3-(4-нбутилоксифенил)-2-метил-2-пропиламино]этанол, 1-[2 Н-5-гидрокси-3-оксо-4 Н-1,4-бензоксазин-8-ил]-24-[3-(4-метоксифенил)-1,2,4-триазол-3-ил]-2-метил-2-бутиламиноэтанол иN-[2-гидрокси-5-(1 гидрокси-2-2-[4-(2-гидрокси-2-фенилэтиламино)фенил]этиламиноэтил)фенил]формамид, необязательно в виде их рацематов, энантиомеров, диастереомеров и необязательно в виде фармакологически приемлемых кислотно-аддитивных солей и гидратов. Среди вышеуказанных бетамиметиков особенно предпочтительны формотерол, салметерол, CHF-4226 (ТА 2005 или кармотерол), 3-(4-6-[2-гидрокси-2-(4 гидрокси-3-гидроксиметилфенил)этиламино]гексилоксибутил)бензолсульфонамид,5-[2-(5,6-диэтилиндан-2-иламино)-1-гидроксиэтил]-8-гидрокси-1H-хинолин-2-он и N-[2-гидрокси-5-(1-гидрокси-2-2-[4(2-гидрокси-2-фенилэтиламино)фенил]этиламиноэтил)фенил]формамид, необязательно в виде их рацематов, энантиомеров, диастереомеров и необязательно в виде их фармакологически приемлемых кислотно-аддитивных солей и их гидратов. В качестве примеров фармакологически приемлемых кислотно-аддитивных солей 2-агонистов в соответствии с изобретением можно назвать фармацевтически приемлемые соли, выбранные из солей соляной кислоты, бромисто-водородной кислоты, серной кислоты, фосфорной кислоты, метансульфоно-5 015353 вой кислоты, уксусной кислоты, фумаровой кислоты, янтарной кислоты, молочной кислоты, лимонной кислоты, винной кислоты, 1-гидрокси-2-нафталинкарбоновой кислоты, 4-фенилкоричной кислоты, 5(2,4-дифторфенил)салициловой кислоты и малеиновой кислоты. В некоторых случаях для получения солей 2-агонистов можно также использовать смеси указанных кислот. Предпочтительны в соответствии с изобретением соли 2-агонистов, выбранные из группы, включающей гидрохлорид, гидробромид, сульфат, фосфат, фумарат, метансульфонат, 4-фенилциннамат, 5(2,4-дифторфенил)салицилат, малеат и ксинафоат. В случае салметерола к наиболее предпочтительным его солям относятся соли из группы, включающей гидрохлорид, сульфат, 4-фенилциннамат, 5-(2,4 дифторфенил)салицилат и ксинафоат, среди которых особое значение имеют 4-фенилциннамат, 5-(2,4 дифторфенил)салицилат и прежде всего ксинафоат. В случае формотерола к наиболее предпочтительным его солям относятся соли из группы, включающей гидрохлорид, сульфат, гемифумарат и фумарат, среди которых особо предпочтительны гидрохлорид, гемифумарат и фумарат. Особое значение согласно изобретению имеет дигидрат фумарата формотерола или гидрат гемифумарата формотерола. При любом упоминании в настоящем описании 2-агонистов подразумеваются также их соответствующие энантиомеры или их смеси. В еще одном варианте изобретение относится к применению солей тиотропия 1 для приготовления лекарственного средства, предназначенного для лечения персистирующей астмы средней тяжести у детей-пациентов, предпочтительно у детей моложе 14 лет, более предпочтительно моложе 10 лет, особенно предпочтительно моложе 8 лет, наиболее предпочтительно моложе 6 лет. В особенно предпочтительном варианте возраст детей составляет менее 5 лет. Еще одним объектом настоящего изобретения является указанное выше применение солей тиотропия 1, при котором их вводят в организм в дозировке, которая из расчета на один прием в предпочтительном варианте составляет от 1 до 20 мкг, более предпочтительно от 2 до 15 мкг тиотропия 1'. Следующим объектом настоящего изобретения является указанное выше применение солей тиотропия 1, при котором их вводят в организм в дозировке, которая из расчета на один прием составляет от 5 до 10 мкг тиотропия 1'. Другим объектом настоящего изобретения является указанное выше применение, при котором соли тиотропия 1 вводят в организм однократно или дважды в день, предпочтительно однократно в день. Следующим объектом настоящего изобретения является указанное выше применение, при котором соли тиотропия 1 вводят в организм утром или вечером. Предлагаемое в изобретении применение солей тиотропия 1 предусматривает также их применение в виде образуемых ими сольватов и гидратов, предпочтительно гидратов, наиболее предпочтительно моногидратов. На основании приведенных выше количеств тиотропия 1', соответствующих его содержанию в качестве действующего вещества в разовой дозе, можно легко рассчитать соответствующие количества,например, тиотропийбромида и/или моногидрата тиотропийбромида. Соли тиотропия 1 согласно изобретению предпочтительно вводить в организм путем ингаляции. Для этого соли тиотропия 1 необходимо перерабатывать в ингалируемые лекарственные формы. В качестве примера таких ингалируемых лекарственных форм можно назвать ингаляционные порошки, дозированные аэрозоли с пропеллентом или ингаляционные растворы без пропеллента. Ингаляционные порошки согласно изобретению содержат соли тиотропия 1 необязательно в смеси с физиологически безвредными вспомогательными веществами. В соответствии с настоящим изобретением под выражением"ингаляционные растворы без пропеллента" подразумеваются также концентраты или стерильные, готовые к применению ингаляционные растворы. Подобные используемые согласно настоящему изобретению лекарственные формы более подробно рассмотрены в последующей части описания. Предпочтительны согласно изобретению ингаляционные порошки с содержанием тиотропия от 0,01 до 2%. Более предпочтительны для предлагаемого в изобретении применения ингаляционные порошки,содержащие тиотропий в количестве от примерно 0,03 до 1%, предпочтительно от 0,05 до 0,6%, наиболее предпочтительно от 0,06 до 0,3%. Особое значение согласно изобретению имеют далее ингаляционные порошки с содержанием тиотропия примерно от 0,08 до 0,22%. Указанные выше данные о содержании тиотропия относятся к количеству содержащегося в порошке тиотропий-катиона. Используемые в предусмотренных настоящим изобретением целях вспомогательные вещества получают путем соответствующего размола и/или просеивания традиционными, известными из уровня техники методами. В некоторых случаях применяемые согласно изобретению вспомогательные вещества могут также представлять собой их смеси, получаемые смешением между собой разных фракций одного и того же вспомогательного вещества с разным средним размером его частиц. В качестве примера физиологически безвредных вспомогательных веществ, которые могут использоваться для получения ингаляционных порошков, применяемых для изготовления содержащих их предлагаемых в изобретении капсул (ингалеток), можно назвать моносахариды (например, глюкозу, фруктозу или арабинозу), дисахариды (например, лактозу, сахарозу, мальтозу, трегалозу), олиго- и полисахариды(например, декстраны, декстрины, мальтодекстрин, крахмал, целлюлозу), полиспирты (например, сор-6 015353 бит, маннит, ксилит), циклодекстрины (например, -циклодекстрин, -циклодекстрин, -циклодекстрин,метилциклодекстрин, гидроксипропилциклодекстрин), аминокислоты (например, гидрохлорид аргинина) или же соли (например, хлорид натрия, карбонат кальция) либо смеси указанных вспомогательных веществ. Предпочтительно применять моно- или дисахариды, при этом особенно предпочтительно применение лактозы или глюкозы, прежде всего, но не исключительно, в форме их гидратов. Особенно предпочтительно согласно изобретению применять в качестве вспомогательного вещества лактозу. Максимальный средний размер частиц используемых в предлагаемых в изобретении ингаляционных порошках вспомогательных веществ достигает 250 мкм, предпочтительно составляет от 10 до 150 мкм, наиболее предпочтительно от 15 до 80 мкм. При определенных условиях может оказаться целесообразным примешивать к указанным выше вспомогательным веществам их же фракции с меньшим средним размером частиц, составляющим от 1 до 9 мкм. Подобные вспомогательные вещества с меньшим размером частиц также выбирают из описанной выше группы вспомогательных веществ, применяемых в ингаляционных порошках. Средний размер частиц можно определять известными из уровня техники методами (см., например, WO 02/30389, разделы А и С). После приготовления смеси вспомогательных веществ к ней для получения предлагаемых в изобретении ингаляционных порошков примешивают микронизированный кристаллический ангидрат тиотропийбромида со средним размером частиц предпочтительно от 0,5 до 10 мкм, наиболее предпочтительно от 1 до 5 мкм (см., например, WO 02/30389, раздел В). Методы размола и микронизации действующих веществ известны из уровня техники. Если в качестве вспомогательного вещества не используется специально приготовленная смесь вспомогательных веществ, то наиболее предпочтительно применять вспомогательные вещества в виде частиц, средний размер которых составляет от 10 до 50 мкм и среди которых 10% приходится на долю мелкой фракции, в которой крупность частиц составляет от 0,5 до 6 мкм. При этом под средним размером (или средней крупностью) частиц в данном контексте подразумевается размер 50% всех частиц, объемное распределение которых по крупности определяли с помощью лазерного дифрактометра методом сухого диспергирования. Средний размер частиц можно определять известными из уровня техники методами (см., например, WO 02/30389, разделы А и С). Аналогичным образом под мелкой фракцией, на долю которой приходится 10%, в данном контексте подразумевается фракция, составляющая 10% от всего количества частиц, объемное распределение которых по крупности определяли с помощью лазерного дифрактометра. Иными словами, под мелкой фракцией, на долю которой приходится 10%, согласно настоящему изобретению имеется в виду фракция частиц с размером, который имеют не более 10% частиц от всего их количества (в пересчете на их объемное распределение по крупности). В соответствии с настоящим изобретением приведенные в процентах данные во всех случаях, если конкретно не указано иное, представляют собой массовые проценты (мас.%). В наиболее предпочтительных ингаляционных порошках используют вспомогательное вещество со средним размером частиц от 12 до 35 мкм, особенно предпочтительно от 13 до 30 мкм. Наиболее предпочтительны далее прежде всего те ингаляционные порошки, в которых размер частиц вспомогательного вещества в мелкой фракции, на долю которой приходится 10% от всего количества частиц вспомогательного вещества, составляет примерно от 1 до 4 мкм, предпочтительно примерно от 1,5 до 3 мкм. Одна из отличительных особенностей предлагаемых в изобретении ингаляционных порошков состоит в соответствии с положенной в основу изобретения задачей в возможности их введения в организм со стабильно высокой точностью однократной дозировки. При этом колебания вводимых за один раз количеств ингаляционного порошка составляют менее 8%, предпочтительно менее 6%, наиболее предпочтительно менее 4% от номинального количества. После отмеривания взвешиванием необходимых порций исходных материалов из вспомогательного вещества и действующего вещества с использованием известных из уровня техники методов приготавливают ингаляционный порошок. При этом можно сослаться, например, на публикацию WO 02/30390. В соответствии с этим предлагаемые в изобретении ингаляционные порошки можно получать, например,описанным ниже методом. В рассмотренных ниже методахполучения ингаляционных порошков указанные компоненты применяют в массовых количествах, которые соответствуют количествам, указанным выше при описании составов ингаляционных порошков. Сначала в соответствующий смеситель загружают вспомогательное вещество и действующее вещество. Средний размер частиц используемого действующего вещества составляет от 0,5 до 10 мкм, предпочтительно от 1 до 6 мкм, наиболее предпочтительно от 2 до 5 мкм. Действующее вещество и вспомогательное вещество предпочтительно подавать в смеситель через сито или ситовый гранулятор с размером отверстий сита от 0,1 до 2 мм, более предпочтительно от 0,3 до 1 мм, наиболее предпочтительно от 0,3 до 0,6 мм. При этом в смеситель предпочтительно сначала загружать вспомогательное вещество, а затем подавать в смеситель действующее вещество. При такой технологии смешения оба компонента предпочтительно подавать отдельными порциями. При этом наиболее предпочтительным является поочередная подача в смеситель обоих компонентов путем их послойного просеивания в него. Вспомогательное вещество можно смешивать с действующим веществом уже в процессе подачи обоих этих компонентов в смеситель. Более предпочтительно, однако, начинать смешение обоих компонентов только по-7 015353 завершении их послойного просеивания в смеситель. Настоящее изобретение относится также к применению предлагаемых в нем ингаляционных порошков для приготовления фармацевтической композиции, предназначенной для лечения указанной выше тяжелой персистирующей астмы. Предлагаемые в изобретении ингаляционные порошки можно вводить в организм, например, с помощью ингаляторов, в которых разовая доза из расходной емкости выдается с помощью дозирующей камеры (например, согласно US 4570630) или с помощью других устройств (например, согласно DE 3625685). Предпочтительно, однако, расфасовывать предлагаемые в изобретении ингаляционные порошки в капсулы (с получением так называемых ингалеток), которые применяются в ингаляторах, описанных, например, в WO 94/28958. Для введения в организм предлагаемых в изобретении ингаляционных порошков из содержащих их капсул наиболее предпочтительно использовать ингалятор, показанный, например, на фиг. 1 в публикации WO 03/084502 А 1, которая включена в настоящее описание в качестве ссылки. Подобный ингалятор отличается наличием корпуса 1 с двумя окошками 2, пластинчатой перегородки 3, в которой предусмотрены впускные отверстия для воздуха и которая снабжена сеткой 5, удерживаемой в собранном состоянии соответствующим крепежным элементом 4, соединенной с пластинчатой перегородкой 3 камеры 6, в которую помещается капсула с ингаляционным порошком и сбоку которой предусмотрена нажимная кнопка 9, снабженная двумя заточенными иглами 7 и выполненная подвижной против усилия пружины 8, мундштука 12, который выполнен откидным с возможностью поворота вокруг оси 10, соединяющей его с корпусом 1, пластинчатой перегородкой 3 и колпачком 11, и сквозных отверстий 13 для прохода воздуха, служащих для регулирования аэрогидродинамического сопротивления. При расфасовывании предлагаемых в изобретении содержащих кристаллический тиотропийбромид ингаляционных порошков в капсулы наиболее предпочтительно использовать капсулы, материал которых выбирают из группы синтетических полимеров, особенно предпочтительно из группы, включающей полиэтилен, поликарбонат, сложные полиэфиры, полипропилен и полиэтилентерефталат. Наиболее предпочтительным синтетическим полимером в качестве материала для изготовления капсул является полиэтилен, поликарбонат или полиэтилентерефталат. При изготовлении капсул из полиэтилена, который является одним из предпочтительных согласно изобретению материалов, предпочтительно применять полиэтилен с плотностью от 900 до 1000 кг/м 3, более предпочтительно от 940 до 980 кг/м 3, наиболее предпочтительно примерно от 960 до 970 кг/м 3 (полиэтилен высокой плотности). Подобные полимерные материалы при изготовлении из них капсул можно согласно изобретению перерабатывать разнообразными, известными из уровня техники методами. Предпочтительным согласно изобретению методом переработки полимеров является литье под давлением. При изготовлении капсул литьем под давлением согласно наиболее предпочтительному варианту не используют антиадгезионные смазки для извлечения капсул из формы. Для подобного метода изготовления капсул характерна хорошо отработанная на практике технология и особо высокая воспроизводимость. Еще одним объектом настоящего изобретения являются описанные выше капсулы, содержащие предлагаемый в изобретении ингаляционный порошок, описанный выше. Содержание ингаляционного порошка в таких капсулах может составлять примерно от 1 до 20 мг, предпочтительно примерно от 3 до 15 мг, наиболее предпочтительно примерно от 4 до 12 мг. Предпочтительные согласно изобретению капсулы содержат от 4 до 6 мг ингаляционного порошка. Равным образом предпочтительны согласно изобретению и капсулы для ингаляции, содержащие предлагаемые в изобретении порошковые композиции в количестве от 8 до 12 мг. Настоящее изобретение относится далее к применению описанных выше капсул, содержащих предлагаемые в изобретении ингаляционные порошки, для приготовления фармацевтической композиции,предназначенной для лечения описанной выше персистирующей астмы средней тяжести. Заполненные предлагаемыми в изобретении ингаляционными порошками капсулы изготавливают известными из уровня техники методами путем расфасовывания предлагаемых в изобретении ингаляционных порошков в пустые капсулы. Примеры ингаляционных порошков Ниже изобретение более подробно рассмотрено на примерах, при этом, однако, объем изобретения не ограничен представленными в этих примерах конкретными вариантами его осуществления. В рассмотренных ниже примерах содержание действующего вещества в порошковой смеси указано в пересчете на ее порцию массой 5,5 мг. Исходя из концентраций, приведенных ниже в примерах порошковых фармацевтических композиций, можно также приготавливать порошки с большей массой одной их порции. Помимо действующего вещества порошковая смесь содержит только указанное в примерах вспомогательное вещество. Порошки, состав которых указан в приведенных ниже примерах, можно расфасовывать в капсулы для ингаляции из них с помощью соответствующих ингаляторов. В другом варианте для введения в организм порошков, состав которых указан в приведенных ниже примерах, можно использовать многодозовые ингаляторы сухих порошков (МДИСП). Подобные МДИСП подразделяются на ингаляторы, в которых порошок содержится в предварительно разделенном на разовые дозы виде, и на дозирующие ингаляторы, которые сами дозируют порошок из находящейся в них емкости. Соответст-8 015353 вующие устройства известны из уровня техники. Пример композиции 1. Лактоза содержит 5% специально добавленной к ней мелкой фракции микронизированного моногидрата лактозы со средним размером частиц примерно 4 мкм. Пример композиции 6. Лактоза содержит 5% специально добавленной к ней мелкой фракции микронизированного моногидрата лактозы со средним размером частиц примерно 4 мкм. Пример композиции 7. Лактоза содержит 5% специально добавленной к ней мелкой фракции микронизированного моногидрата лактозы со средним размером частиц примерно 4 мкм. Суспензии с пропеллентом для аэрозольной ингаляции Соль тиотропия при необходимости можно также вводить в организм в составе содержащих пропеллент лекарственных форм для аэрозольной ингаляции. Для применения в этих целях наиболее пригодны суспензии для аэрозольной ингаляции. В соответствии с этим настоящее изобретение относится также к суспензиям предлагаемого в изобретении кристаллического тиотропийбромида в пропеллентах HFA 227 и/или HFA 134 а, необязательно в смеси с еще одним либо несколькими другими пропеллентами, предпочтительно выбранными из группы, включающей пропан, бутан, пентан, диметиловый эфир, CHClF2, CH2F2, CF3CH3, изобутан, изопентан и неопентан. Согласно изобретению предпочтительны суспензии, которые в качестве пропеллента содержат только HFA 227, смесь из HFA 227 и HFA 134 а либо только HFA 134 а. При использовании в предлагаемых в изобретении композициях в виде суспензий смеси пропеллентов HFA 227 и HFA 134 а соотношение по массе между обоими этими компонентами может варьироваться произвольно. При использовании в предлагаемых в изобретении композициях в виде суспензий наряду с пропеллентами HFA 227 и/илиHFA 134 а еще одного либо нескольких других пропеллентов, выбранных из группы, включающей пропан, бутан, пентан, диметиловый эфир, CHClF2, CH2F2, CF3CH3, изобутан, изопентан и неопентан, на долю этих других пропеллентов предпочтительно должно приходиться менее 50%, более предпочтительно менее 40%, наиболее предпочтительно менее 30%. Предлагаемые в изобретении суспензии в предпочтительном варианте должны содержать тиотропийбромид в таком количестве, которое соответствует содержанию тиотропий-катиона от 0,001 до 0,8%,более предпочтительно от 0,08 до 0,5%, наиболее предпочтительно от 0,2 до 0,4%. В соответствии с настоящим изобретением приведенные в процентах данные, если не указано иное,всегда представляют собой массовые проценты (мас.%). В некоторых случаях в настоящем описании вместо понятия "суспензия" используется также понятие "композиция в виде суспензии". Оба эти понятия в соответствии с изобретением являются равнозначными. В состав предлагаемых в изобретении содержащих пропеллент композиций для аэрозольной ингаляции, соответственно композиций в виде суспензий могут входить и иные компоненты, такие как поверхностно-активные вещества (ПАВ), адъюванты, антиокислители или вкусовые вещества.-9 015353 Включаемые в некоторых случаях в состав предлагаемых в изобретении суспензий поверхностноактивные вещества предпочтительно выбирать из группы, включающей полисорбат 20, полисорбат 80,мивацет (Myvacet) 9-45, мивацет 9-08, изопропилмиристат, олеиновую кислоту, пропиленгликоль, полиэтиленгликоль, бридж (Brij), этилолеат, глицерилгриолеат, глицерилмонолаурат, глицерилмоноолеат,глицерилмоностеарат, глицерилмонорицинолеат, цетиловый спирт, стеариловый спирт, цетилпиридинийхлорид, блоксополимеры, природное масло, этанол и изопропанол. Из числа вышеуказанных вспомогательных веществ в суспензиях предпочтительно использовать полисорбат 20, полисорбат 80, мивацет 9-45, мивацет 9-08 или изопропилмиристат. Наиболее предпочтительно применение мивацета 9-45 или изопропилмиристата. При включении в состав предлагаемых в изобретении суспензий поверхностно-активных веществ их содержание предпочтительно должно составлять от 0,0005 до 1%, наиболее предпочтительно от 0,005 до 0,5%. Включаемые в некоторых случаях в состав предлагаемых в изобретении суспензий адъюванты предпочтительно выбирать из группы, включающей аланин, альбумин, аскорбиновую кислоту, аспартам,бетаин, цистеин, фосфорную кислоту, азотную кислоту, соляную кислоту, серную кислоту и лимонную кислоту. Более предпочтительно при этом использовать аскорбиновую кислоту, фосфорную кислоту,соляную кислоту или лимонную кислоту, среди которых наиболее предпочтительна соляная кислота или лимонная кислота. При включении в состав предлагаемых в изобретении суспензий адъювантов их содержание предпочтительно должно составлять от 0,0001 до 1,0%, более предпочтительно до 0,0005 до 0,1%, особенно предпочтительно от 0,001 до 0,01%, а наиболее предпочтительный согласно изобретению интервал значений содержания адъювантов составляет от 0,001 до 0,005%. Включаемые в некоторых случаях в состав предлагаемых в изобретении суспензий антиокислители предпочтительно выбирать из группы, включающей аскорбиновую кислоту, лимонную кислоту, эдетат натрия, эдитиновую кислоту, токоферолы, бутилгидрокситолуол, бутилгидроксианизол и аскорбилпальмитат, из числа которых наиболее предпочтительно использовать токоферолы, бутилгидрокситолуол,бутилгидроксианизол или аскорбилпальмитат. Включаемые в некоторых случаях в состав предлагаемых в изобретении суспензий вкусовые вещества или добавки предпочтительно выбирать из группы, включающей мяту перечную, сахарин, Dentomint, аспартам и эфирные масла (например, коричное, анисовое, ментоловое, камфорное), из числа которых наиболее предпочтительно использовать, например, мяту перечную или Dentomint. Учитывая, что предлагаемые в изобретении суспензии предполагается вводить в организм путем ингаляции, содержащиеся в них действующие вещества должны быть представлены в высокодисперсной форме. Для этого предлагаемый в изобретении кристаллический тиотропийбромид либо подвергают размолу (микронизируют), либо непосредственно получают в высокодисперсной форме известными из уровня техники методами. Методы микронизации действующих веществ известны из уровня техники. Средний размер частиц действующего вещества после его микронизации предпочтительно должен составлять от 0,5 до 10 мкм, более предпочтительно от 1 до 6 мкм, наиболее предпочтительно от 1,5 до 5 мкм. В предпочтительном варианте размеры по меньшей мере 50%, более предпочтительно по меньшей мере 60%, наиболее предпочтительно по меньшей мере 70% частиц действующего вещества должны лежать в указанном выше интервале значений. В наиболее предпочтительном варианте размеры по меньшей мере 80%, особенно предпочтительно по меньшей мере 90% частиц действующих веществ должны лежать в указанных выше интервалах значений. Еще одним объектом изобретения являются суспензии, которые содержат только одно из предлагаемых в изобретении действующих веществ и не содержат никаких других добавок. Предлагаемые в изобретении суспензии можно получать известными из уровня техники методами. В соответствии с ними компоненты суспензии смешивают с пропеллентом или пропеллентами (при необходимости при низких температурах) и затем полученную суспензию расфасовывают в соответствующие емкости. Для введения в организм описанных выше предлагаемых в изобретении суспензий с пропеллентом могут использоваться известные из уровня техники ингаляторы (находящиеся под давлением ингаляторы с дозировочной шкалой, дИДШ). В соответствии с этим еще одним объектом настоящего изобретения являются фармацевтические композиции в виде описанных выше суспензий в сочетании с одним или несколькими пригодными для их введения в организм ингаляторами. Еще одним объектом настоящего изобретения являются ингаляторы, отличающиеся тем, что они содержат описанные выше предлагаемые в изобретении суспензии с пропеллентом. Настоящее изобретение относится также к емкостям (сменным баллончикам), которые будучи оснащены соответствующим клапаном могут использоваться в соответствующем ингаляторе и которые содержат одну из описанных выше предлагаемых в изобретении суспензий с пропеллентом. Подобные емкости (сменные баллончики) и способы их заполнения предлагаемыми в изобретении суспензиями с пропеллентом известны из уровня техники.- 10015353 С учетом фармацевтической эффективности тиотропия настоящее изобретение относится далее к применению предлагаемых в нем суспензий для получения вводимой в организм путем ингаляции или назально фармацевтической композиции, предпочтительно для получения фармацевтической композиции, предназначенной для ингаляционного или назального лечения заболеваний, при которых антихолинергические средства способны проявлять терапевтический эффект. В особенно предпочтительном варианте настоящее изобретение относится далее к применению предлагаемых в нем суспензий для получения фармацевтической композиции, предназначенной для ингаляционного лечения описанной выше персистирующей астмы средней тяжести. Ниже настоящее изобретение более подробно поясняется на примерах, которые носят исключительно иллюстративный характер и не ограничивают его объем. Примеры композиций в виде суспензий для аэрозольной ингаляции Ниже представлены примеры суспензий, содержащих наряду с действующим веществом и пропеллентом другие компоненты. Пример композиции 8. Ниже представлены примеры суспензий, содержащих только действующее вещество и пропеллент. Пример композиции 17. Композиции для аэрозольной ингаляции без пропеллента Предлагаемые в изобретении соли тиотропия 1 особенно предпочтительно использовать для приготовления на их основе ингаляционных растворов и ингаляционных суспензий без пропеллента. В качестве таких растворов могут использоваться водные или спиртовые, предпочтительно этанольные, растворы. Растворителем при этом может служить только вода либо смесь воды с этанолом. Относительное содержание этанола в пересчете на количество воды не ограничено какими-либо конкретными пределами, предпочтительно, однако, чтобы максимальное содержание этанола составляло до 70 об.%, прежде всего до 60 об.%, наиболее предпочтительно до 30 об.%. Остальное количество, недостающее до 100 об.%, приходится на воду. Значение рН растворов или суспензий, содержащих соли тиотропия 1, устанавливают с помощью пригодных для этой цели кислот на 2-7, предпочтительно на 2-5. Более предпочтительно устанавливать значение рН ингаляционных растворов или суспензий на 2,8-3,05, предпочтительно на 2,85-3,0, наиболее предпочтительно на 2,9. Для регулирования значения рН с целью его установки на указанные выше значения могут использоваться кислоты из числа неорганических или органических кислот. В качестве примера предпочти- 12015353 тельных в этом отношении неорганических кислот можно назвать соляную кислоту, бромистоводородную кислоту, азотную кислоту, серную кислоту и/или фосфорную кислоту. В качестве примера наиболее пригодных для применения в указанных целях органических кислот можно назвать аскорбиновую кислоту, лимонную кислоту, яблочную кислоту, винную кислоту, малеиновую кислоту, янтарную кислоту, фумаровую кислоту, уксусную кислоту, муравьиную кислоту и/или пропионовую кислоту, а также другие кислоты. Предпочтительными неорганическими кислотами являются соляная кислота и серная кислота. Возможно также использование кислот, которые с одним из действующих веществ уже образуют кислотно-аддитивную соль. Среди органических кислот предпочтительны аскорбиновая кислота, фумаровая кислота и лимонная кислота. При определенных условиях допустимо использование и смесей указанных кислот, прежде всего в случае тех кислот, которые наряду с их повышающими кислотность свойствами обладают и иными свойствами, например могут использоваться в качестве вкусовых веществ, антиокислителей или комплексообразователей, как, например, лимонная кислота или аскорбиновая кислота. Для регулирования значения рН согласно изобретению наиболее предпочтительно использовать соляную кислоту. Согласно изобретению можно отказаться от включения в состав ингаляционных растворов или суспензий эдитиновой кислоты (ЭДТК) или одной из ее известных солей, в частности эдетата натрия, в качестве стабилизатора или комплексообразователя. Однако в других вариантах предусматривается использование этого(их) соединения(ий). В одном из таких предпочтительных вариантов, в котором предусмотрено применение эдетата натрия, его концентрация в растворе составляет менее 100 мг на 100 мл,предпочтительно менее 50 мг на 100 мл, наиболее предпочтительно менее 20 мг на 100 мл. В целом же предпочтительны ингаляционные растворы, содержание в которых эдетата натрия составляет от 0 до 10 мг на 100 мл. К ингаляционным растворам без пропеллента можно добавлять сорастворители и/или другие вспомогательные вещества. В качестве таких сорастворителей предпочтительно использовать таковые, которые содержат гидроксильные группы или иные полярные группы, например спирты, прежде всего изопропиловый спирт, гликоли, прежде всего пропиленгликоль, полиэтиленгликоль, полипропиленгликоль,гликолевый эфир, глицерин, полиоксиэтиленовые спирты и эфиры полиоксиэтилена и жирных кислот. Под вспомогательными веществами и добавками в данном контексте подразумевается любое фармакологически приемлемое вещество, которое не является действующим веществом, но которое можно включать в состав препарата совместно с действующим(и) веществом(ами) в фармакологически приемлемом растворителе для улучшения качественных характеристик такого препарата. Эти вещества не должны проявлять никакого или с учетом целевого терапевтического эффекта никакого сколько-нибудь значительного или по меньшей мере никакого нежелательного фармакологического действия. К подобным вспомогательным веществам и добавкам относятся, например, поверхностно-активные вещества, такие как соевый лецитин, олеиновая кислота, сорбитановый эфир, в частности полисорбаты, поливинилпирролидон, прочие стабилизаторы, комплексообразователи, антиокислители и/или консерванты, обеспечивающие сохранность готового лекарственного препарата или позволяющие продлить срок его годности,вкусовые вещества, витамины и/или иные известные из уровня техники добавки. К таким добавкам относятся также фармакологически приемлемые соли, такие, например, как хлорид натрия, в качестве придающих изотоничность агентов. К числу предпочтительных вспомогательных веществ относятся антиокислители, такие, например,как аскорбиновая кислота, если только она уже не используется для регулирования значения рН, витамин А, витамин Е, токоферолы и аналогичные встречающиеся в организме человека витамины и провитамины. Консерванты могут использоваться для защиты лекарственного препарата от заражения патогенными микроорганизмами. В качестве подобных консервантов могут использоваться известные из уровня техники вещества, прежде всего цетилпиридинийхлорид, бензалконийхлорид или бензойная кислота,соответственно бензоаты, такие как бензоат натрия. Особое значение имеет при этом применение бензалконийхлорида в концентрациях, составляющих до 50 мг на 100 мл раствора, более предпочтительно от 5 до 20 мг на 100 мл раствора, наиболее предпочтительно от 8 до 15 мг на 100 мл раствора. Предпочтительные лекарственные препараты помимо растворителя, которым является вода, и солей тиотропия 1, содержат также только бензалконийхлорид и эдетат натрия. В другом предпочтительном варианте предлагается полностью отказаться от применения эдетата натрия. Для введения в организм ингаляционных растворов без пропеллента, которые могут применяться согласно настоящему изобретению для лечения персистирующей астмы средней тяжести, наиболее пригодны такие ингаляторы, которые позволяют в течение нескольких секунд распылять небольшое количество жидкого препарата в терапевтически необходимой дозировке в виде аэрозоля, вводимого в организм ингаляцией в терапевтических целях. Согласно настоящему изобретению предпочтительны ингаляторы,которые в оптимальном случае уже при однократном приведении их в действие (за один ход поршня) позволяют выдавать распыляемый в виде аэрозоля со средним размером капелек менее 20 мкм, предпочтительно менее 10 мкм, раствор действующего вещества или действующих веществ порцией менее 100 мкл, предпочтительно менее 50 мкл, наиболее предпочтительно от 10 до 30 мкл, таким образом, чтобы ингалируемая, т.е. непосредственно попадающая в дыхательные пути, доля аэрозоля уже соответствова- 13015353 ла терапевтически эффективному количеству действующего вещества или действующих веществ. Подобное устройство, предназначенное для ингаляционного введения в организм жидкой фармацевтической композиции, распыляемой в дозированных количествах в виде аэрозоля без помощи пропеллента, подробно рассмотрено, например, в публикации WO 91/14468, а также в публикации WO 97/12687 (в частности, представлено на фиг. 6 а и 6b приложенных к этой публикации чертежей). Описанные в указанных публикациях распылители или ингаляторы (устройства) известны также под названием Respimat. Концентрация соли тиотропия в пересчете на долю тиотропия в готовом лекарственном препарате зависит от требуемого терапевтического эффекта. При большинстве заболеваний, поддающихся лечению тиотропием, его используют в концентрации от 0,01 до 0,06 г на 100 мл лекарственного препарата. Более предпочтительно использовать тиотропий в количестве от 0,015 до 0,055 г на 100 мл лекарственного препарата, особенно предпочтительно от 0,02 до 0,05 г на 100 мл лекарственного препарата. Наиболее же предпочтительно согласно настоящему изобретению использовать тиотропий в количестве от 0,023 0,001 до 0,0450,001 г на 100 мл лекарственного препарата. Примеры композиций для аэрозольной ингаляции без пропеллента В приведенной ниже таблице содержание компонентов указано в пересчете на 100 мл лекарственного препарата. Примечание: указанное количество тиотропия относится к содержанию тиотропий-катиона,представляющего собой активное начало в составе тиотропийбромида, 1 мг тиотропия соответ ствует 1,2494 мг моногидрата тиотропийбромида Оставшимся компонентом лекарственных препаратов в примерах 23-28 является очищенная вода или вода для инъекций с плотностью 1,00 г/см 3 при температуре от 15 до 31 С. При использовании ингалятора Respimat для введения в организм представленных выше лекарственных препаратов выдаваемая при двукратном его приведении в действие порция лекарственного препарата составляет 22,1 мкл. В соответствии с этим доза тиотропия (в пересчете на тиотропий-катион) при двукратном аэрозольном распылении лекарственных препаратов из примеров 23, 25 и 27 с помощью такого ингалятора составляет 5 мкг. При двукратном же аэрозольном распылении лекарственных препаратов из примеров 24, 26 и 28 с помощью подобного ингалятора доза тиотропия (в пересчете на тиотропийкатион) составляет 10 мкг. В зависимости от состояния пациента лекарственный препарат можно также вводить в организм с помощью указанного ингалятора, например, подряд 3 или 4 порциями. Дополнительные примеры 33-42. Аналогично примерам 23-32, но с содержанием эдетата натрия 8 мг. Дополнительные примеры 43-52. Аналогично примерам 23-32, но с содержанием эдетата натрия 12 мг. Дополнительные примеры 53-62. Аналогично примерам 23-32, но с содержанием бензалконийхлорида 8 мг. Дополнительные примеры 63-72. Аналогично примерам 23-32, но с содержанием бензалконийхлорида 12 мг. Среди лекарственных препаратов (фармацевтических композиций) из примеров 23-32 особый интерес представляют лекарственные препараты из примеров 23-28, а наибольший интерес представляют лекарственные препараты из примеров 23 и 24.- 14015353 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение солей тиотропия 1 в которой X- обозначает однозарядный анион, предпочтительно анион, выбранный из группы, включающей хлорид, бромид, иодид, сульфат, фосфат, метансульфонат, нитрат, малеат, ацетат, цитрат, фумарат,тартрат, оксалат, сукцинат, бензоат и n-толуолсульфонат, необязательно в виде их гидратов и/или сольватов, для приготовления лекарственного средства, предназначенного для лечения пациентов, страдающих астмой со степенью тяжести 3 по классификации Глобальной стратегии лечения и профилактики бронхиальной астмы (GINA). 2. Применение по п.1 для приготовления лекарственного средства, предназначенного для лечения персистирующей астмы средней тяжести у пациентов, у которых, несмотря на лечение ингалируемыми кортикостероидами, ежедневно проявляются симптомы астмы или наблюдаются ее приступы. 3. Применение по п.1 или 2 для приготовления лекарственного средства, предназначенного для лечения персистирующей астмы средней тяжести у пациентов с генотипом Arg/Arg кодона 16 гена ADRB2(хромосома 5), у которых, несмотря на лечение ингалируемыми 2-агонистами, постоянно проявляются симптомы астмы. 4. Применение по п.1 или 2 для приготовления лекарственного средства, предназначенного для лечения персистирующей астмы средней тяжести у пациентов с генотипом Arg/Arg кодона 16 гена ADRB2(хромосома 5), у которых, несмотря на комбинированное лечение ингалируемыми кортикостероидами и длительно действующими 2-агонистами, ежедневно проявляются симптомы астмы или наблюдаются ее приступы. 5. Применение по одному из пп.1-4 для приготовления лекарственного средства, предназначенного для лечения персистирующей астмы средней тяжести у детей-пациентов. 6. Применение по одному из пп.1-5 для приготовления лекарственного средства, предназначенного для поддерживающей терапии при персистирующей астме средней тяжести и для предупреждения проявления бронхо-обструктивных симптомов у пациентов с неадекватной реакцией на поддерживающую регуляторную терапию ингалируемыми кортикостероидами и длительно действующими 2-агонистами. 7. Применение по одному из пп.1-6 для приготовления лекарственного средства, предназначенного для третичной поддерживающей регуляторной терапии персистирующей астмы средней тяжести. 8. Применение по одному из пп.1-7, при котором соли тиотропия вводят в организм в дозировке,которая из расчета на один прием предпочтительно составляет от 1 до 20 мкг тиотропия 1'.
МПК / Метки
МПК: A61K 31/381, A61P 11/06
Метки: тиотропия, астмы, персистирующей, лечения, тяжести, солей, применение, средней
Код ссылки
<a href="https://eas.patents.su/16-15353-primenenie-solejj-tiotropiya-dlya-lecheniya-persistiruyushhejj-astmy-srednejj-tyazhesti.html" rel="bookmark" title="База патентов Евразийского Союза">Применение солей тиотропия для лечения персистирующей астмы средней тяжести</a>
Предыдущий патент: Замещенные 5-фенил-3,6-дигидро-2-оксо-2h-1,3,4-тиадиазины
Следующий патент: Способ индуцирования толерантности к бактериальному заражению растений
Случайный патент: Способ изготовления эмалированной стальной подложки