Поливалентные иммуногенные композиции и способы их применения
Номер патента: 6313
Опубликовано: 27.10.2005
Авторы: Пулман Жан, Капио Карин, Бутрио Доминик, Лемуан Доминик, Десмон Пьер Мишель
Формула / Реферат
1. Поливалентная иммуногенная композиция, содержащая конъюгат белка-носителя и капсульного полисахарида или олигосахарида H. influenzae типа B, причем указанная композиция дополнительно содержит 2 или более дополнительных бактериальных полисахаридов или олигосахаридов, способных обеспечить защиту организма-хозяина против инфицирования бактериями, от которых они получены, а конъюгат капсульного полисахарида или олигосахарида H. influenzae типа B и все полисахариды или олигосахариды не адсорбированы на адъювантной соли алюминия.
2. Поливалентная иммуногенная композиция по п.1, в которой конъюгат капсульного полисахарида или олигосахарида H. influenzae типа B и все полисахариды или олигосахариды не адсорбированы на адъюванте.
3. Поливалентная иммуногенная композиция по п.1 или 2, в которой 2 или более дополнительных бактериальных полисахаридов или олигосахаридов конъюгированы с белком-носителем.
4. Поливалентная иммуногенная композиция по п.3, в которой 2 или более дополнительных бактериальных полисахаридов или олигосахаридов включают в себя капсульный полисахарид или олигосахарид N. meningitidis серогруппы A, конъюгированные с белком-носителем, и капсульный полисахарид или олигосахарид N. meningitidis серогруппы C, конъюгированные с белком-носителем.
5. Поливалентная иммуногенная композиция по п.3, в которой 2 или более дополнительных бактериальных полисахаридов или олигосахаридов включают в себя капсульный полисахарид или олигосахарид N. meningitidis серогруппы C, конъюгированный с белком-носителем, и капсульный полисахарид или олигосахарид N. meningitidis серогруппы Y, конъюгированный с белком-носителем.
6. Поливалентная иммуногенная композиция, содержащая конъюгат белка-носителя и капсульного полисахарида H. influenzae типа B, причем указанная композиция дополнительно содержит 1 или более дополнительных бактериальных полисахаридов, способных обеспечить защиту организма-хозяина против инфицирования бактериями, от которых они получены, а 1 или более дополнительные бактериальные полисахариды включают в себя капсульный полисахарид N. meningitidis серогруппы C, конъюгированный с белком-носителем, а конъюгат капсульного полисахарида H. influenzae типа B и все полисахариды не адсорбированы на адъюванте.
7. Поливалентная иммуногенная композиция по любому из пп.1 или 2, которая содержит более семи дополнительных бактериальных полисахаридов или олигосахаридов.
8. Поливалентная иммуногенная композиция по п.7, в которой дополнительные бактериальные полисахариды или олигосахариды представляют собой пневмококковые капсульные полисахариды или олигосахариды.
9. Поливалентная иммуногенная композиция по любому из пп.1-8, в которой дополнительные бактериальные полисахариды или олигосахариды выбраны из группы, состоящей из капсульного полисахарида N. meningitidis серогруппы A, капсульного полисахарида N. meningitidis серогруппы C, капсульного полисахарида N. meningitidis серогруппы Y, капсульного полисахарида N. meningitidis серогруппы W, капсульного полисахарида Streptococcus pneumoniae серотипа 1, капсульного полисахарида S. pneumoniae серотипа 2, капсульного полисахарида S. pneumoniae серотипа 3, капсульного полисахарида S. pneumoniae серотипа 4, капсульного полисахарида S. pneumoniae серотипа 5, капсульного полисахарида S. pneumoniae серотипа 6A, капсульного полисахарида S. pneumoniae серотипа 6B, капсульного полисахарида S. pneumoniae серотипа 7F, капсульного полисахарида S. pneumoniae серотипа 8, капсульного полисахарида S. pneumoniae серотипа 9N, капсульного полисахарида S. pneumoniae серотипа 9V, капсульного полисахарида S. pneumoniae серотипа 10A, капсульного полисахарида S. pneumoniae серотипа 11A, капсульного полисахарида S. pneumoniae серотипа 12F, капсульного полисахарида S. pneumoniae серотипа 14, капсульного полисахарида S. pneumoniae серотипа 15B, капсульного полисахарида S. pneumoniae серотипа 17F, капсульного полисахарида S. pneumoniae серотипа 18C, капсульного полисахарида S. pneumoniae серотипа 19A, капсульного полисахарида S. pneumoniae серотипа 19F, капсульного полисахарида S. pneumoniae серотипа 20, капсульного полисахарида S. pneumoniae серотипа 22F, капсульного полисахарида S. pneumoniae серотипа 23F, капсульного полисахарида S. pneumoniae серотипа 33F, капсульного полисахарида группы 1 стрептококка группы B, капсульного полисахарида группы II стрептококка группы B, капсульного полисахарида группы III стрептококка группы B, капсульного полисахарида группы IV стрептококка группы B, капсульного полисахарида группы V стрептококка группы B, капсульного полисахарида Staphylococcus aureus типа 5, капсульного полисахарида Staphylococcus aureus типа 8, Vi полисахарида из Salmonella typhi, липополисахарида (LPS) N. meningitidis, LPS M. catarrhalisи LPS H. influenzae или их олигосахаридов.
10. Поливалентная иммуногенная композиция по любому из пп.1-9, в которой белок-носитель (белки-носители) выбран(ы) из группы, содержащей столбнячный анатоксин, дифтерийный анатоксин, CRM197, рекомбинантный дифтерийный токсин, OMPC из N. meningitidis, пневмолизин из S. pneumoniae и белок D из H. influenzae.
11. Поливалентная иммуногенная композиция по любому из пп.1-9, в которой белок-носитель представляет собой столбнячный анатоксин.
12. Поливалентная иммуногенная композиция по п.10, в которой капсульный полисахарид или олигосахарид H. influenzae типа B и дополнительные полисахариды или олигосахариды не конъюгированы с одним и тем же носителем.
13. Поливалентная иммуногенная композиция по п.12, в которой капсульный полисахарид или олигосахарид H. influenzae типа B и дополнительные полисахариды или олигосахариды не все конъюгированы с CRM197.
14. Поливалентная иммуногенная композиция по любому из пп.1-13, в которой конъюгат белка-носителя и полисахарида или олигосахарида получен при использовании 1-цианодиметиламинопиридиния тетрафторбората (CDAP).
15. Поливалентная иммуногенная композиция по любому из пп.1-14, содержащая 0,1-10 мкг каждого полисахарида или олигосахарида.
16. Способ приготовления поливалентной иммуногенной композиции по любому из пп.1-15, включающий смешивание индивидуальных компонентов композиции.
17. Применение поливалентной иммуногенной композиции по любому из пп.1-15 в производстве лекарства для лечения или предупреждения инфекций, вызванных Haemophilus influenzae типа B.
18. Способ иммунизации человека против инфекции, вызванной Haemophilus influenzae типа B, включающий введение человеку иммунопротективной дозы поливалентной иммуногенной композиции по любому из пп.1-15.
Текст
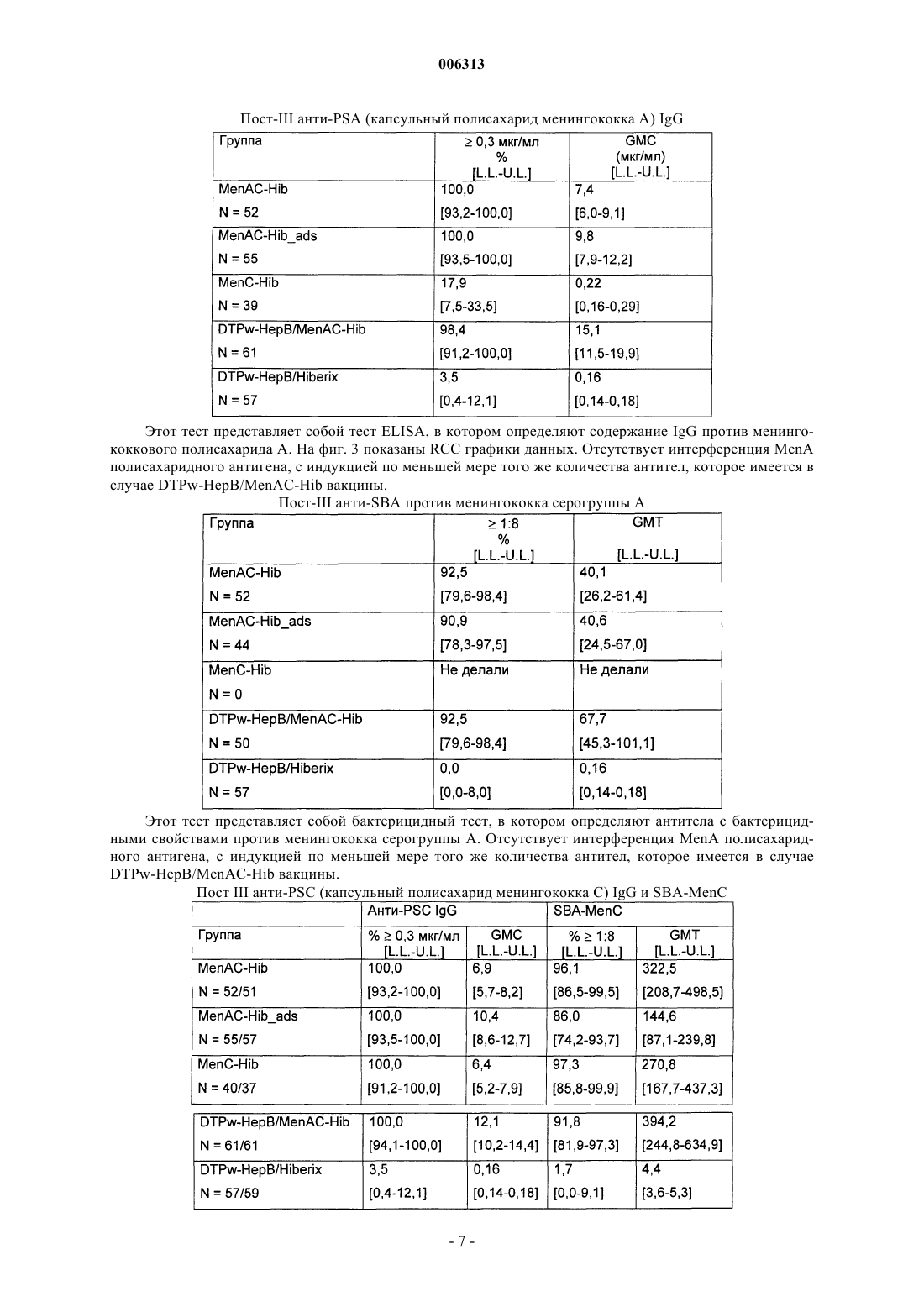
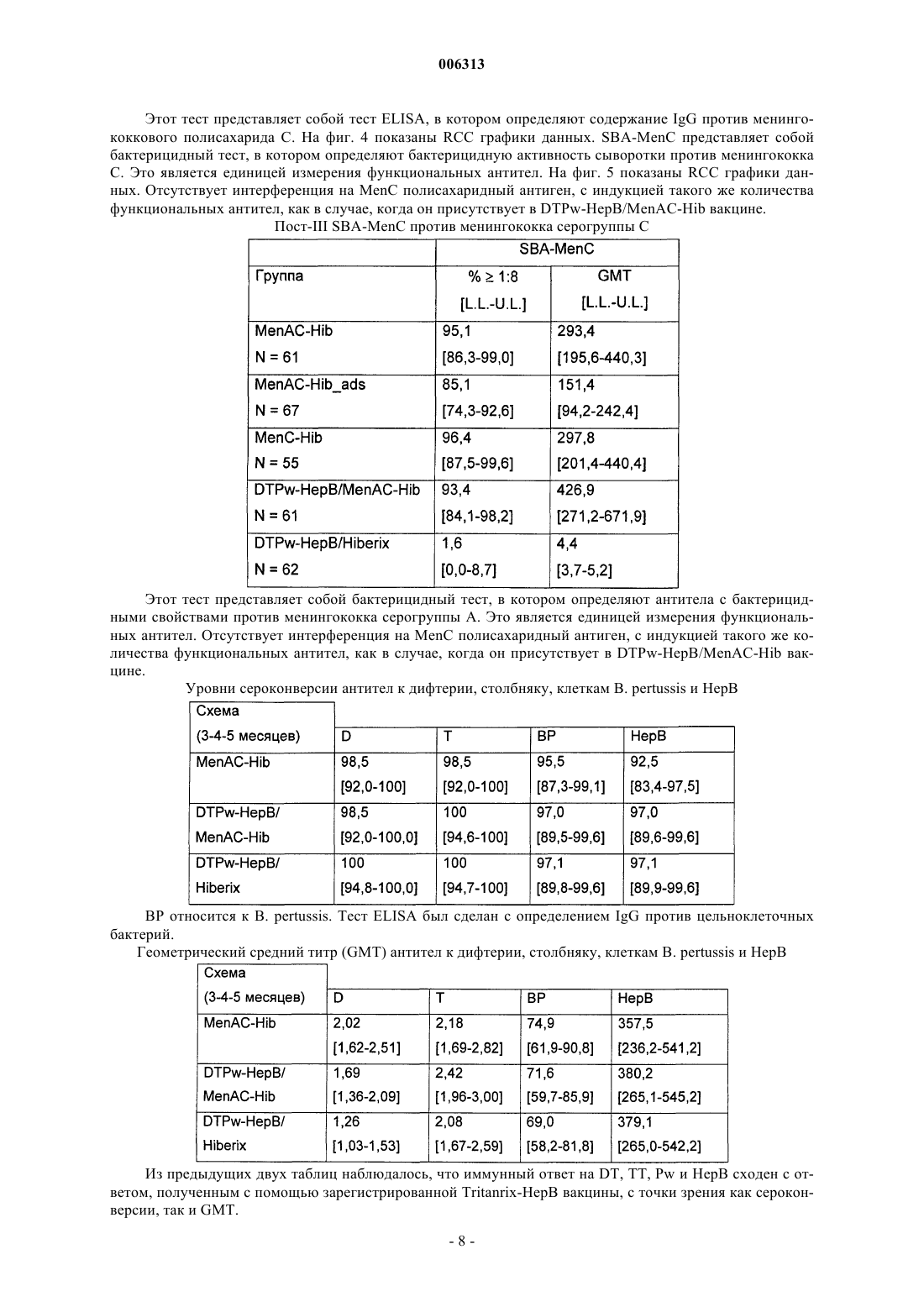
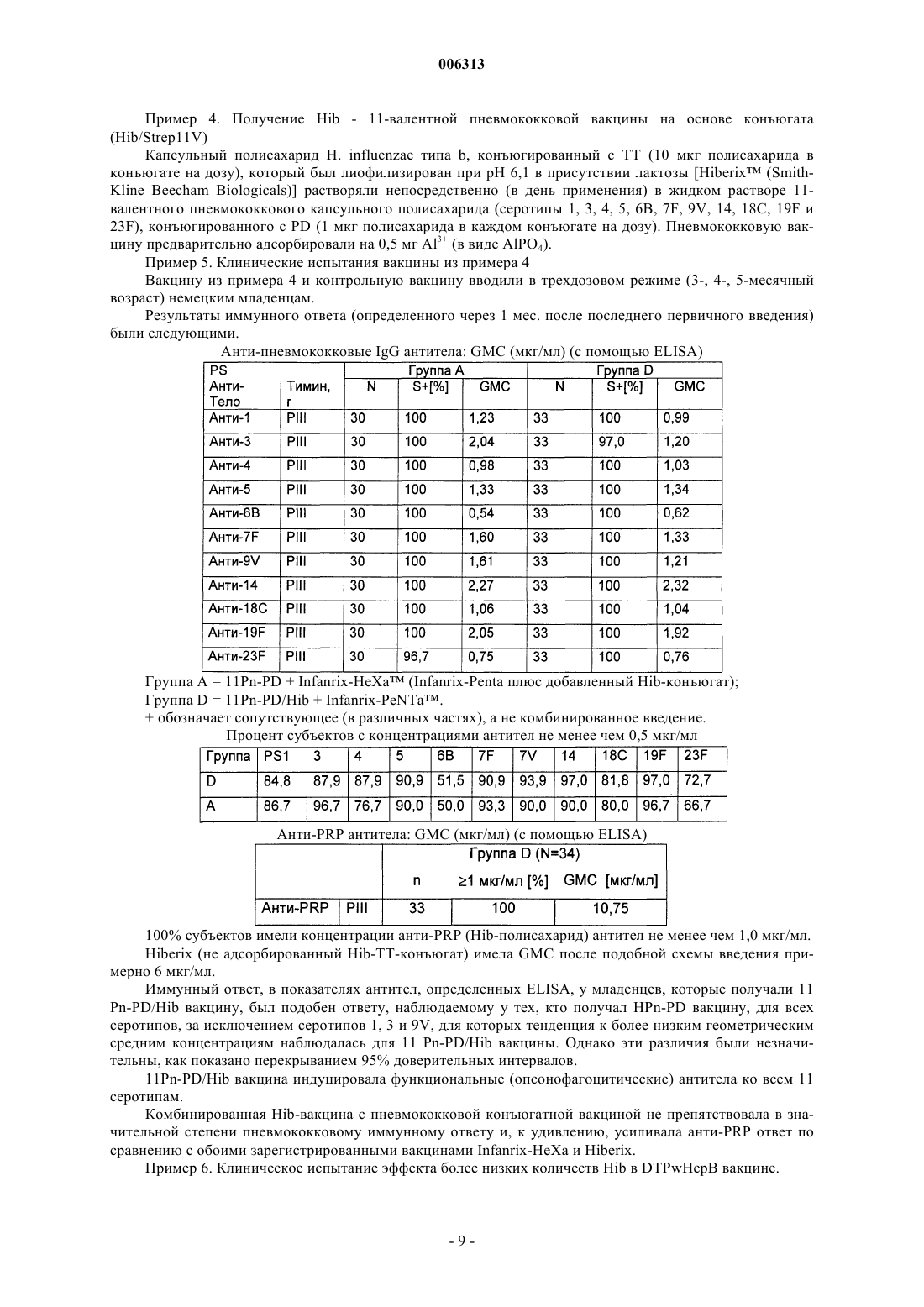
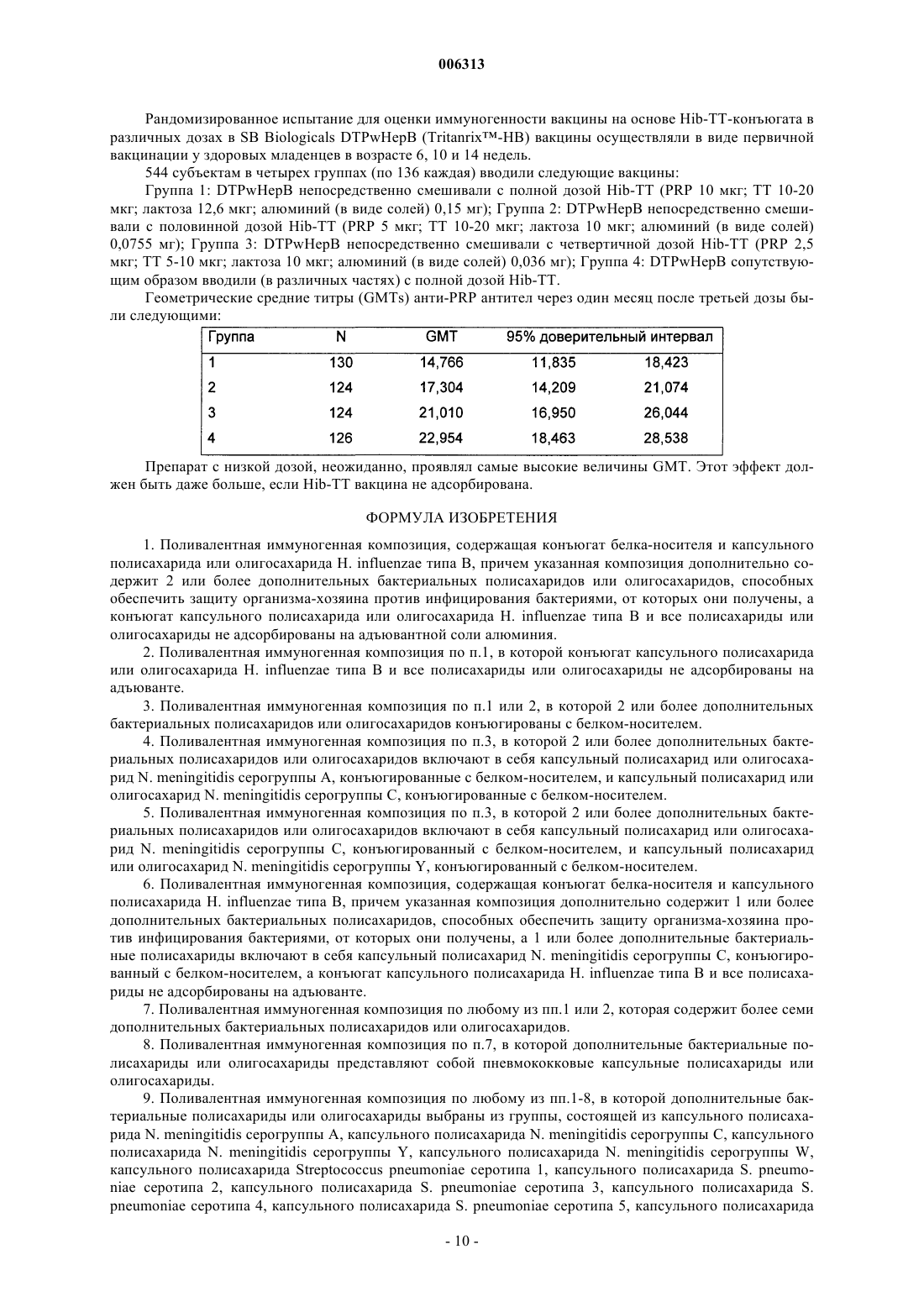
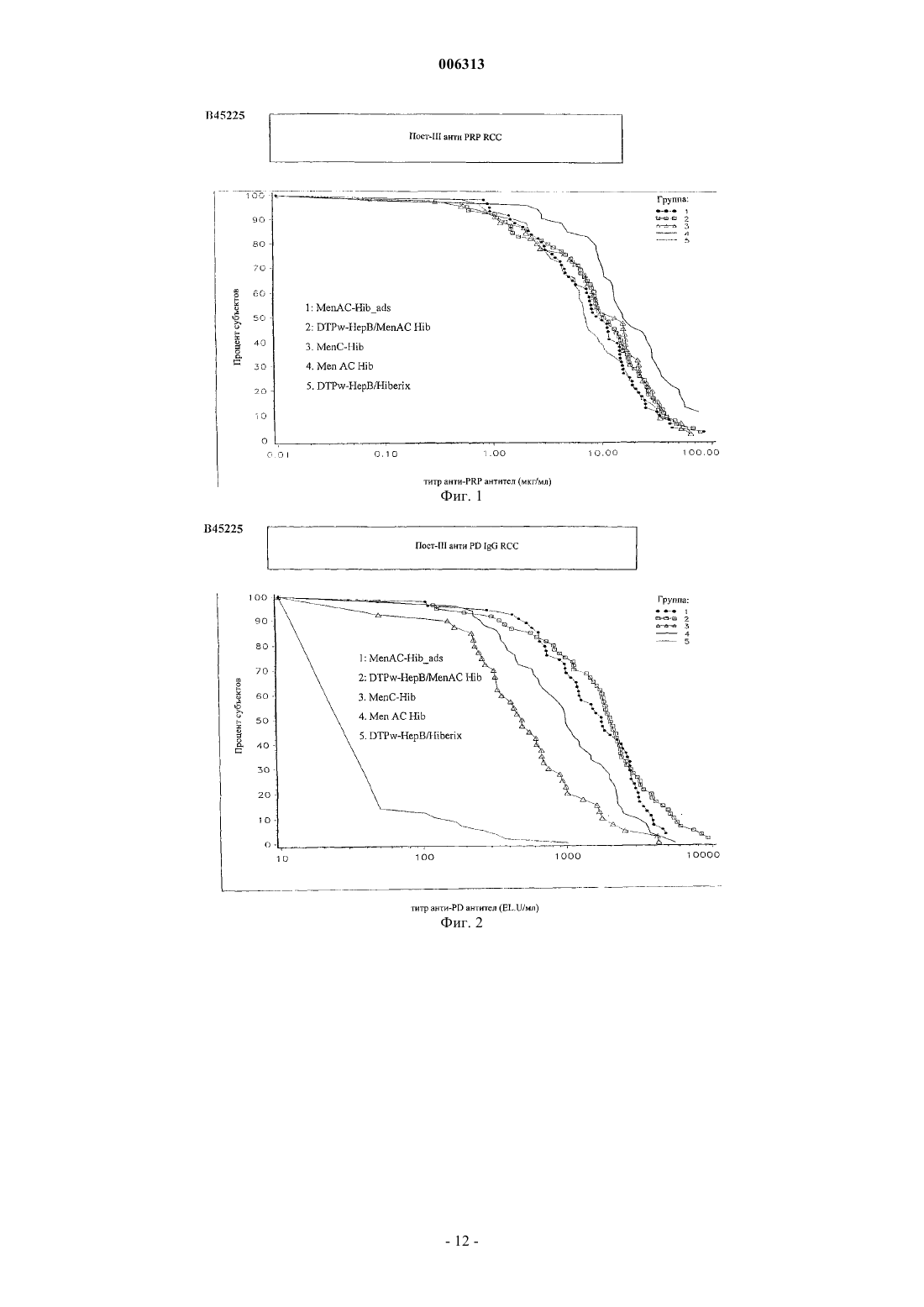
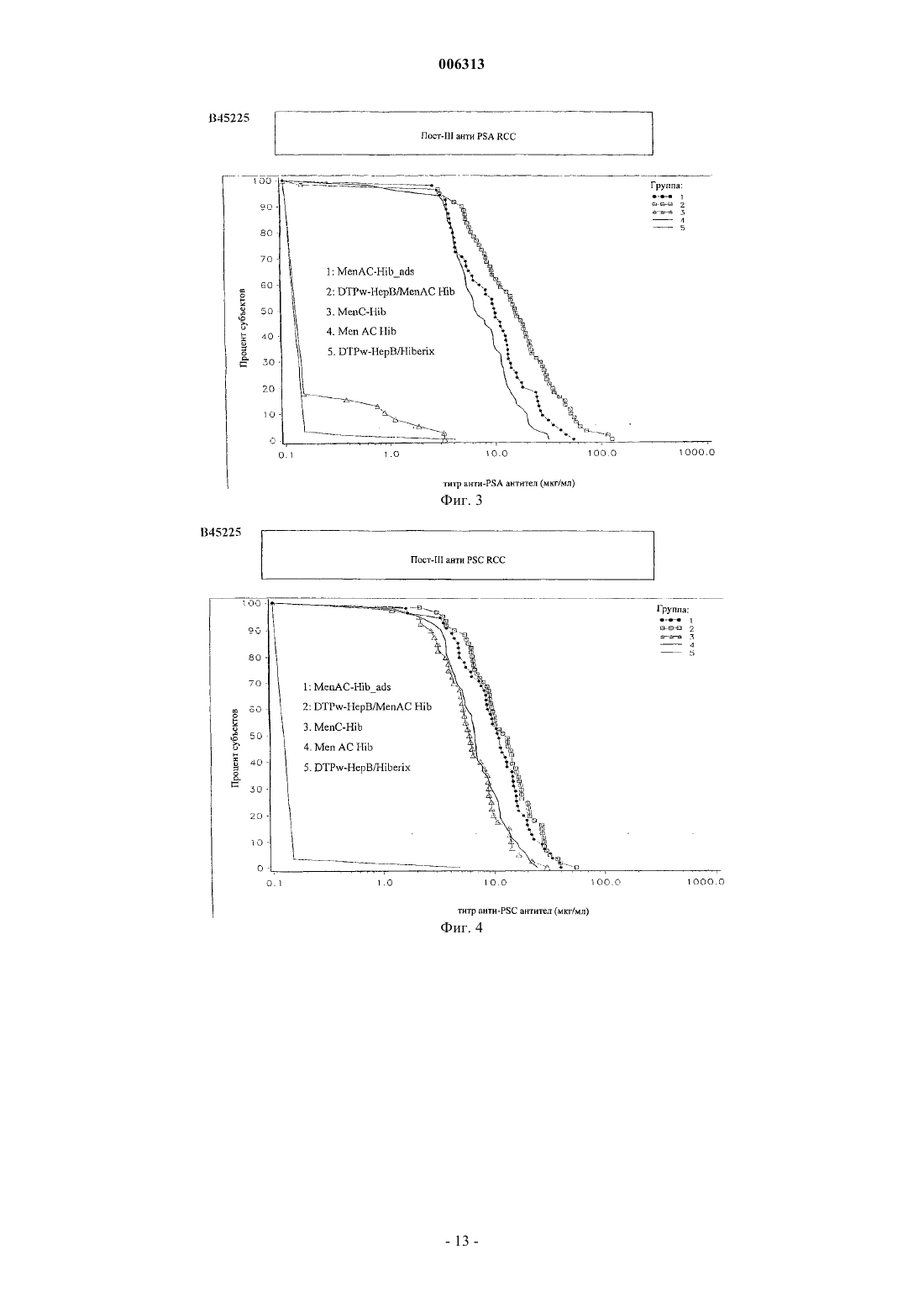
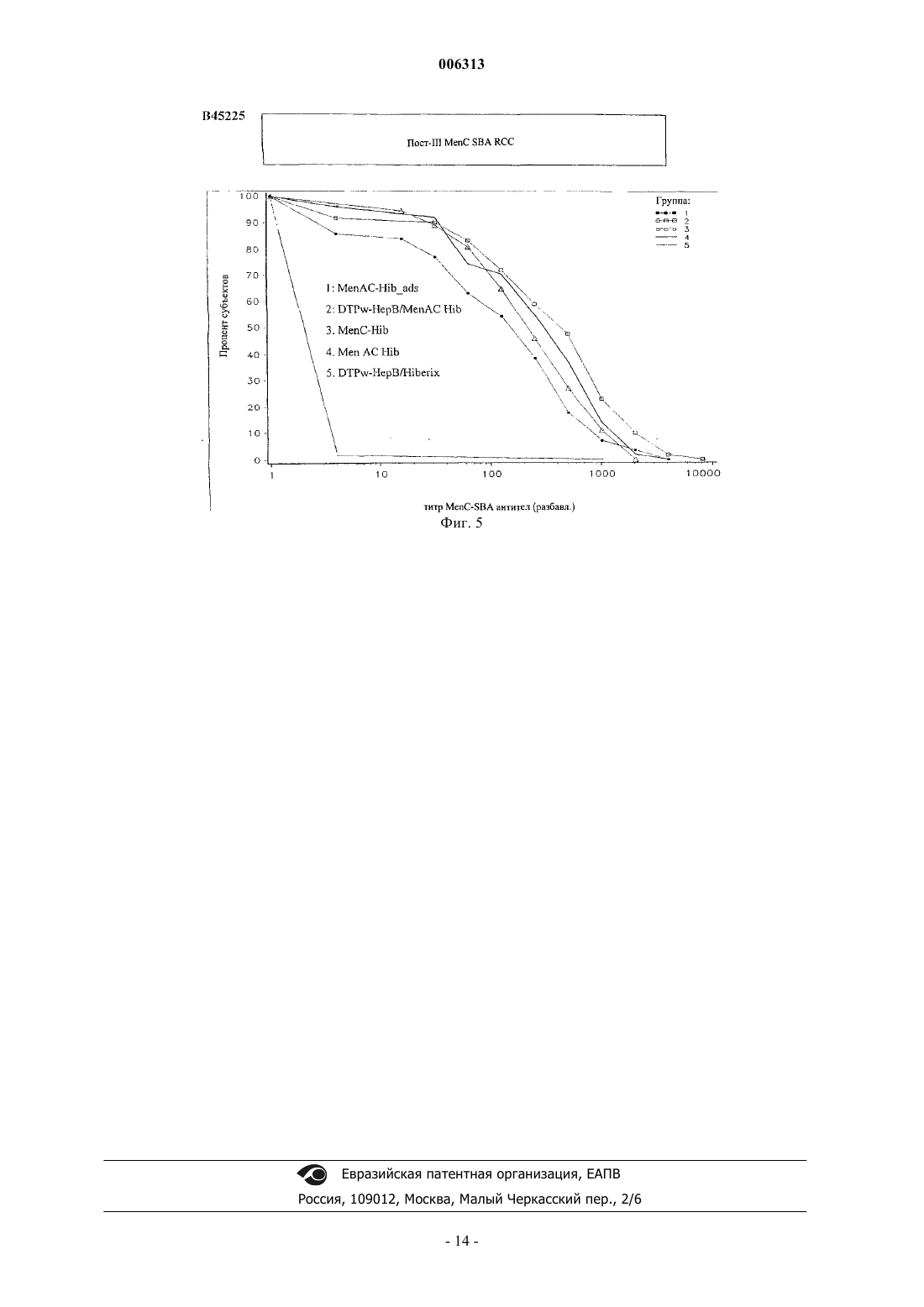
006313 Настоящее изобретение относится к новым комбинированным вакцинным препаратам. Комбинированные вакцины (которые обеспечивают защиту против нескольких патогенов) очень желательны для уменьшения числа иммунизаций, необходимых для обеспечения защиты против нескольких патогенов,для снижения затрат на введение и для увеличения принятия и степеней охвата. Хорошо известное явление антигенной конкуренции (или интерференции) осложняет разработку многокомпонентных вакцин. Антигенная интерференция относится к наблюдению того факта, что введение нескольких антигенов часто приводит к ослабленному ответу на некоторые антигены по сравнению с иммунным ответом, наблюдаемым, когда такие антигены вводят по отдельности. Известны комбинированные вакцины, которые могут предотвращать Bordetella pertussis, Clostridium(см., например, WO 93/24148 и WO 97/00697). Согласно изобретению предложена поливалентная иммуногенная композиция, содержащая конъюгат белка-носителя и капсульного полисахарида или олигосахарида Н. influenzae типа В, причем указанная композиция дополнительно содержит 2 или более дополнительных бактериальных полисахаридов или олигосахаридов, способных обеспечить защиту организма-хозяина против инфицирования бактериями, от которых они получены, а конъюгат капсульного полисахарида или олигосахарида Н. influenzae типа В и все полисахариды или олигосахариды не адсорбированы на адъювантной соли алюминия. Предпочтительной является поливалентная иммуногенная композиция по изобретению, в которой конъюгат капсульного полисахарида или олигосахарида Н. influenzae типа В и все полисахариды или олигосахариды не адсорбированы на адъюванте. Также предпочтительной является поливалентная иммуногенная композиция по изобретению, в которой 2 или более дополнительных бактериальных полисахаридов или олигосахаридов конъюгированы с белком-носителем. Более предпочтительной является вышеуказанная поливалентная иммуногенная композиция, в которой 2 или более дополнительных бактериальных полисахаридов или олигосахаридов включают в себя капсульный полисахарид или олигосахарид N. meningitidis серогруппы А, конъюгированные с белкомносителем, и капсульный полисахарид или олигосахарид N. meningitidis серогруппы С, конъюгированные с белком-носителем, а также поливалентная иммуногенная композиция, в которой 2 или более дополнительных бактериальных полисахаридов или олигосахаридов включают в себя капсульный полисахарид или олигосахарид N. meningitidis серогруппы С, конъюгированный с белком-носителем, и капсульный полисахарид или олигосахарид N. meningitidis серогруппы Y, конъюгированный с белкомносителем. Согласно изобретению предложена также поливалентная иммуногенная композиция, содержащая конъюгат белка-носителя и капсульного полисахарида Н. influenzae типа В, причем указанная композиция дополнительно содержит 1 или более дополнительных бактериальных полисахаридов, способных обеспечить защиту организма-хозяина против инфицирования бактериями, от которых они получены, а 1 или более дополнительные бактериальные полисахариды включают в себя капсульный полисахарид N.meningitidis серогруппы С, конъюгированный с белком-носителем, а конъюгат капсульного полисахарида Н. influenzae типа В и все полисахариды не адсорбированы на адъюванте. Одно из воплощений изобретения составляет поливалентная иммуногенная композиция, которая содержит более семи дополнительных бактериальных полисахаридов или олигосахаридов, которые предпочтительно представляют собой пневмококковые капсульные полисахариды или олигосахариды. Предпочтительными воплощениями заявленных поливалентных иммуногенных композиций являются композиции, в которых дополнительные бактериальные полисахариды или олигосахариды выбраны из группы, состоящей из капсульного полисахарида N. meningitidis серогруппы А, капсульного полисахарида N. meningitidis серогруппы С, капсульного полисахарида N. meningitidis серогруппы Y, капсульного полисахарида N. meningitidis серогруппы W, капсульного полисахарида Streptococcus pneumoniae серотипа 1, капсульного полисахарида S. pneumoniae серотипа 2, капсульного полисахарида S. pneumoniae серотипа 3, капсульного полисахарида S. pneumoniae серотипа 4, капсульного полисахарида S.S. pneumoniae серотипа 19F, капсульного полисахарида S. pneumoniae серотипа 20, капсульного полисахарида S. pneumoniae серотипа 22F, капсульного полисахарида S. pneumoniae серотипа 23F, капсульного полисахарида S. pneumoniae серотипа 33F, капсульного полисахарида группы I стрептококка группы В,капсульного полисахарида группы II стрептококка группы В, капсульного полисахарида группы III стрептококка группы В, капсульного полисахарида группы IV стрептококка группы В, капсульного по-1 006313 лисахарида группы V стрептококка группы В, капсульного полисахарида Staphylococcus aureus типа 5,капсульного полисахарида Staphylococcus aureus типа 8, Vi полисахарида из Salmonella typhi, липополисахарида (LPS) N. meningitidis, LPS M. catarrhalis и LPS H. influenzae, или их олигосахаридов. Еще более предпочтительными являются поливалентные иммуногенные композиции, в которых белок-носитель (белки-носители) выбран(ы) из группы, содержащей: столбнячный анатоксин, дифтерийный анатоксин, CRM197, рекомбинантный дифтерийный токсин, ОМРС из N. meningitidis, пневмолизин из S. pneumoniae и белок D из Н. Influenzae, наиболее предпочтительно белок-носитель представляет собой столбнячный анатоксин. Одно из воплощений изобретения составляет поливалентная иммуногенная композиция, в которой капсульный полисахарид или олигосахарид Н. influenzae типа В и дополнительные полисахариды или олигосахариды не конъюгированы с одним и тем же носителем, предпочтительно в которой капсульный полисахарид или олигосахарид Н. influenzae типа В и дополнительные полисахариды или олигосахариды не все конъюгированы с CRM197. Предпочтительно конъюгат белка-носителя и полисахарида или олигосахарида в поливалентных иммуногенных композициях по изобретению получают при использовании 1-цианодиметиламинопиридиния тетрафторбората (CDAP). Целесообразно, когда поливалентные иммуногенные композиции по изобретению содержат 0,1-10 мкг каждого полисахарида или олигосахарида. Согласно данному изобретению предложен также способ приготовления вышеописанной поливалентной иммуногенной композиции, включающий смешивание индивидуальных компонентов композиции. Согласно изобретению предложено применение вышеописанной поливалентной иммуногенной композиции в производстве лекарства для лечения или предупреждения инфекций, вызванных Haemophilus influenzae типа В. В изобретении далее предложен способ иммунизации человека против инфекции, вызванной Haemophilus influenzae типа В, включающий введение человеку иммунопротективной дозы поливалентной иммуногенной композиции по изобретению. Авторы настоящего изобретения сделали неожиданное открытие, представляющее собой тот факт,что комбинированные вакцины, содержащие Hib-конъюгат, вызывают значительно более высокие титры анти-Hib антител в организме хозяина (по сравнению с моновалентной вакциной на основе неадсорбированного Hib-конъюгата), если Hib-конъюгат вводят в виде вакцины, дополнительно содержащей 1, но особенно 2 или более чем два дополнительных бактериальных полисахарида, и Hib-полисахарид (и предпочтительно все полисахариды) вакцины не адсорбированы на адъюванте (в частности солях алюминия). Таким образом, независимый аспект настоящего изобретения заключается в том, что предложена поливалентная иммуногенная композиция, содержащая конъюгат белка-носителя и капсульного полисахарида Н. influenzae типа В (Hib), причем указанная композиция дополнительно содержит 1, но особенно 2 или более чем два дополнительных бактериальных полисахарида (предпочтительно более чем 2, 3, 4, 5,6, 7, 8, 9, 10, 11, 12 или 13), способных обеспечить защиту организма-хозяина против инфицирования бактериями, от которых они получены, и причем Hib-полисахарид (и предпочтительно ни один из указанных полисахаридов) в композиции не адсорбированы на адъювантной соли алюминия. Наиболее предпочтительно, чтобы адъювантная соль алюминия не присутствовала в композиции. Под антигеном, который не адсорбирован на адъювантной соли алюминия подразумевают, что никакая особая или специально предназначенная стадия адсорбции для антигена на дополнительной адъювантной соли алюминия, не входит в процесс приготовления данной композиции. Конъюгаты бактериального капсульного полисахарида могут содержать любой пептид-, полипептид- или белок-носитель, содержащий по меньшей мере один Т-хелперный эпитоп. Предпочтительно,используемый(ые) белок-носитель(белки-носители) выбран(ы) из группы, содержащей: столбнячный анатоксин, дифтерийный анатоксин, CRM197, рекомбинантный дифтерийный токсин (как описано в любом из US 4709017, WO 93/25210, WO 95/33481 или WO 00/48638), пневмолизин (предпочтительно химически детоксифицированный, или детоксифицированный мутант) из S. pneumoniae, ОМРС из N. meningitidis и белок D (PD) из Н. influenzae (EP 594610). Вследствие известного эффекта индуцированной носителем супрессии, является преимущественным, если в каждой из композиций по данному изобретению полисахаридные антигены, содержащиеся в ней ("n" антигены), конъюгированы с более чем одним носителем. Таким образом, (n-1) полисахаридов может быть нанесено (отдельно) на один тип носителя и 1 - на другой носитель, либо (n-2) - на один и 2 - на два других носителя, и так далее. Например, в вакцине, содержащей 4 бактериальных полисахаридных конъюгата, 1, 2 или все четыре могут быть конъюгированы с различными носителями. Белок D, однако, преимущественно используют в качестве носителя в композициях по данному изобретению, так как он может быть использован для различных (2, 3, 4 или более) полисахаридов в композиции без заметного эффекта индуцированной носителем супрессии. Наиболее предпочтительно, Hib присутствует в виде ТТ-конъюгата, a MenA, MenC, MenY и MenW пред-2 006313 ставляют собой либо ТТ-, либо PD-конъюгаты. Белок D также является полезным носителем, поскольку он обеспечивает дополнительный антиген, который может обеспечить защиту против Н. influenzae.Hib может быть конъюгирован с любым носителем, который может обеспечить по меньшей мере один Т-хелперный эпитоп, и предпочтительно столбнячным анатоксином. Полисахарид может быть связан с белком-носителем с помощью любого известного способа (например, Likhite, патент США 4372945 и Armor et al., патент США 4474757). Предпочтительно осуществляют CDAP-конъюгацию (WO 95/08348). При CDAP цианирующий реагент 1-циано-диметиламинопиридиния тетрафторборат (CDAP) предпочтительно используют для синтеза полисахарид-белковых конъюгатов. Реакцию цианирования можно осуществлять в относительно мягких условиях, чтобы избежать гидролиза полисахаридов, чувствительных к щелочи. Этот синтез дает возможность прямого связывания с белком-носителем. Способы получения столбнячного анатоксина (ТТ) хорошо известны в данной области техники. Например, ТТ предпочтительно получают путем очистки токсина из культуры Clostridium tetani с последующей химической детоксификацией, однако альтернативно получают путем очистки рекомбинантного, или генетически детоксифицированного аналога токсина (например, как описано в ЕР 209281)."Столбнячный анатоксин" также включает в себя иммуногенные фрагменты полноразмерного белка (например Фрагмент С - см. ЕР 478602). Способы получения дифтерийного анатоксина (DT) также хорошо известны в данной области техники. Например, DT предпочтительно получают путем очистки токсина из культуры Corynebacteriumdiphtheriae с последующей химической детоксификацией, однако альтернативно получают путем очистки рекомбинантного, или генетически детоксифицированного аналога токсина (например, CRM197 или другие мутанты, как описано в US 4709017, US 5843711, US 5601827 и US 5917017). Предпочтительно, дополнительные бактериальные полисахариды также конъюгированы с белкомносителем (примеры которых описаны выше). В конкретных воплощениях капсульный полисахарид Н.influenzae типа В и дополнительные полисахариды не конъюгированы с одним и тем же носителем (Hib и ни один из дополнительных полисахаридов не используют совместно один и тот же носитель), особенно когда носитель представляет собой CRM197. В предпочтительных воплощениях примеров по меньшей мере один из полисахаридов данной композиции конъюгирован с белком D, однако это не существенно для осуществления изобретения - в действительности, ни Hib, ни любой другой полисахарид, не обязательно должен быть конъюгирован с белком D. В конкретном воплощении настоящего изобретения, только Hib и дополнительные бактериальные полисахариды (и их конъюгаты) представляют собой антигены, присутствующие в композиции. Количество полисахарида, которое способно обеспечить защиту для организма хозяина (эффективное количество) может легко определить специалист в данной области техники. Обычно ожидается, что каждая доза будет содержать 0,1-100 мкг полисахарида, предпочтительно 0,1-50 мкг, предпочтительно 0,1-10 мкг, из которых 1-5 мкг представляет собой наиболее предпочтительный диапазон. Hib-конъюгат предпочтительно присутствует в количестве 3-15 мкг (полисахарида в конъюгате), более предпочтительно 4-12 мкг, и наиболее предпочтительно 5-10 мкг. В предпочтительном воплощении суммарно не менее чем 2 мкг дополнительного полисахарида (особенно, когда он конъюгирован) присутствует в композиции на 0,5 мл дозы, и, предпочтительно, включено не менее чем 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 17,20, 25, 30, 35, 40, 45 или 50 мкг. Предпочтительно не более чем 100 мкг дополнительного полисахарида включено на 0,5 мл дозы. Предпочтительно дополнительные бактериальные полисахариды выбраны из группы, состоящей из: капсульного полисахарида N. meningitidis серогруппы A (Men А), капсульного полисахарида N. meningitidis серогруппы С (Men С), капсульного полисахарида N. meningitidis серогруппы Y (Men Y), капсульного полисахарида N. meningitidis серогруппы W (Men W), капсульного полисахарида группы I стрептококка группы В, капсульного полисахарида группы II стрептококка группы В, капсульного полисахарида группы III стрептококка группы В, капсульного полисахарида группы IV стрептококка группы В, капсульного полисахарида группы V стрептококка группы В, капсульного полисахарида Staphylococcustyphi, липополисахарида (LPS) N. meningitidis, LPS M. catarrhalis и LPS H. influenzae. Под LPS понимают либо нативный липополисахарид (или липоолигосахарид), либо липополисахарид, где участок липида А детоксифицирован любым из большинства известных способов (см. например, WO 97/18837 или WO 98/33923), или любую молекулу, содержащую O-полисахарид, полученный из указанного LPS. Под LPSN. meningitidis подразумевают один или более чем один из 12 известных иммунотипов (L1, L2, L3, L4,L5, L6, L7, L8, L9, L10, L11 или L12). Особенно предпочтительными комбинациями являются композиции, содержащие или включающие в себя: 1) конъюгированный Hib, конъюгированный МеnА и конъюгированный МеnС; 2) конъюгированный Hib, конъюгированный MenY и конъюгированный МеnС; и 3) конъюгированный Hib и конъюгированный МеnС. Количество PS в каждом из вышеуказанных конъюгатов может составлять 5 или 10 мкг каждого на 0,5 мл дозы для человека. Возможно, вышеуказанные композиции могут также включать в себя везикулы наружных мембран N. meningitidis серотипа В, или один или более чем один белок (по-3 006313 верхностно-экспонированный) наружной мембраны N. meningitidis серотипа В, или один или более чем один LPS (как он определен выше) N. meningitidis для создания общей вакцины против менингита. Предпочтительно МеnА, МеnС и MenY представляют собой либо ТТ-, либо PD-конъюгаты. Дополнительные бактериальные полисахариды могут также быть выбраны из любого из капсульных пневмококковых полисахаридов (предпочтительно более чем 7, более предпочтительно 11 или более, и наиболее предпочтительно 13 или более), таких как от серотипа: 1, 2, 3, 4, 5, 6 А, 6 В, 7F, 8, 9N, 9V,10A, 11 А, 12F, 14, 15 В, 17F, 18 С, 19 А, 19F, 20, 22F, 23F или 33F. Предпочтительно пневмококковые полисахариды конъюгированы (наиболее предпочтительно PD-конъюгаты). Например, пневмококковые полисахариды, полученные от по меньшей мере четырех серотипов(включая 6 В, 14, 19F и 23F, например), или от по меньшей мере 7 серотипов (включая 4, 6 В, 9V, 14, 18 С,19F и 23F, например) могут быть выбраны из списка, указанного выше. Более предпочтительно, полисахариды от более чем 7 серотипов включены в композицию, например, по меньшей мере 11 серотипов. Например, композиция в одном воплощении включает в себя 11 капсульных полисахаридов, полученных от серотипов 1, 3, 4, 5, 6 В, 7F, 9V, 14, 18 С, 19F и 23F (предпочтительно конъюгированных). В предпочтительном воплощении данного изобретения по меньшей мере 13 полисахаридных антигенов (предпочтительно конъюгированных) включены, хотя дополнительные полисахаридные антигены, например 23 валентные (такие как серотипы 1, 2, 3, 4, 5, 6 В, 7F, 8, 9N, 9V, 10A, 11 А, 12F, 14, 15 В, 17F, 18 С, 19 А, 19F,20, 22F, 23F и 33F) также включены в изобретение. Для вакцинации пожилых людей (например для предупреждения пневмонии) является преимущественным включить серотипы 8 и 12F (и наиболее предпочтительно 15 и 22 также) в предпочтительную 11-валентную антигенную композицию, описанную выше, с образованием 13/15-валентной вакцины,тогда как для младенцев или детей раннего возраста (когда большое значение имеет отит среднего уха) серотипы 6 А и 19 А преимущественно включены с получением 13-валентной вакцины. Пневмококковые полисахариды могут быть адсорбированы или могут не быть адсорбированы на адъювантных солях алюминия.Hib (предпочтительно лиофилизированный) и пневмококковые полисахариды (предпочтительно в жидкой форме) можно смешивать непосредственно перед введением в организм хозяина в одном введении/инъекции. С помощью такого препарата возможно, при иммунизации, получить титры антител против Hib капсульного полисахарида сверх 100% титра, полученного, когда Hib-конъюгат вводят отдельно. В предпочтительных воплощениях никакого (значительного) неблагоприятного эффекта не возникает в отношении к пневмококковым полисахаридным конъюгатам (в смысле защитной эффективности) в комбинации, по сравнению с их введением по отдельности. Это можно оценить в единицах измерения постпервичных геометрических средних концентраций (GMC) антитела против полисахарида через 1 месяц после последней прайминг-дозы (прайминг-дозы представляют собой первичные введения - обычно 3 - в первый год жизни). GMC (в мкг/мл) для вакцины по данному изобретению должна быть предпочтительно выше 55% (более предпочтительно выше 60, 70, 80 или 90%) от GMC, когда пневмококковые полисахариды вводят без Hib-конъюгата. Другим указанием на то, что никакого неблагоприятного эффекта не возникает, является то, что % субъектов с концентрациями антитела не менее чем 0,5 мкг/мл отличается не более, чем на 10% (предпочтительно менее чем 9, 7, 5, 3 или 1%), при сравнении 1-месячных постпервичных введений вакцины по данному изобретению против вакцины без Hib-конъюгата. Хотя вышеуказанное относится к Hib и дополнительным бактериальным полисахаридам (предпочтительное воплощение), предусмотрено, что данное изобретение может быть расширено до Hib и дополнительных бактериальных олигосахаридов (которые в природе имеют низкое число повторяющихся единиц, или которые представляют собой полисахариды, уменьшенные в размере для осуществимости, но которые все еще способны к индукции защитного иммунного ответа в организме хозяина), которые хорошо известны в технологии вакцин. Предпочтительно, поливалентную иммуногенную композицию по этому аспекту изобретения приготавливают в виде вакцины для введения in vivo в организм хозяина, причем индивидуальные компоненты композиции готовят таким образом, чтобы иммуногенность индивидуальных компонентов не была снижена другими индивидуальными компонентами этой композиции. Не существенно снижена означает, что при иммунизации получают титр антител против каждого компонента, который составляет более чем 60%, предпочтительно более чем 70%, более предпочтительно более чем 80%, еще более предпочтительно более чем 90%, и наиболее предпочтительно более чем 95-100% титра, полученного,когда антиген вводят отдельно. Таким образом, в предпочтительных воплощениях никакого (значительного) неблагоприятного эффекта не возникает в отношении к дополнительным бактериальным полисахаридам (в смысле защитной эффективности) в комбинации, по сравнению с их введением по отдельности. Предпочтительно, поливалентную иммуногенную композицию по этому аспекту изобретения приготавливают в виде вакцины для введения in vivo в организм хозяина, которая обеспечивает титр антител, превышающий критерий для серологической защиты для каждого антигенного компонента для приемлемого процента субъектов-людей. Это является важным тестом в оценке эффективности вакцины в популяции. Антигены с титром связанных антител, выше которого считается, что в организме хозяина наблюдается сероконверсия против антигена, хорошо известны, и такие титры опубликованы организа-4 006313 циями, такими как Всемирная Организация Здравоохранения (ВОЗ). Предпочтительно у более чем 80% статистически значимой выборки субъектов наблюдается сероконверсия, более предпочтительно у более чем 90%, еще более предпочтительно у более чем 93%, и наиболее предпочтительно у 96-100%. Композиции по данному аспекту изобретения предпочтительно приготавливают в виде вакцины. Применение поливалентной иммуногенной композиции по изобретению в производстве лекарства для лечения или предупреждения инфекций, вызванных Haemophilus influenzae типа В (и предпочтительно также теми организмами, от которых получены дополнительные бактериальные полисахариды), также предусмотрено, как и способ иммунизации человека против инфекции, вызванной Haemophilus influenzae типа В (и предпочтительно также теми организмами, от которых получены дополнительные бактериальные полисахариды), включающий введение человеку иммунопротективной дозы поливалентной иммуногенной композиции по изобретению. Если дополнительные бактериальные полисахариды должны быть адсорбированы на адъювантной соли алюминия, это должно быть сделано перед добавлением Hib к препарату. Предпочтительно избыток адъювантной соли алюминия не должен быть использован. Наиболее предпочтительно Hib должен быть добавлен к дополнительному полисахариду, содержащему адъювантный алюминий, непосредственно к композиции, которую вводят в организм хозяина. Все цитированные ссылки и публикации включены здесь путем ссылки. Примеры Примеры предложены только для целей иллюстрации и не предназначены для ограничения объема данного изобретения. Пример 1. Получение DT-TT-Pw-HepB (DTPw-HepB) вакцины Это получение осуществляли, как описано в WO 93/24148. Эта вакцина имеется в продаже под названием Tritanrix-HepB (SmithKline Beecham Biologicals). Пример 2. Получение MenA-MenC-Hib (MenAC-Hib) вакцин 1) MenC-Hib или MenA-MenC-Hib без адъювантовMenAC-Hib: капсульный полисахарид N. meningitidis типа А, конъюгированный с белком D (с использованием CDAP-методики), капсульный полисахарид N. meningitidis типа С, конъюгированный с белком D, и капсульный полисахарид Н. influenzae типа b, конъюгированный с ТТ, смешивали вместе в количестве 5 мкг каждого полисахарида в каждом конъюгате на 0,5 мл дозы для человека. Значение рН доводили до 6,1 и лиофилизировали в присутствии сахарозы.MenC-Hib: капсульный полисахарид N. meningitidis типа С, конъюгированный с белком D (с использованием CDAP-методики) и капсульный полисахарид Н. influenzae типа b, конъюгированный с ТТ,смешивали вместе в количестве 5 мкг полисахарида в каждом конъюгате на 0,5 мл дозы для человека. Значение рН доводили до 6,1, и лиофилизировали в присутствии сахарозы. 2) MenA-MenC-Hib с адъювантами Капсульный полисахарид N. meningitidis типа А, конъюгированный с белком D (с использованиемCDAP-методики), капсульный полисахарид N. meningitidis типа С, конъюгированный с белком D, и капсульный полисахарид Н. influenzae типа b, конъюгированный с ТТ, адсорбировали каждый отдельно в солевом растворе на фосфате алюминия (5 мкг каждого конъюгата на 100 мкг, 100 мкг и 60 мкг Аl3+, соответственно, на дозу). Адсорбированные вакцины смешивали вместе при рН 6,1 и лиофилизировали в присутствии сахарозы. Пример 3. Клиническое испытание В исследовании MenAC-Hib 001 оценивается иммуногенность, реактогенность и безопасность, индуцированная MenC-Hib и MenAC-Hib (адсорбированной и не адсорбированной), приготовленными согласно вышеуказанному примеру, которые давали младенцам в виде трехдозовой первичной вакцинации. Данное исследование представляло собой фазу II, рандомизированное исследование, и включало в себя пять исследуемых групп. Препараты, которые оценивали, представляли собой лиофилизированный простой и адсорбированный препарат Men AC-Hib и простой препарат MenC-Hib. Эти три препарата вводили младенцам в возрасте 3, 4 и 5 месяцев в трех первых исследуемых группах; Tritanrix-HepB давали сопутствующим образом (в виде отдельной инъекции) в этих трех группах. Простой препаратMen AC-Hib также разводили в жидкой комбинированной дифтерийно-столбнячной, цельно-клеточной коклюшной, гепатит В - вакцине (Tritanrix-HepB) и вводили в виде единой инъекции младенцам в возрасте 3, 4 и 5 месяцев в четвертой исследуемой группе. В пятой группе (контроль) вводили TritanrixHepB-Hib вакцину младенцам в возрасте 3, 4, 5 месяцев. Исследование было открытым, но в двух первых группах, получающих два различных препарата MenAC-Hib, являлось двойным слепым, также как и в двух последних группах, получающих Tritanrix-HepB-MenAC-Hib и Tritanrix-HepB-Hib вакцины. В итоге, исследуемые группы представляли собой: Результаты показали, что каждый препарат, который оценивали, индуцировал хороший иммунный ответ против каждого антигена (определяли антитела против менингококковых групп А и С, ПолиРибозил-Фосфата (капсульного полисахарида Н. influenzae типа b), дифтерийного анатоксина, столбнячного анатоксина, Bordetella pertussis и гепатита В). Каждый вакцинный препарат хорошо переносился. Пост-III анти-Поли-Рибозил-Фосфат (PRP) 0,15 и 1,0 мкг/мл являются типичными порогами титров, которые наблюдают для оценки серологической защиты. В случае DTPw-HepB/MenAC-Hib вакцины Hib-интерференция отсутствует. Это также можно видеть на фиг. 1, которая показывает обратную кумулятивную кривую (RCC) данных. Кроме того, является неожиданным то, что не адсорбированная MenAC-Hib вакцина показала значительно более высокий анти-PRP титр по сравнению с адсорбированным препаратом. Пост-III анти-белок D IgG См. также фиг. 2 для соответствующих RCC анти-PD IgG кривых. Как можно видеть, все препараты индуцировали иммунный ответ к белку-носителю (белок D). Этот тест представляет собой тест ELISA, в котором определяют содержание IgG против менингококкового полисахарида А. На фиг. 3 показаны RCC графики данных. Отсутствует интерференция МеnА полисахаридного антигена, с индукцией по меньшей мере того же количества антител, которое имеется в случае DTPw-HepB/MenAC-Hib вакцины. Пост-III анти-SBA против менингококка серогруппы А Этот тест представляет собой бактерицидный тест, в котором определяют антитела с бактерицидными свойствами против менингококка серогруппы А. Отсутствует интерференция МеnА полисахаридного антигена, с индукцией по меньшей мере того же количества антител, которое имеется в случае-7 006313 Этот тест представляет собой тест ELISA, в котором определяют содержание IgG против менингококкового полисахарида С. На фиг. 4 показаны RCC графики данных. SBA-MenC представляет собой бактерицидный тест, в котором определяют бактерицидную активность сыворотки против менингококка С. Это является единицей измерения функциональных антител. На фиг. 5 показаны RCC графики данных. Отсутствует интерференция на МеnС полисахаридный антиген, с индукцией такого же количества функциональных антител, как в случае, когда он присутствует в DTPw-HepB/MenAC-Hib вакцине. Пост-III SBA-MenC против менингококка серогруппы С Этот тест представляет собой бактерицидный тест, в котором определяют антитела с бактерицидными свойствами против менингококка серогруппы А. Это является единицей измерения функциональных антител. Отсутствует интерференция на МеnС полисахаридный антиген, с индукцией такого же количества функциональных антител, как в случае, когда он присутствует в DTPw-HepB/MenAC-Hib вакцине. Уровни сероконверсии антител к дифтерии, столбняку, клеткам В. pertussis и НерВ ВР относится к B. pertussis. Тест ELISA был сделан с определением IgG против цельноклеточных бактерий. Геометрический средний титр (GMT) антител к дифтерии, столбняку, клеткам B. pertussis и НерВ Из предыдущих двух таблиц наблюдалось, что иммунный ответ на DT, ТТ, Pw и НерВ сходен с ответом, полученным с помощью зарегистрированной Tritanrix-HepB вакцины, с точки зрения как сероконверсии, так и GMT.-8 006313 Пример 4. Получение Hib - 11-валентной пневмококковой вакцины на основе конъюгата(Hib/Strep11V) Капсульный полисахарид Н. influenzae типа b, конъюгированный с ТТ (10 мкг полисахарида в конъюгате на дозу), который был лиофилизирован при рН 6,1 в присутствии лактозы [Hiberix (SmithKline Beecham Biologicals)] растворяли непосредственно (в день применения) в жидком растворе 11 валентного пневмококкового капсульного полисахарида (серотипы 1, 3, 4, 5, 6 В, 7F, 9V, 14, 18C, 19F и 23F), конъюгированного с PD (1 мкг полисахарида в каждом конъюгате на дозу). Пневмококковую вакцину предварительно адсорбировали на 0,5 мг Аl3+ (в виде АlРO4). Пример 5. Клинические испытания вакцины из примера 4 Вакцину из примера 4 и контрольную вакцину вводили в трехдозовом режиме (3-, 4-, 5-месячный возраст) немецким младенцам. Результаты иммунного ответа (определенного через 1 мес. после последнего первичного введения) были следующими. Анти-пневмококковые IgG антитела: GMC (мкг/мл) (с помощью ELISA)+ обозначает сопутствующее (в различных частях), а не комбинированное введение. Процент субъектов с концентрациями антител не менее чем 0,5 мкг/мл 100% субъектов имели концентрации анти-PRP (Hib-полисахарид) антител не менее чем 1,0 мкг/мл.Hiberix (не адсорбированный Hib-TT-конъюгат) имела GMC после подобной схемы введения примерно 6 мкг/мл. Иммунный ответ, в показателях антител, определенных ELISA, у младенцев, которые получали 11Pn-PD/Hib вакцину, был подобен ответу, наблюдаемому у тех, кто получал HPn-PD вакцину, для всех серотипов, за исключением серотипов 1, 3 и 9V, для которых тенденция к более низким геометрическим средним концентрациям наблюдалась для 11 Pn-PD/Hib вакцины. Однако эти различия были незначительны, как показано перекрыванием 95% доверительных интервалов. 11Pn-PD/Hib вакцина индуцировала функциональные (опсонофагоцитические) антитела ко всем 11 серотипам. Комбинированная Hib-вакцина с пневмококковой конъюгатной вакциной не препятствовала в значительной степени пневмококковому иммунному ответу и, к удивлению, усиливала анти-PRP ответ по сравнению с обоими зарегистрированными вакцинами Infanrix-HeXa и Hiberix. Пример 6. Клиническое испытание эффекта более низких количеств Hib в DTPwHepB вакцине.-9 006313 Рандомизированное испытание для оценки иммуногенности вакцины на основе Hib-TT-конъюгата в различных дозах в SB Biologicals DTPwHepB (Tritanrix-HB) вакцины осуществляли в виде первичной вакцинации у здоровых младенцев в возрасте 6, 10 и 14 недель. 544 субъектам в четырех группах (по 136 каждая) вводили следующие вакцины: Группа 1: DTPwHepB непосредственно смешивали с полной дозой Hib-TT (PRP 10 мкг; ТТ 10-20 мкг; лактоза 12,6 мкг; алюминий (в виде солей) 0,15 мг); Группа 2: DTPwHepB непосредственно смешивали с половинной дозой Hib-TT (PRP 5 мкг; ТТ 10-20 мкг; лактоза 10 мкг; алюминий (в виде солей) 0,0755 мг); Группа 3: DTPwHepB непосредственно смешивали с четвертичной дозой Hib-TT (PRP 2,5 мкг; ТТ 5-10 мкг; лактоза 10 мкг; алюминий (в виде солей) 0,036 мг); Группа 4: DTPwHepB сопутствующим образом вводили (в различных частях) с полной дозой Hib-TT. Геометрические средние титры (GMTs) анти-PRP антител через один месяц после третьей дозы были следующими: Препарат с низкой дозой, неожиданно, проявлял самые высокие величины GMT. Этот эффект должен быть даже больше, если Hib-TT вакцина не адсорбирована. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Поливалентная иммуногенная композиция, содержащая конъюгат белка-носителя и капсульного полисахарида или олигосахарида Н. influenzae типа В, причем указанная композиция дополнительно содержит 2 или более дополнительных бактериальных полисахаридов или олигосахаридов, способных обеспечить защиту организма-хозяина против инфицирования бактериями, от которых они получены, а конъюгат капсульного полисахарида или олигосахарида Н. influenzae типа В и все полисахариды или олигосахариды не адсорбированы на адъювантной соли алюминия. 2. Поливалентная иммуногенная композиция по п.1, в которой конъюгат капсульного полисахарида или олигосахарида Н. influenzae типа В и все полисахариды или олигосахариды не адсорбированы на адъюванте. 3. Поливалентная иммуногенная композиция по п.1 или 2, в которой 2 или более дополнительных бактериальных полисахаридов или олигосахаридов конъюгированы с белком-носителем. 4. Поливалентная иммуногенная композиция по п.3, в которой 2 или более дополнительных бактериальных полисахаридов или олигосахаридов включают в себя капсульный полисахарид или олигосахарид N. meningitidis серогруппы А, конъюгированные с белком-носителем, и капсульный полисахарид или олигосахарид N. meningitidis серогруппы С, конъюгированные с белком-носителем. 5. Поливалентная иммуногенная композиция по п.3, в которой 2 или более дополнительных бактериальных полисахаридов или олигосахаридов включают в себя капсульный полисахарид или олигосахарид N. meningitidis серогруппы С, конъюгированный с белком-носителем, и капсульный полисахарид или олигосахарид N. meningitidis серогруппы Y, конъюгированный с белком-носителем. 6. Поливалентная иммуногенная композиция, содержащая конъюгат белка-носителя и капсульного полисахарида Н. influenzae типа В, причем указанная композиция дополнительно содержит 1 или более дополнительных бактериальных полисахаридов, способных обеспечить защиту организма-хозяина против инфицирования бактериями, от которых они получены, а 1 или более дополнительные бактериальные полисахариды включают в себя капсульный полисахарид N. meningitidis серогруппы С, конъюгированный с белком-носителем, а конъюгат капсульного полисахарида Н. influenzae типа В и все полисахариды не адсорбированы на адъюванте. 7. Поливалентная иммуногенная композиция по любому из пп.1 или 2, которая содержит более семи дополнительных бактериальных полисахаридов или олигосахаридов. 8. Поливалентная иммуногенная композиция по п.7, в которой дополнительные бактериальные полисахариды или олигосахариды представляют собой пневмококковые капсульные полисахариды или олигосахариды. 9. Поливалентная иммуногенная композиция по любому из пп.1-8, в которой дополнительные бактериальные полисахариды или олигосахариды выбраны из группы, состоящей из капсульного полисахарида N. meningitidis серогруппы А, капсульного полисахарида N. meningitidis серогруппы С, капсульного полисахарида N. meningitidis серогруппы Y, капсульного полисахарида N. meningitidis серогруппы W,капсульного полисахарида Streptococcus pneumoniae серотипа 1, капсульного полисахарида S. pneumoniae серотипа 2, капсульного полисахарида S. pneumoniae серотипа 3, капсульного полисахарида S.pneumoniae серотипа 19 А, капсульного полисахарида S. pneumoniae серотипа 19F, капсульного полисахарида S. pneumoniae серотипа 20, капсульного полисахарида S. pneumoniae серотипа 22F, капсульного полисахарида S. pneumoniae серотипа 23F, капсульного полисахарида S. pneumoniae серотипа 33F, капсульного полисахарида группы I стрептококка группы В, капсульного полисахарида группы II стрептококка группы В, капсульного полисахарида группы III стрептококка группы В, капсульного полисахарида группы IV стрептококка группы В, капсульного полисахарида группы V стрептококка группы В, капсульного полисахарида Staphylococcus aureus типа 5, капсульного полисахарида Staphylococcus aureus типа 8, Vi полисахарида из Salmonella typhi, липополисахарида (LPS) N. meningitidis, LPS M. catarrhalis иLPS H. influenzae или их олигосахаридов. 10. Поливалентная иммуногенная композиция по любому из пп.1-9, в которой белок-носитель (белки-носители) выбран(ы) из группы, содержащей столбнячный анатоксин, дифтерийный анатоксин,CRM197, рекомбинантный дифтерийный токсин, ОМРС из N. meningitidis, пневмолизин из S. pneumoniae и белок D из H. influenzae. 11. Поливалентная иммуногенная композиция по любому из пп.1-9, в которой белок-носитель представляет собой столбнячный анатоксин. 12. Поливалентная иммуногенная композиция по п.10, в которой капсульный полисахарид или олигосахарид H. influenzae типа В и дополнительные полисахариды или олигосахариды не конъюгированы с одним и тем же носителем. 13. Поливалентная иммуногенная композиция по п.12, в которой капсульный полисахарид или олигосахарид H. influenzae типа В и дополнительные полисахариды или олигосахариды не все конъюгированы с CRM197. 14. Поливалентная иммуногенная композиция по любому из пп.1-13, в которой конъюгат белканосителя и полисахарида или олигосахарида получен при использовании 1-цианодиметиламинопиридиния тетрафторбората (CDAP). 15. Поливалентная иммуногенная композиция по любому из пп.1-14, содержащая 0,1-10 мкг каждого полисахарида или олигосахарида. 16. Способ приготовления поливалентной иммуногенной композиции по любому из пп.1-15, включающий смешивание индивидуальных компонентов композиции. 17. Применение поливалентной иммуногенной композиции по любому из пп.1-15 в производстве лекарства для лечения или предупреждения инфекций, вызванных Haemophilus influenzae типа В. 18. Способ иммунизации человека против инфекции, вызванной Haemophilus influenzae типа В,включающий введение человеку иммунопротективной дозы поливалентной иммуногенной композиции по любому из пп.1-15.
МПК / Метки
МПК: A61K 39/385, A61P 31/00
Метки: применения, композиции, способы, поливалентные, иммуногенные
Код ссылки
<a href="https://eas.patents.su/15-6313-polivalentnye-immunogennye-kompozicii-i-sposoby-ih-primeneniya.html" rel="bookmark" title="База патентов Евразийского Союза">Поливалентные иммуногенные композиции и способы их применения</a>
Предыдущий патент: Применение соли щелочного металла поли(пара-дигидроксифенилен) тиосульфокислоты в составах для ванн и способ лечения и профилактики заболеваний
Следующий патент: Способ ингибирования прогрессивного развития или стабилизации волчаночного нефрита
Случайный патент: Макроциклические ингибиторы сериновых протеаз гепатита с