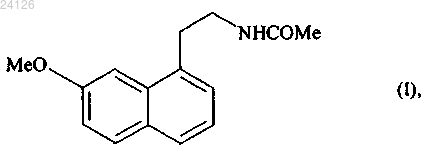
Способ синтеза агомелатина
Формула / Реферат
1. Способ синтеза в промышленных масштабах соединения формулы (I)
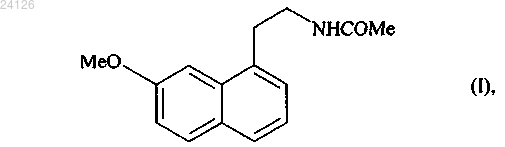
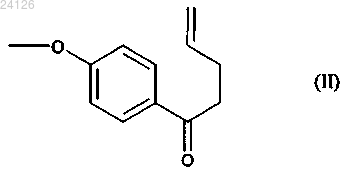
который отличается тем, что 1-(4-метоксифенил)-4-пентен-1-он формулы (II)
вводят в реакцию, в присутствии свободнорадикального инициатора, с соединением формулы (III)
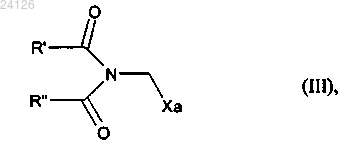
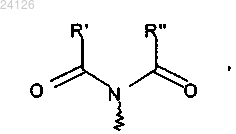
в которой R' и R", которые могут быть одинаковыми или различными, каждый представляет собой линейную или разветвленную (С1-С6)алкильную группу или R' и R" вместе образуют (С2-С3)алкиленовую цепь, при этом образованное таким образом кольцо может быть сконденсировано с фенильной группой, и Ха представляет собой группу -S-C(S)-OR, в которой R представляет собой линейную или разветвленную (С1-С6)алкильную группу,
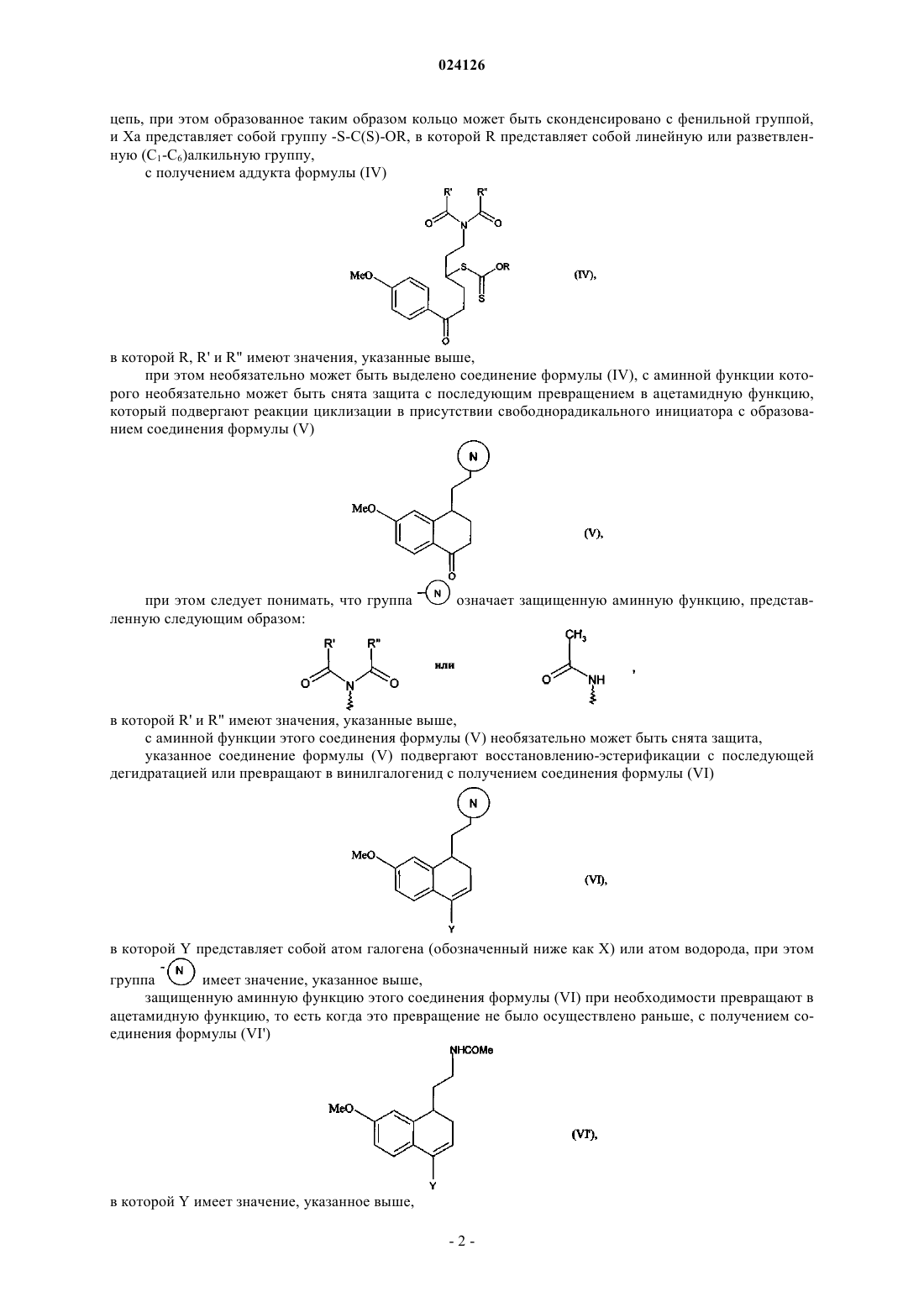
с получением аддукта формулы (IV)
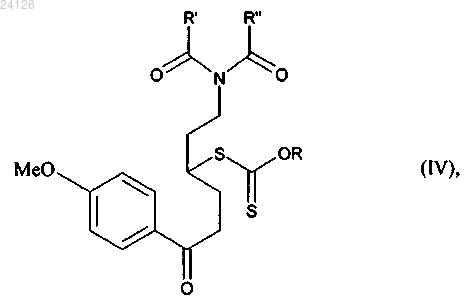
в которой R, R' и R" имеют значения, указанные выше,
при этом необязательно может быть выделено соединение формулы (IV), с аминной группы которого необязательно может быть снята защита с последующим превращением в ацетамидную группу,
который подвергают реакции циклизации в присутствии свободнорадикального инициатора с образованием соединения формулы (V)
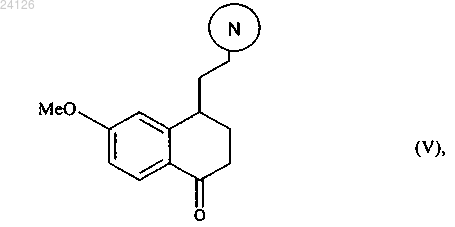
при этом следует понимать, что группа означает защищенную аминную группу, представленную следующим образом:
означает защищенную аминную группу, представленную следующим образом:

где R' и R" имеют значения, указанные выше,
с аминной группы этого соединения формулы (V) необязательно может быть снята защита,
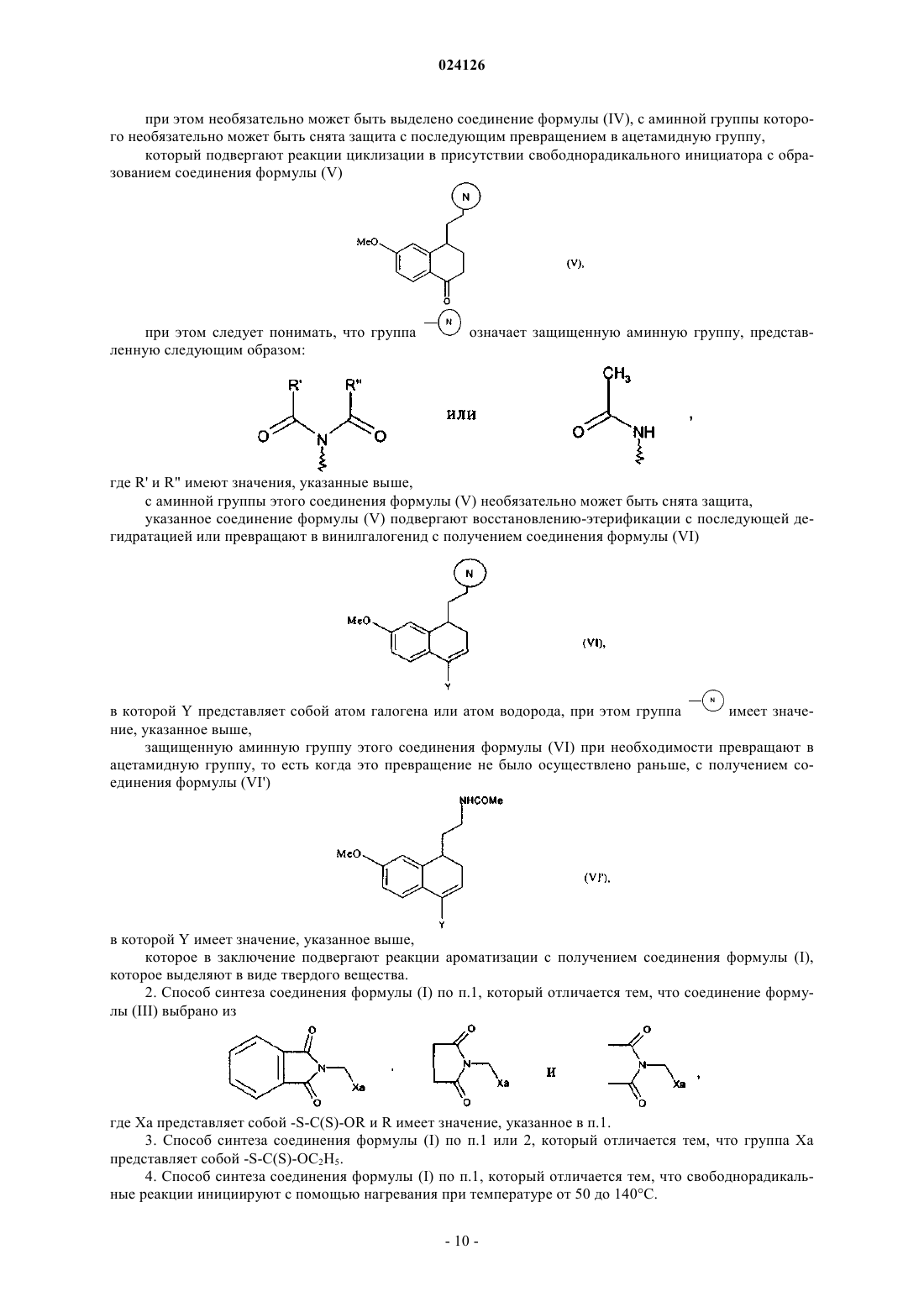
указанное соединение формулы (V) подвергают восстановлению-этерификации с последующей дегидратацией или превращают в винилгалогенид с получением соединения формулы (VI)

в которой Y представляет собой атом галогена или атом водорода, при этом группа имеет значение, указанное выше,
имеет значение, указанное выше,
защищенную аминную группу этого соединения формулы (VI) при необходимости превращают в ацетамидную группу, то есть когда это превращение не было осуществлено раньше, с получением соединения формулы (VI')
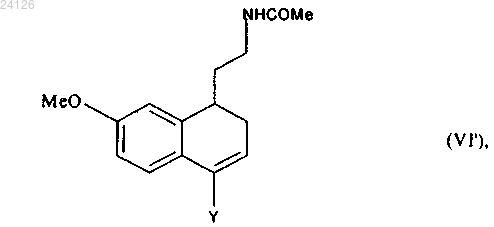
в которой Y имеет значение, указанное выше,
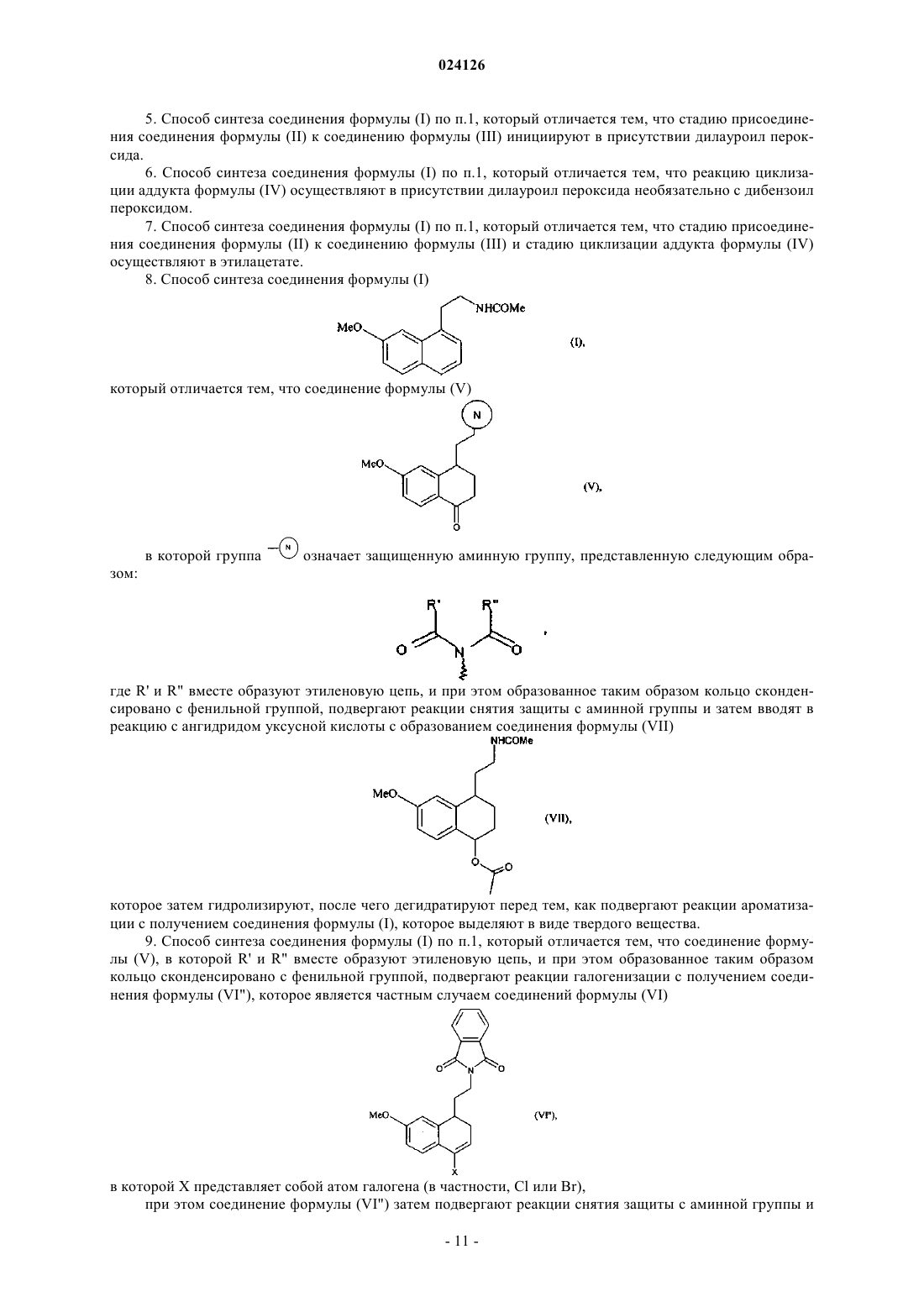
которое в заключение подвергают реакции ароматизации с получением соединения формулы (I), которое выделяют в виде твердого вещества.
2. Способ синтеза соединения формулы (I) по п.1, который отличается тем, что соединение формулы (III) выбрано из
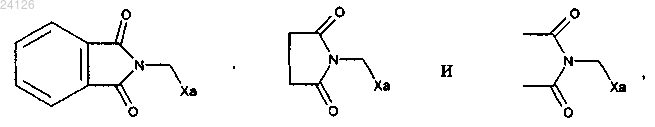
где Ха представляет собой -S-C(S)-OR и R имеет значение, указанное в п.1.
3. Способ синтеза соединения формулы (I) по п.1 или 2, который отличается тем, что группа Ха представляет собой -S-C(S)-OC2H5.
4. Способ синтеза соединения формулы (I) по п.1, который отличается тем, что свободнорадикальные реакции инициируют с помощью нагревания при температуре от 50 до 140°С.
5. Способ синтеза соединения формулы (I) по п.1, который отличается тем, что стадию присоединения соединения формулы (II) к соединению формулы (III) инициируют в присутствии дилауроил пероксида.
6. Способ синтеза соединения формулы (I) по п.1, который отличается тем, что реакцию циклизации аддукта формулы (IV) осуществляют в присутствии дилауроил пероксида необязательно с дибензоил пероксидом.
7. Способ синтеза соединения формулы (I) по п.1, который отличается тем, что стадию присоединения соединения формулы (II) к соединению формулы (III) и стадию циклизации аддукта формулы (IV) осуществляют в этилацетате.
8. Способ синтеза соединения формулы (I)
который отличается тем, что соединение формулы (V)
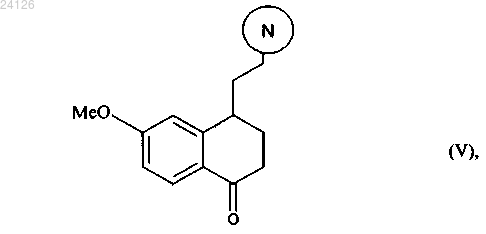
в которой группа означает защищенную аминную группу, представленную следующим образом:
означает защищенную аминную группу, представленную следующим образом:
где R' и R" вместе образуют этиленовую цепь, и при этом образованное таким образом кольцо сконденсировано с фенильной группой, подвергают реакции снятия защиты с аминной группы и затем вводят в реакцию с ангидридом уксусной кислоты с образованием соединения формулы (VII)

которое затем гидролизируют, после чего дегидратируют перед тем, как подвергают реакции ароматизации с получением соединения формулы (I), которое выделяют в виде твердого вещества.
9. Способ синтеза соединения формулы (I) по п.1, который отличается тем, что соединение формулы (V), в которой R' и R" вместе образуют этиленовую цепь, и при этом образованное таким образом кольцо сконденсировано с фенильной группой, подвергают реакции галогенизации с получением соединения формулы (VI"), которое является частным случаем соединений формулы (VI)
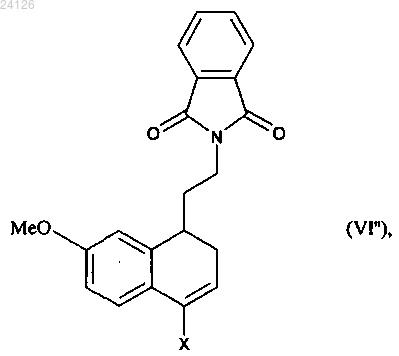
в которой X представляет собой атом галогена (в частности, Cl или Br),
при этом соединение формулы (VI") затем подвергают реакции снятия защиты с аминной группы и затем вводят в реакцию с ангидридом уксусной кислоты с образованием соединения формулы (VIter), которое является частным случаем соединений формулы (VI)

в которой X имеет значение, указанное выше,
и указанное соединение формулы (VIter) в заключение ароматизируют в основной среде с получением соединения формулы (I), которое выделяют в виде твердого вещества.
10. Способ синтеза соединения формулы (I) по п.1, который отличается тем, что реакцию снятия защиты с аминной группы соединения формулы (V), когда аминная группа защищена фталимидной группой, осуществляют в присутствии борогидрида натрия или реагента гидразинового типа.
11. Способ синтеза соединения формулы (I) по п.8, который отличается тем, что стадию ароматизации соединения формулы (VII) осуществляют с использованием бензохинона, такого как 2,3-дихлор-5,6-дициано-1,4-бензохинон (DDQ).
12. Способ синтеза соединения формулы (I) по п.9, который отличается тем, что ароматизацию соединения формулы (VIter) осуществляют в присутствии сильного ненуклеофильного основания.
13. Способ синтеза соединения формулы (I) по п.9, который отличается тем, что ароматизацию соединения формулы (VIter) осуществляют в присутствии пары алкоголят/спирт.
14. Способ синтеза соединения формулы (I) по п.13, который отличается тем, что ароматизацию соединения формулы (VIter) осуществляют в присутствии пары трет-бутилат калия/трет-бутанол или пары 3-метил-3-пентилат калия/3-метил-3-пентанол.
15. Способ синтеза соединения формулы (I) по п.1, который отличается тем, что присоединение соединения формулы (II) к соединению формулы (III), в которой R' и R", каждый, представляет собой метильную группу, осуществляют с получением аддукта формулы (IV')
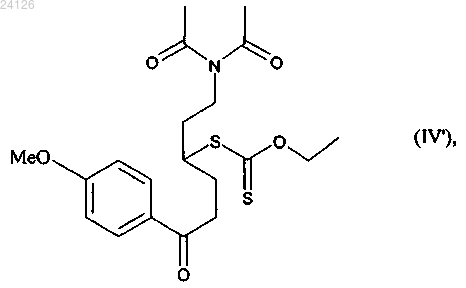
который подвергают реакции снятия защиты в присутствии основания (такого как триэтиламин) с получением соединения формулы (IV"), которое необязательно выделяют
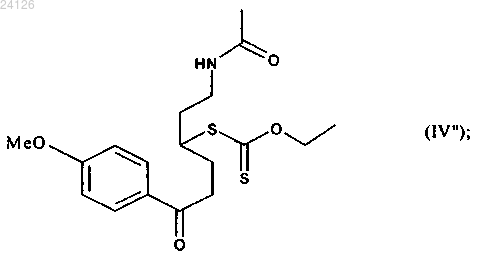
затем указанное соединение формулы (IV") подвергают реакции циклизации в присутствии свободнорадикального инициатора с получением соединения формулы (V'), которое является частным случаем соединений формулы (V)
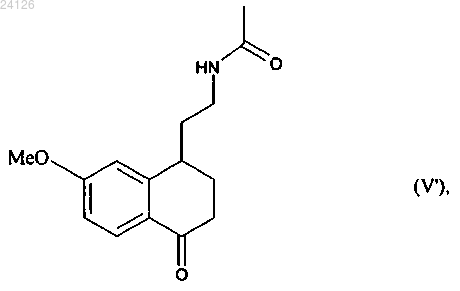
которое превращают в винилгалогенид и затем подвергают реакции ароматизации с получением соединения формулы (I), которое выделяют в виде твердого вещества.
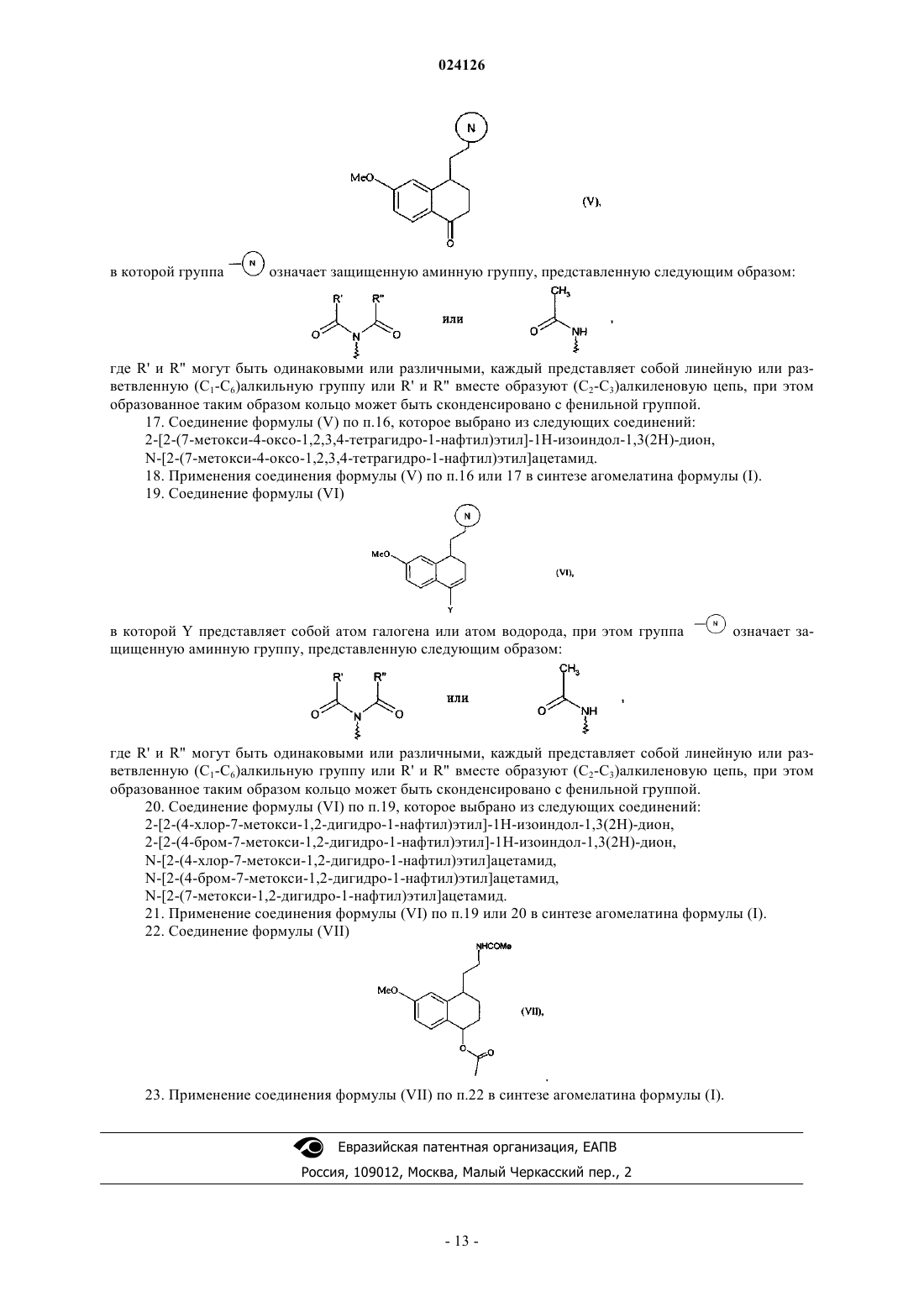
16. Соединение формулы (V)
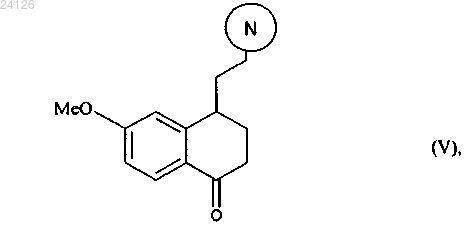
в которой группа означает защищенную аминную группу, представленную следующим образом:
означает защищенную аминную группу, представленную следующим образом:

где R' и R" могут быть одинаковыми или различными, каждый представляет собой линейную или разветвленную (С1-С6)алкильную группу или R' и R" вместе образуют (С2-С3)алкиленовую цепь, при этом образованное таким образом кольцо может быть сконденсировано с фенильной группой.
17. Соединение формулы (V) по п.16, которое выбрано из следующих соединений:
2-[2-(7-метокси-4-оксо-1,2,3,4-тетрагидро-1-нафтил)этил]-1H-изоиндол-1,3(2H)-дион,
N-[2-(7-метокси-4-оксо-1,2,3,4-тетрагидро-1-нафтил)этил]ацетамид.
18. Применения соединения формулы (V) по п.16 или 17 в синтезе агомелатина формулы (I).
19. Соединение формулы (VI)
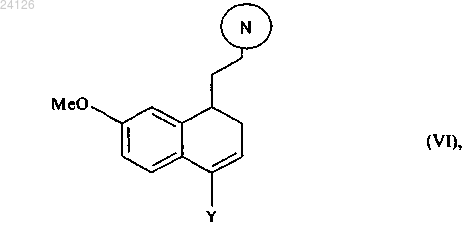
в которой Y представляет собой атом галогена или атом водорода, при этом группа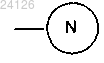 означает защищенную аминную группу, представленную следующим образом:
означает защищенную аминную группу, представленную следующим образом:

где R' и R" могут быть одинаковыми или различными, каждый представляет собой линейную или разветвленную (С1-С6)алкильную группу или R' и R" вместе образуют (С2-С3)алкиленовую цепь, при этом образованное таким образом кольцо может быть сконденсировано с фенильной группой.
20. Соединение формулы (VI) по п.19, которое выбрано из следующих соединений:
2-[2-(4-хлор-7-метокси-1,2-дигидро-1-нафтил)этил]-1H-изоиндол-1,3(2H)-дион,
2-[2-(4-бром-7-метокси-1,2-дигидро-1-нафтил)этил]-1H-изоиндол-1,3(2H)-дион,
N-[2-(4-хлор-7-метокси-1,2-дигидро-1-нафтил)этил]ацетамид,
N-[2-(4-бром-7-метокси-1,2-дигидро-1-нафтил)этил]ацетамид,
N-[2-(7-метокси-1,2-дигидро-1-нафтил)этил]ацетамид.
21. Применение соединения формулы (VI) по п.19 или 20 в синтезе агомелатина формулы (I).
22. Соединение формулы (VII)

23. Применение соединения формулы (VII) по п.22 в синтезе агомелатина формулы (I).
Текст
Способ синтеза в промышленных масштабах соединения формулы (I)(71)(73) Заявитель и патентовладелец: ЛЕ ЛАБОРАТУАР СЕРВЬЕ (FR) Настоящее изобретение относится к новому способу синтеза в промышленных масштабах агомелатина, или N-[2-(7-метокси-1-нафтил)этил]ацетамида, формулы (I) Агомелатин, или N-[2-(7-метокси-1-нафтил)этил]ацетамид, обладает ценными фармакологическими свойствами. В сущности, он обладает двойными свойствами будучи, с одной стороны, агонистом мелатонинергических рецепторов и, с другой стороны, агонистом 5-НТ 2 С рецептора. Эти свойства обеспечивают ему активность в центральной нервной системе и, в особенности, при лечении глубокой депрессии, сезонного аффективного расстройства, нарушения сна, сердечно-сосудистых патологий, патологий пищеварительной системы, бессонницы и усталости из-за нарушения суточного ритма организма, нарушения аппетита и ожирения. Агомелатин, его получение и его применение в терапии были описаны в европейских патентах ЕР 0447285 и ЕР 1564202. Принимая во внимание фармацевтическую ценность этого соединения, было важно сделать возможным получать его, используя эффективный способ синтеза в промышленных масштабах, который можно легко внедрить в промышленное производство и который обеспечивает получение агомелатина в хорошем количественном выходе и с отличной чистотой. В описании патента ЕР 0447285 описано получение агомелатина в восемь стадий, исходя из 7 метокси-1-тетралона. В описании патента ЕР 1564202 заявитель разработал новый, намного более эффективный и промышленно выполнимый путь синтеза только в четыре стадии, исходя из 7-метокси-1-тетралона, который дает возможность получить агомелатин высоковоспроизводимым способом в четко определенном кристаллическом виде. Однако поиск новых путей синтеза, особенно исходя из исходных веществ, которые менее дорогостоящие, чем 7-метокси-1-тетралон, в настоящее время все еще существенно важен. Заявитель продолжил свои исследования и разработал новый способ синтеза агомелатина, исходя из 1-(4-метоксифенил)-4-пентен-1-она и соединения ксантат. Эти новые исходные вещества имеют преимущества будучи легко и быстро получаемыми в больших количествах при меньшей стоимости. Этот путь синтеза базируется на осуществлении свободнорадикальных реакций, которые обычно не очень используются, но несмотря на это, являются очень эффективными. Модификация этих реакций для использования в промышленных масштабах, используя проточные реакторы непрерывного действия,является многообещающей, поскольку становится легче контролировать развитие цепной реакции. Кроме того, данный новый способ дает возможность получать агомелатин воспроизводимым методом и без необходимости в осуществлении сложной очистки, с чистотой, которая подходит для применения его в качестве фармацевтического активного ингредиента. В действительности, агомелатин можно,соответственно, синтезировать в 6 стадий, в ходе которых выделяют только одно из промежуточных соединений. Более точно, настоящее изобретение относится к способу синтеза в промышленных масштабах соединения формулы (I) вводят в реакцию в присутствии свободнорадикального инициатора с соединением формулы (III) в которой R' и R", которые могут быть одинаковыми или различными, каждый представляет собой линейную или разветвленную (С 1-С 6)алкильную группу или R' и R" вместе образуют (С 2-С 3)алкиленовую цепь, при этом образованное таким образом кольцо может быть сконденсировано с фенильной группой,и Ха представляет собой группу -S-C(S)-OR, в которой R представляет собой линейную или разветвленную (С 1-С 6)алкильную группу,с получением аддукта формулы (IV) в которой R, R' и R" имеют значения, указанные выше,при этом необязательно может быть выделено соединение формулы (IV), с аминной функции которого необязательно может быть снята защита с последующим превращением в ацетамидную функцию,который подвергают реакции циклизации в присутствии свободнорадикального инициатора с образованием соединения формулы (V) при этом следует понимать, что группа ленную следующим образом: означает защищенную аминную функцию, представ в которой R' и R" имеют значения, указанные выше,с аминной функции этого соединения формулы (V) необязательно может быть снята защита,указанное соединение формулы (V) подвергают восстановлению-эстерификации с последующей дегидратацией или превращают в винилгалогенид с получением соединения формулы (VI) в которой Y представляет собой атом галогена (обозначенный ниже как X) или атом водорода, при этом группа имеет значение, указанное выше,защищенную аминную функцию этого соединения формулы (VI) при необходимости превращают в ацетамидную функцию, то есть когда это превращение не было осуществлено раньше, с получением соединения формулы (VI') которое в заключение подвергают реакции ароматизации с получением соединения формулы (I),которое выделяют в виде твердого вещества. Соединение формулы (II) специалист в данной области техники с помощью обычных химических реакций и/или химических реакций, описанных в литературе (Pattisson, V.A. et al., J.Am. Chem. Soc. 1962,84, 4295). Предпочтительными соединениями формулы (III) являются где Ха = -S-C(S)-OR, как указано выше. В предпочтительной группе Ха R представляет собой этильную группу. В способах в соответствии с изобретением инициирование свободнорадикальной реакции осуществляют с помощью нагревания. Предпочтительно реакционную смесь нагревают при температуре от 50 до 140 С. Пероксиды являются свободнорадикальными инициаторами, которые особенно подходят для осуществления стадии присоединения соединения формулы (II) к соединению формулы (III) или для выполнения циклизации соединения формулы (IV) с образованием соединения формулы (V). В качестве примеров можно указать, в особенности, диизобутирил пероксид, кумил пероксинеодеканоат, трет-амил пероксинеодеканоат, ди(2-этилгексил) пероксидикарбонат, трет-бутил пероксинеодеканоат, дибутил пероксидикарбонат, дицетил пероксидикарбонат, димиристил пероксидикарбонат, трет-бутил пероксинеогептаноат, трет-амил пероксипивалат, дидеканоил пероксид, трет-амил перокси-2-этилгексаноат, третбутил пероксиизобутират, 1,4-ди(трет-бутилпероксикарбо)циклогексан, трет-бутил пероксиацетат, третбутил пероксибензоат, ди-трет-амил пероксид, трет-бутил кумил пероксид, бис(трет-бутил) пероксид,дикумил пероксид, дилауроил пероксид (DLP), дибензоил пероксид или ди(4-трет-бутилциклогексил) пероксидикарбонат. Предпочтительно реакции присоединения инициируют в присутствии дилауроил пероксида. В предпочтительном варианте осуществления изобретения реакцию циклизации аддукта формулы(IV) осуществляют в присутствии дилауроил пероксида необязательно с дибензоил пероксидом. Реакции присоединения и/или циклизации осуществляют в растворителе, обычно используемом в свободно-радикальной химии, таком как 1,2-дихлорэтан, дихлорметан, бензол, толуол, трифторметилбензол, хлорбензол, гексан, циклогексан, гептан, октан, этилацетат, трет-бутиловый спирт и их смесях. В способах в соответствии с изобретением предпочтительно использовать этилацетат. Когда аминная функция соединения формулы (V) защищена фталимидной группой (т.е. R' и R" вместе образуют этиленовую цепь, при этом образованное таким образом кольцо сконденсировано с фенильной группой),соединение формулы (V) преимущественно подвергают реакции снятия защиты с аминной функции и затем вводят в реакцию с ангидридом уксусной кислоты с образованием соединения формулы (VII) которое затем гидролизируют, после чего дегидратируют перед тем, как подвергают реакции ароматизации с получением соединения формулы (I), которое выделяют в виде твердого вещества; в качестве альтернативы соединение формулы (V) можно подвергать реакции галогенизации с получением соединения формулы (VI"), которое является частным случаем соединений формулы (VI) в которой X представляет собой атом галогена (предпочтительно Cl или Вг),при этом соединение формулы (VI") затем подвергают реакции снятия защиты с аминной функции и затем вводят в реакцию с ангидридом уксусной кислоты с образованием соединения формулы (VIter),которое является частным случаем соединений формулы (VI) в которой X имеет значение, указанное выше,и указанное соединение формулы (VIter) в заключение ароматизируют в основной среде с получением соединения формулы (I), которое выделяют в виде твердого вещества. В предпочтительном варианте осуществления изобретения реакцию снятия защиты с аминной функции, когда аминная функция защищена фталимидной группой, осуществляют в присутствии реагента-восстановителя, такого как борогидрид натрия. Также можно использовать реагент гидразинового типа. Предпочтительно стадию ароматизации соединения формулы (VII) можно осуществлять с использованием бензохинона, такого как 2,3-дихлор-5,6-дициано-1,4-бензохинон (DDQ), тогда как ароматизацию соединения формулы (VIter) преимущественно осуществляют в присутствии сильного ненуклеофильного основания. Последнюю реакцию осуществляют в полярной протоносодержащей среде. В предпочтительном варианте осуществления изобретения, ароматизацию соединения формулы (VIter) осуществляют в присутствии пары алкоголят/спирт, и даже более предпочтительно в присутствии пары трет-бутилат калия/трет-бутанол или пары 3-метил-3-пентилат калия/3-метил-3-пентанол. В другом варианте осуществления изобретения присоединение соединения формулы (II) к соединению формулы (III), в которой R' и R" каждый представляет собой метальную группу осуществляют с получением аддукта формулы (IV') который подвергают реакции снятия защиты в присутствии основания (такого как триэтиламин) с получением соединения формулы (IV"), которое необязательно выделяют затем указанное соединение формулы (IV") подвергают реакции циклизации в присутствии свободнорадикального инициатора с получением соединения формулы (V'), которое является частным случаем соединений формулы (V) которое превращают в винилгалогенид и затем подвергают реакции ароматизации с получением соединения формулы (I), которое выделяют в виде твердого вещества. Данный способ является особенно ценным по следующим причинам: он дает возможность получать соединение формулы (I) в промышленных масштабах с хорошими выходами, исходя из простого, недорогого исходного вещества; только промежуточное соединение формул (V) нуждается в стадии очистки и выделения. Соединения формул (V), (VI) и (VII), полученные в соответствии со способом изобретения, являются новыми и пригодными промежуточными соединениями в синтезе агомелатина. Предпочтительными соединениями формулы (V) являются следующие: Предпочтительными соединениями формулы (VI) являются следующие: Нижеприведенные примеры иллюстрируют изобретение, никоим образом не ограничивая его. С целью обоснования пути реакции промежуточные соединения синтеза были систематически выделены и охарактеризованы. Однако можно значительно оптимизировать методики, ограничив количество выделенных промежуточных соединений. Следовательно, пример 5, приведенный ниже, соответствует тому же самому пути реакции, который используется в примере 4, с разницей лишь в том, что был выделен только N-[2-(7-метокси-4-оксо-1,2,3,4-тетрагидро-1-нафтил)этил]ацетамид. Пример 1: N-[2-(7-метокси-1-нафтил)этил]ацетамид. Стадия А: S-[(1,3-диоксо-1,3-дигидро-2 Н-изоиндол-2-ил)метил]-О-этил дитиокарбонат. К холодному (0 С) раствору N-(хлорметил)фталимида (40.0 г, 205.0 ммоль) в ацетоне (400 мл) добавляют в последовательных порциях О-этилксантат калия (36.1 г, 225.0 ммоль). Реакционную смесь перемешивают при 0 С в течение 30 мин и затем упаривают растворитель. Полученный таким образом остаток вносят в воду. Водную фазу экстрагируют дихлорметаном, пока органические фазы сушат надMgSO4 и концентрируют при пониженном давлении. Полученный таким образом остаток перекристаллизируют из смеси этилацетата и петролейного эфира с получением указанного в заголовке продукта с выходом 74%. 1 Н ЯМР ( , м.д.) (CDCl3, 400 МГц) 7.90-7.84 (m, 2 Н, СН-2), 7.77-7.72 (m, 2 Н, СН-1), 5.33 (s, 2H,СН 2-5), 4.68 (q, 2H, J = 7.1 Гц, СН 2-7), 1.46 (t, 3 Н, J = 7.1 Гц, СН 3-8). 13 С ЯМР ( , м.д.) (CDCl3, 100 МГц) 210.2 (CS), 166.6 (NCO), 134.4 (СН-1), 131.8 (С-3), 123.6 (СН-2),-5 024126S-[1-[2-(1,3-диоксо-1,3-дигидро-2 Н-изоиндол-2-ил)этил]-4-(4-метоксифенил)-4 оксобутил]-О-этил дитиокарбонат. Смесь 1-(4-метоксифенил)-4-пентен-1-она (1-(4-метоксифенил)-4-пентен-1-он получают в соответствии с протоколом, описанным в Pattisson, V.A. et al., J.Am. Chem. Soc. 1962, 84, 4295) (11.0 г, 57.6 ммоль) и ксантата, полученного на стадии А (19.4 г, 69.2 ммоль), в этилацетате (580 мл) нагревают с обратным холодильником в атмосфере азота в течение 15 мин. Затем каждые 1.5 ч добавляют 10 мол.% дилауроил пероксида. После добавления 410 мол.% и 15 мол.% дилауроил пероксида в заключение растворитель упаривают и полученный остаток очищают с помощью колоночной флэш-хроматографии(петролейный эфир-этилацетат: 80-20) с получением указанного в заголовке соединения в виде масла с выходом 78%. МСВР (EI, m/z) Рассчитано для C24H25NO5S2: 471.1174; найдено: 471.1172. Стадия С: 2-[2-(7-метокси-4-оксо-1.2,3,4-тетрагидро-1-нафтил)этил 1-1 Н-изоиндол-1,3(2 Н)-дион. Раствор продукта, полученного на стадии В (20.6 г, 43.7 ммоль), в хлорбензоле (660 мл) нагревают с обратным холодильником в атмосфере азота в течение 15 мин. Затем каждые 15 мин добавляют 10 мол.% дилауроил пероксида, пока не израсходуется весь исходный реагент. Смесь охлаждают до температуры окружающей среды и концентрируют при пониженном давлении. Затем вносят ацетонитрил для того,чтобы большая часть соединений дилауроил пероксида выпала в осадок. Затем смесь фильтруют, концентрируют при пониженном давлении и очищают с помощью колоночной флэш-хроматографии (петролейный эфир-этилацетат: 90-10, затем 70-30) с получением указанного в заголовке продукта в виде твердого вещества с выходом 39%. МСВР (EI, m/z) Рассчитано для C21H19NO4: 349.1314; найдено: 349.1316. Стадия D: 4-[2-(ацетиламино)этил]-6-метокси-1,2,3,4-тетрагидро-1-нафтил ацетат. К раствору тетралона, полученного на стадии С (350 мг, 1.0 ммоль), в изопропаноле (10 мл) при температуре окружающей среды добавляют борогидрид натрия (190 мг, 5.0 ммоль). Смесь перемешивают с обратным холодильником в течение ночи и затем по каплям добавляют раствор гидроксида натрия(80 мг, 2.0 ммоль) в воде (2.0 мл). Смесь выдерживают при нагревании с обратным холодильником в течение 30 мин и затем добавляют ацетон (1.5 мл). Через 10 мин смесь охлаждают до температуры окружающей среды, а затем концентрируют при пониженном давлении. Полученное таким образом масло растворяют в дихлорметане (10 мл). Затем добавляют диметиламинопиридин (270 мг, 2.2 ммоль) с последующим добавлением по каплям ангидрида уксусной кислоты (210 мкл, 2.2 ммоль). Раствор перемешивают при температуре окружающей среды в течение 1 ч и затем добавляют воду. Значение рН раствора устанавливают на 8-9 с помощью добавления насыщенного раствора гидрокарбоната натрия. Водную фазу экстрагируют дихлорметаном и органические фазы промывают насыщенным раствором NaCl, сушат над сульфатом магния, фильтруют и упаривают. Указанное в заголовке соединение получают после очистки с помощью колоночной флэш-хроматографии (этилацетат-петролейный эфир: 90-10, затем этилацетат-метанол: 90-10) в виде масла с выходом 79%. МСВР (EI, m/z) Рассчитано для C17H23NO4: 305.1627; найдено: 305.1630. Стадия Е: N-[2-(7-метокси-1,2-дигидро-1-нафтил)этил]ацетамид. К раствору соединения, полученного на стадии D (261 мг, 0.86 ммоль), в смеси метанол/вода (2/0.2 мл) при температуре окружающей среды добавляют гидроксид натрия (86 мг, 2.14 ммоль). Смесь перемешивают в течение 1 ч при нагревании с обратным холодильником и затем раствор охлаждают. Добавляют соляную кислоту (2.6 мл, 2.6 ммоль, 1 н.) и смесь перемешивают в течение ночи. Водную фазу экстрагируют дихлорметаном и органические фазы промывают насыщенным раствором NaCl, сушат над сульфатом магния, фильтруют и упаривают. Указанное в заголовке соединение получают после очистки с помощью колоночной флэш-хроматографии (этилацетат-петролейный эфир: 90-10, затем этилацетатметанол: 90-10) в виде масла с выходом 61%. МСВР (EI, m/z) Рассчитано для C15H19NO2: 245.1416; найдено: 245.1413. Стадия F: N-[2-(7-метокси-1-нафтил)этил]ацетамид. К раствору соединения, полученного на стадии Е (100 мг, 0.41 ммоль), в дихлорметане (4 мл) добавляют при температуре окружающей среды DDQ (111 мг, 0.49 ммоль). Реакционную смесь перемешивают в течение 2 дней и затем промывают насыщенным раствором NaHCO3. Водную фазу экстрагируют этилацетатом и органические фазы собирают, а затем сушат с использованием соляного раствора, а затем над MgSO4. После фильтрования растворители упаривают при пониженном давлении и полученную сырую реакционную смесь очищают с помощью хроматографии на колонке с силикагелем (элюант: этилацетат/петролейный эфир 90/10, затем этилацетат/метанол 90/10) с получением указанного в заголовке продукта с выходом 48%. Пример 2: N-[2-(7-метокси-1-нафтил)этил]ацетамид. Стадия А: 2-[2-(7-метокси-4-оксо-1,2,3,4-тетрагидро-1-нафтил)этил]-1 Н-изоиндол-1,3(2 Н)-дион. Соединение получают, используя методики, описанные в стадиях А-С примера 1. Стадия В: 2-[2-(4-хлор-7-метокси-1,2-дигидро-1-нафтил)этил]-1 Н-изоиндол-1,3(2 Н)-дион. К раствору ДМФА (190 мкл, 2.4 ммоль) в 1.0 мл дихлорметана при 0 С по каплям добавляютPOCl3(190 мл, 2.0 ммоль) (Lilienkampf A. et al., Org. Letters. 2003, 5, 3387). Через 30 мин тетралон, полученный на стадии А (0.70 г, 2.0 ммоль), растворенный в дихлорметане (2.0 мл), по каплям добавляют к реагенту Вильсмайера. Температуре реакционной смеси позволяют установиться обратно до температуры окружающей среды. Смесь перемешивают, пока реагенты полностью не исчезнут (мониторинг осуществлен с помощью ТСХ). Затем добавляют насыщенный раствор ацетата натрия и затем раствор экстрагируют дихлорметаном. Органическую фазу промывают насыщенным раствором NaCl и водой и затем сушат над MgSO4, фильтруют и упаривают. Указанное в заголовке соединение получают с помощью колоночной флэш-хроматографии (петролейный эфир-этилацетат: 80-20) в виде твердого вещества с выходом 75%. МСВР (EI, m/z) Рассчитано для C21H18ClNO3: 367.0975; найдено: 367.0975. Стадия С: N-[2-(4-хлор-7-метокси-1,2-дигидро-1-нафтил)этил]ацетамид. К раствору соединения, полученного на стадии В (370 мг, 1.0 ммоль), в изопропаноле (10 мл) при температуре окружающей среды добавляют борогидрид натрия (190 мг, 5.0 ммоль). Смесь перемешивают в течение 3 ч при нагревании с обратным холодильником и затем по каплям добавляют раствор гидроксида натрия (80 мг, 2.0 ммоль) в воде (2.0 мл). Смесь выдерживают при нагревании с обратным холодильником в течение 30 мин и затем добавляют ацетон (1.5 мл). Через 10 мин смесь охлаждают до температуры окружающей среды, после чего концентрируют при пониженном давлении. Полученное таким образом масло растворяют в дихлорметане (10 мл). Затем добавляют диметиламинопиридин (270 мг, 2.2 ммоль) с последующим добавлением по каплям ангидрида уксусной кислоты (210 мкл, 2.2 ммоль). Раствор перемешивают при температуре окружающей среды в течение 1 ч и затем добавляют воду. Также добавляют несколько капель соляной кислоты (1 н.) с получением кислого рН. Водную фазу экстрагируют дихлорметаном и органические фазы промывают насыщенным раствором NaCl, сушат над сульфатом магния, фильтруют и упаривают. Указанное в заголовке соединение получают после очистки с помощью колоночной флэш-хроматографии (этилацетат-петролейный эфир: 90-10, затем этилацетат-метанол: 9010) в виде масла с выходом 71%. МСВР (EI, m/z) Рассчитано для C15H18ClNO2: 279.1026; найдено: 279.1030. Стадия D: N-[2-(7-метокси-1-нафтил)этил]ацетамид. К раствору соединения, полученного на стадии С (125 мг, 0.45 ммоль), в трет-бутаноле (1 мл) с обратным холодильником добавляют трет-бутилат калия (200 мг, 1.8 ммоль). Смесь перемешивают в течение 3 ч при нагревании с обратным холодильником и затем добавляют соляную кислоту (1 н.). Водную фазу экстрагируют дихлорметаном и органические фазы промывают насыщенным раствором NaCl, сушат над сульфатом магния, фильтруют и упаривают. Указанное в заголовке соединение получают после очистки с помощью колоночной флэш-хроматографии (этилацетат-петролейный эфир: 90-10, затем этилацетат-метанол: 90-10) в виде твердого вещества с выходом 68%. МСВР (EI, m/z) Рассчитано для C15H19NO3: 261.1365; найдено: 261.1369. Пример 3: N-[2-(7-метокси-1-нафтил)этил]ацетамид. Стадия А: 2-[2-(7-метокси-4-оксо-1,2,3,4-тетрагидро-1-нафтил)этил]-1 Н-изоиндол-1,3(2 Н)-дион. Соединение получают, используя методики, описанные в стадиях А-С примера 1. Стадия В: 2-[2-(4-бром-7-метокси-1,2-дигидро-1-нафтил)этил]-1H-изоиндол-1,3(2 Н)-дион. К холодному раствору трифенил фосфита (290 мкл, 1.1 ммоль) в дихлорметане (3.5 мл), выдержанному при -78 С в атмосфере азота, по каплям добавляют бром (60 мкл, 1.2 ммоль) (Spaggiari A. Et al., J.Org. Chem. 2007, 72, 2216). К раствору добавляют триэтиламин (180 мкл, 1.3 ммоль) и тетралон, полученный на стадии А (350 мг, 1.0 ммоль). Реакционную смесь перемешивают в течение 18 ч, пока е температура не установится обратно до температуры окружающей среды. Затем смесь нагревают с обратным холодильником в течение часа, после чего концентрируют и очищают с помощью колоночной флэш-хроматографии (петролейный эфир-этилацетат: 80-20). Указанного в заголовке соединение получают в виде масла с выходом 95%. МСВР (EI, m/z) Рассчитано для C21H18BrNO3: 411.0470; найдено: 411.0470. Стадия С: N-[2-(4-бром-7-метокси-1,2-дигидро-1-нафтил)этил]ацетамид. К раствору соединения, полученного на стадии В (390 мг, 0.95 ммоль), в изопропаноле (10 мл) при температуре окружающей среды добавляют борогидрид натрия (179 мг, 4.7 ммоль). Смесь перемешивают в течение 3 ч при нагревании с обратным холодильником и затем по каплям добавляют раствор гидроксида натрия (76 мг, 1.9 ммоль) в воде (2.0 мл). Смесь выдерживают при нагревании с обратным холодильником в течение 30 мин и затем добавляют ацетон (1.5 мл). Через 10 мин смесь охлаждают до температуры окружающей среды, после чего концентрируют при пониженном давлении. Полученное таким образом масло растворяют в дихлорметане (10 мл). Затем добавляют диметиламинопиридин (255 мг, 2.1 ммоль) с последующим добавлением по каплям ангидрида уксусной кислоты (200 мкл, 2.1 ммоль). Раствор перемешивают при температуре окружающей среды в течение 1 ч и затем добавляют воду. Также добавляют несколько капель соляной кислоты (1 н.) для получения кислого рН. Водную фазу экстрагируют дихлорметаном и органические фазы промывают насыщенным раствором NaCl, сушат над сульфатом магния, фильтруют и упаривают. Указанное в заголовке соединение получают после очистки с помощью колоночной флэш-хроматографии (этилацетат-петролейный эфир: 90-10, затем этилацетат-7 024126 метанол: 90-10) в виде масла с выходом 64%. МСВР (EI, m/z) Рассчитано для C15H18BrNO2: 323.0521; найдено: 323.0517. Стадия D: N-[2-(7-метокси-1-нафтил)этил]аиетамид. Соединение получают, используя методику, описанную в стадии D примера 2. Пример 4: N-[2-(7-метокси-1-нафтил)этил]ацетамид. Стадия А: S-[(ацетиламино)метил]-О-этил дитиокарбонат. Ацетамид (29.5 г, 0.50 моль) и параформальдегид (18.0 г, 0.6 моль) растворяют в ангидриде уксусной кислоты (250 мл) и уксусной кислоте (50 мл). Раствор нагревают при 80 С в течение 5 ч, охлаждают и упаривают. Затем 20 мас.% полученного в результате масла растворяют в этаноле (200 мл) и охлаждают до 0 С перед добавлением О-этилксантата калия (19.2 г, 0.12 моль). Реакционную смесь перемешивают при температуре окружающей среды в течение 6 ч и затем добавляют воду и большую часть этанола удаляют из смеси при пониженном давлении. Суспензию выдерживают при 0 С в течение 20 мин и фильтруют. После растворения остатка в дихлорметане органическую фазу сушат над сульфатом магния,фильтруют и упаривают с получением указанного в заголовке соединения в виде твердого вещества с выходом 57%. МСВР (EI, m/z) Рассчитано для C6H11NO2S2: 193.0231; найдено: 193.0230. Стадия В: S-[(диацетиламино)метил]-О-этил дитиокарбонат. Раствор ксантата, полученного на стадии А (5.93 г, 30.7 ммоль), в изопренил ацетате (45 мл) нагревают с обратным холодильником в течение ночи в присутствии нескольких кристаллов pтолуолсульфокислоты и затем охлаждают и концентрируют при пониженном давлении. Указанное в заголовке соединение получают в виде масла после очистки с помощью колоночной флэш-хроматографии(этилацетат-петролейный эфир: 80-20) в количественном выходе. МСВР (EI, m/z) Рассчитано для C8H13NO3S2: 235.0337; найдено: 235.0338. Стадия С: S-[1-[2-(диацетиламино)этил 1-4-(4-метоксифенил)-4-оксобутил]-О-этил дитиокарбонат. Соединение стадии В используют непосредственно без очистки. Масло, полученное на стадии выше (25 мас.%), добавляют к раствору 1-(4-метоксифенил)-4-пентен-1-она (2.92 г, 15.3 ммоль) в этилацетате (8 мл) и нагревают с обратным холодильником в атмосфере азота в течение 15 мин. Затем каждые 1.5 ч добавляют 10 мол.% дилауроил пероксида (305 мг). После добавления 210 мол.% и 15 мол.% дилауроил пероксида, растворитель упаривают. Указанное в заголовке соединение получают после очистки с помощью колоночной флэш-хроматографии (этилацетат-петролейный эфир: 90-10, затем чистый этилацетат) в виде масла с выходом 72%. МСВР (EI, m/z) Рассчитано для C20H27NO5S2: 425.1331; найдено: 425.1331. Стадия D: N-[2-(7-метокси-4-оксо-1,2,3,4-тетрагидро-1-нафтил)этил]ацетамид. Раствор соединения, полученного на стадии С (1.10 г, 2.59 ммоль), в этилацетате (52 мл) нагревают с обратным холодильником в атмосфере азота в течение 15 мин и затем каждые 1.5 ч добавляют дибензоил пероксид (940 мг, 3.88 ммоль) и 20 мол.% дилауроил пероксид (206 мг) до тех пор, пока реагент полностью не исчезнет. Затем смесь охлаждают до температуры окружающей среды и концентрируют при пониженном давлении. Полученное таким образом масло растворяют в метаноле (5 мл) в присутствии триэтиламина (3.6 мл) и затем нагревают с обратным холодильником в течение 1 ч. Смесь концентрируют при пониженном давлении и очищают с помощью колоночной флэш-хроматографии (этилацетат-петролейный эфир: 90-10, затем этилацетат-метанол: 80-20) с получением указанного в заголовке соединения в виде масла с выходом 56%. МСВР (EI, m/z) Рассчитано для C15H19NO3: 261.1365; найдено: 261.1369. Стадия Е: N-[2-(7-метокси-1-нафтил)этил]ацетамид. К раствору ДМФА (93 мкл, 1.2 ммоль) в 0.5 мл дихлорметана при 0 С по каплям добавляют POCl3(92 мл, 1.0 ммоль). Через 30 мин тетралон, полученный на стадии D (261 мг, 1.0 ммоль), растворенный в дихлорметане (1 мл), по каплям добавляют к реагенту Вильсмайера. Температуре реакционной смеси позволяют установиться обратно до температуры окружающей среды с перемешиванием в течение ночи. Затем добавляют насыщенный раствор ацетата натрия (NaOAc) и затем раствор экстрагируют дихлорметаном. Органическую фазу промывают с использованием насыщенного раствора NaCl и воды и затем сушат над MgSO4, фильтруют и упаривают. Остаток растворяют в трет-бутаноле (2 мл) и нагревают с обратным холодильником. Добавляют трет-бутилат калия (450 мг, 4.0 ммоль) и смесь выдерживают при нагревании с обратным холодильником в течение 3 ч. После охлаждения до температуры окружающей среды добавляют соляную кислоту (1 н.). Водную фазу экстрагируют дихлорметаном и органическую фазу промывают насыщенным раствором NaCl и затем сушат над MgSO4, фильтруют и упаривают, указанное в заголовке соединение получают после очистки с помощью колоночной флэш-хроматографии(этилацетат-петролейный эфир: 90-10, затем этилацетат-метанол: 90-10) в виде твердого вещества с выходом 53%. МСВР (EI, m/z) Рассчитано для C15H19NO3: 261.1365; найдено: 261.1369. Пример 5: N-[2-(7-метокси-1-нафтил)этил]ацетамид. Стадия А: S-[(Ацетиламино)метил]-О-этил дитиокарбонат. Указанное в заголовке соединение получают в соответствии с экспериментальным протоколом,-8 024126 описанным в примере 4. Стадия В: N-[2-(7-метокси-4-оксо-1,2,3,4-тетрагидро-1-нафтил)этил]ацетамид. Раствор ксантата, полученного на стадии А (9.34 г, 48.3 ммоль), в изопренил ацетате (75 мл) нагревают с обратным холодильником в течение 3 ч в присутствии нескольких кристалов pтолуолсульфокислоты и затем упаривают с получением S-[(диацетиламино)метил]-O-этил дитиокарбоната. Образец полученного таким образом сырого продукта (1.0 г) добавляют к раствору 1-(4 метоксифенил)-4-пентен-1-она (800 мг, 4.20 ммоль) в этилацетате (4 мл) и нагревают с обратным холодильником в атмосфере азота в течение 15 мин. Затем каждые 1.5 ч добавляют 10 мол.% дилауроил пероксида (170 мг). После добавления 410 мол.% и 15 мол.% дилауроил пероксида растворитель упаривают с получением S-[1-[2-(диацетиламино)этил]-4-(4-метоксифенил)-4-оксобутил]-O-этил дитиокарбоната. Полученный таким образом сырой продукт растворяют в этилацетате (85 мл). Раствор нагревают с обратным холодильником в атмосфере азота в течение 15 мин и затем каждые 1.5 ч добавляют дибензоил пероксид (1.53 г, 6.30 ммоль) и 20 мол.% дилауроил пероксид (335 мг) до тех пор, пока реагент полностью не исчезнет. Затем смесь охлаждают до температуры окружающей среды и концентрируют при пониженном давлении. Полученное таким образом масло растворяют в метаноле (8.5 мл) в присутствии триэтиламина (5.9 мл) и затем нагревают с обратным холодильником в течение 1 ч. Смесь концентрируют при пониженном давлении и очищают с помощью колоночной флэш-хроматографии (этилацетатпетролейный эфир: 90-10, затем этил ацетат-метанол: 80-20) с получением указанного в заголовке соединения в виде масла с выходом 44%. МСВР (EI, m/z) Рассчитано для C15H19NO3: 261.1365; найдено: 261.1369. Стадия С: N-[2-(7-метокси-1-нафтил)этил]ацетамид. Указанное в заголовке соединение получают в соответствии с протоколом, описанным в стадии Е примера 4. МСВР (EI, m/z) Рассчитано для C15H19NO3: 261.1365; найдено: 261.1369. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ синтеза в промышленных масштабах соединения формулы (I) в которой R' и R", которые могут быть одинаковыми или различными, каждый представляет собой линейную или разветвленную (С 1-С 6)алкильную группу или R' и R" вместе образуют (С 2-С 3)алкиленовую цепь, при этом образованное таким образом кольцо может быть сконденсировано с фенильной группой,и Ха представляет собой группу -S-C(S)-OR, в которой R представляет собой линейную или разветвленную (С 1-С 6)алкильную группу,с получением аддукта формулы (IV) при этом необязательно может быть выделено соединение формулы (IV), с аминной группы которого необязательно может быть снята защита с последующим превращением в ацетамидную группу,который подвергают реакции циклизации в присутствии свободнорадикального инициатора с образованием соединения формулы (V) при этом следует понимать, что группа ленную следующим образом: означает защищенную аминную группу, представ где R' и R" имеют значения, указанные выше,с аминной группы этого соединения формулы (V) необязательно может быть снята защита,указанное соединение формулы (V) подвергают восстановлению-этерификации с последующей дегидратацией или превращают в винилгалогенид с получением соединения формулы (VI) в которой Y представляет собой атом галогена или атом водорода, при этом группа имеет значение, указанное выше,защищенную аминную группу этого соединения формулы (VI) при необходимости превращают в ацетамидную группу, то есть когда это превращение не было осуществлено раньше, с получением соединения формулы (VI') в которой Y имеет значение, указанное выше,которое в заключение подвергают реакции ароматизации с получением соединения формулы (I),которое выделяют в виде твердого вещества. 2. Способ синтеза соединения формулы (I) по п.1, который отличается тем, что соединение формулы (III) выбрано из где Ха представляет собой -S-C(S)-OR и R имеет значение, указанное в п.1. 3. Способ синтеза соединения формулы (I) по п.1 или 2, который отличается тем, что группа Ха представляет собой -S-C(S)-OC2H5. 4. Способ синтеза соединения формулы (I) по п.1, который отличается тем, что свободнорадикальные реакции инициируют с помощью нагревания при температуре от 50 до 140 С. 5. Способ синтеза соединения формулы (I) по п.1, который отличается тем, что стадию присоединения соединения формулы (II) к соединению формулы (III)инициируют в присутствии дилауроил пероксида. 6. Способ синтеза соединения формулы (I) по п.1, который отличается тем, что реакцию циклизации аддукта формулы (IV) осуществляют в присутствии дилауроил пероксида необязательно с дибензоил пероксидом. 7. Способ синтеза соединения формулы (I) по п.1, который отличается тем, что стадию присоединения соединения формулы (II) к соединению формулы (III) и стадию циклизации аддукта формулы (IV) осуществляют в этилацетате. 8. Способ синтеза соединения формулы (I) который отличается тем, что соединение формулы (V) означает защищенную аминную группу, представленную следующим обра зом: где R' и R" вместе образуют этиленовую цепь, и при этом образованное таким образом кольцо сконденсировано с фенильной группой, подвергают реакции снятия защиты с аминной группы и затем вводят в реакцию с ангидридом уксусной кислоты с образованием соединения формулы (VII) которое затем гидролизируют, после чего дегидратируют перед тем, как подвергают реакции ароматизации с получением соединения формулы (I), которое выделяют в виде твердого вещества. 9. Способ синтеза соединения формулы (I) по п.1, который отличается тем, что соединение формулы (V), в которой R' и R" вместе образуют этиленовую цепь, и при этом образованное таким образом кольцо сконденсировано с фенильной группой, подвергают реакции галогенизации с получением соединения формулы (VI"), которое является частным случаем соединений формулы (VI) в которой X представляет собой атом галогена (в частности, Cl или Br),при этом соединение формулы (VI") затем подвергают реакции снятия защиты с аминной группы и затем вводят в реакцию с ангидридом уксусной кислоты с образованием соединения формулы (VIter),которое является частным случаем соединений формулы (VI) в которой X имеет значение, указанное выше,и указанное соединение формулы (VIter) в заключение ароматизируют в основной среде с получением соединения формулы (I), которое выделяют в виде твердого вещества. 10. Способ синтеза соединения формулы (I) по п.1, который отличается тем, что реакцию снятия защиты с аминной группы соединения формулы (V), когда аминная группа защищена фталимидной группой, осуществляют в присутствии борогидрида натрия или реагента гидразинового типа. 11. Способ синтеза соединения формулы (I) по п.8, который отличается тем, что стадию ароматизации соединения формулы (VII) осуществляют с использованием бензохинона, такого как 2,3-дихлор-5,6 дициано-1,4-бензохинон (DDQ). 12. Способ синтеза соединения формулы (I) по п.9, который отличается тем, что ароматизацию соединения формулы (VIter) осуществляют в присутствии сильного ненуклеофильного основания. 13. Способ синтеза соединения формулы (I) по п.9, который отличается тем, что ароматизацию соединения формулы (VIter) осуществляют в присутствии пары алкоголят/спирт. 14. Способ синтеза соединения формулы (I) по п.13, который отличается тем, что ароматизацию соединения формулы (VIter) осуществляют в присутствии пары трет-бутилат калия/трет-бутанол или пары 3-метил-3-пентилат калия/3-метил-3-пентанол. 15. Способ синтеза соединения формулы (I) по п.1, который отличается тем, что присоединение соединения формулы (II) к соединению формулы (III), в которой R' и R", каждый, представляет собой метильную группу, осуществляют с получением аддукта формулы (IV') который подвергают реакции снятия защиты в присутствии основания (такого как триэтиламин) с получением соединения формулы (IV"), которое необязательно выделяют затем указанное соединение формулы (IV") подвергают реакции циклизации в присутствии свободнорадикального инициатора с получением соединения формулы (V'), которое является частным случаем соединений формулы (V) которое превращают в винилгалогенид и затем подвергают реакции ароматизации с получением соединения формулы (I), которое выделяют в виде твердого вещества. 16. Соединение формулы (V) означает защищенную аминную группу, представленную следующим образом: где R' и R" могут быть одинаковыми или различными, каждый представляет собой линейную или разветвленную (С 1-С 6)алкильную группу или R' и R" вместе образуют (С 2-С 3)алкиленовую цепь, при этом образованное таким образом кольцо может быть сконденсировано с фенильной группой. 17. Соединение формулы (V) по п.16, которое выбрано из следующих соединений: 2-[2-(7-метокси-4-оксо-1,2,3,4-тетрагидро-1-нафтил)этил]-1H-изоиндол-1,3(2H)-дион,N-[2-(7-метокси-4-оксо-1,2,3,4-тетрагидро-1-нафтил)этил]ацетамид. 18. Применения соединения формулы (V) по п.16 или 17 в синтезе агомелатина формулы (I). 19. Соединение формулы (VI) в которой Y представляет собой атом галогена или атом водорода, при этом группа щищенную аминную группу, представленную следующим образом: означает за где R' и R" могут быть одинаковыми или различными, каждый представляет собой линейную или разветвленную (С 1-С 6)алкильную группу или R' и R" вместе образуют (С 2-С 3)алкиленовую цепь, при этом образованное таким образом кольцо может быть сконденсировано с фенильной группой. 20. Соединение формулы (VI) по п.19, которое выбрано из следующих соединений: 2-[2-(4-хлор-7-метокси-1,2-дигидро-1-нафтил)этил]-1H-изоиндол-1,3(2H)-дион,2-[2-(4-бром-7-метокси-1,2-дигидро-1-нафтил)этил]-1H-изоиндол-1,3(2H)-дион,N-[2-(4-хлор-7-метокси-1,2-дигидро-1-нафтил)этил]ацетамид,N-[2-(4-бром-7-метокси-1,2-дигидро-1-нафтил)этил]ацетамид,N-[2-(7-метокси-1,2-дигидро-1-нафтил)этил]ацетамид. 21. Применение соединения формулы (VI) по п.19 или 20 в синтезе агомелатина формулы (I). 22. Соединение формулы (VII) 23. Применение соединения формулы (VII) по п.22 в синтезе агомелатина формулы (I). Евразийская патентная организация, ЕАПВ Россия, 109012, Москва, Малый Черкасский пер., 2
МПК / Метки
МПК: C07D 209/48, C07C 233/31, C07C 231/14, C07C 233/18
Метки: синтеза, агомелатина, способ
Код ссылки
<a href="https://eas.patents.su/14-24126-sposob-sinteza-agomelatina.html" rel="bookmark" title="База патентов Евразийского Союза">Способ синтеза агомелатина</a>
Предыдущий патент: Увлажняющие средства
Случайный патент: Комбинированный металлокорд