Синтез стирилпиридинов, меченных радиоактивным изотопом 18f, из предшественников тозилата и их стабильные фармацевтические композиции
Номер патента: 23014
Опубликовано: 29.04.2016
Авторы: Лим Натаниел, Голдинг Джефф, Чжан Вэй, Бенедум Тайлер
Формула / Реферат
1. Радиофармацевтическая композиция для позитронно-эмиссионной томографии (ПЭТ) нейродегенеративных заболеваний головного мозга, включающая
эффективное количество 18F-меченого соединения, представляющего собой ((E)-4-(2-(6-(2-(2-(2-[18F]фторэтокси)этокси)этокси)пиридин-3-ил)винил)-N-метилбензоламин (18F-AV-45);
приблизительно 10% (об./об.) этилового спирта и
приблизительно 90% (об./об.) 0,9% раствора хлорида натрия, включающего приблизительно 0,5% (мас./об.) аскорбата натрия.
2. Радиофармацевтическая композиция по п.1, где pH радиофармацевтической композиции составляет от приблизительно 4,5 до приблизительно 8,0.
3. Радиофармацевтическая композиция по любому из пп.1, 2, где радиофармацевтическая композиция содержит 18F-меченое соединение, содержание которого больше или равно примерно 90% при измерении по меньшей мере примерно через 4 ч после окончания синтеза.
4. Радиофармацевтическая композиция по п.1, предназначенная для диагностики нейродегенеративного заболевания, которое предпочтительно является по меньшей мере одним из нижеперечисленных: слабоумие, когнитивные нарушения, болезнь Альцгеймера, болезнь Паркинсона, деменция с тельцами Леви и сосудистая деменция.
5. Способ диагностики нейродегенеративных заболеваний у пациентов, который включает следующие стадии:
введение пациенту радиофармацевтической композиции по любому из пп.1-4;
получение изображения по меньшей мере части головного мозга пациента и
выявление мишени.
6. Способ по п.5, в котором стадия получения изображения выполняется с помощью позитронно-эмиссионной томографии (ПЭТ), одновременного проведения ПЭТ и компьютерной томографии (ПЭТ/КТ), одновременного проведения ПЭТ и магнитно-резонансной томографии (ПЭТ/MPT) или их комбинации.
7. Способ получения радиофармацевтической композиции по п.1, который включает следующие стадии:
получение моно-Вос-защищенного виниланилина;
преобразование Boc-виниланилина в метил Вос-виниланилин;
взаимодействие 2-галоген 5-йодопиридина с триэтиленгликолем;
взаимодействие метил Вос-виниланилина с соединением, полученным в результате реакции 2-галоген 5-йодопиридина с триэтиленгликолем с получением (Е)-трет-бутил 4-(2-(6-(2-(2-(2-гидроксиэтокси)этокси)этокси)пиридин-3-ил)винил)фенил(метил)карбамата;
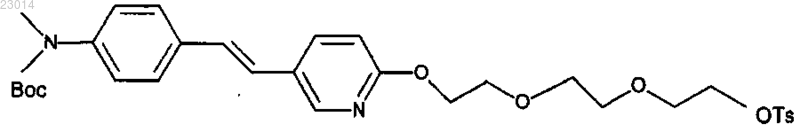
взаимодействие (Е)-трет-бутил 4-(2-(6-(2-(2-(2-гидроксиэтокси)этокси)этокси)пиридин-3-ил)винил)фенил(метил)карбамата с тозилхлоридом с получением (Е)-2-(2-(2-(5-(4-(трет-бутоксикарбонил(метил)амино)стирил)пиридин-2-илокси)этокси)этокси)этил 4-метилбензолсульфоната;
взаимодействие (Е)-2-(2-(2-(5-(4-(трет-бутоксикарбонил(метил)амино)стирил)пиридин-2-илокси)этокси)этокси)этил 4-метилбензолсульфоната с 18F-фторид-ионом в растворе диметилсульфоксида (ДМСО) или апротонным растворителем с высокой температурой кипения с получением ((E)-4-(2-(6-(2-(2-(2-[18F]фторэтокси)этокси)этокси)пиридин-3-ил)винил)-N-метилбензоламина);
выделение ((Е)-4-(2-(6-(2-(2-(2-[18F]фторэтокси)этокси)этокси)пиридин-3-ил)винил)-N-метилбензоламина);
очистка ((E)-4-(2-(6-(2-(2-(2-[18F]фторэтокси)этокси)этокси)пиридин-3-ил)винил)-N-метилбензоламина) и
получение ((Е)-4-(2-(6-(2-(2-(2-[18F]фторэтокси)этокси)этокси)пиридин-3-ил)винил)-N-метилбензоламина) в водном растворе этилового спирта, содержащего по меньшей мере приблизительно 10% (об./об.) этилового спирта и приблизительно 90% (об./об.) 0,9% раствора хлорида натрия, включающего приблизительно 0,5% (мас./об.) аскорбата натрия.
8. Соединение формулы
Текст
СИНТЕЗ СТИРИЛПИРИДИНОВ, МЕЧЕННЫХ РАДИОАКТИВНЫМ ИЗОТОПОМ 18F,ИЗ ПРЕДШЕСТВЕННИКОВ ТОЗИЛАТА И ИХ СТАБИЛЬНЫЕ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ Настоящее изобретение относится к радиофармацевтической композиции для позитронноэмиссионной томографии (ПЭТ) нейродегенеративных заболеваний головного мозга,включающей эффективное количество 18F-меченого соединения, представляющего собой Е)-4(2-(6-(2-(2-(2-[18F]фторэтокси)этокси)этокси)пиридин-3-ил)винил)-N-метилбензоламина (18F-AV45); приблизительно 10,0% (об./об.) этилового спирта и приблизительно 90% (об./об.) 0,9% раствора хлорида натрия, включающего приблизительно 0,5% (мас./об.) аскорбата натрия. Также настоящее изобретение относится к Е)-4-(2-(6-(2-(2-(2-[18F]фторэтокси)этокси)этокси)пиридин 3-ил)винил)-N-метилбензоламину и способу его синтеза. Изобретение также относится к способу диагностики нейродегенеративных заболеваний у пациентов, включающему введение указанного соединения пациенту. Предпосылки создания изобретения В соответствии с разделом 35 Кодекса Соединенных Штатов,119(е) данная заявка претендует на приоритет предварительной заявки на патент США 61/141885, поданной 31 декабря 2008 г., содержание которой включено в настоящий документ посредством ссылки во всей полноте. Область техники изобретения Изобретение относится к методам синтеза F-меченых радиофармпрепаратов, применяемых для исследования головного мозга, а более конкретно к методам синтеза 18F-меченого стирилпиридина с предшественником тозилата и получения стабильных фармацевтических композиций, содержащих 18Fмеченые радиофармпрепараты, применяемые для исследования головного мозга. Предшествующий уровень техники Болезнь Альцгеймера (БА) является прогрессирующим нейродегенеративным заболеванием, которое характеризуется снижением когнитивных функций, необратимой потерей памяти, дезориентацией и нарушениями речи. БА развивается у 10% людей в возрасте старше 65 лет и по меньшей мере у 50% людей в возрасте старше 85 лет. Случаи заболевания БА были зарегистрированы у пациентов в возрасте 4050 лет, но в связи с тем, что без проведения гистологического исследования мозговой ткани наличие этого заболевания трудно установить, момент начала заболевания при жизни больных остается неизвестным. В настоящее время единственным способом точного определения БА является исследование мозговой ткани, которое, как правило, проводится при вскрытии. Во время вскрытия врачи-эксперты исследуют мозговую ткань на предмет наличия в ней избыточных нейритических бляшек (НБ), состоящих из накоплений -амилоидных пептидов и нейрофибриллярных связок (НФС), образованных из нитей гиперфосфорилированных тау-белков, являющихся отличительной особенностью развития болезни БА. Накопления амилоидов образуются путем агрегации амилоидных пептидов и последующим объединением с другими агрегатами и/или амилоидными пептидами. Фибриллярные агрегаты амилоидных пептидовA1-40 и A1-42 являются основными метаболитами-пептидами, образованными из белкапредшественника амилоида, входящими в состав НБ и цереброваскулярных накоплений амилоида у пациентов с БА. Болезнь Паркинсона (БП) является прогрессирующим нейродегенеративным заболеванием с такими характерными симптомами, как тремор покоя, брадикинезия, мышечная ригидность и постуральная нестабильность. БП обычно развивается у людей старше 60 лет, хотя 15% диагностированных пациентов моложе 50 лет. Семейная предрасположенность к БП является этиологическим фактором у 5-10% пациентов с диагнозом болезни Паркинсона, но только в 1% случаев наследственная связь была явно подтверждена. По оценкам специалистов 1,5 млн американцев в настоящее время живут с БП. Деменция с тельцами Леви (ДТЛ) является прогрессирующим заболеванием головного мозга с симптомами различной степени выраженности. К таким симптомам относятся прогрессирующее слабоумие,паркинсонические нарушения движений, галлюцинации и повышенная чувствительность к нейролептическим препаратам. Как и в случае БА, пожилой возраст считается наибольшим фактором риска возникновения ДТЛ - в среднем симптомы заболевания появляются обычно в возрасте от 50 до 85 лет. Кроме того, 20% всех случаев слабоумия вызваны ДТЛ, а у более 50% пациентов с БП развивается "деменция при болезни Паркинсона" (ДБП), являющаяся разновидностью ДТЛ. ДТЛ может возникать как отдельно,так и одновременно с другими патологиями головного мозга, включая БА и БП, как упоминалось выше. В настоящее время окончательный диагноз ДТЛ можно установить только после вскрытия. БП и ДТЛ имеют одинаковую этиологию дофаминовой недостаточности, которая связана с гибелью дофаминергических нейронов черной субстанции. Причина гибели дофаминергических нейронов при БП до сих пор не определена, хотя похоже, что агрегаты -синуклеина в мозгу могут иметь отношение к потере дофаминергических нейронов полосатого тела. Считается также, что причиной гибели дофаминергических нейронов при ДТЛ являются аномальные накопления белка, содержащие -синуклеин, называемые "тельцами Леви". Тельца Леви встречаются, в основном, в области черной субстанции и голубого пятна ствола головного мозга, а также в подкорковых и корковых отделах головного мозга. В связи с тем, что тельца Леви локализованы именно в этих областях головного мозга, они могут препятствовать выработке ацетилхолина, что приводит к нарушению процессов восприятия и мышления и влияет на поведение больных. Тельца Леви считаются одной из разновидностей нейритических бляшек (НБ), поскольку они состоят из агрегатов накоплений белка, содержащих -синуклеин. Этиология нейродегенеративных заболеваний также может включать в себя несколько различных патологий, в том числе уменьшение капиллярного кровотока, т.е. перфузии, головного мозга. Например,при нарушении, которое обычно называют "смешанной деменцией", зачастую наблюдается одновременно снижение перфузии и образование амилоидных бляшек. Термин "смешанная деменция" имеет различные значения, но обычно он используется для обозначения одновременного наличия БА и сосудистой деменции (СД), особенно в тех случаях, когда СД вызвана образованием многочисленных микротромбов в сосудистой системе головного мозга. Хотя в настоящее время мало что известно о действительной распространенности смешанной деменции, эта форма нейродегенерации является клинически важной, по-1 023014 скольку сочетание БА и СД может оказывать большее влияние на головной мозг, чем каждое из этих нарушений в отдельности. Смешанную деменцию очень трудно диагностировать традиционными методами. Симптомы этого заболевания аналогичны симптомам как БА, так и СД, а также их сочетанию. Накопление амилоидов в головном мозге характерно и для многих других заболеваний, к числу которых относятся, помимо прочего, средиземноморская лихорадка, синдром Макла-Уэллса, миеломная болезнь неясного происхождения, амилоидная полинейропатия, амилоидная кардиомиопатия, системный амилоидоз с образованием нейритических бляшек, амилоидная полинейропатия, наследственное внутримозговое кровоизлияние с амилоидозом, синдром Дауна, болезнь скрепи, болезнь КрейтцфельдтаЯкоба, болезнь куру, синдром Герстманна-Штраусслера-Шейнкера, медуллярный рак щитовидной железы, изолированный амилоидоз предсердий, 2-микроглобулиновый амилоидоз у диализных больных,миозит с включенными тельцами, 2-амилоидные отложения при заболеваниях, вызывающих мышечное истощение, инсулинома клеток островков Лангерганса у больных сахарным диабетом 2 типа. В связи с тем, что наличие нейритических бляшек (НБ) играет важную роль при диагностике нейродегенеративных заболеваний, большой интерес вызывает получение лиганд, меченых радиоактивным изотопом, которые связываются с такими патологиями и позволяют визуализировать их с использованием современных технологий. К наиболее распространенным радиофармпрепаратам относятся [11C]PIB,[11C] 4-N-метиламино-4'-гидроксистильбен (SB-13), [18F]FDDNP и [123I]IMPY.[18F]AV-45 (18F-AV-45), E)-4-(2-(6-(2-(2-(2-[18F]фторэтокси)этокси)этокси)пиридин-3-ил)винил)-Nметилбензоламин является одним из радиофармпрепаратов для позитронно-эмиссионной томографии(ПЭТ), позволяющих визуализировать накопления амилоида в головном мозге (см., например, Choi, S.R.,et al., J. Nucl Med, 50(11), 1887-1894, 2009). 18F-AV-45 содержит радиоактивный изотоп F-18 с периодом полураспада 110 мин, поэтому его можно производить централизованно, а затем отправлять в находящиеся на расстоянии от 4 до 8 ч езды томографические центры, которые проводят ПЭТ головного мозга. Для применения такого порядка производства и доставки 18F-AV-45, а также других соединений, меченных радиоактивным изотопом F-18, применяемых для визуализации амилоидных отложений, требуется,чтобы радиофармпрепараты производились в тот же день, в который будет проводиться ПЭТ, в силу радиоактивного распада изотопа F-18. Поэтому должно выполняться несколько требований: во-первых,радиоактивное соединение 18F-AV-45 должно производиться в течение короткого периода времени из стабильного промежуточного соединения (называемого "предшественник"); во-вторых, необходимо обеспечить достаточный радиохимический выход радиофармпрепарата 18F-AV-45 (например, 10%),начиная с реакции предшественника с фторид-ионом F-18; в-третьих, 18F-AV-45 должен находиться в такой среде, которая обеспечивает достаточную растворимость как самого радиофармпрепарата, так и нерадиоактивного компонента (19F-AV-45, который всегда присутствует в некоторых малых количествах благодаря наличию в рабочей среде стабильного изотопа F-19), а также должен обладать стабилизирующими свойствами для подавления радиолитического разложения соединения. Этанол является общепризнанным вспомогательным веществом, способствующим солюбилизации липофильных препаратов, в том числе радиофармацевтических препаратов (см., например, Lemaire С., etal., J. Label Compd and Radiopharm, 42, 63-75, 1999). В качестве вспомогательных веществ для подавления радиолиза радиофармпрепаратов ранее использовалась аскорбиновая кислота или соли аскорбиновой кислоты (см., например, Tofe A.J., et al., J. Nucl Med, 17, 820-825, 1976; Knapp F.F., et al., Anticancer Res 17, 1783-1795, 1997; Liu S., et al., Bioconj Chem, 14, 1052-1056, 2003), в том числе для радиофармпрепаратов F-18 (см., например, Firnau G., et al., J. Nucl Med, 25, 1228-1233, 1984). Однако использование солей аскорбиновой кислоты в водном растворе этанола в качестве предпочтительного вещества как для солюбилизации, так и для стабилизации радиофармпрепаратов с F-18, применяемых для исследований головного мозга, таких как 18F-AV-45, является новым. Использование предшественника, содержащего группу тозилата, в реакции с фторидом F-18 с получением радиофармпрепаратов, содержащих F-18, было описано ранее (см., например, Zhang W., et al.,Nucl Med Biol 34, 89-97, 2007). Однако в предыдущих публикациях не встречаются описания эффективного синтетического метода получения большого количества (т.е. 10 г) предшественника тозилата (называемого далее в данном документе "AV-105"). Все публикации, упоминаемые в настоящем документе,считаются включенными в данный документ посредством ссылки во всей своей полноте в той мере, в какой эти публикации не противоречат сведениям, представленным в данном описании. Краткое описание изобретения Воплощения изобретения описывают получение радиофармацевтической композиции для позитронно-эмиссионной томографии (ПЭТ) для диагностики нейродегенеративных заболеваний головного мозга, содержащей эффективное количество 18F-меченого соединения, от приблизительно 1,0 до приблизительно 20% (об./об.) этилового спирта и не менее приблизительно 0,1% (мас./об.) аскорбиновой кислоты или ее соли. В различных вариантах изобретения F-меченое соединение способно связываться с патологическими мишенями головного мозга пациента. К патологической мишени может относиться аномальная концентрация нативного или патологически измененного белка, пептида или олигонуклеотида;-амилоид; -синуклеин или везикулярный транспортер моноаминов 2 (ВМАТ 2).-2 023014 В некоторых вариантах изобретения 18F-меченым соединением является производная стирилпиридина. В некоторых вариантах изобретения 18F-меченым соединением является E)-4-(2-(6-(2-(2-(2[18F]фторэтокси)этокси)этокси)пиридин-3-ил)винил)-N-метилбензоламин) (18F-AV-45). В некоторых воплощениях настоящего изобретения 18F-AV-45 получен из предшественника тозилата. В других вариантах изобретения 18F-меченым соединением в составе радиофармацевтической композиции является(2R,3R,11bR)-9-(3-[18F]фторпропокси)-3-изопропил-10-метокси-11b-метил-2,3,4,6,7,11b-гексагидро-1 Нпиридо[2,1-а]изохинолин-2-ол (18F-AV-133). В некоторых вариантах 18F-меченым соединением является производная дигидротетрабеназина (ДТБЗ). Радиофармацевтическая композиция в некоторых воплощениях изобретения содержит этиловый спирт в концентрации от приблизительно 1,0 до приблизительно 15,0% (об./об.). Другие воплощения изобретения содержат аскорбиновую кислоту или ее соли в концентрации от приблизительно 0,1 до приблизительно 1,0% (мас./об.). pH радиофармацевтической композиции может варьироваться от приблизительно 4,5 до приблизительно 8,0. В предпочтительных вариантах изобретения степень чистоты радиофармацевтической композиции больше или равна примерно 90% при измерении по меньшей мере примерно через 4 ч после окончания синтеза (OC). Радиофармацевтическая композиция может использоваться при диагностике нейродегенеративных заболеваний, таких как, например, деменция, когнитивные нарушения, болезнь Альцгеймера (БА), болезнь Паркинсона (БП), деменция с тельцами Леви (ДТЛ), сосудистая деменция (СД) и их сочетания. Другие воплощения изобретения описывают способ производства радиофармацевтической композиции для позитронно-эмиссионной томографии (ПЭТ) с получением изображений головного мозга, содержащей эффективное количество 18F-меченого соединения, не менее приблизительно 1,0% (об./об.) этилового спирта, не менее приблизительно 0,1% (мас./об.) соли аскорбиновой кислоты, при этом распад 18 F меченого соединения составляет приблизительно менее 10% с момента окончания синтеза до примерно 12 ч после окончания синтеза. В другом варианте изобретения представлен метод диагностики нейродегенеративных заболеваний у пациентов, который включает в себя следующие этапы: введение пациенту радиофармацевтической композиции, способной связываться с мишенью, ассоциируемой с нейродегенеративным заболеванием,при этом указанная радиофармацевтическая композиция содержит эффективное количество 18F-меченого соединения, не менее приблизительно 1,0% (об./об.) этилового спирта и не менее приблизительно 0,1%(мас./об.) аскорбата натрия; получение изображения по крайней мере части головного мозга пациента,включая область, в которой предполагается наличие патологической мишени; выявление мишени. Изображение головного мозга может быть получено с помощью позитронно-эмиссионной томографии(ПЭТ), одновременного проведения ПЭТ и компьютерной томографии (ПЭТ/КТ), одновременного проведения ПЭТ и магнитно-резонансной томографии (ПЭТ/MPT) или их сочетания. В еще одном варианте воплощения изобретения представлен метод получения 18F-меченой композиции, способной связываться с -амилоидом, включая этап синтеза предшественника тозилата; проведение реакции нуклеофильного замещения 18F-фторидом предшественника тозилата в растворе диметилсульфоксида (ДМСО) с получением 18F-меченого радиофармпрепарата; получение 18F-меченого радиофармпрепарата в водном растворе этилового спирта, содержащем аскорбиновую кислоту или ее соли; при этом в конечной 18F-меченой фармацевтической композиции этиловый спирт присутствует в минимальной концентрации примерно 1,0% (об./об.), а минимальная концентрация аскорбиновой кислоты или ее соли составляет примерно 0,1% (мас./об.). В другом варианте изобретения представлен способ получения предшественника тозилата 18F-AV45, (E)-2-(2-(2-(5-(4-(трет-бутоксикарбонил(метил)амино)стирил)пиридин-2-илокси)этокси)этокси)этил 4-метилбензолсульфонат (AV-105). Этот метод включает в себя следующие стадии:(ii) преобразование соединения виниланилина в производное метил, трет-бутилкарбамата;(iv) взаимодействие производного метил, трет-бутил карбамата, полученного на стадии (ii), с соединением, полученным в результате реакции (iii), с получением (Е)-трет-бутил 4-(2-(6-(2-(2-(2 гидроксиэтокси)этокси)этокси)пиридин-3-ил)винил)фенил(метил)карбамата; и(v) взаимодействие (Е)-трет-бутил 4-(2-(6-(2-(2-(2-гидроксиэтокси)этокси)этокси)пиридин-3 ил)винил)фенил(метил)карбамата с тозилхлоридом с получением AV-105. В еще одном варианте изобретения представлен способ получения радиофармацевтической композиции, который включает взаимодействие предшественника тозилата AV-105 с 18F-фторид-ионом в растворе диметилсульфоксида (ДМСО) или другим апротонным растворителем с высокой температурой кипения с получением Е)-4-(2-(6-(2-(2-(2-[18F]фторэтокси)этокси)этокси)пиридин-3-ил)винил)-Nметилбензоламина) (18F-AV-45); выделение 18F-AV-45; очистку 18F-AV-45. Способ получения радиофармацевтической композиции может дополнительно включать стадию получения 18F-AV-45 в растворе,содержащем от приблизительно 1,0 до приблизительно 15% (об./об.) этилового спирта и от приблизительно 0,1 до приблизительно 1,0% (мас./об.) соли аскорбиновой кислоты. В определенных воплощениях изобретения солью аскорбиновой кислоты является аскорбат натрия, а концентрация составляет прибли-3 023014 зительно 0,5% (мас./об.). Приведенное выше краткое изложение не предназначено для описания каждого приведенного воплощения или каждого варианта осуществления настоящего изобретения. Краткое описание чертежей Для лучшего понимания сущности изобретения следует указать на чертежи, на которых изображено следующее: на фиг. 1 показана схема синтеза предшественника тозилата AV-105 и синтез нерадиоактивного компонента 19F-AV-45 с п-толуолсульфонатом согласно одному из вариантов осуществления изобретения; на фиг. 2 показан альтернативный метод синтеза предшественника тозилата AV-105 согласно другому варианту осуществления изобретения; на фиг. 3 изображен метод радиохимического синтеза, представляющий один из вариантов изобретения, в котором используется предшественник тозилата с получением радиофармпрепарата 18F-AV-45,связывающего -амилоид. Описание иллюстративных вариантов изобретения Это изобретение не ограничивается описанными конкретными композициями или методами, так как они могут варьироваться. Кроме того, терминология, используемая в описании, освещает только отдельные версии или варианты изобретения и не предназначена для ограничения объема изобретения. Если это не определено иначе, то все научно-технические термины, употребляемые в настоящем патенте,понимаются так, как они обычно понимаются специалистами в той области, к которой относится настоящее изобретение. В случае противоречия терминологии описание изобретения, включая определения, имеет превалирующее значение. Используемые в описании формы единственного числа "какой-либо", "такой" и "данный" включают множественное число, если только из контекста не очевидно иное. Используемый в описании термин "приблизительно" означает плюс или минус 10% от численного значения числа, если не указано иное. Термин "введение пациенту", используемый в отношении диагностического средства, например такого как радиофармпрепарат, означает введение непосредственно в или на ткань-мишень или систематическое введение пациенту радиофармпрепарата, посредством чего диагностическое средство используется для получения изображения ткани или патологии, связанной с тканью, на которые оно нацелено."Введение пациенту" композиции может осуществляться путем инъекции, инфузии или любым из этих методов в сочетании с другими известными методами. Термины "включает в себя", "содержит", "имеет" и "составляет" и их спряжения, как они используются в настоящем документе, означают "включая, но не обязательно ограничиваясь этим". Термин "эффективное количество" или "терапевтически эффективная доза", используемый в описании, относится к такому количеству позитрон-излучающего радиофармпрепарата, которое вызывает достаточно сильный импульс -излучения для получения удовлетворительного изображения интересующей биологической мишени в головном мозге человека с подозрением на наличие нейродегенеративного заболевания. Используемый в описании термин "окончание синтеза" или "OC" означает окончание радиохимического синтеза. Это момент времени, на который процесс радиохимического синтеза, включая все этапы очистки, необходимые для выделения радиофармпрепарата, завершен. Используемый в описании термин "апротонный растворитель с высокой температурой кипения" определяется как апротонный растворитель, имеющий температуру кипения по меньшей мере приблизительно 140C при (1) атм. Используемые в описании термины "патология" или "патологический" относятся к измененным биологическим процессам, которые, например, могут быть связаны с аберрантной выработкой белков,пептидов, РНК и других веществ, связанных с течением заболевания. Используемые в описании термины "пациент" и "больной" относятся к любому живому организму,которому вводится описанное в описании соединение и у которого необходимо измерить активность мозга, используя методы данного изобретения. К пациентам и(или) больным могут относиться, не ограничиваясь перечисленным, любые млекопитающие животные, приматы или люди. У таких пациентов и(или) больных могут наблюдаться, а могут и не наблюдаться, признаки, симптомы или патологические проявления одного или нескольких конкретных заболеваний. Термин "мишень", используемый в отношении диагностического средства, такого как радиофармпрепарат настоящего изобретения, относится к ткани или другому материалу, связанному с патологией, в местонахождение которого желательно поместить радиофармпрепарат или диагностическое средство. Мишенями могут являться, помимо прочего, пораженные клетки, болезнетворные микроорганизмы, инфекционные вещества или другие нежелательные вещества у пациента, такие как аномальные белки,пептиды, РНК или ДНК, или нормально экспрессирующие рецепторы, которые подверглись изменению в процессе болезни.-4 023014 В общем случае используемый в описании термин "ткань" относится к любой совокупности подобных специализированных клеток, которые объединены для выполнения определенной функции. В различных вариантах осуществления изобретения представлен способ синтеза 18F-меченого радиофармпрепарата, применяемого для визуализации, из предшественника тозилата и фармацевтической композиции стабильного лекарственного препарата, содержащего этот 18F-меченый радиофармпрепарат. Некоторые воплощения изобретения описывают получение радиофармацевтической композиции,содержащей эффективное количество 18F-меченого соединения, такого как 18F-меченый стирилпиридин или производная 18F-меченого дигидротетрабеназина (ДТБЗ), в растворе, содержащем от приблизительно 1,0 до приблизительно 30% (мас./об.) этилового спирта и не менее приблизительно 0,1% (мас./об.) аскорбата натрия. Другие варианты изобретения описывают получение радиофармацевтической композиции,содержащей эффективное количество 18F-меченого соединения в растворе, предназначенном для внутривенного введения, в котором содержится от приблизительно 1,0 до приблизительно 20% (об./об.) этилового спирта и не менее приблизительно 0,1% (мас./об.) аскорбата натрия с pH примерно от 4,5 до 8,0. Эта радиофармацевтическая композиция представляет собой прозрачный раствор, не содержащий нерастворимых веществ, который сохраняет стабильность в течение не менее 6 ч после его производства, при этом концентрация F-18-содержащего радиофармпрепарата составляет до 100 мКи/мл (от 37 до 3700 МБк/мл) или выше. Радиофармацевтическая композиция для парентерального введения, предлагаемая в некоторых вариантах настоящего изобретения, может содержать F-18-меченое соединение, которое способно связываться с патологическими мишенями головного мозга пациента, такими как, например, аномальная концентрация нативного или патологически измененного белка, пептида или олигонуклеотида, -амилоид,-синуклеин, или с нормально экспрессирующей эндогенной мишенью, поврежденной в присутствии некоторых дегенеративных нарушений, таких как везикулярный транспортер моноаминов 2 (ВМАТ 2) при болезни Паркинсона (БП), деменции с тельцами Леви (ДТЛ) или сахарном диабете. Согласно различным вариантам данного изобретения предложены радиофармацевтические композиции с характеристиками, включающими: высокую аффинность и селективность взаимодействия с заданной мишенью, низкую молекулярную массу (400 г/моль), средний уровень липофильности (log P в диапазоне 1-3), благодаря чему обеспечивается интенсивное проникновение в мозг и быстрое выведение,наличие функциональных групп в молекуле для внедрения позитрон-излучающих радионуклидов, например, таких как 11 С или 18F, высокую стабильность в головном мозге, а также отсутствие проникновения в мозг образующихся на периферии метаболитов меченого изотопом соединения и высокую доступность для клинических центров меченого изотопом соединения. Использование 18F-меченых радиофармпрепаратов, предлагаемых в изобретении, обеспечивает много логистических преимуществ благодаря относительно длительному периоду полураспада 18F (T1/2 = 110 мин) по сравнению с другими радиоизотопами, такими как, например, 11C (T1/2 = 20 мин). Преимущество относительно длительного периода полураспада 18F состоит в том, что обеспечивается больше времени для выведения изотопного индикатора, не связанного с мишенью, при меньшем снижении интенсивности излучения ввиду радиоактивного распада. В некоторых вариантах осуществления изобретения 18F-меченое соединение в радиофармацевтической композиции содержит 18F-меченое соединение, способное связываться с амилоидными скоплениями и предназначенное для использования в позитронно-эмиссионной томографии (ПЭТ) головного мозга. В некоторых вариантах изобретения 18F-меченым соединением является Е)-4-(2-(6-(2-(2-(2[18F]фторэтокси)этокси)этокси)пиридин-3-ил)винил)-N-метилбензоламин) (18F-AV-45). В некоторых воплощениях настоящего изобретения 18F-AV-45 получен из предшественника тозилата. В других вариантах осуществления изобретения 18F-меченым соединением является производная дигидротетрабеназина(ДТБЗ). В других вариантах изобретения 18F-меченым соединением в составе радиофармацевтической композиции является(2R,3R,11bR)-9-(3-[18F]фторпропокси)-3-изопропил-10-метокси-11b-метил 2,3,4,6,7,11b-гексагидро-1 Н-пиридо[2,1-а]изохинолин-2-ол (18F-AV-133). В другом варианте воплощения изобретения предложенная радиофармацевтическая композиция содержит эффективное количество 18F-меченого соединения, не менее приблизительно 1,0% (мас./об.) этилового спирта и не менее приблизительно 0,1% (мас./об.) соли аскорбиновой кислоты (например, аскорбата натрия), при этом радиофармацевтическая композиция сохраняет степень радиохимической чистоты желаемого радиофармпрепарата на уровне 90% в течение не менее 4 ч после окончания радиохимического синтеза, а в более предпочтительном варианте до 8 ч после окончания радиохимического синтеза. Радиофармацевтическая композиция, предложенная в некоторых вариантах изобретения, содержит этиловый спирт в концентрации от приблизительно 1,0 до приблизительно 15,0% (об./об.) и соль аскорбиновой кислоты (например, аскорбат натрия или другую соль аскорбиновой кислоты) в концентрации от приблизительно 0,1 до приблизительно 1,0% (мас./об.). В некоторых вариантах осуществления изобретения аскорбат натрия используется в концентрации 0,5% (мас./об.). Уровень pH радиофармацевтических композиций может варьироваться от приблизительно 4,5 до приблизительно 8,0. В некоторых вари-5 023014 антах изобретения степень чистоты радиофармпрепаратов составляет не менее 90% при измерении по крайней мере примерно через 2 ч после окончания синтеза (OC). В предпочтительных вариантах изобретения степень чистоты радиофармпрепаратов составляет не менее 90% при измерении по крайней мере примерно через 4 ч после OC. В еще одном варианте воплощения изобретения представлен метод получения 18F-меченой композиции, способной связываться с -амилоидом, включая синтез предшественника тозилата; проведение реакции нуклеофильного замещения 18F-фторидом предшественника тозилата; получение 18Fфторированного предшественника тозилата в водном растворе; добавление этилового спирта для достижения минимальной концентрации приблизительно 1,0% (мас./об.) в конечной 18F-меченой композиции стирилпиридина; добавление аскорбата натрия для достижения минимальной концентрации приблизительно 0,1% (мас./об.) в конечной 18F-меченой композиции стирилпиридина. В другом варианте изобретения представлен способ получения предшественника тозилата 18F-AV45, (Е)-2-(2-(2-(5-(4-(трет-бутоксикарбонил(метил)амино)стирил)пиридин-2-илокси)этокси)этокси)этил 4-метилбензолсульфонат (AV-105). Этот метод включает в себя следующие этапы:(ii) преобразование соединения виниланилина, полученного на этапе (i), в производную N-метил,трет-бутилкарбамата (т.е. N-метил, N-Boc);(iii) проведение реакции 2-галоген 5-йодопиридина (в некоторых вариантах изобретения галоген = хлор или бром); с триэтиленгликолем;(iv) проведение реакции производной N-метила, N-Boc, полученного на этапе (ii), с соединением,полученным в результате реакции (iii), с получением (Е)-трет-бутил 4-(2-(6-(2-(2-(2-гидроксиэтокси) этокси)этокси)пиридин-3-ил)винил)фенил(метил)карбамата; и(v) проведение реакции (Е)-трет-бутил 4-(2-(6-(2-(2-(2-гидроксиэтокси)этокси)этокси)пиридин-3 ил)винил)фенил(метил)карбамата с тозилхлоридом для образования AV-105. В другом варианте изобретения представлен способ получения радиофармацевтической композиции, который включает в себя взаимодействие предшественника тозилата AV-105 с 18F-фторид-ионом в ДМСО или другим апротонным растворителем с высокой температурой кипения с получением Е)-4-(2(6-(2-(2-(2-[18F]фторэтокси)этокси)этокси)пиридин-3-ил)винил)-N-метилбензоламина) (18F-AV-45); выделение 18F-AV-45; очистка 18F-AV-45. Способ получения радиофармацевтической композиции может дополнительно включать этап получения 18F-AV-45 в растворе, содержащем от приблизительно 1,0 до приблизительно 15% (об./об.) этилового спирта и от приблизительно 0,1 до приблизительно 1,0% или более(мас./об.) аскорбата натрия или соли аскорбиновой кислоты. В определенных вариантах осуществления изобретения концентрация аскорбата натрия составляет 0,5% (мас./об.). В еще одном варианте воплощения изобретения предложенная радиофармацевтическая композиция содержит эффективное количество 18F-меченого соединения,не менее приблизительно 1,0% (об./об.) этилового спирта и не менее приблизительно 0,1% (мас./об.) аскорбата натрия, при этом скорость распада радиофармацевтической композиции, измеренная in vitro, по существу, соответствует следующим показателям: (а) от приблизительно 0,01 до приблизительно 5% от полного распада при измерении примерно через 2 ч; (b) от приблизительно 0,01 до приблизительно 10% от полного распада при измерении примерно через 10 ч; (с) от приблизительно 0,01 до приблизительно 20% от полного распада при измерении примерно через 15 ч; (d) не более приблизительно 25% от полного распада при измерении примерно через 24 ч. Некоторые варианты изобретения включают в себя методы синтеза 18F-меченого стирилпиридина из предшественника тозилата, AV-105 (показаны на фиг. 1). В методе синтеза AV-105 в качестве активной уходящей группы вместо первичного мезилата используется первичный тозилат. Использование предшественника тозилата для радиофторирования имеет свои преимущества, хотя бы по той причине,что тозилат, образующийся во время реакции радиофторирования, легко отделяется от 18F-меченого радиофармпрепарата путем хроматографических методов. На фиг. 1 изображен начальный синтез AV-105 и синтез холодного AV-45 одного из вариантов изобретения. Использование п-толуолсульфоната (тозилата) в качестве активной ведущей группы исключает необходимость использования метансульфоната (мезилата), который не является предпочтительным из-за генотоксических свойств сульфоновой кислоты метана - побочного продукта, образуемого при использовании мезилата. Кроме того, птолуолсульфоновую кислоту легче обнаружить, чем метансульфоновую кислоту, и, следовательно, ее легче очистить с помощью жидкостной хроматографии с УФ-детектированием. Как далее показано на фиг. 1, на этапе Вос-защиты (6 и 7) и на стадии тозилирования (8) для получения AV-105 добавляется 4 диметиламинопиридин (ДМАП). Включение ДМАП на стадии тозилирования приводит к сокращению количества времени, необходимого для полной конверсии исходного материала. Наличие ДМАП также препятствует распаду во время более продолжительной реакции. В процессе этого синтеза может образовываться небольшое количество (например, грамм) AV-105, однако его не очень просто расширить до производства 50 г или большего количества AV-105. Альтернативный метод синтеза AV-105 изображен на фиг. 2. В этом методе конвергентного синтеза для образования псевдогалоидного соединения вместо типичного метансульфонилхлорида используется-6 023014 п-толуолсульфонилхлорид. Применение реакции Хека, как показано на фиг. 2, способствует конвергенции синтеза, тем самым повышая его эффективность и позволяя получать более высокий выход реакции. Тем не менее, выход реакции, указанный на фиг. 1 и 2, приводится исключительно в иллюстративных целях и не представляет собой максимально достижимого выхода. Специалисту в данной области понятно, что описанные в описании синтетические методы для получения AV-105 могут быть дополнительно оптимизированы с помощью методов очистки как промежуточных реагентов, так и самого AV-105. Такие методы могут включать, например, рекристаллизацию, экстракцию растворителя растворителем или методы колоночной хроматографии, с помощью которых можно удалять примеси реагентов, присутствующих в небольших количествах, и побочные продукты реакций. Однако методы, описанные в настоящем документе, позволяют получать AV-105 с общим выходом 40% и выше и степенью чистоты приблизительно более 95%. Радиохимический синтез одного из вариантов изобретения с использованием первичного алкилтозилата для радиофармпрепарата 18F-AV-45, способного связывать -амилоид, изображен на фиг. 3. После окончания процесса введения радиоактивного изотопа, описанного в вариантах настоящего изобретения,18F-AV-45 (отмеченный на фиг. 3 как формула II) получают в солевом растворе. В некоторых вариантах осуществления изобретения солевой раствор содержит не менее приблизительно 1,0% (об./об.) этилового спирта и не менее приблизительно 0,1% (мас./об.) аскорбата натрия и имеет pH от 4,5 до 8,0. В других вариантах изобретения концентрация этилового спирта составляет от приблизительно 1,0 до приблизительно 10,0% (об./об.) и концентрация аскорбата натрия от приблизительно 0,1 до приблизительно 1,0%(мас./об.). Не ограничиваясь теоретическими рассуждениями в области изобретения, присутствие аскорбата натрия минимизирует радиолиз во время очистки неочищенного 18F-AV-45 и в разбавителе конечного продукта, позволяя увеличить его стабильность и срок годности. В одном варианте осуществления изобретения номинальная концентрация аскорбата натрия составляет 0,5% (мас./об.). В другом варианте изобретения представлен метод для выявления нейродегенеративного заболевания у пациентов, включающий в себя введение пациенту радиофармацевтической композиции, способной связываться с мишенью, ассоциируемой с нейродегенеративным заболеванием, при этом такая композиция содержит эффективное количество 18F-меченого соединения, применяемого для визуализации амилоидных отложений, такого как 18F-AV-45, или альтернативного F-18-меченого радиофармпрепарата,связывающегося с амилоидом, а также от приблизительно 1,0 до 15% (об./об.) этилового спирта и от приблизительно 0,1 до приблизительно 1% (мас./об.) аскорбата натрия; получение изображения части тела пациента, охватывающей ту область, в которой, как предполагается, находится мишень; выявление мишени. Область тела пациента может включать по крайней мере часть головного мозга. Радиофармацевтическая композиция может использоваться при диагностике нейродегенеративных заболеваний, таких как, например, деменция, когнитивные нарушения, болезнь Альцгеймера (БА), болезнь Паркинсона (БП), деменция с тельцами Леви (ДТЛ), сосудистая деменция (СД) и их сочетания. 18F-меченая фармацевтическая композиция, представленная в различных вариантах осуществления настоящего изобретения, может вводиться пациенту любым способом, известным в данной области. Например, в определенном варианте изобретения радиофармацевтическая композиция может быть введена с помощью инъекции. В частности, способы введения композиции могут включать, помимо прочего,интраваскулярное введение, внутривенное введение, интраперитонеальное введение, подкожное введение и внутримышечное введение. 18F-меченая фармацевтическая композиция может также вводиться в дозированной лекарственной форме, например в виде внутривенного введения. В некоторых вариантах осуществления изобретения радиофармацевтическая композиция может быть приготовлена в виде шприца с единичной дозой, содержащего соответствующее количество радиофармпрепарата. 18F-меченые радиофармпрепараты, предложенные в различных вариантах осуществления изобретения, могут быть визуализированы с помощью любого подходящего метода, известного в данной области,включая позитронно-эмиссионную томографию (ПЭТ), однофотонную эмиссионную компьютерную томографию (ОФЭКТ), ПЭТ с одновременным проведением компьютерной томографии (ПЭТ/КТ), ПЭТ с одновременным проведением магнитно-резонансной томографии (ПЭТ/MPT) и их сочетания. 18F-меченые радиофармацевтические композиции, предлагаемые в различных вариантах осуществления настоящего изобретения, имеют высокую степень радиохимической чистоты и высокий выход при радиохимическом синтезе. Сроки годности 18F-меченых радиофармпрепаратов могут отличаться для разных вариантов изобретения и могут зависеть от различных аспектов процесса получения препаратов. В общем случае срок годности 18F-меченых радиофармпрепаратов, приготовленных в виде композиций,описанных в данном документе, превышает 8 ч с момента их изготовления. Некоторые варианты осуществления изобретения также предусматривают приготовление 18F-меченого соединения, которое является безопасным для введения человеку и устойчивым к радиолизу и иному химическому разложению в течение некоторого периода времени (например, до 8-10 ч) после отправки в медицинские учреждения или томографические центры. Например, в одном варианте изобретения радиофармацевтическая композиция 18F-AV-45, содержащая этиловый спирт и аскорбат натрия, сохраняет стабильность (степень радиохимической чистоты РХЧ более 90%) до 20 ч после изготовления.-7 023014 Примеры Следующие примеры приводятся для более ясного понимания изложенного в описании изобретения. Эти примеры служат только для иллюстрации и не должны рассматриваться в качестве какого бы то ни было ограничения настоящего изобретения. Пример 1.0. Синтез предшественника тозилата AV-105 для получения 18F-AV-45. Синтетические соединения подходят для проведения масштабного синтеза предшественника тозилата (Е)-2-(2-(2-(5-(4-(трет-бутоксикарбонил(метил)амино)стирил)пиридин-2-илокси)этокси)этокси)этил 4-метилбензолсульфоната (AV-105) из Е)-4-(2-(6-(2-(2-(2-[18F]фторэтокси)этокси)этокси)пиридин-3-ил) винил)-N-метилбензоламина) (18F-AV-45) в соответствии с одним из вариантов изобретения, см. фиг. 2. Моно-Вос-защищенный виниланилин 10 готовили энергичным перемешиванием виниланилина с дитрет-бутилдикарбоном в воде при комнатной температуре в течение 2 ч. Моно-Вос-защищенный виниланилин 10 осаждали и фильтровали с получением 98% выхода, после чего использовали без дополнительной очистки. Путем метилирования промежуточного соединения с добавлением гидрида натрия и йодистого метила в диметилформамиде (ДМФ) получен неочищенный грет-бутилметил (4 винилфенил)карбамат 11 (выход 88%), который также использовался без дополнительной очистки. 2 Бром-5-йодопиридин алкилировали с триэтиленгликолем, используя трет-бутоксид калия. Для того чтобы обеспечить получение моно-алкилированного продукта 2-(2-(2-(5-йодопиридин-2 илокси)этокси)этокси)этанола 13 в качестве основного продукта, использовали по меньшей мере 4 экв. триэтиленгликоля к йодопиридину. Моноалкилированный продукт 13 (выход 88%) не очищали и использовали непосредственно на стадии реакции d. Реакцию Хека между неочищенным продуктом 11 и моноалкилированным продуктом 13 проводили с использованием ацетата палладия, тетрабутиламмония бромида и карбоната калия в ДМФ с получением стирилпиридина 14, который очищали с помощью флэш-хроматографии среднего давления на хроматографе Biotage (выход 55%). Тозилирование стирилпиридина 14 проводили с использованием тозилхлорида, триэтиламина и ДМАП в дихлорметане (ДХМ) с получением AV-105, который очищали с помощью флэш-хроматографии среднего давления на хроматографе Biotage. Общий выход, начиная с 2-бром-5-йодопиридина, составил 40% (3 этапа). Пример 1.1. трет-Бутил 4-винилфенилкарбамат. Виниланилин (3,75 г, 31,4 ммоль) и ди-трет-бутилдикарбонат (7,55 г, 34,6 ммоль) энергично перемешивали в воде (23 мл) при комнатной температуре в течение 2 ч. Выделившуюся фазу фильтровали, а оставшийся фильтровальный осадок повторно растворили в этилацетате (50 мл). Органический слой промывали водой (50 мл) и рассолом (50 мл), сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении с получением неочищенного моно-Вос-защищенного виниланилина 5 (6,75 г, 98%) в виде твердого вещества розоватого цвета, которое можно использовать на следующей стадии без дополнительной очистки. Пример 1.2. трет-Бутилметил(4-винилфенил)карбамат. Гидрид натрия (1,11 г 46,2 ммоль) добавили к безводному ДМФ (80 мл) в атмосфере азота и полученную суспензию охлаждали до 0C на ледяной бане. Моно-Вос-защищенный виниланилин 10 (6,75 г,30,8 ммоль), растворенный в безводном ДМФ (30 мл), добавляли в течение 30 мин через дополнительную воронку. Реакционную смесь нагревали до комнатной температуры, а затем с помощью шприца добавляли метилиодид (8,75 г, 61,6 ммоль) в течение 30 мин. После перемешивания при комнатной температуре еще в течение 1,5 ч смесь выливали на лед (200 г) и экстрагировали этилацетатом (200 мл). Органический слой отделяли от водного слоя, промывали водой (100 мл) и рассолом (50 мл), сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении с получением неочищенного продукта 11 (6,3 г, 88%) в виде красноватого масла. Пример 1.3. 2-(2-(2-(5-Йодопиридин-2-илокси)этокси)этокси)этанол. трет-Бутоксид калия (8 69 мг, 7,7 ммоль) добавляли порциями к раствору 2-бром-5-йодопиридина (2 г, 7,04 ммоль) и триэтиленгликоля (4,23 г, 28,1 ммоль) в тетрагидрофуране (ТГФ) (40 мл). Затем реакционную смесь нагревали в колбе с обратным холодильником в течение 20 ч. Реакционную смесь концентрировали при пониженном давлении для удаления растворителя ТГФ. Концентрат разбавляли водой(100 мл) и экстрагировали этилацетатом (50 мл 2). Объединенные органические слои промывали сначала водой (50 мл), а затем рассолом (50 мл), сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении с получением моноалкилированного продукта 2-(2-(2-(5 йодопиридин-2-илокси)этокси)этокси)этанол 13 (2,2 г, 88%) в виде масла светло-желтоватого цвета, которое затвердело после отстаивания в течение ночи при комнатной температуре. Пример 1.4. (Е)-трет-бутил 4-(2-(6-(2-(2-(2-гидроксиэтокси)этокси)этокси)пиридин-3-ил)винил)фенил(метил)карбамат. Парные соединения трет-бутилметил (4-винилфенил)карбамат 11 (1,29 г, 5,55 ммоль) и 2-(2-(2-(5 йодопиридин-2-илокси)этокси)этокси)этанол 13 (1,96 г, 5,55 ммоль) добавляли вместе с ацетатом палладия (62,3 мг, 0,278 ммоль), тетрабутиламмония бромидом (5,53 г, 16,65 ммоль) и карбонатом калия (3,83 г, 27,75 ммоль) к безводному ДМФ (80 мл). Реакционную смесь дегазировали с N2 в течение 5 мин и нагревали при 100C в течение ночи. Объем реакционной смеси уменьшали на 50% в вакууме и смесь разделяли между этилацетатом (200 мл) и водой (400 мл). Водный слой отделяли и экстрагировали допол-8 023014 нительным этилацетатом (150 мл). Органические слои соединяли, промывали водой (100 мл) и рассолом (100 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали с помощью колоночной флэш-хроматографии среднего давления на хроматографе Biotage (45% этилацетата в гексане; 65% этилацетата в гексане) с получением (Е)-трет-бутил 4-(2-(6-(2-(2-(2-гидрокси)этокси)этокси)пиридин-3-ил)винил)фенил(метил)карбамата 14 (1,4 г, 55%). Пример 1.5. (Е)-2-(2-(2-(5-(4-(трет-бутоксикарбонил(метил)амино)стирил)пиридин-2-илокси) этокси)этокси)этил 4-метилбензолсульфонат (AV-105).(Е)-трет-бутил 4-(2-(6-(2-(2-(2-гидроксиэтокси)этокси)этокси)пиридин-3-ил)винил)фенил(метил) карбамат 14 (1,3 г, 2,83 ммоль) растворяли в ДХМ (50 мл) с последующим добавлением толуолсульфонилхлорида (1,08 г, 5,68 ммоль), триэтиламина (0,86 г, 8,49 ммоль) и ДМАП (24 мг, 0,2 ммоль). Смесь перемешивали при комнатной температуре в течение 6 ч. Добавляли воду (50 мл). Органический слой отделяли, промывали рассолом, сушили над безводным сульфатом натрия, концентрировали при пониженном давлении и очищали с помощью колоночной флэш-хроматографии среднего давления на хроматографе Biotage (начинали с 30% этилацетата в гексане и увеличивали до 40% этилацетата в гексане) с получением соединения AV-105 (1,5 г, 86%) в виде прозрачного, светло-желтого масла, которое в конечном счете затвердело через несколько дней нахождения под вакуумом. Пример 2.0. Радиохимический синтез 18F-AV-45 из AV-105. Активность ионов фтора [18F] захватывали в анионообменник и элюировали в реакционном сосуде с использованием водного раствора K.2.2.2-K2CO3 (карбонат калия и Kryptofix) и CH3CN. Результат элюирования сушили под вакуумом. После чего фторид [18F] сушили путем добавления в емкость реактораAV-105 (1,5 мг в 2,0 мл ДМСО). Полученную смесь нагревали до 110-120C для проведения реакции введения радиоактивного изотопа 18F. В емкость реактора добавляли раствор, содержащий 3 моль HCl, и полученную смесь нагревали до 120C в течение 5 мин для удаления N-Boc-группы. После охлаждения добавляли раствор, содержащий 1 моль NaOH, для нейтрализации. Раствор помещали в картридж обратной фазы. Отделенный на картридже неочищенный 18F-AV-45 промывали водой для инъекций (ВДИ) объемом примерно 4 мл, содержащей 5% (мас./об.) аскорбата натрия. После чего 18F-AV-45 элюировали с использованием 1,5 мл CH3CN в емкость, содержащую 2 мл ВДИ, содержащий 5% (мас./об.) аскорбата натрия и 1 мл растворителя для высокоэффективной жидкостной хроматографии (ВЭЖХ). Затем 18F-AV45 наносили на колонку полупрепаративной ВЭЖХ и подвергали очистке. Фракцию ВЭЖХ, содержащую очищенный 18F-AV-45, собирали в емкость с 20 мл ВДИ, содержащей 0,5% (мас./об.) аскорбата натрия. Разбавленный раствор пропускали через картридж SEP-PAK С-18, и уловленный 18F-AV-45 промывали в 15 мл ВДИ, содержащей 0,5% (мас./об.) аскорбата натрия. 18F-AV-45 элюировали с картриджаSEP-PAK Light С-18 с использованием 1 мл этанола (Фармакопея США) в 9 мл 0,9% физиологического раствора для инъекций (стерильный, Фармакопея США), содержащего 0,5% (мас./об.) аскорбата натрия(Фармакопея США). Затем этот раствор пропускали через стерилизующий фильтр с диаметром пор 0,22 мкм в стерильный предварительно запечатанный герметичный сосуд объемом 10 или 30 мл. Лекарственный препарат 18F-AV-45 можно разбавлять физиологическим раствором для инъекций (0,9%, Фармакопея США, стерильным), содержащим не более 10% этанола (об./об., Фармакопея США) и 0,5% аскорбата натрия (мас./об., Фармакопея США). Пример 3.0. Технология солюбилизации 19F-AV-45 и стабилизации 18F-AV-45. Радиофармацевтический препарат/композицию 18F-AV-45 оценивали на растворимость нерадиоактивного компонента 19F-AV-45, который также образуется в процессе радиохимического синтеза 18F-AV45 в количестве 1-5 мкг/мл из-за наличия небольшого количества фторида 19F, поступающего в систему радиохимического синтеза из трубок, клапанов и других источников. При отсутствии этанола в составе композиции могут присутствовать твердые частицы ввиду низкой растворимости 19F-AV-45. Поэтому проводилась оценка того, насколько добавление в радиофармацевтическую композицию 10% этанола обеспечивает достаточную растворимость 19F-AV-45 с тем, чтобы избежать возможности образования осадка. Предел растворимости AV-45 в составе лекарственного препарата (10% [об./об.] этанола и 0,5%[мас./об.] аскорбата натрия в 0,9% водном растворе хлорида натрия) при комнатной температуре составил 17 мкг/мл. Видимый осадок наблюдался в растворах с концентрациями 22 мкг/мл. Образцы, приготовленные в концентрациях 20 мкг/мл, оценивались с помощью ВЭЖХ после центрифугирования. Образцы с концентрацией 20 мкг/мл также исследовались после хранения в течение одной недели при комнатной температуре. После одной недели хранения при комнатной температуре не произошло никакого изменения концентрации. Радиофармацевтические композиции 18F-AV-45, представленные в различных вариантах осуществления настоящего изобретения, чрезвычайно устойчивы к радиолизу и химическому разложению. Аскорбат натрия используется для минимизации радиолиза во время очистки 18F-AV-45 и в растворе конечного лекарственного препарата, позволяя увеличить его стабильность и срок годности. Этанол в кон-9 023014 центрации 1-10% (об./об.) в водном растворе способствует солюбилизации 18F-AV-45. Чтобы продемонстрировать стабилизацию 18F-AV-45 в конечном лекарственном препарате, были приготовлены пробные композиции с добавлением и без добавления аскорбата натрия. Полученные композиции были проанализированы на момент окончания синтеза (OC) методом обратной ВЭЖХ с одновременным использованием ультрафиолетового (УФ) детектора и радиохимического детектора. Степень радиохимической чистоты 18F-AV-45 в лекарственном препарате проверяли путем ВЭЖХ с радиометрическим детектированием,а степень чистоты 19F-AV-45 проверяли путем ВЭЖХ с УФ детектированием, пользуясь методом нормирования площадей для определения процентного состава. Процентные значения площадей, полученные при радиохимическом и ультрафиолетовом анализе, приведены в табл. 1 и 2. На момент OC, степень радиохимической чистоты композиции 18F-AV-45, приготовленной без аскорбата натрия, составила 84%, причем распад такой композиции происходил и далее так, что через 2 ч степень чистоты составила 80%. Степень чистоты композиции 18F-AV-45, приготовленной с аскорбатом натрия, была значительно выше. На момент OC степень чистоты составляла 96% с незначительным распадом через 2 ч после OC (чистота 95%). Таблица 1 Процентный анализ радиохимической чистоты содержания 18F-AV-45 на момент окончания синтеза (OC) Аскорбат натрия оказал подобное стабилизирующее влияние на 19F-AV-45 и способствовал уменьшению образования нерадиоактивных примесей, обнаруженных с помощью УФ-детектирования, как показано в табл. 2. Таблица 2 УФ-анализ степени чистоты 19F-AV-45 в 18F-AV-45 в процентном соотношении площадей на момент окончания синтеза (OC) и через 2 ч после OC В эту таблицу включены только примеси, концентрация которых больше или равна 1% В табл. 3 приведены показатели более длительной стабильности радиофармпрепарата 18F-AV-45 приблизительно в 10% (об./об.) растворе этанола в физиологическом растворе, содержащем 0,5%(мас./об.) натрия аскорбата. Как уже отмечалось, радиохимическая чистота соединения 18F сохраняется в течение примерно 20 ч после изготовления. Таблица 3 Продолжительная стабильность инъекционного раствора 18F-AV-45, приготовленного и полученного с аскорбатом натрия в концентрации 0,5% Для того чтобы продемонстрировать стабильность радиофармпрепарата 18F-AV-45 в 10% (об./об.) этанола в физиологическом растворе, содержащем 0,5% (мас./об.) аскорбата натрия, при хранении вFLUROTEC, было проведено дополнительное исследование. Стабильность лекарственного препарата оценивалась в трех отдельно изготовленных партиях 18F-AV-45. Флаконы хранили в вертикальном и в перевернутом положении при комнатной температуре и при 40C, а также в вертикальном положении при температуре 50C. Отбор лекарственного препарата производили через определенные интервалы времени в течение 12 ч тестирования и проводили оценку степени радиохимической чистоты и силы. Неизменность РХЧ на протяжении 12 ч и изменение на 5% силы лекарственного препарата при всех температурах, при которых проводилось тестирование, демонстрирует стабильность лекарственного вещества в лекарственном препарате, а также минимальное взаимодействие лекарственного вещества с пробкой флакона. Хотя настоящее изобретение было описано достаточно подробно с указанием некоторых его предпочтительных аспектов, тем не менее возможны и другие варианты. Поэтому сущность и объем прилагаемой формулы изобретения не должны ограничиваться описанием и предпочтительными вариантами,содержащимися в данной спецификации. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Радиофармацевтическая композиция для позитронно-эмиссионной томографии (ПЭТ) нейродегенеративных заболеваний головного мозга, включающая(мас./об.) аскорбата натрия. 2. Радиофармацевтическая композиция по п.1, где pH радиофармацевтической композиции составляет от приблизительно 4,5 до приблизительно 8,0. 3. Радиофармацевтическая композиция по любому из пп.1, 2, где радиофармацевтическая композиция содержит 18F-меченое соединение, содержание которого больше или равно примерно 90% при измерении по меньшей мере примерно через 4 ч после окончания синтеза. 4. Радиофармацевтическая композиция по п.1, предназначенная для диагностики нейродегенеративного заболевания, которое предпочтительно является по меньшей мере одним из нижеперечисленных: слабоумие, когнитивные нарушения, болезнь Альцгеймера, болезнь Паркинсона, деменция с тельцами Леви и сосудистая деменция. 5. Способ диагностики нейродегенеративных заболеваний у пациентов, который включает следующие стадии: введение пациенту радиофармацевтической композиции по любому из пп.1-4; получение изображения по меньшей мере части головного мозга пациента и выявление мишени. 6. Способ по п.5, в котором стадия получения изображения выполняется с помощью позитронноэмиссионной томографии (ПЭТ), одновременного проведения ПЭТ и компьютерной томографии(ПЭТ/КТ), одновременного проведения ПЭТ и магнитно-резонансной томографии (ПЭТ/MPT) или их комбинации. 7. Способ получения радиофармацевтической композиции по п.1, который включает следующие стадии: получение моно-Вос-защищенного виниланилина; преобразование Boc-виниланилина в метил Вос-виниланилин; взаимодействие 2-галоген 5-йодопиридина с триэтиленгликолем; взаимодействие метил Вос-виниланилина с соединением, полученным в результате реакции 2 галоген 5-йодопиридина с триэтиленгликолем с получением (Е)-трет-бутил 4-(2-(6-(2-(2-(2 гидроксиэтокси)этокси)этокси)пиридин-3-ил)винил)фенил(метил)карбамата; взаимодействие(ДМСО) или апротонным растворителем с высокой температурой кипения с получением E)-4-(2-(6-(2(2-(2-[18F]фторэтокси)этокси)этокси)пиридин-3-ил)винил)-N-метилбензоламина); выделение Е)-4-(2-(6-(2-(2-(2-[18F]фторэтокси)этокси)этокси)пиридин-3-ил)винил)-N-метилбензоламина); очисткаE)-4-(2-(6-(2-(2-(2-[18F]фторэтокси)этокси)этокси)пиридин-3-ил)винил)-N-метилбензоламина) и получение Е)-4-(2-(6-(2-(2-(2-[18F]фторэтокси)этокси)этокси)пиридин-3-ил)винил)-N-метилбензоламина) в водном растворе этилового спирта, содержащего по меньшей мере приблизительно 10%
МПК / Метки
МПК: A61K 51/00, A61M 36/14
Метки: стирилпиридинов, изотопом, меченных, фармацевтические, предшественников, радиоактивным, композиции, синтез, тозилата, стабильные
Код ссылки
<a href="https://eas.patents.su/14-23014-sintez-stirilpiridinov-mechennyh-radioaktivnym-izotopom-18f-iz-predshestvennikov-tozilata-i-ih-stabilnye-farmacevticheskie-kompozicii.html" rel="bookmark" title="База патентов Евразийского Союза">Синтез стирилпиридинов, меченных радиоактивным изотопом 18f, из предшественников тозилата и их стабильные фармацевтические композиции</a>
Предыдущий патент: Пептид, индуцирующий противоопухолевый иммунный ответ, и его применение
Следующий патент: Осахаривание биомассы
Случайный патент: Способ и система для производства спиртов и/или кислот












