Способ алкилирования затрудненных сульфонамидов
Формула / Реферат
1. Соединение формулы
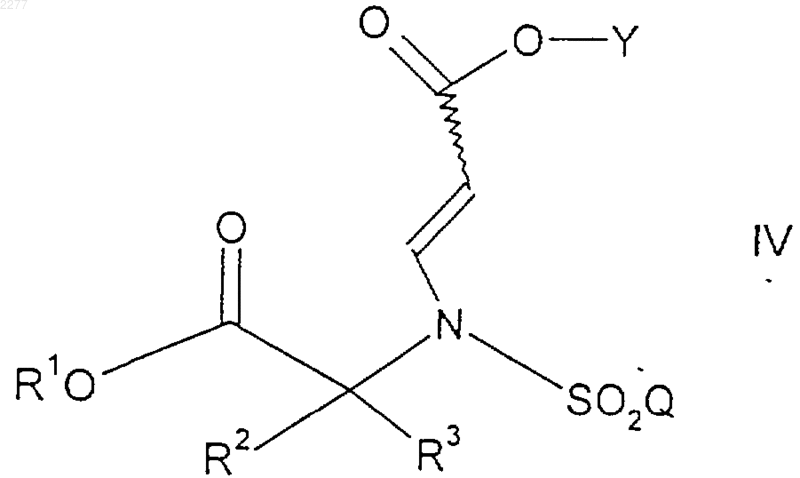
где R1 представляет собой возможно замещенный бензил;
R2 и R3 независимо представляют собой (С1-С6)алкил, либо R2 и R3, взятые вместе, образуют 3-7-членное циклоалкильное, пиран-4-ильное кольцо или бициклическое кольцо формулы
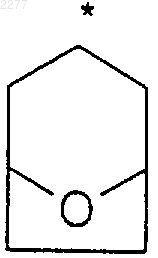
где звездочка указывает на углеродный атом, общий для R2 и R3;
Q представляет собой (С1-С6)алкил, (С6-С10)арил, (С2-С9)гетероарил, (С6-С10)арил(С1-С6)алкил, (С2-С9)гетероарил(С1-С6)алкил, (С6-С10)арилокси(С1-С6)алкил, (С6-С10)арилокси(С6-С10)арил, (С6-С10)арилокси(С2-С9)гетероарил, (С6-С10)арил(С6-С10)арил, (С6-С10)арил(С2-С9)гетероарил, (С6-С10)арил(С6-С10)арил(С1-С6)алкил, (С6-С10)арил(С6-С10)арил(С6-С10)арил, (С6-С10)арил(С6-С10)арил(С2-С9)гетероарил, (С2-С9)гетероарил(С6-С10)арил (С2-С9)гетероарил(С2-С9)гетероарил, (С6-С10)арил(С1-С6)алкокси(С1-С6)алкил, (С6-С10)арил(С1-С6)алкокси(С6-С10)арил, (С6-С10)арил(С1-С6)алкокси(С2-С9)гетероарил, (С2-С9)гетероарилокси(С1-С6)алкил, (С2-С9)гетероарилокси(С6-С10)арил, (С2-С9)гетероарилокси(С2-С9)гетероарил, (С2-С9)гетероарил(С1-С6)алкокси(С1-С6)алкил, (С2-С9)гетероарил(С1-С6)алкокси(С6-С10)арил или (С2-С9)гетероарил(С1-С6)алкокси(С2-С9)гетероарил;
где каждая (С6-С10)арильная или (С2-С9)гетероарильная группировка указанного (С6-С10)арила, (С2-С9)гетероарила, (С6-С10)арил(С1-С6)алкила, (С2-С9)гетероарил(С1-С6)алкила, (С6-С10)арилокси(С1-С6)алкила, (С6-С10)арилокси(С6-С10)арила, (С6-С10)арилокси(С2-С9)гетероарила, (С6-С10)арил(С6-С10)арила, (С6-С10)арил(С2-С9)гетероарила, (С6-С10)арил(С6-С10)арил(С1-С6)алкила, (С6-С10)арил(С6-С10)арил(С6-С10)арила, (С6-С10)арил(С6-С10)арил(С2-С9)гетероарила, (С2-С9)гетероарил(С6-С10)арила, (С2-С9)гетероарил(С2-С9)гетероарила, (С6-С10)арил(С1-С6)алкокси(С1-С6)алкила, (С6-С10)арил(С1-С6)алкокси(С6-С10)арила, (С6-С10)арил(С1-С6)алкокси(С2-С9)гетероарила, (С2-С9)гетероарилокси(С1-С6)алкила, (С2-С9)гетероарилокси(С6-С10)арила, (С2-С9)гетероарилокси(С2-С9)гетероарила, (С2-С9)гетероарил(С1-С6)алкокси(С1-С6)алкила, (С2-С9)гетероарил(С1-С6)алкокси(С6-С10)арила или (С2-С9)гетероарил(С1-С6)алкокси(С2-С9)гетероарила возможно замещена по любому из кольцевых атомов углерода, способных образовывать дополнительную связь с одним или более чем одним заместителем на кольцо, независимо выбранным из фтор-, хлор-, бром-, (С1-С6)алкильной, (С1-С6)алкокси, перфтор(С1-С3)алкильной, перфтор(С1-С3)алкокси и (С6-С10)арилоксигруппы;
и Y представляет собой водород или (С1-С6)алкил.
2. Соединение по п.1, где R2 и R3, взятые вместе, образуют циклобутильное, циклопентильное, пиран-4-ильное кольцо или бициклическое кольцо формулы
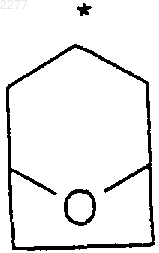
где звездочка указывает на углеродный атом, общий для R2 и R3.
3. Соединение по п.1 где Q представляет собой 4-(4-фторфенокси)фенил.
4. Способ получения соединения формулы
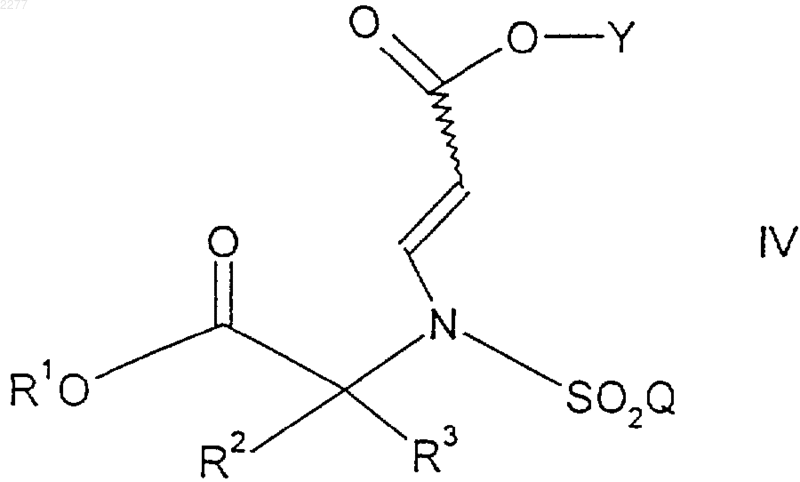
где R1 представляет собой возможно замещенный бензил;
R2 и R3 независимо представляют собой (С1-С6)алкил, либо R2 и R3, взятые вместе, образуют 3-7-членное циклоалкильное, пиран-4-ильное кольцо или бициклическое кольцо формулы
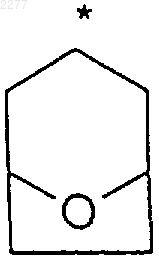
где звездочка указывает на углеродный атом, общий для R2 и R3;
Q представляет собой (С1-С6)алкил, (С6-С10)арил, (С2-С9)гетероарил, (С6-С10)арилокси(С1-С6)алкил, (С6-С10)арилокси(С6-C10)арил, (С6-С10)арилокси(С2-С9)гетероарил, (С6-С10)арил(С6-С10)алкил, (С6-С10)арил(С6-С10)арил (С6-С10)арил(С2-С9)гетероарил, (С6-С10)арил(С6-С10)арил(С1-С6)алкил, (С6-С10)арил(С6-С10)арил(С6-С10)арил, (С6-С10)арил(С6-С10)арил(С2-С9)гетероарил, (С2-С9)гетероарил(С1-С6)алкил, (С2-С9)гетероарил(С6-С10)арил (С2-С9)гетероарил(С2-С9)гетероарил, (С6-С10)арил(С1-С6)алкокси(С1-С6)алкил, (С6-С10)арил(С1-С6)алкокси(С6-С10)арил, (С6-С10)арил(С1-С6)алкокси(С2-С9)гетероарил, (С2-С9)гетероарилокси(С1-С6)алкил, (С2-С9)гетероарилокси(С6-С10)арил, (С2-С9)гетероарилокси(С2-С9)гетероарил, (С2-С9)гетероарил(С1-С6)алкокси(С1-С6)алкил, (С2-С9)гетероарил(С1-С6)алкокси(С6-С10)арил шыш (С2-С9)гетероарил(С1-С6)алкокси(С2-С9)гетероарил;
где каждая (С6-С10)арильная или (С2-С9)гетероарильная группировка указанного (С6-С10)арила, (С2-С9)гетероарила, (С6-С10)aрилокси(С1-С6)алкила, (С6-С10)арилокси(С6-С10)арила, (С6-С10)арилокси(С2-С9)гетероарила, (С6-С10)арил(С1-С6)алкила, (С6-С10)арил(С6-С10)арила, (С6-С10)арил(С2-С9)гетероарила, (С6-С10)арил(С6-С10)арил(С1-С6)алкила, (С6-С10)арил(С6-С10)арил(С6-С10)арила, (С6-С10)арил(С6-С10)арил(С2-С9)гетероарила, (С2-С9)гетероарил(С1-С6)алкила, (С2-С9)гетероарил(С6-С10)арила, (С2-С9)гетероарил(С2-С9)гетероарила, (С6-С10)арил(С1-С6)алкокси(С1-С6)алкила, (С6-С10)арил(С1-С6)алкокси(С6-С10)арила, (C6-С10)арил(С1-С6)алкокси(С2-С9)гетероарила, (С2-С9)гетероарилокси(С1-С6)алкила, (С2-С9)гетероарилокси(С6-С10)арила, (С2-С9)гетероарилокси(С2-С9)гетероарила, (С2-С9)гетероарил(С1-С6)алкокси(С1-С6)алкила, (С2-С9)гетероарил(С1-С6)алкокси(С6-С10)арила или (С2-С9)гетероарил(С1-С6)алкокси(С2-С9)гетероарила возможно замещена по любому из кольцевых атомов углерода, способных образовывать дополнительную связь с одним или более чем одним заместителем на кольцо, независимо выбранным из фтор-, хлор-, бром-, (С1-С6)алкильной, (С1-С6)алкокси, перфтор(С1-С3)алкильной, перфтор(С1-С3)алкокси и (С6-С10)арилоксигруппы;
и Y представляет собой (С1-С6)алкил;
при котором соединение формулы
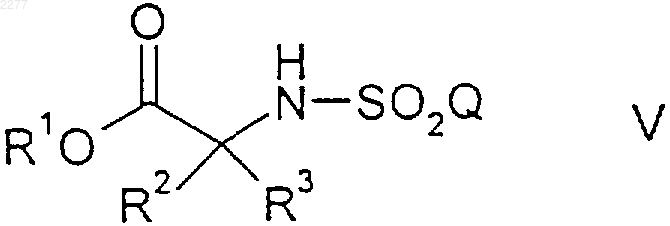
где R1 представляет собой возможно замещенный бензил,
а R2, R3, R4 и Q такие, как определено выше,
подвергают взаимодействию с соединением формулы

где Y представляет собой (С1-С6)алкил,
в присутствии основания и полярного растворителя.
5. Способ по п.4, где указанное основание представляет собой тетрабутиламмонийфторид.
6. Способ по п.4, где указанный растворитель представляет собой тетрагидрофуран.
7. Способ получения соединения формулы
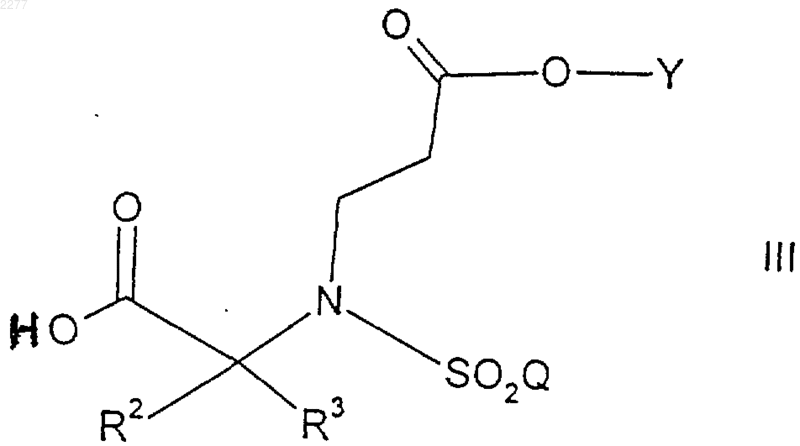
где R2 и R3 независимо представляют собой (С1-С6)алкил, либо R2 и R3, взятые вместе, образуют 3-7-членное циклоалкильное, пиран-4-ильное кольцо или бициклическое кольцо формулы
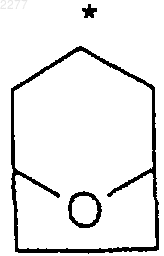
где звездочка указывает на углеродный атом, общий для R2 и R3;
Q представляет собой (С1-С6)алкил, (С6-С10)арил, (С2-С9)гетероарил, (С6-С10)арилокси(С1-С6)алкил, (С6-С10)арилокси(С6-С10)арил, (С6-С10)арилокси(С2-С9)гетероарил, (С6-С10)арил(С6-С10)алкил, (С6-С10)арил(С6-С10)арил (С6-С10)арил(С2-С9)гетероарил, (С6-С10)арил(С6-С10)арил(С1-С6)алкил, (С6-С10)арил(С6-С10)арил(С6-С10)арил, (С6-С10)арил(С6-С10)арил(С2-С9)гетероарил, (С2-С9)гетероарил(С1-С6)алкил, (С12-С9)гетероарил(С6-С10)арил (С2-С9)гетероарил(С2-С9)гетероарил, (С6-С10)арил(С1-С6)алкокси(С1-С6)алкил, (С6-С10)арил(С1-С6)алкокси(С6-С10)арил, (С6-С10)арил(С1-С6)алкокси(С2-С9)гетероарил, (С2-С9)гетероарилокси(С1-С6)алкил, (С2-С9)гетероарилокси(С6-С10)арил, (С2-С9)гетероарилокси(С2-С9)гетероарил, (С2-С9)гетероарил(С1-С6)алкокси(С1-С6)алкил, (С2-С9)гетероарил(С1-С6)алкокси(С6-С10)арил или (С2-С9)гетероарил(С1-С6)алкокси(С2-С9)гетероарил;
где каждая (С6-С10)арильная или (С2-С9)гетероарильная группировка указанного (С6-С10)арила, (С2-С9)гетероарила, (С6-С10)арилокси(С1-С6)алкила, (С6-С10)арилокси(С6-С10)арила, (С6-С10)арилокси(С2-С9)гетероарила, (С6-С10)арил(С1-С6)алкила, (С6-С0)арил(С6-С10)арила, (С6-С10)арил(С2-С9)гетероарила, (С6-С10)арил(С6-С10)арил(С1-С6)алкила, (С6-С10)арил(С6-С10)арил(С6-С10)арила, (С6-С10)арил(С6-С10)арил(С2-С9)гетероарила, (С2-С9)гетероарил(С1-С6)алкила, (С2-С9)гетероарил(С6-С10)арила, (С2-С9)гетероарил(С2-С9)гетероарила, (С6-С10)арил(С1-С6)алкокси(С1-С6)алкила, (С6-С10)арил(С1-С6)алкокси(С6-С10)арила, (С6-С10)арил(С1-С6)алкокси(С2-С9)гетероарила, (С2-С9)гетероарилокси(С1-С6)алкила, (С2-С9)гетероарилокси(С6-С10)арила, (С2-С9)гетероарилокси(С2-С9)гетероарила, (С2-С9)гетероарил(С1-С6)алкокси(С1-С6)алкила, (С2-С9)гетероарил(С1-С6)алкокси(С6-С10)арила или (С2-С9)гетероарил(С1-С6)алкокси(С2-С9)гетероарила возможно замещена по любому из кольцевых атомов углерода, способэых образовывать дополнительную связь с одним или более чем одним заместителем на кольцо, независимо выбранным из фтор-, хлор-, бром-, (С1-С6)алкильной, (С1-С6)алкокси, перфтор(С1-С3)алкильной, перфтор(С1-С3)алкокси и (С6-С10)арилоксигруппы;
и Y представляет собой (С1-С6)алкил;
при котором соединение формулы
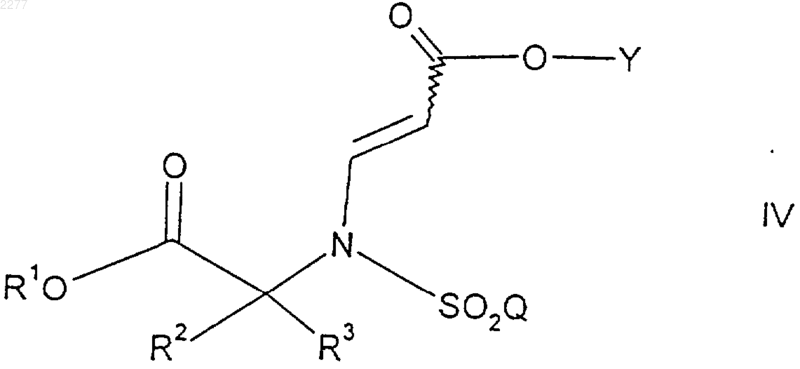
где R1 представляет собой возможно замещенный бензил, a R2, R3, Y и Q такие, как определено выше, восстанавливают восстанавливающим агентом в растворителе.
8. Способ по п.7, где указанный восстанавливающий агент представляет собой водород над палладием-на-углероде.
9. Способ по п.7, где указанный растворитель представляет собой этанол.
10. Способ по п.7, при котором далее указанное соединение формулы III подвергают взаимодействию с дициклогексиламином с образованием дициклогексиламмониевой соли соединения формулы III.
Текст
1 Предпосылки изобретения Настоящее изобретение относится к способу алкилирования затрудненных сульфонамидов по реакции присоединения Михаэля с пропиолатами и к новым промежуточным соединениям, полученным указанным способом. Продукты вышеупомянутой реакции могут быть преобразованы в ингибиторы металлопротеиназы матрикса. Как известно, ингибиторы металлопротеиназы матрикса (МПМ) применяют для лечения состояния, выбранного из группы, состоящей из артрита (включая остеоартрит и ревматоидный артрит), воспалительного кишечного заболевания, болезни Крона, эмфизем, острого респираторного дистресс-синдрома, астмы, хронического обструктивного легочного заболевания, болезни Альцгеймера, интоксикации от трансплантированного органа, кахексии, аллергических реакций, аллергической контактной гиперчувствительности, рака, изъязвления тканей,рестеноза, периодонтального заболевания, врожденного буллезного эпидермолиза, остеопороза, разрыхления искусственно пересаженных имплантатов, атеросклероза (включая разрыв атеросклеротических бляшек), аневризмы аорты(включая аневризму брюшной аорты и аневризму мозговой аорты), застойной сердечной недостаточности, инфаркта миокарда, удара, церебральной ишемии, травмы головы, повреждения спинного мозга, нейродегенеративных нарушений (острых и хронических), аутоиммунных нарушений, болезни Хантингтона, болезни Паркинсона, мигрени, депрессии, периферийной невропатии, боли, церебральной амилоидной ангиопатии, ноотропной или когнитивной активации, бокового амиотрофического склероза,рассеянного склероза, глазного ангиогенеза,повреждения роговицы, дистрофии сетчатки,патологического заживления раны, ожогов, диабетов, распространения опухоли, роста опухоли,метастазирования опухоли, корнеального рубцевания, склерита, СПИДа, сепсиса, септического шока и других болезней, которые характеризуются ингибированием металлопротеиназы или экспрессией АДАМ (ADAM) (включаяTNF-). Кроме того, продукты, которые могут быть получены на основе соединений и способов настоящего изобретения, можно применять при комбинированной терапии со стандартными нестероидными противовоспалительными лекарствами (в дальнейшем НСПВЛ), ингибиторами СОХ-2 и аналгетиками для лечения артрита, а также в комбинации с цитотоксическими лекарственными средствами, такими как адриамицин, дауномицин, цис-платина, этопозид,таксол, таксотер, и алкалоидами, такими как винкристин, для лечения рака. Алкилсульфонамиды, которые могут быть получены в соответствии со способами по настоящему изобретению, описаны в литературе. Публикации РСТ WO 96/27583 и WO 98/07697, 002277 2 опубликованные 7 марта 1996 г. и 26 февраля 1998 г., соответственно, относятся к арилсульфонилгидроксамовым кислотам. Вышеупомянутые ссылки относятся к способам получения сульфонамидов с использованием способов, которые отличаются от способов по настоящему изобретению. Содержание каждой из упомянутых выше ссылок включено в данный документ ссылкой. Сущность изобретения Настоящее изобретение относится к соединению формулы где R1 представляет собой (С 1-С 6)алкил или возможно замещенный бензил;(С 1-С 6)алкил, либо R2 и R3, взятые вместе, образуют 3-7-членное циклоалкильное, пиран-4 ильное кольцо или бициклическое кольцо формулы где звездочка указывает на атом углерода, общий для R2 и R3;(С 2-С 9)гетероарила,(С 6-С 10)арил(С 1-С 6)алкокси(С 1-С 6)алкила, (С 6-С 10)арил(С 1-С 6)алкокси(С 6 С 10)арила, (С 6-С 10)арил(С 1-С 6)алкокси(С 2-С 9)гетероарила, (С 2-С 9)гетероарилокси(С 1-С 6)алкила,(С 2-С 9)гетероарилокси(С 6-С 10)арила, (С 2-С 9)гетероарилокси(С 2-С 9)гетероарила, (С 2-С 9)гетероарил(С 1-С 6)алкокси(С 1-С 6)алкила, (С 2-С 9)гетероарил(С 1-С 6)алкокси(С 6-С 10)арила или (С 2 С 9)гетероарил(С 1-С 6)алкокси(С 2-С 9)гетероарила возможно замещена по любому из кольцевых атомов углерода, способных к образованию дополнительной связи с одним или более чем одним заместителем на кольцо, независимо выбранным из фтор-, хлор-, бром-, (С 1 С 6)алкильной,(С 1-С 6)алкокси,перфтор(С 1 С 3)алкильной, перфтор(С 1-С 3)алкокси и (С 6 С 10)арилоксигруппы; и Y представляет собой водород, (С 1 С 6)алкил или подходящую защитную группу. Предпочтительными соединениями формулы IV являются соединения, в которых R2 иR3, взятые вместе, образуют циклобутильное,циклопентильное, пиран-4-ильное кольцо или бициклическое кольцо формулы где звездочка указывает на атом углерода, общий для R2 и R3; и где Q представляет собой 4-(4 фторфенокси)фенил. Настоящее изобретение также относится к способу получения соединения формулы где R1 представляет собой возможно замещенный бензил, a R2, R3, R4 и Q такие, как определено выше, подвергают взаимодействию с соединением формулы 4 Настоящее изобретение также относится к способу, при котором указанное соединение формулы где R1, R2, R3, Y и Q такие, как определено выше, восстанавливают восстанавливающим агентом, таким как палладиевый катализатор и источник водорода, предпочтительно водород над палладием-на-углероде, в растворителе, таком как спирты или тетрагидрофуран, предпочтительно этанол, с образованием соединения формулыR2, R3, Y и Q такие, как определено выше. Настоящее изобретение также относится к способу, при котором указанное соединение формулы III, где R5 представляет собой водород, далее подвергают взаимодействию с аминами, такими как дициклогексиламин, с образованием аминных солей, таких как дициклогексиламмониевая соль соединения формулы III. Термин "защитная группа", как заместитель Y, описан Greene и Wuts в Protective Groupsin Organic Synthesis, John WileySons, Inc.,Wiley Interscience Second Edition, 1991. Используемый здесь термин "алкил", если не указано иначе, включает в себя насыщенные одновалентные углеводородные радикалы,имеющие прямые, разветвленные или циклические группировки или их комбинации. Используемый здесь термин "алкокси" включает в себя O-алкильные группы, для которых термин "алкил" такой, как определено выше. Используемый здесь термин "арил", если не указано иначе, включает в себя органический радикал, полученный из ароматического углеводорода посредством удаления одного атома водорода, такой как фенил или нафтил. Используемый здесь термин "гетероарил",если не указано иначе, включает в себя органический радикал, полученный из ароматического гетероциклического соединения посредством удаления одного атома водорода, такой как пиридил, фурил, пироил, тиенил, изотиазолил,имидазолил, бензимидазолил, тетразолил, пиразинил, пиримидил, хинолил, изохинолил, бензофурил, изобензофурил, бензотиенил, пиразолил, индолил, изоиндолил, пуринил, карбазолил,изоксазолил, тиазолил, оксазолил, бензтиазолил или бензоксазолил. Предпочтительные гетероарилы включают в себя пиридил, фурил, тиенил, 5 изотиазолил, пиразинил, пиримидил, пиразолил,изоксазолил, тиазолил или оксазолил. Наиболее предпочтительные гетероарилы включают в себя пиридил, фурил или тиенил. Используемый здесь термин "ацил", если не указано иначе, включает в себя радикал общей формулы R-(C=O)-, где R представляет собой алкил, алкокси, арил, арилалкил или арилалкокси, а термины "алкил" или "арил" такие,как определено выше. Используемый здесь термин "ацилокси" означает O-ацильные группы, где термин "ацил" такой, как определено выше. Волнистая линия (то есть " ") в формуле IV указывает, что карбоксильная группа может существовать либо в цис-, либо в трансконфигурации. Соединения формул I-V могут иметь хиральные центры и, таким образом, существовать в различных диастереомерных или энантиомерных формах. Это изобретение относится ко всем оптическим изомерам, таутомерам и стереоизомерам соединений формул I-V и к их смесям. Предпочтительно, соединения формулы I' существуют в виде экзоизомера формулы Подробное описание Следующие схемы реакций иллюстрируют получение соединений по настоящему изобретению. Если не указано иначе, на схемах реакций и в последующем обсуждении n, R1, R2, R3,Q и Z такие, как определено выше. Схема 1 Схема 1 относится к получению соединений формулы I, ингибирующих металлопротеиназу матрикса. Согласно схеме 1 соединения указанной формулы I получают из соединений формулы II взаимодействием с образованным in situ силилированным гидроксиламином с последующей обработкой кислотой. Конкретно, образованныеin situ силилированные гидроксиламины получают взаимодействием гидроксиламина гидрохлорида или гидроксиламина сульфата, предпочтительно гидроксиламина гидрохлорида, с С 1-С 4)алкил)зсилилгалогенидом в присутствии основания с образованиемO-триметилсилилгидроксиламина, N,O-бистриметилсилилгидроксиламина или их комбинации. Подходящие основания включают в себя пиридин, 2,6 лутидин или диизопропилэтиламин, предпочтительно пиридин. Взаимодействие проводят при температуре от примерно 0 до примерно 22 С(то есть при комнатной температуре) в течение от примерно 1 до примерно 12 ч, предпочтительно около 1 ч. Подходящие кислоты включают в себя соляную или серную кислоту, предпочтительно соляную кислоту. Соединения указанной формулы II, предпочтительно не выделяемые, получают из соединений формулы III, где R5 представляет собой водород, взаимодействием с оксалилхлоридом или тионилхлоридом, предпочтительно с оксалилхлоридом, и катализатором, предпочтительно примерно 2% N,N-диметилформамидом,в инертном растворителе, таком как метиленхлорид или толуол. Взаимодействие осуществляют при температуре от примерно 0 до примерно 22 С (то есть при комнатной температуре) в течение от примерно 1 до примерно 12 ч,предпочтительно около 1 ч. Соединения формулы III, где R5 представляет собой водород, могут быть получены из соединений формулы IV, где R1 представляет собой возможно замещенный бензил, восстановлением в полярном растворителе. Подходящие восстанавливающие агенты включают в себя палладиевые катализаторы и источник во 7 дорода, такие как водород над палладием-науглероде или над гидроксидом палладия-науглероде, предпочтительно водород над палладием-на-углероде. Подходящие растворители включают в себя тетрагидрофуран, метанол,этанол и изопропанол и их смеси, предпочтительно этанол. Вышеупомянутое взаимодействие осуществляют при температуре около 22 С (то есть при комнатной температуре) в течение периода от 1 до 7 дней, предпочтительно около 2 дней. Соединения формулы III, где R5 является не водородом, а другой группой, такой как протонированный амин (такой как протонированный первичный амин, вторичный амин или третичный амин), щелочной металл или щелочноземельный металл, могут быть получены из соединений формулы III, где R5 представляет собой водород, путем обработки водным или щелочным раствором, содержащим подходящий катион (например, натрий, калий, дициклогексиламин, кальций и магний, предпочтительно дициклогексиламин), с последующим выпариванием полученного раствора до сухого вещества, предпочтительно при пониженном давлении,или фильтрацией осадка, предпочтительно осадка дициклогексиламинной соли. Соединения формулы IV, где R1 представляет собой (С 1-С 6)алкил или возможно замещенный бензил, могут быть получены из соединений формулы V, где R1 представляет собой возможно замещенный бензил, присоединением по реакции Михаэля к пропиолатному эфиру в присутствии основания в полярном растворителе. Подходящие пропиолаты имеют формулу НСС-CO2Y, где Y представляет собой (С 1 С 6)алкил. Соединения формулы Н-СС-CO2Y коммерчески доступны или могут быть получены способами, которые хорошо известны специалистам в данной области. Подходящие основания включают в себя тетрабутиламмонийфторид, карбонат калия, третичные амины и карбонат цезия, предпочтительно тетрабутиламмонийфторид. Подходящие растворители включают в себя тетрагидрофуран, ацетонитрил, третбутанол, трет-амиловые спирты и N,Nдиметилформамид, предпочтительно тетрагидрофуран. Вышеупомянутую реакцию проводят при температуре от примерно -10 до примерно 60 С, предпочтительно в интервале между 0 и примерно 22 С (то есть при комнатной температуре). Соединения формулы IV получают в виде смеси геометрических изомеров (относительно олефиновой двойной связи) (то есть цис- и транс-изомеров); разделение изомеров не является необходимым. Соединения указанной формулы I, где Y представляет собой (C1-С 6)алкил, можно омылять до свободной кислоты (то есть Y является водородом) с использованием основания, такого как гидроксид натрия, в протонном растворите 002277 8 ле, таком как этанол, метанол или вода, либо смесь, такая как смесь воды и этанола, воды и толуола, либо воды и ТГФ. Предпочтительной системой растворителей является смесь воды и толуола. Взаимодействие проводят в течение периода от 30 мин до 24 ч, предпочтительно около 2 ч. Соединения формулы V, где R1 представляет собой возможно замещенный бензил, могут быть получены согласно способам, известным из уровня техники. Алкилсульфонамиды, которые могут быть получены способами по настоящему изобретению, и исходные материалы формулы V, также описаны в литературе. Публикации РСТ WO 96/27583 и WO 98/07697,опубликованные 7 марта 1996 г. и 26 февраля 1998 г., соответственно, относятся к арилсульфонилгидроксамовым кислотам. Содержание каждой из вышеупомянутых публикаций включено в данный документ ссылкой. Соединения формулы V, где R2 и R3 представляет собой тетрагидропиран-4-ил или бициклическое кольцо формулы где звездочка указывает на атом углерода, общий для R2 и R3, могут быть получены согласно способам, аналогичным тем способам, которые приведены в примерах 2 и 3. Соединения формулы I, которые по своей природе являются основными, с разными неорганическими и органическими кислотами способны образовывать самые различные соли. Хотя такие соли должны быть фармацевтически приемлемыми для введения животным, на практике зачастую желательно вначале выделить соединение формулы I из реакционной смеси в виде фармацевтически неприемлемой соли, а затем просто превратить ее назад в свободное основание путем обработки щелочным реагентом, и после этого превратить это свободное основание в фармацевтически приемлемую соль присоединения кислоты. Соли присоединения кислот основных соединений по данному изобретению легко получают путем обработки основного соединения практически эквивалентным количеством выбранной минеральной или органической кислоты в среде водного растворителя или в подходящем органическом растворителе, таком как метанол или этанол. Требуемую твердую соль получают в результате осторожного выпаривания растворителя. Кислоты, которые используют для получения фармацевтически приемлемых солей присоединения кислот основных соединений по этому изобретению, являются кислотами, которые образуют нетоксичные соли присоединения кислот, то есть соли, содержащие фармакологически приемлемые анионы, такие как гидрохло 9 риды, гидробромиды, гидроиодиды, нитраты,сульфаты или бисульфаты, фосфаты или кислые фосфаты, ацетаты, лактаты, цитраты или кислые цитраты, тартраты или битартраты, сукцинаты,малеаты, фумараты, глюконаты, сахараты, бензоаты, метансульфонаты и памоаты [например 1,1'-метилен-бис-(2-гидрокси-3-нафтоаты)]. Эти соединения формулы I, которые являются также кислотными по своей природе, способны к образованию основных солей с различными фармакологически приемлемыми катионами. Примеры таких солей включают в себя соли щелочных или щелочно-земельных металлов, в частности соли натрия и калия. Эти соли получают стандартными методами. Химические основания, которые используют в качестве реагентов для получения фармацевтически приемлемых основных солей по этому изобретению,представляют собой основания, которые образуют нетоксичные основные соли с описанными здесь кислотными соединениями формулы I. Эти нетоксичные основные соли включают в себя соли, которые образованы фармацевтически приемлемыми катионами, такими как катионы натрия, калия, кальция, магния и т.п. Эти соли могут быть легко получены путем обработки соответствующих кислотных соединений водным раствором, содержащим желательные фармакологически приемлемые катионы, с последующим выпариванием полученного раствора до сухого вещества, предпочтительно при пониженном давлении. Альтернативно, они могут быть также получены путем смешивания растворов кислотных соединений в низших спиртах и желательного алкоголята щелочного металла, а затем выпариванием полученного раствора до сухого вещества так, как было описано ранее. В любом случае, для обеспечения полноты протекания реакции и максимальных выходов продукта, предпочтительно использовать реагенты в стехиометрических количествах. Способность соединений формулы I или их фармацевтически приемлемых солей (в дальнейшем также упоминаемых как активные соединения) к ингибированию металлопротеиназы матрикса или АДАМ (такому как ингибирование продукции фактора некроза опухоли (TNF и, следовательно, к проявлению своей эффективности при лечении заболеваний, связанных с металлопротеиназой матрикса или АДАМ (таких как продукция фактора некроза опухоли) можно определить в соответствии с тестами in vitro, которые хорошо известны специалистам в данной области. Одним из примеров анализа, который демонстрирует конечные продукты, полученные способами по изобретению, является следующий анализ на ингибирование коллагеназы человека. Биологический анализ Ингибирование коллагеназы человека (ММП-1) Рекомбинантную коллагеназу человека активируют трипсином, используя следующее 10 соотношение: 10 мкг трипсина на 100 мкг коллагеназы. Трипсин и коллагеназу инкубируют при комнатной температуре в течение 10 мин,затем добавляют пятикратный избыток (50 мкг/10 мкг трипсина) ингибитора трипсина из соевых бобов. Готовят 10 мМ исходные растворы ингибиторов в диметилсульфоксиде, а затем разбавляют по следующей схеме: Затем по двадцать пять микролитров раствора каждой концентрации трехкратно дозируют в соответствующие лунки 96-луночного планшета для микрофлуориметрии. После добавления фермента и субстрата конечная концентрация ингибитора будет составлять разведение 1:4. Положительные контроли (фермент,ингибитор отсутствует) помещают в лунки D1D6, а пустые контроли (и фермент и ингибиторы отсутствуют) помещают в лунки D7-D12. Коллагеназу разбавляют до концентрации 400 нг/мл, а затем добавляют по 25 мкл в соответствующие лунки планшета для микрофлуориметрии. Конечная концентрация коллагеназы при анализе составляет 100 нг/мл. Субстрат (DNP-Pro-Cha-Gly-Cys(Me)-HisAla-Lys(NMA)-NH2) готовят в виде 5 мМ исходного раствора в диметилсульфоксиде и затем разводят буфером, который используют для анализа, до 20 мМ раствора. Анализ инициируют добавлением по 50 мкл субстрата на лунку планшета для микрофлуориметрии с получением конечной концентрации 50 мкМ. Показания флуоресценции (возбуждение при 360 нМ, эмиссия - 460 нм) снимают во время 0, а затем через 20-минутные интервалы. Анализ проводят при комнатной температуре,типичное время анализа составляет 3 ч. Затем строят график зависимости флуоресценции от времени как для пустого контроля,так и для содержащих коллагеназу образцов(данные трех измерений усредняют). Для определения значений IC50 выбирают точку времени,в которой наблюдается хороший сигнал (пустой контроль) и которая находится на линейном участке кривой (обычно примерно 120 мин). Данные во время 0 используют в качестве пустого контроля для каждого соединения при каждой концентрации, и эти значения вычитают из данных, относящихся ко времени 120 мин. Данные наносят на график "концентрация против % от контроля" (значение флуоресценции в присутствии ингибитора, деленное на значение флуоресценции одной коллагеназы и умноженное на 100). Значения IC50 определяют из концентрации ингибитора, которая дает сигнал,значение которого составляет 50 % от контроля. Если оказывается, что значения IC500,03 мкМ, то ингибиторы анализируют при концентрациях 0,3 мкМ, 0,03 мкМ, 0,03 мкМ и 0,003 мкМ. 11 Следующие примеры иллюстрируют получение соединений по настоящему изобретению. Точки плавления не корректировались. Данные ЯМР приведены в миллионных долях (млн-1)и отнесены к сигналу синхронизации дейтерия от растворителя образца (дейтериохлороформ,если не указано иначе). Коммерческие реагенты использовали без дополнительной очистки. ТГФ означает тетрагидрофуран. ДМФ означает N,N-диметилформамид. Термин хроматография относится к колоночной хроматографии, которую осуществляют с использованием слоя силикагеля 32-63 мм под давлением азота(флэш-хроматография). Комнатная температура или температура окружающей среды соответствуют температуре 20-25 С. Для удобства и для повышения выхода все реакции в неводных средах проводили в атмосфере азота. "Концентрирование при пониженном давлении" означает, что использовали роторный испаритель. Пример 1 3-4-(4-Фторфенокси)бензолсульфонил]-(1 гидроксикарбамоилциклопентил)амино]пропионовая кислота А) Бензиловый эфир 1-[4-(4-фторфенокси)бензолсульфониламино]-циклопентанкарбоновой кислоты. К смеси 12,41 г (0,032 моля) соли бензилового эфира 1-аминоциклопентанкарбоновой кислоты с толуол-4-сульфокислотой (может быть получена согласно описанным в литературе способам, например способами, которые описаны в патенте США 4745124) и 10,0 г(0,035 моля,1,1 эквивалента) 4-(4 фторфенокси)бензолсульфонилхлорида (полученного согласно получению 3) в 113 мл толуола добавляли 11,0 мл (0,079 моля, 2,5 эквивалента) триэтиламина. Полученную смесь перемешивали в течение ночи при температуре окружающей среды, промывали 2 н. соляной кислотой (2 х 100 мл) и солевым раствором (100 мл), сушили над сульфатом натрия и концентрировали до 30 мл. В течение трех часов по каплям добавляли 149 мл гексана, что привело к образованию твердого осадка, который гранулировали в течение одного часа при 0 С и фильтровали с получением 12,59 г (85 %) бензилового эфира 1-[4-(4-фторфенокси)бензолсульфониламино]-циклопентанкарбоновой кислоты. 1 Н ЯМР (CDCl3)7,78-7,82 (m, 2H), 7,307,39 (m, 5H), 7,06-7,12 (m, 2H), 6,99-7,04 (m,2H), 6,93-6,97 (m, 2H), 5,15 (m, 1 Н), 5,02 (m, 2H),2,04-2,13 (m, 2H), 1,92-1,98 (m, 2H), 1,62-1,69 12 коричневых твердых частиц, температура плавления 97,0-97,5 С. Б) Бензиловый эфир 1-(2 этоксикарбонилвинил)-[4-(4-фторфенокси)бензолсульфонил]аминоциклопентанкарбоновой кислоты. Раствор 25,0 г (53,2 ммоль) бензилового эфира 1-[4-(4-фторфенокси)-бензолсульфониламино]циклопентанкарбоновой кислоты и 10,8 мл (106 ммоль, 2 эквивалента) этилпропиолата в 200 мл сухого тетрагидрофурана при температуре 1 С обрабатывали 53,2 мл (53,2 ммоль, 1 эквивалент) раствора тетрабутиламмонийфторида в тетрагидрофуране (1 М) в течение 45 мин. Полученный раствор оставляли медленно нагреваться до температуры окружающей среды и перемешивали в течение ночи. Тетрагидрофуран заменяли толуолом при пониженном давлении, раствор толуола промывали водой и солевым раствором, разбавляли толуолом до 600 мл,перемешивали в течение трех часов с 90 г силикагеля, фильтровали и концентрировали с получением 25,14 г (83%) бензилового эфира 1-(2 этоксикарбонилвинил)-[4-(4-фторфенокси)бензолсульфонил]аминоциклопентанкарбоновой кислоты в виде оранжевого масла. 1H ЯМР (CDCl3) показывает, что соотношение цис-транс-изомеров составляет 1,5:1. Транс 7,74-7,78 (m, 2 Н), 7,72 (d, J=14 Гц,1 Н), 7,26-7,36 (m, 5 Н), 6,96-7,12 (m, 4 Н), 6,786,84 (m, 2 Н), 5,44 (d, J=14 Гц, 1 Н), 5,11 (s, 2 Н),4,12 (q, J=7,1 Гц, 2 Н), 2,08-2,43 (m, 4 Н), 1,631,80 (m, 4 Н), 1,24 (t, J=7,1 Гц, 3 Н). Цис 7,687,72 (m, 2 Н), 7,26-7,36 (m, 5 Н), 6,96-7,12 (m,4 Н), 6,86-6,91 (m, 2 Н), 6,47 (d, J=8,1 Гц, 1 Н),5,90 (d, J=8,1 Гц, 1 Н), 5,11 (s, 2 Н), 3,93 (q, J=7,2 Гц, 2 Н), 2,08-2,43 (m, 4 Н), 1,63-1,80 (m, 4 Н),1,17 (t, J=7,2 Гц, 3 Н). В)1-(2-Этoкcикapбoнилэтил)-[4-(4 фтopфeнoкcи)бeнзoлcульфoнил]-аминоциклопентанкарбоновая кислота. Раствор 2,50 г (4,4 ммоль) бензилового эфира 1-(2-этоксикарбонилвинил)-(4-(4-фторфенокси)бензолсульфонил]аминоциклопентанкарбоновой кислоты в 25 мл этилового спирта обрабатывали 2,5 г катализатора (10% палладия-на- углероде с влажностью 50%) и встряхивали под давлением водорода 53 фунт/кв.дюйм(371 кПа) в течение 21 ч. Катализатор удаляли фильтрацией и промывали этанолом (4 х 25 мл). Фильтрат и промывные жидкости объединяли и концентрировали под вакуумом с получением 1,74 г 13 Г) 1-[2-Этоксикарбонилэтил)-[4-(4-фторфенокси)бензолсульфонил]-аминоциклопентанкарбоновая кислота, дициклогексиламиниевая соль. Раствор 3,10 г (6,5 ммоль) неочищенной 1(2-этоксикарбонилэтил)-[4-(4-фторфенокси)бензолсульфонил]аминоциклопентанкарбоновой кислоты в 30 мл этанола обрабатывали 1,28 мл (6,5 ммоль, 1 эквивалент) дициклогексиламина при температуре окружающей среды,с образованием твердых частиц в течение пяти минут. Эту смесь перемешивали в течение ночи при температуре окружающей среды и затем в течение пяти часов при 0 С. Белые твердые частицы отделяли фильтрацией, промывали 10 мл холодного этанола и сушили на воздухе с получением 2,89 г (67%) 1-(2-этоксикарбонилэтил)[4-(4-фторфенокси)-бензолсульфонил]аминоциклопентанкарбоновой кислоты, дициклогексиламиниевой соли.(q, J=7,1 Гц, 2H), 3,54-3,59 (m, 2H), 2,88-2,95 (m,4H), 2,31-2,38 (m, 2H), 1,95-2,22 (m, 6H), 1,681,77 (m, 6H), 1,53-1,60 (m, 4H), 1,40-1,50 (m,4H), 1,21 (t, J=7,1 Гц, 3 Н), 1,14-1,22 (m, 6H). Температура плавления 164,5-165,9 С. Д) 1-(2-Этоксикарбонилэтил)-[4-(4-фторфенокси)бензолсульфонил]-аминоциклопентанкарбоновая кислота. Раствор 3,0 г (4,5 ммоль) 1-(2 этоксикарбонилэтил)-[4-(4-фторфенокси)бензолсульфонил]аминоциклопентанкарбоновой кислоты, дициклогексиламиниевой соли, в 30 мл дихлорметана обрабатывали 30 мл 2 н. соляной кислоты при температуре окружающей среды, что привело к немедленному осаждению твердых частиц. Эту смесь перемешивали при температуре окружающей среды в течение трех часов. Твердые частицы отфильтровывали, водную фазу экстрагировали дихлорметаном, и объединенные органические фазы промывали водой, сушили над сульфатом натрия и концентрировали под вакуумом с образованием 2,2 г 14 кислоты в 73 мл дихлорметана обрабатывали 1,4 мл (17 ммоль, 1,1 эквивалента) оксалилхлорида и 0,02 мл (0,3 ммоль, 0,02 эквивалента) диметилформамида при температуре окружающей среды, что привело к некоторому выделению газа, и перемешивали в течение ночи. Полученный раствор этилового эфира 3-(1 хлоркарбонилциклопентил)-[4-(4-фторфенокси)бензолсульфонил]аминопропионовой кислоты использовали для получения этилового эфира 3-4-(4-фторфенокси)бензолсульфонил](1-гидроксикарбамоилциклопентил)амино]пропионовой кислоты без выделения. Аналогично полученный раствор этилового эфира 3-(1-хлоркарбонилциклопентил)-[4(4-фторфенокси)бензолсульфонил]аминопропионовой кислоты концентрировали под вакуумом до масла. 1H ЯМР (CDCl3)7,84-7,87 (m, 2H), 6,977,12 (m, 6 Н), 4,10 (q, J=7,2 Гц, 2H), 3,55-3,59 (m,2H), 2,68-2,72 (m, 2H), 2,47-2,53 (m, 2H), 1,952,02 (m, 2H), 1,71-1,76 (m, 4H), 1,24 (t, J=7,2 Гц,3 Н). Ж) Этиловый эфир 3-4-(4-фторфенокси)бензолсульфонил]-(1-гидроксикарбамоилциклопентил)амино]пропионовой кислоты. Раствор 1,37 г (19,7 ммоль, 1,3 эквивалента) гидроксиламина гидрохлорида в 9,2 мл (114 ммоль, 7,5 эквивалента) сухого пиридина при 0 С обрабатывали 5,8 мл (45 ммоль, 3,0 эквивалента) триметилсилилхлорида, что привело к осаждению белых твердых частиц. Смесь оставляли на ночь нагреваться до температуры окружающей среды. Затем эту смесь охлаждали до 0 С и обрабатывали раствором 7,54 г (15,1 ммоль) этилового эфира 3-(1 хлоркарбонилциклопентил)-[4-(4-фторфенокси)бензолсульфонил]аминопропионовой кислоты в 73 мл дихлорметана, полученного как было описано выше, без выделения, что вызвало подъем температуры до примерно 8 С. Эту смесь перемешивали при 0 С в течение 30 мин и при температуре окружающей среды около одного часа. Затем реакционную смесь обрабатывали 50 мл 2 н. водного раствора соляной кислоты и перемешивали при температуре окружающей среды в течение одного часа. Водную фазу экстрагировали дихлорметаном, и объединенные органические фазы промывали 2 н. водным раствором соляной кислоты (2 х 50 мл) и водой(50 мл). Этот раствор этилового эфира 3-4-(4 фторфенокси)бензолсульфонил]-(1-гидроксикарбамоилциклопентил)амино]пропионовой кислоты в дихлорметане использовали без выделения для получения 3-4-(4-фторфенокси)бензолсульфонил]-(1-гидроксикарбамоилциклопентил)амино]пропионовой кислоты. Аликвоту концентрировали с получением пены. 1 2H), 3,42-3,47 (m, 2H), 2,62-2,67 (m, 2H), 2,162,23 (m, 2H), 1,77-1,85 (m, 2H), 1,43-1,52 (m,4H), 1,13(t,J=7,1 Гц, 3 Н). Аналогично полученный раствор концентрировали под вакуумом с образованием 6,71 г(89%) этилового эфира 3-4-(4-фторфенокси)бензолсульфонил]-(1-гидроксикарбамоилциклопентил)амино]пропионовой кислоты в виде твердой сухой пены. З) 3-4-(4-Фторфенокси)бензолсульфонил]-(1-гидроксикарбамоилциклопентил)амино]пропионовая кислота. Раствор 7,48 г (15,1 ммоль) этилового эфира 3-4-(4-фторфенокси)бензолсульфонил]-(1 гидроксикарбамоилциклопентил)амино]пропионовой кислоты в дихлорметане концентрировали в роторном испарителе с добавлением 75 мл толуола. Этот раствор обрабатывали 75 мл воды, охлаждали до 0 С и обрабатывали 6,05 г(151 ммоль, 10 эквивалентов) гранулированным гидроксидом натрия в течение 10 мин при энергичном перемешивании. Эту смесь перемешивали в течение 15 мин при 0 С и нагревали до температуры окружающей среды в течение одного часа. Водную фазу отделяли, разбавляли 7,5 мл тетрагидрофурана, охлаждали до 0 С и обрабатывали 33 мл 6 н. водного раствора соляной кислоты в течение 20 мин. Эту смесь перемешивали с 75 мл этилацетата при 0 С до достижения температуры окружающей среды,этилацетатную фазу отделяли и промывали водой. Этилацетатный раствор медленно обрабатывали 150 мл гексана при температуре окружающей среды, что вызвало осаждение твердых частиц, и перемешивали в течение ночи. После фильтрации получили 5,01 г 3-4-(4 фторфенокси)бензолсульфонил]-(1-гидроксикарбамоилциклопентил)амино]пропионовой кислоты в виде белых твердых частиц (выход 71% в расчете на 1-(2-этоксикарбонилэтил)-[4(4-фторфенокси)бензолсульфонил]аминоциклопентанкарбоновую кислоту). 1(разложение). Пример 2 3-4-(4-Фторфенокси)бензолсульфонил]-(4 гидроксикарбамоилтетрагидропиран-4 ил)амино]пропионовая кислота А) Бензиловый эфир 4-[N-(дифенилметилен)амино]тетрагидропиран-4-карбоновой кислоты. К суспензии гидрида натрия (6,56 г 0,164 моля) в диметиловом эфире этиленгликоля (150 мл) при 0 С по каплям через капельную воронку добавляют раствор бензилового эфира N(дифенилметилен)глицина (0,07398 моля) в ди 002277 16 метиловом эфире этиленгликоля (50 мл). Затем порциями по 10 мл с интервалом примерно в 5 мин к раствору диметилового эфира этиленгликоля добавляют раствор 2,2'-дибромдиэтилового эфира (23,21 г, 0,090 моля) в диметиловом эфире этиленгликоля (50 мл). Ледяную баню убирают, и реакционную смесь перемешивают при комнатной температуре в течение 16 ч. Смесь разбавляют диэтиловым эфиром и промывают водой. Водный слой экстрагируют диэтиловым эфиром. Объединенные органические экстракты промывают солевым раствором, сушат над сульфатом магния и концентрируют с получением неочищенного продукта. В результате хроматографии на силикагеле с элюированием сначала 4 л смеси 5% этилацетата/гексан, а затем 4 л смеси 10% этилацетата/гексан получают бензиловый эфир 4-[N-(дифенилметилен)амино]тетрагидропиран-4-карбоновой кислоты в виде прозрачного желтого масла. Б) Бензиловый эфир 4-аминотетрагидропиран-4-карбоновой кислоты. К раствору бензилового эфира 4-[N(дифенилметилен)амино]-тетрагидропиран-4 карбоновой кислоты (0,047 моля) в диэтиловом эфире (120 мл) добавляют 1 М водный раствор соляной кислоты (100 мл). Смесь энергично перемешивают при комнатной температуре в течение 16 ч. Слои разделяют, и водный слой промывают диэтиловым эфиром. рН водного слоя доводят до 10, разбавляя водным раствором гидроксида аммония, и водный слой экстрагируют дихлорметаном. Органический экстракт сушат над сульфатом натрия и концентрируют с получением бензилового эфира 4 аминотетрагидропиран-4-карбоновой кислоты. В) Бензиловый эфир 4-[4-(4 фторфенокси)бензолсульфониламино]тетрагидропиран-4-карбоновой кислоты. К раствору бензилового эфира 4 аминотетрагидропиран-4-карбоновой кислоты(0,0404 моля) в N,N-диметилформамиде (40 мл) добавляют триэтиламин (5,94 мл, 0,043 моля). К вышеупомянутому раствору по частям добавляют твердый 4-(4-фторфенокси)бензолсульфонилхлорид (12,165 г, 0,0424 моля). Полученную смесь перемешивают при комнатной температуре в течение 16 ч, а затем большую часть растворителя удаляют выпариванием под вакуумом. Остаток распределяют между насыщенным раствором бикарбоната натрия и дихлорметаном. Водный слой отделяют и экстрагируют дихлорметаном. Объединенные органические слои промывают солевым раствором и сушат над сульфатом натрия. Выпаривание растворителя под вакуумом приводит к получению неочищенного бензилового эфира 4-[4-(4 фторфенокси)-бензолсульфониламино]тетрагидропиран-4-карбоновой кислоты. В результате тонкослойной хроматографии на силикагеле с элюированием сначала смесью 25% этилацетата/гексан, а затем смесью 50% этилацета 17 та/гексан получают бензиловый эфир 4-[4-(4 фторфенокси)бензолсульфониламино]тетрагидропиран-4-карбоновой кислоты. Г) Бензиловый эфир 4-(2-этоксикарбонилвинил)-[4-(4-фторфенoкси)бензолсульфонил]аминотетрагидропиран-4-карбоновой кислоты. Раствор продукта (53,2 ммоль), полученного на предыдущей стадии, и 10,8 мл (106 ммоль,2 эквивалента) этилпропиолата в 200 мл сухого тетрагидрофурана обрабатывают 53,2 мл (53,2 ммоль, 1 эквивалент) раствора тетрабутиламмонийфторида в тетрагидрофуране (1 М) в течение 45 мин при температуре 1 С. Полученный раствор оставляют медленно нагреваться до температуры окружающей среды и перемешивают в течение ночи. При пониженном давлении тетрагидрофуран замещают толуолом, толуольный раствор промывают водой и солевым раствором,разбавляют до 600 мл толуолом, в течение трех часов перемешивают с 90 г силикагеля, фильтруют и концентрируют с получением указанного в заголовке соединения. Д) 4-(2-Этоксикарбонилэтил)-[4-(4-фторфенокси)бензолсульфонил-1-аминотетрагидропиран-4-карбоновая кислота. Раствор продукта (4,4 ммоль), полученного на стадии Г, в 25 мл этанола обрабатывают в присутствии 2,5 г катализатора (10% палладияна-углероде с влажностью 50%) и встряхивают под давлением водорода 53 фунт/кв.дюйм (371 кПа) в течение 21 ч. Катализатор удаляют фильтрованием и промывают этанолом (4 х 25 мл). Фильтрат и промывные жидкости объединяют и концентрируют под вакуумом с получением неочищенного продукта. Е) Этиловый эфир 3-(4-хлоркарбонилтетрагидропиран-4-ил)-[4-(4-фторфенокси)бензолсульфонил]аминопропионовой кислоты. Раствор продукта (15,1 ммоль), полученного на стадии Д, в 73 мл дихлорметана обрабатывают 1,4 мл (17 ммоль, 1,1 эквивалента) оксалилхлорида и 0,02 мл (0,3 ммоль, 0,02 эквивалента) диметилформамида при температуре окружающей среды, что вызывает некоторое выделение газа, и перемешивают в течение ночи. Полученный раствор указанного в заголовке соединения используют на стадии Ж без выделения. Ж) Этиловый эфир 3-4-(4-фторфенокси)бензолсульфонил]-(4-гидроксикарбамоилтетрагидропиран-4-ил)амино]пропионовой кислоты. Раствор гидроксиламина гидрохлорида(19,7 ммоль, 1,3 эквивалента) в 9,2 мл (114 ммоль, 7,5 эквивалентов) сухого пиридина при 0 С обрабатывают 5,8 мл (45 ммоль, 3,0 эквивалента) триметилсилилхлорида, что вызывает осаждение белых твердых частиц. Эту смесь оставляют на ночь для медленного нагревания до температуры окружающей среды. Затем эту смесь охлаждают до 0 С и обрабатывают раствором продукта (15,1 ммоль), полученного на 18 стадии Е, в 73 мл дихлорметана, что вызывает подъем температуры до примерно 8 С. Эту смесь перемешивают при 0 С в течение 30 мин и при температуре окружающей среды в течение одного часа. Затем реакционную смесь обрабатывают 50 мл 2 н. водного раствора соляной кислоты и перемешивают при температуре окружающей среды в течение одного часа. Водную фазу экстрагируют дихлорметаном, и объединенные органические фазы промывают 2 н. водным раствором соляной кислоты (2 х 50 мл) и водой (50 мл). Этот раствор указанного в заголовке соединения в дихлорметане используют на следующей стадии. З) 3-4-(4-фторфенокси)-бензолсульфонил](4-гидроксикарбамоилтетрагидропиран-4 ил)амино]пропионовая кислота. Раствор 15,1 ммоль продукта, полученного на стадии Ж, в дихлорметане концентрируют в роторном испарителе с добавлением 75 мл толуола. Этот раствор обрабатывают 75 мл воды,охлажденной до 0 С, и в течение 10 мин при энергичном перемешивании обрабатывают 6,05 г (151 ммоль, 10 эквивалентов) гранулированного гидроксида натрия. Эту смесь перемешивают в течение 15 мин при 0 С и в течение одного часа нагревают до температуры окружающей среды. Водную фазу отделяют, разбавляют 7,5 мл тетрагидрофурана, охлаждают до 0 С и обрабатывают 33 мл 6 н. водного раствора соляной кислоты в течение 20 мин. Эту смесь перемешивают с 75 мл этилацетата при температуре от 0 С до температуры окружающей среды и этилацетатную фазу отделяют и промывают водой. Этилацетатный раствор концентрируют с получением указанного в заголовке соединения. Пример 3 3-4-(4-Фторфенокси)бензолсульфонил]-(3 гидроксикарбамоил-8-оксабицикло[3.2.1] окт-3-ил)амино]пропионовая кислотаA) Бензиловый эфир 3-(бензгидрилиденамино)-8-окcaбицикло[3.2.1]октан-3-карбоновой кислоты. К суспензии гидрида натрия (0,41 г, 17,1 ммоль) в N,N-диметилформамиде (50 мл) при 0 С по каплям добавляют раствор бензилового эфира N-дифенилметиленглицина (7,8 ммоль) вN,N-диметилформамиде (50 мл). После перемешивания в течение 30 мин при комнатной температуре добавляют по каплям раствор цис-2,5 бис(гидроксиметил)-тетрагидрофурандитосилата (4,1 г, 9,3 ммоль) (полученный способами,описанными в литературе, такими как способы,описанные в JOC, 47, 2429-2435 (1982 в N,Nдиметилформамиде (50 мл). Реакционную смесь постепенно нагревают на масляной бане до 100 С и перемешивают при этой температуре в течение ночи. Растворитель выпаривают под вакуумом, остаток переносят в воду и дважды экстрагируют диэтиловым эфиром. Объединенные органические экстракты промывают солевым раствором, сушат над сульфатом магния иB) Бензилового эфира 3-амино-8 оксабицикло[3.2.1]октан-3-карбоновой кислоты гидрохлорид. Двухфазную смесь, состоящую из бензилового эфира 3-(бензгидрилиденамино)-8 оксабицикло[3.2.1]октан-3-карбоновой кислоты(3,9 ммоль) в водном 1 н. растворе соляной кислоты (100 мл) и диэтилового эфира (100 мл),перемешивают при комнатной температуре в течение ночи. Водный слой концентрируют с получением указанного в заголовке соединения. В) Бензиловый эфир 3-экзо-[4-(4 фторфенокси)бензолсульфониламино]-8-оксабицикло[3.2.1]-октан-3-карбоновой кислоты. Раствор бензилового эфира 3-амино-8 оксабицикло[3.2.1]октан-3-карбоновой кислоты гидрохлорида (2,9 ммоль), 4-(4-фторфенокси)бензолсульфонилхлорида (923 мг, 3,2 ммоль) и триэтиламина (0,9 мл, 6,5 ммоль) в N,Nдиметилформамиде (45 мл) перемешивают при комнатной температуре в течение ночи. Растворитель удаляют под вакуумом, и остаток переносят в насыщенный водный раствор бикарбоната натрия. После двукратного экстрагирования метиленхлоридом объединенные органические слои промывают солевым раствором, сушат над сульфатом магния и концентрируют до образования коричневого масла. Указанное в заголовке соединение выделяют хроматографией на кремнеземе с использованием в качестве элюента смеси 1% метанола в метиленхлориде. Г) Бензиловый эфир 3-(2-этоксикарбонилвинил)-[4-(4-фторфенокси) бензолсульфонил]амино-8-оксабицикло[3.2.1]октан-3-карбоновой кислоты. Раствор продукта (53,2 ммоль), полученного на предыдущей стадии, и 10,8 мл (106 ммоль,2 эквивалента) этилпропиолата в 200 мл сухого тетрагидрофурана при температуре 1 С обрабатывают 53,2 мл (53,2 ммоль, 1 эквивалент) раствора тетрабутиламмонийфторида в тетрагидрофуране (1 М) в течение 45 мин. Полученный раствор оставляют медленно нагреваться до температуры окружающей среды и перемешивают в течение ночи. При пониженном давлении тетрагидрофуран замещают толуолом, и толуольный раствор промывают водой и солевым раствором, разбавляют толуолом до 600 мл,перемешивают в течение трех часов с 90 г силикагеля, фильтруют и концентрируют с получением указанного в заголовке соединения. Д) 3-(2-Этоксикарбонилэтил)-[4-(4-фторфенокси)-бензолсульфонил]-амино-8-оксабицикло[3.2.1]октан-3-карбоновая кислота. Раствор продукта (4,4 ммоль), полученного на стадии Г, в 25 мл этанола обрабатывают 2,5 г катализатора (10% палладия-на-углероде с влажностью 50%) и встряхивают под давлением водорода 53 фунт/кв.дюйм (371 кПа) в течение 48 ч. Катализатор удаляют фильтрованием и 20 промывают этанолом (4 х 25 мл). Фильтрат и промывные жидкости объединяют и концентрируют под вакуумом с получением неочищенного продукта. Е) Этиловый эфир 3-(3-хлоркарбонил-8 оксабицикло[3.2.1]окт-3-ил)-[4-(4-фторфенокси)-бензолсульфонил]-аминопропионовой кислоты. Раствор 15,1 ммоль продукта, полученного на стадии Д, в 73 мл дихлорметана обрабатывают 1,4 мл (17 ммоль, 1,1 эквивалента) оксалилхлорида и 0,02 мл (0,3 ммоль, 0,02 эквивалента) диметилформамида при температуре окружающей среды, что вызывает некоторое выделение газа, и перемешивают в течение ночи. Полученный раствор указанного в заголовке соединения используют на стадии Ж без выделения. Ж) Этиловый эфир 3-4,(4-фторфенокси)бензолсульфонил]-(3-гидроксикарбамоил-8 оксабицикло[3.2.1]окт-3-ил)-амино]пропионовой кислоты. Раствор гидроксиламина гидрохлорида(19,7 ммоль, 1,3 эквивалента) в 9,2 мл (114 ммоль, 7,5 эквивалентов) сухого пиридина при 0 С обрабатывают 5,8 мл (45 ммоль, 3,0 эквивалента) триметилсилилхлорида, что приводит к осаждению белых твердых частиц. Смесь оставляют на ночь для нагревания до температуры окружающей среды. Затем эту смесь охлаждают до 0 С и обрабатывают раствором продукта(15,1 ммоль), полученного на стадии Е, в 73 мл дихлорметана, что вызывает подъем температуры до примерно 8 С. Эту смесь перемешивают при 0 С в течение 30 мин и при температуре окружающей среды приблизительно один час. Затем реакционную смесь обрабатывают 50 мл 2 н. водного раствора соляной кислоты и перемешивают при температуре окружающей среды в течение одного часа. Водную фазу экстрагируют дихлорметаном, и объединенные органические фазы промывают 2 н. водным раствором соляной кислоты (2 х 50 мл) и водой (50 мл). Этот раствор указанного в заголовке соединения в дихлорметане используют на следующей стадии. З) 3-4-(4-Фторфенокси)-бензолсульфонил]-(3-гидроксикарбамоил-8-оксабицикло[3.2.1]окт-3-ил)-амино]пропионовая кислота. Раствор 15,1 ммоль продукта, полученного на стадии Ж, в дихлорметане концентрируют в роторном испарителе с добавлением 75 мл толуола. Этот раствор обрабатывают 75 мл воды,охлаждают до 0 С и обрабатывают 6,05 г (151 ммоль, 10 эквивалентов) гранулированного гидроксида натрия в течение 10 мин при энергичном перемешивании. Эту смесь перемешивают в течение 15 мин при 0 С и нагревают до температуры окружающей среды в течение одного часа. Водную фазу отделяют, разбавляют 7,5 мл тетрагидрофурана, охлаждают до 0 С и обрабатывают 33 мл 6 н. водного раствора соляной кислоты в течение 20 мин. Эту смесь перемеши 21 вают с 75 мл этилацетата при 0 С до достижения температуры окружающей среды, этилацетатную фазу отделяют и промывают водой. Этилацетатный раствор концентрируют с получением указанного в заголовке соединения. Получение 1 4-Фторфениловый эфир 4-(4-фторфенокси)бензолсульфоновой кислоты Раствор 14,68 г (0,131 моля, 2,0 эквивалента) трет-бутилата калия в 27 мл сухого Nметилпирролидинона обрабатывали раствором 15,39 г (0,137 моля, 2,1 эквивалента) 4 фторфенола в 27 мл сухогоNметилпирролидинона при температуре окружающей среды, что вызвало постепенный подъем температуры до 45 С. Раствор 13,81 г (0,065 моля) 4-хлорбензолсульфонилхлорида в 27 мл сухого N-метилпирролидинона медленно добавляли к темной реакционной смеси, что вызвало постепенный подъем температуры до 44 С. Полученную смесь перемешивали при комнатной температуре в течение одного часа и затем при 130 С в течение 11 ч. Охлажденную реакционную смесь обрабатывали 162 мл воды,затравленной следами 4-фторфенилового эфира 4-(4-фторфенокси)бензолсульфоновой кислоты,и гранулировали при комнатной температуре в течение ночи. Полученные твердые частицы отфильтровывали с получением 20,24 г (85%) 4 фторфенилового эфира 4-(4-фторфенокси)бензолсульфоновой кислоты. 1H ЯМР (СDСl3)7,74 (dd, J=7,0, 2,0 Гц,2 Н), 7,14-6,97 (m, 10 Н). Температура плавления 78-83 С. Получение 2 4-(4-Фторфенокси)бензолсульфоновая кислота К суспензии 47,43 г (0,131 моль) 4 фторфенилового эфира 4-(4-фторфенокси)бензолсульфоновой кислоты в 475 мл этанола добавляли 13,09 г (0,327 моль, 2,5 эквивалента) гранулированного гидроксида натрия. Эту смесь нагревали с обратным холодильником в течение трех часов и перемешивали в течение ночи при комнатной температуре. Полученные твердые частицы отфильтровывали с получением 37,16 гH ЯМР (CD3OD)7,73-7,78 (m, 2 Н), 7,057,13 (m, 2 Н), 6,99-7,05 (m, 2H), 6,90-6,95 (m,2H). Получение 3 4-(4-Фторфенокси)бензолсульфонилхлорид К суспензии 15,0 г (0,052 моля) натриевой соли 4-(4-фторфенокси)бензолсульфоновой кислоты в 150 мл сухого толуола добавляли 11,3 мл (0,155 моля, 3 эквивалента) тионилхлорида и 0,04 мл (0,5 ммоль, 0,01 эквивалента) диметилформамида. Полученную смесь перемешивали при комнатной температуре в течение 48 ч,фильтровали через диатомовую землю и концентрировали при пониженном давлении до 40 22 мл. Этот раствор без дальнейшей очистки использовали для получения бензилового эфира 1[4-(4-фторфенокси)бензолсульфониламино]циклопентанкарбоновой кислоты. Часть этого раствора в объеме 5,0 мл концентрировали с получением 1,77 г 4-(4 фторфенокси)бензолсульфонилхлорида в виде масла, что соответствует выходу 96%. 1 Н ЯМР (CDCl3)7,92-7,97 (m, 2H), 7,017,13 (m, 6H). Часть аналогично полученного масла перекристаллизовывали из гексана, температура плавления 80 С. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы где R1 представляет собой возможно замещенный бензил;(С 1-С 6)алкил, либо R2 и R3, взятые вместе, образуют 3-7-членное циклоалкильное, пиран-4 ильное кольцо или бициклическое кольцо формулы где звездочка указывает на углеродный атом,общий для R2 и R3;(С 2-С 9)гетероарил(С 6-С 10)арила, (С 2-С 9)гетероарил(С 2-С 9)гетероарила, (С 6-С 10)арил(С 1-С 6)алкокси(С 1-С 6)алкила, (С 6-С 10)арил(С 1-С 6)алкокси(С 6-С 10)арила, (С 6-С 10)арил(С 1-С 6)алкокси(С 2 С 9)гетероарила, (С 2-С 9)гетероарилокси(С 1-С 6)алкила, (С 2-С 9)гетероарилокси(С 6-С 10)арила, (С 2-С 9) гетероарилокси(С 2-С 9)гетероарила, (С 2-С 9)гетероарил(С 1-С 6)алкокси(С 1-С 6)алкила, (С 2-С 9)гетероарил(С 1-С 6)алкокси(С 6-С 10)арила или (С 2 С 9)гетероарил(С 1-С 6)алкокси(С 2-С 9)гетероарила возможно замещена по любому из кольцевых атомов углерода, способных образовывать дополнительную связь с одним или более чем одним заместителем на кольцо, независимо выбранным из фтор-, хлор-, бром-, (С 1 С 6)алкильной,(С 1-С 6)алкокси,перфтор(С 1 С 3)алкильной, перфтор(С 1-С 3)алкокси и (С 6 С 10)арилоксигруппы; и Y представляет собой водород или (С 1 С 6)алкил. 2. Соединение по п.1, где R2 и R3, взятые вместе, образуют циклобутильное, циклопентильное, пиран-4-ильное кольцо или бициклическое кольцо формулы где звездочка указывает на углеродный атом,общий для R2 и R3. 3. Соединение по п.1 где Q представляет собой 4-(4-фторфенокси)фенил. 4. Способ получения соединения формулы где R1 представляет собой возможно замещенный бензил;(С 1-С 6)алкил, либо R2 и R3, взятые вместе, образуют 3-7-членное циклоалкильное, пиран-4 ильное кольцо или бициклическое кольцо формулы где звездочка указывает на углеродный атом,общий для R2 и R3;(С 1-С 6)алкокси(С 1-С 6)алкила, (С 6-С 10)арил(С 1 С 6)алкокси(С 6-С 10)арила, (C6-С 10)арил(С 1-С 6)алкокси(С 2-С 9)гетероарила,(С 2-С 9)гетероарило кси(С 1-С 6)алкила,(С 2-С 9)гетероарилокси(С 6 С 10)арила, (С 2-С 9)гетероарилокси(С 2-С 9)гетероарила,(С 2-С 9)гетероарил(С 1-С 6)алкокси(С 1 С 6)алкила, (С 2-С 9)гетероарил(С 1-С 6)алкокси(С 6 С 10)арила или (С 2-С 9)гетероарил(С 1-С 6)алкокси(С 2-С 9)гетероарила возможно замещена по любому из кольцевых атомов углерода, способных образовывать дополнительную связь с одним или более чем одним заместителем на кольцо, независимо выбранным из фтор-, хлор-,бром-, (С 1-С 6)алкильной, (С 1-С 6)алкокси, перфтор(С 1-С 3)алкильной, перфтор(С 1-С 3)алкокси и(С 6-С 10)арилоксигруппы; и Y представляет собой (С 1-С 6)алкил; при котором соединение формулы где R1 представляет собой возможно замещенный бензил,а R2, R3, R4 и Q такие, как определено выше,подвергают взаимодействию с соединением формулы где Y представляет собой (С 1-С 6)алкил,в присутствии основания и полярного растворителя. 5. Способ по п.4, где указанное основание представляет собой тетрабутиламмонийфторид. 6. Способ по п.4, где указанный растворитель представляет собой тетрагидрофуран. 7. Способ получения соединения формулы где R2 и R3 независимо представляют собой (С 1 С 6)алкил, либо R2 и R3, взятые вместе, образуют 3-7-членное циклоалкильное, пиран-4-ильное кольцо или бициклическое кольцо формулы где звездочка указывает на углеродный атом, общий для R2 и R3;(С 2-С 9)гетероарила,(С 6-С 10)арил(С 1-С 6)алкокси(С 1-С 6)алкила, (С 6-С 10)арил(С 1-С 6)алкокси(С 6 С 10)арила, (С 6-С 10)арил(С 1-С 6)алкокси(С 2-С 9)гетероарила, (С 2-С 9)гетероарилокси(С 1-С 6)алкила,(С 2-С 9)гетероарилокси(С 6-С 10)арила, (С 2-С 9)гетероарилокси(С 2-С 9)гетероарила,(С 2-С 9)гетероарил(С 1-С 6)алкокси(С 1-С 6)алкила, (С 2-С 9)гетероарил(С 1-С 6)алкокси(С 6-С 10)арила или (С 2 С 9)гетероарил(С 1-С 6)алкокси(С 2-С 9)гетероарила возможно замещена по любому из кольцевых атомов углерода, способных образовывать дополнительную связь с одним или более чем одним заместителем на кольцо, независимо выбранным из фтор-, хлор-, бром-, (С 1 С 6)алкильной,(С 1-С 6)алкокси,перфтор(С 1 С 3)алкильной, перфтор(С 1-С 3)алкокси и (С 6 С 10)арилоксигруппы; и Y представляет собой (С 1-С 6)алкил; при котором соединение формулы где R1 представляет собой возможно замещенный бензил, a R2, R3, Y и Q такие, как определено выше, восстанавливают восстанавливающим агентом в растворителе. 8. Способ по п.7, где указанный восстанавливающий агент представляет собой водород над палладием-на-углероде. 9. Способ по п.7, где указанный растворитель представляет собой этанол. 10. Способ по п.7, при котором далее указанное соединение формулы III подвергают взаимодействию с дициклогексиламином с образованием дициклогексиламмониевой соли соединения формулы III.
МПК / Метки
МПК: A61P 19/00, C07C 311/19, C07D 309/14
Метки: алкилирования, способ, сульфонамидов, затрудненных
Код ссылки
<a href="https://eas.patents.su/14-2277-sposob-alkilirovaniya-zatrudnennyh-sulfonamidov.html" rel="bookmark" title="База патентов Евразийского Союза">Способ алкилирования затрудненных сульфонамидов</a>
Предыдущий патент: Способ резки титана и его сплавов
Следующий патент: Противопаразитарные пиразолы
Случайный патент: Способ получения замещенных 4-фенил-4-цианоциклогексановых кислот










