Новые каталитические системы для (со)полимеризации лактонов с раскрытием цикла
Номер патента: 17727
Опубликовано: 28.02.2013
Авторы: Мартин-Вака Бланка, Шериф-Шейк Ролан, Альба Орели, Де Соуса Дельгадо Анн-Паула, Буриссу Дидье
Формула / Реферат
1. Применение сульфонамида в сочетании с основанием в качестве каталитической системы (со)полимеризации лактонов с раскрытием цикла.
2. Применение по п.1 для (со)полимеризации дилактонов.
3. Применение по п.1 для сополимеризации лактида и/или гликолида.
4. Применение по п.3 для полимеризации лактида.
5. Применение по любому из предыдущих пунктов, отличающееся тем, что основание представляет собой третичный амин.
6. Применение по любому из предыдущих пунктов, отличающееся тем, что основание представляет собой третичный амин, выбранный из
диизопропилэтиламина;
спартеина;
N,N-диметилциклогексиламина;
N,N,N',N'-тетраметил-1,2-циклогександиамина;
4-диметиламинопиридина.
7. Применение по любому из предыдущих пунктов, отличающееся тем, что сульфонамид представляет собой моносульфонамид.
8. Применение по любому из предыдущих пунктов, отличающееся тем, что сульфонамид представляет собой моносульфонамид общей формулы (I)
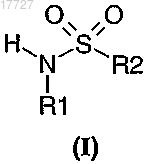
в форме рацемата, энантиомера или любой комбинации таких форм, где R1 и R2 независимо друг от друга представляют собой алкил, галогеналкил или арил, замещенный при необходимости алкилом, галогеналкилом, алкоксигруппой, алкоксикарбонилом, алкилкарбонилоксигруппой, галогеном, циано-, нитрогруппой, арилом, арилоксигруппой, арилоксикарбонилом, арилкарбонилоксигруппой.
9. Применение по п.8, отличающееся тем, что R1 и R2 независимо друг от друга представляют собой фенил, алкил или галогеналкил.
10. Применение по любому из предыдущих пунктов, отличающееся тем, что сульфонамид представляет собой соединение, выбранное из
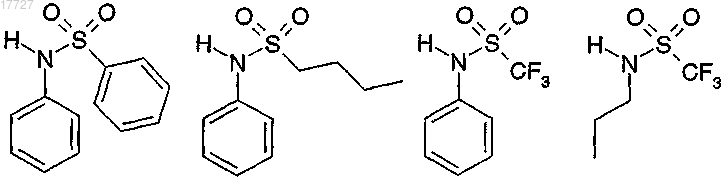
11. Применение по любому из пп.1-6, отличающееся тем, что сульфонамид представляет собой бисульфонамид.
12. Применение по п.11, отличающееся тем, что сульфонамид представляет собой бисульфонамид общей формулы (IIa) или (IIb)
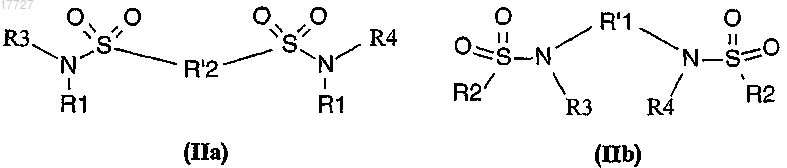
в форме рацемата, энантиомера или любой комбинации таких форм, где
R1 и R2 представляют собой алкил, галогеналкил или арил, замещенный при необходимости алкилом, галогеналкилом, алкоксигруппой, алкоксикарбонилом, алкилкарбонилоксигруппой, галогеном, циано-, нитрогруппой, арилом, арилоксигруппой, арилоксикарбонилом, арилкарбонилоксигруппой;
R'1 и R'2 представляют собой арилен, алкилен или циклоалкилен, причем когда R'1 представляет собой циклоалкилен, R'1 при необходимости замещен фенилом;
R3 и R4 независимо друг от друга представляют собой атом водорода или алкил.
13. Применение по п.12, отличающееся тем, что R3 и R4 независимо друг от друга представляют собой атом водорода или метил.
14. Применение по п.12 или 13, отличающееся тем, что R3 и R4 представляют собой атомы водорода.
15. Применение по любому из пп.12-14, отличающееся тем, что R1 и R2 представляют собой фенил, замещенный при необходимости алкилом, галогеналкилом, алкоксигруппой, алкоксикарбонилом, алкилкарбонилоксигруппой, галогеном, циано-, нитрогруппой, арилом, арилоксигруппой, арилоксикарбонилом, арилкарбонилоксигруппой; алкил или галогеналкил;
R'1 представляет собой циклоалкилен, алкилен;
R'2 означает алкилен или фенилен.
16. Применение по любому из пп.12-15, отличающееся тем, что R1 и R2 представляют собой алкил, трифторметил или фенил, при необходимости замещенный метилом или трифторметилом.
17. Применение по п.12 или 13, отличающееся тем, что сульфонамид представляет собой соединение, выбранное из
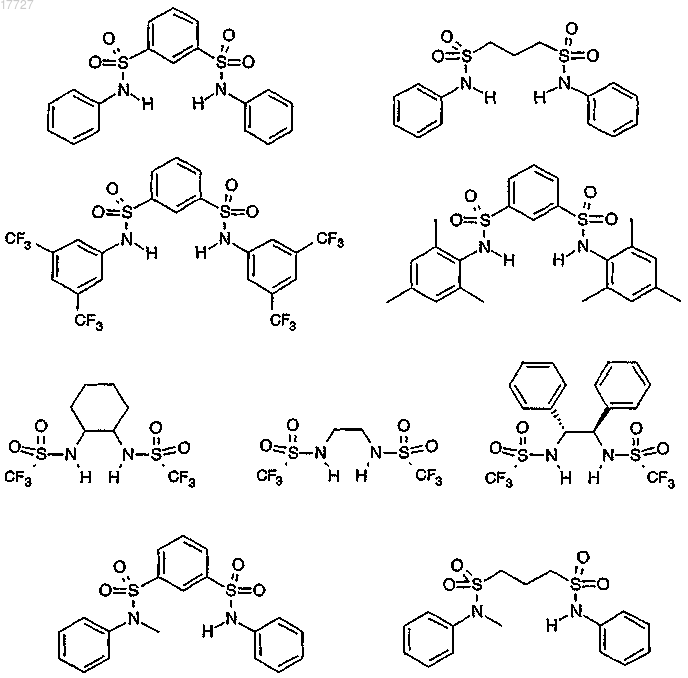
18. Применение по любому из пп.12-17, отличающееся тем, что сульфонамид представляет собой соединение, выбранное из
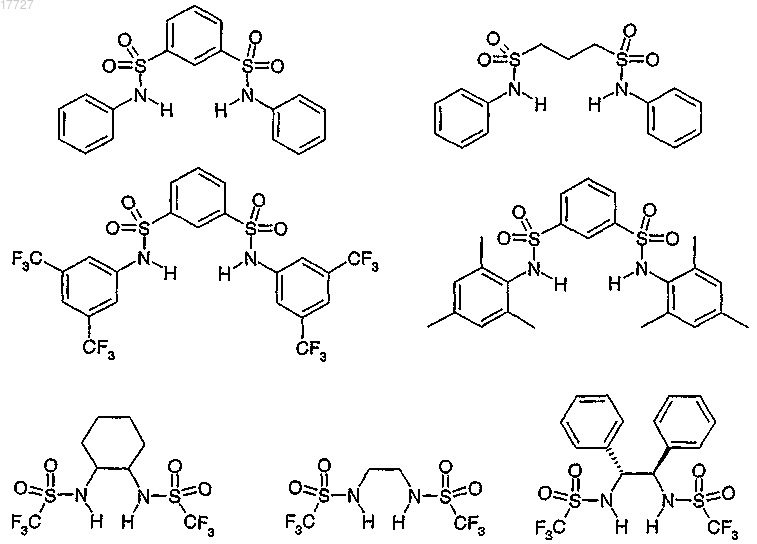
19. Применение по любому из предыдущих пунктов, отличающееся тем, что основание представляет собой 4-диметиламинопиридин.
20. Бисульфонамид, выбранный из соединений формул
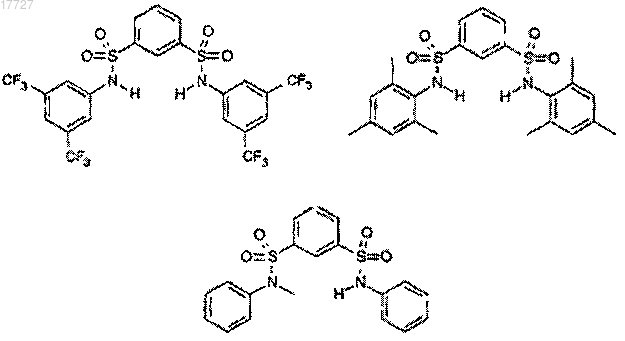
21. Бисульфонамид формулы
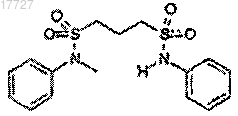
22. Способ (со)полимеризации с раскрытием цикла, отличающийся тем, что в нем предусмотрено применение по любому из пп.1-19 сульфонамида в сочетании с основанием в качестве катализатора.
23. Способ по п.22, отличающийся тем, что сополимеризацию осуществляют с использованием растворителя при температуре от 0 до 250°С в течение интервала времени от нескольких минут до 300 ч.
24. Способ по п.23, отличающийся тем, что сополимеризацию осуществляют с использованием растворителя при температуре от комнатной до 150°С в течение интервала времени от нескольких часов до 72 ч.
25. Способ по п.23, отличающийся тем, что в качестве мономера используют лактид и/или гликолид.
Текст
НОВЫЕ КАТАЛИТИЧЕСКИЕ СИСТЕМЫ ДЛЯ (СО)ПОЛИМЕРИЗАЦИИ ЛАКТОНОВ С РАСКРЫТИЕМ ЦИКЛА Настоящее изобретение относится к применению системы, образованной основанием и сульфонамидом, в качестве катализатора (со)полимеризации лактонов с раскрытием цикла. Изобретение относится также к новым сульфонамидам и способу (со)полимеризации лактонов с раскрытием цикла, при этом сульфонамиды в сочетании с основанием применяют в качестве каталитической системы. Буриссу Дидье, Мартин-Вака Бланка,Альба Орели (FR), Шериф-Шейк Ролан, Де Соуса Дельгадо Анн-Паула 017727 Настоящее изобретение относится к применению системы, образованной основанием и сульфонамидом, в качестве катализатора (со)полимеризации лактонов с раскрытием цикла. Изобретение относится также к новым сульфонамидам и способу (со)полимеризации лактонов с раскрытием цикла, при этом сульфонамиды в сочетании с основанием применяют в качестве каталитической системы. В настоящее время возрастающее внимание уделяется синтетическим полимерам, предназначенным для изготовления искусственных органов и композиций лекарственных средств [Chem. Eng. News 2001,79(6), 30]. Соответствующие полимеры должны обладать некоторой совокупностью свойств, в частности, они должны быть биологически совместимыми. Способность к биодеградации представляет собой дополнительное преимущество, если полимер должен быть удален по истечении соответствующего периода нахождения в организме. В данном отношении сополимеры на основе молочной и гликолевой кислот (PLGA) представляют собой очень большой интерес, поскольку они чувствительны к гидролизу и деградируются in vivo с высвобождением нетоксичных продуктов. Диапазон применения сополимеровPLGA является очень широким (Adv. Mater. 1996, 8, 305 и Chemosphere 2001, 43, 49). В области хирургии их используют для получения комплексных нитей, шовных материалов, имплантатов, протезов и т.п. В фармакологии они обеспечивают инкапсулирование, транспортировку и контролируемое высвобождение активных веществ. В случае всех таких применений ключевым фактором является скорость деградации PLGA, которая бесспорно зависит от структуры (длина цепи, дисперсность, состав, стереохимия и последовательность встраивания мономеров в цепь). Таким образом, в последние годы множество работ было посвящено разработке катализаторов и/или инициаторов (со)полимеризации, то есть полимеризации или сополимеризации, лактида и/или гликолида, позволяющих получать PLGA с контролируемой структурой. Применение металлосодержащих систем наиболее часто ведет к загрязнению полученных таким образом сополимеров вследствие присутствия солей металлов, что иногда представляет собой существенное ограничение для предполагаемого применения. Таким образом, разработка систем, не содержащих металлы и обеспечивающих контролируемую (со)полимеризацию лактида и/или гликолида, представляет собой главную цель. Настоящее изобретение относится к таким разработкам. С этой целью заявителем предложено применение простой каталитической системы, образованной катализатором и присадкой для (со)полимеризации и позволяющей контролировать длину цепи, а также природу концевых групп цепи получаемых (со)полимеров. Таким образом, целью настоящего изобретения является применение сульфонамида в сочетании с основанием в качестве каталитической системы (со)полимеризации лактонов с раскрытием цикла. Термин "(со)полимеризация" означает полимеризацию или сополимеризацию. Данный термин включает в себя термин "(со)олигомеризация", который означает олигомеризацию или соолигомеризацию со степенью полимеризации (DP) меньше 30. Так, например, (со)полимеризация лактида и гликолида означает полимеризацию лактида, полимеризацию гликолида, а также сополимеризацию лактида и гликолида. Термин "(со)полимер" означает полимер или сополимер. Данный термин включает в себя термин "(со)олигомер", который означает олигомер или соолигомер со степенью полимеризации (DP) меньше 30. Так, например, (со)полимер лактида и гликолида означает полимер лактида, полимер гликолида, а также сополимер лактида и гликолида. По настоящему изобретению термин "сульфонамид" означает соединение, содержащее по меньшей мере одну функциональную группу -SO2-NH-, такое как моносульфонамид или бисульфонамид. Термин"моносульфонамид" означает соединение, содержащее одну функциональную группу -SO2-NH-, а термин"бисульфонамид" означает соединение, содержащее две функциональные группы -SO2-NH-. Более предпочтительно настоящее изобретение относится к применению определенного ранее сульфонамида для (со)полимеризации дилактонов. Настоящее изобретение относится также к применению определенного ранее сульфонамида для сополимеризации лактида и/или гликолида и предпочтительно для полимеризации лактида. По настоящему изобретению применяемое основание предпочтительно представляет собой третичный амин и более предпочтительно третичный амин, выбранный из диизопропилэтиламина; спартеина;N,N,N',N'-тетраметил-1,2-циклогександиамина; 4-диметиламинопиридина. В одном из вариантов настоящего изобретения применяемый сульфонамид представляет собой моносульфонамид и предпочтительно моносульфонамид общей формулы (I) в форме рацемата, энантиомера или любой комбинации таких форм, где R1 и R2 независимо друг от друга представляют собой алкил, галогеналкил или замещенный при необходимости арил. В смысле настоящего изобретения арильные радикалы могут быть моно- или полициклическими ароматическими радикалами. Моноциклические арильные радикалы могут быть выбраны из таких радикалов, как фенил, толил, ксилил, мезитил, куменил и предпочтительно фенил. Полициклические арильные радикалы могут быть выбраны из таких радикалов, как нафтил, антрил, фенантрил, флуоренил. При необходимости они могут иметь в качестве заместителей один или несколько радикалов, таких как алкил, галогеналкил, алкоксигруппа, алкоксикарбонил, алкилкарбонилоксигруппа, галоген, циано-, нитрогруппа, арил, арилоксигруппа, арилоксикарбонил, арилкарбонилоксигруппа. Термин "галоген" означает фтор, хлор, бром или иод и предпочтительно фтор. Термин "алкил" означает алкил, содержащий от 1 до 8 атомов углерода. Данный термин охватывает линейные или разветвленные алкилы, содержащие от 1 до 6 атомов углерода, в частности алкилы, содержащие от 1 до 4 атомов углерода, такие как метил, этил, пропил, изопропил, бутил, изобутил, вторбутил, трет-бутил и предпочтительно метил. Термин охватывает также радикалы, содержащие больше 6 атомов углерода, такие как гептил и октил. Термин "галогеналкил" означает определенный ранее алкил, содержащий в качестве заместителей один или несколько одинаковых или различающихся атомов галогенов, таких как определено ранее, например трифторметил, 1,2-дихлорэтил и предпочтительно трифторметил. Термин "арилоксигруппа" означает радикал, в котором арил представляет собой определенный ранее арил, такой как, например, фенилокси-, толилокси-, нафтилокси-, антрилокси- и фенантрилоксигруппа. Термин "арилоксикарбонил" предпочтительно означает радикал, в котором арилоксигруппа представляет собой определенную ранее арилоксигруппу, такой как, например, фенилоксикарбонил, толилоксикарбонил. Термин "арилкарбонилоксигруппа" предпочтительно означает радикал, в котором арил представляет собой определенный ранее арил, такой как, например, фенилкарбонилокси-, толилкарбонилокси- или нафтилкарбонилоксигруппа. Термин "алкоксигруппа" означает радикал, в котором алкил представляет собой определенный ранее алкил, содержащий от 1 до 8 атомов углерода, такой как, например, метокси-, этокси-, пропокси- или изопропоксигруппа, а также линейная, вторичная или третичная бутокси-, пентоксигруппа. Термин "алкоксикарбонил" предпочтительно означает радикал типа алкил-О-С(О), в котором алкил представляет собой определенный ранее алкил, такой как, например, метоксикарбонил, этоксикарбонил. Термин "алкилкарбонилоксигруппа" предпочтительно означает радикал типа алкил-О-С(О)O-, в котором алкил представляет собой определенный ранее алкил, такой как, например, метилкарбонилокси-,этилкарбонилоксигруппа. Настоящее изобретение также предпочтительно относится к применению моносульфонамида общей формулы (I), где R1 и R2 независимо друг от друга представляют собой фенил, алкил или галогеналкил. Более предпочтительно настоящее изобретение относится к применению определенного ранее сульфонамида, выбранного из В другом варианте настоящего изобретения применяемый сульфонамид представляет собой бисульфонамид и предпочтительно бисульфонамид общей формулы (IIa) или (IIb) в форме рацемата, энантиомера или любой комбинации таких форм, гдеR1 и R2 представляют собой алкил, галогеналкил или замещенный при необходимости арил;R'1 и R'2 представляют собой арилен, алкилен, циклоалкилен, причем любые данные радикалы при необходимости имеют заместители;R3 и R4 независимо друг от друга представляют собой атом водорода или алкил, предпочтительноR3 и R4 независимо друг от друга представляют собой атом водорода или метил и более предпочтительно R3 и R4 представляют собой атомы водорода. В смысле настоящего изобретения термин "арилен" означает двухвалентный арил, причем арил имеет определенные ранее значения, термин "алкилен" означает двухвалентный алкил, причем алкил имеет определенные ранее значения, а термин "циклоалкилен" означает двухвалентный циклоалкил,причем циклоалкил представляет собой циклоалкил, определенный далее. Циклоалкилы выбраны из моноциклических насыщенных или ненасыщенных циклоалкилов. Моноциклические насыщенные циклоалкилы могут быть выбраны из радикалов, содержащих от 3 до 7 атомов углерода, таких как циклопропил, циклобутил, циклопентил, циклогексил или циклогептил. Ненасыщенные циклоалкилы могут быть выбраны из циклобутена, циклопентена, циклогексена, циклопентадиена, циклогексадиена. Наиболее предпочтительно R1 и R2 представляют собой замещенный при необходимости фенил,алкил или галогеналкил; R'1 представляет собой циклоалкилен, алкилен, имеющий при необходимости в качестве заместителя фенил; R'2 означает алкилен или фенилен. Более предпочтительно R1 и R2 представляют собой алкил, трифторметил или фенил, имеющий при необходимости в качестве заместителя метил или трифторметил. Более предпочтительно настоящее изобретение относится к применению сульфонамида, выбранного из и наиболее предпочтительно выбранного из Наиболее предпочтительно основание, применяемое по настоящему изобретению, представляет собой 4-диметиламинопиридин. Настоящее изобретение относится также к следующим соединениям: в качестве определенных ранее сульфонамидов, и более предпочтительно настоящее изобретение относится к следующим соединениям: Настоящее изобретение более предпочтительно относится также к способу (со)полимеризации с раскрытием цикла, отличающемуся тем, что в нем применяют сульфонамид в сочетании с основанием в качестве катализатора, такого как определено ранее. Предпочтительно в данном способе используют растворитель (со)полимеризации при температуре в интервале от 0 до 250 С (более предпочтительно в интервале от комнатной температуры до 150 С) в течение интервала времени от нескольких минут до 300 ч (более предпочтительно в интервале от 1 до 72 ч). Температуру выбирают в зависимости от растворителя так, чтобы она попадала в определенный ранее интервал и была не более температуры кипения растворителя, если данная температура меньше 250 С. Более предпочтительно в данном способе в качестве мономера используют лактид и/или гликолид. Настоящее изобретение имеет несколько преимуществ, в частности каталитические системы могут быть легко получены и являются дешевыми; сульфонамиды синтезируются простым образом и с хорошим выходом; сульфонамиды обладают различными структурами, позволяющими проектировать множество различных каталитических систем; сульфонамиды обладают структурами, являющимися стабильными на воздухе при комнатной температуре;-4 017727 распределение масс получаемых полимеров является очень узким; индексы полидисперсности, получаемые по настоящему изобретению, на практике находятся в интервале от 1,05 до 1,20;(со)полимеризация с раскрытием цикла, катализируемая сульфонамидами, может быть осуществлена в различных растворителях, таких как дихлорметан, толуол или тетрагидрофуран. В заключение изобретение относится к полимерам или сополимерам лактида и/или гликолида, которые получают или могут быть получены описанным ранее способом. По меньшей мере, если не было определено иное, то любые технические и научные термины, используемые в настоящей заявке, имеют такие же значения, что и термины, традиционно используемые специалистами в области техники, к которой относится настоящее изобретение. Любые получаемые катализаторы содержат одну или две функциональные группы -SO2NH-, при этом понимают моносульфонамид и бисульфонамид соответственно. Следующая далее экспериментальная часть приведена для пояснения упомянутых ранее процедур и не должна ни в коем случае рассматриваться в качестве ограничения объема патентной охраны по настоящему изобретению. Экспериментальная часть Соединения были охарактеризованы традиционными способами, известными специалистам в данной области техники и описанными далее. Спектры ЯМР 1 Н, 13 С и 19F получали на спектрометрах Bruker Avance 300. Сдвиги рассчитывали как положительные величины в сильных полях и выражали в м.д. В качестве стандартов использовали тетраметилсилан для спектров 1 Н и 13 С и трифторуксусную кислоту для спектров 13F. Для описания сигналов использованы следующие сокращения: с (синглет), с ушир. (уширенный синглет), д (дублет), т (триплет), к (квартет), кв (квинтет), дд (дублет дублетов), м (мультиплет). Температуры плавления определяли цифровым прибором Electrothermal. Масс-спектры получали, используя способы химической ионизации (ХИ (IC или электронного удара (ЭУ (IE на спектрометрах Thermo TSQ 700, Applied Biosystem API-365 или Applied BiosystemQtrap. Анализы способом спектроскопии высокого разрешения (МСВР (HRMS осуществляли на приборе Micromass Waters LCT. Среднечисленные (Mn) и среднемассовые (Mw) молекулярные массы полимеров, а также индексы полидисперсности (Ip) определяли стерической эксклюзионной хроматографией на приборе HPLC Waters 712 (в ТГФ, 1 мл/мин, Т=35 С, колонка Styragel HR1 или Styragel HR4E, градуировка по стандартным образцам полистирола). Синтез 1. Получение сульфонамидов из сульфонилхлорида (примеры 1-6). Первую группу сульфонамидов получали исходя из основы, содержавшей одну или две функциональные сульфонилхлоридные группы, по которым присоединяли выбранный амин. Данные катализаторы, являющиеся стабильными на воздухе и при комнатной температуре, были полностью охарактеризованы (ЯМР 1 Н, 13 С, МС, элементный анализ, температура плавления). Синтез 1 а. Получение моносульфонамидов. Моносульфонамиды получали следующим образом: К смеси амина R1NH2 (1 экв.) и пиридина (1 экв.) в тетрагидрофуране (1,8 мольл-1) медленно прибавляют сульфонилхлорид R2SO2Cl (1 экв.) и реакционную смесь перемешивают при комнатной температуре, то есть при температуре в интервале от 18 до 30 С, до полного превращения реагентов, при этом ход реакции контролируют способом ЯМР 1 Н. Затем растворитель выпаривают в вакууме и полученное неочищенное вещество очищают хроматографией на колонке с диоксидом кремния, используя в качестве подвижной фазы градиентную смесь CH2Cl2/MeOH. Таким образом, были получены следующие моносульфонамиды:(CDCl3, 75 МГц):13,4 (СН 3); 21,3 (СН 2); 25,2 (СН 2); 51,1 (СН 2); 120,3 (СН); 124,8 (СН); 129,5 (СН); 137,1 (С) м.д. МС (ЭУ): 213 [М]+. Элементный анализ: вычислено для (C10H15NO2S): С 56,31%, Н 7,09%,N 6,57%; найдено: С 55,72%, Н 7,27%, N 6,42%. Синтез 1b. Получение бисульфонамидов. Бисульфонамиды получали следующим образом: К смеси амина R1NH2 (2 экв.) и пиридина (2 экв.) в тетрагидрофуране (1 мольл-1) прибавляют сульфонилхлорид (1 экв.). Реакционную смесь перемешивают при комнатной температуре до полного превращения реагентов, при этом ход реакции контролируют способом ЯМР 1 Н. Затем растворитель выпаривают в вакууме и полученное неочищенное вещество очищают хроматографией на колонке с диоксидом кремния, используя в качестве подвижной фазы градиентную смесь CH2Cl2/MeOH. Таким образом, были получены следующие бисульфонамиды:-6 017727 Синтез 2. Получение сульфонамидов из ангидрида сульфоновой кислоты (примеры 7-11). Вторую группу сульфонамидов также синтезировали из аминов путем взаимодействия с ангидридом трифторметансульфоновой кислоты. Полученные катализаторы также были охарактеризованы. Они являются стабильными на воздухе и при комнатной температуре. Синтез 2 а. Получение моносульфонамидов. Моносульфонамиды получали следующим образом: К смеси амина (1 экв., 3 мольл-1) и триэтиламина (1,1 экв.) в безводном дихлорметане при 0 С медленно прибавляют раствор ангидрида трифторметансульфоновой кислоты (1,1 экв., 3 мольл-1) в безводном дихлорметане. Реакционную смесь перемешивают в течение часа при 0 С, затем после нагревания до комнатной температуры прибавляют насыщенный водный раствор NaCl. Водную фракцию экстрагируют два раза дихлорметаном. Органические фракции объединяют, сушат над безводным сульфатом натрия, фильтруют и упаривают досуха. Полученный неочищенный остаток очищают хроматографией на колонке с диоксидом кремния, используя в качестве подвижной фазы градиентную смесь CH2Cl2/MeOH. Были получены следующие моносульфонамиды:[М-С 2 Н 5]+. Пример 8 ЯМР 1 Н (CDCl3, 300 МГц):7,19-7,28 (м, 3H, СН); 7,31-7,36 (м, 2 Н, СН); 6,63 (с ушир., 1 Н, NH) 19 м.д.; F (CDCl3, 280 МГц):-75,2 м.д. МС (ЭУ): 225 [М]+. Синтез 2b. Получение бисульфонамидов. Бисульфонамиды получали следующим образом: К смеси диамина (1 экв., 3 мольл-1) и триэтиламина (2,1 экв.) в безводном дихлорметане при 0 С медленно прибавляют раствор ангидрида трифторметансульфоновой кислоты (2,1 экв., 5 мольл-1) в безводном дихлорметане. Реакционную смесь перемешивают в течение часа на холоду, затем после нагревания до комнатной температуры прибавляют насыщенный раствор NaCl. Водную фракцию экстрагируют два раза дихлорметаном. Органические фракции объединяют, сушат над безводным сульфатом натрия, фильтруют и упаривают досуха. Полученный неочищенный остаток очищают хроматографией на колонке с диоксидом кремния, используя в качестве подвижной фазы градиентную смесь CH2Cl2/MeOH. Были получены следующие бисульфонамиды:(C16H14F6N2O4S2): С 40,34%, Н 2,96%, N 5,88%; найдено: С 40,43%, Н 2,36%, N 5,82%. Температура плавления: 213-215 С. Синтез 3. Получение алкилбисульфонамидов (примеры 12-13). Алкилбисульфонамиды получали по методике А или В. методика А Пример 12. К эквиваленту пиридина (1,47 мл, 18 ммоль) и эквиваленту N-метиланилина в (1,97 мл, 18 ммоль) в виде раствора в 50 мл ТГФ прибавляют эквивалент 1,3-бензолдисульфонилхлорида (5 г, 18 ммоль). После перемешивания в течение 2 ч при комнатной температуре прибавляют эквивалент анилина (1,66 мл,18 ммоль) и эквивалент пиридина (1,47 мл, 18 ммоль). Смесь перемешивают в течение ночи при комнатной температуре. Растворитель выпаривают в вакууме. Полученное неочищенное вещество растворяют вCH2Cl2, промывают сначала 0,1 н. раствором HCl, а затем водой, сушат над сульфатом натрия, фильтруют и упаривают. Полученное твердое вещество (смесь "сульфонамид/монометилсульфонамид/диметилсульфонамид" с соотношением 0,33/1/0,33) очищают хроматографией на силикагеле (элюентCH2Cl2/MeOH, 95/5). Таким образом, получают монометилсульфонамид 12 в виде твердого вещества белого цвета с выходом 50%(С); 140,2 (С); 140,7 (С) м.д. МСВР (DCl, СН 4): вычислено: 403,0786 (М+Н+ - С 19 Н 19 N2O4S2); найдено; 403,0769 (-1,7; -4,2). Температура плавления: 162,0-162,6 С. Пример 13. В атмосфере аргона 1,1 экв. NaH (206 мг, 8,6 ммоль, масло удалено тремя промывками пентаном) прибавляют к раствору эквивалента дисульфонамида 4 (2,75 г, 7,8 ммоль) в 100 мл безводного диэтилового эфира. После перемешивания в течение 30 мин при комнатной температуре прибавляют эквивалент метилтрифлата (880 мкл, 7,8 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи и затем выпаривают растворитель. Неочищенное вещество растворяют в CH2Cl2, промывают сначала два раза 1 н. раствором HCl, а затем насыщенным раствором соли, сушат над сульфатом натрия, фильтруют и упаривают. Полученное твердое вещество (смесь "сульфонамид/монометилсульфонамид/диметилсульфонамид" с соотношением 0,4/0,2/0,4) очищают хроматографией на силикагеле (элюент CH2Cl2/MeOH, 95/5). Таким образом, выделяют сульфонамид 13 в виде порошка белого цвета с выходом 12% ЯМР 1 Н (CDCl3, 300 МГц):2,23 (м, 2 Н, СН 2); 3,13 (м, 4 Н, СН 2); 3,21 (с, 3H, СН 3); 7,08 (м, 1 Н, СН); 7,13-7,16 (м, 2 Н, СН); 7,19-7,24 (м, 3H, СН); 7,27 (м, 4 Н, СН); 7,34 (с ушир., 1 Н, NH) м.д.; 13 С (CDCl3, 75,5 МГц):18,0 (СН 2); 38,6 (СН 3); 47,1 (СН 2); 49,4 (СН 2); 120,8 (СН); 125,3 (СН); 126,7 (СН); 127,7 (СН); 129,5 (СН); 129,7 (СН); 136,6 (С); 140,9 (С) м.д. МСВР (DCl, СН 4): вычислено: 369,0943 (М+Н+ C16H21N2O4S2); найдено: 369,0957 (1,4; -3,8). Температура плавления: 93,6-94,2 С. Синтез 4. Применение сульфонамидных катализаторов для полимеризации с раскрытием цикла(ROP) лактида. Полученные катализаторы были испытаны в процессе полимеризации с раскрытием цикла (ROP)(Me2NCy), N,N,N',N'-тетраметил-1,2-циклогександиамин Me2N)2Cy). Полимеры лактида получали следующим образом: Во всех опытах по полимеризации в колбе Шленка в атмосфере аргона лактид, катализатор и основание растворяли в безводном растворителе (таком как дихлорметан, толуол или тетрагидрофуран). Затем прибавляли пентанол и реакционную смесь перемешивали при комнатной температуре. Превращение лактида в полимер контролировали регулярным отбором проб раствора, который упаривали, снова растворяли в CDCl3 и анализировали способом ЯМР 1 Н. Пример 14. В колбе Шленка в атмосфере аргона лактид (500 мг, 10 экв., 3,47 ммоль), катализатор по примеру 3(134 мг, 1 экв., 0,347 ммоль) и DMAP (42 мг, 1 экв., 0,347 ммоль) растворяют в 3,5 мл безводного дихлорметана. Затем прибавляют пентанол (38 мкл, 1 экв., 0,347 ммоль) и реакционную смесь перемешивают при 26 С. Превращение лактида в полимер контролируют регулярным отбором аликвот раствора,который упаривают, снова растворяют в CDCl3 и анализируют способом ЯМР 1 Н. При полном превращении Mn=1983, Mw=2217, Ip=1,12. Различные синтезы коротких полимеров позволили показать различия сочетаний "сульфонамид/основание", которые могут быть приемлемыми для использования, при этом экспериментальные условия во всех случаях были одинаковыми (CH2Cl2; молярное соотношение "лактид/пентанол/сульфонамид/третичный амин" 5/1/1/1). Полимеры с разной длиной цепи могут быть синтезированы контролируемым образом независимо от применяемого катализатора.-9 017727 Олигомеры (молярное соотношение "лактид/пентанол/сульфонамид/DMAP" составляет 5/1/1/1 или 10/1/1/1 в CH2Cl2) также могут быть получены быстро и контролируемым образом.M/I означает исходное молярное соотношение "мономер/инициатор", используемое при полимеризации.DPЯМР означает степень полимеризации образовавшегося полимера. Степень полимеризации определяют интегрированием соответствующих сигналов в спектрах ЯМР 1 Н. Также возможно синтезировать полимеры с более значительной длиной цепи. Используемые при этом соотношения (лактид/пентанол/сульфонамид/DMAP) составляют 50/1/10/10 или 100/1/10/10. Важно отметить воспроизводимые индексы полидисперсности полученных полимеров.L-лактидD,L-лактид Синтезированные полимеры имеют молекулярные массы, соответствующие используемому соотношению "мономер/инициатор", что показывает хорошую контролируемость полимеризации. Время реакции варьирует от 8 ч до трех суток в зависимости от применяемого катализатора и требуемой степени полимеризации (DP). Приведенные экспериментальные результаты показывают, что сульфонамидные катализаторы обеспечивают полимеризацию лактида. В то же время полученные индексы полидисперсности, близкие к 1, показывают, что данные катализаторы не способствуют перекрестной этерификации. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение сульфонамида в сочетании с основанием в качестве каталитической системы(со)полимеризации лактонов с раскрытием цикла. 2. Применение по п.1 для (со)полимеризации дилактонов. 3. Применение по п.1 для сополимеризации лактида и/или гликолида. 4. Применение по п.3 для полимеризации лактида. 5. Применение по любому из предыдущих пунктов, отличающееся тем, что основание представляет собой третичный амин. 6. Применение по любому из предыдущих пунктов, отличающееся тем, что основание представляет собой третичный амин, выбранный из диизопропилэтиламина; спартеина;N,N,N',N'-тетраметил-1,2-циклогександиамина; 4-диметиламинопиридина. 7. Применение по любому из предыдущих пунктов, отличающееся тем, что сульфонамид представляет собой моносульфонамид. 8. Применение по любому из предыдущих пунктов, отличающееся тем, что сульфонамид представ- 10017727 ляет собой моносульфонамид общей формулы (I) в форме рацемата, энантиомера или любой комбинации таких форм, где R1 и R2 независимо друг от друга представляют собой алкил, галогеналкил или арил, замещенный при необходимости алкилом, галогеналкилом, алкоксигруппой, алкоксикарбонилом, алкилкарбонилоксигруппой, галогеном, циано-, нитрогруппой, арилом, арилоксигруппой, арилоксикарбонилом, арилкарбонилоксигруппой. 9. Применение по п.8, отличающееся тем, что R1 и R2 независимо друг от друга представляют собой фенил, алкил или галогеналкил. 10. Применение по любому из предыдущих пунктов, отличающееся тем, что сульфонамид представляет собой соединение, выбранное из 11. Применение по любому из пп.1-6, отличающееся тем, что сульфонамид представляет собой бисульфонамид. 12. Применение по п.11, отличающееся тем, что сульфонамид представляет собой бисульфонамид общей формулы (IIa) или (IIb) в форме рацемата, энантиомера или любой комбинации таких форм, гдеR1 и R2 представляют собой алкил, галогеналкил или арил, замещенный при необходимости алкилом, галогеналкилом, алкоксигруппой, алкоксикарбонилом, алкилкарбонилоксигруппой, галогеном, циано-, нитрогруппой, арилом, арилоксигруппой, арилоксикарбонилом, арилкарбонилоксигруппой;R'1 и R'2 представляют собой арилен, алкилен или циклоалкилен, причем когда R'1 представляет собой циклоалкилен, R'1 при необходимости замещен фенилом;R3 и R4 независимо друг от друга представляют собой атом водорода или алкил. 13. Применение по п.12, отличающееся тем, что R3 и R4 независимо друг от друга представляют собой атом водорода или метил. 14. Применение по п.12 или 13, отличающееся тем, что R3 и R4 представляют собой атомы водорода. 15. Применение по любому из пп.12-14, отличающееся тем, что R1 и R2 представляют собой фенил,замещенный при необходимости алкилом, галогеналкилом, алкоксигруппой, алкоксикарбонилом, алкилкарбонилоксигруппой, галогеном, циано-, нитрогруппой, арилом, арилоксигруппой, арилоксикарбонилом, арилкарбонилоксигруппой; алкил или галогеналкил;R'2 означает алкилен или фенилен. 16. Применение по любому из пп.12-15, отличающееся тем, что R1 и R2 представляют собой алкил,трифторметил или фенил, при необходимости замещенный метилом или трифторметилом. 17. Применение по п.12 или 13, отличающееся тем, что сульфонамид представляет собой соединение, выбранное из 18. Применение по любому из пп.12-17, отличающееся тем, что сульфонамид представляет собой соединение, выбранное из 19. Применение по любому из предыдущих пунктов, отличающееся тем, что основание представляет собой 4-диметиламинопиридин. 20. Бисульфонамид, выбранный из соединений формул 22. Способ (со)полимеризации с раскрытием цикла, отличающийся тем, что в нем предусмотрено применение по любому из пп.1-19 сульфонамида в сочетании с основанием в качестве катализатора. 23. Способ по п.22, отличающийся тем, что сополимеризацию осуществляют с использованием растворителя при температуре от 0 до 250 С в течение интервала времени от нескольких минут до 300 ч. 24. Способ по п.23, отличающийся тем, что сополимеризацию осуществляют с использованием растворителя при температуре от комнатной до 150 С в течение интервала времени от нескольких часов до 72 ч. 25. Способ по п.23, отличающийся тем, что в качестве мономера используют лактид и/или гликолид.
МПК / Метки
МПК: C08G 63/82, C08G 63/08, C08G 63/87
Метки: новые, системы, сополимеризации, раскрытием, цикла, лактонов, каталитические
Код ссылки
<a href="https://eas.patents.su/14-17727-novye-kataliticheskie-sistemy-dlya-sopolimerizacii-laktonov-s-raskrytiem-cikla.html" rel="bookmark" title="База патентов Евразийского Союза">Новые каталитические системы для (со)полимеризации лактонов с раскрытием цикла</a>
Предыдущий патент: Индолы в качестве модуляторов никотинового рецептора ацетилхолина подтипа альфа-7
Следующий патент: Протектор шины для строительного транспортного средства
Случайный патент: Способ возбуждения нефтяной или газовой скважины и оборудование, предназначенное для использования при реализации данного способа












