Мутантный fsh и способы его применения
Формула / Реферат
1. Нуклеиновая кислота, кодирующая мутантную a-субъединицу FSH, где a-субъединица содержит последовательность SEQ ID NO:4.
2. Вектор, содержащий нуклеиновую кислоту по п.1.
3. Вектор по п.2, который представляет собой вектор экспрессии.
4. Вектор по п.2, дополнительно содержащий нуклеиновую кислоту, кодирующую b-субъединицу FSH, содержащую последовательность SEQ ID NO:3.
5. Клетка-хозяин, содержащая вектор по п.2.
6. Клетка-хозяин по п.5, которая представляет собой клетку млекопитающих.
7. Мутантный FSH, в котором b-субъединица содержит последовательность SEQ ID NO:3 и a-субъединица кодируется нуклеиновой кислотой по п.1 и содержит последовательность SEQ ID NO:4.
8. Мутантный FSH по п.1, в котором любой из 1-6 аспарагиновых остатков гликозилирован.
9. Мутантный FSH по п.7, в котором a-субъединица содержит последовательность SEQ ID NO:4 и в котором N3 гликозилирован.
10. Способ получения мутантного FSH, включающий:
(a) получение клетки, содержащей нуклеиновую кислоту по п.1 и нуклеиновую кислоту, кодирующую b-субъединицу FSH, содержащую SEQ ID NO:3;
(b) культивирование клетки в условиях, обеспечивающих экспрессию первой и второй нуклеиновых кислот;
(c) получение мутантного FSH.
11. Способ по п.1, где клетка способна к гликозилированию белка.
12. Способ по п.11, где клетка содержит один вектор, включающий нуклеиновую кислоту по п.1 и нуклеиновую кислоту, кодирующую b-субъединицу FSH, включающую SEQ ID NO:3.
13. Способ по п.11, где клетка содержит вектор, включающий нуклеиновую кислоту по п.1, и дополнительно содержит второй вектор, включающий нуклеиновую кислоту, которая кодирует b-субъединицу FSH, включающую SEQ ID NO:3.
14. Фармацевтическая композиция, содержащая мутантный FSH по п.1 и при необходимости фармацевтически приемлемый носитель или эксципиент.
15. Способ лечения бесплодия у млекопитающего, включающий введение млекопитающему, нуждающемуся в указанном лечении, фармацевтической композиции по п.14.
16. Способ стимуляции фолликулогенеза у млекопитающего, включающий введение млекопитающему, нуждающемуся в указанной стимуляции, фармацевтической композиции по п.14.
17. Способ индукции гиперстимуляции яичника у млекопитающего, включающий введение млекопитающему, нуждающемуся в указанной индукции, фармацевтической композиции по п.14.
Текст
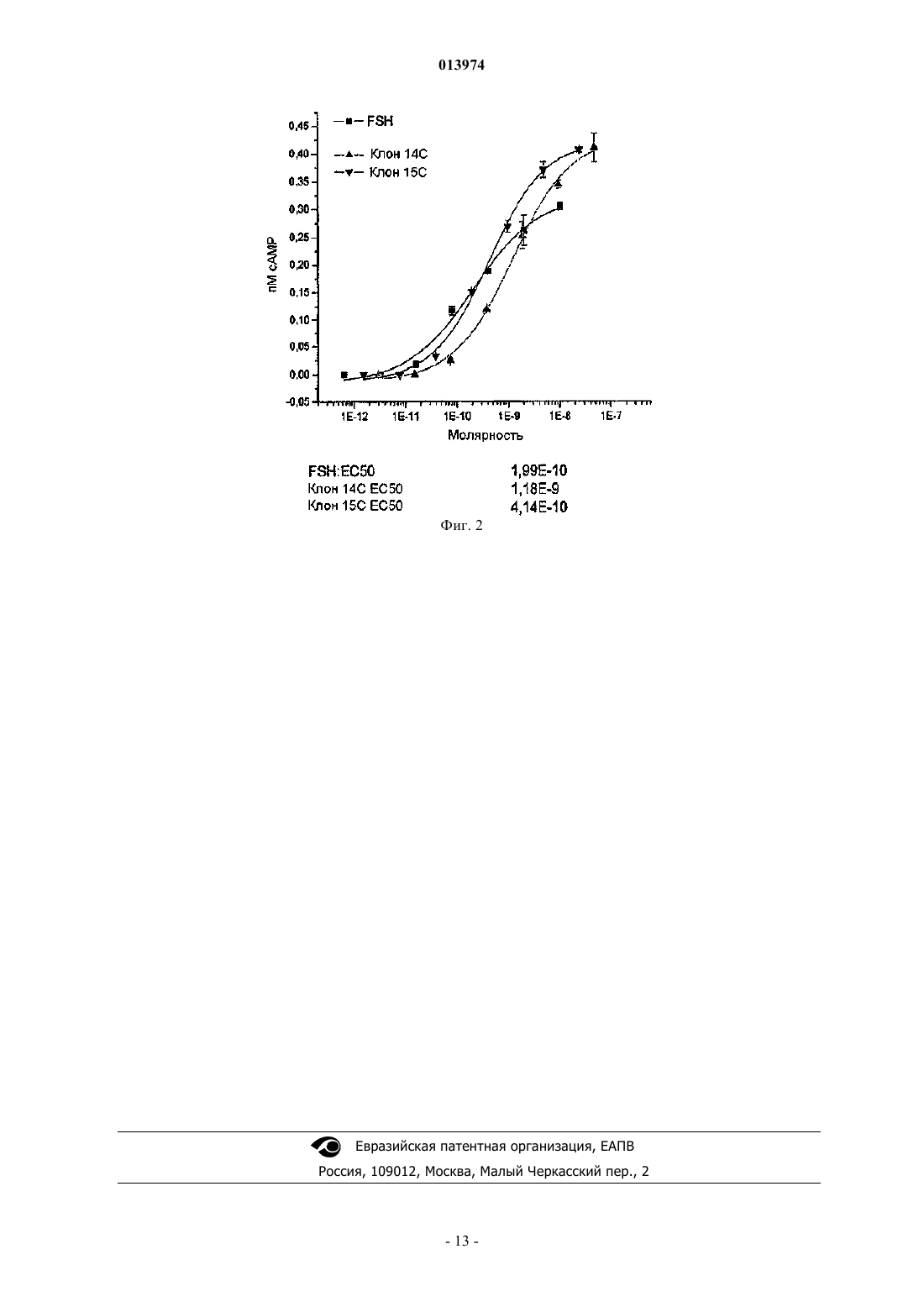
Настоящее изобретение относится к мутантному FSH, в котором -субъединица содержит последовательность SEQ ID NO:3, а -субъединица содержит последовательность SEQ ID NO:4. Кроме того, настоящее изобретение относится к мутантному FSH, описанному выше, в котором любой из шести аспарагиновых остатков гликозилирован. Также заявлены способ получения мутантного FSH, нуклеиновая кислота, кодирующая -субъединицу мутаного FSH, соответствующий вектор и клетка-хозяин. Настоящее изобретение также относится к фармацевтической композиции, содержащей мутантный FSH, а также к способу лечения бесплодия у млекопитающего,к способу стимуляции фолликулогенеза у млекопитающего и к способу индукции гиперстимуляции яичника у млекопитающего, в которых млекопитающему вводят фармацевтическую композицию, содержащую указанный мутантный FSH. 013974 Область техники, к которой относится изобретение Настоящее изобретение относится к репродукции человека. Более конкретно, настоящее изобретение относится к вариантам терапевтического оплодотворения. Описание связанной областиa. Гонадотропины. Фолликулостимулирующий гормон (FSH) является членом семейства гонадотропинов, играющих ключевые роли в оплодотворении человека. Гонадотропины, которые также включают лютеинизирующий гормон (LH) и хорионический гонадотропин (CG), представляют собой гетеродимеры, которые состоят из общей -субъединицы (92 аминокислоты) и уникальной -субъединицы (111 аминокислот вFSH). Аминокислотные последовательности зрелых форм - и -субъединиц FSH представлены в SEQFSH человека был выделен из гипофиза и из мочи, относящейся к периоду после менопаузы (ЕР 322438), и был рекомбинантно получен в клетках млекопитающих (патенты США 5639640, 5156957,4923805, 4840896, 5767251, ЕР 211894 и ЕР 521586). В последних ссылках также описан ген субъединицы FSH человека. В патенте США 5405945 описан модифицированный ген -субъединицы человека, содержащий только один интрон.Liu et al., J. Biol. Chem. 1993, 15; 268(2): 21613-7, Grossmann et al., Mol. Endocrinol. 1996, 10(6): 76979, Roth and Dias (Mol. Cell Endocrinol. 1995, 1; 109(2): 143-9, Valove et al., Endocrinology 1994; 135(6): 2657-61, Yoo et al., J. Biol. Chem. 1993, 25; 268(18): 13034-42), в патенте США 5508261 и Chappel et al.,1998, Human Reproduction, 13(3): 1835 описаны различные исследования взаимосвязи структура-функция и установлены аминокислотные остатки, вовлеченные в связывание рецептора и активацию, а также в димеризацию FSH.b. Использование гонадотропинов во вспомогательных репродуктивных способах. Гонадотропины играют ключевую роль в репродуктивном цикле, и их использование в экзогенных вариантах лечения является необходимым для вспомогательных репродуктивных способов (ART), таких как оплодотворение in vitro (IVF), IVF в сочетании с интрацитоплазматической инъекцией сперматозоидов (IVF/ICSI) и перенос эмбрионов (ЕТ) , а также для индукции овуляции (OI) у пациентов с отсутствием овуляции, подвергающихся оплодотворению in vivo природным образом или посредством внутриматочного осеменения (IUI). В патентах США 4589402 и 4845077 описан очищенный FSH человека, не содержащий LH, а также его использование для оплодотворения in vitro. В ЕР 322438 описан белок, обладающий активностьюFSH по меньшей мере 6200 Ед./мг, который практически не имеет активности LH, и где -субъединица и-субъединица FSH, соответственно, могут представлять собой дикий тип или его конкретные усеченные формы. Для получения терапевтического эффекта необходимо продолжительное лечение, как правило, в течение 8-10 последовательных дней, а в некоторых случаях вплоть до 21 дня для стимуляции фолликулогенеза у женщин и вплоть до 18 месяцев для индукции сперматогенеза у мужчин с гипогонадотропным синдромом. Как правило, рекомбинантный hFSH вводят в виде внутримышечной или подкожной инъекции ежедневно, и последствиями такого введения являются неприятные ощущения и возможная местная реакция на участке инъекции. Снижение частоты введения способствует лечению и делает введение гонадотропина более удобным, более переносимым и безвредным для пациента. с. Гликозилирование FSH. Гонадотропины представляют собой гликопротеины, в которых каждая субъединица содержит связанные посредством аспарагина (N-связанные) олигосахаридные боковые цепи, которые важны для активности и функционирования in vivo. Добавление углевода (гликозилирование) к полипептидам представляет собой посттрансляционное событие, приводящее к добавлению цепей сахаров к специфическим аминокислотам, аспарагину (N-связанный) или серину/треонину (О-связанный). В отличие от постоянной аминокислотной последовательности белкового участка гликопротеинов углеводные структуры являются изменчивыми - свойство, называемое микрогетерогенностью. Например, участки Nгликозилирования на одном и том же белке могут содержать различные углеводные структуры. Кроме того, даже в одном и том же участке гликозилирования на конкретном гликопротеине можно выявлять различные углеводные структуры. Эта гетерогенность является следствием нематричного синтеза углеводов.N-гликозилирование белков специфлчно происходит в консенсусной структуре Asn-Xaa-Ser/Thr и, в меньшей степени, в консенсусной структуре Asn-Xaa-Cys, в которой Хаа может представлять собой любой аминокислотный остаток. Однако присутствие консенсусного трипептида недостаточно для обеспечения гликозилирования аспарагинового остатка. Например, N-гликозилирование последовательностиAsn-Pro-Ser/Thr происходит со скоростью, в 50 раз ниже, чем для других консенсусных структур AsnXaa-Ser/Thr.FSH человека содержит четыре N-связанных участка гликозилирования: два на общей субъединице в положениях 52 и 78 и два на -субъединице в положениях 7 и 24. Углеводы, присоеди-1 013974 ненные к -субъединице FSH, необходимы для сборки димера, целостности, секреции и передачи сигналов, тогда как -субъединица углеводов важна для сборки димера, секреции и выведения гетеродимера из кровотока.Galway et al., Endocrinology 1990; 127(1): 93-100 показано, что варианты FSH, продуцируемые в клеточной линии N-ацетилглюкозаминтрансферазы-I СНО или клеточной линии СНО, дефектной по транспорту сиаловой кислоты, являются такими же активными in vitro, как и FSH, секретируемый клетками дикого типа, или очищенный FSH гипофиза, но не обладают активностью in vivo, предположительно, вследствие быстрого выведения ненадлежащим образом гликозилированных вариантов в сыворотке. В D'Antomo et al., Human Reprod. 1999; L4(5): 1160-7 описаны различные изоформы FSH, циркулирующие в кровотоке. Изоформы содержат одинаковые аминокислотные последовательности, но отличаются по степени своей посттрансляционной модификации. Было обнаружено, что для менее кислой группы изоформ было характерно более быстрое выведение in vivo в сравнении с кислой группой изоформ, возможно, вследствие различий между изоформами в содержании сиаловой кислоты. Кроме того, Bishop etal. Endocrinology 1995; 136(6): 2635-40 сделан вывод, что время полужизни в кровотоке, вероятно, является основным определяющим фактором активности in vivo. Эти наблюдения привели к гипотезе, что время полужизни FSH можно увеличить введением дополнительных участков гликозилирования для повышения содержания сиаловой кислоты в полипептиде.d. Варианты FSH. Агонисты FSH с повышенным временем полужизни были получены слиянием карбоксиконцевого пептида из hCG (CTP) с природным рекомбинантным FSH человека (rhFSH). Молекула СТР состоит из аминокислот от 112-118 до 145 с четырьмя О-связанными участками гликозилирования в положениях 121, 127, 132 и 138. В патентах США 5338835 и 5585345 описана модифицированная -субъединицаFSH, удлиненная у С-концевого Glu с использованием фрагмента СТР из hCG. Указано, что получаемый модифицированный аналог обладает биологической активностью природного FSH, но, тем не менее,продолжительным временем полужизни в кровотоке. В патенте США 5405945 описано, что карбоксиконцевой участок -субъединицы hCG или его вариант оказывает значительные эффекты на выведениеCG, FSH и LH. В патенте США 5883073 описаны состоящие из двух -субъединиц одноцепочечные белки, обладающие активностью агониста или антагониста в отношении CG, TSH, LH и FSH. В патенте США 5508261 описаны гетероцимерные полипептиды с аффинностью связывания в отношении рецепторов LH и FSH, содержащие -субъединицу гликопротеинового гормона и искусственную -субъединицу полипептида, где -субъединица полипептида представляет собой аминокислотную цепь, содержащую четыре соединенные подпоследовательности, каждую из которых выбирают из списка специфических последовательностей. Klein et al. (2003) описывает одноцепочечный аналог FSH с увеличенным временем полужизни, где - и -субъединицы связаны олигопептидом, содержащим два N-связанных участка гликозилирования. В WO 01/58493 описаны 77 мутаций, которые можно осуществлять в -субъединице FSH, и 51 мутация, которые можно осуществлять в -субъединице FSH, для попытки повысить время полужизни FSHin vivo. Кроме того, в WO 01/58493 описано, что к N-концевому участку FSH для увеличения его времени полужизни можно добавлять один или несколько участков гликозилирования или вставлять в различные участки в полипептиде FSH. Хотя в WO 01/58493 описано, что в полипептид FSH мсжно вставлять участки гликозилирования, там не представлено указаний относительно конкретного участка(ов), в который можно вставлять участок гликозилирования и сохранять активность FSH. Кроме того, в WO 01/58493 описано, что мутантные - и -субъединицы можно использовать по отдельности (1 дополнительный участок гликозилирования) или в сочетании (2 дополнительных участка гликозилирования). Были выявлены 128 мутантов-кандидатов с использованием 50 моделей 3D-структуры FSH, которые получали исключительно на основе структуры hCG и выравнивания последовательностей FSH и hCG несмотря на всего лишь 32% совпадение между -субъединицами hCG и FSH. В WO 01/58493 не описано получение или тестирование каких-либо - или -субъединиц FSH, где участок гликозилирования был введен сайт-направленным мутагенезом. В WO 05/020934 описан GM1, содержащий мутации и в -, и в -субъединицах FSH, включая двойную мутацию вE55N/V57T, т.е. остаток Е в аминокислотном положении 55 был изменен мутацией в N,а остаток V в аминокислотном положении 57 был изменен мутацией в Т. Последовательность аминокислотE55N/V57T представлена в SEQ ID NO:3. Существует клиническая необходимость в продукте, который обеспечивает часть или все терапевтически значимые эффекты FSH и который можно вводить с менее частыми интервалами в сравнении с доступными в настоящее время продуктами FSH, и который, предпочтительно, обеспечивает более стабильный уровень активности циркулирующего FSH в сравнении с активностью, доступной при существующем в настоящее время лечении. Настоящее изобретение относится к таким продуктам, а также к способам получения таких продуктов.-2 013974 Сущность изобретения Настоящее изобретение относится к мутантным молекулам FSH, в которых -субъединица FSH содержит SEQ ID NO:4 и в которых -субъединица FSH содержит SEQ ID NO:3. FSH может быть Nгликозилирован по 0, 1, 2, 3, 4, 5 или 6 остаткам аспарагина указанного мутанта FSH. В одном из вариантов осуществления N3 может быть гликозилирован в мутантной -субъединице из SEQ ID NO:4. Также настоящее изобретение относится к выделенным молекулам ДНК, кодирующим мутантную-субъединицу FSH, которая содержит последовательность SEQ ID NO:4. Кроме того, настоящее изобретение относится к выделенной ДНК, кодирующей -субъединицу FSH, которая содержит последовательность SEQ ID NO:3. Также настоящее изобретение относится к вектору, содержащему ДНК, которая кодирует мутантную -субъединицу FSH, содержащую последовательность SEQ ID NO:4. Вектор может представлять собой вектор экспрессии. Кроме того, настоящее изобретение относится к вектору, содержащему ДНК, которая кодирует мутантную -субъединицу FSH, содержащую последовательность SEQ ID NO:3. Вектор может представлять собой вектор экспрессии. Также настоящее изобретение относится к вектору, содержащему первую ДНК и вторую ДНК, где первая ДНК кодирует мутантную -субъединицу FSH, содержащую последовательность SEQ ID NO:4, а вторая ДНК кодирует мутантную -субъединицу FSH, содержащую последовательность SEQ ID NO:3. Вектор может представлять собой вектор экспрессии. Кроме того, настоящее изобретение относится к клетке, содержащей вектор, который содержит ДНК, кодирующую мутантную -субъединицу FSH, включающую последовательность SEQ ID NO:4. Вектор может представлять собой вектор экспрессии. Клетка может представлять собой клетку млекопитающих, например клетку СНО. Также настоящее изобретение относится к клетке, содержащей вектор, который содержит ДНК, кодирующую мутантную -субъединицу FSH, включающую последовательность SEQ ID NO:3. Вектор может представлять собой вектор экспрессии. Клетка может представлять собой клетку млекопитающих,например клетку СНО. Кроме того, настоящее изобретение относится к клетке, содержащей вектор, который содержит первую ДНК и вторую ДНК, где первая ДНК кодирует мутантную -субъединицу FSH, содержащую последовательность SEQ ID NO:4, а вторая ДНК кодирует мутантную -субъединицу FSH, содержащую последовательность SEQ ID NO:3. Вектор может представлять собой вектор экспрессии. Клетка может представлять собой клетку млекопитающих, например клетку СНО. Также настоящее изобретение относится к клетке, содержащей первый и второй векторы, где первый вектор содержит ДНК, кодирующую мутантную -субъединицу FSH, которая состоит из SEQ IDNO:4, а второй вектор содержит ДНК, кодирующую мутантную -субъединицу FSH, которая включаетSEQ ID NO:3. Вектор(ы) может представлять собой вектор экспрессии. Клетка может представлять собой клетку млекопитающих, например клетку СНО. Кроме того, настоящее изобретение относится к способу получения мутантного FSH, который включает культивирование клеток млекопитающих, способных к гликозилированию белков, где указанные клетки содержат первый вектор экспрессии, включающий ДНК, которая кодирует мутантную субъединицу FSH, содержащую последовательность SEQ ID NO:4, и второй вектор экспрессии, включающий ДНК, которая кодирует мутантную -субъединицу FSH, содержащую последовательность SEQID NO:3. В другом варианте осуществления настоящего изобретения указанные клетки содержат один вектор, включающий ДНК, которая кодирует мутантную -субъединицу FSH, содержащую последовательность SEQ ID NO:4, и дополнительно включающий ДНК, которая кодирует мутантную субъединицу FSH, содержащую последовательность SEQ ID NO:3. Также настоящее изобретение относится к композиции, содержащей мутантный FSH и фармацевтически приемлемый носитель или эксципиент, где -субъединица FSH содержит последовательностьSEQ ID NO:4, а -субъединица FSH содержит SEQ ID NO:3. Кроме того, настоящее изобретение относится к способу лечения бесплодного млекопитающего,включающему введение млекопитающему при необходимости этого эффективного количества мутантного FSH, где -субъединица FSH содержит последовательность SEQ ID NO:4, а -субъединица FSH содержит SEQ ID NO:3. Также настоящее изобретение относится к способу стимуляции фолликулогенеза у млекопитающего, включающему введение млекопитающему при необходимости этого эффективного количества мутантного FSH, где -субъединица FSH содержит последовательность SEQ ID NO:4, а -субъединица FSH содержит SEQ ID NO:3. Кроме того, настоящее изобретение относится к способу индукции гиперстимуляции яичника у млекопитающего, включающему введение млекопитающему при необходимости этого эффективного количества мутантного FSH, где -субъединица FSH содержит последовательность SEQ ID NO:4, а -3 013974 субъединица FSH содержит SEQ ID NO:3. Краткое описание графического материала На фиг. 1 представлено выравнивание мутантных -субъединиц D3N (SEQ ID NO:4) с субъединицей FSH человека (SEQ ID NO:1). Номера остатков относятся к -субъединице FSH человека(SEQ ID NO:1), где 1 представляет собой первую аминокислоту зрелого полипептида. На фиг. 2 представлена кривая доза-эффект для мутантного FSH, содержащего мутантную субъединицу D3N и -субъединицу GM-1, которая включает SEQ ID NO:3, в сравнении с кривой дозаэффект для FSH дикого типа. На кривой доза-эффект указана активность FSH при различных разведениях мутантного FSH и FSH дикого типа. Клон 15 С относится к мутанту D3N. Клон 14 С представляет собой неродственный мутантный FSH. Подробное описание изобретения Хотя было показано, что повышение содержания углеводов в FSH может приводить к увеличению времени полужизни in vivo, увеличение времени полужизни FSH является более сложным, чем просто добавление дополнительных участков гликозилирования. Хотя консенсусная последовательность гликозилирования необходима для добавления углеводов, она недостаточна для обеспечения использования участка для добавления углеводов. Присоединится ли олигосахарид к конкретному участку консенсусной последовательности, определяют другие факторы, такие как местная укладка и конформация белка в ходе биосинтеза. Кроме того, для того чтобы дополнительное гликозилирование приводило к увеличению времени полужизни in vivo, консенсусная последовательность должна занимать такое положение,чтобы гликозилирование участка не препятствовало связыванию рецептора или не нарушало укладку,конформацию или стабильность гликопротеина. До настоящего времени аналоги FSH с увеличенным временем полужизни были, в основном, ограничены слитыми белками, где слитый участок полипептида содержал дополнительные участки гликозилирования. 1. Мутантный FSH. Предоставлен мутантный FSH, который был модифицирован для получения дополнительных участков распознавания для гликозилирования. В сравнении с -субъединицей дикого типа -субъединица мутантного FSH может содержать одну из следующих мутаций: D3N и Q5T. Мутантный FSH может содержать указанную выше мутантную -субъединицу в сочетании с мутантной -субъединицей, например,GM1, включающей следующую мутацию: E55N/V57T. В рекомбинантном FSH могут быть гликозилированы один или несколько дополнительных участков гликозилирования. Один или несколько дополнительных участков гликозилирования в мутантном FSH могут быть гликозилированы in vitro или invivo. Мутантный FSH можно получать любым приемлемым способом, известным в данной области. Эти способы включают конструирование нуклеотидных последовательностей, кодирующих соответствующие мутантные FSH и экспрессирующих последовательность аминокислот в приемлемом трансфицированном организме-хозяине. Также мутантный FSH можно получать химическим синтезом или сочетанием химического синтеза и способов рекомбинантной ДНК. Мутантный FSH может содержать - и -субъединицы FSH в виде двух отдельных полипептидных цепей, где две цепи димеризуются in vivo так, чтобы сформировать димерный полипептид, или он может содержать одноцепочечный конструкт, включающий две субъединицы, которые ковалентно связаны пептидной связью или пептидным линкером. Аминокислотные остатки линкерного пептида могут обладать свойствами, практически не препятствующими активности мутантного FSH. Мутантный FSH может иметь повышенное время полужизни в сравнении с FSH дикого типа. Также мутантный FSH может иметь повышенную стабильность в сравнении с FSH дикого типа. МутантныйFSH может содержать олигосахариды в 0, 1, 2, 3, 4, 5 или 6 из N-связанных участков гликозилирования. Также предоставлена совокупность мутантных FSH, которая может содержать одну или несколько мутантных: иаоформ FSH, где каждая изоформа содержит олигосахариды в 0, 1, 2, 3, 4, 5 или 6 из Nсвязанных участков гликозилирования. Нуклеотидную последовательность, кодирующую - или -субъединицы мутантного FSH, можно конструировать выделением или синтезом нуклеотидной последовательности, которая кодирует субъединицу исходного FSH, например, hFSH-альфа или hFSH-бета с аминокислотными последовательностями, представленными в SEQ ID NOS: 1 и 2 соответственно. Затем нуклеотидную последовательность можно изменять таким образом, чтобы осуществить замену или вставку соответствующих аминокислотных остатков. Нуклеотидную последовательность можно модифицировать сайт-направленным мутагенезом. Альтернативно, нуклеотидную последовательность можно получать химическим синтезом, где олигонуклеотиды конструируют на основе специфической аминокислотной последовательности мутантногоFSH. Кодирующую полипептид нуклеотиднуо последовательность можно вставлять в рекомбинантный вектор и функционально связывать с контролирующей последовательностью, необходимой для экспрессии полипептида в желаемой трансфицированной клетке-хозяине. Контролирующие последовательности могут представлять собой любой компонент, необходимый или благоприятный для экспрессии полипеп-4 013974 тида. Примеры приемлемых контролирующих последовательностей для управления транскрипцией в клетках млекопитающих включают ранние и поздние промоторы из SV40 и аденовируса, например, основной поздний промотор аденовируса 2, промотор МТ-1 (гена металлотионеина) и промотор немедленно-ранних генов цитомегаловируса человека (CMV). Специалист в данной области может проводить отбор этих векторов, контролирующих экспрессию последовательностей и организмов-хозяев без чрезмерных экспериментов. Рекомбинантный вектор может представлять собой автономно реплицирующийся вектор, т.е. вектор, существующий в виде внехромосомной структуры, репликация которого не зависит от репликации хромосомы, например, плазмида. Альтернативно, вектор может представлять собой вектор, который при введении в клетку-хозяина встраивается в геном клетки-хозяина и реплицируется вместе с хромосомой(ами), в которую он был встроен. Вектор может представлять собой вектор экспрессии, в котором нуклеотидная последовательность,кодирующая полипептид согласно изобретению, функционально связана с дополнительными участками,необходимыми для транскрипции нуклеотидной последовательности. Вектор можно получать из плазмидной или вирусной ДНК. Множество приемлемых векторов экспрессии для экспрессии в клеткаххозяевах, указанных в настоящей заявке, являются коммерчески доступными или описаны в литературе. Рекомбинантный вектор может дополнительно содержать последовательность ДНК, обеспечивающую репликацию вектора в рассматриваемой клетке-хозяине. Примером такой последовательности (если клетка-хозяин представляет собой клетку млекопитающего) является участок инициации репликацииSV40. Также вектор может содержать селектируемый маркер, например ген, чей продукт восполняет дефект в клетке-хозяине, например ген, кодирующий дигидрофолатредуктазу (DHFR), или ген придающий устойчивость к лекарственному средству, например ампициллину, канамицину, тетрациклину, хлорамфениколу, неомицину, гигромицину или метотрексату. Также вектор может содержать амплифицируемый ген, например DHFR, так чтобы клетки, содержащие многочисленные копии амплифицируемого гена и фланкирующих последовательностей, включая ДНК мутантного FSH, могли быть отобраны в соответствующих средах. Также представлена ДНК, кодирующая -субъединицу мутантного FSH. Нуклеотидная последовательность, кодирующая - и -субъединицы мутантного FSH, вне зависимости от того, получена ли она сайт-направленным мутагенезом, синтезом, PCR или другими способами, может также, необязательно,содержать нуклеотидную последовательность, кодирующую сигнальный пептид. Сигнальный пептид может присутствовать, если полипептид подлежит секреции из клеток, в которых он экспрессируется. Такой сигнальный пептид, в случае наличия, может представлять собой пептид, распознаваемый клеткой, выбранной для экспрессии полипептида. Сигнальный пептид может быть гомологичным (например,пептид, обычно связанный с субъединицей hFSH) или гетерологичным (т.е. происходить из источника,отличного от hFSH) в отношении полипептида или может быть гомологичным или гетерологичным в отношении клетки-хозяина, т.е. представлять собой сигнальный пептид, обычно экспрессируемый из клетки-хозяина, или пептид, который обычно не экспрессируется из клетки-хозяина. Для получения полипептидов можно использовать любой приемлемый организм-хозяин, в том числе бактерии, грибы (включая дрожжи), растения, насекомых, млекопитающих или другие соответствующие клетки или клеточные линии животных, а также трансгенных животных или растения. Примеры приемлемых клеток-хозяев млекопитающих включают линии клеток яичника китайского хомяка (СНО)(например, CHO-KL; ATCC CCL-61), линии клеток зеленой мартышки (COS) (например, COS 1 (ATCCCRL-1650), COS 7 (ATCC CRL-1651; клетки мыши (например, NSIO), линии клеток почки новорожденного хомяка (BI-EK) (например, ATCC CRL-1632 или ATCC CCL-10) и клетки человека (например,ВЕК 293 (АТСС CRL-1573, а также клетки растений в культуре тканей. Дополнительные приемлемые линии клеток известны в данной области и доступны в открытых депозитарных хранилищах, таких как Американская коллекция типовых культур, США. Способы введения экзогенной ДНК в клетки-хозяева млекопитающих включают трансфекцию, опосредуемую фосфатом кальция, электропорацию, трансфекцию, опосредуемую DEAE-декстоаном, опосредуемую липосомами трансфекцию и вирусные векторы. Клетки можно культивировать в приемлемой для получения полипептида питательной среде с использованием способов, которые известны в данной области. Например, клетку можно культивировать с использованием культивации во встряхиваемом флаконе, мелкомасштабной или крупномасштабной ферментации (включая непрерывную, порционную, с подпиткой или твердофазную ферментации) в лабораторных или промышленных ферментерах, осуществляемой в приемлемой среде и в условиях, которые обеспечивают экспрессию и/или выделение полипептида. Культивирование проводят в приемлемой питательной среде, содержащей источники углерода и азота и неорганические соли, с использованием известных в данной области способов. Приемлемые среды доступны у коммерческих поставщиков, или их можно получать в соответствии с опубликованными составами (например, в каталогах Американской коллекции типовых культур). Если полипептид секретируется в питательную среду, его можно выделять непосредственно из среды. Если полипептид не секретируется, его можно выделять из лизатов клеток. Один способ высокопродуктивного получения мутантных FSH согласно изобретению состоит в исполь-5 013974 зовании амплификации дигидрофолатредуктазы (DHFR) в дефектных по DHFR клетках СНО, применяя последовательно возрастающие уровни метотрексата, как описано в патенте США 4889803. Получаемый мутантный полипептид FSH можно выделять известными в данной области способами. Например, его можно выделять из питательной среды общепринятыми способами, включающими в себя, но ими не ограничивающимися, центрифугирование, фильтрацию, экстракцию, сушку распылением, выпаривание или осаждение. Мутантные полипептиды FSH можно очищать множеством известных в данной области способов, которые включают в себя, но ими не ограничиваются, хроматографию (например, ионообменную, аффинную, гидрофобную, хроматофокусирующую и гель-фильтрацию), способы электрофореза (например, изоэлектрическое фокусирование), дифференциальную растворимость (например, осаждение сульфатом аммония), SDS-PAGE или экстракцию. Также представлена фармацевтическая композиция, содержащая мутантный FSH. Такую фармацевтическую композицию можно использовать для стимуляции фолликулогенеза, например, в сочетании с индукцией овуляции или вспомогательными репродуктивными способами (ART). Поскольку мутантныйFSH согласно настоящему изобретению может быть эффективен в индукции развития и созревания множества фолликулов, то он может быть особенно эффективен для использования в ART, при которых желательно получать множество ооцитов. Мутантный FSH можно использовать для индукции монофолликулогенеза для OI или фолликулогенеза в малом количестве (приблизительно вплоть до трех фолликулов) для IUI в случае оплодотворения in vivo. Также монофолликулогенез можно осуществлять с использованием сниженной дозы мутантного FSH или менее частого введения доз в сравнении с общепринятыми препаратами FSH. Например, в случае OI препарат FSH согласно изобретению можно вводить каждые трое суток при 225-400 ME или в более низких дозах в зависимости от реакции пациента. Реакцию пациента можно наблюдать посредством сонографии. Мутантный FSH согласно изобретению можно использовать в схеме контролируемой гиперстимуляции яичника (СОН). Общепринятые схемы для СОН включают стадию подавляющего эффекта, на которой эндогенный лютеинизирующий гормон (LH) подавляют введением агониста высвобождающего гонадотропин гормона (GnRH), с последующей стадией стимуляции, на которой развитие фолликулов(фолликулогенез) индуцируется ежесуточным введением фолликулостимулирующего гормона (FSH), как правило, приблизительно при 150-225 МЕ/сутки. Альтернативно, стимуляцию можно начинать с использованием FSH после самопроизвольной или индуцированной менструации с последующим введением антагониста GnRH (как правило, начиная приблизительно на шестые сутки стадии стимуляции). Когда присутствуют по меньшей мере 3 фолликула 16 мм (один составляет 18 мм), можно вводить разовую ударную дозу hCG (5-10000 ME) для воспроизведения природного выброса LH и индукции овуляции. Время выделения ооцитов можно устанавливать на 36-38 ч после инъекции hCG. Также мутантный FSH можно использовать для OI и IUI. Например, стимуляцию FSH можно начинать после самопроизвольной или индуцированной менструации при суточной дозе 75-150 ME. Когда 1 или 3 фолликула достигнут в диаметре по меньшей мере 16 мм, можно вводить разовую ударную дозуhCG для индукции овуляции. Осеменение можно осуществлять in vivo посредством регулярных половых сношений или IUI. Поскольку мутантный FSH может иметь повышенное время полужизни относительно препаратовFSH дикого типа, в схемах введения, таких как описанные выше, можно использовать дозы FSH при более низкой величине ME, и/или схемы можно модифицировать посредством уменьшения периода стимуляции FSH при достижении такой же или более хорошей реакции в отношении количества и жизнеспособности фолликулов. Например, надлежащего фолликулогенеза можно достигать с использованием суточных доз, равных или приблизительно составляющих 50-150, 50-100 или 50-75 ME FSH. Введение FSH можно осуществлять на суточной основе или два раза в сутки. Период введения доз может составлять менее чем или приблизительно 14, 12, 11 или 10 суток. При 01 препарат мутантного FSH можно вводить в дозах от 25-150 или 50-125 ME FSH/сутки. Для лечения мужского бесплодия препарат мутантного FSH можно вводить в дозе от 3150 до 300 МЕ/неделя до достижения уровня сперматогенеза, достаточного для оплодотворения посредством регулярных половых сношений или способов ART. Вследствие более продолжительного времени полужизни мутантного FSH его можно вводить как препарат длительного действия, который можно вводить реже, чем каждые двое суток. ОбщепринятыйFSH можно вводить каждые вторые сутки в концентрации, равной или составляющей приблизительно 300 ME, при этом достигая результатов, сходных с введением каждые сутки в концентрации, равной или составляющей приблизительно 150 ME. Мутантный FSH можно вводить каждые 3, 4, 5, 6 или 7 суток,достигая при этом результатов, сходных или более хороших, чем при ежесуточном введении общепринятого FSH. Мутантный FSH можно использовать для получения лекарственного средства для лечения заболеваний, нарушений или патологических состояний. В другом аспекте полипептид или фармацевтическую композицию согласно изобретению используют в способе лечения млекопитающего, предпочтительно человека, где способ включает введение такого полипептида или фармацевтической композиции млекопитающему при необходимости этого.-6 013974 Для специалистов в данной области очевидно, что эффективное количество полипептида, препарата или композиции зависит, наряду с прочим, от заболевания, дозы, схемы введения, вводят ли полипептид или препарат, или композицию по отдельности или в сочетании с другими терапевтическими средствами, времени полужизни композиций в сыворотке и общего состояния здоровья пациента. Как правило,эффективная доза препарата или композиции достаточна для обеспечения терапевтического эффекта. Мутантный FSH можно вводить в композиции, содержащей один или несколько фармацевтически приемлемых носителей или эксципиентов. "Фармацевтически приемлемый" обозначает носитель или эксципиент, не вызывающий каких-либо неблагоприятных эффектов у пациентов, которым его вводят. Такие фармацевтически приемлемые носители и эксципиенты хорошо известны в данной области, а полипептиды можно составлять в виде фармацевтических композиций хорошо известными способами (см.,например, Remington's Pharmaceutical Sciences, 18th edition, A. R. Gennaro, Ed., Mack Publishing CompanyPress (2000. Например, фармацевтически приемлемые эксципиенты, которые можно использовать в содержащих полипептид композициях, включают буферные средства, стабилизаторы, консерванты, изотонические вещества, неионные поверхностно-активные вещества или детергенты "увлажнители", антиоксиданты, заполняющие вещества или наполнители, хелатообразующие средства и сорастворители. Фармацевтическую композицию, содержащую мутантный FSH, можно составлять в виде множества форм, включая жидкости, например, готовые к использованию растворы или суспензии, гели, лиофилизированные формы или любую другую приемлемую форму, например, порошок или кристаллическое вещество, приемлемое для получения раствора. Форма композиции может зависеть от конкретного показания, в соответствии с которым проводят лечение, и является очевидной специалисту в данной области. Фармацевтическую композицию, содержащую мутантный FSH, можно вводить внутривенно, внутримышечно, внутрибрюшинно, внутрикожно, подкожно, подъязычно, буккально, интраназально, трансдермально, ингаляцией или любым другим приемлемым способом, например, с использованием способаPowderJect или ProLease или системы для инъекций карандашного типа. Способ введения может зависеть от конкретного показания, в соответствии с которым проводят лечение, и является очевидным специалисту в данной области. Композицию можно вводить подкожно, что позволяет пациенту осуществлять введение самостоятельно. Фармацевтические композиции можно вводить в сочетании с другими терапевтическими средствами. Эти средства можно включать как часть той же самой фармацевтической композиции, или их можно вводить отдельно от полипептидов, одновременно или в соответствии с любой другой приемлемой схемой лечения. Кроме того, полипептид, препарат или фармацевтическую композицию можно использовать в качестве вспомогательного средства для других вариантов лечения. Настоящее изобретение содержит многочисленные аспекты, иллюстрируемые следующими неограничивающими примерами. Пример 1. Мутантные FSH. 3D-кристаллическую структуру FSH человека использовали для выявления возможных участков гликозилирования в -субъединице FSH или областей в молекуле FSH, в который можно вставить возможный участок гликозилирования. В каждом асимметричном звене кристаллической структуры присутствуют две молекулы FSH (четыре субъединицы). Две молекулы FSH накладывали друг на друга и сравнивали, визуально контролируя каждый остаток для выявления возможных участков Nгликозилирования. Кристаллографическую структуру FSH сочетали с информацией по взаимодействиюFSH/FSHR рецептор для дополнительного способствования отбору возможных участков Nгликозилирования. Критерии основной схемы состояли в минимальном нарушении 3D-структуры, минимальном нарушении спрогнозированных участков связывания и активации и в прогнозируемой 3Dструктуре, совместимой с гликозилированием. На основе указанных выше критериев был выявлен следующий мутант в отношении аминокислотной последовательность -субъединицы FSH: Пример 2. Морфологический анализ мутантных FSH. Аликвоты концентрированных супернатантов культур, полученные в результате временной экспрессии -субъединицы мутантного FSH, анализировали посредством SDS-PAGE в невосстанавливающих условиях, обеспечивающих отделение целых гетеродимеров FSH от свободных - и -субъединиц. Посредством сравнения наблюдаемых молекулярных масс каждого мутантного гетеродимера с молекулярной массой FSH дикого типа можно определить, является ли мутантный FSH пипергликозилированным относительно FSH дикого типа. Вкратце, после электрофореза белки электрофоретически переносили на PVDF и получали изображение с использованием антитела Serono 9-14, направленного против субъединицы FSH. В качестве контроля также анализировали FSH человека дикого типа, мутантныйGM1, FSH-CTP и Gonal F. В табл. 1 представлена наблюдаемая молекулярная масса гетеродимера, обра-7 013974 зованного мутантной -субъединицей и -субъединицей дикого типа, как рассчитано на основе эталонов молекулярных масс. Таблица 1 Как представлено в табл. 1, для экспрессируемого мутантного FSH, т.е. мутации D3, наблюдали повышенное гликозилирование, как подтверждено сдвигом распределения наблюдаемой молекулярной массы гетеродимера в сравнении с FSH человека дикого типа. Пример 3. Функционирование мутантных FSH in vitro. Для определения активности мутантных FSH мутант тестировали на предмет способности стимулировать продукцию сАМР в линии клеток СНО, рекомбинантно экспрессирующих рецептор FSH человека. Клетки CHO-FSHR поддерживали в среде для роста FSHR [MEM(-) (Gibco, кат.12561-056)+10% диализированная FBS (Gibco, кат.26300-020)+600 мкг/мл генетицина (Gibco, кат.10131-035)+0,02 мкМ МТХ]. Клетки CHO-FSHR высевали при 2104 клеток/лунка в 100 мкл/лунка (2106 клеток/10 мл = 1 планшет) и инкубировали при 37 С в течение 24 ч перед анализом. Клетки использовали для анализа при достижении степени смыкания монослоя по меньшей мере 70%. Для всех образцов и внутреннего стандарта осуществляли последовательное разведение 1:3 при 12 точках, начиная с 67,5 нМ (в качестве внутреннего стандарта использовали Gonal F). Все разведения проводили в среде для анализа [DMEM/F12 (не содержащая фенол, Gibco, кат.11039-021)+1 мг/млBSA (Sigma, А-6003)+0,1 мМ IBMX (ингибитор 3-изобутил-1-метилксантонфосфодиэстеразы, Sigma, кат.1-7018)]. Удаляли из аналитического планшета среду для роста, добавляли 25 мкл среды для анализа(предоставляемой вместе с набором МА 6000 cAMP MSD Meso Scale Discovery, Gaithersburg, MD), закрывали планшеты и инкубировали в течение 15 мин при 37 С. Затем в лунки вносили дозу тестируемого образца 25 мкл/лунка, перемешивали, закрывали планшеты и инкубировали в течение 1 ч при 37 С. Через 1 ч инкубации образец и среду удаляли из лунок. После этого в каждую лунку добавляли 25 мкл общепринятого буфера для лизиса (предоставляемого вместе с набором МА 6000 Meso Scale Discovery),планшеты закрывали с использованием устройства для заклеивания планшетов (Packard, кат.6005185) и встряхивали в течение 5 мин. После 5-минутной инкубации для лизиса переносили 25 мкл лизированного клеточного вещества в планшет cAMP Meso Scale Discovery (предоставляемый вместе с набором МА 6000 MSD) и инкубировали при осторожном перемешивании при комнатной температуре в течение 30 мин. В каждую лунку добавляли 25 мкл конъюгата сАМР-АР и перемешивали. Затем в каждую лунку добавляли 25 мкл антитела против сАМР, планшеты закрывали с использованием устройства для заклеивания планшетов и встряхивали в течение 30 мин при комнатной температуре. После этого планшеты промывали шесть раз с использованием буфера для промывки 350 мкл/лунка на автоматическом устройстве для промывки планшетов. Затем в каждую лунку добавляли 100 мкл энхансера субстрата Sapphire IIRTU (готового к использованию), планшеты закрывали с использованием устройства для заклеивания планшетов и инкубировали в течение 30 мин в темноте при 25 С. После этого планшеты считывали при одной секунде на лунку, где для низких уровней сАМР наблюдали высокий сигнал, а для высоких уровней сАМР наблюдали низкий сигнал. Кривая доза-эффект для мутантного FSH представлена на фиг. 2. Величины ЕС 50 были рассчитаны и представлены в табл. 2. Как представлено на фиг. 2 и в табл. 2, мутантный FSH обладает активностью in vitro, сравнимой с активностью FSH дикого типа. Таблица 2 Пример 4. Время полужизни мутантных FSH in vivo. В отдельных фармакокинетических (РК) исследованиях анализировали две различные порции мутанта D3N. Два исследования имели одинаковую схему: 33 неполовозрелых самки SD в возрасте 21 суток (масса тела приблизительно 40 г; Charles River Laboratories, Wilmington, MA) случайным образом подразделяли на 5 групп вариантов обработки (n=6) и 1 группу для исходного уровня (n=3). Выбор неполовозрелых самок крыс был основан на использовании их возраста и пела для биологических оценок ак-8 013974 тивности FSH in vivo. Животным в группах обработки проводили подкожные (s.c.) инъекции 4 мкг GM1(контроль), мутанта D3N или 8 мкг Gonal-F rhFSH (контроль). Кровь отбирали из ретроорбитального синуса через 0 ч для группы исходного уровня и через 1, 2, 4, 6, 10, 24, 48 и 72 ч для животных из групп обработки (n=3/момент времени; крыс чередовали таким образом, чтобы не забирать кровь в течение 2 последовательных точек отбора). При каждом заборе крови от каждой крысы получали приблизительно 0,1 мл крови, а плазму выделяли и хранили при -80 С до анализа посредством ELISA. Анализ, который использовали для измерения белков FSH в сыворотке из обоих исследований, представлял собой ELISADSL для покрытых FSH лунок (Diagnostics Systems Laboratories, Webster, TX), Каждый из образцов сыворотки анализировали в трех сериях. Время полужизни мутанта D3N было значимо дольше, чем время полужизни для FSH дикого типа. Пример 5. Биологическая активность in vivo. Модель in vivo, используемая для оценки биологической активности мутанта D3N, представляет собой анализ увеличения массы яичника крысы. Обработка неполовозрелых самок крыс в возрасте 21 суток посредством FSH или молекул с FSH-подобной активностью, например, посредством мутантаD3N, вызывает рост фолликулов яичника и продукцию ооцитов. Этот рост легко выявлять измерением массы яичника по окончании периода обработки. В модели подлежащее тестированию вещество вводят инъекцией в течение трех суток, и после последней дозы яичники собирают и измеряют массу. Этот анализ использовали в течение нескольких десятилетий как основу для определения эффективности FSH для клинических продуктов для указанных целей. Посредством анализа измеряют соответствующее физиологическое действие FSH, и он обладает четкой взаимосвязью с эффективностью продуктов в клинике. Активность мутанта D3N in vivo сравнивали с активностью FSH дикого типа. Все дозы были определены на основе спрогнозированной эквивалентности FSH с учетом эффективности in vitro и временем полужизни у крыс. Было открыто, что мутант D3N обладает возможной активностью FSH на уровне,сходном с таковым для FSH дикого типа. Список последовательностей- 11013974 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Нуклеиновая кислота, кодирующая мутантную -субъединицу FSH, где -субъединица содержит последовательность SEQ ID NO:4. 2. Вектор, содержащий нуклеиновую кислоту по п.1. 3. Вектор по п.2, который представляет собой вектор экспрессии. 4. Вектор по п.2, дополнительно содержащий нуклеиновую кислоту, кодирующую -субъединицуFSH, содержащую последовательность SEQ ID NO:3. 5. Клетка-хозяин, содержащая вектор по п.2. 6. Клетка-хозяин по п.5, которая представляет собой клетку млекопитающих. 7. Мутантный FSH, в котором -субъединица содержит последовательность SEQ ID NO:3 и субъединица кодируется нуклеиновой кислотой по п.1 и содержит последовательность SEQ ID NO:4. 8. Мутантный FSH по п.1, в котором любой из 1-6 аспарагиновых остатков гликозилирован. 9. Мутантный FSH по п.7, в котором -субъединица содержит последовательность SEQ ID NO:4 и в котором N3 гликозилирован. 10. Способ получения мутантного FSH, включающий:(a) получение клетки, содержащей нуклеиновую кислоту по п.1 и нуклеиновую кислоту, кодирующую -субъединицу FSH, содержащую SEQ ID NO:3;(b) культивирование клетки в условиях, обеспечивающих экспрессию первой и второй нуклеиновых кислот;(c) получение мутантного FSH. 11. Способ по п.1, где клетка способна к гликозилированию белка. 12. Способ по п.11, где клетка содержит один вектор, включающий нуклеиновую кислоту по п.1 и нуклеиновую кислоту, кодирующую -субъединицу FSH, включающую SEQ ID NO:3. 13. Способ по п.11, где клетка содержит вектор, включающий нуклеиновую кислоту по п.1, и дополнительно содержит второй вектор, включающий нуклеиновую кислоту, которая кодирует субъединицу FSH, включающую SEQ ID NO:3. 14. Фармацевтическая композиция, содержащая мутантный FSH по п.1 и при необходимости фармацевтически приемлемый носитель или эксципиент. 15. Способ лечения бесплодия у млекопитающего, включающий введение млекопитающему, нуждающемуся в указанном лечении, фармацевтической композиции по п.14. 16. Способ стимуляции фолликулогенеза у млекопитающего, включающий введение млекопитающему, нуждающемуся в указанной стимуляции, фармацевтической композиции по п.14. 17. Способ индукции гиперстимуляции яичника у млекопитающего, включающий введение млекопитающему, нуждающемуся в указанной индукции, фармацевтической композиции по п.14.
МПК / Метки
МПК: A61K 38/24, C07K 14/59, C12N 15/16
Метки: применения, способы, мутантный
Код ссылки
<a href="https://eas.patents.su/14-13974-mutantnyjj-fsh-i-sposoby-ego-primeneniya.html" rel="bookmark" title="База патентов Евразийского Союза">Мутантный fsh и способы его применения</a>
Предыдущий патент: Способы лечения кожной волчанки при помощи аминоизоиндолиновых соединений
Следующий патент: Мутантный fsh и способы его применения
Случайный патент: Ингибиторы тирозинкиназы брутона