Композиция росиглитазона и метформина
Номер патента: 11550
Опубликовано: 28.04.2009
Авторы: Маккензи Дональд Колин, Коулз Питер Джон, Мадд Пол Норман Мл.
Формула / Реферат
1. Пероральная лекарственная форма, включающая эродируемое ядро, которое содержит 5-[4-[2-(N-метил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-дион или его фармацевтически приемлемую соль или сольват и метформин или его фармацевтически приемлемую соль или сольват, причем ядро имеет покрытие с одним или несколькими отверстиями, ведущими к ядру, характеризующаяся тем, что покрытие является эродируемым при рН от 4,5 до 8.
2. Пероральная лекарственная форма по п.1, включающая:
(i) эродируемое ядро, причем ядро содержит 5-[4-[2-(N-метил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-дион или его фармацевтически приемлемую соль или сольват и метформин или его фармацевтически приемлемую соль или сольват; и
(ii) эродируемое покрытие вокруг указанного ядра, причем покрытие содержит одно или несколько отверстий, проходящих по существу полностью через указанное покрытие, но, по существу, не проникающих в указанное ядро и обеспечивающих сообщение между средой применения и указанным ядром;
где высвобождение 5-[4-[2-(N-метил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-диона или его фармацевтически приемлемой соли или сольвата и метформина или его фармацевтически приемлемой соли или сольвата из эродируемого ядра происходит по существу через указанное отверстие (отверстия) и посредством эрозии указанного эродируемого покрытия при рН от 4,5 до 8.
3. Пероральная лекарственная форма по п.1 или 2, где эродируемое покрытие представляет собой энтеросолюбильное покрытие.
4. Пероральная лекарственная форма по п.3, где энтеросолюбильное покрытие является непроницаемым.
5. Пероральная лекарственная форма по п.1, где эродируемое ядро составлено для обеспечения немедленного высвобождения и 5-[4-[2-(N-метил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-диона или его фармацевтически приемлемой соли или сольвата, и метформина или его фармацевтически приемлемой соли или сольвата.
6. Пероральная лекарственная форма по любому из предыдущих пунктов, где указанная лекарственная форма представляет собой форму таблетки.
7. Способ получения пероральной лекарственной формы по п.1, включающий:
(a) получение эродируемого ядра таблетки, содержащего 5-[4-[2-(N-метил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-дион или его фармацевтически приемлемую соль или сольват и метформин или его фармацевтически приемлемую соль или сольват;
(b) покрытие ядра материалом, обладающим способностью к эрозии, зависимой от рН; и
(c) создание одного или нескольких отверстий в покрытии.
8. Способ лечения и/или профилактики расстройства, выбранного из сахарного диабета, состояний, связанных с сахарным диабетом, его осложнений, метаболического синдрома, нарушенной устойчивости к глюкозе и нарушенного уровня глюкозы натощак, включающий введение пероральной лекарственной формы, содержащей 5-[4-[2-(N-метил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-дион или его фармацевтически приемлемую соль или сольват и метформин или его фармацевтически приемлемую соль или сольват по п.1, нуждающемуся в этом человеку или млекопитающему, отличающемуся от человека.
Текст
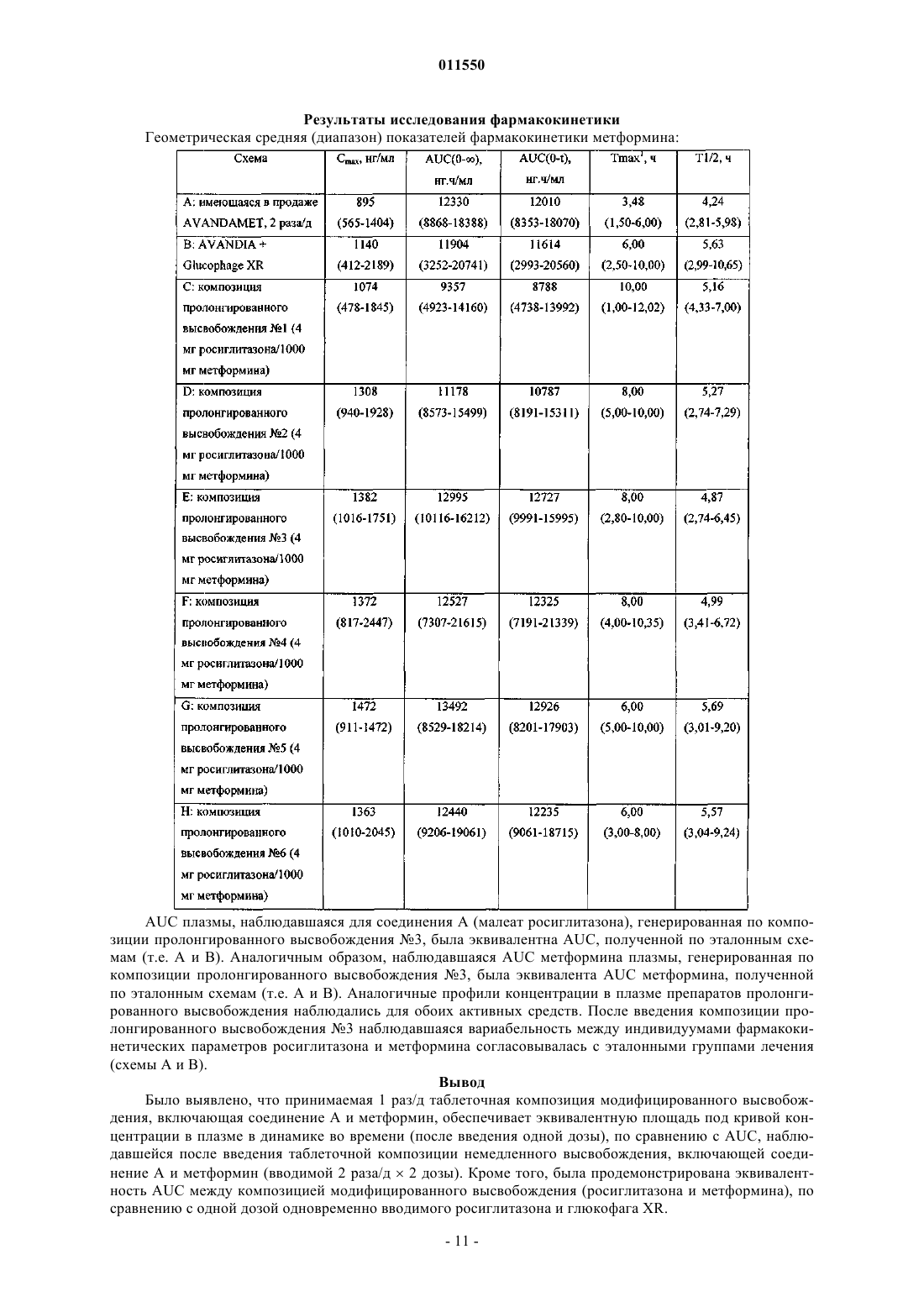
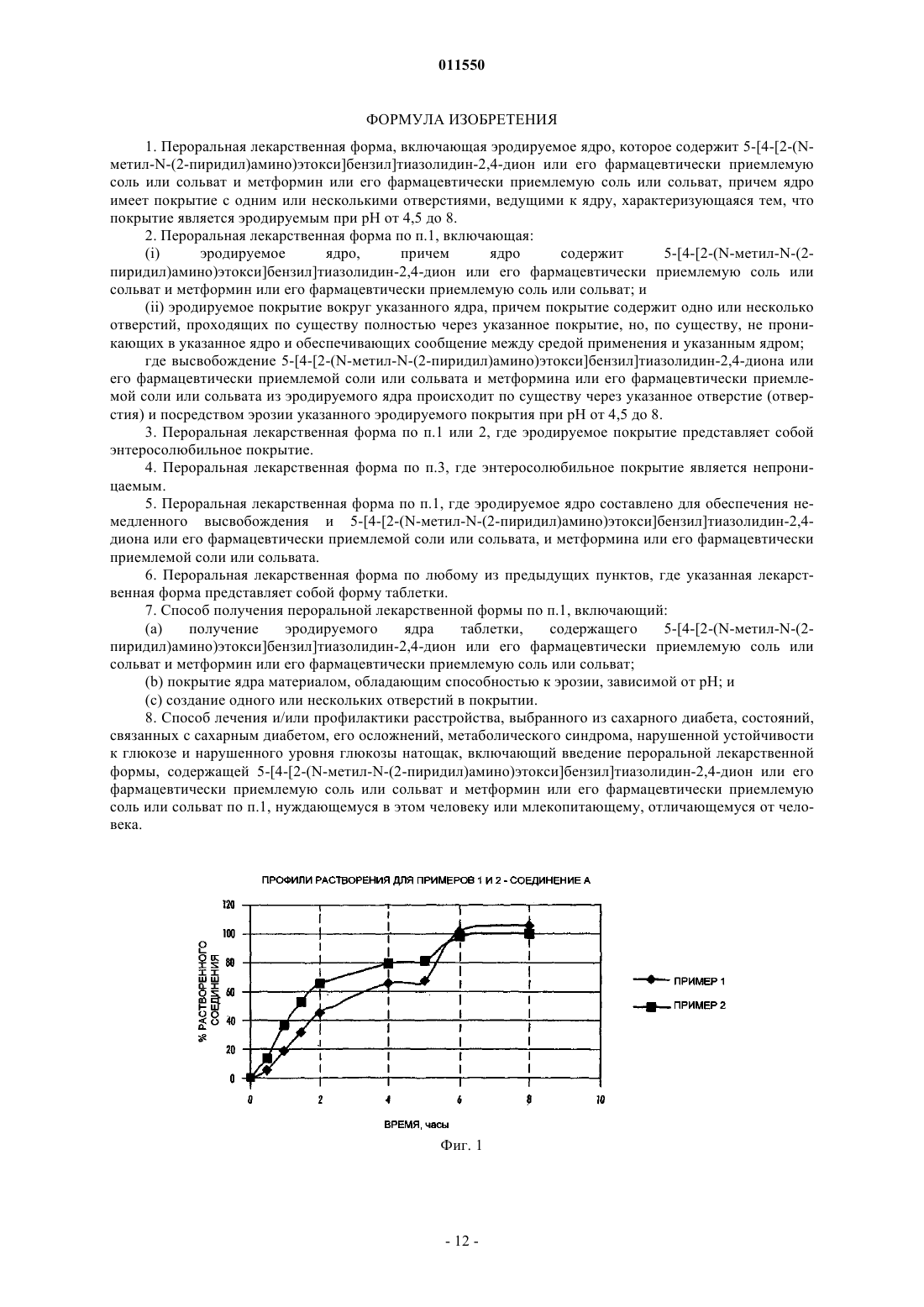
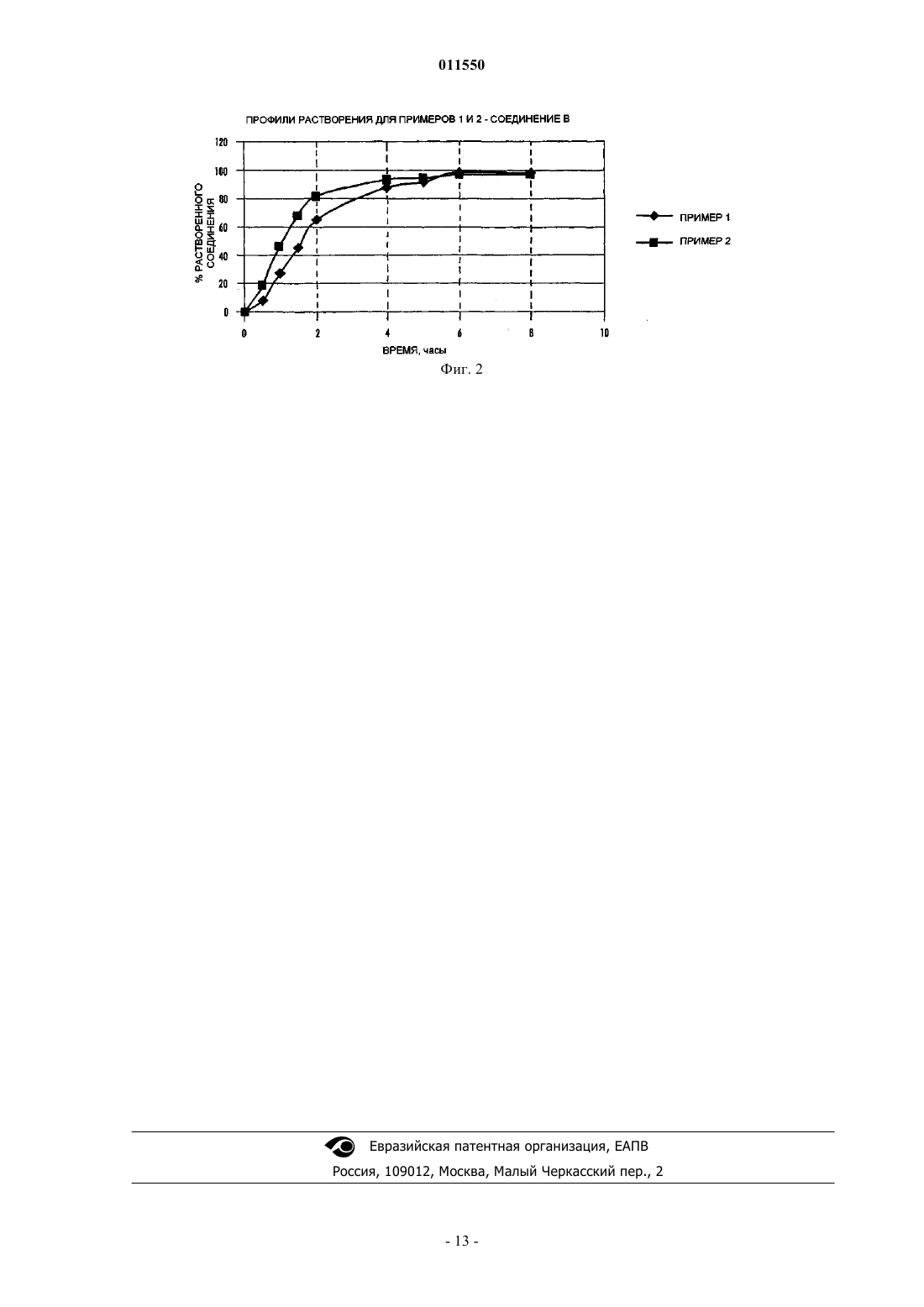
011550 Настоящее изобретение относится к пероральной лекарственной форме, включающей 5-[4-[2-(Nметил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-дион (далее Соединение А) или его фармацевтически приемлемую соль или сольваты и другое противодиабетическое средство, к способу получения такой лекарственной формы и к применению такой лекарственной формы в медицине. Применение покрытия для регулирования скорости высвобождения активного средства привлекло значительное внимание, и для такой цели было разработано множество различных устройств. Например,в международной патентной заявкеWO 01/05430 описано устройство доставки лекарственного средства, которое обеспечивает возможность доставки лекарственных веществ, которые проявляют рНзависимую растворимость, в частности, соединений, которые более растворимы при низких уровнях рН(менее чем рН 2), чем при рН, близком к нейтральному уровню (более чем приблизительно 5). Такие устройства доставки характеризуются присутствием покрытия, которое непроницаемо и нерастворимо в жидкости среды применения. В публикации международной патентной заявкиWO 95/30422 описан ряд лекарственных форм азитромицина контролируемого высвобождения. В частности, описан ряд лекарственных форм, которые снижают воздействие на верхние отделы желудочно-кишечного тракта (например, желудка) высоких концентраций азитромицина, использованием покрытия, зависимого от рН. Такие лекарственные формы не характеризуются наличием отверстий, через которые может происходить высвобождение лекарственного вещества. В патенте США 6099859 описана таблетка контролируемого высвобождения для доставки антигипергликемического препарата, которая включает осмотически активное ядро, содержащее препарат, и полупроницаемую мембрану, причем полупроницаемая мембрана проницаема для прохождения воды и биологических жидкостей и непроницаема для прохождения лекарственного вещества. Полупроницаемая мембрана содержит по меньшей мере один канал для высвобождения антигипергликемического препарата. В патенте США 5543155 описана диффузионно-осмотическая фармацевтическая композиция с контролируемым высвобождением лекарственного препарата, включающая одно- или двухслойное ядро таблетки, содержащее гидроксипропилметилцеллюлозу, причем указанное ядро имеет пленочное покрытие, включающее сополимер метакрилата аммония. Дополнительные устройства, которые используют покрытие для регулирования скорости высвобождения активного средства, обсуждены в патенте США 5004614. В этом патенте описано ядро таблетки, обеспеченное наружным покрытием, которое по существу непроницаемо для жидкости среды. Указанное наружное покрытие можно получить из материалов, которые или нерастворимы или растворимы в жидкостях среды. Когда используется растворимый материал, покрытие имеет достаточную толщину для того, чтобы ядро не контактировало с жидкостями среды до того, как не пройдет период желательного контролируемого высвобождения активного средства. Через это непроницаемое наружное покрытие было создано одно или несколько отверстий с тем, чтобы обеспечить путь доступа жидкостей среды в ядро. Поэтому, после приема внутрь покрытой таблетки, желудочно-кишечная жидкость может войти в отверстия и вступить в контакт или проникнуть в ядро для высвобождения активного средства. Результат состоит в том, что активное средство высвобождается контролируемым образом только из отверстия (отверстий). Предпочтительная геометрия такова, что имеется кольцевое отверстие на верхней и нижней поверхности покрытой таблетки. Рассматриваемое отверстие (отверстия) имеет площадь от приблизительно 10 до 60% лицевой поверхности покрытой таблетки. Обнаружено, что скорость высвобождения препарата прямо зависит от диаметра отверстия (отверстий) и от растворимости матричного ядра и активного средства, обеспечивая возможность разнообразных профилей высвобождения препарата, независимо от того, является ли оно высвобождением нулевого порядка или высвобождением первого порядка. По существу непроницаемые покрытия по патенту США 5004614 не подходят для контролируемого высвобождения активных средств, особенно фармацевтически активных слабых оснований или их фармацевтически приемлемых солей и сольватов. Такие активные средства проявляют выраженную растворимость, зависимую от рН, т.е. они более растворимы при рН около 2, связанном с областями, обнаруживаемыми в желудке, по сравнению с их растворимостью в общем нейтральных условиях тонкой кишки, около рН 7. В публикации международной патентной заявкиWO 03/068195 описана пероральная лекарственная форма, включающая эродируемое ядро, которое содержит фармацевтически активное слабое основание или его фармацевтически приемлемые соль или сольват, такое как соединение А, причем ядро имеет покрытие с одним или несколькими отверстиями, ведущими к ядру, и покрытие является эродируемым в заданных условиях рН. Это обеспечивает благоприятное средство для введения фармацевтически активного слабого основания или его фармацевтически приемлемой соли или сольвата, такого как соединение А, когда желательно, чтобы высвобождение активного соединения происходило в среде с рН,имеющим более одного значения, на основании данных о том, что благоприятно также, чтобы покрытие было эродируемым или растворимым рН-зависимым образом. Авторами данного изобретения обнаружено, что пероральную лекарственную форму, описанную в международной патентной заявкеWO 03/068195, можно успешно использовать в качестве платформы-1 011550 для доставки нескольких активных веществ, таких как, например, соединение А или его фармацевтически приемлемая соль или сольват, и другое противодиабетическое средство. Для этого указанная пероральная лекарственная форма обеспечивает благоприятное средство для доставки другого противодиабетического средства, где противодиабетическое средство имеет узкое окно всасывания. Европейская патентная заявка, публикация 0306228 А 1 относится к определенным производным тиазолидиндиона, раскрытым как обладающие антигипергликемической и гиполипидемической активностью. Одним конкретным тиазолидиндионом, раскрытым в ЕР 0306228 А 1, является соединение А. В международной патентной заявке, публикацияWO 94/05659, раскрыты определенные соли соединения А, включая малеат, в ее примере 1. Соединение А или его фармацевтически приемлемую соль или его фармацевтически приемлемый сольват можно получить, используя известные способы, например способы, раскрытые в ЕР 0306228 и WO 94/05659. Раскрытия в ЕР 0306228 и WO 94/05659 включены в настоящее описание в качестве ссылки. Соединение А представляет собой фармацевтически приемлемое слабое основание. Соединение А или его фармацевтически приемлемые соли или сольваты имеют полезные фармацевтические свойства. В частности, указано, что соединение А или его фармацевтически приемлемую соль или сольват можно применять для лечения и/или профилактики сахарного диабета, состояний, связанных с сахарным диабетом, и его определенных осложнений, метаболического синдрома, нарушенной устойчивости к глюкозе и нарушенного уровня глюкозы натощак. В международной патентной заявке, публикацияWO 01/35941, описаны определенные композиции с фиксированной дозой, включающие тиазолидиндион, такие как соединение А или его фармацевтически приемлемое производное, и другое противодиабетическое средство, такое как гидрохлорид метформина. В Европейской патентной заявке 0861666 описаны фармацевтические композиции, включающие сенсибилизаторы к инсулину, такие как пиоглитазон или соединение А, и метформин. В международной патентной заявке, публикацияWO 00/28989, описаны разнообразные фармацевтические композиции модифицированного высвобождения, включающие соединение А или его фармацевтически приемлемую соль или сольват и другое противодиабетическое средство. В заявке на патент США, публикацияUS 2003/0187074, описана пероральная система доставки,включающая бигуанид, такой как гидрохлорид метформина, которая обеспечивает контролируемое высвобождение бигуанида, независимо от рН среды. В патентах США 6475521 и 6660300 описаны системы доставки контролируемого высвобождения для фармацевтических средств, имеющих высокую растворимость в воде, таких как гидрохлорид метформина. Известно, что соединение А и его фармацевтически приемлемые соли или сольваты, в частности,малеат, проявляют выраженную растворимость, зависимую от рН, т.е. они более растворимы в кислотных условиях желудка (рН около 2), чем в почти нейтральных условиях нижних отделов кишечника (рН около 7). Известно, что определенные противодиабетические средства, такие как метформин, имеют узкое окно всасывания. Поэтому предпочтительно, чтобы такие средства доставлялись, по существу, исключительно в определенную фармакологическую среду, такую как желудок. Таким образом, задачей настоящего изобретения является предоставление пероральной лекарственной формы, которая компенсирует рН-зависимую растворимость соединения А или его фармацевтически приемлемой соли или сольвата и которая компенсирует узкое окно всасывания определенных других противодиабетических средств, таких как метформин, обеспечением доставки другого противодиабетического средства по существу исключительно в определенной фармакологической среде, такой как желудок. Указано, что такая лекарственная форма обеспечивает благоприятное действие на гликемический контроль в течение длительного периода времени. Считается также, что такая лекарственная форма подходит для введения 1 раз/д. Сущность изобретения Таким образом, данное изобретение относится к пероральной лекарственной форме, включающей эродируемое ядро, которое содержит 5-[4-[2-(N-метил-N-(2-пиридил)амино)этокси]бензил]тиазолидин 2,4-дион или его фармацевтически приемлемую соль или сольват и метформин или его фармацевтически приемлемую соль или сольват, причем ядро имеет покрытие с одним или несколькими отверстиями, ведущими к ядру, характеризующейся тем, что покрытие является эродируемым при рН от 4,5 до 8. Предпочтительно пероральная лекарственная форма по изобретению включает:(i) эродируемое ядро,причем ядро содержит 5-[4-[2-(N-метил-N-(2 пиридил)амино)этокси]бензил]тиазолидин-2,4-дион или его фармацевтически приемлемую соль или сольват и метформин или его фармацевтически приемлемую соль или сольват; и(ii) эродируемое покрытие вокруг указанного ядра, причем покрытие содержит одно или несколько отверстий, проходящих по существу полностью через указанное покрытие, но по существу не проникающих в указанное ядро и обеспечивающих сообщение между средой применения и указанным ядром. Высвобождение 5-[4-[2-(N-метил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-диона или его фармацевтически приемлемой соли или сольвата и метформина или его фармацевтически приемлемой-2 011550 соли или сольвата из эродируемого ядра происходит по существу через указанное отверстие (отверстия) и посредством эрозии указанного эродируемого покрытия при рН от 4,5 до 8. В соответствии с одним из вариантов изобретения эродируемое покрытие пероральной лекарственной формы представляет собой энтеросолюбильное покрытие, которое является непроницаемым. В предпочтительном варианте осуществления изобретения эродируемое ядро составлено для обеспечения немедленного высвобождения и 5-[4-[2-(N-метил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-диона или его фармацевтически приемлемой соли или сольвата и метформина или его фармацевтически приемлемой соли или сольвата. Предпочтительно лекарственная форма по изобретению представляет собой форму таблетки. Дополнительно данное изобретение относится к способу получения пероральной лекарственной формы, включающему:(a) получение эродируемого ядра таблетки,содержащего 5-[4-[2-(N-метил-N-(2 пиридил)амино)этокси]бензил]тиазолидин-2,4-дион или его фармацевтически приемлемую соль или сольват и метформин или его фармацевтически приемлемую соль или сольват;(c) создание одного или нескольких отверстий в покрытии. Изобретение также относится к способу лечения и/или профилактики расстройства, выбранного из сахарного диабета, состояний, связанных с сахарным диабетом, его осложнений, метаболического синдрома, нарушенной устойчивости к глюкозе и нарушенного уровня глюкозы натощак, включающему введение пероральной лекарственной формы,содержащей 5-[4-[2-(N-метил-N-(2 пиридил)амино)этокси]бензил]тиазолидин-2,4-дион или его фармацевтически приемлемую соль или сольват и метформин или его фармацевтически приемлемую соль или сольват, нуждающемуся в этом человеку или млекопитающему, отличающемуся от человека. Подробное описание изобретения Соответственно, в его самом широком аспекте настоящее изобретение предоставляет пероральную лекарственную форму, включающую эродируемое ядро, причем ядро содержит соединение А или его фармацевтически приемлемую соль или сольват и другое противодиабетическое средство, причем ядро имеет покрытие с одним или несколькими отверстиями, характеризующееся тем, что покрытие является эродируемым в заданных условиях рН. Настоящее изобретение, кроме того, предоставляет пероральную лекарственную форму, включающую (i) эродируемое ядро, причем ядро содержит соединение А или его фармацевтически приемлемую соль или сольват и другое противодиабетическое средство; и (ii) эродирумое покрытие вокруг указанного ядра, причем покрытие содержит одно или несколько отверстий, проходящих, по существу, полностью через указанное покрытие, но по существу не проникающих в указанное ядро и обеспечивающих сообщение между средой применения и указанным ядром; где высвобождение соединения А или его фармацевтически приемлемой соли или сольвата и другого противодиабетического средства из эродируемого ядра происходит по существу через указанное отверстие (отверстия) и посредством эрозии указанного эродируемого покрытия в заданных условиях рН. Лекарственная форма может представлять собой таблетку. Приведенные выше ссылки на ядро, являющееся эродируемым, включают ситуацию, когда ядро разрушается частично или полностью, или растворяется, или становится пористым после контакта с жидкостью среды с тем, чтобы обеспечить возможность контакта жидкости с активным средством. Ядро может разрушаться частично. Ядро может разрушаться полностью. Ядро может растворяться. Ядро может становиться пористым. Хотя это изобретение обеспечивает то, что эрозия покрытия является зависимой от рН, ядро может высвобождать соединение А или его фармацевтически приемлемую соль или сольват и другое противодиабетическое средство эрозией рН-независимым образом. Однако для удовлетворения особой потребности ядро может представлять собой материал, который обеспечивает возможность рН-зависимой эрозии или разрушения ядра для высвобождения соединения А или его фармацевтически приемлемой соли или сольвата и другого противодиабетического средства из матрицы. В одном варианте осуществления ядро составлено так, чтобы быть эродируемым по существу в одинаковой степени и в желудке, и в кишечнике. Эродируемое ядро может быть составлено для обеспечения немедленного или модифицированного высвобождения по меньшей мере одного из соединения А или его фармацевтически приемлемой соли или сольвата или другого противодиабетического средства. Ядро может быть составлено для обеспечения немедленного высвобождения и соединения А или его фармацевтически приемлемой соли или сольвата, и другого противодиабетического средства. Альтернативно, ядро составлено для обеспечения модифицированного высвобождения и соединения А или его фармацевтически приемлемой соли или сольвата, и другого противодиабетического средства. Подходящие материалы для ядра включают эродируемые полиметилметакрилатные смолы, такие как серия Eudragit, например Eudragit L30D, сахарозы, например лактозу и мальтозу, и сложные эфиры целлюлозы, например метилцеллюлозу, гидроксипропилметилцеллюлозу (НРМС) и гидроксипропил-3 011550 целлюлозу, стеарат магния, гликолят-крахмал натрия и повидон (поливинилпирролидон). Ядро может представлять собой преимущественно микрокристаллическую целлюлозу, гидроксипропилметилцеллюлозу, лактозу и повидон. Более предпочтительно, чтобы ядро состояло по существу из гидроксипропилметилцеллюлозы, лактозы, микрокристаллической целлюлозы, гликолят-крахмала натрия, повидона и стеарата магния. Приведенная выше ссылка на покрытие, являющееся эродируемым, включает ситуацию, где покрытие разрушается частично или полностью, или растворяется, или становится пористым после контакта с жидкостью среды с тем, чтобы обеспечить возможность жидкости контактировать с ядром. Покрытие может разрушаться частично. Покрытие может разрушаться полностью. Покрытие может растворяться. Покрытие может становиться пористым. Предпочтительно эродируемое покрытие представляет собой энтеросолюбильное покрытие, т.е. оно имеет определенный, заданный порог рН, при котором оно растворяется. Предпочтительно покрытие эродирует при рН больше чем 4,5. Предпочтительнее покрытие эродирует при диапазоне рН от 4,5 до 8. Наиболее предпочтительно покрытие эродирует при диапазоне рН от 5 до 7. Предпочтительно энтеросолюбильное покрытие является непроницаемым. Было обнаружено, что применение покрытия, которое быстро эродируется после выхода из желудочной среды, особенно благоприятно, когда другое противодиабетическое средство, такое как метформин, имеет узкое окно всасывания. В таких обстоятельствах любое активное средство, которое не высвобождается в желудке, быстро подается после вхождения в тонкую кишку, сводя к минимуму, таким образом, любую потерю всасывания, связанную с доставкой ниже по желудочно-кишечному тракту. Материалы и их смеси, пригодные для использования в качестве рН-зависимого эродируемого покрывающего материала в данном изобретении, включают различные полимеры полиметакрилата, совместно переработанный поливинилацетатфталат, ацетаттримеллитат целлюлозы, ацетатфталат целлюлозы,шеллак, полимеры фталат гидроксипропилметилцеллюлозы и их сополимеры. Покрывающий материал может быть выбран из ацетата тримеллитата целлюлозы (CAT), фталата поливинилацетата, фталата гидроксипропилметилцеллюлозы 50, фталата гидроксипропилметилцеллюлозы 55, Acryl-eze, Aquateric,ацетатфталата целлюлозы, Eudragit LD30 D, Eudragit L, Eudragit S и шеллак. Предпочтительнее всего материал покрытия представляет собой Eudragit LD30 D. При необходимости, эродируемое покрытие может быть модифицировано добавлением пластификаторов или средств против слипания. Подходящие материалы для этой цели включают восковидные материалы, такие как глицериды, например моностеарат глицерила. Типичные размеры для отверстия (отверстий), имеющего круглую форму, которое предстоит сформировать в покрытии, находятся в диапазоне диаметра от 0,5 до 8 мм, например имеют диаметр 1, 2, 3, 4,5 или 6 мм, в зависимости от общего размера таблетки и желательной скорости высвобождения. Отверстие (отверстия) могут иметь любую подходящую геометрическую форму, но в целом предпочтительна округленная форма, например, по существу, круглая или эллиптическая. Могут быть также сформированы более сложные формы, такие как символы в виде букв или графических изображений, при условии,что в отдельных лекарственных формах можно обеспечить равномерную скорость высвобождения. Типичные размеры некруглых отверстий равны по площади указанным выше размерам для круговых отверстий и, таким образом, находятся в диапазоне от примерно 0,19 до примерно 50,3 мм 2. В целях настоящего изобретения, термин отверстие является синонимичен дырке, щели, проходу,каналу, выпуску и т.д. Отверстие (отверстия) могут быть сформированы способом, описанным в патенте США 5004614. Обычно отверстие (отверстия) могут быть сформированы сверлением, например с использованием буров механической дрели или лазерных лучей или пробойниками, которые удаляют отсеченную область. Формирование отверстия (отверстий) может по умолчанию удалять небольшую часть открытого ядра. Можно также целенаправленно сформировать полость ниже отверстия в качестве устройства, регулирующего скорость высвобождения, причем полость обнажает большую исходную площадь поверхности,чем плоская площадь. Отверстие (отверстия) может проходить через все эродируемое покрытие, так,чтобы был немедленный контакт ядра с жидкостью среды, когда устройство помещается в желательную среду применения. Можно также формировать отверстие (отверстия) in situ, когда введена лекарственная форма, формированием покрытия, содержащего порообразующие средства, т.е. материал, который растворится в желудке, для создания пор в покрытии. Соответственно, предоставляется также пероральная лекарственная форма, включающая:(i) эродируемое ядро, причем ядро содержит соединение А или его фармацевтически приемлемую соль или сольват и другое противодиабетическое средство; и(ii) эродируемое покрытие, окружающее указанное ядро, причем покрытие содержит порообразующее средство, которое является эродируемым в диапазоне рН от 1 до 3, для формирования одного или нескольких отверстий, проходящих по существу полностью через указанное покрытие, но по существу не проникающие в указанное ядро и обеспечивающие сообщение между средой применения и указанным ядром;-4 011550 где высвобождение соединения А или его фармацевтически приемлемой соли или сольвата и другого противодиабетического средства из лекарственной формы происходит через указанное отверстие (отверстия) эрозией указанного эродируемого ядра и посредством эрозии указанного эродируемого покрытия в заданных условиях рН. В патенте США 5004614 отверстие (отверстия) предпочтительно составляют примерно 10-60% общей лицевой поверхности таблетки, т.е. верхней и нижней поверхностей двояковыпуклой таблетки. В настоящем изобретении отверстие (отверстия) могут составлять от 0,25 до 50%, например 10-70% общей лицевой поверхности. Альтернативно, может быть полезным охарактеризовать контролирующий скорость эффект отверстия (отверстий) указанием площади отверстия (отверстий) относительно общей площади поверхности покрытой таблетки. Кроме того, особенно в случаях, когда ядро эродируется подрезанием краев отверстия (отверстий), контролирующий скорость эффект может быть связан с общей окружностью отверстия(отверстий). Неожиданной находкой является то, что 2 отверстия, например по одному на каждой первичной поверхности двояковыпуклой таблетки, высвобождают активное средство из ядра со скоростью, погранично большей, чем скорость высвобождения из одного отверстия такой же общей площади. Указано также,что вариабельность скорости высвобождения из двух отверстий меньше, чем вариабельность скорости высвобождения из соответствующего одного отверстия. Соответственно, в одном варианте осуществления изобретения покрытие ядра снабжено двумя или более отверстиями. Предпочтительнее эродируемое покрытие, окружающее ядро, имеет два отверстия, проходящих по существу полностью через указанное покрытие, но по существу не проникая в указанное ядро и обеспечивая сообщение между средой применения и указанным ядром. Когда имеется более одного отверстия, отверстия могут быть расположены на одной и той же поверхности пероральной лекарственной формы или на различных поверхностях. Пероральная лекарственная форма может содержать 2 отверстия, по одному на каждой противоположной поверхности. Пероральная лекарственная форма может представлять собой таблетку, имеющую 2 противоположные первичные поверхности, причем каждая поверхность имеет одно отверстие, проходящее через покрытие. В качестве защиты для материала ядра, для предотвращения загрязнения через отверстие (отверстия) перед введением, может быть желательным обеспечение обычного герметизирующего покрытия или для ядра, или для лекарственной формы после формирования отверстия (отверстий). Герметизирующее покрытие может представлять собой подлежащее покрытие или перекрывающее покрытие на эродируемом покрытии. Когда пероральная лекарственная форма включает противодиабетическое средство, которое, как известно, имеет узкое окно всасывания, такое как метформин, лекарственная форма предпочтительно составлена для обеспечения доставки противодиабетического средства по существу исключительно в определенную фармакологическую среду, такую как желудок. Когда требуется по существу исключительная доставка другого противодиабетического средства в желудок, пероральная лекарственная форма может составляться для пребывания в желудочной среде в течение продолжительного периода времени. Увеличенные периоды времени удерживания в желудке могут быть достигнуты, например, увеличением размера лекарственной формы и/или введением лекарственной формы с пищей. В соответствии с еще одним аспектом настоящего изобретения предоставляется способ получения пероральной лекарственной формы в соответствии с настоящим изобретением, причем способ включает:(а) получение эродируемого ядра таблетки, содержащего соединение А или его фармацевтически приемлемую соль или сольват и другое противодиабетическое средство;(c) создание одного или нескольких отверстий в покрытии. В соответствии с еще одним аспектом настоящего изобретения предоставляется способ получения пероральной лекарственной формы в соответствии с настоящим изобретением, причем способ включает:(a) получение эродируемого ядра таблетки, содержащего соединение А или его фармацевтически приемлемую соль или сольват, и другое противодиабетическое средство;(c) создание одного или нескольких отверстий в покрытии, причем указанное отверстие (отверстия) проходят по существу полностью через указанное покрытие, но по существу не проникают в указанное ядро и обеспечивают сообщение между средой применения и указанным ядром. Ядро можно получить прессованием подходящих ингредиентов для формирования уплотненной массы, которая включает ядро лекарственной формы (также именуемой в настоящем описании ядром таблетки). Ее можно получить, используя обычные таблеточные эксципиенты и способы прессовки композиций. Так, ядро обычно включает активные вещества наряду с эксципиентами, которые придают удовлетворительные характеристики переработки и прессования, такими как разбавители, связывающие вещества и смазывающие вещества. Дополнительные эксципиенты, которые могут формировать часть ядра устройства, включают разрыхлители, ароматизирующие вещества, красящие вещества, средства,модифицирующие высвобождение и/или солюбилизирующие вещества, такие как поверхностно-5 011550 активные вещества, модификаторы рН и носители образования комплексов. Обычно активные вещества и эксципиенты тщательно смешиваются перед прессованием в твердое ядро. Ядро устройства может быть сформировано способами влажного гранулирования, способами сухого гранулирования или прямым прессованием. Ядро можно получить в соответствии с любой желательной предварительно выбранной формой, такой как двояковыпуклая, полусферическая, почти полусферическая, круглая, овальная, в целом эллипсоидная, продолговатая, в целом цилиндрическая или многогранная, например форма треугольной призмы. Термин почти полусферическая предназначен для толкования в соответствии с тем, как описано в патенте США 5004614. Ядру может придаваться двояковыпуклая форма, например имеющая две куполообразные противоположные поверхности. Кроме того,ядро может быть изготовлено в виде многослойной (например, двух- или трехслойной) конструкции. Например, ядро может быть составлено в виде двухслойной конструкции, в которой один слой включает соединение А или его фармацевтически приемлемую соль или сольват, а другой слой включает другое противодиабетическое средство. Ядро может быть покрыто подходящим материалом, эродируемым в зависимости от рН, любым фармацевтически приемлемым способом покрытия. Примеры включают способы покрытия, описанные в патенте США 5004614, и пленочное покрытие, сахарное покрытие, покрытие напылением, покрытие погружением, покрытие прессованием, электростатическое покрытие. Типичные способы включают напыление покрытия на таблетку в устройстве для покрытия в виде вращающегося чана или в устройстве для покрытия в псевдосжиженном слое до тех пор, пока не будет достигнута желательная толщина покрытия. Покрытие может быть обеспечено для добавки примерно 4-8 или 5-7 мг/см 2 сухого полимера вокруг площади поверхности таблетки. Обычно это приводит к увеличению массы (относительно ядра) от 3 до 10% или от 5 до 10 мас.%. Покрытие может иметь толщину в диапазоне от 0,05 до 0,5 мм. Используемый в настоящем описании термин модифицированное высвобождение означает композицию, которая была предназначена для создания желательного фармакокинетического профиля выбором состава. Модифицированное высвобождение также включает композиции модифицированного высвобождения в комбинации с композициями не модифицированного высвобождения. Например, термин модифицированное высвобождение должен включать отсроченное, пульсирующее и длительное высвобождение или отдельно, или в любой комбинации. В одном аспекте композиция модифицированного высвобождения обеспечивает отсроченное высвобождение по меньшей мере одного из соединения А или его фармацевтически приемлемой соли или сольвата и другого противодиабетического средства. Отсроченное высвобождение может быть получено использованием композиции, устойчивой к желудочной среде, такой как энтеросолюбильная композиция. Такая энтеросолюбильная композиция может включать материал из множества частиц, такой как состоящие из множества частиц сферы, покрытые полимером, устойчивым к желудочной среде. Подходящие полимеры, устойчивые к желудочной среде, включают полимеры, полученные из метакрилатов,ацетатфталата целлюлозы, ацетатфталата поливинила и фталата гидроксипропилметилцеллюлозы. Примеры таких полимеров включают Eudragit L100-55 (поли(метакриловая кислота, этилакрилат) 1:1), например Eudragit L30D-55 или Eudragit FS 30D, Aquateric (ацетатфталат целлюлозы), Sureteric(ацетатфталат поливинила), HPMCP-HP-55S (фталат гидроксипропилметилцеллюлозы). Вещества в виде множества частиц включают покрытые лекарственным препаратом шариковые субстраты, такие как сферы лактозы, или содержащие лекарственный препарат шариковые субстраты,такие как сферы лактозы, содержащие лекарственный препарат. Такие вещества в виде множества частиц покрыты при необходимости соответствующей энтеросолюбильной композицией, например полиметакрилатным полимером. Примером подходящего полиметакрилатного полимера является Eudragit L10055 (поли(метакриловая кислота, этилакрилат) 1:1), например Eudragit L30D-55 или Eudragit FS 30D. В еще одном аспекте композиция модифицированного высвобождения обеспечивает пролонгированное высвобождение по меньшей мере одного из соединения А или его фармацевтически приемлемой соли или сольвата и другого противодиабетического средства, например, обеспечивая высвобождение активного вещества (веществ) в течение периода времени до 26 ч; возможно, в диапазоне от 4 до 24 ч; предпочтительно в диапазоне от 12 до 24 ч. Пролонгированное высвобождение обычно обеспечивается использованием матрицы пролонгированного высвобождения, обычно в форме таблетки, такие как разрушающиеся, не разрушающиеся или эродирующиеся матрицы. Пролонгированное высвобождение может быть получено использованием не разрушающейся таблеточной матрицы. Подходящие композиции с не разрушающейся таблеточной матрицей обеспечиваются включением в таблетку метакрилатов, ацетатов целлюлозы, карбомеров и фталата гидроксипропилметилцеллюлозы. Примеры подходящих материалов включают Eudragit RS (поли(этилакрилат, метилметакрилат, хлорид триметиламмониоэтилметакрилата) 1:2:0,1), Eudragit RL (поли(этилакрилат, метилметакрилат, хлорид триметиламмониоэтилметакрилата) 1:2:0,2), Carbopol 971P (карбомер), HPMCPHP-55S (фталат гидроксипропилметилцеллюлозы).-6 011550 Пролонгированное высвобождение, кроме того, получается использованием таблеточной композиции с разрушающейся матрицей, например включением в таблетку метакрилатов, метилцеллюлозы или гидроксипропилметилцеллюлозы. Примеры подходящих материалов включают Eudragit L (поли(метакриловая кислота, этилакрилат) 1:1) и Methocel K4M (гидроксипропилметилцеллюлоза). Пролонгированное высвобождение может быть также достигнуто использованием материалов в форме множественных частиц, покрытых полупроницаемыми мембранами. Вещества в виде множества частиц включают покрытые лекарственным препаратом шариковые субстраты, такие как сферы лактозы,или содержащие лекарственный препарат субстраты, такие как сферы лактозы, содержащие лекарственный препарат/Avicel (микрокристаллическую целлюлозу). Такие вещества в виде множества частиц покрыты при необходимости соответствующими полупроницаемыми мембранами, такими как полимер этилцеллюлозы. В еще одном аспекте композиция модифицированного высвобождения обеспечивает пульсирующее высвобождение по меньшей мере одного из соединения А или его фармацевтически приемлемой соли или сольвата или другого противодиабетического средства, например, обеспечивая до 4, например 2,импульса высвобождения активного средства в течение 24 ч. Пригодные материалы для композиции немедленного высвобождения включают сахарозы, например лактозу и мальтозу, и целлюлозы, например микрокристаллическую целлюлозу. Наиболее приемлемо, композиция немедленного высвобождения представляет собой преимущественно микрокристаллическую целлюлозу. Более предпочтительно композиция немедленного высвобождения состоит по существу из лактозы, микрокристаллической целлюлозы и стеарата магния. Как указано выше, пероральная лекарственная форма по настоящему изобретению считается пригодной для введения 1 раз/д и, как указано, во время применения обеспечивает терапевтический эффект в течение продолжительного периода времени, например до 24 ч, например до 12, 14, 16, 18, 20 и 24 ч на стандартную дозу. Предпочтительная дозировка соединения А или его фармацевтически приемлемой соли или сольвата при применении в соответствии с настоящим изобретением составляет до 12 мг, например от 1 до 12 мг. Так, пригодные лекарственные формы включают 1, 2, 3, 4, 5, б, 7, 8, 9, 10, 11 или 12 мг соединения А или его фармацевтически приемлемой соли или сольвата. Конкретные лекарственные формы включают от 2 до 4 мг соединения А или его фармацевтически приемлемой соли или сольвата. Конкретные лекарственные формы включают от 4 до 8 мг соединения А или его фармацевтически приемлемой соли или сольвата. Конкретные лекарственные формы включают от 8 до 12 мг соединения А или его фармацевтически приемлемой соли или сольвата. Одна лекарственная форма включает 2 мг соединения А или его фармацевтически приемлемой соли или сольвата. Предпочтительные лекарственные формы включают 4 мг соединения А или его фармацевтически приемлемой соли или сольвата. Предпочтительные лекарственные формы включают 8 мг соединения А или его фармацевтически приемлемой соли или сольвата. Другие пригодные противодиабетические средства в соответствии с настоящим изобретением включают ингибиторы альфа-глюкозидазы, бигуаниды и средства, стимулирующие секрецию инсулина. Пригодный ингибитор альфа-глюкозидазы представляет собой акарбозу. Другими пригодными ингибиторами альфа-глюкозидазы являются эмиглитат и миглитол. Еще одним пригодным ингибитором альфа-глюкозидазы является воглибоза. Пригодные бигуаниды включают метформин, буформин или фенформин, особенно метформин. Предпочтительной фармацевтически приемлемой солью метформина является гидрохлорид. Пригодные средства, стимулирующие секрецию инсулина, включают сульфонилмочевины. Пригодные сульфонилмочевины включают глибенкламид, глипизид, гликлазид, глимепирид, толазамид и толбутамид. Другие сульфонилмочевины включают ацетогексамид, карбутамид, хлорпропамид,глиборнурид, гликвидон, глисентид, глисоламид, глисоксепид, гликлопиамид и глициламид. Включена также сульфонилмочевина глипентид. Другие пригодные средства, стимулирующие секрецию инсулина, включают репаглинид. Дополнительным средством, стимулирующим секрецию инсулина, является натеглинид. Пригодные дозировки, предпочтительно стандартные дозировки, другого противодиабетического средства, такого как ингибитор альфа-глюкозидазы, бигуанид или средство, стимулирующее секрецию инсулина, включают известные допустимые дозы для этих соединений, как описано или указано в справочных источниках, таких как Фармакопеи Великобритании и США, Remington's Pharmaceutical Sciences(Mack Publishing Co.), Martindale The Extra Pharmacopoeia (London, The Pharmaceutical Press) (например,см. 31-е издание, стр.341 и приведенные в нем страницы) или указанные выше публикации. Для ингибитора альфа-глюкозидазы пригодное количество акарбозы находится в диапазоне от 25-7 011550 до 600 мг, включая 50-600 мг, например 100 или 200 мг. Для бигуанида пригодная дозировка метформина составляет от 100 до 3000 мг, например 250, 500,850 или 1000 мг, в частности, 500 и 1000 мг. Для средства, стимулирующего секрецию инсулина, пригодное количество глибенкламида находится в диапазоне от 2,5 до 20 мг, например 10 или 20 мг; пригодное количество глипизида находится в диапазоне от 2,5 до 40 мг; пригодное количество гликлазида находится в диапазоне от 40 до 320 мг; пригодное количество толазамида находится в диапазоне от 100 до 1000 мг; пригодное количество толбутамида находится в диапазоне от 1000 до 3000 мг; пригодное количество хлорпропамида находится в диапазоне от 100 до 500 мг и пригодное количество гликвидона находится в диапазоне от 15 до 180 мг. Также пригодное количество глимепирида составляет от 1 до 6 мг и пригодное количество глипентида составляет от 2,5 до 20 мг. Пригодное количество репаглинида находится в диапазоне от 0,5 до 20 мг, например 16 мг. Также пригодное количество натеглинида составляет от 90 до 360 мг, например 270 мг. Когда лекарственная форма включает соединение А или его фармацевтически приемлемую соль или сольват и метформин, предпочтительными фиксированными дозами являются 2 мг соединения А и 500 мг метформина; 4 мг соединения А и 500 мг метформина; 2 мг соединения А и 1000 мг метформина; 4 мг соединения А и 1000 мг метформина; и 8 мг соединения А и 1000 мг метформина. Путем подбора указанных выше переменных величин и площади поверхности обнаженного ядра,можно согласовать для получения сравнимых скоростей высвобождения в условиях различных сред организма и, таким образом, достижения более постоянного введения пациенту. Предпочтительно скорости растворения пероральных лекарственных форм по настоящему изобретению располагаются по порядку, например, путем обычного подбора эродируемого покрытия и размеров отверстия (отверстий) с тем, чтобы скорость высвобождения была по существу одинаковой в средах с различным рН лекарственной формой после введения. Скорости растворения можно оценить тестированием in vitro в растворах с соответствующими значениями рН. Например, при сравнении растворения в желудке и кишечнике испытания можно провести сначала при рН 1,5 с переходом на рН 6,8 через 2 ч или 4 ч как предполагаемого времени нахождения в желудке перед опорожнением в кишечник воображаемого пациента соответственно в состоянии натощак и после приема пищи. Альтернативно, испытания можно проводить исходно при рН 4,0 для имитации желудочной среды после приема пищи с переходом через 5 ч к рН 6,8. Как упомянуто выше, соединение А или его фармацевтически приемлемая соль или сольват при введении в пероральной лекарственной форме по настоящему изобретению можно, как указано, использовать для лечения и/или профилактики сахарного диабета, состояний, связанных с сахарным диабетом,и определенных его осложнений; метаболического синдрома, нарушенной устойчивости к глюкозе и нарушенного уровня глюкозы натощак (далее именуемых расстройствами по изобретению). Соединение А или его фармацевтически приемлемая соль или сольват при введении в пероральной лекарственной форме по настоящему изобретению, как указано, могут быть использованы при лечении и/или профилактике сахарного диабета, состояний, связанных с сахарным диабетом, и определенных его осложнений. Соединение А или его фармацевтически приемлемая соль или сольват при введении в пероральной лекарственной форме по настоящему изобретению, как указано, могут быть использованы при лечении и/или профилактике метаболического синдрома. Соединение А или его фармацевтически приемлемая соль или сольват при введении в пероральной лекарственной форме по настоящему изобретению, как указано, могут быть использованы при лечении и/или профилактике нарушенной устойчивости к глюкозе. Соединение А или его фармацевтически приемлемая соль или сольват при введении в пероральной лекарственной форме по настоящему изобретению, как указано, могут быть использованы при лечении и/или профилактике нарушенного уровня глюкозы натощак. В предпочтительном варианте осуществления настоящее изобретение предоставляет способ лечения и/или профилактики расстройств по изобретению, причем способ включает введение пероральной лекарственной формы по настоящему изобретению, содержащей соединение А или его фармацевтически приемлемую соль или сольват и другое противодиабетическое средство, нуждающемуся в нем человеку или млекопитающему, отличающемуся от человека. В еще одном предпочтительном варианте осуществления настоящее изобретение предоставляет пероральную лекарственную форму по настоящему изобретению, включающую соединение А или его фармацевтически приемлемую соль или сольват и другое противодиабетическое средство, для применения при лечении и/или профилактике расстройств по изобретению. Пригодные фармацевтически приемлемые формы другого противодиабетического средства зависят от конкретного применяемого средства, однако они включают фармацевтически приемлемые формы конкретного выбранного средства. Такие производные можно обнаружить или они указаны в стандартных справочных публикациях, таких как Фармакопеи Великобритании и США, Remington's Pharmaceutical Sciences (Mack Publishing Co.), Martindale The Extra Pharmacopoeia (London, The Pharmaceutical Press)(например, см. 31-е издание, стр.341 и приведенные в нем страницы) или указанные выше публикации. Например, конкретной формой метформина является гидрохлорид метформина, конкретной формой ре-8 011550 паглинида является форма соли бензойной кислоты и конкретной формой толбутамида является форма натриевой соли. Используемый в настоящем описании термин фармацевтически приемлемое охватывает соединения, композиции и ингредиенты для применения и у людей, и в ветеринарии. Например, термин фармацевтически приемлемая соль охватывает ветеринарно приемлемую соль. В частности, пригодные фармацевтически приемлемые солевые формы соединения А включают формы, описанные в Европейском патенте 0308228 и в Международной патентной заявке, публикацияWO 94/05659. Особенно предпочтительной солью соединения А является малеат. Предпочтительной фармацевтически приемлемой сольватированной формой соединения А является гидрат. Используемый в настоящем описании термин Cmax должен означать средний максимальный уровень концентрации в плазме. Используемый в настоящем описании термин AUC должен означать среднюю площадь под кривой динамики концентрации в плазме в течение интервала между введениями в стационарном состоянии. При указанных выше способах лечения не указаны побочные токсикологические эффекты. Все публикации, включая, но не ограничиваясь, патенты и патентные заявки, приведенные в настоящем описании, включены в него в качестве ссылки, как если бы каждая отдельная публикация была специально и индивидуально указана как включенная в настоящее описание в качестве ссылки в полном изложении. В следующих примерах ядра таблеток были составлены обычными средствами смешиванием вместе активных ингредиентов с эксципиентами и прессованием для формирования ядра таблеток. Эти примеры предназначены служить в качестве иллюстрации, а не ограничения настоящего изобретения, а комбинация соединения А и метформина используется просто в качестве одного примера комбинации, пригодной для применения в настоящем изобретении. Пример 1. Ядро формируют из следующей композиции: прессованием для формирования овальной таблетки размером 19,0 мм 9,2 мм массой 1174 мг. Ядра таблеток покрывают подлежащим покрытием на основе НРМС и полиметакрилатной смолой,растворимой при рН 5,5 до общей массы 1246,5 мг. Отверстие диаметром 3,0 мм сверлят через покрытие в каждой из двух основных поверхностей покрытых ядер для обнажения поверхности ядра. Пример 2. прессованием для формирования овальной таблетки размером 19,0 мм 9,2 мм массой 1174 мг.-9 011550 Ядра таблеток покрывают подлежащим покрытием на основе НРМС и полиметакрилатной смолой,растворимой при рН 5,5 до общей массы 1246,5 мг. Отверстие диаметром 4,0 мм сверлят через покрытие в каждой из двух основных поверхностей покрытых ядер для обнажения поверхности ядра. Профили растворения для лекарственных форм примеров 1 и 2, для соединения А и метформина(соединение В) показаны соответственно на фиг. 1 и 2 на сопровождающих чертежах. Тесты растворения выполняют сначала при рН 4,0 с переходом к рН 6,8 через 5 ч. Исследование для оценки фармакокинетики шести композиций пролонгированного высвобожденияAVANDAMET (4 мг малеата росиглитазона/1000 мг метформина HCl), по сравнению с имеющейся в продаже композицией AVANDAMET (2 мг малеата росиглитазона/500 мг метформина HCl, вводимые 2 раза/д) и сопутствующим введением Glucophaget XR (метформин HCl 2500 мг) с AVANDIA (4 мг малеата росиглитазона) Первичные цели Сравнить фармакокинетику однократной дозы шести композиций пролонгированного высвобождения AVANDAMET (4 мг малеата росиглитазона/1000 мг метформина HCl) с фармакокинетикой имеющейся в продаже композиции AVANDAMET (2 мг малеата росиглитазона/500 мг метформина НС 1, вводимой 2 раза/д). Сравнить фармакокинетику однократной дозы шести композиций пролонгированного высвобождения AVANDAMET (4 мг малеата росиглитазона/1000 мг метформина НС 1) с фармакокинетикой одновременно введенного Glucophage XR (метформин HCl 2500 мг) с AVANDIA (4 мг малеата росиглитазона). Вторичные цели Оценить безопасность и переносимость однократных пероральных доз каждой из шести композиций пролонгированного высвобождения AVANDAMET (4 мг малеата росиглитазона/1000 мг метформина HCl); имеющейся в настоящее время в продаже композиции AVANDAMET (2 мг малеата росиглитазона/500 мг метформина HCl, вводимой 2 раза/д) и одновременного введения имеющихся в продаже таблеток Glucophage XR (метформин HCl 2500 мг) с AVANDIA (4 мг малеата росиглитазона) . Сравнить фармакокинетику имеющейся в настоящее время в продаже композиции AVANDAMETGlucophage XR (метформин HCl 2500 мг) с AVANDIA (4 мг малеата росиглитазона). Структура исследования Это было рандомизированное, открытое, состоящее из четырех периодов, сбалансированное по периодам перекрестное исследование с тремя параллельными группами, проведенное на здоровых добровольцах. Каждый индивидуум участвовал в четырех циклах исследования, разделенных периодом очистки в течение по меньшей мере 7 д. В каждом цикле исследования индивидуумов методом случайной выборки включали в группу, которая вечером в состоянии сытости получала или одну пероральную дозуAVANDAMET, AVANDIA плюс Glucophage XR, или 2 из 6 композиций пролонгированного высвобождения AVANDAMET. Количество и основные характеристики индивидуумов 51 индивидуум был включен в исследование, и 39 индивидуумов завершили исследование. Индивидуумы представляли собой здоровых взрослых мужчин и женщин в возрасте от 18 до 65 лет включительно с массой тела 50 кг (110 фунтов) и индексом массы тела (BMI) от 19 до 30 кг/м 2. Критерии для оценки Образцы плазмы для анализа фармакокинетики росиглитазона и метформина получали перед введением исследуемого лекарственного препарата в каждый цикл и в течение 24-часового интервала. Анализировали данные изменения со временем концентрации в плазме росиглитазона и метформина. Если позволяли данные, то определяли следующие фармакокинетические параметры: максимальную наблюдаемую концентрацию в плазме (Cmax), время до достижения Cmax (tmax), площадь под кривой изменения концентрации в плазме во времени до последней измеряемой концентрации (AUC(0-t, (AUC(0-36 ч, и экстраполированной на бесконечность (AUC(0-inf и период полувыведения (Т 1/2). Безопасность и переносимость оценивали по побочным явлениям, клиническим лабораторным оценкам (гематология, клиническая химия и анализ мочи), показателям жизненных функций (артериальное давление, частота сердечных сокращений в положении полулежа), ЭКГ в 12 отведениях и одновременно принимаемые лекарственные средства. Все индивидуумы, которые получали по меньшей мере одну дозу исследуемого лекарственного средства, были включены в оценку клинической безопасности и переносимости.- 10011550 Результаты исследования фармакокинетики Геометрическая средняя (диапазон) показателей фармакокинетики метформина:AUC плазмы, наблюдавшаяся для соединения А (малеат росиглитазона), генерированная по композиции пролонгированного высвобождения 3, была эквивалентна AUC, полученной по эталонным схемам (т.е. А и В). Аналогичным образом, наблюдавшаяся AUC метформина плазмы, генерированная по композиции пролонгированного высвобождения 3, была эквивалента AUC метформина, полученной по эталонным схемам (т.е. А и В). Аналогичные профили концентрации в плазме препаратов пролонгированного высвобождения наблюдались для обоих активных средств. После введения композиции пролонгированного высвобождения 3 наблюдавшаяся вариабельность между индивидуумами фармакокинетических параметров росиглитазона и метформина согласовывалась с эталонными группами лечения(схемы А и В). Вывод Было выявлено, что принимаемая 1 раз/д таблеточная композиция модифицированного высвобождения, включающая соединение А и метформин, обеспечивает эквивалентную площадь под кривой концентрации в плазме в динамике во времени (после введения одной дозы), по сравнению с AUC, наблюдавшейся после введения таблеточной композиции немедленного высвобождения, включающей соединение А и метформин (вводимой 2 раза/д 2 дозы). Кроме того, была продемонстрирована эквивалентность AUC между композицией модифицированного высвобождения (росиглитазона и метформина), по сравнению с одной дозой одновременно вводимого росиглитазона и глюкофага XR.- 11011550 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Пероральная лекарственная форма, включающая эродируемое ядро, которое содержит 5-[4-[2-(Nметил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-дион или его фармацевтически приемлемую соль или сольват и метформин или его фармацевтически приемлемую соль или сольват, причем ядро имеет покрытие с одним или несколькими отверстиями, ведущими к ядру, характеризующаяся тем, что покрытие является эродируемым при рН от 4,5 до 8. 2. Пероральная лекарственная форма по п.1, включающая:(i) эродируемое ядро,причем ядро содержит 5-[4-[2-(N-метил-N-(2 пиридил)амино)этокси]бензил]тиазолидин-2,4-дион или его фармацевтически приемлемую соль или сольват и метформин или его фармацевтически приемлемую соль или сольват; и(ii) эродируемое покрытие вокруг указанного ядра, причем покрытие содержит одно или несколько отверстий, проходящих по существу полностью через указанное покрытие, но, по существу, не проникающих в указанное ядро и обеспечивающих сообщение между средой применения и указанным ядром; где высвобождение 5-[4-[2-(N-метил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-диона или его фармацевтически приемлемой соли или сольвата и метформина или его фармацевтически приемлемой соли или сольвата из эродируемого ядра происходит по существу через указанное отверстие (отверстия) и посредством эрозии указанного эродируемого покрытия при рН от 4,5 до 8. 3. Пероральная лекарственная форма по п.1 или 2, где эродируемое покрытие представляет собой энтеросолюбильное покрытие. 4. Пероральная лекарственная форма по п.3, где энтеросолюбильное покрытие является непроницаемым. 5. Пероральная лекарственная форма по п.1, где эродируемое ядро составлено для обеспечения немедленного высвобождения и 5-[4-[2-(N-метил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4 диона или его фармацевтически приемлемой соли или сольвата, и метформина или его фармацевтически приемлемой соли или сольвата. 6. Пероральная лекарственная форма по любому из предыдущих пунктов, где указанная лекарственная форма представляет собой форму таблетки. 7. Способ получения пероральной лекарственной формы по п.1, включающий:(a) получение эродируемого ядра таблетки,содержащего 5-[4-[2-(N-метил-N-(2 пиридил)амино)этокси]бензил]тиазолидин-2,4-дион или его фармацевтически приемлемую соль или сольват и метформин или его фармацевтически приемлемую соль или сольват;(c) создание одного или нескольких отверстий в покрытии. 8. Способ лечения и/или профилактики расстройства, выбранного из сахарного диабета, состояний,связанных с сахарным диабетом, его осложнений, метаболического синдрома, нарушенной устойчивости к глюкозе и нарушенного уровня глюкозы натощак, включающий введение пероральной лекарственной формы, содержащей 5-[4-[2-(N-метил-N-(2-пиридил)амино)этокси]бензил]тиазолидин-2,4-дион или его фармацевтически приемлемую соль или сольват и метформин или его фармацевтически приемлемую соль или сольват по п.1, нуждающемуся в этом человеку или млекопитающему, отличающемуся от человека.
МПК / Метки
МПК: A61P 3/10, A61K 31/4439, A61K 31/155, A61K 9/28
Метки: росиглитазона, композиция, метформина
Код ссылки
<a href="https://eas.patents.su/14-11550-kompoziciya-rosiglitazona-i-metformina.html" rel="bookmark" title="База патентов Евразийского Союза">Композиция росиглитазона и метформина</a>
Предыдущий патент: Новый, содержащий тиотропий порошковый препарат для ингаляции
Следующий патент: Изопентилкарбоксанилиды для борьбы с нежелательными микроорганизмами
Случайный патент: Способ получения эпросартана (варианты)