Способ получения эпросартана (варианты)
Формула / Реферат
1. Способ получения эпросартана, соединения формулы (I)
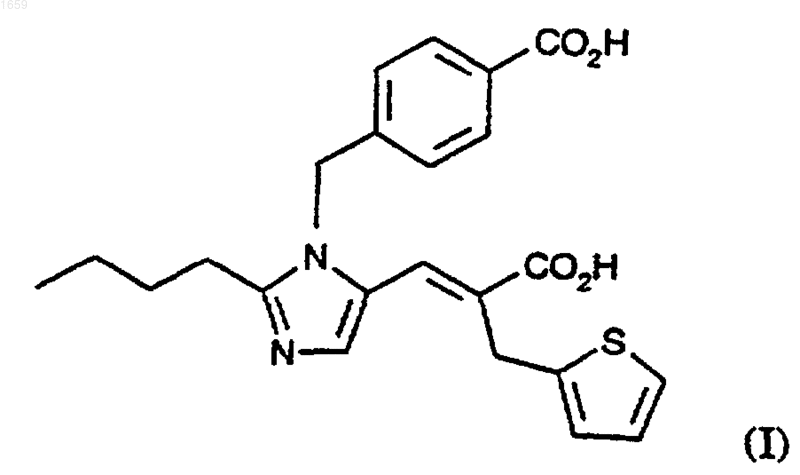
или его фармацевтически приемлемой соли, который заключается во взаимодействии соединения формулы (II)
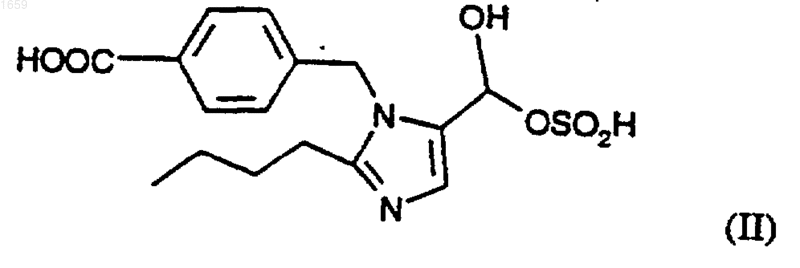
или его соли добавления кислоты или основания, с соединением формулы (III)

где R' представляет собой C1-4алкил, при пониженном давлении в присутствии катализатора и последующего гидролиза сложноэфирного R' и, необязательно, образование фармацевтически приемлемой соли.
2. Способ по п.1, где соединение формулы (II) представляет собой
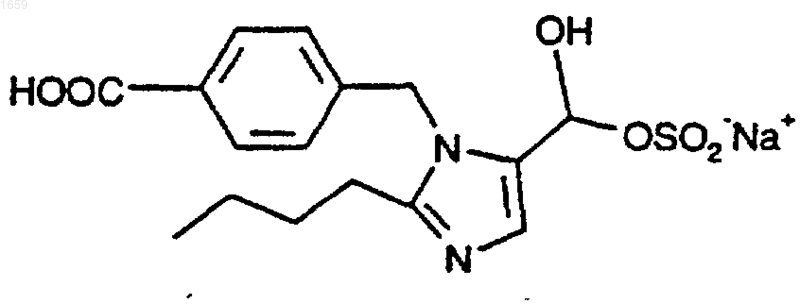
3. Способ по п.1, где фармацевтически приемлемая соль соединения формулы (I) представляет собой соль метансульфоновой кислоты.
4. Способ по п.1, где катализатор представляет собой пропионат пиперидиния и используют избыток пропионовой кислоты.
5. Способ по п.1, где давление понижено до около 9-13 дюймов ртутного столба (30,5-44,0 кПа).
6. Способ по п.1, где давление понижено до 11 дюймов ртутного столба (37,2 кПа).
7. Способ по п.1, где катализатором является пиперидин.
8. Способ получения эпросартана, соединения формулы (I)

или его фармацевтически приемлемой соли, который заключается во взаимодействии соединения формулы (IV)
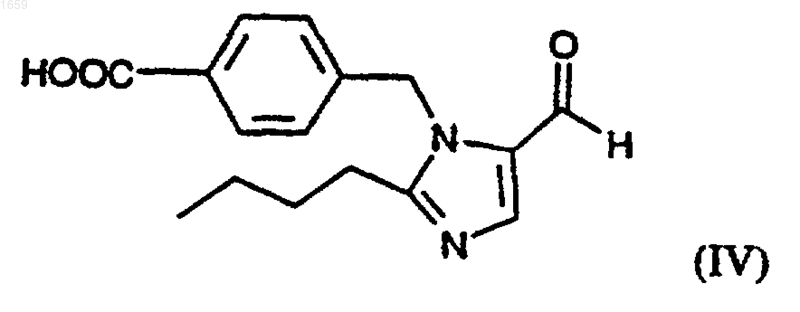
или его соли добавления кислоты или основания, с соединением формулы (III)
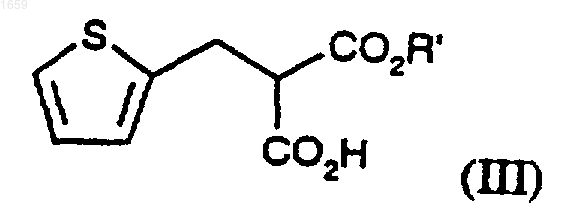
где R' представляет собой C1-4алкил, при пониженном давлении в присутствии катализатора и последующего гидролиза сложноэфирного R' и, необязательно, образования фармацевтически приемлемой соли.
9. Способ по п.8, где фармацевтически приемлемая соль соединения, описываемого формулой (I), представляет собой соль метансульфоновой кислоты.
10. Способ по п.8, где катализатор представляет собой пропионат пиперидиния и используют избыток пропионовой кислоты.
11. Способ по п.8, где давление понижено до около 9-13 дюймов ртутного столба (30,5-44,0 кПа).
12. Способ по п.8, где давление понижено до 11 дюймов ртутного столба (37,2 кПа).
13. Способ по п.8, где катализатором является пиперидин.
Текст
1 Область техники Настоящее изобретение касается способа получения эпросартана. Данное соединение описано в патенте США 5 185 351 в качестве антагониста рецептора ангиотенсина II, который может использоваться при лечении артериальной гипертензии, хронической сердечной недостаточности и почечной недостаточности. Предпосылки изобретения В патенте США 5 185 351 описаны способы получения соединений имидазола. Один из способов, описываемых в данной заявке, представляет собой реакцию взаимодействия альдегида с замещенным полукислотным полусложноэфирным производным малоната. Хотя данный способ приводит к получению заявленных имидазолов, все еще существовала необходимость усовершенствования данного способа при получении соединений, таких как эпросартан, в коммерческих масштабах. В настоящее время обнаружено, что эпросартан может быть получен путем взаимодействия 4-[(2-н-бутил-5-формил-1 Н-имидазол-1-ил) метил]бензойной кислоты или бисульфитного аддитивного производного 4-[(2-н-бутил-5 формил-1 Н-имидазол-1-ил)метил)бензойной кислоты, (РСТ Application WO 95/32189) с моноэтиловым эфиром (2-тиенилметил)пропандиовой кислоты с эффективным получением эпросартана с высоким выходом и высокой степенью чистоты. Эффективность данного способа и качество и выход имидазольного продукта в особенности важны при получении указанного продукта в больших масштабах для терапевтического использования. Описание изобретения Настоящее изобретение относится к способу получения эпросартана, который представляет собой или его фармацевтически приемлемой соли,данный способ заключается во взаимодействии соединения формулы (II) или его соли добавления кислоты или основания, с соединением, описываемым формулой 2 где R' представляет собой C1-4 алкил, при пониженном давлении в присутствии катализатора,такого, как пиперидин или пропионат пиперидиния, в избытке пропионовой кислоты, и последующего гидролиза сложноэфирного R' и,необязательно, образования фармацевтически приемлемой соли. Альтернативно, соединение формулы (I) может быть получено путем взаимодействия соединения формулы (IV) с соединением формулы (III) при пониженном давлении в присутствии катализатора, такого как пиперидин или пропионат пиперидиния, в избытке пропионовой кислоты и последующего гидролиза сложноэфирного R' и, необязательно,образования фармацевтически приемлемой соли. Соли добавления кислоты соединений формул (I) и (II) получают с подходящими неорганическими или органическими кислотами,известными из уровня техники способами. Представительными примерами подходящих кислот являются малеиновая, фумаровая, уксусная, янтарная, хлористоводородная, бромистоводородная, серная, фосфорная или метансульфоновая. Предпочтительно, фармацевтически приемлемой солью добавления кислоты для соединения формулы (I), является соль добавления метансульфоновой кислоты. Соли добавления основания соединений формул (I) и (II) образуются с подходящими неорганическими или органическими основаниями известными из уровня техники методами. Катионные соли получают путем обработки исходного соединения избытком щелочного реагента, такого как гидроксид, карбонат или алкоксид, содержащие соответствующий катион; или подходящим органическим амином. Представительными примерами катионов являются Li+, Na+, K+, Са, Мg и NH+4. Предпочтительной формой соли соединения формулы Как здесь используется, C1-4 алкил обозначает алкильную группу, содержащую 1-4 углерода, разветвленную или неразветвленную. C1-4aлкил включает метил, этил, н-пропил, изопропил, н-бутил, изобутил и трет-бутил. Предпочтительный R' C1-4 алкил является этильной группой. Обычно способ проводят путем объединения 4-[(2-н-бутил-5-формил-1 Н-имидазол-1-ил) метил]бензойной кислоты или бисульфитного аддитивного производного 4-[(2-н-бутил-5 3 формил-1 Н-имидазол-1-ил)метил)бензойной кислоты с моноэтиловым эфиром (2-тиенилметил)пропандиовой кислоты в подходящем растворителе, таком как толуол, в присутствии катализатора, например, в присутствии пропионата пиперидиния и избытка пропионовой кислоты, при подходящей температуре, такой как температура от около 75 С до около 100 С,предпочтительно при температуре 80-85 С, при пониженном давлении, таком как внутреннее давление, пониженное до около 9-13 дюймов ртутного столба (30,5-44,0 кПа), предпочтительное 11 дюймов ртутного столба (37,2 кПа). Сложноэфирные предшественники соединения формулы (I) гидролизуются до соответствующей карбоновой кислоты формулы (I), при использовании основания, такого как водный раствор гидроксида натрия или калия. После этого,как описано выше, могут быть получены фармацевтически приемлемые соли. Альтернативно, 4-[(2-н-бутил-5-формил 1 Н-имидазол-1-ил)метил]бензойная кислота или бисульфитное аддитивное производное 4-[(2-нбутил-5-формил-1 Н-имидазол-1-ил)метил]бензойной кислоты и моноэтиловый эфир (2 тиенилметил)пропандиовой кислоты подвергают взаимодействию с получением (Е)2 бутил-1-[(4-карбоксифенил)метил]-1 Н-имидазол-5-ил]метилен]-2-тиофенпропаной кислоты путем нагревания двух субстратов в толуоле при кипении с обратным холодильником при пониженном давлении и в присутствии пиперидина в качестве катализатора с последующим гидролизом промежуточного этилового эфира(этил(Е)2-бутил-1-[(4-карбоксифенил)метил]-1 Н-имидазол-5-ил]метилен]-2-тиофенпропаноата). В данном варианте получения 4-[(2-нбутил-5-формил-1 Н-имидазол-1-ил)метил)бензойная кислота или бисульфитное аддитивное производное 4-[(2-н-бутил-5-формил-1 Н-имидазол-1-ил)метил]бензойной кислоты, моноэтиловый эфир (2-тиенилметил)пропандиовой кислоты и толуол подаются в стальной резервуар со стеклянной футеровкой и сначала нагревают до 55-60 С с получением гомогенного раствора. Добавляют катализатор (66% моль пиперидин),и реакционную смесь нагревают с обратным холодильником (70-75 С) при пониженном давлении. Кипение с обратным холодильником продолжают в течение 20-35 ч и добавляют дополнительное количество моноэтилового эфира(2-тиенилметил)пропандиовой кислоты. Как только реакция завершается, в сосуд добавляют воду и водный раствор гидроксида натрия, и реакционную смесь нагревают при кипении с обратным холодильником при атмосферном давлении в течение 1-3 ч. Реакция считается завершенной, когда уровень содержания этил 4 будет меньше, чем 2,0%. Реакционную смесь охлаждают до 45-50 С и разделяют водную и органическую фазы. Толуольную фазу отбрасывают. В водную фазу добавляют этанол и раствор подкисляют водным раствором соляной кислоты до рН от 5,0 до 5,4, поддерживая температуру при 50-55 С. Полученную взвесь охлаждают и оставляют перемешиваться при 1015 С в течение 2 ч. Продукт выделяют центрифугированием, промывают и хранят. После этого могут быть получены фармацевтически приемлемые соли, как описано выше. Взаимодействие между 4-[(2-н-бутил-5 формил-1 Н-имидазол-1-ил)метил)бензойной кислотой или бисульфитным аддитивным производным 4-[(2-н-бутил-5-формил-1 Н-имидазол-1-ил)метил]бензойной кислоты и моноэтиловым эфиром (2-тиенилметил)пропандиовой кислоты, катализируемое пиперидином, может быть с успехом проведено в растворителях(и/или системах растворителей), отличных от толуола; такие растворители включают циклогексан, циклогексан : дихлорэтан (12:5 или 1:1),циклогексан : пиридин (12:5) и циклогексан : этилацетат : пиридин (8:3:1). Другие катализаторы, которые с успехом катализируют реакцию между 4-[(2-н-бутил-5 формил-1 Н-имидазол-1-ил)метил)бензойной кислотой или бисульфитным аддитивным производным 4-[(2-н-бутил-5-формил-1 Н-имидазол-1-ил)метил]бензойной кислоты и моноэтиловым эфиром (2-тиенилметил)пропандиовой кислоты в толуоле при пониженном давлении,помимо пиперидина, включают морфолин, 1 метилпиперазин и пирролидин. Настоящее изобретение иллюстрируется следующими далее примерами. Примеры не предназначены для ограничения объема притязаний настоящего изобретения, определенного выше, и охарактеризованного формулой изобретения. Примеры Пример 1. Получение (Е)2-бутил-1[(4-карбоксифенил)метил]-1 Н-имидазол-5-ил] метилен]-2-тиофенпропаной кислоты (эпросартана). Реагенты и растворители 1. Бисульфитное аддитивное производное 4-[(2-н-бутил-5-формил-1 Н-имидазол-1 ил)метил]бензойной кислоты, 12,03 кг, 28,82 моль 5 8. Этанол, 41,2 кг. 9. 6 н НСl до установления рН 5,0-5,2. 10. Вода, 75,0 л. Методика 1. Поместить толуол в реактор (56,5 л). 2. Поместить моноэтиловый эфир (2 тиенилметил)пропандиовой кислоты (15,29 кг,80,9 мас.% по анализу) и бисульфитное аддитивное производное 4-[(2-н-бутил-5-формил-1 Нимидазол-1-ил)метил]бензойной кислоты (12,03 кг, 68,57% 4-[(2-н-бутил-5-формил-1 Н-имидазол-1-ил)метил]бензойной кислоты) в реактор и начать перемешивание. Понизить внутреннее давление до 11 дюймов ртутного столба (37,2 кПа) и нагревать при кипении с обратным холодильником (внутренняя температура реакционной смеси поддерживается между 80-85 С) в течение 1-2 ч. Установить температуру рубашки, равной 110 С. Воду собирать в насадку Дина-Старка. 3. Поместить толуол (19,0 л), затем пропионовую кислоту (6,45 л, 86,46 моль) во второй реактор. Медленно обработать полученный раствор пиперидином (2,85 л, 28,82 моль) при комнатной температуре. Перемешивать полученную смесь приблизительно 30 мин. 4. Продуть первый реактор азотом и уменьшить температуру в рубашке до 80 С. Перенести раствор пропионата пиперидиния пропионовой кислоты в толуоле из второго реактора в первый реактор. Снизить внутреннее давление до 11 дюймов ртутного столба (37,2 кПа) и нагревать при кипении с обратным холодильником (внутренняя температура реакционной смеси поддерживается между 80-85 С). Установить температуру рубашки, равной 140 С. Воду собирать в насадку Дина-Старка. 5. Спустя 7,5 ч количество альдегида 4-[(2 н-бутил-5-формил-1 Н-имидазол-1-ил)метил] бензойная кислота), остающегося в растворе,составляет около 20% и количество оставшегося моноэтилового эфира (2-тиенилметил)пропандиовой кислоты составляет около 20%. Дополнительную загрузку моноэтильного сложного эфира (2-тиенилметил)пропандиовой кислоты(1,53 кг, 5,42 моль) осуществить на 8,5 ч. 6. Спустя 13,5 ч реакция завершается, и реакционную смесь охлаждают до 70 С. (Количество остающегося альдегида около 5%). Добавляют воду (65,0 л) и гидроксид натрия (16,7 кг; 50 мас.%-ный водный раствор), и реакционную смесь доводят до кипения с обратным холодильником,7. Реакционную смесь кипятят с обратным холодильником в течение часа. Проводят анализ реакционной смеси на присутствие пропаноата этил (Е)2-бутил-1-[(4-карбоксифенил)метил]-1 Н-имидазол-5-ил]метилен]-2-тиофена. Если некоторое количество присутствует,кипятят с обратным холодильником еще в течение получаса. Повторить анализ. 6 8. Охладить раствор до 60 С. Разделить слои и добавить этанол (41,2 кг) в водный слой. Медленно довести рН раствора до 5,2 с помощью 6 н. НСl (температура 60 С). Продукт начнет кристаллизоваться (температура 60 С). Охладить до комнатной температуры и перемешивать в течение двух часов. Отфильтровать и промыть продукт водой (2 х 37,5 л). 7. Твердую фазу высушить в вакууме (9,44 кг, 77,2%). Аналитические данные ВЭЖХ. Колонка Температура колонки Скорость потока Приготовление образца Объем введения Длина волны определения Подвижная фаза А Подвижная фаза В Градиентная программаZorbax SB-C18, 3,5 мм, 7,5 см х 4,6 мм 40 С 2,0 мл/мин 8 мл реакционной смеси продувают потоком азота и затем растворяют в 2 мл смеси ацетонитрил:вода 50:50 2, 0 мл 235 нм 0,1 М ацетат аммония (рН=6,7). 0,1 М ацетат аммония: ацетонитрил 50:50 От 0 до 10 мин, от 100% подвижной фазы А до 100% подвижной фазы В при линейном градиенте,5 мин при 100% подвижной фазы В, затем повторное установление равновесия для 5 мин при 100% подвижной фазы А 15 мин Время пробега Время установления равновесия 5 мин Время 4-[(2-н-Бутил-5-формил-1 Н-имидаудерживания зол-1-ил)метил]бензойная кислота(Е)2-Бутил-1-[(4-карбоксифенил) метил]-1 Н-имидазол-5-ил]метилен]4,58 мин 2-тиофенпропановая кислота Моноэтиловый эфир (2-тиенилметил)пропандиовой кислоты Этил (Е)2-бутил-1-[(4-карбоксифенил)метил]-1 Н-имидазол-5 ил]метилен]-2-тиофенпропаноат Пример 2. Получение (Е)2-бутил-1[(4-карбоксифенил)метил]-1 Н-имидазол-5 ил]метилен]-2-тиофенпропаной кислоты (эпросартана). В стальной реакционный сосуд со стеклянной футеровкой помещают 4-[(2-н-бутил-5 формил-1 Н-имидазол-1-ил)метил]бензойную кислоту, моноэтиловый эфир (2-тиенилметил) пропандиовой кислоты (около 1,9 мольных эквивалентов по отношению к опытной 4-[(2-нбутил-5-формил-1 Н-имидазол-1-ил)метил]бензойной кислоты) и толуол (приблизительно 6,3 г на один грамм полученного из анализа количества 4-[(2-н-бутил-5-формил-1 Н-имидазол-1-ил) метил]бензойной кислоты) и нагревают до 5560 С. Добавляют пиперидин (приблизительно 66% моль по отношению к 4-[(2-н-бутил-5 формил-1 Н-имидазол-1-ил)метил]бензойной кислоте. Затем реакционную смесь нагревают с обратным холодильником при азеотропном уда 7 лении воды при пониженном давлении таким образом, чтобы внутренняя температура поддерживалась равной около 70-75 С. Реакцию отслеживают с помощью ИПХ 1 на предмет исчезновения исходной 4-[(2-н-бутил-5-формил 1 Н-имидазол-1-ил)метил]бензойной кислоты. Если 10% исходной 4-[(2-н-бутил-5-формил 1 Н-имидазол-1-ил)метил]бензойной кислоты останется через 12-30 ч, может быть добавлено дополнительное количество моноэтилового эфира (2-тиенилметил)пропандиовой кислоты(0,10 эквивалента на загрузку относительно 4[(2-н-бутил-5-формил-1 Н-имидазол-1-ил)метил] бензойной кислоты), и реакцию продолжают. Когда анализ ИПХ 1 свидетельствует о том, что взаимодействие исходной 4-[(2-нбутил-5 формил-1 Н-имидазол-1-ил)метил]бензойной кислоты по существу завершено (остается 10%), раствор охлаждают до около 60-65 С. Охлажденный раствор обрабатывают деминерализованной водой (6,8 г на грамм опытной 4-[(2 н-бутил-5-формил-1 Н-имидазол-1-ил)метил] бензойной кислоты) и водным 6,7 н раствором гидроксида натрия (около 2,0 мл раствора на грамм опытной 4-[(2-н-бутил-5-формил-1 Нимидазол-1-ил)метил]бензойной кислоты), и смесь нагревают до кипения с обратным холодильником в течение около 1,0-3,5 ч. С помощью ИПХ 2 проводят анализ реакционной смеси для подтверждения полного превращения ( 2,0%) в конечный продукт. После этого раствор охлаждают до около 50 С и слои разделяют. К водной фазе добавляют этиловый спирт (около 5,0 г на грамм опытной 4-[(2-н-бутил-5-формил 1 Н-имидазол-1-ил)метил]бензойной кислоты), и рН устанавливают около 5,0-5,4 с помощью водного 6 н раствора соляной кислоты. Получаемую суспензию перемешивают при около 10-15 С в течение около 2 ч для завершения процесса образования осадка. Продукт выделяют центрифугированием, два раза промывают водой, и влажный осадок используют сразу на следующей стадии. Уточненный выход выделенного в чистом виде продукта на данной стадии обычно равен приблизительно 70-85%. Анализ высушенного образца продукта при помощи ВЭЖХ на основе отношения масс по отношению к стандартному образцу обычно свидетельствует об относительной чистоте,приблизительно равной 97-99%. Аналитические данные ИПХ 1. ВЭЖХ (градиент). Оборудование: Может быть использовано следующее оборудование или его эквивалент: Прибор: Hewlett Packard, Model 1050. Система насоса: тройной, смешивающий градиентный насос низкого давления, HP 1050. Инжектор: автоматический податчик пробы, HP 1050 Series. Детектор: УФ, переменная длина волны,HP 1050 Series. 8 Условия Колонка: Zorbax SB-C18, 7,5 см х 4,6 мм,размер частиц 3,5 микрон, производится компанией Rockland Technologies, Inc Дистрибьютор в США: MAC - MOD Analytical, Inc Разбавляющий растворитель: ацетонитрил:вода марки для ВЭЖХ 1:5. Элюент органический: ацетонитрил марки для ВЭЖХ; водный: 0,1 М ацетат аммония (рН = 6,7). Приготовление подвижной фазы: подвижная фаза А = 0,1 М ацетата аммония. Подвижная фаза В = 0,1 М ацетата аммония : ацетонитрил 50:50. Длина волны детектирования: 235 нм, 0,1 AUPS. Скорость потока 2,0 мл/мин. Температура: 40 С. Объем вводимой пробы: 20 мкл. Время проведения анализа: 20 мин. Время повторного установления равновесия: 6 мин. Приготовление образца: приблизительно 30 мг (2 капли) реакционной смеси отвешивают в 25 мл-овую мерную колбу и сушат в потоке азота. Затем мерную колбу заполняют до объема разбавляющим растворителем. Образец обрабатывают ультразвуком в течение 10 мин и оставляют остывать до комнатной температуры. Градиентная программа 1.) Исходный состав растворителя - 0%-ая подвижная фаза В. 2.) Линейный градиент от 0%-ой до 100%ой подвижной фазы В за 10 мин. 3.) Выдерживание при 100%-ой подвижной фазе В в течение 5 мин. 4.) Линейный градиент от 100%-ой до 0% ой подвижной фазы В в течение 5 минут. 5.) Повторное установление равновесия при 0%-ой подвижной фазе В в течение 6 мин. ИПХ 2. ВЭЖХ (градиент). Оборудование: Может быть использовано следующее оборудование или его эквивалент: Прибор: Hewlett Packard, Model 1050. Система насоса: тройной, смешивающий градиентный насос низкого давления, HP 1050. Инжектор: автоматический податчик пробы, HP 1050 Series. Детектор: УФ, переменная длина волны,HP 1050 Series. Условия: Колонка: Spherisorb SCX, 5 um, 250 mm x 4,6 mm. Разбавляющий растворитель: ацетонитрил: вода марки для ВЭЖХ 1:5. Элюент органический: ацетонитрил марки для ВЭЖХ. Водный буфер А: 11,5 г дигидрофосфата аммония, растворенные в 1000 мл воды, с установлением рН 2,5 с помощью фосфорной кислоты. Приготовление подвижной фазы: подвижная фаза А = 200 мл буфера А, 700 мл воды, 100 мл ацетонитрила. Подвижная фаза В = 200 мл буфера А, 450 мл воды, 350 мл ацетонитрила. Длина волны детектирования: 235 нм. Скорость потока: 2,0 мл/мин. Температура: 60 С. Объем вводимой пробы: 10 мкл. Время проведения анализа: 20 мин. Время повторного установления равновесия: 5 мин. Приготовление образца: перенести 20 мл образца ИПХ в химический стакан на 50 мл. Перемешать и в случае необходимости добавлять метанол (от одного до двух мл) до тех пор,пока раствор не станет гомогенным. При помощи пипетки Пастера перенести четыре капли образца ИПХ (50 мкл) в мерную колбу на 25 мл. Разбавить 20 мл подвижной фазы В и обработать ультразвуком в течение одной минуты. Градиентная программа 1.) Состав растворителя от 0 до 3 мин: 0%ая подвижная фаза В. 2.) Линейный градиент от 0%-ой до 100%ой подвижной фазы В за одну минуту. 3.) Выдерживание при 100%-ой подвижной фазе В в течение 16 мин. 4.) Линейный градиент от 100%-ой до 0%ой подвижной фазы В в течение 5 мин. 5.) Повторное установление равновесия при 0%-ой подвижной фазе В в течение 5 мин. Следует учесть , что настоящее изобретение не ограничивается вариантами реализации,проиллюстрированными выше в настоящем документе, и заявители сохраняют за собой права на проиллюстрированные варианты реализации и все модификации, находящиеся в объеме притязаний следующей формулы изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 10 необязательно, образование фармацевтически приемлемой соли. 2. Способ по п.1, где соединение формулы 3. Способ по п.1, где фармацевтически приемлемая соль соединения формулы (I) представляет собой соль метансульфоновой кислоты. 4. Способ по п.1, где катализатор представляет собой пропионат пиперидиния и используют избыток пропионовой кислоты. 5. Способ по п.1, где давление понижено до около 9-13 дюймов ртутного столба (30,544,0 кПа). 6. Способ по п.1, где давление понижено до 11 дюймов ртутного столба (37,2 кПа). 7. Способ по п.1, где катализатором является пиперидин. 8. Способ получения эпросартана, соединения формулы (I) или его фармацевтически приемлемой соли,который заключается во взаимодействии соединения формулы (IV) или его соли добавления кислоты или основания, с соединением формулы (III) или его фармацевтически приемлемой соли,который заключается во взаимодействии соединения формулы (II) или его соли добавления кислоты или основания, с соединением формулы (III) где R' представляет собой C1-4 алкил, при пониженном давлении в присутствии катализатора и последующего гидролиза сложноэфирного R' и, где R' представляет собой C1-4 алкил, при пониженном давлении в присутствии катализатора и последующего гидролиза сложноэфирного R' и,необязательно, образования фармацевтически приемлемой соли. 9. Способ по п.8, где фармацевтически приемлемая соль соединения, описываемого формулой (I), представляет собой соль метансульфоновой кислоты. 10. Способ по п.8, где катализатор представляет собой пропионат пиперидиния и используют избыток пропионовой кислоты. 11. Способ по п.8, где давление понижено до около 9-13 дюймов ртутного столба (30,544,0 кПа). 12. Способ по п.8, где давление понижено до 11 дюймов ртутного столба (37,2 кПа). 13. Способ по п.8, где катализатором является пиперидин.
МПК / Метки
МПК: C07D 409/06, A61P 9/12
Метки: способ, получения, эпросартана, варианты
Код ссылки
<a href="https://eas.patents.su/6-1659-sposob-polucheniya-eprosartana-varianty.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения эпросартана (варианты)</a>
Предыдущий патент: Хиноксалиндионы
Следующий патент: Салфетка для очистки и ухода в анальной и интимной области, а также в области стомы
Случайный патент: Комбинированный противотуберкулезный препарат










