Конъюгаты эритропоэтина, их применение, фармацевтические композиции и способы лечения
Формула / Реферат
1. Конъюгат, который включает гликопротеин эритропоэтина, имеющий, по меньшей мере, одну свободную аминогруппу и обладающий биологической активностью in vivo, обусловливающей увеличение продуцирования ретикулоцитов и эритроцитов клетками костного мозга, и выбранный из группы, включающей человеческий эритропоэтин и его аналоги, которые имеют последовательность человеческого эритропоэтина, модифицированную добавлением от 1 до 6 сайтов гликозилирования или перегруппировкой, по меньшей мере, одного сайта гликозилирования, при этом гликопротеин ковалентно связан с n поли(этиленгликольными) группами формулы
-CO(CH2)x-(OCH2CH2)m-OR,
где -CO-группа каждой поли(этиленгликольной) группы образует амидную связь с одной из этих аминогрупп и R обозначает (низш.)алкил, х равно 2 или 3, m равно от примерно 450 до примерно 900, n равно 1-3 и n и m выбирают таким образом, чтобы молекулярная масса конъюгата за вычетом гликопротеина эритропоэтина составляла от 20 до 100 кДа.
2. Конъюгат по п.1 формулы
P-[NHCO-(CH2)x-(OCH2CH2)m-OR]n (I)
где x, m, n и R имеют значения, указанные в п.1, а P обозначает остаток гликопротеина без аминогруппы или аминогрупп, которая(ые) образует(ют) амидную связь с поли(этиленгликольной(ыми)) группой(ами).
3. Конъюгат по любому из предыдущих пунктов, где R обозначает метил.
4. Конъюгат по любому из предыдущих пунктов, где m равно от примерно 650 до примерно 750.
5. Конъюгат по любому из предыдущих пунктов, где n равно 1.
6. Конъюгат по любому из предыдущих пунктов, где R обозначает метил, m равно от примерно 650 до примерно 750, а n равно 1.
7. Конъюгат по любому из предыдущих пунктов, имеющий формулу
[CH3O(CH2CH2O)mCH2CH2CH2CO-NH]n-P,
где m равно от 650 до 750, n равно 1, а P имеет значения, указанные в п.2.
8. Конъюгат по любому из предыдущих пунктов, где гликопротеин представляет собой человеческий эритропоэтин.
9. Конъюгат по любому из пп.1-7, при этом гликопротеин, представляющий собой человеческий эритропоэтин, экспрессируется в результате эндогенной активации гена.
10. Конъюгат по любому из пп.1-9, при этом гликопротеин имеет последовательность, представленную в SEQ ID NO:1.
11. Конъюгат по любому из пп.1-8, при этом гликопротеин имеет последовательность человеческого эритропоэтина, модифицированную путем добавления от 1 до 6 сайтов гликозилирования.
12. Конъюгат по любому из пп.1-11, при этом гликопротеин имеет последовательность человеческого эритропоэтина, модифицированную путем модификации, выбранной из группы, включающей
Asn30Thr32,
Asn51Thr53,
Asn57Thr59,
Asn69,
Asn69Thr71,
Ser68Asn69Thr71,
Val87Asn88Thr90.
Ser87Asn88Thr90,
Ser87Asn88Gly89Thr90,
Ser87Asn88Thr90Thr92,
Ser87Asn88Thr90Ala162,
Asn69Thr71Ser87Asn88Thr90,
Asn30Thr32Val87Asn88Thr90,
Asn89Ile90Thr91,
Ser87Asn89Ile90Thr91,
Asn136Thr138,
Asn138Thr140,
Thr125 и
Pro124Thr125.
13. Конъюгат по любому из пп.1-12, при этом гликопротеин имеет последовательность человеческого эритропоэтина и вторую последовательность на карбоксильном конце последовательности человеческого эритропоэтина, причем вторая последовательность содержит, по меньшей мере, один сайг гликозилирования.
14. Конъюгат по п.13, при этом вторая последовательность включает последовательность из последовательности карбоксильного конца человеческого гонадотропина хориона.
15. Конъюгат по п.13, при этом гликопротеин имеет последовательность, выбранную из группы, включающей
(а) последовательность человеческого эритропоэтина и последовательность, представленную в SEQ ID NO:3, на карбоксильном конце последовательности человеческого эритропоэтина,
(б) последовательность, указанную в разделе (а), модифицированную Ser87Asn88Thr90, и
(в) последовательность, указанную в разделе (а), модифицированную Asn30Thr32Val87Asn88Thr90.
16. Конъюгат по любому из пп.1-7, при этом гликопротеин имеет последовательность человеческого эритропоэтина, модифицированную путем перегруппировки, по меньшей мере, одного сайта гликозилирования.
17. Конъюгат по п.16, при этом перегруппировка включает делецию любого из N-связанных сайтов гликозилирования в человеческом эритропоэтине и добавление N-связанного сайта гликозилирования в положение 88 последовательности человеческого эритропоэтина.
18. Конъюгат по п.17, при этом гликопротеин имеет последовательность человеческого эритропоэтина, содержащую модификацию, выбранную из группы, включающей
Gln24Ser87Asn88Thr90,
Gln38Ser87Asn88Thr90 и
Gln83Ser87Asn88Thr90.
19. Композиция, включающая конъюгаты, каждый из которых содержит гликопротеин эритропоэтин, имеющий, по меньшей мере, одну свободную аминогруппу и обладающий биологической активностью in vivo, обусловливающей увеличение продуцирования ретикулоцитов и эритроцитов клетками костного мозга, и выбранный из группы, включающей человеческий эритропоэтин и его аналоги, которые имеют последовательность человеческого эритропоэтина, модифицированную добавлением от 1 до 6 сайтов гликозилирования или перегруппировкой, по меньшей мере, одного сайта гликозилирования, при этом гликопротеин в каждом таком конъюгате ковалентно связан с n поли(этиленгликольными) группами формулы
-CO(CH2)x-(OCH2CH2)m-OR,
где -CO-группа каждой поли(этиленгликольной) группы образует амидную связь с одной из этих аминогрупп и в каждом таком конъюгате R обозначает (низш.)алкил, х равно 2 или 3, m равно от примерно 450 до примерно 900, n равно 1-3 и n и m выбирают таким образом, чтобы молекулярная масса конъюгата за вычетом гликопротеина эритропоэтина составляла от 20 до 100 кДа, причем процентное содержание конъюгатов, в которых n равно 1, составляет, по меньшей мере, 90%.
20. Композиция, которая включает конъюгат по любому из пп.1-18 и в которой процентное содержание конъюгатов, в которых n равно 1, составляет, по меньшей мере, 90%.
21. Композиция по п.19 или 20, в которой процентное содержание конъюгатов, в которых n равно 1, составляет, по меньшей мере, 92%.
22. Композиция по п.21, в которой процентное содержание конъюгатов, в которых n равно 1, составляет, по меньшей мере, 96%.
23. Композиция по п.19 или 20, в которой процентное содержание конъюгатов, в которых n равно 1, составляет от 90 до 96%.
24. Фармацевтическая композиция, включающая конъюгат или композицию по любому из пп.1-23 и фармацевтически приемлемый эксципиент.
25. Применение конъюгата или композиции по любому из пп.1-23 для приготовления лекарственных средств, предназначенных для лечения или профилактики болезней, связанных с анемией у пациентов с хронической почечной недостаточностью (ХПН), больных СПИДом и для лечения раковых больных, подвергающихся химиотерапии.
26. Способ профилактического и/или терапевтического лечения нарушений, включающшх анемию у пациентов с хронической почечной недостаточностью (ХПН), больных СПИДом и раковых больных, подвергающихся химиотерапии, предусматривающий введение пациенту композиции по любому из пп.1-23.
27. Способ получения соединений по любому из пп.1-23, включающий конденсацию соединения формулы II
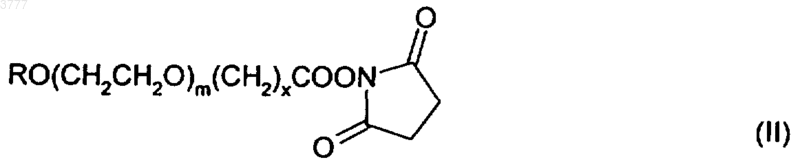
с гликопротеином эритропоэтина, в котором R, m и х имеют значения, указанные в пп.1-6.
28. Соединения по любому из пп.1-3, полученные способом по п.27.
29. Соединения по любому из пп.1-23, предназначенные для лечения болезней, связанных с анемией у пациентов с хронической почечной недостаточностью (ХПН), больных СПИДом и раковых больных, подвергающихся химиотерапии.
Текст
1 Предпосылки создания изобретения Эритропоэз представляет собой процесс образования эритроцитов, который служит для восполнения клеточной деструкции. Эритропоэз является контролируемым физиологическим механизмом, в результате которого образуется такое количество эритроцитов, которого достаточно для соответствующего насыщения ткани кислородом. Встречающийся в естественных условиях человеческий эритропоэтин (hEPO) продуцируется в почке и представляет собой гуморальный фактор плазмы,который стимулирует образование эритроцитов(1957. Встречающийся в естественных условиях ЕРО стимулирует деление и дифференцировку коммитированных эритроидных клеток-предшественников в костном мозге и проявляет свою биологическую активность посредством связывания с рецепторами на эритроидных предшественниках(Krantz B.S. Blood 77: 419 (1991. Эритропоэтин был получен путем биологического синтеза с использованием методики рекомбинантной ДНК (Egrie J.C., Strickland T.W., Lane J. и др. Immunobiol. 72: 213-224 (1986 и является продуктом клонированного человеческого гена ЕРО, встроенного и экспрессируемого в клетках ткани яичника китайского хомячка (СНО-клетки). Первичная структура основной полностью процессированной формы hЕРО приведена в SEQ IDNO:1. В ней присутствуют два дисульфидных мостика между Cys7-Cys161 и Cys29-Cys33. Молекулярная масса полипептидной цепи ЕРО без фрагмента сахара составляет 18236 Да. В интактной молекуле ЕРО примерно 40% молекулярной массы приходится на долю углеводных групп, которые гликозилируют протеин в сайтах гликозилирования протеина (Sasaki Н., Bothner В. Dell А. и Fukuda М. J.Biol. Chem. 262: 12059 (1987. Поскольку человеческий эритропоэтин играет ключевую роль в образовании эритроцитов, этот гормон может найти применение при лечении нарушений крови, для которых характерно продуцирование недостаточных количеств эритроцитов или продуцирование аномальных эритроцитов. В клинических условиях ЕРО применяют для лечения анемии у пациентов с хронической почечной недостаточностью (ХПН) (Eschbach J.W., Egri J.C.,Downing M.R. и др. NEJM 316: 73-78 (1987); Eschbach J.W., Abdulhadi M.H., Browne J.K. и др. Ann.Intern. Med. 110: 108-114 (1989, больных СПИДом и раковых больных, подвергающихся химиотерапии (Danna R.P., Rudnick S.A., Abels R.I. Erythropoietin in Clinical Application - An International Perspective, под ред. M.B. Garnick, New York, NY: Marcel Dekker, 1990, стр. 301-324). Однако биологическая доступность поступающих в продажу терапев 003777 2 тических средств на основе протеинов, таких как ЕРО, ограничена их коротким временем полужизни в плазме и чувствительностью к разложению протеазами. Эти недостатки препятствуют проявлению их максимальной потенциальной активности в клинических условиях. Краткое изложение сущности изобретения Настоящее изобретение относится к конъюгату эритропоэтина, причем этот конъюгат включает гликопротеин эритропоэтина, имеющий по меньшей мере одну свободную аминогруппу и обладающий биологической активностью in vivo, обусловливающей увеличение продуцирования ретикулоцитов и эритроцитов клетками костного мозга, и выбранный из группы, включающей человеческий эритропоэтин и его аналоги, которые имеют последовательность человеческого эритропоэтина, модифицированную добавлением от 1 до 6 сайтов гликозилирования или перегруппировкой по меньшей мере одного сайта гликозилирования, при этом гликопротеин ковалентно связан с "n" поли(этиленгликольными) группами формулы -СО(СН 2)x(ОСH2 СН 2)m-ОR, где -СО-группа (т.е. с карбонил) каждой поли(этиленгликольной) группы образует амидную связь с одной из этих аминогрупп и R обозначает (низш.)алкил, х равно 2 или 3, m равно от примерно 450 до примерно 900, n равно 1-3 и n и m выбирают таким образом, чтобы молекулярная масса конъюгата за вычетом гликопротеина эритропоэтина составляла от 20 до 100 кДа. Изобретение также относится к содержащим предлагаемые конъюгаты композициям, в которых процентное содержание конъюгатов в композиции, когда n равно 1,составляет, по меньшей мере, 90%. По сравнению с немодицированным ЕРО(т.е. ЕРО без присоединенного ПЭГ) и обычными конъюгатами ПЭГ-ЕРО конъюгаты по изобретению отличаются более продолжительным временем полужизни в кровотоке и временем сохранения в плазме, пониженным клиренсом и более высокой активностью, выявленной in vivo в клинических условиях. Конъюгаты по изобретению применяются таким же образом, как и ЕРО. В частности, конъюгаты по изобретению могут применяться для лечения пациентов, стимулируя деление и дифференцировку коммитированных эритроидных клеток-предшественников в костном мозге таким же образом,как это происходит при использовании ЕРО для лечения пациентов. Подробное описание изобретения Настоящее изобретение относится к конъюгату эритропоэтина, причем этот конъюгат включает гликопротеин эритропоэтина, имеющий, по меньшей мере, одну свободную аминогруппу и обладающий биологической активностью in vivo,обусловливающей увеличение продуцирования клетками костного мозга ретикулоцитов и эритроцитов, и выбранный из группы, включающей человеческий эритропоэтин и его аналоги, которые 3 имеют последовательность человеческого эритропоэтина, модифицированную добавлением от 1 до 6 сайтов гликозилирования или перегруппировкой, по меньшей мере, одного сайта гликозилирования, при этом гликопротеин ковалентно связан с-CO(CH2)x-(OCH2CH2)m-OR, где -СО-группа (т.е. с карбонил) каждой поли(этиленгликольной) группы образует амидную связь с одной из этих аминогрупп и R обозначает (низш.)алкил, х равно 2 или 3, m равно от примерно 450 до примерно 900,n равно 1-3 и n и m выбирают таким образом, чтобы молекулярная масса конъюгата за вычетом гликопротеина эритропоэтина составляла от 20 до 100 кДа. Было установлено, что конъюгаты по изобретению могут применяться таким же образом,что и немофицированный ЕРО. Однако конъюгаты по изобретению отличаются более продолжительным временем полужизни в кровотоке и временем сохранения в плазме, пониженным клиренсом и более высокой активностью,выявленной in vivo в клинических условиях. Благодаря этим улучшенным свойствам протеинов конъюгаты по изобретению могут вводиться один раз в неделю вместо 3 раз в неделю, как это требуется для немодифицированного ЕРО. Снижение частоты введения вероятно должно привести к облегчению соблюдения пациентом режима и схемы лечения, что улучшает результат лечения, а также улучшает состояние пациента. По сравнению с обычными, связанными с поли(этиленгликолем) конъюгатами ЕРО конъюгаты, имеющие молекулярную массу и строение линкера, соответствующие конъюгатам по изобретению, обладают повышенной эффективностью, стабильностью, AUC (площадь над кривой), временем полужизни в кровотоке, а также предпочтительной ценой продукта. Конъюгаты по изобретению можно вводить в терапевтически эффективном количестве пациенту таким же способом, которым вводят ЕРО. Терапевтически эффективное количество представляет собой такое количество конъюгата, которое необходимо для проявления биологической активности in vivo, обусловливающей увеличение продуцирования клетками костного мозга ретикулоцитов и эритроцитов. Точное количество конъюгата предпочтительно определяется такими факторами, как конкретный тип состояния, подлежащего лечению, состояние пациента, подвергаемого лечению, а также другими ингредиентами композиции. Так, в частности, вводимая, например,один раз в неделю доза может составлять от 0,01 до 10 мкг/кг веса тела, предпочтительно от 0,1 до 1 мкг/кг веса тела. Фармацевтические композиции, содержащие конъюгат, могут быть приготовлены в виде композиций, которые могут вводиться различными путями больному человеку, страдающему нарушениями крови, для которых характерно продуцирование недостаточных количеств 4 эритроцитов или продуцирование аномальных эритроцитов. Средние терапевтически эффективные количества конъюгатов могут варьироваться и, в частности, должны выбираться согласно рекомендациям и предписаниям квалифицированного лечащего врача. Продукты, представляющие собой гликопротеин эритропоэтин, полученные согласно изобретению, могут быть приготовлены в виде пригодных для инъекции фармацевтических композиций в сочетании с фармацевтически приемлемым носителем или наполнителем по методам, известным в данной области. Так, например, приемлемые композиции описаны в WO 97/09996, WO 97/40850,WO 98/58660 и WO 99/07401. Среди предпочтительных фармацевтически приемлемых носителей,пригодных для приготовления продуктов по изобретению, можно назвать человеческий сывороточный альбумин, человеческие протеины плазмы и т.д. Соединения по изобретению могут быть приготовлены в 10 мМ натрий/калийфосфатном буфере с рН 7, который содержит способствующий поддержанию тоничности агент, например 132 мМ хлорид натрия. Необязательно фармацевтическая композиция может содержать консервант. Фармацевтическая композиция может содержать различные количества эритропоэтина, например 10-1000 мкг/мл, в частности 50 мкг или 400 мкг. Понятие "эритропоэтин" или "ЕРО" относится к гликопротеину, имеющему аминокислотную последовательность, которая представлена в SEQ ID NO:1 или в SEQ ID NO:2 либо практически гомологична ей и биологические свойства которой связаны со стимуляцией продуцирования эритроцитов и стимуляцией деления и дифференцировки коммитированных эритроидных клеток-предшественников в костном мозге. В контексте настоящего описания эти понятия включают такие протеины, которые преднамеренно модифицированы, например, с помощью сайтнаправленного мутагенеза, или модифицированы в результате случайных мутаций. Эти понятия также включают аналоги,имеющие от 1 до 6 дополнительных сайтов гликозилирования, аналоги, имеющие, по меньшей мере, одну дополнительную аминокислоту на карбоксильном конце гликопротеина, причем дополнительная аминокислота включает, по меньшей мере, один сайт гликозилирования, и аналоги, имеющие аминокислотную последовательность, которая включает перегруппировку,по меньшей мере, одного сайта гликозилирования. Эти понятие включают как имеющий естественное происхождение, так и полученный рекомбинантным путем человеческий эритропоэтин. Конъюгаты эритропоэтина по изобретению могут быть представлены формулой I: Р-[NHCO-(CH2)x-(OCH2CH2)m-OR]n (I),где х, m, n и R имеют указанные выше значения. В формуле I символ Р обозначает остаток гликопротеина эритропоэтина, представленный в 5 настоящем описании (т.е. остаток без аминогруппы или аминогрупп, которая(ые) образует(ют) амидную связь с карбонилом, приведенным в формуле (I, который обладает биологической активностью in vivo, обусловливающей увеличение продуцирования клетками костного мозга ретикулоцитов и эритроцитов. В предпочтительном варианте осуществления настоящего изобретения R обозначает метил. Предпочтительно m равно от примерно 650 до примерно 750, а n предпочтительно равно 1. В наиболее предпочтительном варианте осуществления настоящего изобретения R обозначает метил, m равно от примерно 650 до примерно 750, а n предпочтительно равно 1, т.е. конъюгат, как он определен выше, имеет формулу[СН 3 О(СН 2 СН 2O)mСН 2 СН 2 СН 2 СО-NН]n-Р,где m равно 650-750, n равно 1, а Р имеет указанные выше значения. Предпочтительно среднее значение m составляет примерно 680. Предпочтительно гликопротеин в конъюгатах, как они определены выше, представляет собой человеческий эритропоэтин. Человеческий эритропоэтин и аналогичные протеины,как они определены выше, могут экспрессироваться путем эндогенной активации гена. Предпочтительными гликопротеинами человеческого эритропоэтина являются гликопротеины,имеющие последовательность, представленную в SEQ ID NO:1 и в SEQ ID NO:2, наиболее предпочтительно в SEQ ID NO:1. Кроме того, Р может быть выбран из группы, включающей остатки человеческого эритропоэтина или его аналогов, имеющих от 1 до 6 дополнительных сайта гликозилирования. Как более подробно описано ниже, процессы получения и очистки ЕРО хорошо известны в данной области. Под понятием ЕРО подразумевают встречающийся в естественных условиях или рекомбинантный протеин, предпочтительно человеческий, полученный из любого обычного источника, такого как ткани, в результате синтеза протеинов, из культуры клеток с использованием встречающихся в естественных условиях или рекомбинантных клеток. Под это понятие подпадают любые протеины, обладающие активностью ЕРО, такие как мутеины или протеины, модифицированные иным путем. Рекомбинантный ЕРО может быть получен путем экспрессии в клетках линии СНО, ВНK или HeLa с использованием метода рекомбинантной ДНК или путем эндогенной активации гена. Экспрессия протеинов, включая ЕРО, в результате эндогенной активации гена хорошо известна в данной области и описана, например, в патентах US 5733761, US 5641670 и US 5733746 и заявкахWO 93/09222, WO 94/12650, WO 95/31560, WO 90/11354, WO 91/06667 и WO 91/09955, при этом содержание каждого документа включено в настоящее описание в качестве ссылки. Предпочтительными видами ЕРО для получения 6 продуктов гликопротеинов эритропоэтина являются различные виды человеческого ЕРО. Более предпочтительные виды ЕРО представляют собой человеческий ЕРО, имеющий аминокислотную последовательность, представленную в SEQ ID NO:1 или в SEQ ID NO:2, наиболее предпочтительно аминокислотную последовательность, представленную в SEQ ID NO:1 В одном из вариантов осуществления Р может обозначать остаток аналога гликопротеина, имеющий от 1 до 6 дополнительных сайтов гликозилирования. Гликозилирование протеина с помощью одной или нескольких олигосахаридных групп происходит в определенных местах на каркасе полипептида и в значительной степени влияет на такие физиологические свойства протеина, как стабильность протеина, секреция, субклеточная локализация и биологическая активность. Как правило, гликозилирование может быть двух типов. O-связанные олигосахариды присоединяются к остаткам серина или треонина, a N-связанные олигосахариды присоединяются к остаткам аспарагина. Обнаружен один тип олигасахаридов, относящихся как к N-связанным, так и к O-связанным олигосахаридам, который представляет собой Nацетилнейраминовую кислоту (сиаловая кислота), относящуюся к семейству аминосахаров,содержащих 9 или более атомов углерода. Сиаловая кислота, как правило, является концевым остатком как на N-связанных, так и на Oсвязанных олигосахаридах и, поскольку она несет отрицательный заряд, обусловливает кислотные свойства гликопротеина. Человеческий эритропоэтин, имеющий 165 аминокислот, содержит три N-связанных и одну O-связанную олигосахаридные цепи, на долю которых приходится примерно 40% общей молекулярной массы гликопротеина. N-связанное гликозилирование происходит на остатках аспарагина,локализованных в положениях 24, 38 и 83, а Oсвязанное гликозилирование происходит на остатке серина, локализованном в положении 126. Олигосахаридные цепи модифицируют концевыми остатками сиаловой кислоты. Ферментативное удаление всех остатков сиаловой кислоты из гликозилированного эритропоэтина приводит к потере активности in vivo, но при этом сохраняется активность in vitro, поскольку сиалилирование эритропоэтина препятствует его связыванию связывающим протеином печени и последующему клиренсу. Гликопротеины по изобретению включают аналоги человеческого эритропоэтина с одним или с несколькими изменениями в аминокислотной последовательности человеческого эритропоэтина, что приводит к увеличению количества сайтов, к которым присоединяется сиаловая кислота. Эти аналоги гликопротеина могут быть получены сайтнаправленным мутагенезом, и они имеют вставки, делеции или замены аминокислотных остатков, что увеличивает 7 количество или изменяет сайты, доступные для гликозилирования. Аналоги гликопротеина, в которых содержание сиаловой кислоты выше,чем содержание, обнаруженное в человеческом эритропоэтине, получают путем добавления сайтов гликозилирования, которые не нарушают вторичную или третичную конформацию, необходимую для проявления биологической активности. Гликопротеины по изобретению также включают аналоги, имеющие повышенные уровни углевода, присоединенного в сайте гликозилирования, что, как правило, включает замену одной или нескольких аминокислот, близко расположенных к N-связанному или Освязанному сайту. Гликопротеины по изобретению также включают аналоги, имеющие одну или несколько аминокислот, расположенных за карбоксильным концом эритропоэтина и дающих, по меньший мере, один дополнительный сайт для присоединения углевода. Гликопротеины по изобретению также включают аналоги, имеющие аминокислотную последовательность, включающую перегруппировку по меньшей мере одного сайта гликозилирования. Такая перегруппировка сайта гликозилирования включает делецию одного или нескольких сайтов гликозилирования в человеческом эритропоэтине и добавление одного или нескольких не встречающихся в естественных условиях сайтов гликозилирования. Увеличение количества углеводных цепей на эритропоэтине и вследствие этого количества остатков сиаловой кислоты на молекулу эритропоэтина может обусловливать ценные свойства, такие как повышенная растворимость, большая устойчивость к протеолизу,пониженная иммуногенность, повышенное время полужизни в сыворотке и увеличенная биологическая активность. Аналоги эритропоэтина с дополнительными сайтами гликозилирования описаны более подробно в заявке ЕР 0640619,поданной на имя Elliot и опубликованной 1 марта 1995 г. В предпочтительном варианте осуществления гликопротеины по изобретению имеют аминокислотную последовательность, которая включает, по меньшей мере, один дополнительный сайт для гликозилирования, такие как эритропоэтины, имеющие последовательность человеческого эритропоэтина, измененную путем модификации, выбранной из группы, включающей:Pro124Thr125,но не ограничены этими гликопротеинами. Условные обозначения, примененные в настоящем описании для описания аминокислотной последовательности, означают, что положение(я) в аминокислотной последовательности соответствующего немодифицированного протеина (например hEPO, имеющего последовательность SEQ ID NO:1 или SEQ ID NO:2), указанные с помощью верхнего(их) индекса(ов),заменены на аминокислоту(ы), которая(ые) стоит(ят) непосредственно перед соответствующим(и) верхним(и) индексом(ами). Гликопротеин также может являться аналогом, имеющим, по меньшей мере, одну дополнительную аминокислоту на карбоксильном конце гликопротеина, причем дополнительная аминокислота включает, по меньшей мере, один сайт гликозилирования, т.е. понятие "конъюгат", как оно определено выше, также относится к соединению, в котором гликопротеин имеет последовательность, включающую последовательность человеческого эритропоэтина и вторую последовательность на карбоксильном конце последовательности человеческого эритропоэтина, причем вторая последовательность содержит, по меньшей мере, один сайт гликозилирования. Дополнительная аминокислотная последовательность может включать пептидный фрагмент из карбоксильного конца человеческого гонадотропина хориона. Предпочтительно гликопротеин представляет собой аналог, выбранный из группы, включающей (а) человеческий эритропоэтин, имеющий следующую аминокислотную последовательность Ser Ser Ser Ser(SEQ ID NO:3), располагающуюся за карбоксильным концом, (б) аналог, указанный в разделе (а), дополнительно включающий Ser87Asn88Asn88Thr90 EPO. Гликопротеин также может представлять собой аналог, имеющий аминокислотную последовательность, которая включает перегруппировку, по меньшей мере, одного сайта гликозилирования. Перегруппировка может представлять собой делецию любого из N-связанных сайтов, предназначенных для присоединения углевода в человеческом эритропоэтине, и добавление N-связанного сайта, предназначенного для присоединения углевода в положение 88 аминокислотной последовательности человеческого эритропоэтина. Предпочтительно гликопротеин представляет собой аналог, выбранныйAsn88Thr90 EPO. В контексте настоящего описания понятие"(низш.)алкил" означает линейную или разветвленную алкильную группу, имеющую от 1 до 6 атомов углерода. Примеры (низш.)алкильных групп включают метил, этил и изопропил. Согласно настоящему изобретению R обозначает(низш.)алкил. Предпочтительными являются конъюгаты, в которых R обозначает метил. Символ m обозначает количество этиленоксидных звеньев(ОСН 2 СН 2) в поли(этиленоксидной) группе. Одно ПЭГ-звено этиленоксида имеет молекулярную массу примерно 44 Да. Таким образом, молекулярная масса конъюгата (включая молекулярную массу ЕРО) зависит от значения m. В конъюгатах по изобретению m равно от 450 до 900 (что соответствует молекулярной массе от примерно 20 кДа до примерно 40 кДа), предпочтительно от примерно 650 до примерно 750 (что соответствует молекулярной массе примерно 30 кДа). Значение m выбирают таким образом, чтобы образовавшийся конъюгат по изобретению имел физиологическую активность, сопоставимую с активностью немодицированного ЕРО, и указанная активность может быть такой же, более высокой или составлять только часть от активности немодифицированного ЕРО. Понятие"примерно" по отношению к молекулярной массе обозначает определенные усредненные значения, которые находятся в приемлемом диапазоне значений этой величины при определении с использованием общепринятых аналитических методов. Значение m выбирают таким образом,чтобы молекулярная масса каждой поли(этиленгликольной) группы, ковалентно связанной с гликопротеином эритропоэтина, составляла от примерно 20 кДа до примерно 40 кДа, предпочтительно примерно 30 кДа. В конъюгатах по изобретению символ n обозначает количество полиэтиленгликольных групп, ковалентно связанных со свободными аминогруппами (включая -аминогруппы аминокислоты лизина и/или N-концевую аминогруппу) протеина эритропоэтина через амидную(ые) связь(и). Конъюгат по изобретению может иметь одну, две или три ПЭГ-группы на молекулу ЕРО. Символ n обозначает целое число в пределах от 1 до 3, предпочтительно n обозначает 1 или 2 и более предпочтительно n обозначает 1. Соединение формулы I может быть получено из известного полимерного продукта где R и m имеют указанные выше значения, путем конденсации соединения формулы II с гликопротеином эритропоэтина. Соединения формулы II, в которых х равно 3, представляют со 003777 10 бой сукцинимидиловые эфиры масляной кислоты и альфа-(низш.)алкокси-поли(этиленгликоля)[(низш.)алкокси-ПЭГ-СМK]. Соединения формулы II, в которых х равно 2, представляют собой сукцинимидиловые эфиры пропионовой кислоты и альфа-(низш.)алкокси-поли(этиленгликоля) [(низш.)алкокси-ПЭГ-СПК]. Для получения амида может применяться любой обычный метод взаимодействия активированного сложного эфира с амином. В описанном выше взаимодействии приведенный в качестве примера сукцинимидиловый сложный эфир представляет собой уходящую группу, приводящую к образованию амида. Применение сукцинимидиловых сложных эфиров в качестве соединений формулы II с целью получения конъюгатов с протеинами описано в патенте US 5672662, выданном 30 сентября 1997 г. (Harris и др.). Человеческий ЕРО содержит девять свободных аминогрупп, N-концевую аминогруппу плюс -аминогруппу восьми остатков лизина. Когда пэгилирующий реагент объединяли с СМК-соединением формулы II, было установлено, что при рН 7,5 соотношении протеин:ПЭГ 1:3 и температуре реакции 20-25 С получали смесь моно-, ди- и следовых количеств трипэгилированных видов. Когда пэгилирующий реагент представлял собой СПК-соединение формулы II при аналогичных условиях, за исключением того, что соотношение протеин:ПЭГ составляло 1:2, получали первичные монопэгилированные виды. Пэгилированный ЕРО может применяться в виде смеси или в виде различных пэгилированных видов, разделенных с помощью катионообменной хроматографии. Изменяя реакционные условия (например соотношение реагентов, рН, температуру, концентрацию протеина, время реакции и т.д.), можно изменять относительные количества различных пэгилированных видов. Человеческий эритропоэтин (ЕРО) представляет собой человеческий гликопротеин, который стимулирует образование эритроцитов. Его получение и терапевтическое применение подробно описано, например, в US 5547933, US 5621080, ЕР-В 0148605, у Huang S.L., Proc. Natl.(1987). Эритропоэтин для терапевтических целей может быть получен рекомбинантными методами (ЕР-В 0148605, ЕР-В 0209539 и EgrieJ.C., Strickland T.W., Lane J. и др. Immunobiol. 72: 213-224 (1986. Методы экспрессии и получения эритропоэтина в бессывороточной среде описаны, например, в заявке WO 96/35718 (на имя Burg),опубликованной 14 ноября 1996 г., и в ЕР 0513738 (на имя Koch), дата публикации 12 июня 1992 г. Помимо методов, представленных в указанных выше публикациях, также известно, 11 что в бессывороточной среде может быть проведена ферментация рекомбинантных СНОклеток, которые содержат ген ЕРО. Такие методы описаны, например, в ЕР-А-0513738, ЕР-А 0267678 и в общем виде у Kawamoto Т. и др.Analytical Biochem. 130, 445-453 (1983), ЕР-А 0248656, у Kowar J. и Franek F., Methods in Enzymology 421, 277-292 (1986), Bavister В.,Expcology 271, 45-51 (1981), ЕР-А-0481791, ЕРА-0307247, ЕР-А-0343635, WO 88/00967. В ЕР-А-0267678 описано применение ионообменной хроматографии на S-сефарозе, препаративной ЖХВР с обращенной фазой на C8 колонке и гель-фильтрации для очистки ЕРО,полученного в бессывороточной культуре после диализа. В этом отношении стадия гельфильтрации может быть заменена ионообменной хроматографией с высокой скоростью потока на S-сефарозе. Перед ионообменной хроматографией также предлагается осуществлять хроматографию с красителем на колонке типаBlue Trisacryl. Метод очистки рекомбинантного ЕРО описан у Nobuo I. и др. J. Biochem. 107, 352-359(1990). Согласно этому методу перед стадиями очистки ЕРО обрабатывают раствором Tween 20, фенилметилсульфонилфторидом, этилмалеимидом, пепстатином А, сульфатом меди и оксаминовой кислотой. В публикациях, включая заявку WO 96/35718 (на имя Burg), опубликованную 14 ноября 1996 г., описан метод получения эритропоэтина путем ферментации в бессывороточной среде (EPOsf). Удельная активность ЕРО или ЕРОконъюгатов согласно настоящему изобретению может быть определена различными известными в данной области методами. Биологическая активность очищенных ЕРО-протеинов по изобретению проявляется в том, что при введении ЕРО-протеина путем инъекции больным людям в клетках костного мозга увеличивается продуцирование ретикулоцитов и эритроцитов по сравнению с контрольной группой людей, не подвергавшихся инъекции. Биологическая активность ЕРО-протеинов или их фрагментов,полученных и очищенных согласно настоящему изобретению, может быть оценена с помощью методов, описанных у Annable и др. в Bull. Wld.Spec. Issue Erythropoietin BRP Bio, 1997(2). Другой биологический метод определения активности ЕРО-протеина, заключающийся в использовании нормоцитарных мышей (мышей с нормоцитами (зрелыми эритроцитами, описан в примере 4. В изобретении предлагается также композиция, включающая конъюгаты, как они описаны выше. Композиция, включающая, по меньшей мере, 90% моно-ПЭГ-конъюгатов, т.е. в которой n равно 1, может быть получена по методу, описанному в примере 5. Как правило, требуются моноПЭГ-конъюгаты гликопротеинов эритропоэтина, 003777 12 поскольку они обладают тенденцией проявлять более высокую активность по сравнению с диПЭГ-конъюгатами. Процентное содержание моноПЭГ-конъюгатов, а также соотношение моно- и ди-ПЭГ-конъюгатов может контролироваться путем объединения более широкого спектра фракций с целью увеличения процентного содержания моно-ПЭГ-конъюгатов в композиции. Примерно 90%-ное содержание моно-ПЭГ-конъюгатов является хорошим балансом между выходом и активностью. Иногда могут требоваться композиции, в которых, например, содержание моно-ПЭГконъюгатов (n равно 1) составляет, по меньшей мере, 92% или, по меньшей мере, 96%. В одном из вариантов осуществления настоящего изобретения процентное содержание конъюгатов, в которых n равно 1, составляет от 90 до 96%. Изобретение также относится к соответствующим фармацевтическим композициям,включающим конъюгат или композицию, как они описаны выше, и фармацевтически приемлемый эксципиент. Конъюгаты и композиции по изобретению наиболее пригодны для приготовления лекарственных средств, предназначенных для лечения или профилактики болезней, связанных с анемией у пациентов с хронической почечной недостаточностью (ХПН), больных СПИДом и для лечения раковых больных, подвергающихся химиотерапии. Еще одним объектом изобретения является способ профилактического и/или терапевтического лечения нарушений, включающих анемию у пациентов с хронической почечной недостаточностью (ХПН), больных СПИДом и раковых больных, подвергающихся химиотерапии, предусматривающий введение пациенту композиции, как она описана выше. Кроме того, изобретение относится к способу получения описанных выше соединений,причем этот способ включает конденсацию соединения формулы II с гликопротеином эритропоэтина, где R, m и х имеют указанные выше значения. Изобретение также относится к описанным выше соединениям, предназначенным для лечения болезней, связанных с анемией у пациентов с хронической почечной недостаточностью(ХПН), больных СПИДом и раковых больных,подвергающихся химиотерапии. Ниже изобретение проиллюстрировано на примерах, которые не ограничивают его объем. Примеры Пример 1. Ферментация и очистка человеческого ЕРО. а) Получение инокулята и ферментация. Из рабочего банка клеток, созданного из ЕРО-продуцирующей линии клеток СНО (может быть использован штамм АТСС CRL8695, 13 описанный в ЕР 41167 (Genetic Institute, берут один флакон из замороженного в газообразной фазе жидкого азота, хранящегося в соответствующем тэнке. Клетки переносят в стеклянные вращающиеся колбы и культивируют в забуференной бикарбонатом среде во влажном СО 2 инкубаторе. Типичная бессывороточная среда,применяемая для получения инокулята и ферментации, описана в Европейской заявке на патент 513738 на имя Koch, опубликованной 12 июня 1992 г., или в заявке WO 96/35718 на имяBurg, опубликованной 14 ноября 1996 г., и, например, представляет собой среду DMEM/F12(например, фирм JRH Biosciences/Hazleton Biologiсs, Дэнвер, США, порядковый номер 57736) и дополнительно бикарбонат натрия,L+глутамин, D+глюкозу, рекомбинантный инсулин, селенит натрия, диаминобутан, гидрокортизон, сульфат железа (II), аспарагин, аспарагиновую кислоту, серин и стабилизатор для клеток млекопитающих, такой как, например,поливиниловый спирт, метилцеллюлоза, полидекстран, полиэтиленгликоль, Pluronic F68, увеличивающий объем плазмы полигелин (HEMACCEL) или поливинилпирролидон (WO 96/35718). Культуры оценивают с помощью микроскопа на отсутствие загрязняющих микроорганизмов и определяют плотность клеток. Эти тесты проводят на каждой стадии расщепления. После начального периода роста культуру клеток разбавляют свежей средой до получения исходной плотности клеток и подвергают второму циклу роста. Эту процедуру повторяют до тех пор, пока во вращающейся колбе не будет получен объем культуры, равный примерно 2 л. После получения примерно 12 удвоенных объемов по 1-5 л этой культуры их используют в качестве инокулята в 10-литровом ферментере,предназначенном для получения большего объема инокулята. Через 3-5 дней культура из 10-литрового ферментера может использоваться в качестве инокулята для 100-литрового ферментера, предназначенного для получения большего объема инокулята. После культивирования в течение еще 3-5 дней культура из 100-литрового ферментере может использоваться в качестве инокулята для 1000-литрового ферментера, предназначенного для получения продукта. б) Сбор и разделение клеток. Применяют процесс с периодической подпиткой, т.е. когда достигается требуемая плотность клеток, при этом собирают примерно 80% культуры. Оставшуюся культуру пополняют свежей культуральной средой и культивируют до следующего сбора. Один цикл получения состоит максимум из 10 последовательных сборов клеток: 9 частичных сборов и 1 полного сбора в конце ферментации. Сборы производят каждые 3-4 дня. 14 Определенный объем сбора переносят в охлажденный сосуд. Клетки удаляют центрифугированием или фильтрацией и отбрасывают. Содержащий ЕРО супернатант на стадии центрифугирования сразу подвергают фильтрации и собирают во второй охлажденный сосуд. Каждый сбор обрабатывают по-отдельности. Типичный метод очистки ЕРО-протеина описан в заявке WO 96/35718 на имя Burg,опубликованной 14 ноября 1996 г. Этот метод очистки описан ниже. а) Хроматография с использованием голубой сефарозы (Blue Sepharose).Blue Sepharose (фирма Pharmacia) состоит из гранул сефарозы, с поверхностью которых ковалентно связан краситель голубой Cibacron. Поскольку ЕРО более сильно связывается с BlueSepharose, чем большинство небелковых загрязнителей, некоторые белковые загрязнители и ПВА, содержание ЕРО может быть повышено на этой стадии. Элюирование заполненной BlueSepharose колонки осуществляют, повышая концентрацию соли, а также значение рН. Колонку заполняют 80-100 л Blue Sepharose, регенерируют с помощью NaOH и уравновешивают уравновешивающим буфером (хлорид натрия/кальция и ацетат натрия). Загружают полученный из ферментера подкисленный и профильтрованный супернатант. По окончании загрузки колонку промывают сначала буфером,который аналогичен уравновешивающему буферу и который содержит более высокую концентрацию хлорида натрия, а затем трисбуфером. Продукт элюируют трис-буфером и собирают в виде одной фракции в соответствии с основным профилем элюирования. б) Хроматография с использованием ButylButyl Toyopearl 650 С (фирма Toso Haas) представляет собой матрицу, основой которой является полистирол, с которым ковалентно связаны алифатические бутильные фрагменты. Поскольку ЕРО более сильно связывается с этим гелем, чем большинство загрязнителей и ПВА, он может элюироваться с помощью содержащего изопропанол буфера. Колонку заполняют 30-40 л Butyl Toyopearl 650 С, регенерируют с помощью NaOH,промывают трис-буфером и уравновешивают с помощью содержащего изопропанол трисбуфера. Концентрацию изопропанола в элюате, полученном с помощью хроматографии на BlueSepharose, доводят до концентрации изопропанола в уравновешивающем буфере и загружают в колонку. Затем колонку промывают уравновешивающим буфером с повышенной концентрацией изопропанола. Продукт элюируют буфером для элюирования (трис-буфер с высокой концентрацией изопропанола) и собирают в виде одной фракции в соответствии с основным профилем элюирования. 15 в) Хроматография с использованием гидроксиапатитного ультрагеля. Гидроксиапатитный ультрагель (Hydroxyapatite Ultragel фирмы Biosepra) состоит из гидроксиапатита, включенного в агарозную матрицу с целью улучшения механических свойств. ЕРО обладает низкой аффинностью по отношению к гидроксиапатиту и вследствие этого может элюироваться более низкими концентрациями фосфата, чем белковые загрязнители. Колонку заполняют 30-40 л гидроксиапатитного ультрагеля и регенерируют буфером,содержащим фосфат калия/хлорид кальция иNaOH, a затем трис-буфером. Затем ее уравновешивают трис-буфером с низким содержанием изопропанола и хлорида натрия. В колонку загружают элюат, полученный с помощью хроматографии на Butyl Toyopearl. Колонку последовательно промывают уравновешивающим буфером и трис-буфером без изопропанола и хлорида натрия. Продукт элюируют трис-буфером с низким содержанием фосфата калия и собирают в виде одной фракции в соответствии с основным профилем элюирования. г) ЖХВР с обращенной фазой на материале Vydac C4. Материал Vydac C4 (фирма Vydac) для ЖХВР с обращенной фазой состоит из частиц силикагеля, на поверхности которых находятся С 4 алкильные цепи. Отделение ЕРО от белковых загрязнителей основано на различиях в силе их гидрофобных взаимодействий. Элюирование осуществляют в градиенте ацетонитрила в разбавленной трифторуксусной кислоте. Препаративную ЖХВР проводят с использованием колонки из нержавеющей стали (заполненной 2,8-3,2 л силикагеля Vydac C4). Элюат, полученный с помощью хроматографии на гидроксиапатитном ультрагеле, подкисляют,добавляя трифторуксусную кислоту, и загружают в колонку, заполненную Vydac C4. Для промывки и элюирования используют градиент ацетонитрила в разбавленной трифторуксусной кислоте. Фракции собирают и немедленно нейтрализуют фосфатным буфером. Объединяют содержащие ЕРО фракции, которые соответствуют требованиям IPC. д) Хроматография на ДЭАЭ-сефарозе. Материал ДЭАЭ-сефароза (фирма Pharmacia) состоит из диэтиламиноэтильных (ДЭАЭ) групп, ковалентно связанных с поверхностью гранул сефарозы. Связывание ЕРО с ДЭАЭгруппами опосредуется ионными взаимодействиями. Ацетонитрил и трифторуксусную кислоту пропускают через колонку без задержки. После того, как эти вещества смывают, следовые количества загрязнителей удаляют, промывая колонку ацетатным буфером с низким значением рН. Затем колонку промывают нейтральным фосфатным буфером и ЕРО элюируют буфером с повышенной ионной силой. 16 Колонку заполняют ДЭАЭ-сефарозой,предназначенной для хроматографии с высокой скоростью потока. Объем колонки регулируют таким образом, чтобы обеспечить загрузку ЕРО из расчета 3-10 мг ЕРО/мл геля. Колонку промывают водой и уравновешивающим буфером(фосфат натрия/калия). Объединенные фракции,полученные после элюирования с использованием ЖХВР, загружают и колонку промывают уравновешивающим буфером. Затем колонку промывают промывочным буфером (натрийацетатный буфер), а затем промывают уравновешивающим буфером. После этого ЕРО элюируют из колонки с помощью элюирующего буфера (хлорид натрия, фосфат натрия/калия) и собирают в виде одной фракции в соответствии с основным профилем элюирования. Элюат, полученный с колонки, заполненной ДЭАЭ-сефарозой, доводят до определенной проводимости. Полученную субстанцию для приготовления лекарственного средства фильтруют в стерильных условиях в сосуды из тефлона (Teflon) и хранят при -70 С. Пример 2. Пэгилирование ЕРО с помощью мПЭГ-СМК. ЕРО, очищенный по описанному в примере 1 методу в бессывороточной среде (EPOsf),является гомогенным по данным аналитических методов и имеет типичную схему изоформ, состоящую из 8 изоформ. Его удельная биологическая активность составляет 190000 МЕ/мг, как установлено в опыте с использованием нормоцитарных мышей. Примененный пэгилирующий реагент представляет собой метокси-ПЭГ-СМК,т.е. соединение формулы II, в котором R обозначает метил, х равно 3 и m равно 650-750 (в среднем примерно 680, что соответствует средней молекулярной массе примерно в 30 кДа). Реакция пэгилирования. К 100 мг EPOsf (9,71 мл маточного раствора ЕРО с концентрацией 10,3 мг/мл, 548 мкмоля) добавляют 10 мл 0,1 М калий-фосфатного буфера, рН 7,5, содержащего 506 мг метоксиПЭГ-СМК с молекулярной массой 30 кДа (16,5 мкмоля) (полученного от фирмы ShearwaterPolymers Inc., Хантсвилл, шт. Алабама) и перемешивают в течение 2 ч при комнатной температуре (20-23 С). Конечная концентрация протеина составляет 5 мг/мл, а соотношение протеин/ПЭГ-реагент составляет 1:3. Через 2 ч реакцию прекращают, доводя значение рН до 4,5 с помощью ледяной уксусной кислоты, и хранят при -20 С до начала очистки. Очистка. 1. Смесь конъюгатов Примерно 28 мл SP-SEPHAROSE FF(сульфопропильная катионобменная смола) загружают в стеклянную колонку типа AMICON(2,2 х 7,5 см) и уравновешивают 20 мМ ацетатным буфером, рН 4,5, при скорости потока 150 мл/ч. Шесть мл реакционной смеси, содержащей 30 мг протеина, пятикратно разбавляют 17 уравновешивающим буфером и вносят в колонку. Неадсорбированные продукты отмывают буфером, а адсорбированную смесь ПЭГконъюгата элюируют с колонки с помощью 0,175 М NaCl в уравновешивающем буфере. Еще сохранившийся на колонке немодифицированный EPOsf элюируют 750 мМ NaCl. Колонку повторно уравновешивают исходным буфером. Образцы анализируют с помощью электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия (ПААГ-ДСН) и определяют степень их пэгилирования. Установлено,что элюат, полученный с помощью 0,175 МNaCl, содержит моно-, а также ди- и следовые количества трипэгилированных видов, в то время как элюат, полученный с помощью 750 МNaCl, содержит немодифицированный EPOsf. 2. Ди-ПЭГ- и моно-ПЭГ-EPOsf Очищенную смесь конъюгатов, элюированную из колонки на предыдущей стадии, четырехкратно разбавляют буфером и повторно вносят в колонку и промывают, как описано выше. ДиПЭГ-EPOsf и моно-ПЭГ-EPOsf элюируют по отдельности с колонки с помощью 0,1 М NaCl и 0,175 М NaCl соответственно. Проводят элюирование с помощью 750 М NaCl для того, чтобы элюировать немодифицированный EPOsf. В альтернативном варианте реакционную смесь пятикратно разбавляют ацетатным буфером и вносят в колонку, заполненную SPSepharose (0,5 мг протеина/мл геля). Колонку промывают и адсорбированные моно-ПЭГEPOsf, ди-ПЭГ-EPOsf и немодифицированныйEPOsf элюируют по методу, описанному в предыдущем разделе. Результаты. ПЭГ-EPOsf синтезируют с помощью химической конъюгации линейной молекулы ПЭГ со средней молекулярной массой 30 кДа. ПЭГ-EPOsf получают в результате реакции между первичными аминогруппами EPOsf и производным сукцинимидилового эфира ПЭГ-масляной кислоты, где молекулярная масса ПЭГ составляет 30 кДа, приводящей к образованию амидной связи. Полученные результаты обобщены в табл. 1. Очищенная смесь конъюгатов содержит моно- и ди-ПЭГ-EPOsf и не содержит немодифицированный EPOsf, что установлено анализом с использованием ПААГ-ДСН. Смесь конъюгатов включает 23,4 мг или 78% исходного материала. Разделение с помощью катионообменной хроматографии моно- и ди-ПЭГ-EPOsf позволило установить, что соотношение моно- и ди-ПЭГ в смеси конъюгатов составляет примерно 1:1. По завершении реакции соотношение индивидуальных компонентов моно- : ди- : немодифицированный EPOsf составило 40:38:20 (%). Общий выход оказался практически количественным. 18 Таблица 1. Обобщенные результаты по пэгилированию EPOsf. Образец Протеин, мг Выход, % Смесь Rxn. 30 100 Моно 12,0 40 Ди 11,4 38 Немодифициро 6,0 20 ванный Смесь конъюгатов 23,4 78 Пример 3. Пэгилирование ЕРО с помощью мПЭГ-СПК. Различные аликвотные количества EPOsf,указанные в примере 2, подвергают взаимодействию с метокси-ПЭГ-СПК с молекулярной массой 30 кДа (фирма Shearwater Polymers Inc., Хантсвилл, шт. Алабама). Реакцию проводят при соотношении протеин/реагент 1:2 и используют методы очистки, описанные в примере 2. Получают первичные монопэгилированные виды. Пример 4. Активность in vivo пэгилированного ЕРО, определенная с помощью опыта с использованием нормоцитарных мышей. Опыт с использованием нормоцитарных мышей известен в данной области (Pharm. Europa Spec. Issue Erythropoietin BRP Bio, 1997(2 и является методом, описанным в монографии по эритропоэтину Ph. Eur. BRP. Образцы разбавляют смесью бычьего сывороточного альбумина с забуференным фосфатом физиологическим раствором (БСА-3 ФР). Нормальным здоровым мышам возрастом 7-15 недель вводят подкожно 0,2 мл ЕРО-фракции, содержащей непэгилированный ЕРО или три-, ди- или монопэгилированный ЕРО, полученный в примере 2 или 3. Через 6 дней берут кровь путем пункции хвостовой вены и разбавляют таким образом,чтобы в 1 мл раствора окрашенного 0,15 мкМ акридином оранжевым находился 1 мкл крови. Время окрашивания составляет 30-10 мин. Количество ретикулоцитов определяют микрофлуорометрически с использованием проточного цитометра, анализируя гистограмму флуоресценции красного цвета. Количество ретикулоцитов указано в виде абсолютных величин (на 30000 проанализированных эритроцитов). Для получения представленных данных обобщают результаты, получаемые каждый день для группы, состоящей из 5 мышей, и у мышей берут кровь только один раз. В отдельных экспериментах мышам вводят одну дозу немодицированного ЕРО (25 нг ЕРО),смесь ПЭГ(СМК)-ЕРО, полученную в примере 2(10 нг конъюгата) и буферный раствор. Полученные результаты приведены в табл. 2. Эти результаты свидетельствуют о более высокой активности и пролонгированном времени полужизни пэгилированных видов ЕРО, о чем гово 19 рит существенное увеличение количества ретикулоцитов и сдвиг максимального количества ретикулоцитов при использовании одной и той же дозы/мышь (10 нг) по сравнению с дозой 25 нг немодифицированного ЕРО. Таблица 2 Вре ЕРО мя, (немоч дифицированный) 72 96 ч 120 144 Смесь конъюгатов ПЭГЕРО СМК Пример 5. Получение в основном моноПЭГ-ЕРО Реакция пэгилирования. В качестве исходного продукта используют 100 мг (5,48 мкмоля) EPOsf в 100 мМ калийфосфатном буфере, рН 7,5, полученный согласно примеру 1, и к нему добавляют 329 мг (10,96 мкмоля) реагента ПЭГ-СМК с мол. массой 30 кДа, растворенного в 3 мл 1 мМ НСl. Добавляют еще 100 мМ калий-фосфатный буфер, рН 7,5,для доведения объема до 20 мл. Конечная концентрация протеина составляет 5 мг/мл, а соотношение протеин/ПЭГ составляет 1:2. Реакционную смесь перемешивают в течение 2 ч при температуре окружающей среды (20-22 С). Через 2 ч реакцию прекращают, доводя значение рН до 4,5 с помощью ледяной уксусной кислоты, и хранят при -20 С до начала очистки. Очистка. Полученную на предыдущей стадии реакционную смесь разбавляют в соотношении 1:5 10 мМ ацетатом натрия, рН 4,5, и вносят в 300 мл SPSepharose FF (сульфопропильная катионобменная смола), загруженной в колонку размером 4,2 х 19 см. Колонку предварительно уравновешивают таким же буфером. Выходящие с колонки продукты исследуют при длине волны 280 нм с помощью УФ-монитора типа Gilson и оценивают с помощью записывающего устройства Kipp и Zonen. Колонку промывают уравновешивающим буфером, используя 300 мл или объем, равный объему 1 слоя, с целью удаления избытка реагентов, побочных продуктов реакции и олигомерного ПЭГЕРО. Затем осуществляют промывку 100 мМ NaCl,используя объем, равный объему 2 слоев, с целью удаления ди-ПЭГ-ЕРО. Затем элюируют моноПЭГ-ЕРО с помощью 200 мМ NaCl. В процессе элюирования моно-ПЭГ-ЕРО первые 50 мл пика протеина отбрасывают и моно-ПЭГ-ЕРО собирают в виде фракции объемом 150 мл. Немодифицированный EPOsf, оставшийся на колонке, элюируют 750 мМ NaCl. Все элюирующие буферы готовят в уравновешивающем буфере. Все элюированные образцы анализируют с помощью ПААГ 20 ДСН и с помощью хроматографии высокого разрешения с вытеснением по размерам (ХВП). Пул моно-ПЭГ-ЕРО, который получен из фракции объемом 150 мл и который не имеет обнаруживаемых количеств немодифицированного EPOsf,затем концентрируют до концентрации 4,5-7,5 мг/мл и подвергают диафильтрации (фильтрации посредством диализа) в противотоке буфера для хранения, представляющего собой 10 мМ фосфат калия, 100 мМ NaCl, рН 7,5. Концентрирование/диафильтрацию проводят при температуре окружающей среды, используя систему MilliporeLabscale8M TFF System, снабженную мембраной типа Millipore Pellicon XL Biomax 50, пропускающей продукты с максимальной молекулярной массой 5 кДа. Концентрированный моно-ПЭГ-ЕРО стерилизуют фильтрацией и хранят в замороженном состоянии при -20 С. Примерно 75% EPOsf было пэгилировано. После очистки общий выход моно-ПЭГ-ЕРО без обнаруживаемых количеств немодифицированногоEPOsf составил -30%, выход ди-ПЭГ-ЕРО составил примерно 25%. Оставшийся протеин представлен олигомерами и непэгилированным EPOsf. Пул моно-ПЭГ-ЕРО, полученный из фракции объемом 150 мл, содержал примерно 90% моно-ПЭГ-ЕРО и примерно 10% ди-ПЭГ-ЕРО. ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Конъюгат, который включает гликопротеин эритропоэтина, имеющий, по меньшей мере, одну свободную аминогруппу и обладающий биологической активностью in vivo, обусловливающей увеличение продуцирования ретикулоцитов и эритроцитов клетками костного мозга, и выбранный из группы, включающей человеческий эритропоэтин и его аналоги, которые имеют последовательность человеческого эритропоэтина, модифицированную добавлением от 1 до 6 сайтов гликозилирования или перегруппировкой, по меньшей мере, одного сайта гликозилирования, при этом гликопротеин ковалентно связан с n поли(этиленгликольными) группами формулы-СО(СH2)x-(ОСH2 СH2)m-OR,где -СО-группа каждой поли(этиленгликольной) группы образует амидную связь с одной из этих аминогрупп и R обозначает (низш.)алкил, х равно 2 или 3, m равно от примерно 450 до примерно 900, n равно 1-3 и n и m выбирают таким образом, чтобы молекулярная масса конъюгата за вычетом гликопротеина эритропоэтина составляла от 20 до 100 кДа. 2. Конъюгат по п.1 формулы(I) где х, m, n и R имеют значения, указанные в п.1,а Р обозначает остаток гликопротеина без аминогруппы или аминогрупп, которая(ые) образует(ют) амидную связь с поли(этиленгликольной(ыми группой(ами). 3. Конъюгат по любому из предыдущих пунктов, где R обозначает метил. 22 4. Конъюгат по любому из предыдущих пунктов, где m равно от примерно 650 до примерно 750. 5. Конъюгат по любому из предыдущих пунктов, где n равно 1. 6. Конъюгат по любому из предыдущих пунктов, где R обозначает метил, m равно от примерно 650 до примерно 750, а n равно 1. 7. Конъюгат по любому из предыдущих пунктов, имеющий формулу[СН 3 О(СН 2 СН 2O)mСН 2 СН 2 СН 2 СО-NH]n-Р,где m равно от 650 до 750, n равно 1, а Р имеет значения, указанные в п.2. 8. Конъюгат по любому из предыдущих пунктов, где гликопротеин представляет собой человеческий эритропоэтин. 9. Конъюгат по любому из пп.1-7, при этом гликопротеин, представляющий собой человеческий эритропоэтин, экспрессируется в результате эндогенной активации гена. 10. Конъюгат по любому из пп.1-9, при этом гликопротеин имеет последовательность,представленную в SEQ ID NO:1. 11. Конъюгат по любому из пп.1-8, при этом гликопротеин имеет последовательность человеческого эритропоэтина, модифицированную путем добавления от 1 до 6 сайтов гликозилирования. 12. Конъюгат по любому из пп.1-11, при этом гликопротеин имеет последовательность человеческого эритропоэтина, модифицированную путем модификации, выбранной из группы,включающейPro124Thr125. 13. Конъюгат по любому из пп.1-12, при этом гликопротеин имеет последовательность человеческого эритропоэтина и вторую последовательность на карбоксильном конце последовательности человеческого эритропоэтина,причем вторая последовательность содержит, по меньшей мере, один сайт гликозилирования. 14. Конъюгат по п.13, при этом вторая последовательность включает последовательность из последовательности карбоксильного конца человеческого гонадотропина хориона. 15. Конъюгат по п.13, при этом гликопротеин имеет последовательность, выбранную из группы, включающей(а) последовательность человеческого эритропоэтина и последовательность, представленную в SEQ ID NO:3, на карбоксильном конце последовательности человеческого эритропоэтина,(б) последовательность, указанную в разделе (а), модифицированную Ser87Asn88Thr90, иAsn88Thr90. 16. Конъюгат по любому из пп.1-7, при этом гликопротеин имеет последовательность человеческого эритропоэтина, модифицированную путем перегруппировки, по меньшей мере,одного сайта гликозилирования. 17. Конъюгат по п.16, при этом перегруппировка включает делецию любого из Nсвязанных сайтов гликозилирования в человеческом эритропоэтине и добавление N-связанного сайта гликозилирования в положение 88 последовательности человеческого эритропоэтина. 18. Конъюгат по п.17, при этом гликопротеин имеет последовательность человеческого эритропоэтина, содержащую модификацию,выбранную из группы, включающейGln83Ser87Asn88Thr90. 19. Композиция, включающая конъюгаты,каждый из которых содержит гликопротеин эритропоэтин, имеющий, по меньшей мере, одну свободную аминогруппу и обладающий биологической активностью in vivo, обусловливающей увеличение продуцирования ретикулоцитов и эритроцитов клетками костного мозга, и выбранный из группы, включающей человеческий эритропоэтин и его аналоги, которые имеют последовательность человеческого эритропоэтина, модифицированную добавлением от 1 до 6 сайтов гликозилирования или перегруппировкой, по меньшей мере, одного сайта гликозилирования, при этом гликопротеин в каждом таком конъюгате ковалентно связан с n поли(этиленгликольными) группами формулы-CO(CH2)x-(OCH2CH2)m-OR,где -СО-группа каждой поли(этиленгликольной) группы образует амидную связь с одной из этих аминогрупп и в каждом таком конъюгате R обозначает (низш.)алкил, х равно 2 или 3, m равно от примерно 450 до примерно 900, n равно 1-3 иn и m выбирают таким образом, чтобы молеку 24 лярная масса конъюгата за вычетом гликопротеина эритропоэтина составляла от 20 до 100 кДа, причем процентное содержание конъюгатов, в которых n равно 1, составляет, по меньшей мере, 90%. 20. Композиция, которая включает конъюгат по любому из пп.1-18 и в которой процентное содержание конъюгатов, в которых n равно 1, составляет, по меньшей мере, 90%. 21. Композиция по п.19 или 20, в которой процентное содержание конъюгатов, в которыхn равно 1, составляет, по меньшей мере, 92%. 22. Композиция по п.21, в которой процентное содержание конъюгатов, в которых n равно 1, составляет, по меньшей мере, 96%. 23. Композиция по п.19 или 20, в которой процентное содержание конъюгатов, в которыхn равно 1, составляет от 90 до 96%. 24. Фармацевтическая композиция, включающая конъюгат или композицию по любому из пп.1-23 и фармацевтически приемлемый эксципиент. 25. Применение конъюгата или композиции по любому из пп.1-23 для приготовления лекарственных средств, предназначенных для лечения или профилактики болезней, связанных с анемией у пациентов с хронической почечной недостаточностью (ХПН), больных СПИДом и для лечения раковых больных, подвергающихся химиотерапии. 26. Способ профилактического и/или терапевтического лечения нарушений, включающих анемию у пациентов с хронической почечной недостаточностью (ХПН), больных СПИДом и раковых больных, подвергающихся химиотерапии, предусматривающий введение пациенту композиции по любому из пп.1-23. 27. Способ получения соединений по любому из пп.1-23, включающий конденсацию соединения формулы II с гликопротеином эритропоэтина, в котором R,m и х имеют значения, указанные в пп.1-6. 28. Соединения по любому из пп.1-3, полученные способом по п.27. 29. Соединения по любому из пп.1-23,предназначенные для лечения болезней, связанных с анемией у пациентов с хронической почечной недостаточностью (ХПН), больных СПИДом и раковых больных, подвергающихся химиотерапии.
МПК / Метки
МПК: C12N 15/12, A61K 38/18, A61P 7/06, C07K 14/505
Метки: конъюгаты, лечения, фармацевтические, способы, применение, эритропоэтина, композиции
Код ссылки
<a href="https://eas.patents.su/13-3777-konyugaty-eritropoetina-ih-primenenie-farmacevticheskie-kompozicii-i-sposoby-lecheniya.html" rel="bookmark" title="База патентов Евразийского Союза">Конъюгаты эритропоэтина, их применение, фармацевтические композиции и способы лечения</a>
Предыдущий патент: Производные 6-деоксиэритромицина, способ их получения и их применение в качестве лекарственных средств
Следующий патент: Матирующие агенты для термически отверждаемых систем
Случайный патент: Контейнер с крышкой

















