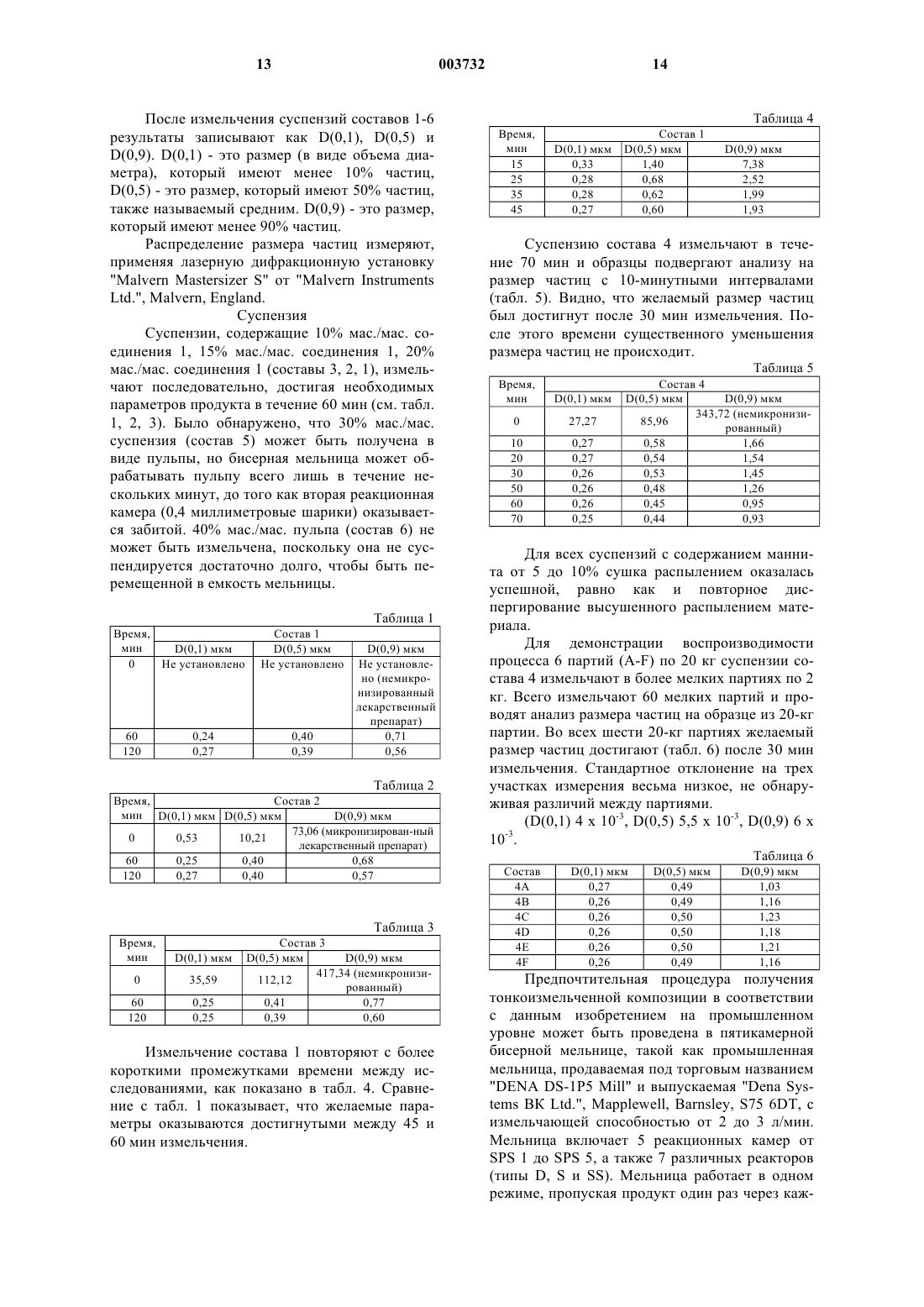
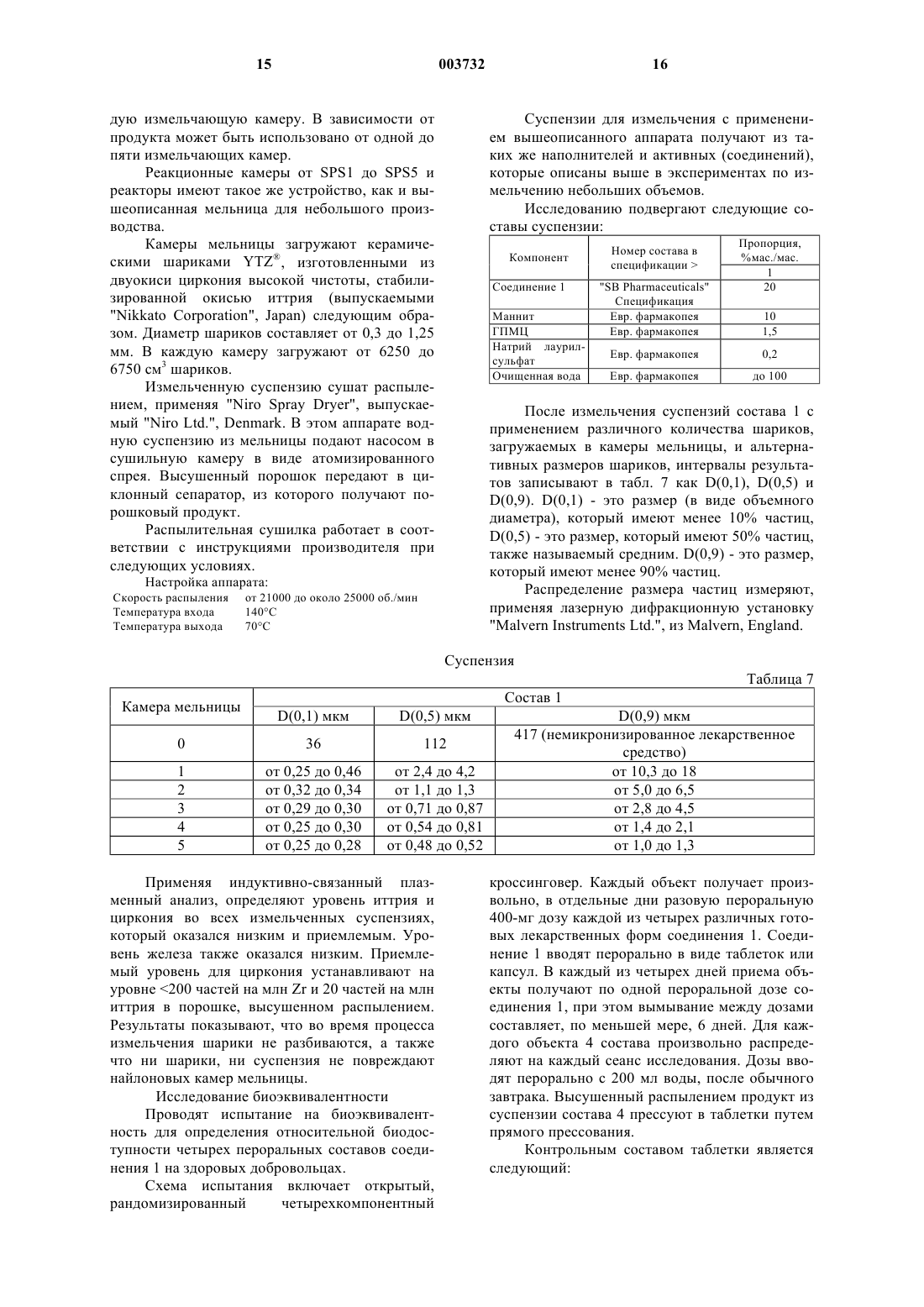
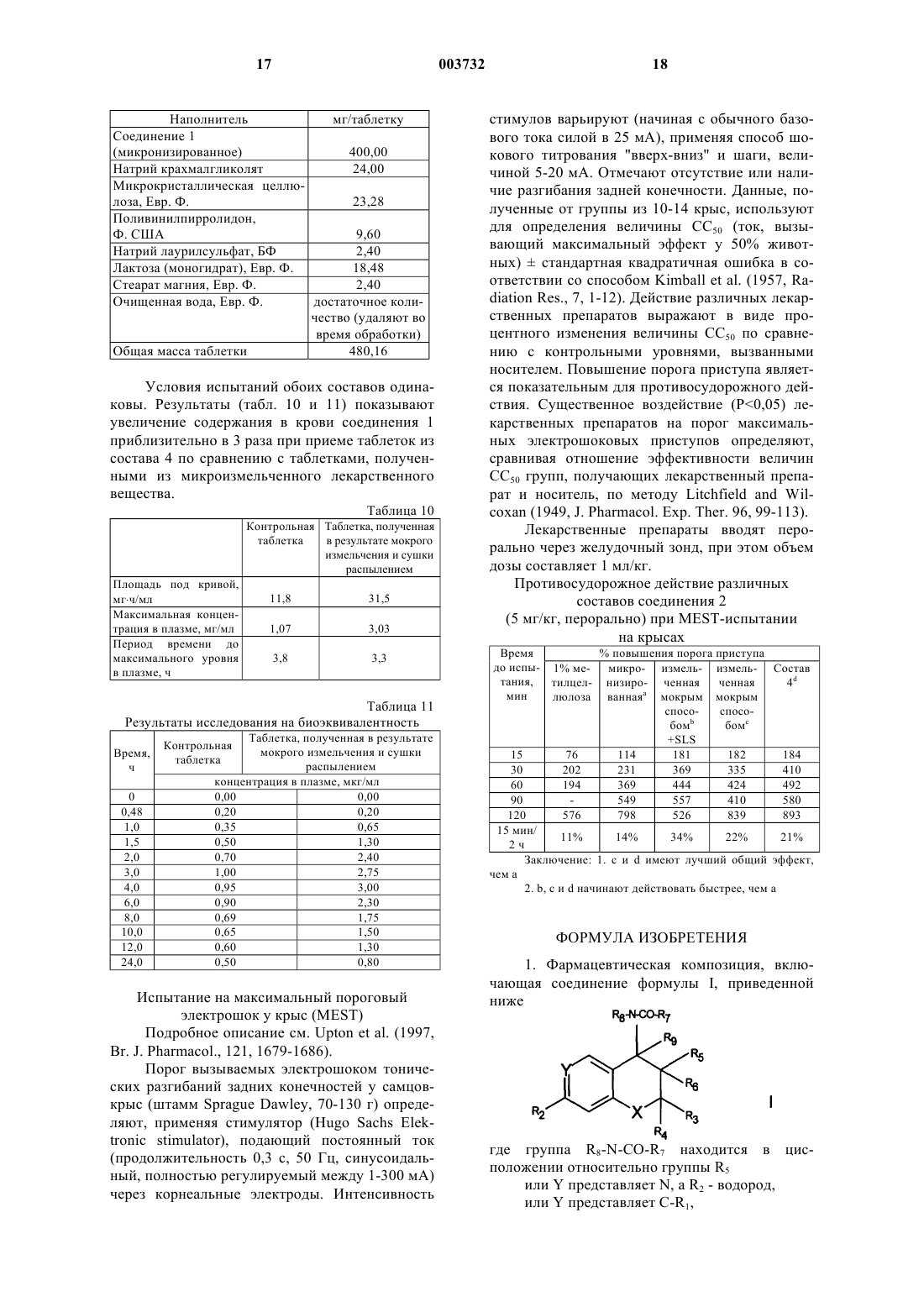
Фармацевтические композиции, содержащие микронизированные бициклические лекарственные средства
Номер патента: 3732
Опубликовано: 28.08.2003
Авторы: Найт Венди Энн, Холланд Симон Джозеф, Дамплтон Дэвид Роберт, Леонард Грэхэм Стэнли
Формула / Реферат
1. Фармацевтическая композиция, включающая соединение формулы I, приведенной ниже
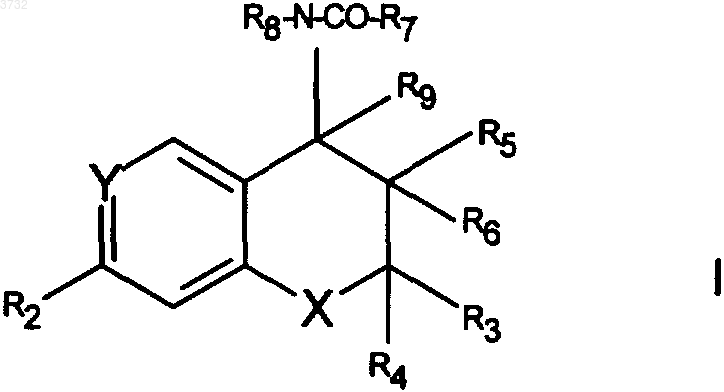
где группа R8-N-CO-R7 находится в цис-положении относительно группы R5
или Y представляет N, a R2 - водород,
или Y представляет C-R1,
любой из R1 и R2 является водородом, а другой выбран из группы, содержащей водород, C3-8циклоалкил, C1-6алкил, необязательно прерванный кислородом или замещенный гидрокси, C1-6алкокси или замещенный аминокарбонил, C1-6алкилкарбонил, C1-6алкоксикарбонил, C1-6алкилкарбонилокси, C1-6алкокси, нитро, циано, галоген, трифторметил, CF3S или группу CF3-A-, где A представляет -CF2-, -CO-, -CH2- или CH(OH), трифторметокси, C1-6 алкилсульфинил, C1-6алкилсульфонил, C1-6алкоксисульфинил, C1-6алкоксисульфонил, арил, гетероарил, арилкарбонил, гетероарилкарбонил, арилсульфинил, гетероарилсульфинил, арилсульфонил, гетероарилсульфонил, C1-6алкилкарбониламино, C1-6алкоксикарбониламино, C1-6алкилтиокарбонил, C1-6алкокситиокарбонил, C1-6алкилтиокарбонилокси, 1-меркапто C2-7алкил, формил или аминосульфинил, аминосульфонил или аминокарбонил, любой аминоостаток, необязательно замещенный одной или двумя C1-6алкильными группами, или C1-6алкилсульфиниламино, C1-6алкилсульфониламино, C1-6алкоксисульфиниламино, или C1-6алкоксисульфониламино, или этиленил, замещенный на конце C1-6алкилкарбонилом, нитро или циано, или -C(C1-6алкил) NOH или -C(C1-6 алкил)NNH2, или один из R1 и R2 представляет нитро, циано или C1-3алкилкарбонил, а другой представляет метокси или амино, необязательно замещенный одним или двумя C1-6алкилом или C2-7 алканоилом;
один из R3 и R4 представляет водород или C1-4алкил, а другой - C1-4алкил, или R3 и R4 вместе представляют C2-5 полиметилен;
R5 представляет C1-6алкилкарбонилокси, бензоилокси, ONO2, бензилокси, фенилокси или C1-6алкокси, a R6 и R9 - водород, или R5 - гидрокси, R6 - водород или C1-2алкил, a R9 - водород;
R7 - фторфенил; R8 - водород или C1-6алкил; а
X - кислород или NR10, где R10 - водород или C1-6алкил;
или
где группа R8-N-CO-R7 находится в цис-положении относительно группы R5,
любой из R1 и R2 представляет водород, а другой выбран из группы, включающей группу CF3-A-, где A представляет SO2, SO, CH2-O или CONH или группу CF2H-A'-, где A' - кислород, сера, SO, SO2, CF2 или CFH; перфтор C2-6алкилсульфонил, фосфоно, арилкарбонилокси, гетероарилкарбонилокси, или
R1 и R2 вместе представляют (CH2)4- или -CH=CH-CH=CH-, триазольное или оксадиазольное кольцо;
один из R3 и R4 - водород или C1-4алкил, а другой - CF3 или CH2Xa, где Xa - фтор, хлор, бром, йод, C1-4алкокси, гидрокси, C1-4алкилкарбонилокси, -S-C1-4алкил, нитро, амино, необязательно замещенный одной или двумя C1-4алкильными группами; циано или C1-4алкоксикарбонил, или R3 и R4 вместе являются C2-5 полиметиленом, необязательно замещенным C1-4алкилом;
R7 - гетероарил или фенил, которые оба необязательно замещены один или несколько раз, независимо, группой или атомом, выбранным из хлор, фтор, бром, йод, нитро, амино, необязательно замещенным один или два раза C1-4алкилом, циано, азидо, C1-4алкилом, C1-4алкокси, трифторметокси и трифторметилом; и
R8 - OR9 или NHCOR10, где R9 - водород, C1-6алкил, формил, C1-6алканоил, ароил или арил-C1-6алкил, a R10 - водород, C1-6 алкил, C1-6алкокси, моно или ди-C1-6алкиламино, амино, амино-C1-6алкил, гидрокси-C1-6алкил, галоген-C1-6алкил, C1-6ацилокси-C1-6алкил, C1-6алкоксикарбонил-C1-6алкил, арил или гетероарил,
в форме микрочастиц; указанная композиция имеет такой гранулометрический состав частиц, что средняя величина среднего объемного диаметра находится в интервале от 350 до 700 нм:
2. Композиция по п.1, в которой частицы соединений формулы I характеризуются мономодальным распределением по размерам.
3. Композиция по п.2, в которой более 10% частиц имеют объемный диаметр 280 нм или ниже, а не менее 90% частиц имеют объемный диаметр 2000 нм или ниже.
4. Композиция по любому из пп.1-3, в которой средний объемный диаметр находится в интервале от 450 до 550 нм.
5. Композиция по п.4, в которой 10% частиц имеют объемный диаметр 260 нм или ниже, а 90% частиц имеют объемный диаметр 1450 нм или ниже.
6. Композиция по любому из пп.1-5, полученная путем мокрого измельчения соединений формулы I в виде водной дисперсии.
7. Композиция по п.6, полученная путем мокрого измельчения с применением многокамерной шаровой мельницы за один проход или в результате рециркуляции продукта между камерами.
8. Композиция по п.6 или 7, полученная с применением керамических шариков оксидов редкоземельных металлов в качестве измельчающей среды.
9. Композиция по п.7 или 8, полученная с применением многокамерной мельницы, в которой шарики в одной камере имеют меньший диаметр, чем шарики в других камерах.
10. Композиция по п.9, полученная с применением шариков размером между 0,4 и 1,25 мм в каждой камере.
11. Композиция по любому из пп.1-10, включающая растворимый носитель, применяемый в качестве наполнителя для сушки распылением.
12. Композиция по п.10, в которой растворимым носителем является маннит.
13. Композиция по любому из пп.1-12, включающая поверхностно-активное вещество для поддержания частиц в суспензии во время измельчения и повторного суспендирования.
14. Композиция по п.13, в которой поверхностно-активным веществом является натрий лаурилсульфат.
15. Композиция по любому из пп.1-14, включающая вещество для предотвращения агломерации, действующее после введения фармацевтического состава пациенту.
16. Композиция по п.15, в которой веществом, предотвращающим агломерацию, является гидроксипропилметилцеллюлоза.
17. Способ получения композиции в виде микрочастиц, в которой лекарственным веществом является соединение формулы I, включающий мокрое измельчение лекарственного препарата в виде водной дисперсии в многокамерной шаровой мельнице с циркуляцией продукта между камерами, при этом водная дисперсия содержит растворимый носитель, подходящий в качестве наполнителя для распыления сушкой, поверхностно-активное вещество для поддержания частиц в суспензии или повторной суспензии и вещество для предотвращения агломерации, действующее после введения фармацевтического состава пациенту, а также сушку распылением водной дисперсии после измельчения.
18. Способ по п.17, в котором измельчаемая водная дисперсия включает примерно от 10 до 30% мас./мас. соединения формулы I, примерно от 4 до 15% мас./мас. растворимого носителя, примерно от 0,1 до 0,4% мас./мас. поверхностно-активного вещества и примерно от 1 до 2% мас./мас. вещества, предотвращающего агломерацию.
19. Способ лечения и/или профилактики состояния тревоги, мании, депрессии, паничесъшх расстройств и/или агрессии, нарушений, связанных с субарахноидальным кровоизлиянием или невральным шоком, последствий, вызываемых отменой веществ, таких как кокаин, никотин, алкоголь и бензодиазепины, нарушений, подлежащих лечению и/или профилактике противосудорожными препаратами, таких как эпилепсия, включая посттравматическую эпилепсию, болезнь Паркинсона, психоз, мигрень, церебральная ишемия, болезнь Альцгеймера и другие дегенеративные заболевания, такие как хорея Хантингдона, шизофрения, навязчивые компульсивные состояния, неврологические дефициты, связанные со СПИДом, нарушения сна (включая нарушения циркадного ритма, бессонницу и нарколепсию), тики (например, синдром Жиль де ла Туретта), травматическое повреждение мозга, шум в ушах, невралгию, особенно невралгию тройничного нерва, невропатическую боль, зубную боль, боль при раке, неправильную нейронную активность, приводящую к нейродистезии при таких заболеваниях, как диабет, рассеянный склероз и заболевание двигательных нейронов, атаксия, мышечная ригидность (спастичность), дисфункция височно-нижнечелюстного сустава и/или боковой амиотрофический склероз, включающий введение больному, нуждающемуся в этом, эффективного или профилактического количества композиции по любому из пп.1-16.
20. Применение композиции по любому из пп.1-16 для получения лекарственного средства для лечения и/или профилактики состояния тревоги, мании, депрессии, паники и/или агрессии, нарушений, вызываемых субарахноидальным кровоизлиянием или невральным шоком, последствий, вызываемых отменой веществ, таких как кокаин, никотин, алкоголь и бензодиазепины; нарушений, подлежащих лечению и/или профилактике противосудорожными препаратами, таких как эпилепсия, включая посттравматическую эпилепсию, болезнь Паркинсона, психоз, мигрень, церебральная ишемия, болезнь Альцгеймера и другие дегенеративные заболевания, такие как хорея Хантингдона, шизофрения, навязчивые компульсивные состояния, неврологические дефициты, связанные со СПИДом, нарушения сна (включая нарушения циркадного ритма, бессонницу и нарколепсию), тики (например, синдром Жиль де ла Туретта), травматическое повреждение мозга, шум в ушах, невралгию, особенно невралгию тройничного нерва, невропатическую боль, зубную боль, боль при раке, неправильную нейронную активность, приводящую к нейродистезии при таких заболеваниях, как диабет, рассеянный склероз и заболевание двигательных нейронов, атаксия, мышечная ригидность (спастичность), дисфункция височно-нижнечелюстного сустава и/или боковой амиотрофический склероз.
21. Способ лечения и/или профилактики состояния тревоги, мании, депрессии, паники и/или агрессии, нарушений, вызываемых субарахноидальным кровоизлиянием или невральным шоком, последствий, вызываемых отменой веществ, таких как кокаин, никотин, алкоголь и бензодиазепины, нарушений, подлежащих лечению и/или профилактике противосудорожными препаратами, таких как эпилепсия, включая посттравматическую эпилепсию, болезнь Паркинсона, психоз, мигрень, церебральная ишемия, болезнь Альцгеймера и другие дегенеративные заболевания, такие как хорея Хантигдона, шизофрения, навязчивые компульсивные состояния, неврологические дефициты, связанные со СПИДом, нарушения сна (включая нарушения циркадного ритма, бессонницу и нарколепсию), тики (например, синдром Жиль де ла Туретта), травматическое повреждение мозга, шум в ушах, невралгию, особенно невралгию тройничного нерва, невропатическую боль, зубную боль, боль при раке, неправильную нейронную активность, приводящую к нейродистезии при таких заболеваниях, как диабет, рассеянный склероз и заболевание двигательных нейронов, атаксия, мышечная ригидность (спастичность), дисфункция височно-нижнечелюстного сустава и/или боковой амиотрофический склероз, включающий введение пациенту, нуждающемуся в этом, эффективного количества соединения формулы I или его фармацевтически приемлемой соли или сольвата и, необязательно, фармацевтически приемлемого носителя.
Текст
1 Данное изобретение относится к новым композициям соединений, проявляющим терапевтическую активность в виде микрочастиц,особенно к композициям плохо растворимых в воде соединений с повышенной биодоступностью, а также к применению таких композиций для терапевтических целей. ЕР-А-0126311 и ЕР-А-0139992 описывают производные бензопирана, обладающие гипотензивной активностью. В WO 92/22293, WO 94/13657 и WO 95/34545 описано, что соединения бензопирана также обладают анксиолитической и противосудорожной активностью, а также раскрыты производные бензопирана и родственные производные пиридопирана, проявляющие подобную активность. Неопубликованная международная заявка на патентРСТ/ЕР 97/05168 раскрывает дополнительное применение этих соединений, включая лечение невропатической боли. Известно, что фармацевтически активные соединения измельчают для получения размера частиц, подходящего для прессования таблеток и других видов рецептур. Предпочтительными являются измельчение при помощи воздушной струи и энергии жидкости (микроизмельчение) для уменьшения возможности загрязнения измельчающими материалами. Однако для получения микронизированных частиц для фармацевтического использования были предложены процессы мокрого измельчения, описанные,например, в US-A-4540602 и ЕР-А-0499299. Последний раскрывает процедуру мокрого измельчения для получения частиц кристаллического лекарственного вещества, содержащего модификатор поверхности, абсорбированный на его поверхности в количестве, достаточном для поддержания эффективного среднего размера частиц, составляющего менее приблизительно 400 нм. Такая композиция в виде микрочастиц обеспечивает повышенную биодоступность плохо растворимых в воде соединений. Данное изобретение основано на открытии, что вышеупомянутые соединения бензопирана и пиридопирана обладают повышенной биодоступностью в определенных композициях с контролируемым размером частиц. Данное изобретение также предусматривает способ получения таких композиций воспроизводимым образом. В соответствии с данным изобретением разработана композиция, включающая соединение формулы I, приведенной ниже, в микроизмельченном виде, имеющем такое распределение размера частиц, что средняя величина среднего объемного диаметра находится в интервале от 350 до 700 нм. Композиция в соответствии с данным изобретением может быть в виде водной дисперсии частиц соединения формулы I, которое обычно является продуктом мокрого измельчения. Композиция в соответствии с данным изобретением 2 также может представлять собой порошок,включающий частицы соединения формулы I,который обычно является продуктом сушки или гранулирования распылением. В данном изобретении применяют следующие соединения:Y представляет C-R1; любой из R1 и R2 является водородом, а другой выбран из группы, содержащей водород,С 3-8 циклоалкил, C1-6 алкил, необязательно прерванный кислородом или замещенный гидрокси, C1-6 алкокси или замещенным аминокарбонилом, C1-6 алкилкарбонил, C1-6 алкоксикарбонил,C1-6 алкилкарбонилокси, C1-6 алкокси, нитро,циано, галоген, трифторметил, СF3S или группу СF3-А-, где А представляет CF2-, -СО-, -СН 2 или СН(ОН), трифторметокси, C1-6 алкилсульфинил, C1-6 алкилсульфонил, C1-6 алкоксисульфинил, C1-6 алкоксисульфонил, арил, гетероарил,арилкарбонил, гетероарилкарбонил, арилсульфинил, гетероарилсульфинил, арилсульфонил,гетероарилсульфонил, C1-6 алкилкарбониламино,C1-6 алкоксикарбониламино,C1-6 алкилтиокарбонил, C1-6 алкокситиокарбонил, C1-6 алкилтиокарбонилокси, 1-меркапто С 2-7 алкил, формил,или аминосульфинил, аминосульфонил или аминокарбонил, любой аминоостаток, необязательно замещенный одной или двумя C1-6 алкильными группами, или C1-6 алкилсульфиниламино, C1-6 алкилсульфониламино, C1-6 алкоксисульфиниламино илиC1-6 алкоксисульфониламино, или этиленил, замещенный на конце C1-6 алкилкарбонилом, нитро или циано,или -С(C1-6 алкил)NOH или -C(C1-6 алкил)NNH2,или один из R1 и R2 представляет нитро, циано или C1-3 алкилкарбонил, а другой представляет метокси или амино, необязательно замещенный одним или двумя C1-6 алкилом или C2-7 алканоилом; один из R3 и R4 представляет водород илиR8 - водород или C1-6 алкил; а Х - кислород или NR10,где R10 - водород или C1-6 алкил; или где группа R8-N-CO-R7 находится в цисположении относительно группы R5,любой из R1 и R2 представляет водород, а другой выбран из группы, включающей группу СF3-А-, где А представляет SO2, SO, СН 2-O или-СН=СН-СН=СН-, или триазольное или оксадиазольное кольцо; один из R3 и R4 - водород или C1-4 алкил, а другой - СF3 или СН 2 Хa, где Xa - фтор, хлор,бром, йод, C1-4 алкокси, гидрокси, C1-4 алкилкарбонилокси, -S-C1-4 алкил, нитро, амино, необязательно замещенный одной или двумяR7 - гетероарил или фенил; которые оба необязательно замещены один или несколько раз, независимо, группой или атомом, выбранным из хлора, фтора, брома, йода, нитро, амино,необязательно замещенным один или два разаR10 - водород, C1-6 алкил, C1-6 алкокси, моноили ди-С 1-6 алкиламино, амино, амино-C1-6 алкил,гидрокси-С 1-6 алкил,галоген-C1-6 алкил,C1-6 ацилокси-С 1-6 алкил, C1-6 алкоксикарбонил-С 1-6 алкил, арил или гетероарил. Соединения, подпадающие под формулу I,описаны в ЕР-А-0139992, ЕР-А-0126311, WO 92/22293, WO 94/13657 и WO 95/34545. Ссылка на эти публикации приводится с целью получения информации о получении и применении этих соединений, о предпочтительных заместителях и моделях замещения, а также о подходящих отдельных соединениях и их получении. Предпочтительными соединениями, используемыми в данном изобретении, являются транс-6-ацетил-4S-(4-фторбензоиламино)-3,4 дигидро-2,2-диметил-2 Н-1-бензопиран-3R-ол, в дальнейшем называемый "соединение 1" (его получение описано в примере 20 WO 92/22293); и цис-6-ацетил-4S-(3-хлор-4-фторбензоиламино)-3,4-дигидро-2,2-диметил-2 Н-1-бензопиран 3S-ол, в дальнейшем называемый "соединение 2" (его получение описано в примере 17 WO 95/34545); и транс-6-ацетил-4S-(3,5-дифторбензоиламино)-3,4-дигидро-2,2-диметил-2 Н-1 бензопиран-3R-ол (его получение описано в примере 4 WO 95/34545). 4 Соединения, применяемые в данном изобретении, имеют чрезвычайно низкую растворимость в воде. Например, соединение 1 имеет растворимость в воде, составляющую 0,008 мг/мл, что означает "практически нерастворимый" в соответствии с классификацией, принятой в фармакопее США. Вышеперечисленные соединения могут быть использованы в виде фармацевтически приемлемых сольватов, особенно гидратов. Перед измельчением они могут быть в кристаллическом или аморфном виде. Композиции в соответствии с данным изобретением удобнее всего получать способом мокрого измельчения соединений формулы I и формулы II в виде водной дисперсии. При небольших масштабах обработки мокрое измельчение предпочтительно проводят, применяя двухкамерную шаровую мельницу с циркуляцией продукта между камерами. С целью снижения загрязнения материалами мельницы среда для измельчения предпочтительно включает керамические шарики из оксидов редкоземельных металлов, а измельчение проводят в камерах, покрытых износостойким полимерным материалом, таким как найлон, или изготовленные из него. Для эффективного измельчения шарики в одной камере имеют меньший диаметр, чем шарики в другой камере; эффективные результаты получают при использовании шариков размером 1,25 мм в одной камере и шариков размером 0,4 мм в другой камере. Шариками для измельчения предпочтительно являются шарики из двуокиси циркония, особенно шарики, сделанные из порошка двуокиси циркония,стабилизированного окисью иттрия. При больших масштабах обработки может быть использована пятикамерная шаровая мельница. Продукт пропускают за один проход через одну,две, три, четыре или все пять камер мельницы. Для эффективного измельчения шарики в первой камере имеют размер от 0,65 мм и 1,25 мм. Шарики в последующих камерах имеют меньший или одинаковый размер с шариками в предыдущей мельнице. Для облегчения последующей обработки,т.е. получения фармацевтических составов для терапевтических целей, таких как таблетки,дисперсии для инъекций и т.д., мокрое измельчение соединений формулы I и формулы II предпочтительно проводят в водной среде,включающей один или несколько наполнителей,таких как растворимый носитель, подходящий для сушки распылением; поверхностноактивное вещество для поддержания частиц в суспензии и вещество, предотвращающее агломерацию и эффективное после введения фармацевтического состава пациенту. Особенно подходящим наполнителем для сушки распылением является маннит, однако, другие углеводы, такие как сорбит, лактоза, лактит и ксилит, а также крахмал могут быть использованы в качестве 5 носителя. Предпочтительно натрий лаурилсульфат применяют в качестве поверхностноактивного вещества, а целлюлозные загустители, такие как гидроксипропилметилцеллюлоза или гидроксиэтилцеллюлоза, могут быть использованы в качестве веществ, предотвращающих агломерацию. В водной среде, подвергаемой измельчению, соединение формулы I может присутствовать в количестве приблизительно от 10 до 30% маc./маc. При количестве 30% маc./маc. и выше могут возникнуть трудности с сохранением суспензии соединения формулы I в процессе измельчения. На практике 20% маc./маc. являются эффективным компромиссом между высокой производительностью и коротким периодом измельчения. Количество растворимого носителя может варьироваться приблизительно от 4 до 15% маc./маc. от измельчаемой композиции. Предпочтительно, количество растворимого носителя не превышает 50 маc.% от количества обрабатываемого соединения формулы I. Было установлено, что при количестве соединения, составляющем около 20% маc./маc.,эффективным является количество растворимого носителя приблизительно от 4 до 10%, а предпочтительным является количество около 5% маc./маc. Количество поверхностно-активного вещества может варьироваться приблизительно от 0,1 до 0,4% маc./маc. от массы водной среды. Предпочтительно оно присутствует в количестве около 1 маc.% от количества обрабатываемого соединения. Количество вещества, предотвращающего агломерацию, обычно составляет приблизительно от 1 до 2% маc./маc. от массы водной среды. Предпочтительным является количество,составляющее около 1,5% маc./маc. Частицы соединений формулы I предпочтительно присутствуют в виде мономодального распределения, при этом обычно не более 10% частиц имеют объемный диаметр 280 нм и ниже, а не менее 90% частиц имеют объемный диаметр 2000 нм и ниже. В предпочтительном варианте осуществления данного изобретения средний объемный диаметр находится в интервале от 400 до 600 нм, особенно от 450 до 550 нм. В этом среднем интервале эффективные композиции получают,когда 10% частиц имеют объемный диаметр,составляющий 260 нм и менее, а 90% частиц имеют объемный диаметр, составляющий 1450 нм и менее. Применяя систему измельчающих шариков и водного носителя, описанную выше, композицию, имеющую предпочтительное распределение размера частиц, можно получить на удивление быстро, например, после измельчения в течение приблизительно 30 мин на мельнице для небольших объемов с применением 6 рециркуляции продукта. Увеличение периода измельчения, например, приблизительно до 1 ч,обеспечивает уменьшение самых больших частиц таким образом, что, по меньшей мере, 90% частиц имеют объемный диаметр менее 1000 нм. Однако эффект средней величины является маргинальным, поэтому более длительный период измельчения является экономически невыгодным. Подобным образом, при широкомасштабной обработке размеры партий до 200 кг при количестве соединения, составляющем около 20% маc./маc., могут быть обработаны на удивление быстро, при этом предпочтительное распределение размера частиц получают после одного прохода продукта на протяжении более 70 мин. Водная дисперсия, получаемая в результате процесса измельчения, может быть использована непосредственно в качестве терапевтического агента, если она получена в соответствующих гигиенических условиях. В результате применения воды и других компонентов, отвечающих стандартам Евр. Ф., могут быть получены композиции, которые можно хранить до одного месяца при 5 С без обнаруживаемых признаков бактериального роста. Однако при получении составов, используемых для лечения людей, водную дисперсию предпочтительно превращают в сухой порошок. Наиболее удобна для этих целей сушка распылением; продукт обычно забирают из сушилки, применяя циклонный сепаратор. Включая вышеописанные наполнители в водную среду для измельчения,может быть получена порошковая композиция,содержащая микроизмельченные соединения формулы I в виде композиции, имеющей хорошую текучесть и пригодной для введения в состав таблеток или состав порошка для капсул. До настоящего времени соединения формулы I прессовали в таблетки, вначале подвергая лекарственное вещество микронизированию, а затем мокрому гранулированию микронизированного лекарственного вещества с наполнителями для таблеток. Порошок, высушенный распылением, полученный в соответствии с данным изобретением, может быть спрессован в таблетки в результате прямого прессования. Было обнаружено, что период измельчения для достижения желаемого распределения размера частиц по существу одинаков, независимо от того, был ли подвергнут исходный материал микронизированию или нет. Возможность начинать измельчение немикронизированного лекарственного вещества, полученного в результате первичного производственного процесса при помощи шариков, делает данный процесс измельчения особенно экономически выгодным. Влажный осадок после получения промывают и высушивают на поддоне, после этого он готов для измельчения шариками. Альтернативно, в случае с некоторыми соединениями влажный осадок может быть промыт и 7 вновь суспендирован для измельчения шариками, устраняя таким образом дорогую стадию сушки. Полагают, что соединения формулы I применимы для лечения и/или профилактики состояния тревоги, мании, депрессии, паники и/или агрессии, нарушений, связанных с субарахноидальным кровоизлиянием или невральным шоком, последствий, вызванных отменой таких веществ, таких как кокаин, никотин, алкоголь к бензодиазепины, расстройств, подлежащих лечению и/или профилактике противосудорожными препаратами, таких как эпилепсия,включая посттравматическую эпилепсию, болезнь Паркинсона, психоз, мигрень, церебральную ишемию, болезнь Альцгеймера и другие дегенеративные заболевания, такие как хорея Хантингдона, шизофрения, навязчивые компульсивные состояния, неврологические дефициты, связанные со СПИДом, нарушения сна(включая нарушения циркадного ритма, бессонницу и нарколепсию), тики (например, синдром Жиль де ла Туретта), травматическое повреждение мозга, шум в ушах, невралгию, особенно невралгию тройничного нерва, невропатическую боль, зубную боль, боль при раке, неправильную нейронную активность, приводящую к нейродистезии при таких заболеваниях, как диабет, рассеянный склероз и заболевание двигательных нейронов, атаксию, мышечную ригидность (спастичность), дисфункцию височнонижнечелюстного сустава и/или боковой амиотрофический склероз. Соединение в форме микрочастиц может быть введено млекопитающему перорально, парентерально, сублингвально, назально, легочно, ректально или трансдермально. Количество, эффективное для лечения вышеописанных заболеваний, зависит от обычных факторов, таких как природа и тяжесть подвергаемых лечению нарушений и масса млекопитающего. Однако стандартная доза обычно содержит от 1 до 1000 мг, предпочтительно от 1 до 500 мг, например, количество, входящее в интервал от 2 до 400 мг, такое как 2, 5, 10, 20,30, 40, 50, 100, 200, 300 и 400 мг активного соединения. Стандартные дозы обычно вводят один или несколько раз в сутки, например, 1, 2,3, 4, 5 или 6 раз в сутки, как правило, от 1 до 4 раз в сутки, таким образом, чтобы общая суточная доза составляла от 1 до 1000 мг для взрослого пациента, имеющего массу 70 кг, например,от 5 до 500 мг, т.е. в интервале, приблизительно составляющем 0,01-15 мг/кг/сутки, как правило,от 0,1 до 6 мг/кг/сутки, например, от 1 до 6 мг/кг/сутки. Наиболее предпочтительно, чтобы соединение формулы I вводилось в виде композиции для стандартной лекарственной формы, такой как пероральная, включая сублингвальную, назальную, легочную, ректальную, местную или парентеральную (особенно внутривенную),композиция. 8 Такие композиции получают смешиванием и соответственно приспосабливают для перорального, парентерального или легочного введения; как таковые они могут быть в форме таблеток, капсул, жидких препаратов для перорального приема, порошков, гранул, пастилок,порошков для растворения, растворов для инъекций и вливаний или суcпензий, или вдыхаемых порошков или порошковых суспензий, или суппозиториев. Подходящий аппарат для введения легочным способом описан, например, в патентах США 5363842, 5392768, 5394866,5404871, 5497763, 5509404, 5544646 и 5608647. Предпочтительными являются перорально вводимые композиции, в частности, формованные композиции для перорального введения, поскольку они более удобны для общего применения. Таблетки и капсулы для перорального введения обычно представлены в стандартной лекарственной форме и содержат общепринятые эксципиенты, такие как связующие, наполнители, разбавители, таблетирующие агенты (вспомогательные вещества для прессования), смазывающие агенты, дезинтегрирующие агенты,красители, корригенты и увлажнители. На таблетки может быть нанесено покрытие в соответствии со способами, хорошо известными в данной области. Подходящие наполнители включают целлюлозу, маннит, лактозу и другие подобные вещества. Подходящие дезинтегрирующие вещества включают крахмал, поперечно-сшитый поливинилпирролидон и другие сильные дезинтегрирующие агенты и производные крахмала,такие как натрий крахмалгликолят. Подходящие смазывающие агенты включают, например,стеарат магния. Эти твердые композиции для перорального введения могут быть получены известными способами смешивания, наполнения, таблетирования и т.д. Для распределения активного агента в этих композициях могут быть использованы повторные процедуры смешивания с применением большого количества наполнителей. Такие процедуры являются общеизвестными в данной области. Жидкие препараты для перорального введения могут быть, например, в виде водных или масляных суспензий, растворов, эмульсий, сиропов или эликсиров, или могут быть представлены в виде сухого продукта для воссоздания водой или другим подходящим носителем перед использованием. Такие жидкие препараты могут содержать известные добавки, такие как суспендирующие агенты, например, сорбит, сироп,метилцеллюлоза,желатин,гидроксиэтилцеллюлоза,карбоксиметилцеллюлоза,гель стеарата алюминия или гидрогенизированные пищевые жиры, эмульгирующие агенты, например, лецитин, сорбитан моноолеат или аравийская камедь, неводные носители (которые могут 9 включать пищевые масла), например, миндальное масло, фракционированное кокосовое масло, сложные эфиры, такие как сложные эфиры глицерина, пропиленгликоля или этилового спирта; консерванты, например, метил или пропил, п-гидроксибензоат или сорбиновая кислота, и, прижелании, корригенты или красители. Готовые лекарственные формы для перорального введения также включают готовые формы с контролируемым выделением, такие как таблетки или гранулы, имеющие энтеросолюбильное покрытие или модифицированные таким или другим способом, для контроля выделения активного компонента, например, в результате включения гелеобразующих полимеров, таких как Метоцель К 4 М. Для парентерального введения получают жидкие стандартные лекарственные формы,содержащие соединение и стерильный носитель. Суспензии для парентерального введения обычно готовят, суспендируя соединение в стерильном носителе, вначале стерилизуя соединение,подвергая его воздействию этиленоксида, гамма-облучению или другим стерилизационным процедурам перед суспендированием в стерильном носителе. Альтернативно, весь процесс,начиная с рекристаллизации активного соединения, раствор которого был ранее подвергнут стерильной фильтрации, например, через фильтр с 0,22-микронной мембраной, может быть проведен в асептических условиях для обеспечения стерильности. Предпочтительно в композицию включают поверхностно-активное вещество или увлажнитель для облегчения равномерного распределения соединения в соответствии с данным изобретением. К композициям обычно прилагают написанные или напечатанные инструкции по применению при определенном виде медицинского лечения. Соответственно данное изобретение также предусматривает способ лечения и/или профилактики состояния тревоги, мании, депрессии,паники и/или агрессии, нарушений, вызванных субарахноидальным кровоизлиянием или невральным шоком, последствий, вызванных отменой таких веществ, как кокаин, никотин, алкоголь и бензодиазепины, нарушений, подлежащих лечению и/или профилактике противосудорожными препаратами, таких как эпилепсия,включая посттравматическую эпилепсию, болезнь Паркинсона, психоз, мигрень, церебральную ишемию, болезнь Альцгеймера и другие дегенеративные заболевания, такие как хорея Хантингдона, шизофрения, навязчивые компульсивные состояния, неврологические дефициты, связанные со СПИДом, нарушения сна(включая нарушения циркадного ритма, бессонницу и нарколепсию), тики (например, синдром Жиль де ла Туретта), травматическое повреждение мозга, шум в ушах, невралгию, особенно невралгию тройничного нерва, невропатиче 003732 10 скую боль, зубную боль, боль при раке, неправильную нейронную активность, приводящую к нейродистезии при таких заболеваниях, как диабет, рассеянный склероз и заболевание двигательных нейронов, атаксия, мышечная ригидность (спастичность), дисфункция височнонижнечелюстного сустава и/или боковой амиотрофический склероз, включающий введение пациенту, нуждающемуся в этом, эффективного или профилактического количества соединения в соответствии с данным изобретением. Данное изобретение предусматривает применение композиции для получения лекарственного средства для лечения и/или профилактики состояния тревоги, мании, депрессии,паники и/или агрессии, нарушений, вызываемых субарахноидальным кровоизлиянием или невральным шоком, последствий, вызываемых отменой веществ, таких как кокаин, никотин, алкоголь и бензодиазепины, нарушений, подлежащих лечению и/или профилактике противосудорожными препаратами, таких как эпилепсия, включая посттравматическую эпилепсию,болезнь Паркинсона, психоз, мигрень, церебральную ишемию, болезнь Альцгеймера и другие дегенеративные заболевания, такие как хорея Хантингдона, шизофрения, навязчивые компульсивные состояния, неврологические дефициты, вызываемые СПИДом, нарушения сна(включая нарушения циркадного ритма, бессонницу и нарколепсию), тики (например, синдром Жиль де ла Туретта), травматическое повреждение мозга, шум в ушах, невралгию, особенно невралгию тройничного нерва, невропатическую боль, зубную боль, боль при раке, неправильную нейронную активность, приводящую к нейродистезии при таких заболеваниях, как диабет, рассеянный склероз и заболевание двигательных нейронов, атаксия, мышечная ригидность (спастичность), дисфункция височнонижнечелюстного сустава и/или боковой амиотрофический склероз. Предпочтительная процедура получения небольшого количества композиции в форме микрочастиц в соответствии с данным изобретением может быть проведена в двухкамерной бисерной мельнице, такой как мельница для лабораторного измельчения, продаваемая под торговым названием "DENA Mill" by Dena Systems BK Ltd., Mapplewell, Barnsley, S75 6DT, с измельчающей способностью 2 л. Мельница включает две реакционные камеры SPS 1, SPS 2,и три различных реактора D3, S1 SS. Мельница может работать в трех различных режимах:"процесс 1", "процесс 2" и "комбинированный процесс 1 и 2". Процесс 1 проходит в реакционной камере SPS1, содержащей 1,25-миллиметровые шарики. Процесс 2 проходит в реакционной камере SPS2, содержащей 0,4 миллиметровые шарики. Когда мельница работает в режиме "комбинированный процесс 1 и 2", то суспензия измельчаемого продукта проходит через обе реакционные камеры. Реакционные камеры SPS1 и SPS2 содержат вращающиеся лопасти, при этом реакционные камеры и лопасти изготавливают из износостойкого инертного найлона. Внутренняя часть выпускного конца реакционных камер закрыта ситом подходящего размера для задерживания шариков и любых неизмельченных материалов,покидающих камеру. Скорость вращения лопастей постоянна. В реакторах D3, S1 и SS проводят различные процессы. Реактор D3 - это деагломерирующий реактор; он в основном предназначен для предотвращения агломерации измельчаемого вещества перед поступлением в реакционную камеру SPS1. Реактор S1 - это сдвиговой и эмульгирующий реактор; он обеспечивает получение однородной суспензии в конце процесса измельчения. Реактор SS предназначен для гомогенизирования материалов и, при необходимости, эмульгирования суспензии перед выходом из мельницы. Подходящие реакторы для перемешивания и гомогенизации твердых суспензий описаны в патенте UK2268090 В. Внутренняя часть каждого реактора представляет собой сотовую разделительную структуру, установленную таким образом, чтобы образовывать углы потока внутри реактора, продиктованные его функцией. Мельница имеет также два теплообменника; по одному для охлаждения продукта, выходящего из каждой реакционной камеры. При использовании такой мельницы для проведения процедур в соответствии с данным изобретением ее применяют, следуя инструкциям производителя для "комбинированного процесса 1 и 2" таким образом, чтобы измельчаемое соединение циркулировало между двумя реакционными камерами. Камеры мельницы загружают керамическими шариками YTZ, изготовленными из двуокиси циркония высокой чистоты, стабилизированной окисью иттрия (выпускаемыми Компонент Соединение 1 Маннит ГПМЦ Натрий лаурилсульфат Очищенная вода Шарики Диаметр Плотность Твердость Масса Диаметр Плотность Твердость Масса Измельченную суспензию подвергают сушке распылением, применяя "Mobile MinorSpray Dryer", выпускаемую "Niro Ltd.", Denmark. В этом аппарате водную суспензию из мельницы подают насосом в сушильную камеру в виде распыленной струи. Высушенный порошок передают в циклонный сепаратор, из которого получают порошковый продукт."Mobile Minor" применяют в соответствии с инструкциями производителя при следующих условиях. Настройка аппарата: Скорость распыления Эксгаустер/ нагреватель Скорость насоса Температура входа Температура выхода Суспензии для измельчения с применением вышеописанного аппарата получают из: Соединение 1"SB Pharmaceuticals" (в неизмельченном виде, размер частиц обычно составляет 1 мм) как для Соединения 1 от "Roquette UK Ltd." Соединение 2 Маннит Гидроксипропилметилцеллюлоза (ГПМЦ) от "Stancourt Sons and Muir" Натрий лаурилсульфат от "Henkel Organics" Пропорции этих соединений варьируют,как указано ниже. Суспензии получают, диспергируя гидроксипропилметилцеллюлозу (ГПМЦ) в очищенной воде с применением подходящего смесителя. К дисперсии гидроксипропилметилцеллюлозы добавляют маннит, а затем натрий лаурилсульфат. Затем при перемешивании на высокой скорости исследуемый лекарственный препарат диспергируют и перемешивание продолжают до тех пор, пока не останется его агломератов. Исследованию подвергают следующие составы суспензии. Пропорция, % маc./маc. 3 4 5 10 20 30 После измельчения суспензий составов 1-6 результаты записывают как D(0,1), D(0,5) иD(0,9). D(0,1) - это размер (в виде объема диаметра), который имеют менее 10% частиц,D(0,5) - это размер, который имеют 50% частиц,также называемый средним. D(0,9) - это размер,который имеют менее 90% частиц. Распределение размера частиц измеряют,применяя лазерную дифракционную установкуLtd.", Malvern, England. Суспензия Суспензии, содержащие 10% мас./мас. соединения 1, 15% мас./мас. соединения 1, 20% мас./мас. соединения 1 (составы 3, 2, 1), измельчают последовательно, достигая необходимых параметров продукта в течение 60 мин (см. табл. 1, 2, 3). Было обнаружено, что 30% мас./мас. суспензия (состав 5) может быть получена в виде пульпы, но бисерная мельница может обрабатывать пульпу всего лишь в течение нескольких минут, до того как вторая реакционная камера (0,4 миллиметровые шарики) оказывается забитой. 40% мас./мас. пульпа (состав 6) не может быть измельчена, поскольку она не суспендируется достаточно долго, чтобы быть перемещенной в емкость мельницы. Таблица 1 Время,минD(0,9) мкм Не установлено (немикронизированный лекарственный препарат) 0,71 0,56 Измельчение состава 1 повторяют с более короткими промежутками времени между исследованиями, как показано в табл. 4. Сравнение с табл. 1 показывает, что желаемые параметры оказываются достигнутыми между 45 и 60 мин измельчения. Суспензию состава 4 измельчают в течение 70 мин и образцы подвергают анализу на размер частиц с 10-минутными интервалами(табл. 5). Видно, что желаемый размер частиц был достигнут после 30 мин измельчения. После этого времени существенного уменьшения размера частиц не происходит. Таблица 5 Время,мин Для всех суспензий с содержанием маннита от 5 до 10% сушка распылением оказалась успешной, равно как и повторное диспергирование высушенного распылением материала. Для демонстрации воспроизводимости процесса 6 партий (A-F) по 20 кг суспензии состава 4 измельчают в более мелких партиях по 2 кг. Всего измельчают 60 мелких партий и проводят анализ размера частиц на образце из 20-кг партии. Во всех шести 20-кг партиях желаемый размер частиц достигают (табл. 6) после 30 мин измельчения. Стандартное отклонение на трех участках измерения весьма низкое, не обнаруживая различий между партиями. Предпочтительная процедура получения тонкоизмельченной композиции в соответствии с данным изобретением на промышленном уровне может быть проведена в пятикамерной бисерной мельнице, такой как промышленная мельница, продаваемая под торговым названием"DENA DS-1P5 Mill" и выпускаемая "Dena Systems ВК Ltd.", Mapplewell, Barnsley, S75 6DT, с измельчающей способностью от 2 до 3 л/мин. Мельница включает 5 реакционных камер от(типы D, S и SS). Мельница работает в одном режиме, пропуская продукт один раз через каж 15 дую измельчающую камеру. В зависимости от продукта может быть использовано от одной до пяти измельчающих камер. Реакционные камеры от SPS1 до SPS5 и реакторы имеют такое же устройство, как и вышеописанная мельница для небольшого производства. Камеры мельницы загружают керамическими шариками YTZ, изготовленными из двуокиси циркония высокой чистоты, стабилизированной окисью иттрия (выпускаемыми"Nikkato Corporation", Japan) следующим образом. Диаметр шариков составляет от 0,3 до 1,25 мм. В каждую камеру загружают от 6250 до 6750 см 3 шариков. Измельченную суспензию сушат распылением, применяя "Niro Spray Dryer", выпускаемый "Niro Ltd.", Denmark. В этом аппарате водную суспензию из мельницы подают насосом в сушильную камеру в виде атомизированного спрея. Высушенный порошок передают в циклонный сепаратор, из которого получают порошковый продукт. Распылительная сушилка работает в соответствии с инструкциями производителя при следующих условиях. Суспензии для измельчения с применением вышеописанного аппарата получают из таких же наполнителей и активных (соединений),которые описаны выше в экспериментах по измельчению небольших объемов. Исследованию подвергают следующие составы суспензии: Компонент Соединение 1 Маннит ГПМЦ Натрий лаурилсульфат Очищенная вода После измельчения суспензий состава 1 с применением различного количества шариков,загружаемых в камеры мельницы, и альтернативных размеров шариков, интервалы результатов записывают в табл. 7 как D(0,1), D(0,5) иD(0,9). D(0,1) - это размер (в виде объемного диаметра), который имеют менее 10% частиц,D(0,5) - это размер, который имеют 50% частиц,также называемый средним. D(0,9) - это размер,который имеют менее 90% частиц. Распределение размера частиц измеряют,применяя лазерную дифракционную установку Настройка аппарата: Скорость распыления Температура входа Температура выхода Применяя индуктивно-связанный плазменный анализ, определяют уровень иттрия и циркония во всех измельченных суспензиях,который оказался низким и приемлемым. Уровень железа также оказался низким. Приемлемый уровень для циркония устанавливают на уровне 200 частей на млн Zr и 20 частей на млн иттрия в порошке, высушенном распылением. Результаты показывают, что во время процесса измельчения шарики не разбиваются, а также что ни шарики, ни суспензия не повреждают найлоновых камер мельницы. Исследование биоэквивалентности Проводят испытание на биоэквивалентность для определения относительной биодоступности четырех пероральных составов соединения 1 на здоровых добровольцах. Схема испытания включает открытый,рандомизированный четырехкомпонентныйD(0,9) мкм 417 (немикронизированное лекарственное средство) от 10,3 до 18 от 5,0 до 6,5 от 2,8 до 4,5 от 1,4 до 2,1 от 1,0 до 1,3 кроссинговер. Каждый объект получает произвольно, в отдельные дни разовую пероральную 400-мг дозу каждой из четырех различных готовых лекарственных форм соединения 1. Соединение 1 вводят перорально в виде таблеток или капсул. В каждый из четырех дней приема объекты получают по одной пероральной дозе соединения 1, при этом вымывание между дозами составляет, по меньшей мере, 6 дней. Для каждого объекта 4 состава произвольно распределяют на каждый сеанс исследования. Дозы вводят перорально с 200 мл воды, после обычного завтрака. Высушенный распылением продукт из суспензии состава 4 прессуют в таблетки путем прямого прессования. Контрольным составом таблетки является следующий:(микронизированное) 400,00 Натрий крахмалгликолят 24,00 Микрокристаллическая целлюлоза, Евр. Ф. 23,28 Поливинилпирролидон,Ф. США 9,60 Натрий лаурилсульфат, БФ 2,40 Лактоза (моногидрат), Евр. Ф. 18,48 Стеарат магния, Евр. Ф. 2,40 Очищенная вода, Евр. Ф. достаточное количество (удаляют во время обработки) Общая масса таблетки 480,16 Условия испытаний обоих составов одинаковы. Результаты (табл. 10 и 11) показывают увеличение содержания в крови соединения 1 приблизительно в 3 раза при приеме таблеток из состава 4 по сравнению с таблетками, полученными из микроизмельченного лекарственного вещества. Таблица 10 Контрольная Таблетка, полученная таблетка в результате мокрого измельчения и сушки распылением Площадь под кривой,мгч/мл Максимальная концентрация в плазме, мг/мл Период времени до максимального уровня в плазме, ч Таблица 11 Результаты исследования на биоэквивалентность Время,ч 0 0,48 1,0 1,5 2,0 3,0 4,0 6,0 8,0 10,0 12,0 24,0 Таблетка, полученная в результате мокрого измельчения и сушки распылением концентрация в плазме, мкг/мл 0,00 0,00 0,20 0,20 0,35 0,65 0,50 1,30 0,70 2,40 1,00 2,75 0,95 3,00 0,90 2,30 0,69 1,75 0,65 1,50 0,60 1,30 0,50 0,80 Испытание на максимальный пороговый электрошок у крыс (MEST) Подробное описание см. Upton et al. (1997,Br. J. Pharmacol., 121, 1679-1686). Порог вызываемых электрошоком тонических разгибаний задних конечностей у самцовкрыс (штамм Sprague Dawley, 70-130 г) определяют, применяя стимулятор (Hugo Sachs Elektronic stimulator), подающий постоянный ток(продолжительность 0,3 с, 50 Гц, синусоидальный, полностью регулируемый между 1-300 мА) через корнеальные электроды. Интенсивность 18 стимулов варьируют (начиная с обычного базового тока силой в 25 мА), применяя способ шокового титрования "вверх-вниз" и шаги, величиной 5-20 мА. Отмечают отсутствие или наличие разгибания задней конечности. Данные, полученные от группы из 10-14 крыс, используют для определения величины CC50 (ток, вызывающий максимальный эффект у 50% животных)стандартная квадратичная ошибка в соответствии со способом Kimball et al. (1957, Radiation Res., 7, 1-12). Действие различных лекарственных препаратов выражают в виде процентного изменения величины CC50 по сравнению с контрольными уровнями, вызванными носителем. Повышение порога приступа является показательным для противосудорожного действия. Существенное воздействие (Р 0,05) лекарственных препаратов на порог максимальных электрошоковых приступов определяют,сравнивая отношение эффективности величинCC50 групп, получающих лекарственный препарат и носитель, по методу Litchfield and Wilcoxan (1949, J. Pharmacol. Exp. Ther. 96, 99-113). Лекарственные препараты вводят перорально через желудочный зонд, при этом объем дозы составляет 1 мл/кг. Противосудорожное действие различных составов соединения 2% повышения порога приступа до испы- 1% ме- микро- измель- измель- Состав тания, тилцел- низиро- ченная 4d ченная мин люлоза ваннаяa мокрым мокрым спососпособомb бомc+SLS 15 76 114 181 182 184 30 202 231 369 335 410 60 194 369 444 424 492 90 549 557 410 580 120 576 798 526 839 893 15 мин/ 11% 14% 34% 22% 21% 2 ч Заключение: 1. c и d имеют лучший общий эффект,чем а 2. b, с и d начинают действовать быстрее, чем а ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Фармацевтическая композиция, включающая соединение формулы I, приведенной ниже где группа R8-N-CO-R7 находится в цисположении относительно группы R5 или Y представляет N, a R2 - водород,или Y представляет C-R1, 19 любой из R1 и R2 является водородом, а другой выбран из группы, содержащей водород,С 3-8 циклоалкил, C1-6 алкил, необязательно прерванный кислородом или замещенный гидрокси, C1-6 алкокси или замещенный аминокарбонил, C1-6 алкилкарбонил, C1-6 алкоксикарбонил,C1-6 алкилкарбонилокси, C1-6 алкокси, нитро,циано, галоген, трифторметил, СF3S или группу СF3-А-, где А представляет -CF2-, -CO-, -CH2 или СН(ОН), трифторметокси, C1-6 алкилсульфинил, C1-6 алкилсульфонил, C1-6 алкоксисульфинил, C1-6 алкоксисульфонил, арил, гетероарил,арилкарбонил, гетероарилкарбонил, арилсульфинил, гетероарилсульфинил, арилсульфонил,гетероарилсульфонил, C1-6 алкилкарбониламино,C1-6 алкоксикарбониламино,C1-6 алкилтиокарбонил, C1-6 алкокситиокарбонил, C1-6 алкилтиокарбонилокси, 1-меркапто C2-7 алкил, формил,или аминосульфинил, аминосульфонил или аминокарбонил, любой аминоостаток, необязательно замещенный одной или двумя C1-6 алкильными группами, или C1-6 алкилсульфиниламино, C1-6 алкилсульфониламино, C1-6 алкоксисульфиниламино,илиC1-6 алкоксисульфониламино, или этиленил, замещенный на конце C1-6 алкилкарбонилом, нитро или циано,или -C(C1-6 алкил) NOH или -C(C1-6 алкил)NNH2,или один из R1 и R2 представляет нитро, циано или C1-3 алкилкарбонил, а другой представляет метокси или амино, необязательно замещенный одним или двумя C1-6 алкилом или С 2-7 алканоилом; один из R3 и R4 представляет водород илиR7 - фторфенил; R8 - водород или C1-6 алкил; а Х - кислород или NR10, где R10 - водород или C1-6 алкил; или где группа R8-N-CO-R7 находится в цисположении относительно группы R5,любой из R1 и R2 представляет водород, а другой выбран из группы, включающей группу СF3-А-, где А представляет SO2, SO, СН 2-O или-СН=СН-СН=СН-, триазольное или оксадиазольное кольцо; один из R3 и R4 - водород или C1-4 алкил, а другой - СF3 или СH2 Хa, где Xa - фтор, хлор,бром, йод, C1-4 алкокси, гидрокси, С 1-4 алкилкарбонилокси, -S-C1-4 алкил, нитро, амино,необязательно замещенный одной или двумяR7 - гетероарил или фенил, которые оба необязательно замещены один или несколько раз, независимо, группой или атомом, выбранным из хлор, фтор, бром, йод, нитро, амино,необязательно замещенным один или два разаR8 - OR9 или NHCOR10, где R9 - водород,C1-6 алкил, формил, C1-6 алканоил, ароил или арил-С 1-6 алкил, a R10 - водород, C1-6 алкил, C1-6 алкокси, моно или ди-С 1-6 алкиламино, амино,амино-C1-6 алкил, гидрокси-С 1-6 алкил, галогенС 1-6 алкил, C1-6 ацилокси-C1-6 алкил, C1-6 алкоксикарбонил-C1-6 алкил, арил или гетероарил,в форме микрочастиц; указанная композиция имеет такой гранулометрический состав частиц,что средняя величина среднего объемного диаметра находится в интервале от 350 до 700 нм. 2. Композиция по п.1, в которой частицы соединений формулы I характеризуются мономодальным распределением по размерам. 3. Композиция по п.2, в которой более 10% частиц имеют объемный диаметр 280 нм или ниже, а не менее 90% частиц имеют объемный диаметр 2000 нм или ниже. 4. Композиция по любому из пп.1-3, в которой средний объемный диаметр находится в интервале от 450 до 550 нм. 5. Композиция по п.4, в которой 10% частиц имеют объемный диаметр 260 нм или ниже,а 90% частиц имеют объемный диаметр 1450 нм или ниже. 6. Композиция по любому из пп.1-5, полученная путем мокрого измельчения соединений формулы I в виде водной дисперсии. 7. Композиция по п.6, полученная путем мокрого измельчения с применением многокамерной шаровой мельницы за один проход или в результате рециркуляции продукта между камерами. 8. Композиция по п.6 или 7, полученная с применением керамических шариков оксидов редкоземельных металлов в качестве измельчающей среды. 9. Композиция по п.7 или 8, полученная с применением многокамерной мельницы, в которой шарики в одной камере имеют меньший диаметр, чем шарики в других камерах. 10. Композиция по п.9, полученная с применением шариков размером между 0,4 и 1,25 мм в каждой камере. 11. Композиция по любому из пп.1-10,включающая растворимый носитель, применяемый в качестве наполнителя для сушки распылением. 12. Композиция по п.10, в которой растворимым носителем является маннит. 13. Композиция по любому из пп.1-12,включающая поверхностно-активное вещество 21 для поддержания частиц в суспензии во время измельчения и повторного суспендирования. 14. Композиция по п.13, в которой поверхностно-активным веществом является натрий лаурилсульфат. 15. Композиция по любому из пп.1-14,включающая вещество для предотвращения агломерации, действующее после введения фармацевтического состава пациенту. 16. Композиция по п.15, в которой веществом, предотвращающим агломерацию, является гидроксипропилметилцеллюлоза. 17. Способ получения композиции в виде микрочастиц, в которой лекарственным веществом является соединение формулы I, включающий мокрое измельчение лекарственного препарата в виде водной дисперсии в многокамерной шаровой мельнице с циркуляцией продукта между камерами, при этом водная дисперсия содержит растворимый носитель, подходящий в качестве наполнителя для распыления сушкой,поверхностно-активное вещество для поддержания частиц в суспензии или повторной суспензии и вещество для предотвращения агломерации, действующее после введения фармацевтического состава пациенту, а также сушку распылением водной дисперсии после измельчения. 18. Способ по п.17, в котором измельчаемая водная дисперсия включает примерно от 10 до 30% мас./мас. соединения формулы I, примерно от 4 до 15% мас./мас. растворимого носителя, примерно от 0,1 до 0,4% мас./мас. поверхностно-активного вещества и примерно от 1 до 2% мас./мас. вещества, предотвращающего агломерацию. 19. Способ лечения и/или профилактики состояния тревоги, мании, депрессии, панических расстройств и/или агрессии, нарушений,связанных с субарахноидальным кровоизлиянием или невральным шоком, последствий, вызываемых отменой веществ, таких как кокаин, никотин, алкоголь и бензодиазепины, нарушений,подлежащих лечению и/или профилактике противосудорожными препаратами, таких как эпилепсия, включая посттравматическую эпилепсию, болезнь Паркинсона, психоз, мигрень, церебральная ишемия, болезнь Альцгеймера и другие дегенеративные заболевания, такие как хорея Хантингдона, шизофрения, навязчивые компульсивные состояния, неврологические дефициты, связанные со СПИДом, нарушения сна (включая нарушения циркадного ритма,бессонницу и нарколепсию), тики (например,синдром Жиль де ла Туретта), травматическое повреждение мозга, шум в ушах, невралгию,особенно невралгию тройничного нерва, невропатическую боль, зубную боль, боль при раке,неправильную нейронную активность, приводящую к нейродистезии при таких заболеваниях, как диабет, рассеянный склероз и заболевание двигательных нейронов, атаксия, мышечная 22 ригидность (спастичность), дисфункция височно-нижнечелюстного сустава и/или боковой амиотрофический склероз, включающий введение больному, нуждающемуся в этом, эффективного или профилактического количества композиции по любому из пп.1-16. 20. Применение композиции по любому из пп.1-16 для получения лекарственного средства для лечения и/или профилактики состояния тревоги, мании, депрессии, паники и/или агрессии,нарушений, вызываемых субарахноидальным кровоизлиянием или невральным шоком, последствий, вызываемых отменой веществ, таких как кокаин, никотин, алкоголь и бензодиазепины; нарушений, подлежащих лечению и/или профилактике противосудорожными препаратами, таких как эпилепсия, включая посттравматическую эпилепсию, болезнь Паркинсона,психоз, мигрень, церебральная ишемия, болезнь Альцгеймера и другие дегенеративные заболевания, такие как хорея Хантингдона, шизофрения, навязчивые компульсивные состояния,неврологические дефициты, связанные со СПИДом, нарушения сна (включая нарушения циркадного ритма, бессонницу и нарколепсию),тики (например, синдром Жиль де ла Туретта),травматическое повреждение мозга, шум в ушах, невралгию, особенно невралгию тройничного нерва, невропатическую боль, зубную боль, боль при раке, неправильную нейронную активность, приводящую к нейродистезии при таких заболеваниях, как диабет, рассеянный склероз и заболевание двигательных нейронов,атаксия, мышечная ригидность (спастичность),дисфункция височно-нижнечелюстного сустава и/или боковой амиотрофический склероз. 21. Способ лечения и/или профилактики состояния тревоги, мании, депрессии, паники и/или агрессии, нарушений, вызываемых субарахноидальным кровоизлиянием или невральным шоком, последствий, вызываемых отменой веществ, таких как кокаин, никотин, алкоголь и бензодиазепины, нарушений, подлежащих лечению и/или профилактике противосудорожными препаратами, таких как эпилепсия, включая посттравматическую эпилепсию, болезнь Паркинсона, психоз, мигрень, церебральная ишемия,болезнь Альцгеймера и другие дегенеративные заболевания, такие как хорея Хантигдона, шизофрения, навязчивые компульсивные состояния, неврологические дефициты, связанные со СПИДом, нарушения сна (включая нарушения циркадного ритма, бессонницу и нарколепсию),тики (например, синдром Жиль де ла Туретта),травматическое повреждение мозга, шум в ушах, невралгию, особенно невралгию тройничного нерва, невропатическую боль, зубную боль, боль при раке, неправильную нейронную активность, приводящую к нейродистезии при таких заболеваниях, как диабет, рассеянный склероз и заболевание двигательных нейронов,атаксия, мышечная ригидность (спастичность), 23 дисфункция височно-нижнечелюстного сустава и/или боковой амиотрофический склероз, включающий введение пациенту, нуждающемуся в этом, эффективного количества соединения формулы I или его фармацевтически приемле 24 мой соли или сольвата и, необязательно, фармацевтически приемлемого носителя.
МПК / Метки
МПК: A61K 9/10, A61P 25/00
Метки: фармацевтические, лекарственные, микронизированные, композиции, средства, содержащие, бициклические
Код ссылки
<a href="https://eas.patents.su/13-3732-farmacevticheskie-kompozicii-soderzhashhie-mikronizirovannye-biciklicheskie-lekarstvennye-sredstva.html" rel="bookmark" title="База патентов Евразийского Союза">Фармацевтические композиции, содержащие микронизированные бициклические лекарственные средства</a>
Следующий патент: Способ получения (гетеро) ароматических гидроксиламинов
Случайный патент: Стопчатые моделированные биоматериалы и/или подложки для тканевой инженерии