Получение 3,5-диоксогексаноата в 2 стадии
Формула / Реферат
1. Способ получения соединения формулы (II)
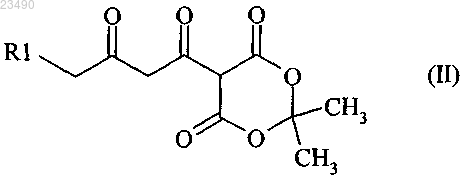
R1 обозначает Cl, Br и CN;
способ включает стадию (С) и стадию (В);
стадию (В) проводят после стадии (С);
стадия (С) включает реакцию соединения формулы (VI) с соединением (С1) с получением соединения формулы (IV)
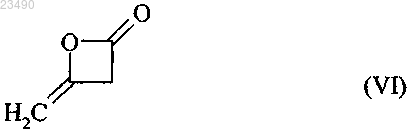
соединение (С1) выбрано из группы, состоящей из Cl2, Br2 и ClBr;
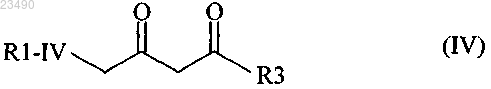
стадия (В) включает реакцию соединения формулы (IV) с соединением формулы (V) в присутствии основания (В')
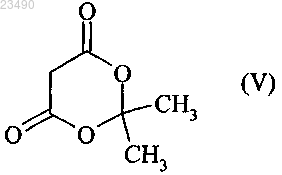
R1-IV и R3 являются одинаковыми или разными и независимо друг от друга обозначают Cl или Br;
основание (В') выбрано из группы, состоящей из N(R4)(R5)R6, 1,4-диазабицикло[2.2.2]октана, 1,8-диазабицикло[5.4.0]ундец-7-ена, пиридина, пиридина, замещенного 1 или 2 независимо выбранными одинаковыми или разными С1-С2-алкильными остатками, N,N-диметил-4-пиридинамина, морфолина, 4-метилморфолина, 1-метилпиперидина, имидазола, бензимидазола, 2-метилимидазола, 4-метилимидазола, 2-этилимидазола, 2-этил-4-метилимидазола, 2-изопропилимидазола, 2-фенилимидазола, 4-фенилимидазола, пиколина, и их смесей;
R4, R5, R6 являются одинаковыми или разными и независимо друг от друга выбраны из группы, состоящей из Н, С1-С15-алкила, С5-С6-циклоалкила, (C(R16)R17)mN(R12)R13 и фенила, при условии, что по меньшей мере один из остатков R4, R5 или R6 не обозначает Н;
R12 и R13 являются одинаковыми или разными и независимо друг от друга обозначают Н или С1-С15-алкил;
m равно 2, 3, 4, 5 или 6;
R16 и R17 являются одинаковыми или разными и независимо друг от друга выбраны из группы, состоящей из Н, метила и этила;
при условии, что если R1 в формуле (II) обозначает CN, то стадия (В) дополнительно включает реакцию (B-add) продукта реакции на стадии (В) с соединением (В1);
соединение (В1) выбрано из группы, состоящей из NaCN, KCN, Si(R9)(R10)(R11)CN, HCN, тетрабутиламмонийцианида, 1-цианобензотриазола и триселендицианида и их смесей;
R9, R10 и R11 являются одинаковыми или разными и независимо друг от друга выбраны из группы, состоящей из С1-С4-алкила и фенила.
2. Способ по п.1, в котором R1-IV и R3 являются одинаковыми и обозначают Cl или Br.
3. Способ по п.1 или 2, в котором
R4, R5, R6 являются одинаковыми или разными и независимо друг от друга выбраны из группы, состоящей из циклогексила, фенила, метила, этила, н-пропила, изопропила, н-бутила, изобутила, втор-бутила, трет-бутила и (CH2)mN(R12)R13;
R12 и R13 являются одинаковыми или разными и независимо друг от друга выбраны из группы, состоящей из Н, метила, этила, н-пропила, изопропила, н-бутила, изобутила, втор-бутила и трет-бутила;
m равно 2, 3 или 4.
4. Способ по п.1 или 2, в котором
основание (В') выбрано из группы, состоящей из NEt3, тетраметилэтилендиамина и N,N-диметил-4-пиридинамина и их смесей.
5. Способ по пп.1-4, в котором R9, R10 и R11 являются одинаковыми и выбраны из числа С1-С4-алкилов.
6. Способ по пп.1-5, в котором соединение (В1) представляет собой NaCN или KCN.
7. Способ по пп.1-6, в котором реакцию на стадии (В) проводят в растворителе (В"), выбранном из группы, состоящей из гексанов, гептанов, дихлорметана, дихлорэтана, хлороформа, тетрахлорида углерода, толуола, ксилола, мезитилена, диоксана, метил-трет-бутилового эфира и их смесей.
8. Способ по пп.1-7, в котором соединение (С1) представляет собой Cl2 или Br2.
9. Способ по пп.1-8, в котором реакцию на стадии (С) проводят в растворителе (С"), выбранном из группы, состоящей из гексана, гептана, дихлорметана, дихлорэтана, хлороформа, тетрахлорида углерода, толуола, ксилола, мезитилена, диоксана, метил-трет-бутилового эфира и их смесей.
10. Способ по пп.1-9, в котором соединение (С1) представляет собой Cl2, R1-IV и R3 обозначают Cl и R1 обозначает Cl или CN.
11. Способ по пп.1-9, в котором способ дополнительно включает стадию (А);
стадию (А) проводят после стадии (В);
стадия (А) включает реакцию соединения формулы (II) с соединением формулы (III) с получением соединения формулы (I)

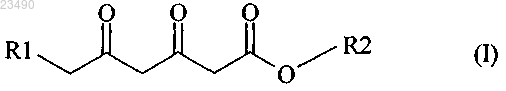
R2 обозначает С1-С4-алкил.
12. Способ по п.11, в котором R1 обозначает Cl или CN.
13. Способ по п.11 или 12, в котором R2 обозначает этил или трет-бутил.
Текст
В изобретении описан способ получения трет-бутил-6-хлор-3,5-диоксогексаноата из производного кислоты Мельдрума и его применение для получения трет-бутил-(4R,6S)-(6-гидроксиметил-2,2 диметил-1,3-диоксан-4-ил)ацетата (БГА), росувастатина и аторвастатина. Настоящее изобретение относится к способу получения трет-бутил-6-хлор-3,5-диоксогексаноата из производного кислоты Мельдрума и к его применению для получения трет-бутил-(4R,6S)-(6 гидроксиметил-2,2-диметил-1,3-диоксан-4-ил)ацетата (БГА), росувастатина и аторвастатина. БГА является промежуточным продуктом для получения росувастатина и аторвастатина, которые являются активными фармацевтическими ингредиентами, использующимися для приготовления соответствующих лекарственных средств, предназначенных для уменьшения высокого уровня холестерина и лечения родственных патологических состояний и для предупреждения сердечно-сосудистого заболевания. БГА получают из 3,5-диоксогексаноата. В ЕР 1024139 В раскрыт способ получения БГА, включающий реакцию ацетата с производным гидроксимасляной кислоты с получением промежуточного 3,5-диоксогексаноата. В публикации Tetrahedron 55 (1999) 4783-4792 описан синтез 3,6- и 5,6-диалкил-4-гидрокси-2 пиронов с помощью кислоты Мельдрума. В WO 01/72706 А раскрыт многостадийный способ получения БГА и неявным образом раскрыт предшественник, который является продуктом конденсации производного -кетомасляной кислоты и кислоты Мельдрума; его гидролиз дает соответствующее производное 3,5-диоксогексановой кислоты,предшественник БГА. Преимущества настоящего изобретения по сравнению со способом, раскрытым вWO 01/72706 А, описаны ниже. Известные способы получения промежуточного 3,5-диоксогексаноата, который используют для получения БГА, представляют собой многостадийные методики, включающие использование содержащих металл оснований, полученных, например, из лития или магния. Необходим упрощенный способ получения промежуточного 3,5-диоксогексаноата, требующий меньшее количества стадий, не включающий использование содержащих металл оснований, полученных из лития или магния и обеспечивающий более высокий выход и более чистые продукты, которые можно выделить простым путем. Согласно изобретению неожиданно обнаружен эффективный способ, в котором использутся промежуточная кислота Мельдрума. Если не указано иное, используются следующие аббревиатуры. В приведенном ниже описании галоген означает F, Cl, Br или I, предпочтительно Cl, Br или I; более предпочтительно Cl или Br; алкил означает линейный и разветвленный алкил; если не указано иное. Объектом настоящего изобретения является способ получения соединения формулы (II) где R1 обозначает Cl, Br и CN; способ включает стадию (С) и стадию (В); стадию (В) проводят после стадии (С); стадия (С) включает реакцию на стадии (С) соединения формулы (VI) с соединением (С 1) с получением соединения формулы (IV) соединение (С 1) выбрано из группы, состоящей из Cl2, Br2 и ClBr; стадия (В) включает реакцию на стадии (В) соединения формулы (IV), которое было получено на стадии (С), с соединением формулы (V) в присутствии основания, применяемого на стадии (В)R1-IV и R3 являются одинаковыми или разными и независимо друг от друга обозначают Cl или Br; Основание, применяемое на стадии (В), выбрано из группы, состоящей из N(R4)(R5)R6, 1,4 диазабицикло[2.2.2]октана, 1,8-диазабицикло[5.4.0]ундец-7-ена, пиридина, пиридина, содержащего 1 или 2 одинаковых или разных заместителя, независимо друг от друга выбранных из группы, состоящей из метила, этила, N,N-диметил-4-пиридинамина, морфолина, 4-метилморфолина, 1-метилпиперидина, имидазола, бензимидазола, 2-метилимидазола, 4-метилимидазола, 2-этилимидазола, 2-этил-4-метил-1 023490R4, R5, R6 являются одинаковыми или разными и независимо друг от друга выбраны из группы, состоящей из Н, C1-C15-алкила, C5-С 6-циклоалкила, (C(R16)R17)mN(R12)R13 и фенила, при условии, что по меньшей мере один из остатков R4, R5 или R6 не обозначает Н;R12 и R13 являются одинаковыми или разными и независимо друг от друга обозначают Н или C1C15-алкил;R16 и R17 являются одинаковыми или разными и независимо друг от друга выбраны из группы, состоящей из Н, метила и этила; при условии, что если R1 в формуле (II) обозначает CN, то стадия (В) дополнительно включает реакцию (B-add) продукта реакции на стадии (В) с соединением (В 1), реакцию (B-add) проводят после реакции на стадии (В); соединение (В 1) выбрано из группы, состоящей из NaCN, KCN, Si(R9)(R10)(R11)CN, HCN, тетрабутиламмонийцианида, 1-цианобензотриазола и триселендицианида и их смесей;R9, R10 и R11 являются одинаковыми или разными и независимо друг от друга выбраны из группы,состоящей из C1-C4-алкила и фенила. Формула (IV) включает все возможные таутомерные формы соединения формулы (IV). Формула (V) включает все возможные таутомерные формы соединения формулы (V). Основание, применяемое на стадии (В), соединение формулы (IV) и соединение формулы (V) можно добавлять в любой последовательности. Предпочтительно, если основание, применяемое на стадии (В), используют для депротонирования фрагмента СН 2 соединения формулы (V). Предпочтительно, если депротонированное соединение формулы (V) добавляют к соединению формулы (IV) или наоборот. Продукт реакции на стадии (В), который вводят в реакцию с соединением (В 1) при проведении реакции (B-add) на стадии (В) после проведения реакции на стадии (В), представляет собой соединение формулы (II-R1-IV) в которой R1-IV является таким, как определено выше, также включая все его предпочтительные варианты осуществления. Формула (II-R1-IV) включает все возможные таутомерные формы соединения формулы (II-R1-IV). Соединения формул (IV) и (V) являются известными соединениями и их можно получить по известным методикам. Предпочтительно, если R1-IV и R3 являются одинаковыми и обозначают Cl или Br. Предпочтительно, если R1-IV и R3 обозначают Cl. Предпочтительно, если R4, R5, R6 являются одинаковыми или разными и независимо друг от друга выбраны из группы, состоящей из циклогексила, фенила, метила, этила, н-пропила, изопропила, нбутила, изобутила, втор-бутила, трет-бутила и (CH2)mN(R12)R13;R12 и R13 являются одинаковыми или разными и независимо друг от друга выбраны из группы, состоящей из Н, метила, этила, н-пропила, изопропила, н-бутила, изобутила, втор-бутила и трет-бутила;m равно 2, 3 или 4. Более предпочтительно, если R4, R5, R6 являются одинаковыми или разными и независимо друг от друга выбраны из группы, состоящей из циклогексила, фенила, метила, этила, н-пропила, изопропила иR12 и R13 являются одинаковыми или разными и независимо друг от друга выбраны из группы, состоящей из Н, метила, этила, н-пропила и изопропила; m равно 2, 3 или 4. Еще более предпочтительно, если R4, R5, R6 выбраны из группы, состоящей из циклогексила, фенила, метила, этила, н-пропила, изопропила и (CH2)mN(R12)R13;m равно 2. Особенно предпочтительно, если R4, R5, R6 обозначают метил или этил и (CH2)mN(R12)R13;m равно 2. Основание должно обладать способностью депротонировать фрагмент СН 2 соединения формулы(V). Предпочтительно, если значение pKa соответствующей протонированной формы основания, применяемого на стадии (В), составляет от 5 до 40, более предпочтительно от 6 до 18, еще более предпочтительно от 6 до 13. Предпочтительно, если основание, применяемое на стадии (В), выбрано из группы, состоящей изN(R4)(R5)R6, 1,4-диазабицикло[2.2.2]октана, 1,8-диазабицикло[5.4.0]ундец-7-ена, пиридина, пиридина,замещенного 1 или 2 независимо выбранными одинаковыми или разными C1-C2-алкильными остатками,N,N-диметил-4-пиридинамина, морфолина, 4-метилморфолина, 1-метилпиперидина, имидазола, бензимидазола, 2-метилимидазола, 4-метилимидазола, 2-этилимидазола, 2-этил-4-метилимидазола, 2 изопропилимидазола, 2-фенилимидазола, 4-фенилимидазола, пиколина и их смесей;R4, R5, R6 обозначают метил или этил и (CH2)mN(R12)R13;m равно 2. Еще более предпочтительно, если основание, применяемое на стадии (В), выбрано из группы, состоящей из N(R4)(R5)R6, 1,4-диазабицикло[2.2.2]октана, 1,8-диазабицикло[5.4.0]ундец-7-ена, пиридина,пиридина, замещенного 1 или 2 независимо выбранными одинаковыми или разными C1-C2-алкильными остатками, N,N-диметил-4-пиридинамина, морфолина, имидазола, бензимидазола, 2-метилимидазола, 4 метилимидазола, 2-этилимидазола, 2-этил-4-метилимидазола, 2-изопропилимидазола, 2-фенилимидазола,4-фенилимидазола, пиколина и их смесей;R4, R5, R6 обозначают метил или этил и (CH2)mN(R12)R13;m равно 2. Особенно предпочтительно, если основание, применяемое на стадии (В), выбрано из группы, состоящей из NEt3, тетраметилэтилендиамина и N,N-диметил-4-пиридинамина и их смесей. Предпочтительно, если R9, R10 и R11 являются одинаковыми и выбраны из числа С 1-С 4-алкилов. Более предпочтительно, если R9, R10 и R11 обозначают метил. Предпочтительно, если соединение (В 1) представляет собой NaCN или KCN. Реакцию на стадии (В) можно провести в растворителе, применяемом на стадии (В). Предпочтительно, если растворитель, применяемый на стадии (В), выбран из группы, состоящей из гексанов, гептанов, дихлорметана, дихлорэтана, хлороформа, тетрахлорид углерода, толуола, ксилола, мезитилена, диоксана, метил-трет-бутилового эфира и их смесей. Предпочтительно, если растворителем, применяемым на стадии (В), является дихлорметан. Предпочтительно, если температура проведения реакции на стадии (В) составляет от -78 до 100 С,более предпочтительно от -50 до 50 С, еще более предпочтительно от -25 до 25 С, особенно предпочтительно от -15 до 25 С. Предпочтительно, если реакцию на стадии (В) проводят при давлении в диапазоне от атмосферного давления до 60 бар, более предпочтительно от атмосферного давления до 10 бар, еще более предпочтительно от атмосферного давления до 2 бар, особенно предпочтительно при атмосферном давлении. Предпочтительно, если время проведения реакции на стадии (В) составляет от 5 мин до 24 ч, более предпочтительно от 5 мин до 12 ч, еще более предпочтительно от 1 до 5 ч, особенно предпочтительно от 2 до 3 ч. Предпочтительно, если количество соединения формулы (V) составляет от 0,5 до 10 мол.экв., более предпочтительно от 0,9 до 5 мол.экв., еще более предпочтительно от 0,95 до 1,25 мол.экв., особенно предпочтительно от 0,98 до 1,05 мол.экв. в пересчете на 1 моль соединения формулы (IV). Предпочтительно, если масса растворителя, применяемого на стадии (В), в 1-100 раз, более предпочтительно в 5-50 раз, еще более предпочтительно в 5-20 раз, особенно предпочтительно в 5-15 раз больше массы соединения формулы (IV). Предпочтительно, если молярное содержание основания, применяемого на стадии (В), в 0,5-10 раз,более предпочтительно в 0,95-3 раза превышает молярное содержание соединения формулы (V). Предпочтительно, если реакцию на стадии (В) проводят в инертной атмосфере. После проведения реакции на стадии (В) соединение формулы (II) можно выделить из реакционной смесей, полученной при проведении реакции на стадии (В), по стандартным методикам, известным специалисту в данной области техники, таким как подкисление, фильтрование, выпаривание летучих компонентов, экстракция, промывка, сушка, концентрирование, кристаллизация, перегонка и любая их комбинация. Любую органическую фазу необязательно можно сушить, предпочтительно над сульфатом магния или сульфатом натрия. Соединение формулы (II) необязательно можно выделить из реакционной смеси путем добавления кислоты, применяемой на стадии (В). Поэтому другим объектом настоящего изобретения является способ, который дополнительно включает стадию (ACID); стадию (ACID) проводят после стадии (В); стадия (ACID) включает объединение реакционной смеси, полученной на стадии (В), с кислотой,применяемой на стадии (В). На стадии (ACID) реакционную смесь, полученную на стадии (В), можно добавить к кислоте, применяемой на стадии (В), или наоборот. Кислота, применяемая на стадии (В), выбрана из группы, состоящей из полимерной смолы на основе сульфоновой кислоты, толуолсульфоновой кислоты, HCl, H2SO4, лимонной кислоты, винной кислоты,уксусной кислоты, хлорида аммония, щавелевой кислоты, фосфорной кислоты и их смесей, предпочтительно, если кислота, применяемая на стадии (В), представляет собой полимерную смолу на основе сульфоновой кислоты. В случае, если кислоту, применяемую на стадии (В), добавляют к реакционной смеси, полученной на стадии (В), то предпочтительно, если кислоту, применяемую на стадии (В), используют без добавления воды или, по меньшей мере, в виде смеси лишь с небольшим количеством воды, например, в виде газа в случае HCl, без кристаллической воды в случае, например, лимонной или винной кислоты или в виде концентрированной H2SO4 в случае серной кислоты. В этом случае содержание воды в кислоте, применяемой на стадии (В), предпочтительно составляет от 0 до 5 мас.%, более предпочтительно от 0 до 2,5 мас.%, еще более предпочтительно от 0 до 2 мас.%,значения в мас.% указаны в пересчете на полную массу кислоты, применяемой на стадии (В). Если реакционную смесь, полученную на стадии (В), добавляют к кислоте, применяемой на стадии(В), то кислоту, применяемую на стадии (В), предпочтительно используют в виде смеси с водой и содержание воды в кислоте, применяемой на стадии (В), предпочтительно составляет от 0,5 до 99 мас.%. Предпочтительно, если на стадии (В) не добавляют воду. Если на стадии (ACID) не добавляют воду, то воду или смесь кислоты, применяемой на стадии (В), с водой можно добавить после проведения стадии (ACID). Предпочтительно, если количество кислоты, применяемой на стадии (В), составляет от 0,5 до 10,более предпочтительно от 1 до 3, еще более предпочтительно от 1,2 до 2 мол.экв. в случае, если кислотой, применяемой на стадии (В), не является полимерная смола на основе сульфоновой кислоты, тогда как в случае, если кислотой, применяемой на стадии (В), является полимерная смола на основе сульфоновой кислоты, то кислоту, применяемую на стадии (В), используют в таком количестве, что содержание сульфоновых групп, содержащихся в кислоте, применяемой на стадии (В), составляет от 0,5 до 10, более предпочтительно от 1 до 5, еще более предпочтительно от 1,3 до 2 мол.экв., значения в мол.экв. указаны в пересчете на молярное содержание основания, применяемого на стадии (В). Предпочтительно, если кислоту, применяемую на стадии (В) добавляют в таком количестве, что обеспечивается значение рН, равное от 0 до 7, более предпочтительно от 0,5 до 7, еще более предпочтительно от 1 до 7, особенно предпочтительно от 1 до 4, еще более предпочтительно от 1 до 2. Полимерной смолой на основе сульфоновой кислоты предпочтительно является кислотная катионообменная смола, более предпочтительно сильно кислотная катионообменная смола, например, такая,как использующаяся в кислотном гетерогенном катализе. Предпочтительно, если полимерная смола на основе сульфоновой кислоты обладает средней молекулярной массой, равной от 1000 до 1000000 Да; и/или предпочтительно обладает концентрацией кислых центров, составляющей от 1 до 15, более предпочтительно от 1 до 11,6, еще более предпочтительно от 1 до 10, особенно предпочтительно от 1 до 8, еще более предпочтительно от 1 до 7 экв./кг смолы; и/или предпочтительно обладает кислотным числом, равным от 1 до 650, более предпочтительно от 1 до 560,еще более предпочтительно от 1 до 450, особенно предпочтительно от 1 до 350, более предпочтительно от 50 до 650, еще более предпочтительно от 1 до 560, особенно предпочтительно от 50 до 450, еще более предпочтительно от 50 до 350; и/или предпочтительно обладает средним размером частиц, равным от 4 до 800 меш, более предпочтительно от 4 до 400 меш. Концентрацию кислых центров определяют по методике Master Test Method МТМ 0232, Edition 1.4, Rohm and Haas Company, 1998, в которой содержание летучих веществ в катализаторе определяют по методике Master Test Method МТМ 0126, Edition 1.6,Rohm and Haas Company, 2000. Кислотное число определяют в соответствии со стандартом DIN EN ISO 3682. Дополнительная информация о кислотном числе и его взаимосвязи с концентрацией кислых центров приведена в публикации "BASF Handbuch Lackiertechnik", Artur Goldschmidt and Hans-Joachim Streitberger, Vincentz Verlag,2002, ISBN 3-87870-324-4, chapter 2.3.2.2 (pages 272-273). В соответствии с приведенным в ней описанием концентрация кислых центров, равная 1 экв./кг, соответствует кислотному числу, равному 56, поэтому концентрация кислых центров, равная 4,7 экв./кг, соответствует кислотному числу, равному 263. Особенно предпочтительно, если полимерная смола на основе сульфоновой кислоты выбрана из группы, состоящей из сульфонированных полистирольных смол, сульфонированных полистирольных смол, сшитых дивинилбензолом и поли(2-акриламидо-2-метил-1-пропансульфоновой кислотой). Сульфонированные полистирольные смолы, сшитые дивинилбензолом, также называют сополимером дивинилбензола со стиролсульфоновой кислотой. Одним примером полимерной смолы на основе сульфоновой кислоты является Amberlyst 15 DRY. После добавления кислоты, применяемой на стадии (В), смесь можно профильтровать. Предпочтительно, если любые летучие компоненты реакционной смеси удаляют путем выпаривания при пониженном давлении. Любое концентрирование предпочтительно проводят путем перегонки предпочтительно при пони-4 023490 женном давлении. Еще более предпочтительно, если реакционную смесь подкисляют, органическую фазу отделяют и концентрируют. Особенно предпочтительно, если кислота, применяемая на стадии (В), представляет собой полимерную смолу на основе сульфоновой кислоты и растворитель, применяемый на стадии (В) выбирают таким образом, что кислота, применяемая на стадии (В), не растворима в растворителе, применяемом на стадии (В). Таким образом, после подкисления путем добавления полимерной смолы на основе сульфоновой кислоты реакционную смесь можно профильтровать, отфильтровывая при этом смолу, и выделить соединение путем выпаривания растворителя, применяемого на стадии (В). При этом нет необходимости добавлять воду. Соединение формулы (II) можно очистить по стандартным методикам, известным специалисту в данной области техники, предпочтительно путем кристаллизации или перегонки при пониженном давлении. Соединение формулы (VI) является известным соединением и его можно получить по известным методикам. Предпочтительно, если соединение (С 1) представляет собой Cl2 или Br2, более предпочтительно Cl2. Еще более предпочтительно, если соединение (C1) представляет собой Cl2, R1-IV и R3 обозначаютCl и R1 обозначает Cl или CN. Реакцию на стадии (С) можно провести в растворителе, применяемом на стадии (С). Предпочтительно, если растворитель, применяемый на стадии (С), выбран из группы, состоящей из гексана, гептана, дихлорметана, дихлорэтана, хлороформа, тетрахлорид углерода, толуола, ксилола, мезитилена, диоксана, метил-трет-бутилового эфира и их смесей. Предпочтительно, если растворителем, применяемым на стадии (С), является дихлорметан. Предпочтительно, если температура проведения реакции на стадии (С) составляет от -78 до 100 С,более предпочтительно от -40 до 40 С, еще более предпочтительно от -25 до 25 С, особенно предпочтительно от -20 до 20 С. Предпочтительно, если реакцию на стадии (С) проводят при давлении в диапазоне от атмосферного давления до 60 бар, более предпочтительно от атмосферного давления до 10 бар, еще более предпочтительно от атмосферного давления до 2 бар, особенно предпочтительно при атмосферном давлении. Предпочтительно, если время проведения реакции на стадии (С) составляет от 1 мин до 24 ч, более предпочтительно от 1 мин до 12 ч, еще более предпочтительно от 1 мин до 6 ч, особенно предпочтительно от 10 мин до 2 ч. Предпочтительно, если количество соединения (C1) составляет от 0,9 до 10 мол.экв., более предпочтительно от 0,95 до 2 мол.экв., еще более предпочтительно от 0,98 до 1,05 мол.экв. в пересчете на 1 моль соединения формулы (VI). Предпочтительно, если масса растворителя, применяемого на стадии (С) в 1-100 раз, более предпочтительно в 5-50 раз, еще более предпочтительно в 5-20 раз, особенно предпочтительно в 5-15 раз больше массы соединения формулы (VI). Предпочтительно, если реакцию на стадии (С) проводят в инертной атмосфере. После проведения реакции на стадии (С) соединение формулы (IV) можно выделить из реакционной смеси, полученной при проведении реакции на стадии (С), по стандартным методикам, известным специалисту в данной области техники, таким как подкисление, фильтрование, выпаривание летучих компонентов, экстракция, промывка, сушка, концентрирование, кристаллизация, перегонка и любая их комбинация. Соединение формулы (IV) также можно не выделять, а использовать в следующей реакции, не выделяя. Любую органическую фазу необязательно можно сушить предпочтительно над сульфатом магния или сульфатом натрия. Предпочтительно, если способ дополнительно включает стадию (А), где способ является таким, как определено в настоящем изобретении, также включая все их предпочтительные варианты осуществления; стадию (А) проводят после стадии (В); стадия (А) включает реакцию на стадии (А) соединения формулы (II), которое было получено на стадии (В), с соединением формулы (III) с получением соединения формулы (I)R2 обозначает C1-С 4-алкил. Формула (I) включает все возможные таутомерные формы соединения формулы (I). Формула (II) включает все возможные таутомерные формы соединения формулы (II). Возможными таутомерами соединения формулы (I) являются, в частности, соединение формулы (I-5 023490 Возможными таутомерами соединения формулы (II) являются, в частности, соединение формулыR1 обозначает Cl или CN. Предпочтительно, если R2 выбран из группы, состоящей из метила, этила, н-пропила, изопропила,н-бутила, изобутила, втор-бутила и трет-бутила; более предпочтительно, если R2 обозначает этил или трет-бутил; еще более предпочтительно, если R2 обозначает трет-бутил. Особенно предпочтительно, если R1 обозначает Cl или CN, и R2 обозначает трет-бутил. Еще более предпочтительно, если R1 обозначает Cl или CN, R2 обозначает трет-бутил, соединение(С 1) представляет собой Cl2 и R1-IV и R3 обозначают Cl. Реакцию на стадии (А) можно провести в растворителе, применяемом на стадии (А). В принципе,можно использовать любой растворитель, который не мешает протеканию реакции и обладает температурой кипения, равной 50 С или выше. Предпочтительно, если растворитель, применяемый на стадии (А), выбран из группы, состоящей из гексана, гептана, дихлорметана, дихлорэтана, хлороформа, толуола, ксилола, мезитилена, диоксана, N,Nди-C1-C4-алкил-C1-С 4-монокарбоксамида, ди-С 1-С 2-алкилсульфоксида и их смесей. Предпочтительно, если соединение формулы (III) также выступает в качестве растворителя, применяемого на стадии (А). Предпочтительно, если соединение формулы (III) также выступает в качестве растворителя, применяемого на стадии (А), и не используют другой растворитель, применяемый на стадии (А). Предпочтительно, если температура проведения реакции на стадии (А) составляет от -40 до 180 С,более предпочтительно от 20 до 100 С, еще более предпочтительно от 20 до 150 С, особенно предпочтительно от 30 до 90 С, еще более предпочтительно от 40 до 85 С. Предпочтительно, если реакцию на стадии (А) проводят при давлении в диапазоне от атмосферного давления до 60 бар, более предпочтительно от атмосферного давления до 10 бар, еще более предпочтительно от атмосферного давления до 2 бар, особенно предпочтительно при атмосферном давлении. Предпочтительно, если время проведения реакции на стадии (А) составляет от 5 мин до 48 ч, более предпочтительно от 5 мин до 24 ч, более предпочтительно от 1 до 8 ч, еще более предпочтительно от 1 до 3 ч. Предпочтительно, если количество соединения формулы (III) составляет от 1 до 200 мол.экв., более предпочтительно от 1 до 100 мол.экв., еще более предпочтительно от 1 до 50 мол.экв. в пересчете на 1 моль соединения формулы (II). Предпочтительно, если масса растворителя, применяемого на стадии (А), в 0,1-100 раз, более предпочтительно в 0,1-50 раз, еще более предпочтительно в 0,1-20 раз, особенно предпочтительно в 0,1-10 раз больше массы соединения формулы (II). Обычно масса растворителя, применяемого на стадии (А), по меньшей мере в 2 или 5 раз больше массы соединения формулы (II), поэтому другими возможными диапазонами количества растворителя являются следующие: предпочтительно в 2-100 раз, более предпочтительно в 2-50 раз, еще более предпочтительно в 2-20 раз, особенно предпочтительно в 2-10 раз больше массы соединения формулы (II); или предпочтительно в 5-100 раз, более предпочтительно в 5-50 раз, еще более предпочтительно в 5-20 раз, особенно предпочтительно в 5-10 раз больше массы соединения формулы (II). Если соединение формулы (III) не используют в качестве растворителя, то предпочтительно, если количество соединения формулы (III) составляет от 1 до 2 мол.экв., более предпочтительно от 1 до 1,5 мол.экв., еще более предпочтительно от 1,1 до 1,5 мол.экв. в пересчете на 1 моль соединения формулы (II). Реакцию на стадии (А) можно провести в присутствии кислоты, применяемой на стадии (А). Предпочтительно, если кислота, применяемая на стадии (А), выбрана из группы, состоящей из полимерной смолы на основе сульфоновой кислоты, толуолсульфоновой кислоты, HCl, H2SO4, лимонной кислоты, винной кислоты, уксусной кислоты, хлорида аммония, щавелевой кислоты, фосфорной кислоты и их смесей, предпочтительно, если кислотой, применяемой на стадии (А), является HCl. Предпочтительно, если масса кислоты, применяемой на стадии (А), в 0,1-100 раз, более предпочтительно в 0,1-50 раз, еще более предпочтительно в 0,1-20 раз, особенно предпочтительно в 0,1-10 раз больше массы соединения формулы (II). Кислоту, применяемую на стадии (А), используют без добавления воды или в виде смесей с водой,например в виде водного раствора HCl или водного раствора H2SO4, или концентрированной H2SO4. Содержание воды в кислоте, применяемой на стадии (А), предпочтительно составляет от 0 до 99 мас.%, значения в мас.% указаны в пересчете на полную массу кислоты, применяемой на стадии (А). Предпочтительно, если реакцию на стадии (А) проводят в инертной атмосфере. После проведения реакции на стадии (А) соединение формулы (I) можно выделить из реакционной смеси, полученной при проведении реакции на стадии (А), по стандартным методикам, известным специалисту в данной области техники, таким как фильтрование, выпаривание летучих компонентов, экстракция, промывка, сушка, концентрирование, кристаллизация, перегонка и любая их комбинация. Окрашенные примеси необязательно можно удалить путем обычной известной обработки древесным углем, например, путем обработки реакционной смеси, полученной при проведении реакции на стадии (В) и/или полученной при проведении реакции на стадии (А), древесным углем. Любую органическую фазу необязательно можно сушить предпочтительно над сульфатом магния или сульфатом натрия. Предпочтительно, если любые летучие компоненты реакционной смеси удаляют путем выпаривания при пониженном давлении. Любое концентрирование предпочтительно проводят путем перегонки предпочтительно при пониженном давлении. Соединение формулы (I) можно очистить предпочтительно путем кристаллизации или перегонки при пониженном давлении. Стадию (ACID) проводят после стадии (В) и до стадии (А). Предпочтительно, если стадию (В), необязательно стадию (ACID) и затем стадию (А) проводят последовательно без выделения соединения формулы (II). Предпочтительно, если необязательный растворитель, применяемый на стадии (В), и необязательный растворитель, применяемый на стадии (А), являются одинаковыми. Более предпочтительно, если стадию (В) и стадию (А) проводят в одном реакторе и необязательный растворитель, применяемый на стадии (В), и необязательный растворитель, применяемый на стадии (А),являются одинаковыми. Предпочтительно, если стадию (С) и стадию (В) проводят последовательно без выделения соединения формулы (IV). Предпочтительно, если необязательный растворитель, применяемый на стадии (С), и необязательный растворитель, применяемый на стадии (В), являются одинаковыми. Более предпочтительно, если стадию (С) и стадию (В) проводят в одном реакторе и необязательный растворитель, применяеемый на стадии (С), и необязательный растворитель, применяемый на стадии (В),являются одинаковыми. Предпочтительно, если стадию (С), стадию (В) и стадию (А) проводят последовательно без выделения соединений формул (IV) и (II). Предпочтительно, если необязательный растворитель, применяемый на стадии (С), необязательный растворитель, применяемый на стадии (В), и необязательный растворитель, применяемый на стадии (А),являются одинаковыми. Более предпочтительно, если стадию (С), стадию (В) и стадию (А) проводят в одном реакторе и необязательный растворитель, применяемый на стадии (С), необязательный растворитель, применяемый на стадии (В), и необязательный растворитель, применяемый на стадии (А), являются одинаковыми. В другом предпочтительном варианте осуществления стадию (ACID) проводят после стадии (В),выделяют соединение формулы (II) и затем проводят стадию (А), растворителем, применяемым на ста-7 023490 дии (А). является соединение формулы (III); более предпочтительно, если кислота, применяемая на стадии (В), представляет собой полимерную смолу на основе сульфоновой кислоты и растворитель, применяемый на стадии (В), выбирают таким образом, что кислота, применяемая на стадии (В), не растворима в растворителе, применяемом на стадии (В). Каждую из стадий (С), (В), (А) и необязательную стадию (ACID) можно провести последовательно в проточном реакторе. Стадии (С) и (В) или стадии (С), (В), (А) и необязательную стадию (ACID) также можно провести последовательно и без перерывов в проточном реакторе без выделения какого-либо промежуточного продукта. Подходящие проточные реакторы известны в данной области техники, отсутствуют особые требования, предъявляемые к проточному реактору, подходящему для непрерывного проведения любой из стадий (С), (В) или (А). В способе, предлагаемом в настоящем изобретении, не требуется обязательное использование полученных из металлов оснований. Способ обеспечивает получение соединений формул (I) и (II) с высоким выходом и высокой чистотой, соединения обладают ярким белым цветом. После проведения реакции соединение формулы (II) можно выделить простым путем, в частности, в смеси органической и водной фазы происходит быстрое и явное разделение двух фаз, что существенно облегчает выделение. Другой простой методикой выделения соединений является добавление кислоты, предпочтительно нерастворимой полимерной смолы на основе сульфоновой кислоты, фильтрование и выпаривание растворителя,при этом можно не использовать воду. Способ не приводит к вредному воздействию на окружающую среду; в нем не используют токсичные вещества. Другим преимуществом является тот факт, что раскрытые способы можно осуществлять при температуре намного выше -78 С, которую обычно используют в методиках, в которых ядро С 6 соединения формулы (I) образуется при реакции предшественника С 4 с производным эфира уксусной кислоты, например при альдольной конденсации и аналогичных реакциях. Другими преимуществами реакции на стадии (А) являются побочные продукты: в качестве побочных продуктов образуются только диоксид углерода и ацетон, поэтому реакция на стадии (А) является экологически благоприятной методикой. Ацетон даже можно выделить и использовать для других целей. В WO 01/72706 А в примерах 1.4 и 1.5 раскрыт способ, включающий 6 стадий, начиная с получения исходного структурного блока С 2, который можно использовать для получения соединения формулы (I),которое является предшественником БГА: 1) хлоруксусную кислоту превращают в ее хлорангидрид, затем 2) вводят в реакцию с кислотой Мельдрума, затем 3) путем гидролиза превращают в соответствующее производное масляной кислоты, затем 4) повторно превращают в хлорангидрид кислоты, 5) повторно вводят в реакцию с кислотой Мельдрума и в заключение 6) путем этерификации превращают в соответствующее производное соединения формулы (I). Требуется по 2 экв. кислоты Мельдрума, хлора, основания и спирта. Способ, предлагаемый в настоящем изобретении, обеспечивает получение соединения формулы (I),которое является предшественником БГА, по 4-стадийной методике: 1) уксусную кислоту превращают в дикетен, 2) дикетен с помощью Cl2 превращают в производное хлорангидрида хлорированной масляной кислоты, затем 3) вводят в реакцию с кислотой Мельдрума и в заключение 4) путем этерификации превращают в соединение формулы (I). Требуется только по 1 экв. кислоты Мельдрума, хлора, основания и спирта. Кроме того, в отличие от способа, представленного в WO 01/72706 А на схеме 2 или на его стадииb), описанной в п.8 формулы изобретения, не требуются основания, образованные из магния или лития. Кроме того, хлорирующим реагентом, использующимся в настоящем изобретении, является Cl2, который является недорогим по сравнению с оксалилхлоридом, тионилхлоридом или PCl5, которые раскрыты в качестве возможных хлорирующих реагентов в WO 01/72706 А, стр. 8. На стадии добавления хлора к предшественнику не образуются отходы или побочные продукты, такие как СО 2, CO, SO2, SO3 или производные фосфора. Способ, предлагаемый в настоящем изобретении, обеспечивает последовательное проведение реакции на стадии (С) и реакции на стадии (В) без выделения промежуточного соединения формулы (IV), две реакции можно провести в одном и том же растворителе и даже в одном реакторе. Можно легко использовать непрерывный режим проведения реакции. Способ, предлагаемый в настоящем изобретении, обеспечивает получение ярких белых твердых веществ с высоким выходом, твердые вещества получают в виде суспензий, которые обладают хорошими характеристиками фильтрования. В отличие от WO 01/72706 А не образуется промежуточная свободная кислота, которая по своей природе обладает повышенной растворимостью в воде, что затрудняет ее выделение из органической фазы, использующейся в реакции. В способе, раскрытом в WO 01/72706 в примерах 1.4 и 1.5 и на схеме 1, в качестве исходного вещества используют свободную С 2-карбоновую кислоту и другую свободную С 4-карбоновую кислоту выделяют в виде промежуточного продукта. Примеры Список аббревиатур и исходных веществ.Amberlyst 15 DRY CAS 39389-20-3; сополимер дивинилбензола со стиролсульфоновой кислотой,сильно кислая катионообменная смола, использующаяся в кислотном гетерогенном катализе, является подходящим для катализа в неводной среде и обладает концентрацией кислых центров, равной по меньшей мере 4,7 экв./кг. Amberlyst 15 DRY является продуктом, выпускающимся фирмой Rohm and Haas,и его использовали в соответствии со спецификациями, опубликованными в августе 2005 г. ДБУ - 1,8-диазабицикло[5.4.0]ундец-7-ен,ДМАП - N,N-диметил-4-пиридинамин,ТМЭДАтетраметилэтилендиамин,экв. - эквивалент(ы). Пример 1 а. К раствору соединения формулы (VI) (5,25 г, 62,4 ммоль) в дихлорметане (50 мл), обладающему температурой, равной -15 С, при -15 С в течение 30 мин добавляли Cl2 (4,43 г, 62,4 ммоль). Образовывался раствор соединения формулы Затем этот раствор соединения формулы (1) в течение 45 мин добавляли к смеси, содержащей соединение формулы (V) (9 г, 62,4 ммоль), NEt3 (12,65 г, 124,9 ммоль) и дихлорметан (50 мл), обладающей температурой, равной -15 С. Полученную реакционную смесь перемешивали при 0 С в течение 2 ч. Добавляли Amberlyst 15 DRY (18 г) и охлаждение реакционной смесей прекращали и ей давали нагреться до комнатной температуры. Amberlyst 15 DRY отфильтровывали и к фильтрату добавляли водный раствор HCl (1 М раствор, 100 мл). Фазы разделяли, органическую фазу сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении и получали соединение формулы (2) в виде твердого вещества (15,1 г, 92%). Н ЯМР (ядерный магнитный резонанс) (400 МГц, CDCl3): (1,75 (s, 6H), 4,26 (s, 2 Н), 4,29 (s, 2H),14,8 (s, 1H). Пример 1b. К раствору соединения формулы (VI) (17,5 г, 0,21 моль) в дихлорметане (90 мл) при -15 С в течение 120 мин добавляли Cl2 (14,76 г, 0,21 моль). Реакционную смесь перемешивали при -10 С в течение 45 мин. Образовывался раствор соединения формулы (1). Затем к этому раствору соединения формулы (1) в течение 60 мин добавляли смесь, содержащую соединение формулы (V) (30 г, 0,21 моль), NEt3 (42,13 г,0,42 моль) и дихлорметан (100 мл), обладающую температурой, равной -15 С. Полученную реакционную смесь перемешивали при 0 С в течение 16 ч. Реакционную смесь при комнатной температуре подкисляли с помощью HCl (1 М раствор, 100 мл) и получали темно-коричневую смесь. Невозможно было однозначно распознать 2 фазы, поэтому разделение фаз проводили, исходя из рассчитанных предполагаемых объемов ожидаемых фаз. Фазы разделяли, органическую фазу 3 раза экстрагировали и сушили надNa2SO4. Твердые вещества отфильтровывали, фильтрование происходило медленно. Оставшийся растворитель удаляли в вакууме и получали соединение формулы (2) в виде темно-коричневого твердого вещества (52,2 г, 96%). Пример 1 с. К раствору соединения формулы (VI) (5,25 г, 62,4 ммоль) в дихлорметане (50 мл) при -15 С в течение 35 мин добавляли Cl2 (4,43 г, 62,4 ммоль). Образовывался раствор соединения формулы (1). Затем этот раствор соединения формулы (1) при -15 С в течение 60 мин добавляли к смеси, содержащей соединение формулы (V) (9 г, 62,4 ммоль), NEt3 (12,65 г, 124,9 ммоль) и дихлорметан (54 мл). Полученную реакционную смесь перемешивали при 0 С в течение 2,5 ч. Добавляли Amberlyst 15 DRY (18 г) и перемешивание продолжали в течение 30 мин. Затем реакционной смеси давали нагреться до комнатной температуры. Amberlyst 15 DRY отфильтровывали; реакционную смесь фильтровали через целит и в заключение концентрировали досуха и получали соединение формулы (2) в виде твердого вещества (14,2 г,87%). Пример 1d. К раствору соединения формулы (VI) (10,5 г, 0,13 моль) в дихлорметане (108 мл) при -20 С в течение 105 мин добавляли Cl2 (8,86 г, 0,13 моль). Образовывался раствор соединения формулы (1). Затем этот раствор соединения формулы (1) при -15 С в течение 90 мин добавляли к смеси, содержащей соеди-9 023490 нение формулы (V) (18 г, 0,13 моль), NEt3 (25,28 г, 0,25 моль) и дихлорметан (110 мл). Полученную реакционную смесь перемешивали при -10 С в течение 2,5 ч. Добавляли Amberlyst 15 DRY (32 г) и перемешивание продолжали при 0 С в течение 30 мин. Затем реакционную смесь фильтровали через диоксид кремния; затем при 2 С подкисляли с помощью HCl (1 М раствор, 150 мл). Фазы разделяли, водную фазу экстрагировали дихлорметаном (100 мл) и объединенные органические фазы сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении и получали соединение формулы (2) в виде твердого вещества (28,3 г, 86%). Пример 1 е. К раствору соединения формулы (VI) (7,87 г, 0,09 моль) в дихлорметане (77 мл) при -15 С в течение 60 мин добавляли Cl2 (6,44 г, 0,09 моль). Реакционную смесь перемешивали при -10 С в течение 75 мин. Образовывался раствор соединения формулы (1). Затем к этому раствору соединения формулы (1) в течение 60 мин добавляли смесь, содержащую соединение формулы (V) (10,8 г, 0,07 моль), NEt3 (16,68 г,0,16 моль) и дихлорметан (80 мл), обладающую температурой, равной -15 С. Полученную реакционную смесь перемешивали при -10 С в течение 16 ч. Реакционную смесь при 5 С подкисляли до рН 1 газообразным HCl (6 г) и получали желто-коричневую реакционную смесь. Добавляли воду (120 мл) и фазы разделяли и сушили над Na2SO4. Растворитель удаляли в вакууме и получали соединение формулы (2) в виде желтого твердого вещества (19,7 г, 80%). Пример 1f. К раствору соединения формулы (VI) (7,87 г, 0,09 моль) в дихлорметане (77 мл) при -15 С в течение 60 мин добавляли Cl2 (6,44 г, 0,09 моль). Реакционную смесь перемешивали при -10 С в течение 75 мин. Образовывался раствор соединения формулы (1). Затем к этому раствору соединения формулы (1) в течение 60 мин добавляли смесь, содержащую соединение формулы (V) (10,8 г, 0,07 моль), NEt3 (16,68 г,0,16 моль) и дихлорметан (80 мл), обладающую температурой, равной -15 С. Полученную реакционную смесь перемешивали при -10 С в течение 16 ч. Реакционную смесь при 5 С подкисляли до рН 1 концентрированной H2SO4 (13,3 г) и получали желто-коричневую смесь. Добавляли воду (120 мл) и фазы разделяли и сушили над Na2SO4. Растворитель удаляли в вакууме и получали соединение формулы (2) в виде коричневого твердого вещества (16,3 г, 66%). Пример 1g. К раствору соединения формулы (VI) (39,4 г, 0,469 моль) в дихлорметане (340 мл) при -15 С в течение 120 мин добавляли Cl2 (33,3 г, 469 моль). Реакционную смесь перемешивали при -10 С в течение 180 мин. Образовывался раствор соединения формулы (1). Затем к этому раствору соединения формулы (1) в течение 120 мин добавляли смесь, содержащую соединение формулы (V) (52 г, 0,361 моль), ТМЭДА(83,9 г, 0,722 моль) и дихлорметан (340 мл), обладающую температурой, равной -5 С. Полученную реакционную смесь перемешивали при -5 С в течение 4 ч. Реакционную смесь при 5 С переносили в водный раствор HCl (5 мас.% HCl в пересчете на полную массу водного раствора HCl, 658 г) и получали желтокоричневую смесь, обладающую значением рН ниже 2. После разделения фаз растворитель удаляли в вакууме и получали соединение формулы (2) в виде коричневого твердого вещества, обладающего чистотой, равной 80% (101 г, выход 86%). Пример 2 а. Смесь соединения формулы (2) (7,5 г, 28,3 ммоль), полученного в соответствии с примером 1, и трет-бутанола (75 мл, 0,81 моль) перемешивали при кипячении с обратным холодильником в течение 2,5 ч. Полученную реакционную смесь фильтровали через диоксид кремния и концентрировали при пониженном давлении и получали соединение формулы (3) (6,4 г, 96%). Н ЯМР (400 МГц, CDCl3): соотношение енольная форма (еф)/кето-форма (кф) = 86:14 (площадь:площадь);1,48 (s, 9 Н-еф), 1,49 (s, 9 Н-кф), 3,31 (s, 2 Н-еф), 3,49 (s, 2 Н-кф), 3,92 (s, 2 Н-кф), 4,06 (s,2 Н-еф), 4,20 (s, 2 Н-кф), 5,97 (s, 1 Н-еф). Пример 2b. Смесь соединения формулы (2) (5,2 г, 19,8 ммоль), полученного в соответствии с примером 1, и трет-бутанола (52 мл, 0,55 моль) перемешивали при кипячении с обратным холодильником в течение 2,5 ч. Полученную реакционную смесь концентрировали при пониженном давлении и получали соединение формулы (3) (4,5 г, 97%). Пример 2 с. Смесь соединения формулы (2) (20 г, 76 ммоль), полученного в соответствии с примером 1, третбутанола (56 г, 0,76 моль) и моногидрата п-толуолсульфоновой кислоты (0,66 г, 4 ммоль) перемешивали при 50 С в течение 3,5 ч. Полученную реакционную смесь растворяли в ДХМ (дихлорметан) (150 мл) и промывали водой (150 мл). Органическую фазу смешивали с водой (150 мл), добавляли водный растворNaOH (25% мас./мас.) до установления значения рН, равного 8,0-9,0, после разделения фаз добавляли 0,5 н. водный раствор HCl до установления значения рН, равного 2,5-3,5, и смесь концентрировали при пониженном давлении и получали соединение формулы (3) (14 г, выход 63%). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения соединения формулы (II)R1 обозначает Cl, Br и CN; способ включает стадию (С) и стадию (В); стадию (В) проводят после стадии (С); стадия (С) включает реакцию соединения формулы (VI) с соединением (С 1) с получением соединения формулы (IV) соединение (С 1) выбрано из группы, состоящей из Cl2, Br2 и ClBr; стадия (В) включает реакцию соединения формулы (IV) с соединением формулы (V) в присутствии основания (В')R1-IV и R3 являются одинаковыми или разными и независимо друг от друга обозначают Cl или Br; основание (В') выбрано из группы, состоящей из N(R4)(R5)R6, 1,4-диазабицикло[2.2.2]октана, 1,8 диазабицикло[5.4.0]ундец-7-ена, пиридина, пиридина, замещенного 1 или 2 независимо выбранными одинаковыми или разными С 1-С 2-алкильными остатками, N,N-диметил-4-пиридинамина, морфолина, 4 метилморфолина, 1-метилпиперидина, имидазола, бензимидазола, 2-метилимидазола, 4-метилимидазола,2-этилимидазола,2-этил-4-метилимидазола,2-изопропилимидазола,2-фенилимидазола,4 фенилимидазола, пиколина, и их смесей;R4, R5, R6 являются одинаковыми или разными и независимо друг от друга выбраны из группы, состоящей из Н, С 1-С 15-алкила, С 5-С 6-циклоалкила, (C(R16)R17)mN(R12)R13 и фенила, при условии, что по меньшей мере один из остатков R4, R5 или R6 не обозначает Н;R12 и R13 являются одинаковыми или разными и независимо друг от друга обозначают Н или С 1 С 15-алкил;R16 и R17 являются одинаковыми или разными и независимо друг от друга выбраны из группы, состоящей из Н, метила и этила; при условии, что если R1 в формуле (II) обозначает CN, то стадия (В) дополнительно включает реакцию (B-add) продукта реакции на стадии (В) с соединением (В 1); соединение (В 1) выбрано из группы, состоящей из NaCN, KCN, Si(R9)(R10)(R11)CN, HCN, тетрабутиламмонийцианида, 1-цианобензотриазола и триселендицианида и их смесей;R9, R10 и R11 являются одинаковыми или разными и независимо друг от друга выбраны из группы,состоящей из С 1-С 4-алкила и фенила. 2. Способ по п.1, в котором R1-IV и R3 являются одинаковыми и обозначают Cl или Br. 3. Способ по п.1 или 2, в которомR4, R5, R6 являются одинаковыми или разными и независимо друг от друга выбраны из группы, состоящей из циклогексила, фенила, метила, этила, н-пропила, изопропила, н-бутила, изобутила, вторбутила, трет-бутила и (CH2)mN(R12)R13;R12 и R13 являются одинаковыми или разными и независимо друг от друга выбраны из группы, состоящей из Н, метила, этила, н-пропила, изопропила, н-бутила, изобутила, втор-бутила и трет-бутила; пиридинамина и их смесей. 5. Способ по пп.1-4, в котором R9, R10 и R11 являются одинаковыми и выбраны из числа С 1-С 4 алкилов. 6. Способ по пп.1-5, в котором соединение (В 1) представляет собой NaCN или KCN. 7. Способ по пп.1-6, в котором реакцию на стадии (В) проводят в растворителе (В"), выбранном из группы, состоящей из гексанов, гептанов, дихлорметана, дихлорэтана, хлороформа, тетрахлорида углерода, толуола, ксилола, мезитилена, диоксана, метил-трет-бутилового эфира и их смесей. 8. Способ по пп.1-7, в котором соединение (С 1) представляет собой Cl2 или Br2. 9. Способ по пп.1-8, в котором реакцию на стадии (С) проводят в растворителе (С"), выбранном из группы, состоящей из гексана, гептана, дихлорметана, дихлорэтана, хлороформа, тетрахлорида углерода,толуола, ксилола, мезитилена, диоксана, метил-трет-бутилового эфира и их смесей. 10. Способ по пп.1-9, в котором соединение (С 1) представляет собой Cl2, R1-IV и R3 обозначают Cl и R1 обозначает Cl или CN. 11. Способ по пп.1-9, в котором способ дополнительно включает стадию (А); стадию (А) проводят после стадии (В); стадия (А) включает реакцию соединения формулы (II) с соединением формулы (III) с получением соединения формулы (I)R2 обозначает С 1-С 4-алкил. 12. Способ по п.11, в котором R1 обозначает Cl или CN. 13. Способ по п.11 или 12, в котором R2 обозначает этил или трет-бутил.
МПК / Метки
МПК: C07C 69/716, C07D 319/06, C07C 67/32
Метки: получение, 3,5-диоксогексаноата, стадии
Код ссылки
<a href="https://eas.patents.su/13-23490-poluchenie-35-dioksogeksanoata-v-2-stadii.html" rel="bookmark" title="База патентов Евразийского Союза">Получение 3,5-диоксогексаноата в 2 стадии</a>
Предыдущий патент: Заградительное устройство
Следующий патент: Способ ультразвуковой диагностики экспериментального неспецифического хронического орхоэпидидимита
Случайный патент: Пластинчатый электронагреватель












