Кристаллическое твердое основание разагилина
Формула / Реферат
1. Кристаллический R(+)-N-пропаргил-1-аминоиндан (разагилин).
2. Кристаллический R(+)-N-пропаргил-1-аминоиндан по п.1, характеризующийся порошковой рентгенограммой, имеющей пики 8,5; 12,6; 16,1 и 16,9 при угле дифракции в градусах 2q±0,2.
3. Кристаллический разагилин по п.2, дополнительно характеризующийся порошковой рентгенограммой, имеющей пики 20,3; 20,9; 25,4; 26,4 и 28,3 при угле дифракции в градусах 2q±0,2.
4. Кристаллический разагилин по любому из пп.1-3, характеризующийся температурой плавления 38-39°C при определении в открытом капилляре или 41°C при определении дифференциальной сканирующей калориметрией.
5. Фармацевтическая композиция, содержащая кристаллический R(+)-N-пропаргил-1-аминоиндан по любому из пп.1-4 и фармацевтически приемлемый носитель.
6. Фармацевтическая композиция по п.5, полученная для трансдермального применения.
7. Фармацевтическая композиция по п.6 в виде трансдермального пластыря.
8. Способ получения кристаллического R(+)-N-пропаргил-1-аминоиндана, включающий:
a) растворение соли R(+)-N-пропаргил-1-аминоиндана в воде с образованием раствора;
b) охлаждение указанного раствора до температуры приблизительно 0-15°C;
c) повышение основности указанного раствора до pH приблизительно 11 с образованием суспензии;
d) получение указанного кристаллического R(+)-N-пропаргил-1-аминоиндана из суспензии.
9. Способ по п.8, где кристаллический R(+)-N-пропаргил-1-аминоиндан обладает повышенной оптической чистотой по сравнению с R(+)-N-пропаргил-1-аминоинданом до кристаллизации.
10. Способ получения кристаллического R(+)-N-пропаргил-1-аминоиндана, который включает:
a) получение первого раствора R(+)-N-пропаргил-1-аминоиндана в органическом растворителе;
b) полное выпаривание растворителя из первого раствора в вакууме с образованием остатка;
c) растворение остатка во втором органическом растворителе с образованием второго раствора;
d) полное выпаривание второго органического растворителя из второго раствора в вакууме с образованием второго остатка;
e) выдерживание второго остатка при температуре в диапазоне от 0 до 25°C с образованием кристаллического R(+)-N-пропаргил-1-аминоиндана.
11. Способ по п.10, где органический растворитель и второй органический растворитель являются одинаковыми.
12. Способ по п.11, где органический растворитель и второй органический растворитель представляют собой спирты.
13. Способ по п.11, где органический растворитель и второй органический растворитель представляют собой изопропанол.
14. Способ по любому из пп.10-13, где кристаллический R(+)-N-пропаргил-1-аминоиндан обладает повышенной оптической чистотой по сравнению с R(+)-N-пропаргил-1-аминоинданом до кристаллизации.
15. Способ получения кристаллического R(+)-N-пропаргил-1-аминоиндана, включающий:
a) получение раствора R(+)-N-пропаргил-1-аминоиндана в растворимом в воде органическом растворителе;
b) смешивание раствора с водой;
c) охлаждение указанного раствора до температуры в диапазоне от 0 до 20°C с образованием кристаллического R(+)-N-пропаргил-1-аминоиндана;
d) выделение кристаллического R(+)-N-пропаргил-1-аминоиндана.
16. Способ по п.15, где растворимый в воде органический растворитель представляет собой спирт.
17. Способ по п.16, где указанный спирт представляет собой либо этанол, либо изопропанол или смесь этанола и изопропанола.
18. Способ по любому из пп.15-17, где кристаллический R(+)-N-пропаргил-1-аминоиндан обладает повышенной оптической чистотой по сравнению с R(+)-N-пропаргил-1-аминоинданом до кристаллизации.
Текст
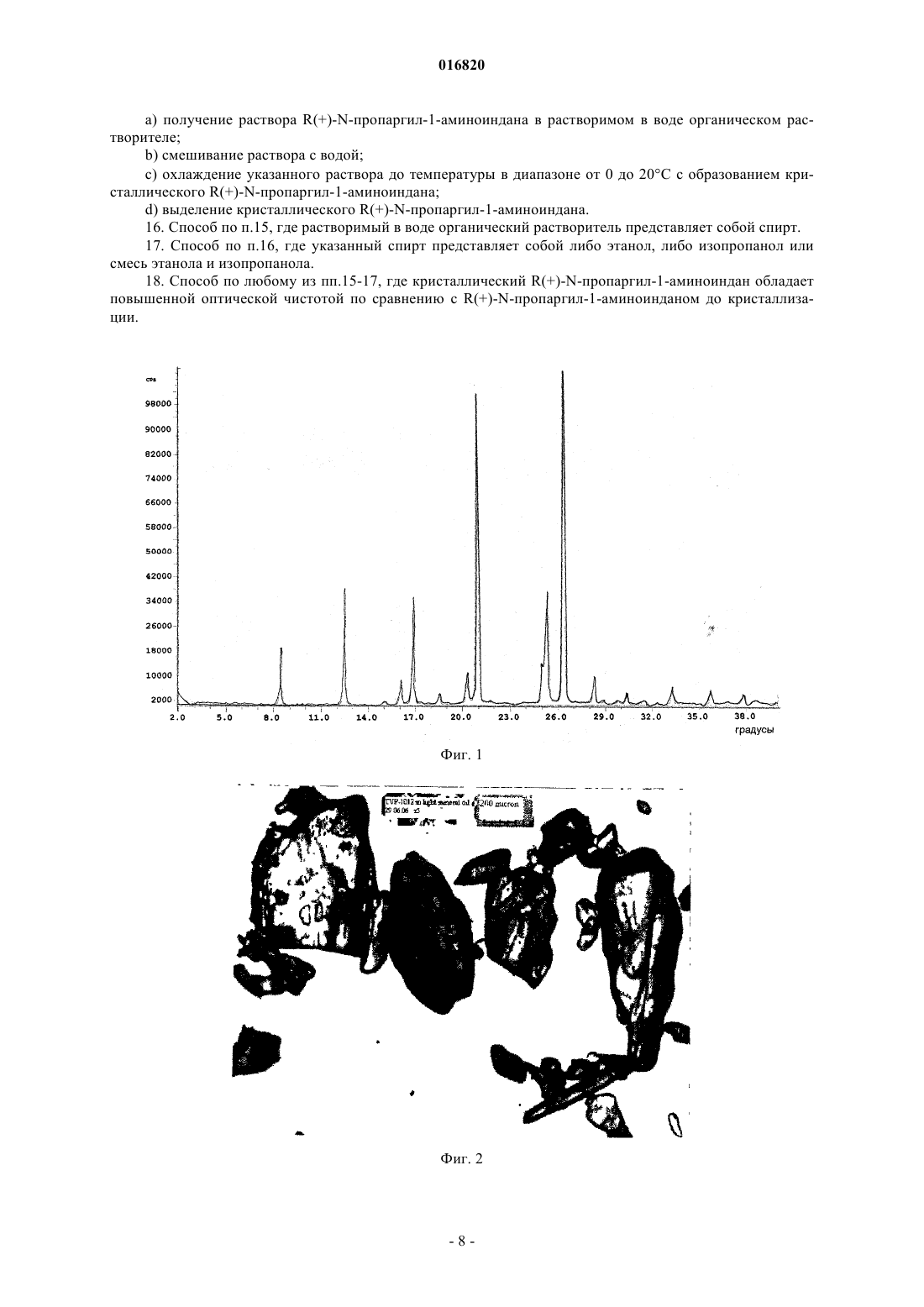
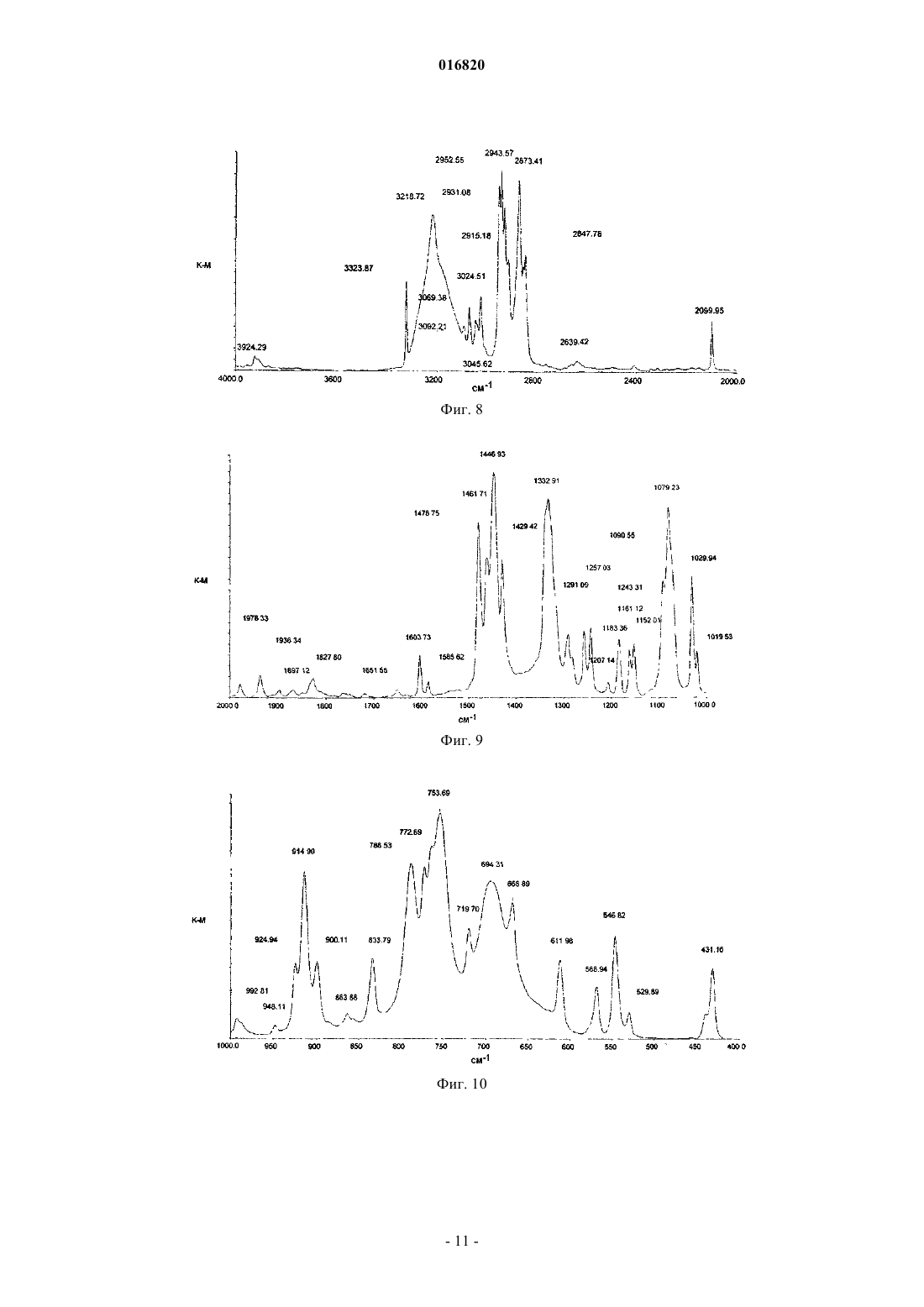
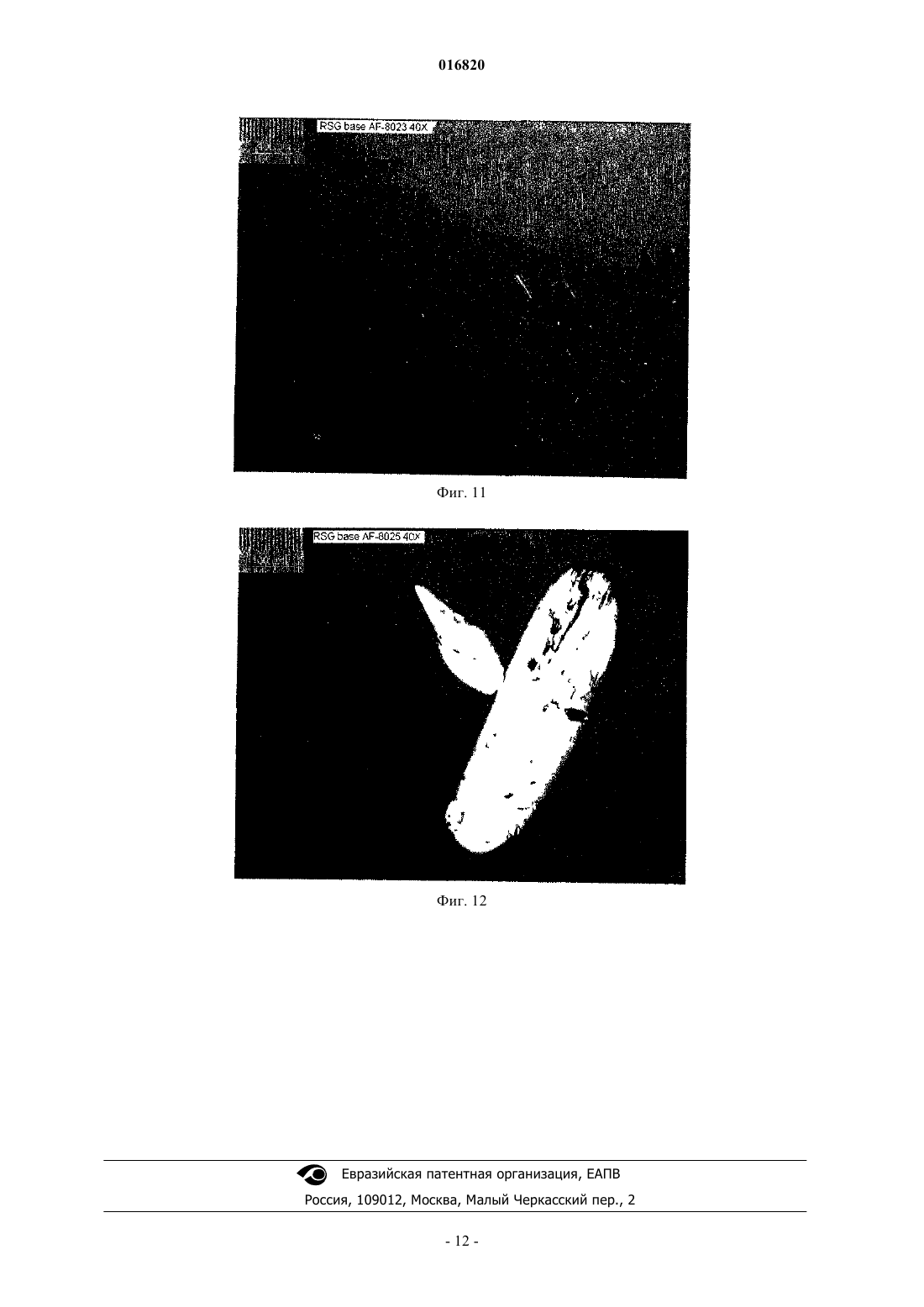
КРИСТАЛЛИЧЕСКОЕ ТВЕРДОЕ ОСНОВАНИЕ РАЗАГИЛИНА Настоящее изобретение относится к кристаллическому R(+)-N-пропаргил-1-аминоиндану,фармацевтическим композициям и способам его получения. 016820 На всем протяжении данного изобретения приведены различные публикации, опубликованные патентные заявки и опубликованные патенты. Описания данных публикаций полностью включены, таким образом, в качестве ссылки в данный патент для того, чтобы более полно описать существующий уровень техники, к которому относится данное изобретение. В патентах США 5532415, 5387612, 5453446, 5457133, 5599991, 5744500, 5891923, 5668181,5576353, 5519061, 5786390, 6316504, 6630514 описан R(+)-N-пропаргил-1-аминоиндан ("R-PAI"), также известный как разагилин. Разагилин, как сообщали, является селективным ингибитором формы B фермента моноаминоксидазы ("MAO-B") и применим для лечения болезни Паркинсона и различных других состояний посредством ингибирования MAO-B в головном мозге. В патенте США 6126968 и публикации PCT WO 95/11016 описаны фармацевтические композиции, содержащие соли разагилина. Мезилат разагилина одобрен для лечения болезни Паркинсона либо в качестве монотерапии, либо в качестве вспомогательного средства с другими лечебными схемами. См., например, AGILECT, Physician's Desk Reference (2006), 60th Edition, Thomson Healthcare. Синтез разагилина описан в патенте США 5532415, в котором в примере 3 описано извлечение основания разагилина в виде масла после хроматографического разделения. В других примерах синтеза в патенте США 5532415 описано получение соли разагилина из его неочищенной формы или его рацемической формы, которую дополнительно подвергают реакции с подходящими кислотами, чтобы получить фармацевтически приемлемые соли. Тем не менее, наличие или получение кристаллической формы свободного основания разагилина в данной области не описано. Настоящее изобретение относится к кристаллическому R(+)-N-пропаргил-1-аминоиндану. Настоящее изобретение также относится к способу промышленного получения кристаллическогоb) охлаждение указанного раствора до температуры приблизительно 0-15C;c) повышение основности указанного раствора до pH приблизительно 11 с образованием суспензии;d) получение указанного кристаллического разагилина R(+)-N-пропаргил-1-аминоиндана из суспензии. Настоящее изобретение также относится к способу промышленного получения кристаллическогоa) получение первого органического раствора жидкого R(+)-N-пропаргил-1-аминоиндана;b) полное выпаривание растворителя из первого органического раствора в вакууме с образованием остатка;c) растворение остатка во втором органическом растворителе с образованием второго органического раствора;d) полное выпаривание второго органического растворителя из второго органического раствора в вакууме с образованием остатка;e) выдерживание второго остатка при температуре в диапазоне от 0 до 25C с образованием кристаллического R(+)-N-пропаргил-1-аминоиндана. Настоящее изобретение также относится к способу промышленного получения кристаллическогоa) получение раствора кристаллического R(+)-N-пропаргил-1-аминоиндана в растворимом в воде органическом растворителе;c) охлаждение указанного раствора до диапазона от 0 до 20C с образованием кристаллическогоd) выделение кристаллического R(+)-N-пропаргил-1-аминоиндана. Краткое описание чертежей Фиг. 1: дифрактограмма рентгеновского анализа основания разагилина, полученного согласно примеру 4. Фиг. 2: электронный микроснимок основания разагилина, полученного согласно примеру 4. Фиг. 3: электронный микроснимок основания разагилина, полученного согласно примеру 5. Фиг. 4: электронный микроснимок основания разагилина, полученного согласно примеру 6. Фиг. 5: электронный микроснимок основания разагилина, полученного согласно примеру 7. Фиг. 6: электронный микроснимок основания разагилина, полученного согласно примеру 8 а. Фиг. 7-10: спектры FTIR основания разагилина, полученного согласно примеру 5. Фиг. 11: электронный микроснимок основания разагилина, полученного согласно примеру 9. Фиг. 12: электронный микроснимок основания разагилина, полученного согласно примеру 10. Настоящее изобретение относится к кристаллическому R(+)-N-пропаргил-1-аминоиндану. Настоящее изобретение также относится к R(+)-N-пропаргил-1-аминоиндану, характеризующемуся порошковой рентгенограммой, имеющей пики 8,5, 12,6, 16,1, и 16,9 при угле дифракции в градусах-1 016820 20,2. Его можно также охарактеризовать порошковой рентгенограммой, имеющей пики 20,3, 20,9,25,4, 26,4, и 28,3 при угле дифракции 20,2 или температурой плавления 38-41C. Настоящее изобретение также относится к фармацевтической композиции, содержащей кристаллический R(+)-N-пропаргил-1-аминоиндан и фармацевтически приемлемый носитель. Фармацевтическую композицию можно получить для трансдермального применения. Фармацевтическая композиция может находиться в виде трансдермального пластыря. Настоящее изобретение также относится к способу получения кристаллического R(+)-N-пропаргил 1-аминоиндана, который включает:b) охлаждение указанного раствора до температуры приблизительно 0-15C;c) повышение основности указанного раствора до pH приблизительно 11 с образованием суспензии;d) получение указанного кристаллического разагилина R(+)-N-пропаргил-1-аминоиндана из суспензии. В варианте осуществления способа кристаллический R(+)-N-пропаргил-1-аминоиндан обладает повышенной оптической чистотой по сравнению с R(+)-N-пропаргил-1-аминоинданом до кристаллизации. Настоящее изобретение также относится к способу получения кристаллического R(+)-N-пропаргил 1-аминоиндана, который включает:a) получение первого органического раствора жидкого R(+)-N-пропаргил-1-аминоиндана;b) полное выпаривание растворителя из первого органического раствора в вакууме с образованием остатка;c) растворение остатка во втором органическом растворителе с образованием второго органического раствора;d) полное выпаривание второго органического растворителя из второго органического раствора в вакууме с образованием второго остатка;e) выдерживание второго остатка при температуре в диапазоне от 0 до 25C с образованием кристаллического R(+)-N-пропаргил-1-аминоиндана. В одном варианте осуществления способа органический растворитель и второй органический растворитель одинаковы. В другом варианте осуществления органический растворитель и второй органический растворитель представляют собой спирты. В еще одном варианте осуществления органический растворитель и второй органический растворитель представляют собой изопропанол. В еще одном варианте осуществления способа кристаллический R(+)-N-пропаргил-1-аминоиндан обладает повышенной оптической чистотой по сравнению с R(+)-N-пропаргил-1-аминоинданом до кристаллизации. Настоящее изобретение также относится к способу получения кристаллического R(+)-N-пропаргил 1-аминоиндана, который включает:c) охлаждение указанного раствора до температуры в диапазоне от 0 до 20C с образованием кристаллического R(+)-N-пропаргил-1-аминоиндана;d) выделение кристаллического R(+)-N-пропаргил-1-аминоиндана. В одном варианте осуществления способа растворимый в воде органический растворитель представляет собой спирт. В другом варианте осуществления спирт представляет собой либо этанол, либо изопропанол, либо смесь этанола и изопропанола. В еще одном варианте осуществления способа кристаллический R(+)-N-пропаргил-1-аминоиндан обладает повышенной оптической чистотой по сравнению с R(+)-N-пропаргил-1-аминоинданом до кристаллизации. При разработке фармацевтических композиций упорядоченность структуры является необходимым свойством активного фармацевтического ингредиента. Кристаллические вещества обеспечивают легкость получения и приготовления в большинство типов фармацевтических лекарственных форм. Ранее основание разагилина выделяли в виде масла, а не в виде кристаллического твердого вещества. Не привязываясь к теории, возможно, что разагилин ранее выделяли в виде масла из-за присутствия остаточных растворителей, таких как толуол или изопропанол. Авторы изобретения неожиданно обнаружили, что основание разагилина можно выделить в негигроскопичной форме, которая остается кристаллической при комнатной температуре. Кристаллическое основание разагилина обладает более низкой растворимостью в воде, чем множество солей разагилина, особенно соль мезилат, которая является растворимой в воде. Растворимость мезилата разагилина в воде составляет 92 мг/мл при pH 6,7 и 570 мг/мл при pH 3,3, обе измерены при 25C.-2 016820 При той же самой температуре растворимость основания разагилина в воде составляет 5,5 мг/мл приpH 11. Кристаллическое основание разагилина можно использовать в качестве синтетического промежуточного продукта, который используется для получения соли разагилина, такой как мезилат разагилина или тартрат разагилина. Кристаллическое основание разагилина можно растворить в растворителе и подвергнуть взаимодействию с кислотой, чтобы получить фармацевтически приемлемую аддитивную соль кислоты. Кристаллизация основания разагилина могла бы обеспечить дополнительную очистку аддитивной соли кислоты. Растворимость в воде часто является важной характеристикой активного фармацевтического ингредиента, особенно при приготовлении композиций для перорального приема. Иногда требуется липофильность активного фармацевтического ингредиента при приготовлении других фармацевтических композиций. Кристаллическое основание разагилина можно применять для приготовления фармацевтических композиций, в которых требуется низкая растворимость в воде. Например, композиции для трансдермального введения можно приготовить из липофильных соединений. Примеры таких трансдермальных композиций включают в себя мази, кремы и пластыри. Трансдермальные препараты и трансдермальные пластыри. Трансдермальные пластыри представляют собой медицинские липкие пластыри, помещаемые на кожу, чтобы доставить высвобождающуюся в течение времени дозу лекарственного препарата через кожу и в кровоток. Большое разнообразие фармацевтических препаратов можно доставить посредством трансдермальных пластырей, таких как никотин для отказа от курения, скополамин при болезни движения, эстроген при климактерическом периоде и для предотвращения остеопороза, нитроглицерин при стенокардии, лидокаин для обезболивания при опоясывающем лишае. Некоторые фармацевтические препараты необходимо комбинировать с другими веществами, такими как спирт, чтобы увеличить их способность проникать через кожу. Молекулы инсулина и множество других фармацевтических препаратов, однако, слишком велики, чтобы пройти через кожу. Трансдермальные пластыри имеют несколько важных компонентов, включающих в себя поверхностный слой для защиты пластыря во время хранения,лекарственное средство, клейкий материал, мембрану (для контроля за высвобождением лекарственного средства из резервуара) и подстилающий слой для защиты пластыря от внешнего окружения. Два самых распространенных типа трансдермальных пластырей представляют собой матричный и резервуарный тип ("Transdermal Patches", Wikipedia, November 15, 2007, Wikipedia Foundation, Inc., December 13, 2007Edition, 2000). В пластырях резервуарного типа лекарственное средство объединяют с нелетучей инертной жидкостью, такой как минеральное масло, тогда как лекарственное средство в пластырях матричного типа распределено в липофильном или гидрофильном полимерном матриксе, таком как акриловые или виниловые полимеры. Клейкие полимеры, такие как полиизобутилен, используют для удерживания пластыря на участке кожи (Stanley Scheindlin (2004), "Transdermal Drug Delivery: PAST, PRESENT, FUTURE", Molecular Interventions, 4:308-312). Основное ограничение трансдермально доставляемого лекарственного средства заключается в присущем коже барьерном свойстве. Средства для усиления проницаемости часто добавляют к трансдермальным лекарственным препаратам, для того чтобы нарушить поверхность кожи и привести к более быстрой доставке лекарственного средства. Типичные средства для усиления проницаемости включают в себя спирты с высокой температурой кипения, диолы, сложные эфиры жирных кислот, олеиновую кислоту и растворители на основе глицерина, и их обычно добавляют в концентрации от одного до 20%(мас./мас.) (Melmda Норр, "Developing Custom Adhesive Systems for Transdermal Drug Delivery Products",Drug Delivery). Разагилин также можно использовать в трансдермальном пластыре в сочетании с другими лекарственными средствами, такими как леводопа, L-карбидопа, бенсеразид, ладостигил, пятиатомный спирт,шестиатомный спирт или рилузол. Экспериментальная информация Пример 1. Выделение основания разагилина разделением и экстракцией. Мезилат разагилина получали, по существу, как описано в примере 6B патента США 5532415, за исключением того, что соль винной кислоты разделяли добавлением NaOH, и свободное основание разагилина выделяли в виде масла. Мезилат затем получали при добавлении метансульфоновой кислоты. 120 г мезилата разагилина растворяли в 700 мл деионизованной воды. Добавляли 400 мл толуола, и смесь превращали в основание при помощи 25% раствора NaOH до pH приблизительно 14. После перемешивания разделяли две фазы. Нижнюю водную фазу экстрагировали 200 мл толуола. Фазам позволяли разделиться и водную фазу удаляли. Два толуоловых экстракта объединяли и растворитель перегоняли в вакууме. Выход основания разагилина составлял 88,5 г масла желтоватого цвета с температурой плавления ниже 20C. Отбирали образцы 25,1 г жидкого основания разагилина. Образец смешивали с этанолом и растворитель перегоняли в вакууме. 22,6 г остатка основания разагилина в виде масла желтоватого цвета оста-3 016820 валось после выпаривания этанола. Основание разагилина в виде масла оставалось в виде масла в течение большого количества недель и самопроизвольно не кристаллизовалось. Пример 2. Выделение основания разагилина разделением и экстракцией. 155 г тартрата разагилина, полученного, по существу, как описано в примере 6 В патента США 5532415, и 20 г мезилата разагилина, полученного, как описано в примере 1, растворяли в 800 мл воды. Добавляли 400 мл толуола и смесь превращали в основание при помощи 25% раствора NaOH до pH приблизительно 14 и нагревали до 455C. После перемешивания разделяли две фазы. Нижнюю водную фазу дважды экстрагировали 300 мл толуола при 455C. Органические фазы объединяли и водную фазу удаляли. Объединенную органическую фазу промывали 200 мл деионизованной воды. Затем растворитель перегоняли в вакууме и 50 мл изопропанола добавляли к полученному остатку. Растворитель удаляли в вакууме и дополнительные 50 мл изопропанола добавляли и затем удаляли в вакууме. Получали 100 г похожего на сироп жидкого основания разагилина. Пример 3. Разделение и самопроизвольная кристаллизация из воды. 15 г мезилата разагилина растворяли в 150 мл воды при перемешивании. Раствор охлаждали до 5C и медленно добавляли 25% раствор NaOH. Во время добавления температуру партии поддерживали в диапазоне от 3 до 5C. Осаждение твердого вещества наблюдали после достижения pH 7,5. После достижения pH 11 останавливали добавление NaOH, партию перемешивали при охлаждении в течение 1 ч и фильтровали. Фильтрация происходила быстро. Твердый продукт промывали водой на фильтре и высушивали в вакууме. Получали 8,8 г твердого высушенного основания разагилина. Выход продукта составлял 91,6%. Температура плавления твердого вещества, как определили, составляла 38,2-38,4C. Пример 4. Кристаллизация из расплава. 6 г жидкого в виде сиропа основания разагилина из примера 1 после толулового выпаривания растворяли в 20 мл изопропанола. Раствор выпаривали на бане с теплой водой, используя ротационный испаритель в вакууме при 12 мбар, до полного удаления растворителя. Остаток затем растворяли в дополнительных 20 мл изопропанола и выпаривание повторяли. Полученный остаток кристаллизовался самопроизвольно при комнатной температуре через несколько часов. Твердый кристаллический остаток, как определили, представлял собой основание разагилина. Получали 5,2 г твердого кристаллического основания. Выход продукта был количественным. Пример 5. Добавление этанолового раствора разагилина к воде. 2,4 г основания разагилина из примера 1 растворяли в 2,4 г этанола. Раствор добавляли по капле к 5 мл холодной (0-5C) воды при перемешивании и во время добавления образовывался осадок белого цвета. Полученную смесь перемешивали, охлаждая, в течение приблизительно 30 мин и фильтровали. Фильтрация происходила быстро и твердый продукт высушивали до постоянного веса в вакууме. 2,15 г твердого кристаллического разагилина получали с выходом продукта 89,6%. Анализ. Хроматографическая чистота при ВЭЖХ 100%, анализ при помощи ВЭЖХ - 99,0%. Пример 6. Добавление воды к этаноловому раствору разагилина. 3 г основания разагилина из примера 1 растворяли в 5 мл этанола. Раствор перемешивали при комнатной температуре и добавляли 4,5 мл воды. Не происходило никакого осаждения. Полученный раствор охлаждали и при 12C наблюдали осаждение вещества белого цвета. Смесь охлаждали до 0C, перемешивали при данной температуре в течение 30 мин и фильтровали. Фильтрация происходила быстро. Твердый продукт промывали водой на фильтре и высушивали в вакууме. 2,72 г твердого кристаллического разагилина получали с выходом продукта 90,0%. Анализ. Хроматографическая чистота при ВЭЖХ 100%, анализ при помощи ВЭЖХ - 100,0%. Пример 7. Добавление изопропанолового раствора разагилина к воде. 8,2 г основания разагилина из примера 1 растворяли в 10 мл изопропанола и раствор перемешивали при комнатной температуре. Добавляли 14 мл воды. Не происходило никакого осаждения. Полученный раствор охлаждали и при 17C наблюдали осаждение вещества белого цвета. 20 мл деионизованной воды добавляли к смеси и смесь дополнительно охлаждали до 0C, перемешивали при данной температуре в течение 30 мин и фильтровали. Фильтрация происходила быстро. Твердый продукт промывали водой на фильтре и высушивали в вакууме. 5, 96 г твердого кристаллического разагилина получали с выходом продукта 72,7%. Анализ. Хроматографическая чистота при ВЭЖХ 100%, анализ при помощи ВЭЖХ - 99,7%. Пример 8. Добавление воды к изопропаноловому раствору разагилина. Порция A. 148 г основания разагилина (48,0 г из примера 1 и 100,0 г из примера 2) растворяли в 180 мл изопропанола. Раствор охлаждали до 17C и 252 мл деионизованной воды добавляли при данной температуре. Раствор охлаждали до 10C и затравляли кристаллами твердого основания разапилина. Наблюдали немедленную кристаллизацию. Затем к смеси добавляли 100 мл воды. Смесь охлаждали до 1C, переме-4 016820 шивали при данной температуре в течение 30 мин и фильтровали. Твердое вещество промывали на фильтре 200 мл воды и высушивали в вакууме. 138,9 г твердого кристаллического разагилина получали с выходом продукта 93,8%. Температура плавления в открытом капилляре, как определили, составляла 39,0-39,2C. Анализ. Хроматографическая чистота при ВЭЖХ 100%, анализ при помощи ВЭЖХ - 98,5%. Порция B. Объединяли маточный раствор и промывочный раствор из порции А, твердый продукт осаждался из смеси. Вещество желтоватого цвета разделяли фильтрацией и высушивали в вакууме. 1,5 г твердого кристаллического основания разагилина получали с выходом продукта 1,0%. Обсуждение. Твердое кристаллическое основание разагилина, которое синтезировали в примерах 3-8, как обнаружили, было высокой чистоты. Одну и ту же величину температуры плавления (41C при дифференциальной сканирующей калориметрии (DSC) или 38-39C в открытом капилляре) измеряли для всех партий основания разагилина. Низкие уровни летучих веществ (вода и остаточные растворители) определили способами анализа по Карлу Фишеру (KF) и термического гравиметрического анализа (TGA). Такие данные указывают на то, что кристаллическое основание разагилина не является гигроскопичным. Кристаллическое основание разагилина, как обнаружили, легко растворимо в полярных и неполярных органических растворителях - спиртах, ацетоне, этилацетате, толуоле, диэтиловом эфире, диоксане,гексане и н-гептане. Все партии твердого основания разагилина, как обнаружили способом порошковой рентгенографии(XRD) и DSC, высококристаллические. Характерные паттерны XRD и инфракрасной спектроскопии с преобразованием Фурье (FTIR) и воспроизводимый узкий диапазон плавления и энтальпии демонстрируют одинаковую полиморфную композицию для всех экспериментальных партий из примеров 3-8. Кристаллическую форму обозначали форма I. Используемое оборудование для рентгеноструктурного анализа представляло собой дифрактометр для порошковой рентгенографии Scintag модель X'TRA, Cu-трубка, твердотельный детектор. Держатель образцов: круглый стандартный алюминиевый держатель для образцов с круглой кварцевой пластиной с нулевым фоном с полостью 25 (диаметр)0,5 (отделение) мм. Параметры сканирования: диапазон: 2-40 2. Режим сканирования: непрерывное сканирование. Размер шага: 0,05. Скорость: 5 град./мин. Пики для образца, полученного по примеру 4, перечислены ниже. Наиболее характерные пики выделены жирным шрифтом. Анализ FTIR образцов осуществляли, как приведено ниже. Оборудование: спектрометр Spectrum One FT-IR Spectrometer фирмы Perkin Elmer S/N 58001. Параметры: образцы исследовали в режиме DRIFT. Все спектры измеряли при 16 циклах сканирования. Разрешение: 4,0 см-1. Все образцы твердого основания разагилина, полученные в данном исследовании, появлялись в виде кристаллического порошка белого цвета (за исключением порции В из примера, которую выделяли в виде порошка желтоватого цвета). Исследования под микроскопом показали, что на условия кристаллизации сильно влияет размер частиц и морфология. Кристаллизация с затравкой приводила к получению больших неагрегированных кристаллов правильной формы, в то время как самопроизвольное осаждение приводило к образованию небольших агрегированных частиц. Различие в морфологии не связано с полиморфизмом. Морфология и размер частиц кристаллического основания разагилина из указанных выше примеров показаны ниже в таблице. Морфологию и размер частиц определяли при исследовании под микроскопом. Исходные вещества для примеров 9, 10 и 11:(2) рацемическое основание PAI, масло, содержание PAI - 94% при ВЭЖХ. Пример 9. Разделение и осаждение из смеси изопропанол-вода, кристаллизация эмульсии с затравкой. 70,0 г тартрата разагилина (1) суспендировали в 320 мл деионизованной воды при перемешивании. Суспензию нагревали до 45C и 31 мл 25% раствора NaOH добавляли с 160 мл толуола. Смесь перемешивали и полученную эмульсию осаждали. Разделяли две фазы. Нижнюю водную фазу (pH 13-14) удаляли. Верхнюю толуоловую фазу промывали 100 мл деионизованной водой при 45C и осаждали. Нижнюю водную фазу (pH 9-10) удаляли. Толуоловый раствор выпаривали в вакууме в испарителе, после окончания выпаривания растворителя 50 мл изопропанола добавляли к остатку и продолжали выпаривание. После окончания выпаривания добавляли 25 мл изопропанола и перегоняли в тех же условиях. Остаток, основание R-PAI в виде масла (33,9 г), растворяли в 41 мл изопропанола. Раствор охлаждали до 15C и 58 мл деионизованной воды добавляли порциями через 2 ч при охлаждении и перемешивании. Во время добавления воды образовывался масляный осадок. Полученную эмульсию типа масло-в-воде перемешивали при 1-3C в течение 1 ч, не наблюдали никакой кристаллизации. Партию затравляли кристаллическим основанием разагилина при 1-3C, имела место быстрая экзотермическая кристаллизация. 50 мл воды добавляли к получившейся взвеси, чтобы улучшить перемешиваемость и текучесть. Партию перемешивали в течение дополнительных 30 мин и фильтровали. Твердое вещество промывали водой и высушивали при комнатной температуре в вакууме. 31,5 г твердого сухого основания R-PAI получали с выходом продукта 92% на основе масла. На фиг. 11 представлен электронный микроснимок данного основания разагилина. Анализ. Температура плавления (при DSC) - 40,8C, S-изомер при ВЭЖХ - 0,02%, чистота при ВЭЖХ - 100%, анализ ВЭЖХ - 98%. Пример 10. Разделение и осаждение из смеси изопропанол-вода, кристаллизация с затравкой из раствора изопропанол-вода. 100,0 г тартрата разагилина (1) суспендировали в 458 мл деионизованной воды, добавляли 229 мл толуола и 46 мл 25% раствора NaOH добавляли при перемешивании. Смесь нагревали до 45C, перемешивали при 45C в течение 15 мин и осаждали при данной температуре. Разделяли две фазы. Нижнюю водную фазу (pH 13-14) удаляли, верхнюю толуоловую фазу промывали 140 мл деионизованной воды. Полученную эмульсию осаждали и разделяли две фазы. Нижнюю водную фазу (pH 9-10) удаляли, толуоловый раствор выпаривали в вакууме в испарителе. После окончания выпаривания растворителя 60 мл изопропанола добавляли к остатку и продолжали выпаривание. После окончания выпаривания добавляли 50 мл изопропанола и перегоняли в тех же условиях. Остаток, масло основания R-PAI (46,4 г), растворяли в 56 мл изопропанола. Раствор охлаждали до 16C и 147,5 мл деионизованной воды добавляли порциями через 3 ч при охлаждении и перемешивании. Во время добавления воды наблюдали процесс осаждения и партию сразу же затравляли кристаллическим основанием R-PAI. Полученную суспензию охлаждали до 2C, перемешивали при данной температуре в течение ночи и фильтровали. Твердое вещество промывали водой и высушивали при комнатной температуре в вакууме. 48,1 г твердого сухого основания R-PAI получали с выходом продукта 96% масляного основания. На фиг. 12 представлен электронный микроснимок данного основания разагилина. Анализ. Температура плавления (при DSC) - 41,3C, S-изомер при ВЭЖХ - 0,01%, чистота при ВЭЖХ - 100%, анализ ВЭЖХ - 96%. Пример 11. Кристаллизация рацемического основания PAI (AF-8026) осаждением из смеси изопропанол-вода. 51,0 г рацемического основания PAI в виде масла (2) растворяли в 50 мл изопропанола. Растворитель отгоняли из раствора в вакууме в испарителе. Остаток (49,4 г) растворяли в 60 мл изопропанола, перемешивали и охлаждали. 156 мл деоинизованной воды добавляли порциями через 3 ч при охлаждении и перемешивании. Во время добавления-6 016820 воды образовывался маслянистый осадок. Партию затравляли кристаллическим основанием разагилина,не наблюдали никакой кристаллизации. Полученную эмульсию типа масло-в-воде перемешивали при 3C в течение 1 ч, не наблюдали никакой кристаллизации. Партия кристаллизовалась самопроизвольно во время перемешивания в течение ночи при 1C. Твердое вещество фильтровали, но во время фильтрации оно начинало плавиться. При комнатной температуре твердый продукт полностью разжижали на фильтре через 1-2 мин. Вещество отбирали до завершения плавления. Анализ. S-изомер при ВЭЖХ - 49,4%, анализ ВЭЖХ - 87%. Обсуждение. В примерах 9-11, представленных выше, показано, что способность кристаллизоваться при комнатной температуре является неотъемлемым свойством чистого основания разагилина (R-изомер). Рацемическое основание PAI существует при комнатной температуре только в жидкой форме, причем его температура плавления находится в диапазоне от 1 до 18C (пример 11). Также в примерах показано, что кристаллизация основания разагилина с примесью S-изомера приводит к значительному очищению кристаллизованного продукта. Исходное вещество, содержащее 0,7%S-изомера, превращалось в твердое кристаллическое основание разагилина только с 0,01-0,02% Sизомера. В примерах 9-11 также показана такая же тенденция в размере частиц кристаллизованного продукта, как было описано в предыдущих примерах. Медленная кристаллизация с затравкой при 10-16C(пример 9) приводит к получению большего размера частиц основания разагилина, чем кристаллизация эмульсии при 1-3C (пример 10). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Кристаллический R(+)-N-пропаргил-1-аминоиндан (разагилин). 2. Кристаллический R(+)-N-пропаргил-1-аминоиндан по п.1, характеризующийся порошковой рентгенограммой, имеющей пики 8,5; 12,6; 16,1 и 16,9 при угле дифракции в градусах 20,2. 3. Кристаллический разагилин по п.2, дополнительно характеризующийся порошковой рентгенограммой, имеющей пики 20,3; 20,9; 25,4; 26,4 и 28,3 при угле дифракции в градусах 20,2. 4. Кристаллический разагилин по любому из пп.1-3, характеризующийся температурой плавления 38-39C при определении в открытом капилляре или 41C при определении дифференциальной сканирующей калориметрией. 5. Фармацевтическая композиция, содержащая кристаллический R(+)-N-пропаргил-1-аминоиндан по любому из пп.1-4 и фармацевтически приемлемый носитель. 6. Фармацевтическая композиция по п.5, полученная для трансдермального применения. 7. Фармацевтическая композиция по п.6 в виде трансдермального пластыря. 8. Способ получения кристаллического R(+)-N-пропаргил-1-аминоиндана, включающий:b) охлаждение указанного раствора до температуры приблизительно 0-15C;c) повышение основности указанного раствора до pH приблизительно 11 с образованием суспензии;d) получение указанного кристаллического R(+)-N-пропаргил-1-аминоиндана из суспензии. 9. Способ по п.8, где кристаллический R(+)-N-пропаргил-1-аминоиндан обладает повышенной оптической чистотой по сравнению с R(+)-N-пропаргил-1-аминоинданом до кристаллизации. 10. Способ получения кристаллического R(+)-N-пропаргил-1-аминоиндана, который включает:a) получение первого раствора R(+)-N-пропаргил-1-аминоиндана в органическом растворителе;b) полное выпаривание растворителя из первого раствора в вакууме с образованием остатка;c) растворение остатка во втором органическом растворителе с образованием второго раствора;d) полное выпаривание второго органического растворителя из второго раствора в вакууме с образованием второго остатка;e) выдерживание второго остатка при температуре в диапазоне от 0 до 25C с образованием кристаллического R(+)-N-пропаргил-1-аминоиндана. 11. Способ по п.10, где органический растворитель и второй органический растворитель являются одинаковыми. 12. Способ по п.11, где органический растворитель и второй органический растворитель представляют собой спирты. 13. Способ по п.11, где органический растворитель и второй органический растворитель представляют собой изопропанол. 14. Способ по любому из пп.10-13, где кристаллический R(+)-N-пропаргил-1-аминоиндан обладает повышенной оптической чистотой по сравнению с R(+)-N-пропаргил-1-аминоинданом до кристаллизации. 15. Способ получения кристаллического R(+)-N-пропаргил-1-аминоиндана, включающий:c) охлаждение указанного раствора до температуры в диапазоне от 0 до 20C с образованием кристаллического R(+)-N-пропаргил-1-аминоиндана;d) выделение кристаллического R(+)-N-пропаргил-1-аминоиндана. 16. Способ по п.15, где растворимый в воде органический растворитель представляет собой спирт. 17. Способ по п.16, где указанный спирт представляет собой либо этанол, либо изопропанол или смесь этанола и изопропанола. 18. Способ по любому из пп.15-17, где кристаллический R(+)-N-пропаргил-1-аминоиндан обладает повышенной оптической чистотой по сравнению с R(+)-N-пропаргил-1-аминоинданом до кристаллизации.
МПК / Метки
МПК: A61P 25/16, A61K 31/135, A01N 33/02
Метки: кристаллическое, основание, твердое, разагилина
Код ссылки
<a href="https://eas.patents.su/13-16820-kristallicheskoe-tverdoe-osnovanie-razagilina.html" rel="bookmark" title="База патентов Евразийского Союза">Кристаллическое твердое основание разагилина</a>
Предыдущий патент: Производные 1-(-d-гликопиранозил)-3-(4-циклопропилфенилметил)-4-галогеноиндола и их применение в качестве ингибиторов sglt
Следующий патент: Кристаллическая форма [3-(4,5-дигидро-3-изоксазолил)-2-метил-4-(метилсульфонил)фенил]-(5-гидрокси-1-метил-1h-пиразол-4-ил)метанона
Случайный патент: Вирулицидные композиции