Вакцинная композиция против папилломавируса человека и способы ее получения и применения
Формула / Реферат
1. Вакцинная композиция против человеческого папилломавируса (ЧПВ), содержащая смесь вирусоподобных частиц ЧПВ 16, ЧПВ 18, ЧПВ 31 и ЧПВ 45, где каждая вирусоподобная частица содержит только белок L1 или функциональное производное белка L1 только из одного типа ЧПВ, причем иммунный ответ, генерированный данной вакциной, направлен против каждой из четырех указанных вирусоподобных частиц.
2. Вакцинная композиция по п.1, где по меньшей мере один белок L1 является усеченным белком L1.
3. Вакцинная композиция по п.1 или 2, содержащая только вирусоподобные частицы, состоящие из белков из ЧПВ 16, ЧПВ 18, ЧПВ 31 и ЧПВ 45.
4. Вакцинная композиция по п.1 или 2, дополнительно содержащая вирусоподобную частицу, которая содержит белок L1 или его функциональное производное из другого типа ЧПВ.
5. Вакцинная композиция по п.4, где дополнительная вирусоподобная частица содержит белок L1 или его функциональное производное, выбранное из типов ЧПВ 33, 52, 53, 58, 35, 56 и 59.
6. Вакцинная композиция по любому из пп.1-5, которая является по меньшей мере на 60% эффективной в предотвращении рака шейки матки.
7. Вакцинная композиция по любому из пп.1, 2, 4, 5 или 6, дополнительно содержащая антиген возбудителя заболевания, передаваемого половым путем.
8. Вакцинная композиция по п.7, где указанный антиген представляет собой антиген вируса простого герпеса или его иммунологически активный фрагмент.
9. Вакцинная композиция по п.7, где указанный антиген представляет собой антиген ВИЧ или его иммунологически активный фрагмент.
10. Вакцинная композиция по п.7, где указанный антиген представляет собой антиген хламидии или его иммунологически активный фрагмент.
11. Вакцинная композиция по любому из пп.1-10, дополнительно содержащая адъювант.
12. Вакцинная композиция по п.11, где адъювант представляет собой соль алюминия.
13. Вакцинная композиция по п.11, где адьювант представляет собой гидроксид алюминия.
14. Вакцинная композиция по п.12 или 13, дополнительно содержащая 3D-MPL.
15. Способ получения вакцины по любому из пп.1-14, при котором комбинируют вирусоподобные частицы, которые содержат белки L1 или функциональные производные белков L1 из ЧПВ 16, ЧПВ 18, ЧПВ 31 и ЧПВ 45.
16. Применение смеси вирусоподобных частиц ЧПВ 16, ЧПВ 18, ЧПВ 31 и ЧПВ 45, содержащих только белок L1 или его функциональное производное, для получения вакцины против ЧПВ по любому из пп.1-14.
17. Способ предотвращения инфекции ЧПВ или лечения заболевания, связанного с инфицированием ЧПВ, при котором нуждающемуся в этом индивидууму вводят эффективное количество вакцинной композиции по любому из пп.1-14.
18. Стабилизированная вакцинная композиция, содержащая вакцину по любому из пп.1-14, где вирусоподобные частицы из ЧПВ 16, 18, 31 и 45 адсорбированы на гидроксиде алюминия перед смешиванием.
19. Вакцинная композиция по любому из пп.1-14 или 18, при использовании которой иммунный ответ против определенного типа вирусоподобных частиц, входящих в вакцину, составляет по меньшей мере 50% от ответа на тот же тип вирусоподобных частиц, если частицы этого типа используются для вакцинации индивидуально.
20. Способ по п.15, где иммунный ответ против определенного типа вирусоподобных частиц, входящих в полученную данным способом вакцину, составляет по меньшей мере 50% от ответа на тот же тип вирусоподобных частиц, если частицы этого типа используются индивидуально.
21. Применение по п.16, где иммунный ответ против определенного типа вирусоподобных частиц, входящих в вакцину, составляет по меньшей мере 50% от ответа на тот же тип вирусоподобных частиц, если частицы этого типа используются индивидуально.
22. Способ по п.17, где иммунный ответ против определенного типа вирусоподобных частиц, входящих в вакцину, составляет по меньшей мере 50% от ответа на тот же тип вирусоподобных частиц, если частицы этого типа используются индивидуально.
Текст
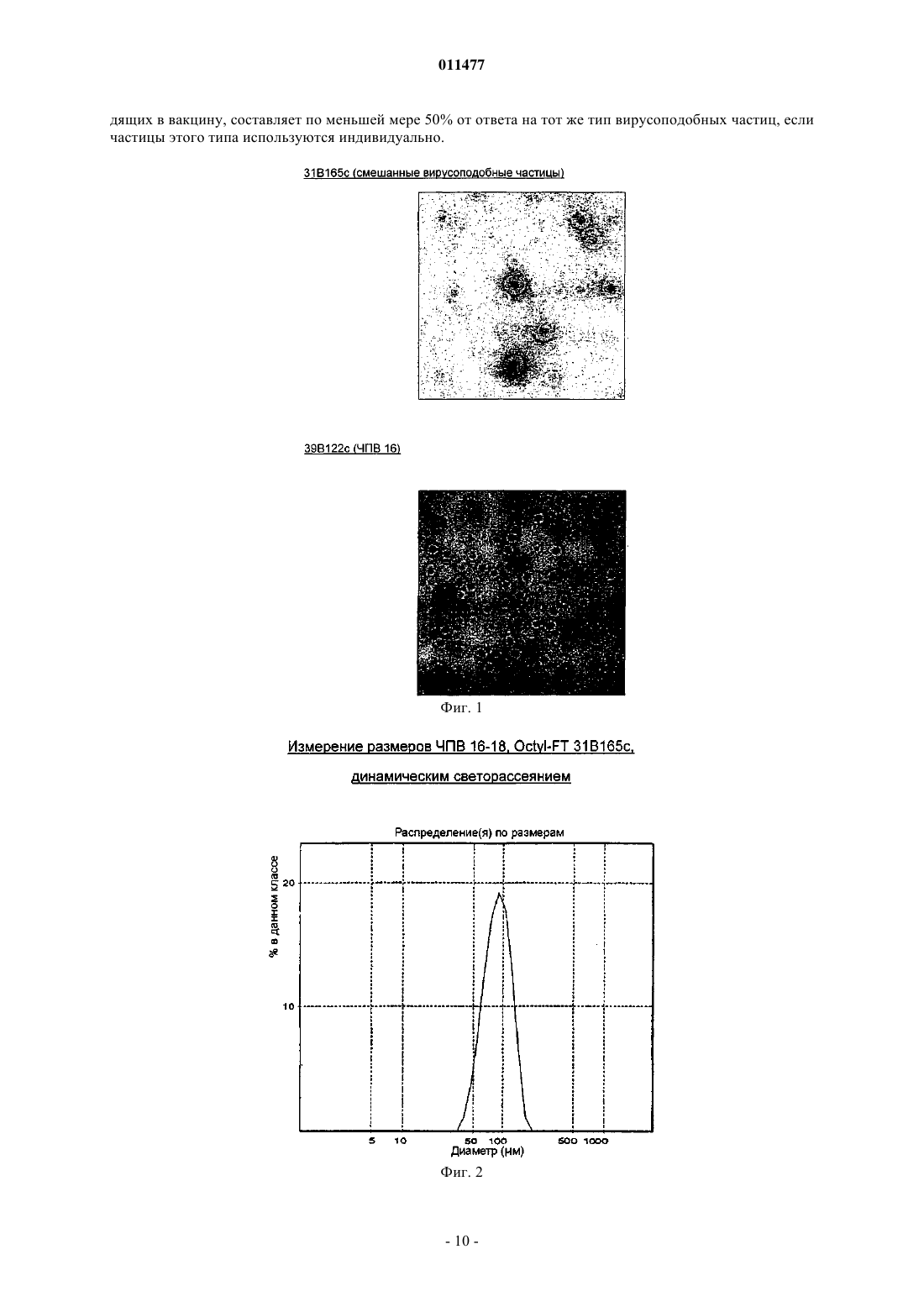
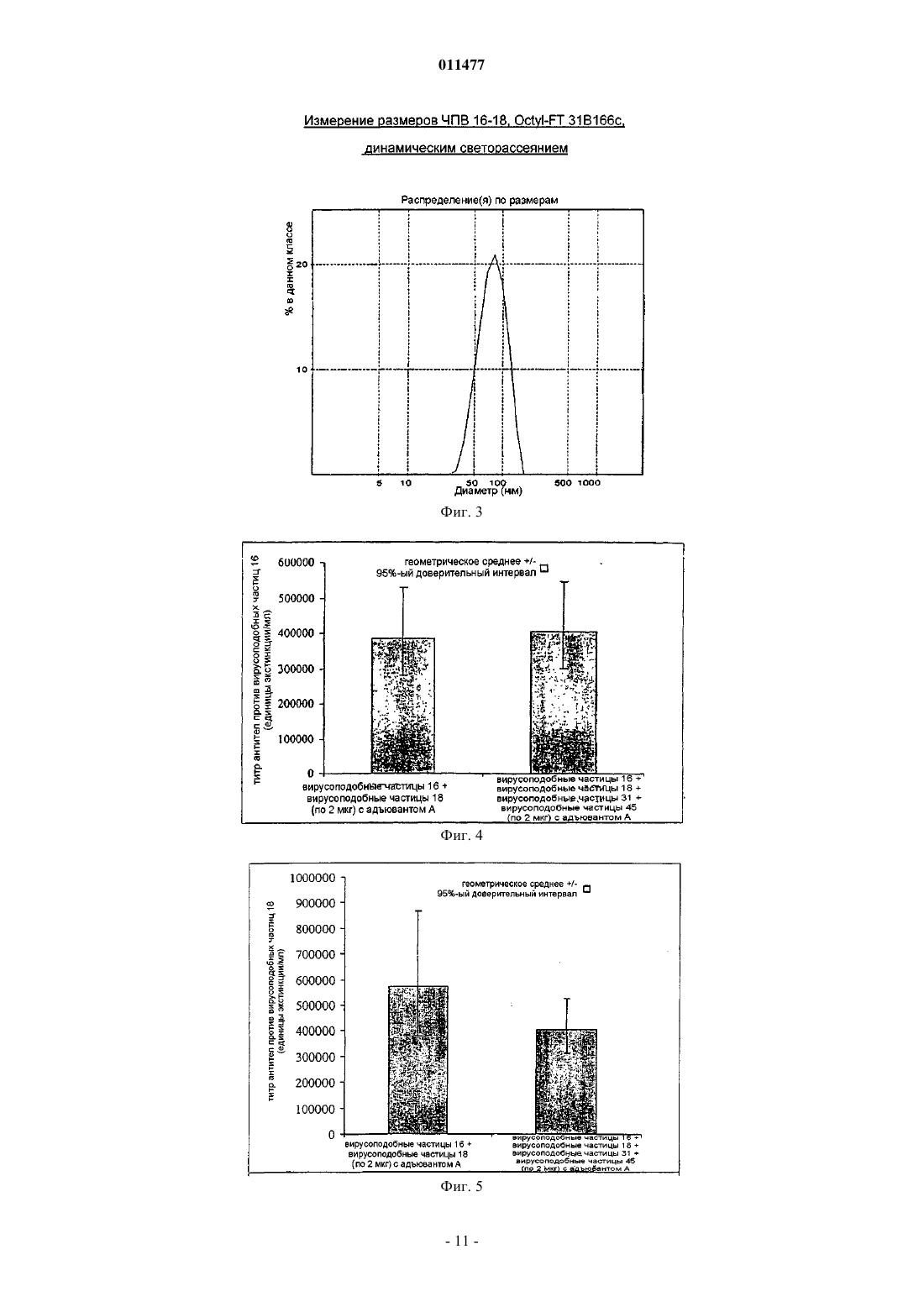
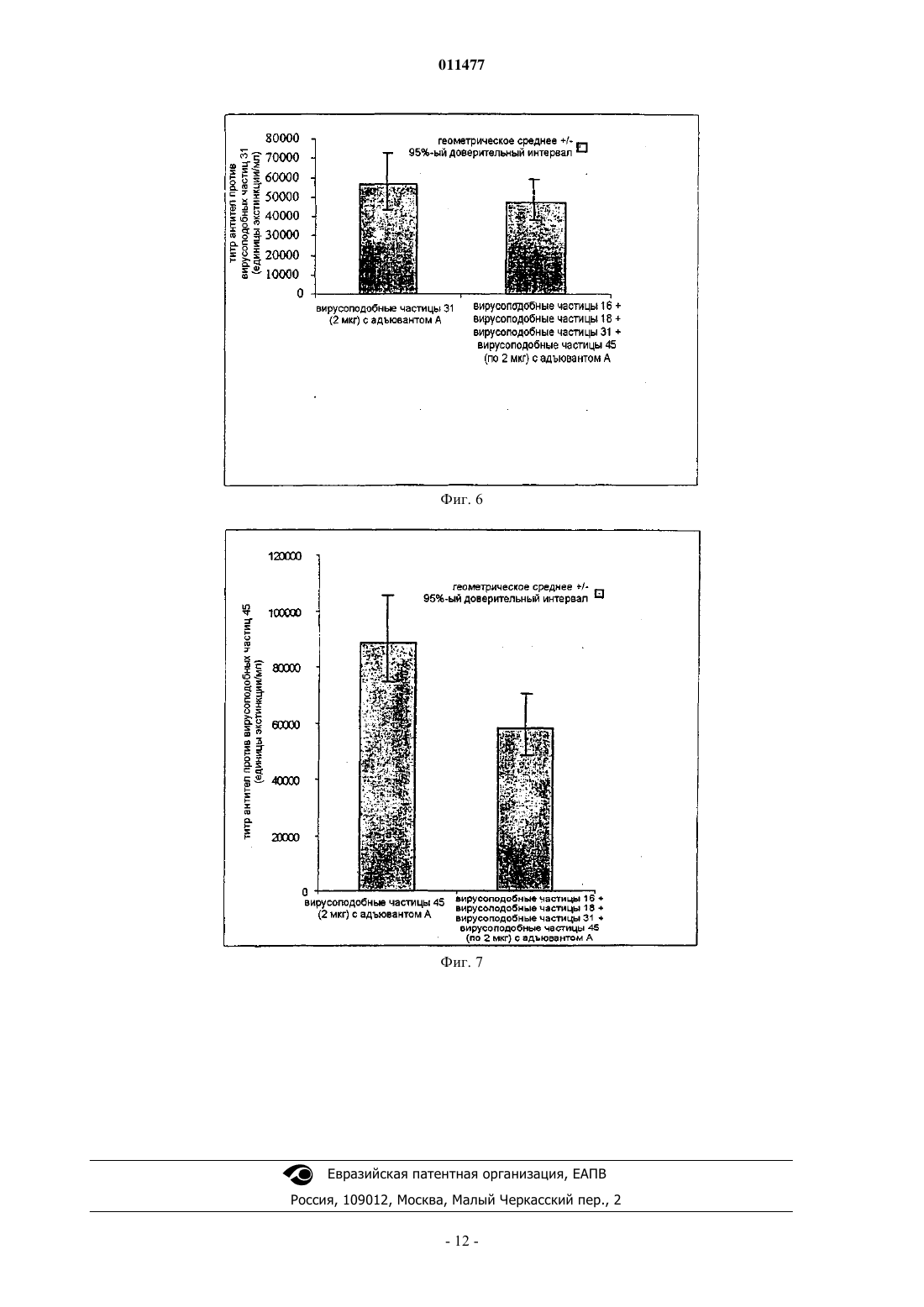
011477 Настоящее изобретение относится к вакцинам против человеческого папилломавируса (ЧПВ). В частности, это изобретение относится к вакцинам, содержащим вирусоподобные частицы, особенно вирусоподобные частицы, содержащие белки из ЧПВ. Вирусы папилломы являются малыми ДНК-овыми опухолевыми вирусами, которые обладают высокой видовой специфичностью. К настоящему времени описано более 100 индивидуальных генотипов вирусов папилломы человека. ЧПВ, в общем, специфичны к коже (например, ЧПВ-1 и -2) или слизистым поверхностям (например, ЧПВ-6 и -11) и обычно вызывают доброкачественные опухоли (бородавки),которые существуют несколько месяцев или лет. Такие доброкачественные опухоли могут расстраивать индивидов, которых это касается, но имеют тенденцию не быть угрозой для жизни, за несколькими исключениями. Некоторые ЧПВ также ассоциированы с раковыми заболеваниями. Самой сильной положительной ассоциацией между ЧПВ и раковым заболеванием человека является та, которая существует у ЧПВ-16 и ЧПВ-18 с карциномой шейки матки. Рак шейки матки является наиболее обычным злокачественным заболеванием в развивающихся странах, причем каждый год имеют место 500000 новых случаев. Сейчас технически достижима активная борьба с первичными инфекциями ЧПВ-16 и даже с возникшими раковыми опухолями, содержащими ЧПВ-16, при использовании вакцин. Обзор перспектив профилактической и терапевтической вакцинации против ЧПВ-16 см. в Cason J., J. Clin. Immunother. 1994; 1 (4) 293-306 и Hagenesee M.E., Infections in Medicine 1997 14 (7) 555-556, 559-564. Хотя существуют небольшие вариации, все описанные геномы ЧПВ имеют по меньшей мере восемь ранних генов, от Е 1 до Е 8, и два поздних гена, L1 и L2. Вдобавок, находящаяся впереди этих генов регуляторная область несет регуляторные последовательности, которые, по всей видимости, контролируют большинство транскрипционных событий в геноме ЧПВ. Вакцины на основе L1 ЧПВ раскрыты в WO 94/00152, WO 94/20137, WO 93/02184 и WO 94/05792. Такие вакцины могут содержать антиген L1 в виде мономера, капсомера или вирусоподобной частицы. Способы получения вирусоподобных частиц хорошо известны в данной области и включают в себя подходы, при которых осуществляют разборку/сборку вирусоподобных частиц, чтобы обеспечивать лучшую гомогенность, например, как описывают WO 9913056 и US 6245568. Такие частицы могут дополнительно содержать белки L2. Вакцины на основе L2 раскрыты, например, в WO 93/00436. Другие ЧПВ-вакцины основаны на ранних белках, таких как Е 7, или слитных белках, таких как L2-E7. Несмотря на работу по ЧПВ-вакцинам, имеющая широкую эффективность вакцина против рака шейки матки не существует. Настоящее изобретение относится к улучшенной вакцине против вируса папилломы человека. Согласно изобретению предложена вакцинная композиция против человеческого папилломавируса(ЧПВ), содержащая смесь вирусоподобных частиц ЧПВ 16, ЧПВ 18, ЧПВ 31 и ЧПВ 45, где каждая вирусоподобная частица содержит только белок L1 или функциональное производное белка L1 только из одного типа ЧПВ, причем иммунный ответ, генерированный данной вакциной, направлен против каждой из четырех указанных вирусоподобных частиц. Предпочтительной является вакцинная композиция по изобретению, где по меньшей мере один белок L1 является усеченным белком L1. Согласно одному аспекту изобретения предложена вакцинная композиция по изобретению, содержащая только вирусоподобные частицы, состоящие из белков из ЧПВ 16, ЧПВ 18, ЧПВ 31 и ЧПВ 45. Согласно другому аспекту изобретения предложена вакцинная композиция по изобретению, дополнительно содержащая вирусоподобную частицу, которая содержит белок L1 или его функциональное производное из другого типа ЧПВ. Предпочтительно дополнительная вирусоподобная частица содержит белок L1 или его функциональное производное, выбранное из типов ЧПВ 33, 52, 53, 58, 35, 56 и 59. Вакцинная композиция по изобретению предпочтительно является по меньшей мере на 60% эффективной в предотвращении рака шейки матки. Еще в одном аспекте предложена вакцинная композиция по изобретению, дополнительно содержащая антиген возбудителя заболевания, передаваемого половым путем. Предпочтительно указанный антиген представляет собой антиген вируса простого герпеса или его иммунологически активный фрагмент, антиген ВИЧ или его иммунологически активный фрагмент либо антиген хламидии или его иммунологически активный фрагмент. Целесообразно, когда вакцинная композиция по изобретению дополнительно содержит адъювант. Предпочтительно адъювант представляет собой соль алюминия или гидроксид алюминия. Более предпочтительно указанная вакцинная композиция дополнительно содержит 3D-MPL. Согласно изобретению предложен также способ получения вакцины по изобретению, при котором комбинируют вирусоподобные частицы, которые содержат белки L1 или функциональные производные белков L1 из ЧПВ 16, ЧПВ 18, ЧПВ 31 и ЧПВ 45. Предпочтительно иммунный ответ против определенного типа вирусоподобных частиц, входящих в полученную данным способом вакцину, составляет по меньшей мере 50% от ответа на тот же тип вирусоподобных частиц, если частицы этого типа используются индивидуально. Также предложено применение смеси вирусоподобных частиц ЧПВ 16, ЧПВ 18, ЧПВ 31 и ЧПВ 45,-1 011477 содержащих только белок L1 или его функциональное производное, для получения вакцины против ЧПВ, как она описана выше. Предпочтительно иммунный ответ против определенного типа вирусоподобных частиц, входящих в данную вакцину, составляет по меньшей мере 50% от ответа на тот же тип вирусоподобных частиц, если частицы этого типа используются индивидуально. Далее, согласно изобретению предложен способ предотвращения инфекции ЧПВ или лечения заболевания, связанного с инфицированием ЧПВ, при котором нуждающемуся в этом индивидууму вводят эффективное количество вакцинной композиции, как она определена выше. Предпочтительно иммунный ответ против определенного типа вирусоподобных частиц, входящих в используемую вакцину, составляет по меньшей мере 50% от ответа на тот же тип вирусоподобных частиц, если частицы этого типа используются индивидуально. Кроме того, согласно изобретению предложена стабилизированная вакцинная композиция, содержащая вакцину по изобретению, где вирусоподобные частицы из ЧПВ 16, 18, 31 и 45 адсорбированы на гидроксиде алюминия перед смешиванием. Предпочтительной является вакцина по изобретению, при использовании которой иммунный ответ против определенного типа вирусоподобных частиц, входящих в вакцину, составляет по меньшей мере 50% от ответа на тот же тип вирусоподобных частиц, если частицы этого типа используются для вакцинации индивидуально. Вирусоподобные частицы по настоящему изобретению могут быть образованы или из полноразмерного белка L1 ЧПВ, или из определенных производных L1 при использовании стандартных способов в данной области, например, как раскрывает WO 99/13056, что включено сюда ссылкой. Белок L1, использованный для образования вирусоподобных частиц, предпочтительно является усеченным белком L1. Предпочтительно по меньшей мере одна из вирусоподобных частиц содержит усеченный белок L1, и предпочтительно все белки L1 в комбинационной вакцине являются усеченными белками L1. Усечение предпочтительно удаляет сигнал ядерной локализации. Усечение предпочтительно является С-концевым усечением. С-Концевое усечение предпочтительно удаляет меньше чем 50 аминокислот, более предпочтительно меньше чем 40 аминокислот. Наиболее предпочтительно С-концевое усечение удаляет 34 аминокислоты из ЧПВ 16 и 35 аминокислот из ЧПВ 18. Усеченные белки L1 являются подходящим образом функциональными производными белков L1. Функциональные производные белков L1 способны вызывать иммунный ответ (при необходимости с подходящим адъювантом), причем указанный иммунный ответ способен распознавать вирусоподобные частицы, состоящие из полноразмерного белка L1 и/или типа ЧПВ, из которого был произведен белок L1. Вирусоподобные частицы по этому изобретению могут также содержать другие типы функциональных производных белков, в том числе мутанты полноразмерных или усеченных белков L1 ЧПВ, таких как мутанты с делецией, заменой или вставкой. Подходящие производные также включают в себя последовательности, оптимизированные по кодонам. Белок L1 или функциональное производное белка является способным подходящим образом образовывать вирусоподобные частицы, и образование вирусоподобных частиц можно оценить стандартными методиками, например электронной микроскопией или динамическим светорассеянием. Полидисперность вирусоподобных частиц предпочтительно составляет меньше чем 0,15, наиболее предпочтительно меньше чем 0,1 и более предпочтительно меньше чем 0,08 при измерении с использованием Malvern Zetasizer 3000HS в описанных здесь условиях. Применение термина "белок" или упоминание специфичного белка, например "L1", здесь ниже принято как включающее в себя упоминание функциональных производных белка, если иначе не указано или не очевидно из контекста. В предпочтительном аспекте этого изобретения вакцина по этому изобретению имеет только четыре типа вирусоподобных частиц: вирусоподобные частицы ЧПВ 16, ЧПВ 18, ЧПВ 31 и ЧПВ 45. Вирусоподобные частицы предпочтительно являются вирусоподобными частицами, состоящими только из L1 каждого из этих 4 генотипов. Или же, и наиболее предпочтительно, вакцина содержит дополнительную ЧПВ-валентность с получением пентавалентной вакцины. Дополнительной валентностью предпочтительно является вирусоподобная частица, содержащая белок L1 или его функциональные производное, как и выше, из одного из ЧПВ 52, 53, 58, 33, 35, 56 и 59. Пятым генотипом предпочтительно является ЧПВ 33 в вакцине для применения в Южной Америке или ЧПВ 52, 53 или 58 в вакцине для применения в Азии. Настоящее изобретение также охватывает вакцины, содержащие 2 или более чем 2 дополнительные валентности с получением вакцины с 6 или более чем 6 генотипами. В одном предпочтительном воплощении эта комбинация исключает вирусоподобные частицы из генотипов ЧПВ 6 а, 6b или ЧПВ 11. Вакцина по этому изобретению предпочтительно является по меньшей мере на 55% эффективной в предотвращении рака шейки матки, более предпочтительно на 60, 65, 70, 75%, предпочтительно на 80% или даже более эффективной в предотвращении рака шейки матки. Во избежание сомнений, % эффективности в предотвращении рака шейки матки означает защиту против всех раковых заболеваний шейки-2 011477 матки, индуцированных инфекцией ЧПВ, а не просто защиту от ракового заболевания, вызываемого одним генотипом. Предотвращение можно подходящим образом оценивать в течение 1 года после первой вакцинации, хотя предпочтительные вакцины являются равно эффективными в течение 2, 3, 4, 5 или более чем 5 лет. % эффективности можно увеличить выбором надлежащих генотипов ЧПВ для нацеливания вакцинного состава на специфические географические области. Комбинация вирусоподобных частиц в вакцине предпочтительно не снижает иммуногенность вирусоподобных частиц каждого типа. В частности, предпочтительно отсутствие интерференции между вирусоподобными частицами ЧПВ в комбинации по этому изобретению, так что комбинированная вакцина из вирусоподобных частиц по этому изобретению способна давать эффективную защиту против инфекции каждым генотипом ЧПВ, представленным в вакцине. Иммунный ответ против вирусоподобных частиц данного типа в комбинации подходящим образом составляет по меньшей мере 50% иммунного ответа на такой же тип вирусоподобных частиц при измерении в отдельности, предпочтительно 100% или, по существу, 100%. Для ответов на вирусоподобные частицы ЧПВ 16 и ЧПВ 18 комбинированная вакцина по этому изобретению предпочтительно стимулирует иммунный ответ, который составляет по меньшей мере 50% от того, который обеспечивает комбинированная вакцина из вирусоподобных частиц ЧПВ 16/ЧПВ 18. Иммунный ответ, который вызывает вакцина по этому изобретению, подходящим образом находится на уровне, на котором все еще заметен защитный эффект каждого их типов вирусоподобных частиц. Иммунный ответ можно подходящим образом измерять, например, антительными ответами, как проиллюстрировано здесь. Вакцину по этому изобретению можно использовать для лечения или предотвращения инфекции и/или болезни, которую вызывает ЧПВ. Например, вакцину можно использовать терапевтическим образом для редукции вирусной нагрузки и/или инфекции, которая приводит к карциноме шейки матки или осложнениям типа CIN III. Это изобретение, таким образом, относится к применению вакцины по этому изобретению в терапевтическом лечении заболеваний, относящихся в инфекциям ЧПВ, и в профилактике инфекции или заболевания. Это изобретение также относится к применению комбинации вирусоподобных частиц по этому изобретению в генерировании иммунного ответа против ЧПВ 16, 18, 31 и 45. Вакцина по этому изобретению возможно может быть составлена с вирусоподобными частицами,которые обеспечивают защиту против генитальных бородавок, такими как вирусоподобные частицы,содержащие белок L1 из генотипов ЧПВ 6 а, 6b и/или ЧПВ 11. Возможно вакцина может быть также составлена или введена вместе с не-ЧПВ антигенами. Эти антигены могут подходящим образом обеспечивать защиту против других заболеваний, наиболее предпочтительно заболеваний, передаваемых половым путем, таких как вызываемые вирусом простого герпеса(ВПГ), хламидиями и ВИЧ. Мы особенно предпочитаем вакцину, которая содержит gD или его усеченную форму из ВПГ, предпочтительно белок gD2t, какой описан в WO 99/45957. Таким путем вакцина обеспечивает защиту против и ЧПВ, и ВПГ. Предпочтительными антигенами ВИЧ являются те, что раскрыты в WO/9916884 и WO/0154719. Настоящее изобретение, в общем, относится к смеси вирусоподобных частиц, содержащих капсидные белки из ЧПВ 16, 18, 31 и 45, таких как вирусоподобные частицы, состоящие только из L1. В особенно предпочтительном воплощении это изобретение предлагает вакцину, содержащую смесь вирусоподобных частиц ЧПВ 16 , вирусоподобных частиц ЧПВ 18, вирусоподобных частиц ЧПВ 31 и вирусоподобных частиц ЧПВ 45. Упоминание здесь, например, о "вирусоподобных частицах ЧПВ 16" является упоминанием о вирусоподобных частицах с белком L1 или производным L1 из ЧПВ 16. Тот же принцип номенклатуры применим, путем расширения, к другим описанным здесь вирусоподобным частицам, таким как вирусоподобные частицы ЧПВ 18, ЧПВ 31 и ЧПВ 45. Сборку вирусоподобных частиц обычно осуществляют удалением восстановителя. При получении смешанных вирусоподобных частиц смешивание белков как таковое предпочтительно имеет место перед удалением восстановителя из смеси белков. Получение смешанных вирусоподобных частиц предпочтительно содержит стадии, на которых формируют смешанные вирусоподобные частицы из смеси диссоциированных белков L1 удалением восстановителя из смеси в условиях, которые делают возможным образование вирусоподобных частиц. Процесс воссоединения предпочтительно является результатом удаления восстановителя, такого как -меркаптоэтанол. Однако известно, что формирование вирусоподобной частицы зависит от рН, ионов металлов и солености так же, как от присутствия восстановителя. В таком случае при некоторых обстоятельствах можно предвидеть, что вирусоподобные частицы могут образоваться в присутствии восстановителя. Для этого изобретения важно только то, что смешивание белков из разных генотипов происходит перед изменением условий среды, которые делают возможным формирование смешанных вирусоподобных частиц, будь то рН, ионы металлов, соленость, восстановительная среда или их комбинация. Для всех вакцин по этому изобретению вакцину предпочтительно использовать для вакцинации девочек-подростков в возрасте 10-15 лет, предпочтительно 10-13 лет. Вакцину можно также вводить женщинам после аномального результата мазка по Папаиоанну или после операции по удалению поражения,которое вызвал ЧПВ.-3 011477 Вакцину предпочтительно доставляют двумя или тремя дозами, например, в нулевой и первый месяц или нулевой, первый и шестой месяц, соответственно. Режим вакцинации подходящим образом включает в себя бустерную инъекцию через 5-10 лет, предпочтительно 10 лет. Вакцина предпочтительно является жидким вакцинным составом, хотя можно лиофилизировать вакцину и восстановить влагосодержание перед введением. Вакцины по этому изобретению могут также содержать адъюванты в комбинации с вирусоподобными частицами. Вирусоподобные частицы по этому изобретению подходящим образом применяют в комбинации с алюминием, и они являются подходящим образом адсорбированными или частично адсорбированными на алюминиевых адъювантах. Также предпочтительными являются адъюванты, который стимулируют ответ типа Th1, такие как 3D-MPL или QS21. Адъювантом подходящим образом является соль алюминия, предпочтительно в комбинации с 3D-MPL, такой как фосфат алюминия и 3D-MPL. Предпочтительным адъювантом является гидроксид алюминия, причем особенно предпочтительна комбинация гидроксида алюминия с 3D-MPL. Когда вирусоподобные частицы являются адсорбированными на адъюванте, содержащем алюминий, адъювант предпочтительно добавляют перед смешиванием вирусоподобных частиц для формирования готового вакцинного продукта. Вакцина может также содержать алюминий или соединение алюминия в качестве стабилизатора, и настоящее изобретение также относится к стабилизированной комбинационной вакцине, в которой вирусоподобные частицы являются адсорбированными на соль алюминия. Вирусоподобные частицы являются подходящим образом более стабильными во времени после адсорбции на соль алюминия, чем в отсутствие алюминия. Получают или можно получать стабилизированные вирусоподобные частицы предпочтительно способами в соответствии с примером 1, разделом С 3. Вакцины по этому изобретению можно предоставлять любым из множества разных путей, таким как пероральный, локальный, подкожный, через слизистые (в типичных случаях во влагалище), внутривенный, внутримышечный, через нос, под язык, в кожу и через суппозиторий. Доставка в мышцу и доставка в кожу являются предпочтительными. Дозировка вирусоподобных частиц и других белков должна варьировать в зависимости от состояния, пола, возраста и веса индивида, от пути введения и от ЧПВ вакцины. Количество можно также варьировать в зависимости от числа типов вирусоподобных частиц. Количество вирусоподобных частиц,подходящее для генерирования иммунологически защитного ответа, доставляют подходящим образом. Каждая доза вакцины подходящим образом содержит 1-100 мкг каждых вирусоподобных частиц, предпочтительно 5-80 мкг, более предпочтительно 5-30 мкг каждых вирусоподобных частиц, наиболее предпочтительно 5-20 мкг каждых вирусоподобных частиц, особенно предпочтительно 5, 6, 10, 15 или 20 мкг. Мультивалентную вакцину по настоящему изобретению подходящим образом получают комбинированием вирусоподобных частиц из очищенных L1. Способы получения вирусоподобных частиц из L1 хорошо известны в данной области и включают в себя, например, способы, раскрытые в WO 9531532,WO 9615247, WO 00/09671 и US 5888526, все содержание которых включено сюда. Вирусоподобные частицы по этому изобретению подходящим образом получают разборкой и воссоединением вирусоподобных частиц с получением гомогенных и чистых вирусоподобных частиц. Примеры подходящих способов даны в WO 0057906, US 6245568 и WO 9913056. Предпочтительно получают вирусоподобные частицы из клеток насекомых, таких как клетки Sf9 или Hi-5, хотя также можно использовать любые подходящие клетки, такие как клетки Е. coli или клетки дрожжей, например S. cerevisiae, S. pombe или Pichia sp. Предпочтительно очистка вирусоподобных частиц после экспрессии L1 включают в себя одну или более чем одну из стадий, представляющих собой ионообменную хроматографию (диметиламиноэтил DMAE), анионообменную хроматографию (триметиламиноэтил - ТМАЕ), хроматографию на гидроксиапатите, фильтрацию, такую как нанометровая фильтрация или ультрафильтрация, или хроматографию на основе гидрофобных взаимодействий. Во время очистки предпочтительно применять по меньшей мере одну стадию анионного обмена и более предпочтительно две стадии анионного обмена. Предпочтительно по меньшей мере одну стадию очистки анионным обменом проводят перед смешиванием белков. Возможно может быть использована одна стадия облучения ультрафиолетом. Во избежание сомнений, полное содержание всех упомянутых здесь документов включено сюда ссылкой. Настоящее изобретение иллюстрируют нижеследующие не ограничивающие примеры и фигуры,причем фиг. 1 иллюстрирует смешанные вирусоподобные частицы в сравнении с вирусоподобными частицами ЧПВ 16 при электронной микроскопии; фиг. 2 и 3 иллюстрируют распределение смешанных вирусоподобных частиц по размерам; фиг. 4 иллюстрирует антительные ответы против вирусоподобных частиц 16 в комбинационной вакцине из смешанных ЧПВ 16, 18, 31, 45 при сравнении с контролем, представляющим собой ЧПВ 16; фиг. 5 иллюстрирует антительные ответы против вирусоподобных частиц 18 в комбинационной вакцине из смешанных ЧПВ 16, 18, 31, 45 при сравнении с контролем, представляющим собой ЧПВ 18;-4 011477 фиг. 6 иллюстрирует антительные ответы против вирусоподобных частиц 31 в комбинационной вакцине из смешанных ЧПВ 16, 18, 31, 45 при сравнении с контролем, представляющим собой ЧПВ 31; и фиг. 7 иллюстрирует антительные ответы против вирусоподобных частиц 45 в комбинационной вакцине из смешанных ЧПВ 16, 18, 31, 45 при сравнении с контролем, представляющим собой ЧПВ 45. Пример 1. Здесь детализирована комбинация вирусоподобных частиц из L1 ЧПВ 16 и ЧПВ 18. Белки L1 из других генотипов ЧПВ можно легко получать сходными способами, известными в данной области. А. Получение вирусоподобных частиц из L1 ЧПВ 16/18. Получение вирусоподобных частиц ЧПВ 16 и ЧПВ 18 осуществляли по стандартным протоколам,например см. WO 9913056. Экспрессировали белки ЧПВ 16/18 в клетках Trichoplusia ni (High Five)(при плотности 350000 клеток/мл), инфицированных рекомбинантным бакуловирусом (MOI составляет 0,3), кодирующим ген L1 ЧПВ 16 или 18, представляющий интерес. Собирали клетки приблизительно через 72 ч после инфицирования. В. Сбор клеток/экстракция антигена. Антиген (L1-16/18) экстрагировали из клеток Hi5 трехстадийным способом концентрирования, экстракции, осветления. Стадия концентрирования удаляет до 90% культуральной среды, и ее осуществляли фильтрацией в тангенциальном потоке. Стадию экстракции осуществляли с гипотоническим буфером(20 мМ Трис, рН 8,5). Для осуществления экстракции использовали объем, равный объему культуры. Использовали период времени контакта не менее получаса при мягком перемешивании. Осветление осуществляли фильтрацией в тангенциальном потоке. С. Очистка. Процесс очистки осуществляли при комнатной температуре. К экстракту добавляли -меркаптоэтанол, чтобы разбирать вирусоподобные частицы на капсомеры для обоих антигенов L1-16/18. Глицерин добавляли до концентрации 10 мас.%, непосредственно перед добавлением -меркаптоэтанола. Все использованные буферы были профильтрованы на 0,22-микрометровых фильтрах до хранения при 2-8 С. Перед каждым сеансом очистки гелевые матриксы санировали и уравновешивали с надлежащим буфером до нанесения пробы. Режимы очистки даны для отдельной очистки L1 из ЧПВ 16 и ЧПВ 18. Эти схемы имеют много сходства и включают в себя стадии, на которых проводят анионообменную хроматографию (диметиламиноэтил - DMAE),анионообменную хроматографию (триметиламиноэтил - ТМАЕ),хроматографию на гидроксиапатите,нанометровую фильтрацию (Planova),ультрафильтрацию,хроматографию на основе гидрофобных взаимодействий (с использованием октил-Сефарозы) для ЧПВ 18 или анионообменную хроматографию (DEAE) для ЧПВ 16 и стерильную фильтрацию. Конкретно: С 1. Очистка антигена L1-18. Анионообменная хроматография на DMAE. Осветленный экстракт (белок в концентрации около 1 г/мл, причем белок L1 в концентрации около 150 мг/мл) наносят на анионообменную колонку (DMAE). Элюирование осуществляют буфером (20 мМ Трис, 200 мМ NaCl, 4% -меркаптоэтанол ВМЕ) при рН 7,90,2. Антиген выходит приблизительно в 5 объемах колонки, профиль элюирования мониторируют при 280 нм. Анионообменная хроматография на ТМАЕ. Элюат первой стадии разбавляют одним объемом Н 2 О/4% ВМЕ. Разбавленный элюат затем наносят на вторую анионообменную колонку (ТМЕА). Элюирование осуществляют буфером (20 мМ Трис, 200 мМ NaCl, 4% ВМЕ) при рН 7,90,2. Антиген выходит приблизительно в 4 объемах колонки, профиль элюирования мониторуют при 280 нм. Хроматография на гидроксиапатите. Элюат стадии ТМАЕ наносят на колонку с гидроксиапатитом (НА). После нанесения пробы гель выходит приблизительно в 2,5 объемах колонки, буфер (100 мМNaH2PO4, 30 мМ NaCl, 4% ВМЕ) при рН 6,00,2. Нанометровая фильтрация (Planova). Элюат с НА разбавляют для достижения следующих условий: буфер (25 мМ NaH2PO4, 10 мМ NaCl, 4% ВМЕ) при рН 7,50,2. Затем его фильтруют последовательно на 0,2-микрометровом префильтре и на фильтре Planova 15N площадью 0,12 м 2. Фильтрацию осуществляют при постоянном давлении 20020 мбар. Ультрафильтрация. Ультрафильтрацию осуществляют на системе ультрафильтрации в тангенциальном потоке, снабженной полиэфирсульфоновыми мембранами (кассета Centramate, 0,1 м 2, 100 кДа). Элюат от Planova об-5 011477 рабатывают для достижения следующих условий: (100 мМ NaH2PO4, 30 мМ NaCl, 4% ВМЕ), рН 6,00,2; затем его загружают в систему, концентрируют в 5 раз и подвергают диафильтрации при непрерывной инжекции примерно 10 начальных объемов буфера (20 мМ NaH2PO4, 500 мМ NaCl) при рН 6,00,2. Хроматография на основе гидрофобных взаимодействий (октил-Сефароза). Ультрафильтрат наносят на колонку с октил-Сефарозой. Эту стадию хроматографии проводят в негативном режиме, причем объем буфера (20 мМ NaH2PO4,500 мМ NaCl) при рН 6,00,2 составляет приблизительно 5 объемов колонки. Стерильная фильтрация. Раствор очищенного антигена L1-18 стерилизуют фильтрацией на 0,22-микрометровой мембране. С 2. Очистка антигена L1-16. Анионообменная хроматография на DMAE. Осветленный экстракт наносят на анионообменную колонку (DMAE). Элюирование осуществляют буфером (20 мМ Трис, 180 мМ NaCl, 4% ВМЕ), рН 7,90,2. Антиген выходит приблизительно в 4 объемах колонки, профиль элюирования мониторируют при 280 нм. Анионообменная хроматография на ТМАЕ. Элюат первой стадии разбавляют 1 объемом Н 2 О/4% ВМЕ. Разбавленный элюат затем наносят на вторую анионообменную колонку (ТМЕА). Элюирование осуществляют буфером (20 мМ Трис, 180 мМNaCl, 4% ВМЕ) при рН 7,90,2. Антиген выходит приблизительно в 5 объемах колонки, профиль элюирования мониторируют при 280 нм. Хроматография на гидроксиапатите. Элюат стадии ТМАЕ наносят на колонку с гидроксиапатитом (НА). После нанесения пробы гель выходит приблизительно в 3 объемах колонки буфера (100 мМ NaH2PO4,30 мМ NaCl, 4% ВМЕ) при рН 6,00,2. Нанометровая фильтрация (Planova). Элюат с НА разбавляют для достижения следующих условий: буфер (25 мМ NaH2PO4, 10 мМ NaCl, 4% ВМЕ) при рН 7,50,2. Затем его фильтруют последовательно на 0,2-микрометровом префильтре и на фильтре Planova 15N площадью 0,12 м 2. Фильтрацию осуществляют при постоянном давлении 200 мбар 20 мбар. Ультрафильтрация. Ультрафильтрацию осуществляют на системе ультрафильтрации в тангенциальном потоке, снабженной полиэфирсульфоновыми мембранами (кассета Centramate, 0,1 м 2, 100 кДа). Элюат от Planova обрабатывают для достижения следующих условий: (100 мМ NaH2PO4, 30 мМ NaCl, 4% ВМЕ) при рН 6,00,2; затем его загружают в систему, концентрируют в 5 раз и подвергают диафильтрации при непрерывной инжекции примерно 10 начальных объемов буфера (20 мМ NaH2PO4, 500 мМ NaCl) при рН 6,00,2. Анионообменная хроматография на DEAE. Элюат с ультрафильтрации доводят до проводимости уравновешивающего буфера (20 мМ Na3PO4,250 мМ NaCl) при рН 6,00,2 и наносят на анионообменную колонку (DEAE). Элюирование проводят буфером (20 мМ NaH2PO4, 500 мМ NaCl) при рН 6,00,2. Антиген выходит примерно в 3 объемах колонки, профиль элюирования мониторируют при 280 нм. Стерильная фильтрация. Раствор очищенного антигена L1-16 стерилизуют фильтрацией на 0,22-микрометровой мембране.C3. Каждый тип вирусоподобной частицы адсорбируют независимо с получением концентрированного адсорбированного моновалента. Получение концентрированного адсорбированного моновалента вирусоподобных частиц 16. 60 мкг очищенных вирусоподобных частиц из ЧПВ 16 адсорбируют на 150 мкг Al3+ из Al(OH)3 при рН 6,00,2 в течение 1 ч при комнатной температуре и мягком перемешивании. Этот концентрированный адсорбированный моновалент хранят при +4 С. Адсорбцию проверяют центрифугированием препарата и количественным определением вирусоподобных частиц в супернатанте. Получение концентрированного адсорбированного моновалента вирусоподобных частиц 18. 60 мкг очищенных вирусоподобных частиц из ЧПВ 18 адсорбируют на 150 мкг Al3+ из Al(OH)3 при рН 6,00,2 в течение 1 ч при комнатной температуре и мягком перемешивании. Этот концентрированный адсорбированный моновалент хранят при +4 С. Адсорбцию проверяют центрифугированием препарата и количественным определением вирусоподобных частиц в супернатанте.D. Получение готовой вакцины. Концентрированные адсорбированные моноваленты, полученные вышеописанными способами,комбинировали для формирования суспензии, которая содержат 20 мкг каждых вирусоподобных частиц в дозе. Готовую вакцину хранят при +4 С. Добавление вирусоподобных частиц из ЧПВ 31 и 45 при концентрации каждых вирусоподобных частиц, составляющей 20 мкг, довершает тетравалентную вакцину. Комбинированные адсорбированные массы или индивидуальные адсорбированные массы можно далее смешивать с адъювантами, такими как 3D-MPL.-6 011477 Пример 2. А. Получение вирусоподобных частиц L1 ЧПВ 16/18. Получение вирусоподобных частиц ЧПВ 16 и ЧПВ 18 осуществляли при использовании стандартных протоколов как выше. В. Формирование смешанных вирусоподобных частиц. В способе по этому изобретению осуществляют разборку и воссоединение вирусоподобных частиц ЧПВ 16 и 18 так, что воссоединение L1 ЧПВ 16 и 18 осуществляют совместно, чтобы дать возможность формирования смешанной вирусоподобной частицы. Вирусоподобные частицы ЧПВ 16 и 18 можно комбинировать в любой подходящий момент вышеуказанного процесса перед моментом воссоединения вирусоподобных частиц. Примером 2 протестированы конкретные стратегии. 1. Смешивание обоих антигенов после стадии НА. На основании концентрации L1 в пулах НА смешивают два компонента для достижения равных концентраций ЧПВ 16 и 18, чтобы начать стадию ультрафильтрации. В этом случае после стадии ультрафильтрации стадию октил-Сефарозы осуществляют как для очистки ЧПВ 18 с последующей стадией DEAE, как осуществляют в процедуре ЧПВ 16. 2. Смешивание и совместная очистка обоих экстрактов. На основании концентрации L1 в экстрактах смешивают две валентности для достижения равных концентраций ЧПВ 16 и 18, чтобы начать стадию DMAE. Опять же, после стадии ультрафильтрации осуществляют стадию с октил-Сефарозой как для ЧПВ 18 с последующей стадией DEAE, которую осуществляют, как в процедуре ЧПВ 16. Вирусоподобная частица ЧПВ 16-ЧПВ 18, смешанная на стадии ультрафильтрации. Вирусоподобная частица ЧПВ 16-ЧПВ 18, смешанная на стадии DMAE. Используют такую же технологическую схему, но смешивание осуществляют на стадии DMAE,вместо стадии ультрафильтрации. Концентрация, использованная для элюирования на стадиях DMAE и ТМАЕ анионного обмена, составляет 200 мМ. Результаты. Вирусоподобная частица ЧПВ 16-ЧПВ 18, смешанная на стадии ультрафильтрации. Комбинированием белков L1 ЧПВ 16 и ЧПВ 18 получили 2 партии смешанных вирусоподобных частиц (номера партий 31b165 с и 31b166 с). Чистота по электрофорезу в полиакриламидном геле с додецилсульфатом натрия. Чистота у смешанных вирусоподобных частиц была столь же хорошей, как у "классических" масс ЧПВ 16 или ЧПВ 18. Чистота этих масс была выше 95%. Данные электронной микроскопии - фиг. 1. Электронную микроскопию 31 В 165 С (удержанный ультрафильтрацией материал после созревания) сравнивали с партией классических ЧПВ 16 (39 В 122 с). Вирусоподобные частицы были хорошо сформированными, гомогенными по размеру, без агрегации, в обоих экспериментах присутствует некоторое количество лент из капсомеров. Распределение по размерам. Распределение вирусоподобных частиц по размерам определяли при использовании Malvern Zetasizer 3000 HS. Отмеряли пробы неразбавленными в пластиковые кюветы для анализа на Malvern (800 мкл/кювета). Техническими условиями были-7 011477 длина волны лазера: 532 нм,мощность лазера: 50 млВт,определение светорассеяния при 90,температура: 25 С,длительность: автоматическое определение программным обеспечением,число: 3 последовательных измерения,z-усредненный диаметр: кумулятивный анализ,распределение по размерам: способ Контина (Contin). Классическими результатами для вирусоподобных частиц из L1 ЧПВ 18 являются 70-80 нм при хорошей полидисперности (0,1). Классическими результатами для вирусоподобных частиц из L1 ЧПВ 16 являются 60-70 нм при хорошей полидисперности (0,1). Для смешанных вирусоподобных частиц были получены следующие результаты: 31 В 165 с : 85 нм при хорошей полидисперности (0,08). Вирусоподобные частицы почти полностью сформированы в начале созревания. 31 В 166 с : 76 нм при хорошей полидисперности (0,08). Распределение по размерам в партии 31 В 165 с и 31 В 166 с при измерении динамическим светорассеянием показано на фиг. 2 и 3. Вирусоподобная частица ЧПВ 16-ЧПВ 18, смешанная на стадии DMAE. Партия 31 В 167 В была получена из партий E18L1C005 (ЧПВ 18) и 39 В 167(ЧПВ 16). Чистота по электрофорезу в полиакриламидном геле с додецилсульфатом натрия. Чистота у смешанных вирусоподобных частиц была столь же хорошей, как у классических масс. Чистота этих масс была выше 95%. Распределение по размерам. Распределение вирусоподобных частиц по размерам определяли при использовании Malvern Zetasizer 3000 HS. Классическими результатами для вирусоподобных частиц из L1 ЧПВ 18 являются 70-80 нм при хорошей полидисперности (0,1). Классическими результатами для вирусоподобных частиц из L1 ЧПВ 16 являются 60-70 нм при хорошей полидисперности (0,1). Для смешанных вирусоподобных частиц были получены следующие результаты: ЧПВ 16-ЧПВ 18 31 В 167 В: 74 нм при хорошей полидисперности (0,07). Вирусоподобные частицы почти полностью сформированы в начале созревания. Пример 3. Получение комбинационной вакцины из смешанных ЧПВ 16, 18, 31, 45. Введение. Исследование иммуногенности проводили на мышах Balb/C при использовании комбинации вирусоподобных частиц 16, 18, 31 и 45 с усеченными по С-концами L1 при использовании адъюванта алюминий + 3D-MPL (здесь обозначен как "адъювант А" - 50 мкг соли алюминия и 5 мкг 3D MPL). Иммунизировали 4 группы по 10 мышей внутримышечным путем в день 0 и 21, соответственно,следующим: 1. вирусоподобные частицы 31 (2 мкг)/адъювант А,2. вирусоподобные частицы 45 (2 мкг)/адъювант А,3. вирусоподобные частицы 16 (2 мкг) и вирусоподобные частицы 18 (2 мкг)/адъювант А,4. вирусоподобные частицы 16 (2 мкг), вирусоподобные частицы 18 (2 мкг), вирусоподобные частицы 31 (2 мкг), вирусоподобные частицы 45 (2 мкг)/адъювант А. Мониторировали антительные ответы против вирусоподобных частиц 16, 18, 31 и 45 на сыворотках, взятых в день 35 (14 дней после дозы II). Результаты показаны на фиг. 4-7. Антительный ответ против вирусоподобных частиц 16. Сильные антительные ответы индуцированы в сыворотках после дозы II как вирусоподобными частицами 16, составленными с вирусоподобными частицами 18 на адъюванте А (группа 3), так и полной комбинацией (группа 4). Аналогичный уровень антител, направленных против вирусоподобных частиц 16, измерен в обеих группах, и интерференция не наблюдается. Антительный ответ против вирусоподобных частиц 18. Сильные антительные ответы индуцированы в сыворотках после дозы II как вирусоподобными частицами 18, составленными с вирусоподобными частицами 16 на адъюванте А (группа 3), так и полной комбинацией (группа 4). Аналогичный уровень антител, направленных против вирусоподобных частиц 18, измерен в обеих группах (разница меньше чем 1,5-кратная), и интерференция не наблюдалась. Антительный ответ против вирусоподобных частиц 31. Сильные антительные ответы индуцированы в сыворотках после дозы II как вирусоподобными частицами 31, составленными отдельно на адъюванте А (группа 1), так и полной комбинацией (группа 4).-8 011477 Аналогичный уровень антител, направленных против вирусоподобных частиц 31, измерен в обеих группах, поэтому интерференция не наблюдается. Антительный ответ против вирусоподобных частиц 45. Сильные антительные ответы индуцированы в сыворотках после дозы II как вирусоподобными частицами 45, составленными отдельно на адъюванте А (группа 2), так и полной комбинацией (группа 4). Аналогичный уровень антител, направленных против вирусоподобных частиц 45, измерен в обеих группах, таким образом, интерференция не наблюдается. Заключения. Интерференция не наблюдается, когда доставляют четыре вирусоподобные частицы (вирусоподобные частицы 16, 18, 31 и 45) в виде комбинации. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Вакцинная композиция против человеческого папилломавируса (ЧПВ), содержащая смесь вирусоподобных частиц ЧПВ 16, ЧПВ 18, ЧПВ 31 и ЧПВ 45, где каждая вирусоподобная частица содержит только белок L1 или функциональное производное белка L1 только из одного типа ЧПВ, причем иммунный ответ, генерированный данной вакциной, направлен против каждой из четырех указанных вирусоподобных частиц. 2. Вакцинная композиция по п.1, где по меньшей мере один белок L1 является усеченным белком L1. 3. Вакцинная композиция по п.1 или 2, содержащая только вирусоподобные частицы, состоящие из белков из ЧПВ 16, ЧПВ 18, ЧПВ 31 и ЧПВ 45. 4. Вакцинная композиция по п.1 или 2, дополнительно содержащая вирусоподобную частицу, которая содержит белок L1 или его функциональное производное из другого типа ЧПВ. 5. Вакцинная композиция по п.4, где дополнительная вирусоподобная частица содержит белок L1 или его функциональное производное, выбранное из типов ЧПВ 33, 52, 53, 58, 35, 56 и 59. 6. Вакцинная композиция по любому из пп.1-5, которая является по меньшей мере на 60% эффективной в предотвращении рака шейки матки. 7. Вакцинная композиция по любому из пп.1, 2, 4, 5 или 6, дополнительно содержащая антиген возбудителя заболевания, передаваемого половым путем. 8. Вакцинная композиция по п.7, где указанный антиген представляет собой антиген вируса простого герпеса или его иммунологически активный фрагмент. 9. Вакцинная композиция по п.7, где указанный антиген представляет собой антиген ВИЧ или его иммунологически активный фрагмент. 10. Вакцинная композиция по п.7, где указанный антиген представляет собой антиген хламидии или его иммунологически активный фрагмент. 11. Вакцинная композиция по любому из пп.1-10, дополнительно содержащая адъювант. 12. Вакцинная композиция по п.11, где адъювант представляет собой соль алюминия. 13. Вакцинная композиция по п.11, где адьювант представляет собой гидроксид алюминия. 14. Вакцинная композиция по п.12 или 13, дополнительно содержащая 3D-MPL. 15. Способ получения вакцины по любому из пп.1-14, при котором комбинируют вирусоподобные частицы, которые содержат белки L1 или функциональные производные белков L1 из ЧПВ 16, ЧПВ 18,ЧПВ 31 и ЧПВ 45. 16. Применение смеси вирусоподобных частиц ЧПВ 16, ЧПВ 18, ЧПВ 31 и ЧПВ 45, содержащих только белок L1 или его функциональное производное, для получения вакцины против ЧПВ по любому из пп.1-14. 17. Способ предотвращения инфекции ЧПВ или лечения заболевания, связанного с инфицированием ЧПВ, при котором нуждающемуся в этом индивидууму вводят эффективное количество вакцинной композиции по любому из пп.1-14. 18. Стабилизированная вакцинная композиция, содержащая вакцину по любому из пп.1-14, где вирусоподобные частицы из ЧПВ 16, 18, 31 и 45 адсорбированы на гидроксиде алюминия перед смешиванием. 19. Вакцинная композиция по любому из пп.1-14 или 18, при использовании которой иммунный ответ против определенного типа вирусоподобных частиц, входящих в вакцину, составляет по меньшей мере 50% от ответа на тот же тип вирусоподобных частиц, если частицы этого типа используются для вакцинации индивидуально. 20. Способ по п.15, где иммунный ответ против определенного типа вирусоподобных частиц, входящих в полученную данным способом вакцину, составляет по меньшей мере 50% от ответа на тот же тип вирусоподобных частиц, если частицы этого типа используются индивидуально. 21. Применение по п.16, где иммунный ответ против определенного типа вирусоподобных частиц,входящих в вакцину, составляет по меньшей мере 50% от ответа на тот же тип вирусоподобных частиц,если частицы этого типа используются индивидуально. 22. Способ по п.17, где иммунный ответ против определенного типа вирусоподобных частиц, вхо-9 011477 дящих в вакцину, составляет по меньшей мере 50% от ответа на тот же тип вирусоподобных частиц, если частицы этого типа используются индивидуально.
МПК / Метки
МПК: C12N 7/04, C07K 14/025, A61K 39/12
Метки: способы, папилломавируса, против, применения, человека, композиция, вакцинная, получения
Код ссылки
<a href="https://eas.patents.su/13-11477-vakcinnaya-kompoziciya-protiv-papillomavirusa-cheloveka-i-sposoby-ee-polucheniya-i-primeneniya.html" rel="bookmark" title="База патентов Евразийского Союза">Вакцинная композиция против папилломавируса человека и способы ее получения и применения</a>
Предыдущий патент: Одномагистральное смазочное устройство
Следующий патент: Автотермический реформинг- процесс для комплексного производства уксусной кислоты и метанола
Случайный патент: Водонепроницаемая и воздухопроницаемая подошва для обуви и способ ее изготовления