Терапия глиобластомы тимозином -α-1
Формула / Реферат
1. Способ терапии глиобластомы, включающий введение хлорэтилнитрозомочевины в комбинации с пептидом тимозина-a 1 (TA1).
2. Способ по п.1, где хлорэтилнитрозомочевина означает BCNU.
3. Способ по п.2, где BCNU вводят в дозе 150-200 мг/м2.
4. Способ по п.1, где пептид (TA1) означает тимозин-a 1 и вводится в дозе от 0,001 до 10 мг/кг массы тела/день.
5. Способ по п.4, где тимозин-a 1 вводится в дозе 0,02 мг/кг массы тела/день.
Текст
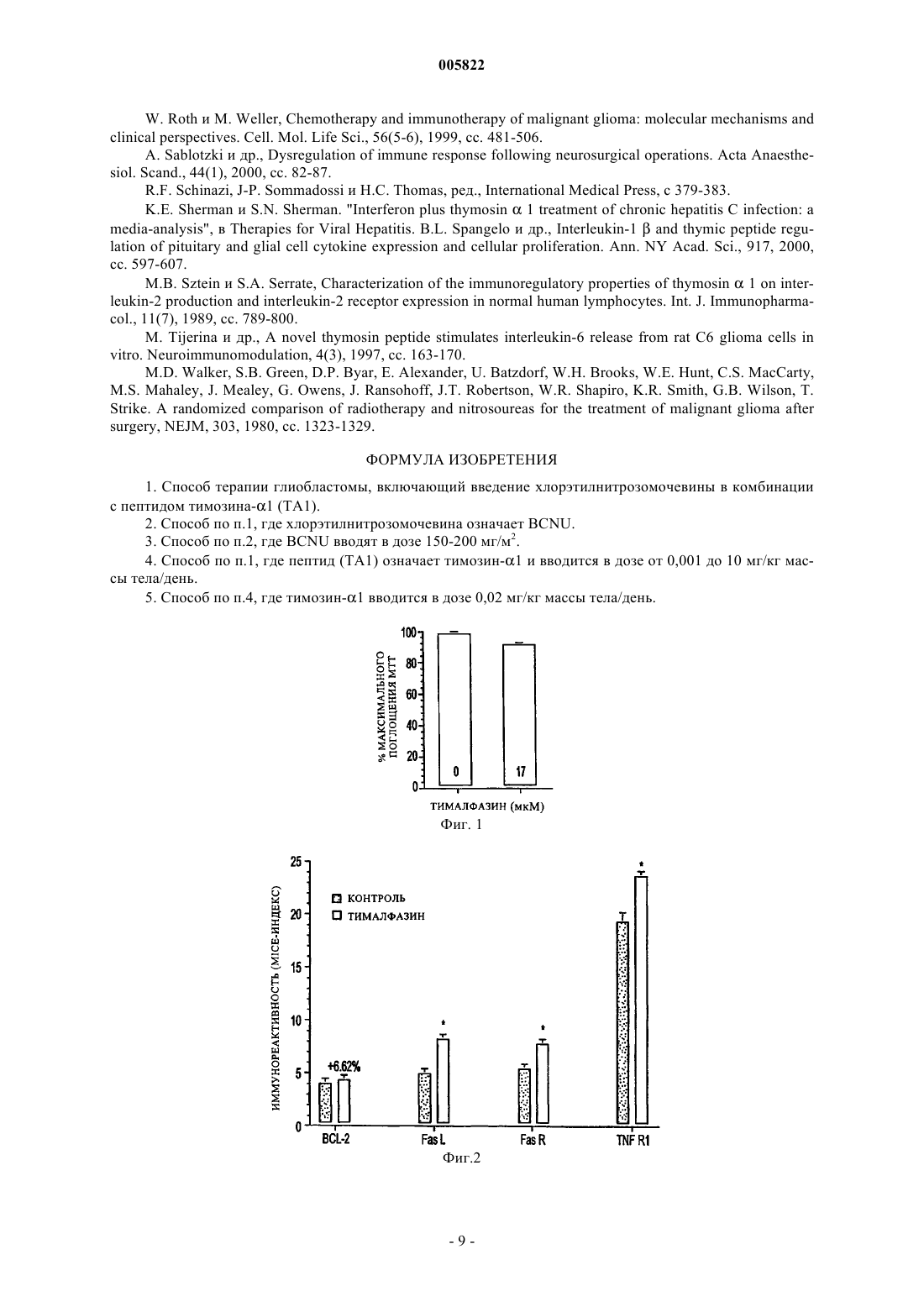
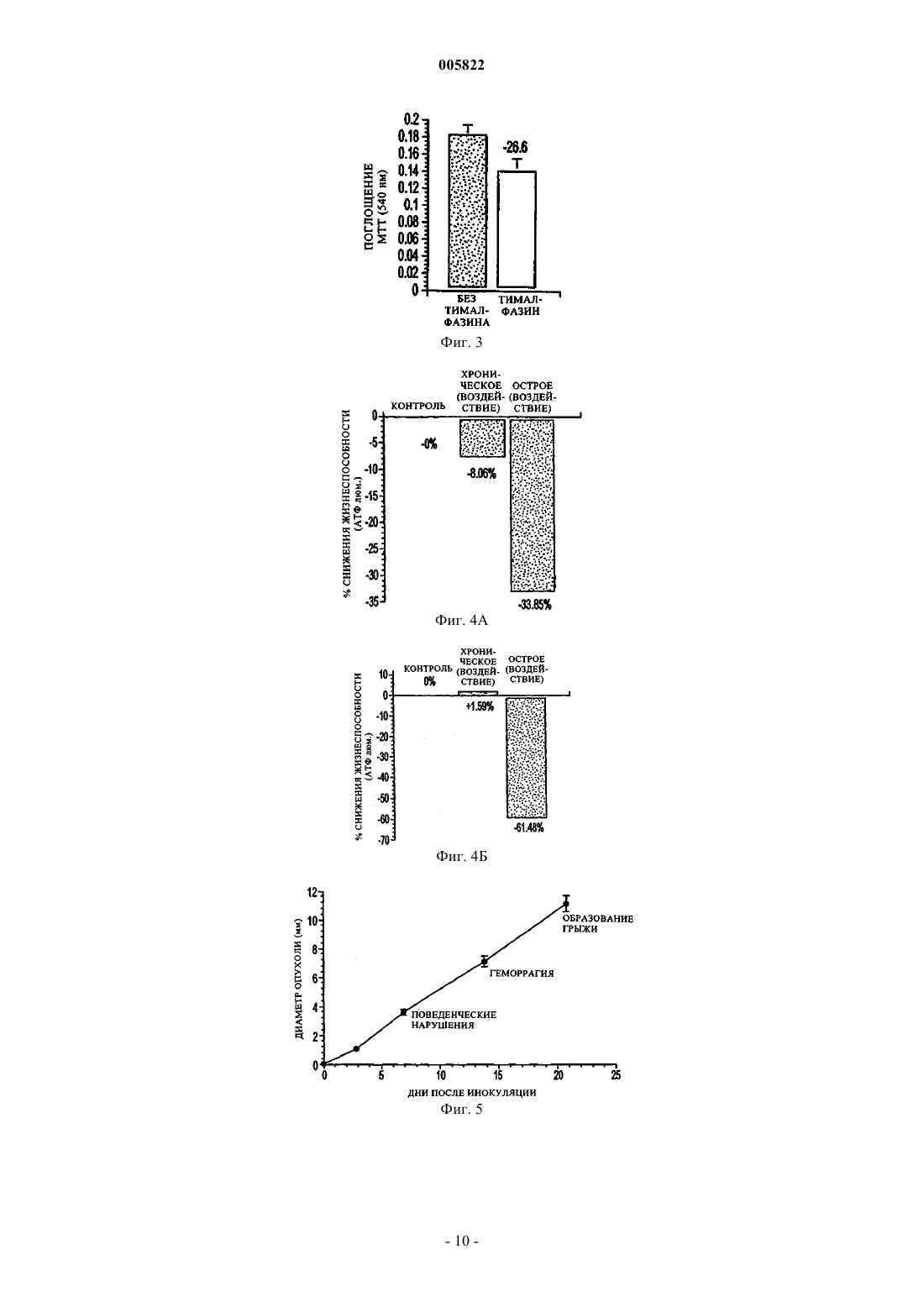
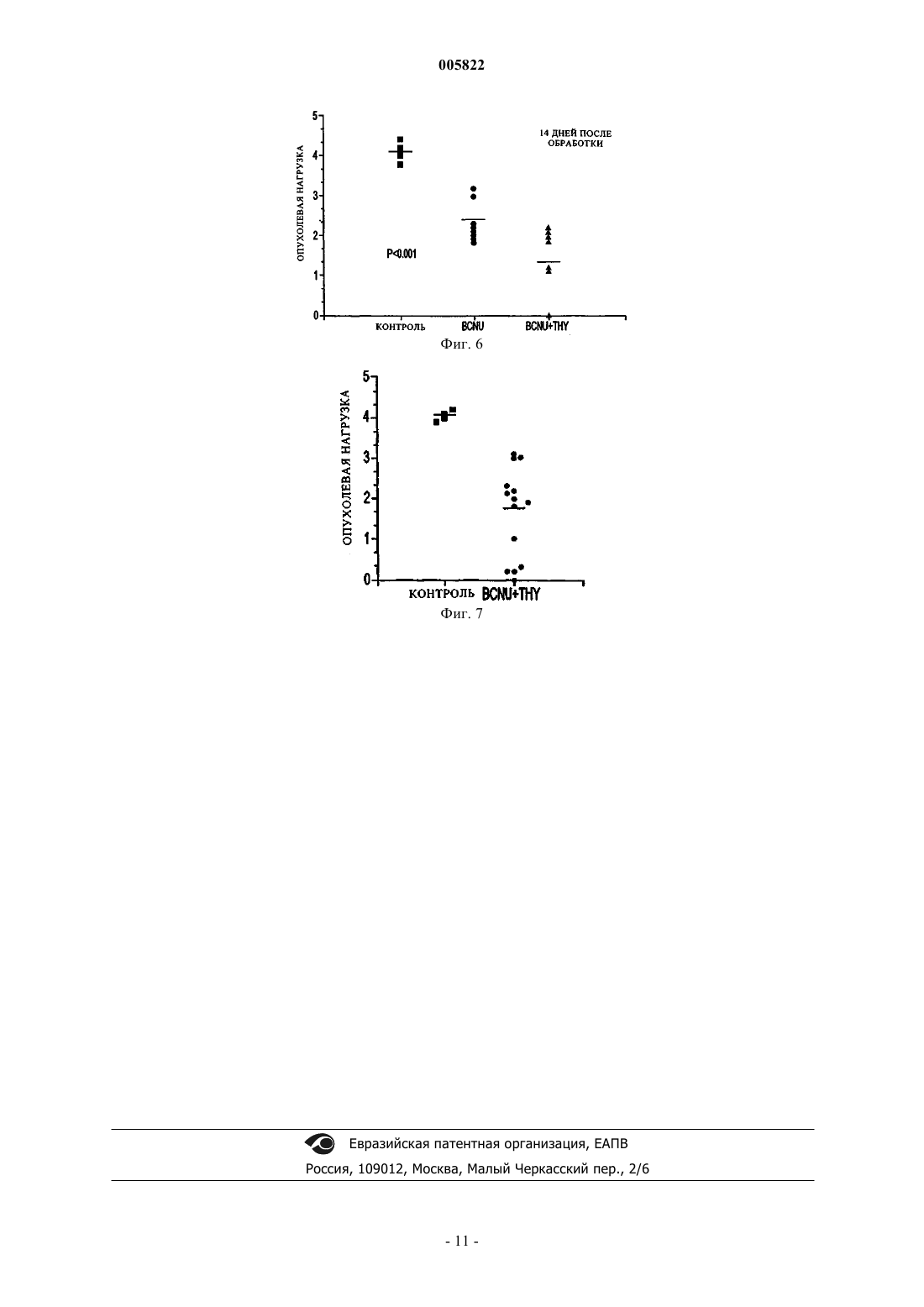
005822 Предпосылки создания изобретения Глиобластома является наиболее широко распространенным первичным злокачественным новообразованием ЦНС и служит причиной почти 75% случаев заболеваний. Хотя в их лечении и наблюдается устойчивый прогресс благодаря усовершенствованиям в нейровизуализации, микрохирургии и облучении, глиобластомы остаются инкурабельными (McDonald, 20001; Burton, 2000; Prados, 2000). Средняя предполагаемая продолжительность жизни составляет менее одного года со времени постановки диагноза, а пятилетняя выживаемость после агрессивной терапии, включая резекцию крупной опухоли, составляет менее 10% (Burton, 2000; Niedr, 2000; Napolitano, 1999; Dazzi, 2000). Глиобластомы являются причиной смерти из-за быстрого, агрессивного и инфильтративного роста в мозге. Инфильтративный характер роста ответствен за неоперабельную природу этих опухолей. Глиобластомы довольно устойчивы также к облучению и химиотерапии, и поэтому скорости появления посттерапевтических рецидивов высоки. Кроме того, иммунная реакция на опухолевые клетки по большей части неэффективна при полном уничтожении остающихся опухолевых клеток после резекции и радиотерапии (Roth, 1999; Dix, 1999;Sablotzki, 2000). Злокачественные клетки глиомы избегают детектирования иммунной системой хозяина, продуцируя иммуносупрессивные пептиды, которые ослабляют Т-клеточную пролиферацию и продукцию IL-2(Dix, 1999). Центральная нервная система является в некотором роде иммунопривилегированной, что позволяет злокачественным клеткам расти необнаруженными. Поиск эффективного способа терапии пациентов с глиобластомами все еще продолжается в настоящее время. Иммунотерапия или терапия с помощью рекрутмента иммунной системы для борьбы с этими опухолевыми клетками исследована на многих моделях. Среди многих связанных с иммунной системой компонентов, которые изучены на их способность бороться со злокачественными опухолями, тимозиновая фракция 5 (TF5), тимозин 1 (тималфазин), интерферон- (IFN-) и интерлейкин-2 (IL-2). Кармустин (бисхлорэтилнитрозомочевина, BCNU или BiCNU) является химиотерапевтическим агентом из семейства хлорэтилнитрозомочевин, которое включает и другие химиотерапевтические агенты, такие как хлорозотоцин (DCNU) (Anderson, 1975), ломустин (CCNU) (Carter, 1968), нимустин (Saijo,1980) и ранимустин (Sekido, 1979). Хлорнитрозомочевины использовали в качестве монотерапии при первичных опухолях мозга в течение многих лет; однако, историческая статистика, по-видимому, не всегда подтверждала эффективность этих соединений в качестве единственного агента при опухолях мозга(например, Aquafedda и др.). Комбинация кармустин плюс радиотерапия давала скромный выигрыш в длительной (18-месячной) выживаемости пациентов, пораженных злокачественной глиобластомой, по сравнению с одной радиотерапией, хотя различие между кривыми выживаемости было незначительным,на уровне 0,05 (Walker, 1980). Тимозин 1 (тималфазин) представляет собой пептид из 28 аминокислот, синтетическую форму природного соединения, которое найдено в системе кровообращения (Bodey, 2000; Bodey, 2001). Тималфазин стимулирует рост и дифференцировку тимоцитов, продукцию IL-2, рецепторов Т-клеточного IL-2,IFN- и INF- (Andreone, 20001; Sztein, 1989; Knutsen, 1999; Spangelo, 2000; Tijerina, 1997; Garbin, 1997;Attia, 1993; Cordero, 1992; Baxevamis, 1994 и 1990; Beuth, 2000). Тималфазин применялся в клинических испытаниях для лечения инфекции, вызванной вирусом гепатита В (L-Y Chan, 2001), гепатита С (H.L.Chan, 2001; Sherman, 1998; Schinazi), карцином легкого или головы и шеи, меланомы (Bodey, 2000 и 2001; Garaci, 2000) и синдрома приобретенного иммунодефицита (AIDS) (Billich, 2002). Многообещающие результаты этих исследований вместе с доказательством пониженной Т-клеточной восприимчивости глиобластом привели к настоящей работе, оценивающей потенциальную терапевтическую выгоду иммунотерапии тималфазином при лечении злокачественных глиом и определяющую механизмы, по которым тималфазин проявляет свое противоопухолевое действие. Краткое содержание изобретения Глиобластомы являются высокозлокачественными новообразованиями центральной нервной системы, которые почти всегда имеют фатальный исход в пределах 12 месяцев от постановки диагноза. Недавние исследования показали, что иммунотерапия с использованием провоспалительных цитокинов,таких как IL-2 или IL-12, может увеличить выживаемость пациентов с глиобластомами. Тимозин 1 (тималфазин) представляет собой пептид тимуса, который действует как иммуномодулятор, увеличивая продукцию IL-2 и Т-клеточную пролиферацию. Настоящая работа демонстрирует значительно сниженную опухолевую нагрузку и усиленный ответ лимфо-мононуклеарных воспалительных клеток у пациентов, леченных комбинацией тималфазин+BCNU, по сравнению со всеми другими группами. Эксперименты in vitro продемонстрировали, что обработка тималфазином не имела прямого влияния на жизнеспособность или митохондриальную функцию в культивированных клетках 9L. Однако обработка тималфазином приводила к значительному повышению уровней экспрессии проапоптотических генов,включая FasL, FasR и TNF-IR (65,89%, 44,08% и 22,18% соответственно). Кроме того, обработка тималфазином делала клетки 9L более чувствительными к окислительному стрессу, так что обычные не летальные дозы перекиси водорода убивали 30-50% клеток 9L, которые были обработаны тималфазином. Дальнейшие исследования обнаружили, что тималфазин усиливает чувствительность клеток 9L к В- (Т-1 005822 клеточному) гранзиму или опосредованной BCNU гибели. Результаты показывают, что тималфазин усиливает опосредованную хлорэтилнитрозомочевиной ликвидацию глиобластомы in vivo и что тималфазин опосредует свои эффекты путем активации проапоптотических механизмов, делая злокачественные клетки более чувствительными к окислительному стрессу и уничтожению с помощью гранзима В (Тклеточного) или химиотерапии. Краткое описание чертежей Фиг. 1 показывает, что тималфазин оказывает минимальное воздействие на жизнеспособность и митохондриальную функцию клеток 9L; фиг. 2 показывает усиленную экспрессию проапоптотических генов в клетках 9L, подвергшихся воздействию тималфазина в течение 72 ч; фиг. 3 показывает, что тималфазин (THY) делает глиобластомные клетки 9L более чувствительными к уничтожению окислительным стрессом или химиотерапией с BCNU; фиг. 4 показывает, что тималфазин делает глиобластомные клетки 9L более чувствительными к опосредованному гранзимом В уничтожению; панель А показывает влияние на клетки, подвергшиеся воздействию наполнителя или тималфазина (24 ч - острое, 72 ч - хроническое), затем разделенные для дополнительной обработки наполнителем в течение 1 ч, и панель (В) показывает влияние на клетки, подвергшиеся воздействию наполнителя или тималфазина (24 ч - острое, 72 ч - хроническое), затем разделенные для дополнительной обработки наполнителем в течение 3 ч; фиг. 5 показывает временной ход развития клинико-нейропатологических аномалий после имплантации 10000 глиобластомных клеток 9L в правую лобную долю головного мозга взрослых крыс LongEvans; фиг. 6 показывает влияние BCNU и комбинации BCNU+тималфазин (THY) на прогрессирование глиобластомы in vivo; фиг. 7 показывает сниженную глиобластомную нагрузку и 25% излечение у крыс, обработанных комбинацией BCNU+тималфазин (THY). Подробное описание В настоящее время найдено, что тималфазин может потенцировать опосредованное иммунной системой уничтожение клеток глиобластомы, что делает возможным его применение как адъюванта в комбинации с хлорнитрозомочевиной как химиотерапевтического соединения эффективной антиглиобластомной терапии. Изобретение применимо к пептидам тималфазина (ТА 1), включая природный ТА 1, а также синтетический ТА 1 и рекомбинантный Ta1, имеющий аминокислотную последовательность природного ТА 1,аминокислотную последовательность в основном подобную ему или сокращенную форму его и их биологически активные аналоги, имеющие замещенную, укороченную, удлиненную, замененную или подругому модифицированные последовательности, которые обладают биологической активностью, по существу подобной активности ТА 1, например, пептид, являющийся производным ТА 1, имеющий достаточную аминокислотную гомологию с ТА 1, так что он функционирует, по существу, тем же самым образом и в основном с такой же активностью, как ТА 1. Исследования in vivo с использованием экспериментальной модели глиобластомы демонстрировали, что в то время как обработка с BCNU должна значительно снижать опухолевую нагрузку, ответы были неоднородными, во многих случаях не дающими детектируемых реакций. Однако обработка комбинацией тималфазин+BCNU обеспечивала значительный терапевтический выигрыш как в отношении снижения средней опухолевой нагрузки, так и излечения опухолей приблизительно в 25% случаев. Опосредованные комбинацией тималфазин+BCNU снижения опухолевой нагрузки были ассоциированы с увеличением лимфо-мононуклеарных клеточных инфильтратов внутри и вокруг злокачественных клеток в мозге. В случаях, когда не было найдено остаточной опухоли, были определены только ткань глиотического рубца и слабое воспаление, ассоциированные с начальными клеточными инфильтратами. Излечение глиобластомы наблюдали приблизительно у 25% групп, обработанных низкими дозами и высокими дозами комбинации тималфазин+BCNU. Довольно неожиданная находка состояла в том, что группы, получавшие только тималфазин, питались так же, как контрольная, или хуже. Часто мозги обработанных тималфазином крыс были более опухшими и выходящими за пределы области из-за воспаления и отека, соединившегося с растущей массой опухоли. В этом отношении примечателен тот факт, что крысы, обработанные более низкой концентрацией комбинации тимaлфaзинBCNU, имели лучшие показатели, чем те, которые были обработаны более высокой концентрацией тималфазинВСNU, поскольку гибель опухолевых клеток была одинаковой в двух группах, но отек и образование грыжи преобладали в группе, которая получала более высокую концентрацию тималфазина. Следовательно, обработка одним тималфазином не уничтожала глиобластомы и, возможно, была повреждающей благодаря избыточному опуханию в отсутствие сопутствующей гибели клеток. Результаты далее позволили предположить, что тималфазин имеет слабое или не оказывает прямого цитотоксического воздействия на клетки злокачественных опухолей и что дополнительная гибель опухолевых клеток, наблюдаемая при обработке комбинацией тималфазин+BCNU, была опосредована непрямыми дей-2 005822 ствиями тималфазина. В мозге обработанных тималфазином крыс обнаружение повышенной плотности лимфо-мононуклеарных воспалительных клеток, которые были охарактеризованы как преимущественно Т-клетки и макрофаги, позволило предположить, что тималфазин играет важную роль в рекрутинге эффекторных иммунных клеток в злокачественных опухолях. Была проведена серия экспериментов in vitro, чтобы определить механизм, по которому тималфазин опосредует свои антиглиобластомные воздействия. Начальные исследования определили, что тималфазин не имеет прямого цитотоксического действия на клетки глиобластомы. То же самое было правильно для других типов клеток, включая клетки нейробластомы и постмитотические кортикальные нейроны. Чтобы расширить эти исследования заявители оценивали, воздействует ли неблагоприятно тималфазин на функцию клеток и, возможно, делает их более чувствительными к апоптозу. Чтобы это осуществить,заявители исследовали уровни экспрессии генов, действующих в пользу апоптоза и выживаемости, а также гена роста и хаускипинг гена. Эти исследования обнаружили, что обработка тималфазином в течение 24 или 72 ч приводит к значительному повышению уровня проапоптотических генов в клетках глиобластомы 9L. Подобные результаты были получены для нейробластомных клеток Sy5y. В клетках 293 отмечен тот же феномен, за исключением того, что механизмы, действующие в пользу выживаемости, были ингибированы, и проапоптотические гены не подвергались воздействию. Эти находки предполагают, что хотя тималфазин не имеет прямого цитотоксического действия, он может делать клетки более чувствительными к цитотоксическим агентам путем усиления базальной экспрессии проапоптотических генов или ослабления базальной экспрессии генов выживаемости. Чтобы исследовать эту гипотезу,заявители определили, являются ли обработанные тималфазином клетки более чувствительными к окислительному стрессу или к гибели, опосредованной хлорэтилнитрозомочевиной. Исследования показали,что после обработки тималфазином в течение 24 или 72 ч сублетальные концентрации перекиси водорода или BCNU убивали 25 или 40%, соответственно, клеток 9L. Следовательно, по меньшей мере некоторые из эффектов тималфазина скорее были опосредованы его действием на опухолевые клетки, чем были только результатом иммунной модуляции и рекрутмента Т-клеток и макрофагов. Были установлены иммуномодулирующие свойства тималфазина и родственных молекул. Их главными эффектами являются усиление продукции провоспалительных цитокинов и пролиферации лимфоцитов. Активированные Т-лимфоциты убивают клетки-мишени посредством взаимодействий генов FasLFasR и путем активации системы перфорин-гранзим. Обнаружение повышенной экспрессии FasL/FasR в обработанных тималфазином глиобластомных клетках 9L предполагает, что активированные Т-клетки могли бы эффективно убивать эти клетки-мишени посредством взаимодействий генов FasL-FasR. Однако используя новый анализ in vitro, созданный с применением SLO (агента, способствующего проницаемости) и рекомбинантного гранзима В вместо Т-клеток, заявители продемонстрировали, что обработанные тималфазином глиобластомные клетки 9L быстро погибали, подвергаясь воздействию SLO и гранзима В. Эти находки предполагают, что тималфазин может эффективно способствовать опосредованной иммунной системой гибели глиобластомных клеток несколькими путями: (1) увеличением базальных уровней экспрессии проапоптотических генов, делая клетки более чувствительными к окислительному стрессу и цитотоксическим/химиотерапевтическим агентам; (2) увеличение уровней FasR, который мог бы взаимодействовать с FasL на активированных Т-клетках и привести к ускоренному апоптозу; и (3) рекрутингом активированных Т-клеток и макрофагов и усилением опосредованной перфорином-гранзимом гибели опухолевых клеток-мишеней. Кроме того, результаты четко указывают на то, что обработка тималфазином глиобластом эффективна при использовании в комбинации с хлорэтилнитрозомочевинами, но не в качестве единственного агента. Результаты обеспечивают существенное доказательство того, что тималфазин, введенный в одиночку, может быть вредным из-за усиленного опухания и воспаления при минимальной гибели опухолевых клеток. Следовательно, наиболее подходящей ролью для тималфазина при терапии глиобластом является роль в качестве вспомогательного агента для усиления иммунного ответа хозяина и уничтожения остаточных опухолевых клеток, которые пережили общепринятую химиотерапию. В заключение работа, описанная в контексте, демонстрирует, что тималфазин обладает антиглиобластомным действием, которое опосредуется несколькими путями, включая (1) модуляцию генов проапоптоза/выживаемости, приводящую к повышенной чувствительности опухолевых клеток к окислительному стрессу или цитотоксическим/химиотерапевтическим агентам; (2) активацию опосредованныхFasR-FaL каскадов гибели иммунных клеток; и (3) усиление чувствительности клеток-мишеней к опосредованной перфорином-гранзимом гибели иммунных клеток. Однако терапевтические эффекты тималфазина в отношении его антиглиобластомных свойств были зависимы от сопутствующего введения хлорэтилнитрозомочевин, подчеркивая тем самым, что тималфазин был бы более подходящим в качестве адъювантного иммуномодулятора, а не определенного противоопухолевого агента. Очевидно также, что при комбинировании с другими химиотерапевтическими соединениями тималфазин проявлял бы подобные позитивные эффекты в облегчении уменьшения опухолевой нагрузки, прогрессирования и рецидивов при значительно более высоких скоростях, чем наблюдаемые в настоящее время при общепринятой химиотерапии. Изобретение применимо к нативному (т.е. к природному) тималфазину, а также к синтетическому-3 005822 тималфазину и рекомбинантному тималфазину, имеющему аминокислотную последовательность нативного тимозина, аминокислотным последовательностям в основном подобным ему, или сокращенной его последовательности и их биологически активным аналогам, имеющим замещенные, укороченные, удлиненные, замененные или другим способом модифицированные последовательности, которые обладают биологической активностью, по сути подобной активности тималфазина. Выделение, характеристика и применение тималфазина описано, например, в патентах US 4079127,4353821, 4148788 и 4116951. Количество тималфазина, необходимое для того, чтобы добиться требуемой степени потенцирования химиотерапевтического эффекта BCNU, может быть определено с помощью рутинных экспериментов титрования дозы. Было найдено, что тималфазин безопасен для человека при введении в таких высоких дозах, как 16 мг/кг массы тела/день. Предпочтительная доза тималфазина находится в диапазоне 0,001 мг/кг массы тела/день до 10 мг/кг массы тела/день, доза примерно 0,02 мг/кг массы тела/день является наиболее предпочтительной. Хлорнитрозомочевина может быть введена в дозе примерно 90-250 мг/м с помощью инъекции, перорально, посредством биодеградируемой капсулы или какими-либо другими обычными способами, известными специалистам. Она может быть дана как однократная доза или разделена на ежедневные инъекции, такие как 75-100 мг/м, на два последовательных дня. Последующее дозирование от начальной дозы должно быть скорректировано в соответствии с гематологическим ответом пациента на предыдущую дозу. Анализ крови должен регистрироваться еженедельно, и повторные курсы не должны даваться ранее 6 недель из-за того, что гематологическая токсичность является отсроченной и кумулятивной. Предпочтительной хлорэтилнитрозомочевиной является та, которая может быть введена в дозе 150-200 мг/м внутривенно каждые 6 недель. BCNU может быть также введена путем имплантации биодеградируемых капсул (например, Gliadel, Guilford Pharmaceuticals) непосредственно в ложе опухоли. Если введение происходит посредством биодеградируемой капсулы, совводимый тималфазин можно удобно объединить с BCNU непосредственно в капсуле. Пример 1. Обработка тимозином 1 линий опухолевых клеток 9L и 293. Линии опухолевых клеток: крысиные клетки глиобластомы 9L и клетки почки человека 293 поддерживали в модифицированной Дюльбекко среде Игла (DMEM) с добавлением 5% эмбриональной телячьей сыворотки (FCS), 2 мМ L-глутамина и 100 мкМ не незаменимых аминокислот (Gibco-BRL, GrandIsland, NY). Все клеточные линии выдерживали при 37 С в увлажненной атмосфере, содержащей 5% СО 2. Клеточные линии были получены от Американской коллекции типов культур и были сертифицированы как свободные от патогенов. Обработка тимозином 1: для острой обработки клетки, высеянные в 96-луночные планшеты при плотности клеток 20000 клеток/лунку, обрабатывали 10-5 М тималфазина в течение 24 ч. Клетки, обработанные хронически тималфазином, выращивали во флаконах и обрабатывали каждые 24 ч с 10-5 М тималфазина (добавленного в свежей среде) на протяжении всей обработки (3 дня). Кроме того, для определения кривой доза-ответ на тималфазин для клеток 9L клетки обрабатывали разбавленными по сериям количествами тималфазина, получая концентрации тималфазина в диапазоне от 50 до 0,022 мкМ. Перекись водорода использовали, чтобы индуцировать в клетках окислительный стресс. Клетки,которые были обработаны тималфазином или наполнителем в течение 24 ч, были подвергнуты действию перекиси водорода с диапазоном концентраций от 9 до 1,8 мкМ и затем оценивались на жизнеспособность и митохондриальную функцию, используя анализы с красителями кристаллический фиолетовый(CV) и тиазолил голубой (МТТ), как описано. В экспериментах, в которых разбавленные по сериям количества тималфазина вводили в клетки, постоянное количество 1,8 мМ перекиси водорода использовали для обработки клеток. Для клеток 9L была построена кривая перекиси водорода для того, чтобы определить точную концентрацию перекиси водорода, которой обрабатывать клетки. МТТ-анализы проводили на клетках линий 9L и 293, чтобы определить влияние обработки тималфазином и индуцированного перекисью водорода окислительного стресса на митохондриальную функцию клеток. После обработки прибавляли 10 мкл МТТ в каждую лунку, содержащую 100 мкл среды. Планшеты инкубировали с красителем МТТ в термостате на 37 С в течение 15 мин-1 ч в зависимости от типа клеток. Затем среду удаляли и в каждую лунку прибавляли 200 мкл подкисленного изопропанола. Планшеты встряхивали при комнатной температуре до тех пор, пока не проходил лизис, затем считывали при 540 нм на приборе Packard SpectraCount. Кристаллический фиолетовый (CV) также использовали для окрашивания клеток в 96-луночных планшетах. После отделения среды в каждую лунку прибавляли 20 мкл кристаллического фиолетового и встряхивали при комнатной температуре в течение 10 мин. Затем планшеты промывали несколько раз теплой водой и сушили. В каждую лунку прибавляли 100-200 мкл (в зависимости от плотности клеток) ЗФР об./1% додецилсульфат натрия (SDS). Планшеты инкубировали при комнатной температуре на вибраторе до тех пор, пока клетки не были достаточно лизированы. Планшеты считывали при 540 нм, чтобы определить различия в жизнеспособности клеток между различными исследуемыми группами. Микротитрационные иммуноцитохимические иммуноферментные (MICE) анализы (de la Monte,1999) были проведены на клетках 9L и 293. Клетки высевали в 96-луночные планшеты, обрабатывали-4 005822 10-5 М тималфазином в течение 24 ч, фиксировали гистологически в течение ночи перед исследованием,используя MICE-анализ. Фиксированные клетки пропитывали 0,05% сапонином в трис-забуференном физиологическом растворе (TBS) (50 мМ трис, рН 7,5, 0,9% хлористый натрий) блокировали сSuperblock-TBS (Pierce, Rockford, IL) и затем инкубировали в течение ночи при 4 С с первичными антителами к антигену ядра пролиферирующей клетки (PCNA), bcl-2, h21/Wwaf-l, p53, FasL, FasR, TNF-R1 или GAPDH, каждое разбавленное до 0,5-1 мкг/мл в TBS, содержащем твин-20 и 0,5% бычий сывороточный альбумин (TBST-BSA). Иммунореактивность определяли, используя пероксидазу хрена, конъюгированную вторичным антителом (Pierce, Rockford, IL) и растворимый субстрат тетраметилбензидин(ТМВ) (Pierce, Rockford, IL). Реакции останавливали добавлением 1 М серной кислоты и измеряли поглощение при 450 нм на приборе для считывания микропланшетов Spectracount (Packard Instrument Co.,Meriden, CT). Затем плотность клеток измеряли окрашиванием приросших клеток с красителем кумасси голубой и определением поглощения элюированного красителя (de la Monte, 1999). Индекс MICE составил рассчитанное соотношение поглощения ТМВ и кумасси голубого, определенное в той же культуральной лунке. Использовали среднее значениестандартное отклонение (SD) результатов, полученных от 16 повторяющихся культуральных лунок, для межгрупповых статистических сравнений. Первичные эксперименты, в которых клетки 9L были обработаны в течение 24 ч различными концентрациями тималфазина, показали незначительное ослабление функционирования клеточных митохондрий, как видно по МТТ-анализам (фиг. 1). Измеряли митохондриальную функцию, поскольку клеточная гибель может быть опосредована скорее дисфункцией митохондрий, а не апоптозом или некрозом. Исследования демонстрировали подобные уровни жизнеспособности и МТТ-активности в обработанном наполнителем контроле и обработанных тималфазином культурах (фиг. 1), указывая на то, что тималфазин не обладает прямым цитотоксическим действием на клетки глиобластомы 9L, что совпадало с результатами in vivo. Подобные результаты были получены и в отношении других клеточных линий,включая почечные клетки 293 и нервные клетки SH-Sy5y (данные не приведены). Поскольку тималфазин не обладает прямым цитотоксическим действием, были исследованы другие потенциальные механизмы, по которым тималфазин может функционировать, чтобы ингибировать рост глиобластом. В этом отношении исследовали экспрессию генных продуктов, которые активируют или апоптоз, или выживаемость клеток, используя экспрессию гена хаускипинг в качестве контроля. Исследования проводили в 96-луночных планшетах, используя микротитрационный иммуноцитохимический иммуноферментный (MICE) анализ, чтобы генерировать данные от множественных повторяющихся культур. Обработка тималфазином в течение 24 ч привела к значительно повышенным уровням FasR(44,8%), FasL (65,89%) и TNF-R1 (22,18%) относительно обработанных наполнителем контролей (р 0,01; фиг. 2). В противоположность этому, уровни bcl-2 и GAPDH незначительно подвергались воздействию обработки тималфазином. Исследования проводились также с использованием клеток 293, которые демонстрировали значительное снижение уровня bcl-2 (36,67%; р 0,01), но незначительные изменения в уровнях экспрессии FasR, FasL или TNF-R1 (данные не приведены). Таким образом, результаты MICEанализов указывают, что на двух линиях клеток тималфазин действует по различным путям, чтобы повысить чувствительность клеток к клеточной гибели путем апоптоза. Подтверждение способности тималфазина повышать чувствительность клеток 9L и 293 к апоптозу было получено при исследовании индуцированного перекисью водорода окислительного стресса. Как определено по МТТ-анализам, клетки 9L, обработанные тималфазином в течение 24 ч и впоследствии перекисью водорода в течение 24 ч, действительно обнаруживали значительную потерю жизнеспособности по сравнению с клетками 9L, обработанными только перекисью водорода в течение 24 ч (фиг. 3). Клетки 9L, обработанные тималфазином и 270 мкМ перекисью водорода, демонстрировали снижение функционирования митохондрий на 26,6%, как видно по МТТ-анализу, по сравнению с клетками 9L, обработанными только 270 мкМ перекисью водорода (фиг. 3). Подобные результаты были получены при использовании клеток 293 в анализах в качестве мишеней (данные не приведены). Пример 2. Исследования индуцированного гранзимом апоптоза. Исследования с помощью MICE-анализа, описанные выше, демонстрировали индуцированную тималфазином экспрессию TNF-R1, FasL и FasR в клетках 9L глиобластом. Для того чтобы определить дифференциальную чувствительность глиобластомных клеток 9L, обработанных (или нет) тималфазином, к апоптозу, индуцированному цитотоксическими Т-лимфоцитами (CTL), проводили экспериментальные анализы, в которых клетки 9L обрабатывали тималфазином как остро в течение 24 ч, так и хронически в течение 72 ч, после чего они были выращены, пересеяны в 96-луночные черные планшеты (7,510 клеток/75 мкл/ячейку) и подвергнуты действию 20000 единиц/мл стрептолизина О (SLO) плюс 100 нг рекомбинантного гранзима В (реакционный объем 100 мкл) в течение 1 или 3 ч при 37 С. Использовали SLO вместо перфорина, чтобы сделать клетки проницаемыми, а рекомбинантный гранзим В использовали для стандартизации анализа. Контрольные исследования включали параллельные реакции, в которых SLO, гранзим В или оба были исключены. Плотность жизнеспособных клеток измеряли, используя АТФ люминесцентный анализ ATPlite (Packard Instrument Company, Meriden, CT), который имел широкий линейный динамический диапазон, коррелирующий относительные световые единицы с плотностями клеток между 103 до 106 клеток на культуральную лунку.-5 005822 Злокачественные опухолевые клетки уничтожаются in vivo цитотоксическими Т-клетками и макрофагами, которые обновляются с помощью провоспалительных цитокинов, таких как IL-2 и IL-12. Цитотоксические Т-клетки уничтожают опухолевые клетки путем высвобождения перфорина, который вызывает образование отверстий в мембранах клеток-мишеней, и гранзима В, который вызывает энзиматическую деструкцию и гибель клеток-мишеней. Для изучения потенциальной роли тималфазина в усилении опосредованного Т-клетками уничтожения глиобластомных клеток 9L, использовали анализ in vitro, в котором обработанные тималфазином или наполнителем клетки 9L инкубировали с гранзимом В в присутствии или в отсутствие стрептолизина О (агента, способствующего проницаемости) в течение 1 или 3 ч. Жизнеспособность измеряли, используя АТФ люминесцентный анализ, и внутри группы проводили сравнения, чтобы определить относительную гибель, ассоциированную с обработкой SLO+гранзим В. Исследования демонстрировали значительные снижения жизнеспособности клеток в обработанных тималфазином культурах, которые были подвергнуты воздействию SLO+гранзим В, относительно обработанных тималфазином культур, подвергнутых воздействию SLO, гранзима В или наполнителя в отдельности (р 0,001; фиг. 4 А и 4 В). Кроме того, опосредованная гранзимом В гибель прогрессировала во времени, как доказано существенно более высокими уровнями потерь клеток, наблюдаемых в анализах,проведенных после трехчасовой по сравнению с часовой инкубацией с SLO+гранзим В (фиг. 4 А и 4 В). В противоположность этому, обработанные наполнителем контрольные культуры обладали подобными уровнями жизнеспособности при воздействии SLO, гранзима В, наполнителя или SLO+гранзим В. В этих исследованиях острое (24 ч) воздействие тималфазина ассоциировалось со значительно более высокими степенями опосредованной гранзимом B+SLO клеточной гибелью, по сравнению с культурами, инкубированными с тималфазином в течение 72 ч (хроническое воздействие) перед анализами (фиг. 4). Пример 3. Влияние тималфазина на жизнеспособность клеток первичных культур нервных клеток. Исследовали первичные культуры кортикальных нейронов, чтобы облегчить отбор доз тималфазина, которые не были бы токсичны для нормальных клеток мозга. Жизнеспособность клеток и митохондриальную функцию измеряли, используя анализы с кристаллическим фиолетовым (CV) и МТТ, поскольку предыдущие анализы показали, что поглощение CV и МТТ возрастает линейно с увеличением плотности клеток от 1104 до 5105 клеток на лунку (de la Monte, 2001 и 2000). Первичные клетки кортикальных нейронов, обработанные в 96-луночных планшетах серийными разбавлениями тималфазина (конечные концентрации находились в диапазоне от 3,310-5 до 1-10-9 М), не обнаруживали снижения жизнеспособности клеток в использованных экспериментальных условиях. Самая высокая использованная концентрация тималфазина (3,310-7 М) оказала 30% снижение жизнеспособности, как видно из МТТ-анализа. Однако эта доза выше, чем установленные экспериментальная и клиническая дозы. Пример 4. Адъювантная обработка тималфазином in vivo крысиной глиобластомы. Клетки глиобластомы крысы 9L получали от Американской коллекции типов культур (Washington,DC) и сертифицировали как не содержащие патогенов. Клетки поддерживали в модифицированной Дюльбекко среде Игла (DMEM) с добавлением 5% эмбриональной телячьей сыворотки (FCS) и 2 мМ глутамина. Антибиотики не добавляли в среду. Перед инъекцией клетки промывали забуференным фосфатом физиологическим раствором (ЗФР), отслаивали от поверхности культур и разъединяли в одноклеточные суспензии с 0,25% трипсином/0,05% этилендиаминтетрауксусной кислотой (EDTA). Разделенные клетки промывали 3 раза бессывороточной средой DMEM и, наконец, суспендировали в бессывороточной среде DMEM при плотности 5106 жизнеспособных клеток/мл. Плотность жизнеспособных клеток определяли, используя вытеснение трипанового голубого и гемоцитометрическую камеру. Эксперименты проводили, чтобы определить, мог ли тималфазин, доставляемый в отдельности или в комбинации с BCNU, значительно снижать глиобластомную нагрузку по сравнению с обработкой бисхлорэтилнитрозомочевиной (BCNU). Модель глиобластомы in vivo генерировали у взрослых крыс линииLong Evans (250-300 г). Крысам давали наркоз с помощью однократной внутрибрюшинной инъекции коктейля, содержащего 100 мг/кг кетамина и 100 мг/кг ксилазина в 50% этаноле. После анестезии голову обривали и подготавливали с повидонйодидом, и крысу помещали в стереотактическую рамку для головы. Делали разрез по средней линии, трепанационное отверстие 3 мм было просверлено над фронтальной долей, и 2 мкл суспензии клеток глиомы 9L (общее число клеток 10000) инъецировали непосредственно в мозг, используя шприц Hamilton, соединенный с иглой 26 размера, помещаемой на глубину 3,5 мм. После удаления иглы рану промывали стерильным физиологическим раствором, животное освобождали от рамки, и кожу скрепляли рассасывающимися швами. Крыс возвращали в их клетки и наблюдали за появлением любых признаков ухудшения, включая потерю массы, уменьшенное потребление корма и воды,гемипарез, эпилептические припадки или пассивность. При любых наблюдаемых мучениях животных подвергали эвтаназии с помощью 120 мг/кг пентобарбитала натрия. Животных наблюдали ежедневно и взвешивали еженедельно. Эмпирически инъекция 10000 клеток 9L убивала 100% животных в течение 26 дней имплантации. Опухоли давали развиваться в течение 5 дней с последующей противоопухолевой обработкой. Крыс делили на шесть групп обработки: контроль с наполнителем; низкая доза (45 мкг/кг) тималфазина;(ip) инъекции на день 6 после интрацеребральной инокуляции опухоли. Крысы, обработанные тималфазином, получали однократные внутрибрюшинные инъекции тималфазина в течение 3 последовательных дней, начиная с дня 6 после инокуляции опухолевых клеток. Крыс забивали на день 20 после инокуляции опухоли. Крыс убивали с помощью внутрибрюшинной инъекции 120 мг/кг пентобарбитала натрия. Мозги собирали, готовили гистологические секции, фиксировали погружением в Histochoice (Amresco Co.,Solon, Ohio) и обрабатывали для заливки парафином. Опухолевую нагрузку оценивали по крупным блокам опухоли и гистологическим секциям, окрашенным гематоксилином и эозином. Гистологические секции использовали также в исследованиях с иммуногистохимическим окрашиванием, чтобы детектировать воспалительные клеточные инфильтраты. Модель глиобластомы: интрацеребральная инокуляция взрослых крыс Long Evans с 10000 клеток крысиной глиобластомы 9L воспроизводимо давала опухоли, которые прогрессивно увеличивались и вызывали гибель в пределах 21 дня. Зависимое от времени прогрессирование опухолевого роста и ассоциированные клинические симптомы были охарактеризованы следующим образом: (1) повышенная физическая активность при диаметрах опухоли 4-5 мм в день 7; (2) гиперреактивность в день 14 при диаметрах опухоли 7-8 мм и часто встречающаяся ассоциированная внутриопухолевая геморрагия; и (3) полубессознательное состояние при опухолевых массах 10-12 мм, сопровождающаяся образованием церебральной грыжи на день 21 (фиг. 5). Гистологические секции, окрашенные гематоксилином и эозином,подтвердили наличие больших опухолевых масс, состоящих из инфильтративных злокачественных опухолевых клеток. Гистопатологические исследования корональных секций по всему мозгу демонстрировали, что в пределах 5 дней инокуляции клеток 9L опухолевые клетки образовали небольшие опухолевые массы, которые были локализованы в поверхностном корковом слое и перекрывающей мягкой и паутинной оболочке. В пределах 14 дней опухолевые массы распространяются на более глубокие структуры, включая базальные ганглии и стенки бокового желудочка, и ассоциированы с умеренным отеком,но не образованием грыжи (сдвигом структур средней линии). На день 21 опухолевые массы захватывают почти целиком правую лобную долю с переменными степенями распространения в противоположное полушарие (фиг. 3). Обширная опухолевая масса была ассоциирована с выраженным церебральным отеком, геморрагией и образованием грыжи. Полуколичественная гистологическая градуированная шкала была использована, чтобы оценить опухолевую нагрузку для межгрупповых сравнений: 0 - излечение, нет остаточной опухоли; 1 - микроскопическая опухоль (1 мм), ограниченная поверхностным корковым слоем; 2 - опухолевая масса, занимающая менее чем 25% поперечной секции полушария (1-2 мм); 3 - опухолевая масса, занимающая до 50% поперечной секции полушария (2-3 мм) и распространяющаяся в глубокие структуры; 4 - массивная опухолевая нагрузка с включением 50-90% поперечной секции полушария, с образованием грыжи. Секции были закодированы и сортировались одновременно двумя разными специалистами без знания группы обработки. Для подтверждения совместимости при сортировке все образцы были перемешаны и вновь пересмотрены под кодом. Воздействия тималфазина и BCNU на рост глиобластомы (фиг. 6) Поскольку в предварительных исследованиях спонтанные отторжения опухолей не наблюдались,все эксперименты заканчивались на день 20 после имплантации клеток глиобластомы 9L. Крысы, обработанные наполнителем, обладали таким же зависимым от времени прогрессированием опухолевого роста и клиническими симптомами, которые наблюдались у необработанных животных. Крысы, обработанные BCNU, обладали значительным снижением опухолевой массы относительно обработанных наполнителем контролей. Однако отклики были неоднородными при почти половине группы, не проявляющей очевидный терапевтический ответ. У остающихся животных опухолевые нагрузки снижались до 50%. У крыс, обработанных только тималфазином, наблюдался рост опухоли и темпы клинического ухудшения, которые были подобны таковым в контроле. Кроме того, обработанные тималфазином крысы имели предельное интрацеребральное опухание и существенно более высокую степень образования грыжи (ткань мозга, выступающая через трепанационное отверстие) по сравнению со всеми другими группами, включая контроли. В противоположность этому, группа, получавшая тималфазин+BCNU, обладала самой низкой нагрузкой объемистой опухоли с явным доказательством опухолевой регрессии. Используя стандартизованную квалификационную схему для оценки опухолевой нагрузки, заявители демонстрировали, что обработка одной BCNU значительно снижала опухолевую нагрузку относительно обработки наполнителем или тималфазином (низкой или высокой дозой) (р 0,001) и что крысы, обработанные или низкой (45 мкг/кг), или высокой (200 мкг/кг) дозой тималфазина+BCNU, имели самые низкие средние опухолевые нагрузки (фиг. 6). Дальнейшие исследования подтверждали добавленное клиническое и патологическое улучшение со сниженными опухолевыми нагрузками плюс 25% частота излечения в группе, обработанной тималфазином+BCNU (р 0,001; фиг. 7). Гистопатологический анализ также демонстрировал присутствие лимфо-мононуклеарных воспалительных клеток, примыкающих к опухолевому очагу или находящихся в его пределах. В мозге обработанных наполнителем или обработанных BCNU крыс инфильтраты были слабыми и в основном распре-7 005822 деленными в околососудистом пространстве. У крыс, обработанных тималфазином с BCNU или без нее,воспалительные клеточные инфильтраты были заметны и ассоциированы с опухолевыми массами, а также с прилегающей паренхимой и покрывающей мягкой и паутинной оболочкой. Исследования иммуногистохимического окрашивания идентифицировали клетки как Т-лимфоциты и макрофаги. Крысы, обработанные высокой дозой тималфазина с BCNU или без нее, имели более сильное церебральное опухание,чем крысы, обработанные низкой дозой тималфазина. Исследования гистопатологического и иммуногистохимического окрашивания подтвердили наличие более обширного отека и воспаления, ассоциированного с опухолевыми массами в группе, получавшей высокую дозу тималфазина. Ссылкиsurgery, NEJM, 303, 1980, cc. 1323-1329. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ терапии глиобластомы, включающий введение хлорэтилнитрозомочевины в комбинации с пептидом тимозина-1 (ТА 1). 2. Способ по п.1, где хлорэтилнитрозомочевина означает BCNU. 3. Способ по п.2, где BCNU вводят в дозе 150-200 мг/м 2. 4. Способ по п.1, где пептид (ТА 1) означает тимозин-1 и вводится в дозе от 0,001 до 10 мг/кг массы тела/день. 5. Способ по п.4, где тимозин-1 вводится в дозе 0,02 мг/кг массы тела/день.
МПК / Метки
МПК: A61K 38/00
Метки: тимозином, alpha;-1, терапия, глиобластомы
Код ссылки
<a href="https://eas.patents.su/12-5822-terapiya-glioblastomy-timozinom-alpha-1.html" rel="bookmark" title="База патентов Евразийского Союза">Терапия глиобластомы тимозином -α-1</a>
Предыдущий патент: Иммуномодулирующие пептиды, полученные из белков теплового шока, и их применение
Следующий патент: Способ лечения с использованием конъюгатов лиганд-иммуноген
Случайный патент: Стентовое устройство на основе хинолиновых и хиноксалиновых соединений в качестве ингибиторов pdgf-рецептора и/или тирозинкиназы lck