Применение лептина для ингибирования пролиферации эндотелиальных клеток
Формула / Реферат
1. Применение лептина, или гомолога лептина, или его производного вместе с ингибитором действия ФРЭС, или синтеза ФРЭС, и/или ингибитором ангиогенеза для получения лекарственного средства, ингибирующего пролиферацию эндотелиальных клеток.
2. Применение по п.1, включающее ингибитор ангиогенеза.
3. Применение по любому одному из предшествующих пунктов, отличающееся тем, что ингибитор ФРЭС выбирают из ДМПК, антагониста А2-7-(бета-гидроксиэтил)теофиллина, 8-фенилтеофиллина, антагониста А2 рецептора аденозина - ХСК, теобромина, варианта антагониста ФРЭС - sFLT-1, траниласта, 8-(3-оксо-4,5,6-тригидрокси-3h-ксантен-9-ил)-1-нафтойной кислоты, сурамина и тромбоцитарного фактора-4.
4. Фармацевтическая композиция для ингибирования пролиферации эндотелиальных клеток, включающая лептин, или гомолог лептина, или его производное, необязательно вместе с ингибитором действия ФРЭС, или синтеза ФРЭС, и/или ингибитором ангиогенеза.
5. Способ ингибирования пролиферации эндотелиальных клеток для ингибирования ангиогенеза у млекопитающих, включающий введение субъекту фармацевтической композиции по п.4 в подходящей дозированной форме и с использованием соответствующего режима введения.
6. Смесь для применения в ингибировании ангиогенеза, включающая лептин и ингибитор ФРЭС.
Текст
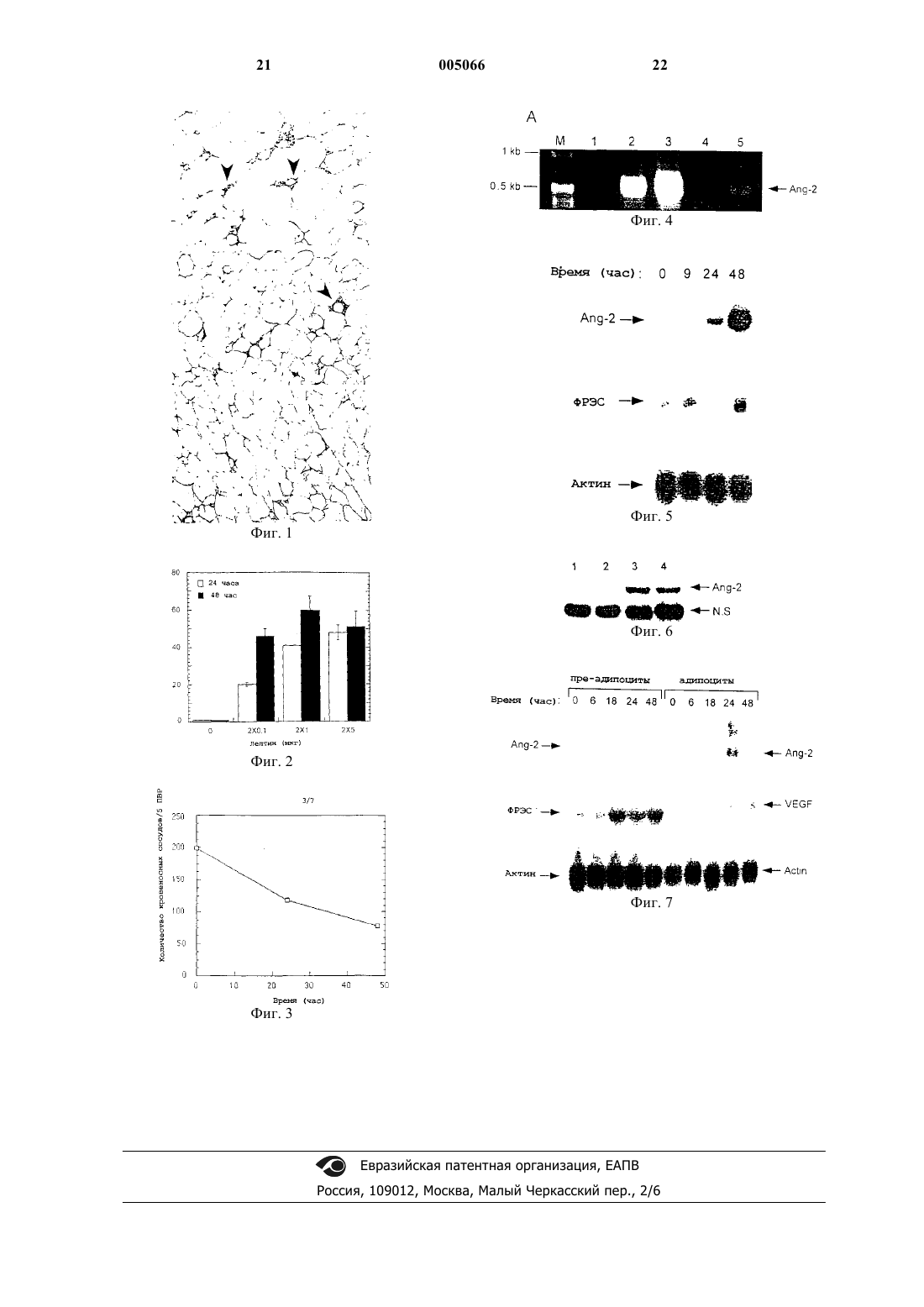
1 Область техники, к которой относится изобретение Настоящее изобретение относится к ингибированию пролиферации эндотелиальных клеток и к модуляции ангиогенеза женской репродуктивной системы. Более конкретно, настоящее изобретение относится к использованию лептина, или гомологов, или производных лептина, необязательно вместе с ингибиторами действия ФРЭС (фактор роста эндотелиальных сосудов) или ингибиторами синтеза ФРЭС, для получения лекарственного средства, применяемого для ингибирования ангиогенеза или для модуляции ангиогенных процессов. Настоящее изобретение также относится к применению лептина или гомологов или производных лептина, вместе с ингибиторами действия ФРЭС или ингибиторами синтеза ФРЭС, при получении лекарственного средства, применяемого для модуляции ангиогенеза в женской репродуктивной системе. Предпосылки создания изобретения В контексте настоящего описания термин"ангиогенез" означает образование новых кровеносных сосудов в ткани или органе. В нормальных физиологических условиях ангиогенез у людей или животных происходит только в очень специфических ограниченных ситуациях. Так, например, ангиогенез обычно наблюдается при заживлении ран, фетальном и эмбриональном развитии, образовании желтого тела, в эндометрии и плаценте и при росте жировой ткани. Термин "эндотелий" обозначает тонкий слой эпителиальных клеток, которые выстилают лимфатическое пространство, лимфатические сосуды и кровеносные сосуды. Считается, что и контролируемый, и неконтролируемый ангиогенез осуществляется сходным образом. Эндотелиальные клетки и перициты, окруженные базальной мембраной, образуют капилляры. Агиогенез начинается с эрозии базальной мембраны,осуществляемой ферментами, высвобождаемыми эндотелиальными клетками и лейкоцитами. Эндотелиальные клетки, которые выстилают просвет кровеносных сосудов, проникают затем через базальную мембрану. Стимуляторы ангиогенеза индуцируют миграцию эндотелиальных клеток через эродированную базальную мембрану. Мигрирующие клетки образуют "отросток" от родительского кровеносного сосуда,в котором эндотелиальные клетки подвергаются митозу и пролиферируют. Эндотелиальные отростки сливаются друг с другом с образованием капиллярных петель, образующих новый кровеносный сосуд. Постоянный, нерегулируемый ангиогенез имеет место при множестве различных болезненных состояний, при метастазировании опухоли и при аномальном росте эндотелиальных клеток и поддерживает патологическое поражение, обладаемое при таких состояниях. Различные патологические болезненные состояния, 005066 2 при которых имеет место нерегулируемый ангиогенез, объединяют в общие группы заболеваний, зависимых от ангиогенеза или ассоциированных с ангиогенезом. Впервые гипотеза о том, что опухолевый рост зависит от ангиогенеза, была предложена в 1971 году (Folkman L.,Tumor angiogenesis: Therapeutic implication. N.Engl. J. Med. 285:1182-1186, 1971). В своем наиболее упрощенном виде она звучит следующим образом: "Как только появляется опухоль, каждому повышению популяции опухолевых клеток должно предшествовать увеличение числа новых капилляров, сопровождающих опухоль". Появление опухоли в настоящее время понимают, как указание на наличие предсосудистой фазы роста опухоли, при которой популяция опухолевых клеток, занимающая объем в несколько кубический миллиметров и не превышающая несколько миллионов клеток, может выживать на существующих реципиенте сосудах. Расширение объема опухоли за переделы указанной фазы требует индукции образования новый капилляров. Так, например, микрометастазирование в легких на ранней предсосудистой фазе у мышей не обнаруживается иначе,как на гистологических срезах при высокой разрешающей способности микроскопа. Сосудистый морфогенез регулируется индуцируемым гипоксией фактором роста эндотелиальных сосудов (ФРЭС) и его рецепторами в эндотелиальных клетках Flk 1 и Flt 1. Были также идентифицированы два других ангиогенных фактора, ангиопоэтин-1 и 2 (Ang1 и Ang2), которые связываются с общим рецептором эндотелиальных клеток (Tie 2), (S. Davis, et al., Cell 87, 1161-1169, 1996; Р.С. Maisonpierre, et al.,Science 277, 55-60, 1997). Ang1 представляет собой агонист рецептора (С. Suri, et al., Science 282, 468-471, 1998), который конститутивно экспрессируется во многих тканях, тогда какAng2 представляет собой антагонист рецептора,экспрессия которого лимитируется сайтами ремоделирования сосудов. Таким образом, Ang2 был идентифицирован в фетальных тканях, в эндотелиальных клетках, в гладкомышечных клетках и в органах женской репродуктивной системы у взрослых мышей и у людей (Р.С.Yancopoulos, J.M. Isner, J. Biol. Chem. 273,18514-18521, 1998; S.J. Mandriota, M.S. Pepper,Circ. Res. 83, 852-859, 1998). И ФРЭС, и Ang2 подвергаются положительной регуляции в органах женской репродуктивной системы при сосудистом морфогенезе, тогда как только Ang2 экспрессируется при регрессии кровеносных сосудов. По всей видимости, Ang2 отмечает те сосуды, которые подлежат регрессии посредством апоптоза, хотя индукция апоптоза с помощью Ang2 в культивируемых эндотелиальных клетках не была показана (В. Witzenbichler, P.С.Hanahan, Science 277, 48-50, 1997). Специфическое антитело против ФРЭС снижает плотность микрососудов и вызывает"значительное или резкое" ингибирование роста трех опухолей человека, которые зависят от ФРЭС как от единственного медиатора ангиогенеза (у голых мышей). Антитело не ингибирует рост опухолевых клеток тела in vitro (Kim К.J. et(AGM-1470) ингибирует рост опухоли и метастазов in vivo, но он менее активен в ингибировании пролиферации опухолевых клеток in vitro. Он ингибирует пролиферацию эндотелиальных клеток сосудов на половинном уровне от максимума, в концентрации на 4 логарифма меньшей,чем ингибирует пролиферацию опухолевых клеток (Ingber D., et al., Angioinhibins: Syntheticand suppress tumor growth. Nature, 48:555-557,1990). Имеется также косвенное клиническое доказательство того, что опухолевый рост зависит от ангиогенеза. Микроциркуляция в жировой ткани представляет уникальное явление в сосудистой системе в связи со способностью указанной системы расти в течение большей части жизни во взрослом состоянии (D.L. Crandall, G.J. Hausman, J.G.Kral, Microcirculation 4, 211-232, 1997). И, в действительности, коричневые и белые жировые ткани обладают распространенной сетью микрососудов и экспрессируют высокие уровни ФРЭС (K.P. Claffey, W.O. Wilkinson, В.М.Spiegelman, J. Biol. Chem. 267, 16317-16322,1992; Q.X. Zhang, et al., J. Surg. Res. 67, 147-154,1997). Таким образом, очевидно, что ангиогенез играет важную роль в росте и поддержании жировой ткани. Если указанная ангиогенная активность может быть подавлена или устранена,то жировая ткань будет регрессировать. Тучность, определяемая как избыток жира тела в сравнении с массой тела худого индивидуума, связана с важными психологическими и медицинскими заболеваниями, причем последние включают гипертензию, повышенный уровень липидов в крови и инсулиннезависимый сахарный диабет (ИНЗСД) или диабет типа II. В США насчитывается 6-10 миллионов человек с диагнозом ИНЗСД, включая 18% населения в возрасте 65 лет (Hanis et al., Ira. J. Obes., 11:275283, 1987). Примерно 45% мужчин и 70% женщин с ИНЗСД являются тучными, и диабет у них в значительной мере корректируется или устраняется при снижении веса (Harris, DiabetesY. Zhang et al., 372, 425-431, 1994, предположил, что одной из молекул, играющей ключевую роль в регуляции энергетического баланса, 005066Zhang с соавторами также сообщили о клонировании и секвенировании лептина мыши и человека. Описание патента Соединенного Королевства 2292382 относится, в том числе, к полипептидам, ob-полипептидам или их аллельным вариантам или аналогам и к их использованию для модуляции веса тела. В частности, в GB 2292382 раскрывается, что лептины и некоторые их аналоги, такие как агонисты, могут быть полезны для лечения ожирения. И, в действительности, было показано, что полученный из адипоцитов лептин регулирует потребление пищи у грызунов посредством его действия на рецепторы гипоталамуса. Более поздние исследования показали, что у тучных субъектов повышен уровень лептина в сыворотке крови и что имеется прямая корреляция между содержанием лептина в сыворотке крови и индексом массы тела (вес в кг, поделенный на квадрат роста в м). Расхождение между действием лептина как ингибитора потребления пищи и высоким уровнем лептина у тучных индивидуумов привело к созданию теории "лептиновой резистентности",где указанный термин указывает предположительно на то, что тучные индивидуумы не реагируют на высокий уровень лептина и поддерживают свою высокую массу тела. Таким образом, очевидно, что лептин сам по себе неэффективен в плане снижения массы жировой тканиCell Biol. 30, 1285-1290, 1998). В связи с вышесказанным, существует потребность в разработке композиции и способа,позволяющих ингибировать нежелательный рост кровеносных сосудов, особенно в опухолях и в жировой ткани. Композиция должна также быть способна модулировать образование капилляров при других ангиогенных процессах,таких как заживление ран и репродукция. Композиция и способ, применяемые для ингибирования ангиогенеза, должны быть предпочтительно нетоксичными и характеризоваться незначительными побочными эффектами. Если ангиогенная активность может быть подавлена или устранена, то опухоль, хотя и будет присутствовать, но не будет расти, а также будет регрессировать жировая ткань. В болезненном состоянии предупреждение ангиогенеза могло бы позволить избежать повреждения, вызываемого инвазией новой микрососудистой системы. Терапия, направленная на контроль ангиогенных процессов, могла бы привести к толерантности организма или к смягчению указанных заболеваний. Мыши, не содержащие лептин, характеризуются бесплодием в связи с тем, что лептин необходим для высвобождения гонадотропинрилизинг гормона (Г-РГ) из гипоталамуса. Г-РГ действует на гипофиз и необходим для высвобождения гонадотропинов ФСГ и ЛГ. И, фактически, инъекция лептина лептин-дефицитным 5 мышам устраняет их стерильность. Женщины с очень низкой массой жировой ткани, как лица с атлетическим сложением или пациенты с нервной анорексией, характеризуются бесплодием в связи с недостаточным уровнем лептина, продуцируемого жировой тканью. Одной из характеристик эстрального цикла является ангиогенез в яичниках, который происходит при созревании фолликулов в яичнике. Разрушение фолликулов и образование желтого тела связаны с обширной регрессией кровеносных сосудов. Было показано, что указанные ткани экспрессируют ФРЭС и Аng 2. Терапия,направленная на контроль ангиогенных процессов в женской репродуктивной системе, может регулировать фертильность. Краткое описание сущности изобретения Настоящее изобретение относится к применению лептина, гомолога лептина или его производного, необязательно в сочетании с ингибитором действия ФРЭС или синтеза ФРЭС,для получения лекарственного средства, ингибирующего пролиферацию эндотелиальных клеток. Одним объектом настоящего изобретения является применение лептина, гомолога лептина или его производного для получения лекарственного средства, предназначенного для модуляции ангиогенных процессов. Более конкретно, рассматривается применение при ингибировании ангиогенеза. Другой объект настоящего изобретения относится к применению лептина, гомолога лептина или его производного вместе с ингибитором действия ФРЭС или синтеза ФРЭС для получения лекарственного средства для регуляции фертильности у млекопитающих. В соответствии с настоящим изобретением может использоваться любой известный фармацевтически приемлемый ингибитор ФРЭС. Настоящее изобретение также относится к фармацевтическим композициям, модулирующим ангиогенные процессы, или вес тела, или фертильность, включающим лептин, гомолог лептина или производное лептина, необязательно вместе с ингибитором действия ФРЭС или синтеза ФРЭС. Предпочтительно композицию используют при заболеваниях, опосредованных ангиогенезом. Краткое описание чертежей На фиг. 1 показаны индуцированная лептином регрессия кровеносных сосудов и апоптоз жировой ткани у мышей C57BL-ob-/-. Мышам C57BL-ob-/- инъецируют мышиный лептин(2 х 1 мкг/г) в момент времени 0 и 9 ч. Через 24 и 48 ч отбирают жировую ткань из брюшной полости. В срезах тканей визуализируют кровеносные сосуды при иммунном окрашивании антителами к фактору VIII (DAKO A/S, Denmark). Отмечается, что количество окрашенных кровеносных сосудов снижается через 24 и 48 ч после инъекции. 6 На фиг. 2 показана кривая доза-ответ регрессии кровеносных сосудов в жировой ткани у мышей оb-/- через 24 и 48 ч после инъекции лептина. На фиг. 3 показана регрессия с течением времени числа кровеносных сосудов в жировой ткани мышей ob-/- после инъекции мышиного лептина (2 х 1 мкг/г). На фиг. 4 показанa опосредованная лептином индукция ангиопоэтина-2 (Аng 2), выявленная при анализе с помощью реакции обратной транскрипции-ПЦР РНК в жировых тканях. Полоса 1 - контроль (нет РНК); полоса 2 - РНК из жировой ткани нормальных мышей C57BL; полоса 3 - РНК из жировой ткани мышейC57BL, которым инъецировали лептин (2 х 5 мкг/г); полоса 4 - РНК из жировой ткани мышейC57BL-ob-/-; полоса 5 - РНК из жировой ткани мышей C57BL-ob-/-, которым инъецировали лептин (2 х 5 мкг/г). ПЦР реакции завершают до наступления насыщения. ПЦР праймеры Аng 2,номер хранения в GeneBank No.AF004326, соответствуют положениям 637-657 (смысловое направление) и 1167-1147 (обратное направление). На фиг. 5 показана индукция с течением времени Аng2 лептином в жировые ткани у мышей ob-/-. Лептин (2 х 5 мкг/г) вводят мышамC57BL-ob-/-', общую РНК из жировой ткани экстрагируют в указанное время и анализируют методом блоттинга РНК с зондами к мышиномуAng2, ФРЭС и актину. На фиг. 6 показана зависимая от дозы индукция Ang2 в жировой ткани мышей ob-/-. Лептин вводят мышам C57BL-ob-/- и через 48 ч экстрагируют белки жировой ткани. Аng2 анализируют методом иммуноблоттинга (50 мкг белка/полосу) со специфической антисывороткой(Santa Cruz Biotechnology, Santa Cruz, CA). Неспецифическую полосу (N.S.) используют для нормализации иммуноблоттов. На фиг. 7 показана индукция Ang2 лептином в культивируемых адипоцитах. Культуры недифференцированных предадипоцитов мышей 3T3-F442A и дифференцированных адипоцитов индуцируют лептином (1 мкг/мл). В разные временные точки экстрагируют суммарную РНК и подвергают РНК-блоттингу с зондами к мышиному Ang2, ФРЭС и актину. Фиксируют индукцию Ang2 в адипоцитах через 24 ч и снижение уровня ФРЭС после дифференциации предадипоцитов в зрелые адипоциты. Подробное описание В последнее время появилось сообщение о том, что лептин действует как ангиогенный фактор. Он индуцирует пролиферацию in vitro эндотелиальных клеток пупочной вены, усиливает образование капилляроподобных трубок invitro и индуцирует реваскуляризацию в роговице мышей и хорионаллантоисной оболочке цыпленка (М.R. Sierra-Honigmann, et al., Science 281, 1683-1686, 1998; A. Bouloumie, Н.С.Drexler, M. Lafontan, R. Busse, Circ. Res. 83, 7 1059-1066, 1998). Несмотря на то, что указанные исследования позволяют предположить, что лептин способен индуцировать ангиогенез в сайте его продуцирования, роль лептина как ангиогенного фактора в жировой ткани и в опухолях все еще недостаточно изучена. В рамках настоящего изобретения было обнаружено, что лептин, необязательно вместе с другими агентами, действует как индуктор регрессии кровеносных сосудов в тканях и опухолях. Лептин действует как мощный индуктор экспрессии ангиостатического фактора ангиопоэтина-2 (Ang2) в различных тканях, включая жировую ткань и опухоли. Ang2 обладает ангиостатическим действием в отсутствие ФРЭС. Таким образом, лептин эффективен в плане модуляции ангиогенеза и ингибирования нежелательного ангиогенеза, особенно ангиогенеза,связанного с ростом опухоли, ростом жировой ткани и с эстральным циклом. Настоящее изобретение включает применение лептина, или гомологов лептина, или производных лептина, не обязательно вместе с одним или более ингибиторами образования ФРЭС или действия ФРЭС (далее: "ингибиторы ФРЭС"), в качестве ингибиторов опухолевого ангиогенеза и модуляторов ангиогенеза в репродуктивных органах женщин. Настоящее изобретение также включает применение лептина, или гомологов лептина,или производных лептина вместе с ингибиторами ФРЭС для индукции регрессии жировой ткани и для модуляции ангиогенеза в женских репродуктивных органах. Введение лептина, или гомологов лептина,или производных лептина либо отдельно, либо в сочетании с ингибиторами ФРЭС человеку или животному с наличием метастазирующих опухолей в состоянии предваскуляризации будет препятствовать росту или расширению указанных опухолей. Введение лептина, или гомологов лептина,или производных лептина в сочетании с ингибиторами ФРЭС или другими ингибиторами ангиогенеза женщинам позволят модулировать ангиогенез в их репродуктивных органах. Заболевания и процессы, которые опосредованы ангиогенезом, включают, но не ограничиваются нижеуказанными, гемангиому, солидные опухоли, опухоли крови, лейкозы,мeтастазы, телангиэктазию, псориаз, склеродерму, пиогенную гранулему, миокардиальный ангиогенез, болезнь Крона, бляшкообразную неоваскуляризацию, образование коронарных коллатералей, церебральных коллатералей, артериовенозные мальформации, ангиогенез при ишемии конечности, заболевания роговицы,покраснение, неоваскулярную глаукому, диабетическую ретинопатию, ретролентальную фиброплазию, артрит, диабетическую неоваскуляризацию, дегенерацию желтого пятна, заживление раны, пептическую язву, болезни, связан 005066 8 ные с инфекцией Helicobacter, переломы, келоиды, васкулогенез, гематопоэз, овуляцию, менструальный цикл, образование плаценты и лихорадку от кошачьих царапин. Введение лептина, или гомологов лептина,или производных лептина вместе с ингибиторами ФРЭС или другими ингибиторами ангиогенеза человеку или животному будет снижать аберрантный ангиогенез, связанный с указанными выше заболеваниями, более эффективно,чем один ингибитор ФРЭС или другие ингибиторы ангиогенеза без лептина. Возможно также модулировать ангиогенный процесс в ходе генной терапии, как будет показано далее в описании. Настоящее изобретение включает способ лечения заболевания, опосредованного ангиогенезом, эффективным количеством лептина, или гомологов лептина, или производных лептина,необязательно вместе с ингибиторами ФРЭС или другими ингибиторами ангиогенеза. Эффективное количество лептина, или гомологов лептина, или производных лептина, необязательно вместе с ингибиторами ФРЭС или другими ингибиторами ангиогенеза, вводят пациентам в виде фармацевтически приемлемой композиции. Следует иметь в виду, что настоящее изобретение включает применение любых гомологов лептина, которые индуцируют активность по ингибированию эндотелиальных клеток. Гомологи лептина относятся к белкам, в которых один или более аминокислотных остатков натурального лептина замещены другими аминокислотными остатками, или они делетированы, или один или более аминокислотных остатков добавлены к натуральной последовательности лептина, без существенного изменения активности полученных продуктов в сравнении с лептином дикого типа. Указанные гомологи получают с помощью известных методов синтеза,и/или путем направленного мутагенеза, или с использованием любых других методик для достижения данной цели. Любой такой гомолог предпочтительно имеет аминокислотную последовательность, в достаточной мере дуплицированную в сравнении с лептином, так чтобы достигалась, по существу, аналогичная лептину активность. Одной такой активностью является способность гомолога лептина снижать вес тела мышейob/ob. Таким образом можно определить, обладает ли данный гомолог, по существу, той же активностью, что и лептин, с помощью рутинных экспериментальных процедур. В предпочтительном варианте реализации изобретения любой такой мутеин характеризуется по меньшей мере 40% идентичностью или гомологией своей последовательности с последовательностью лептина. Более предпочтительно, он характеризуется по меньшей мере 50%,по меньшей мере 60%, по меньшей мере 70%, 9 по меньшей мере 80% или наиболее предпочтительно по меньшей мере 90% идентичностью или гомологией по последовательности. Гомологи полипептидов лептина, которые могут использоваться в соответствии с настоящим изобретением, или нуклеиновая кислота,кодирующая их, включают определенный набор, по существу, соответствующих последовательностей в виде замещенных пептидов или полинуклеотидов, которые могут быть получены рутинным способом любым специалистом со средним уровнем знаний в данной области без дополнительных экспериментов, на основании представленных в описании методов. Для получения подробного описания химии белков и их структуры см. Schulz, G.Е. et al., Principles ofFrancisco, 1983, работы которых включены в описание в качестве ссылки. Для получения информации по замещению нуклеотидных последовательностей, таких как предпочтительные кодоны (см. Ausubel et al., supra, atA.1.A.1.24 и Sambrook et al., supra, в приложениях Сand D). Предпочтительные изменения, введенные в гомологи согласно настоящему изобретению,включают такие изменения, которые известны как "консервативные" замещения. Консервативные замещения аминокислот в полипептидах лептина могут включать синонимичные аминокислоты из группы, которая характеризуется достаточно близкими физико-химическими свойствами, так что замещение с использованием представителей указанной группы позволяет сохранить биологическую функцию молекулы(Grantham, Science, Vol. 185, pp. 862-864 (1974. Очевидно, что вставки и делеции аминокислот могут также быть введены в указанные выше последовательности без изменения их функций,в особенности, если вставки или делеции включают всего несколько аминокислот, например до тридцати, и предпочтительно до десяти, и не удаляют или не замещают аминокислоты, которые являются решающими для функциональной конформации, например цистеиновые остатки(1973. Белки и мутеины, образуемые при введении таких делеций и/или вставок, входят в область настоящего изобретения. Предпочтительно группа синонимичных аминокислот включает те из них, которые приведены в табл. 1. Более предпочтительно группа синонимичных аминокислот включает те из них, которые приведены в табл. 2; и наиболее предпочтительно группа синонимичных аминокислот включает те из них, которые определены в табл. 3. 10 Таблица 1 Предпочтительные группы синонимичных аминокислот Аминокислота Синонимичная группаTrp Таблица 2 Более предпочтительные группы синонимичных аминокислот Аминокислота Синонимичная группаTrp Таблица 3 Наиболее предпочтительные группы синонимичных аминокислот Аминокислота Синонимичная группа Примеры получения аминокислотных замещений в белках, которые могут использоваться для получения гомологов полипептидов или белков лептина, с целью применения в настоящем изобретении, включают любые стадии методов, приведенных в патентах США RE 33 653,4 959 314, 4 588 585 и 4 737 462 (Mark et al.); 5 116 943 (Koths et al.), 4 965 195 (Namen et al.),4 879 111 (Chong et al.), 5017691 (Lee et al.) и патент США 4 904 584 (Shaw et al.), который относится к белкам с замещенным лизином. В другом предпочтительном варианте реализации настоящего изобретения любой гомолог лептина имеет аминокислотную последовательность, по существу, соответствующую таковой лептина. Термин "по существу, соответствующий" охватывает белки с небольшими изменениями в последовательности натурального белка, которые не влияют на базовые характеристики белков, в частности на их способность индуцировать ангиостатическую активность. Тип изменений, которые, в основном,рассматриваются как охватываемые термином"по существу, соответствующие", представляeт собой такие изменения, которые возникают в результате проведения традиционной процедуры мутагенеза ДНК, кодирующей указанные белки, приводящей к появлению нескольких минорных модификаций, и способ скрининга желательной активности обсуждался выше. Следует понимать, что настоящее изобретение включает рассмотрение применения любого производного лептина, которое индуцирует ингибирующую активность эндотелия в случае его нанесения, необязательно с ингибитором ФРЭС или другими ингибиторами ангиогенеза. Настоящее изобретение включает применение полного белка лептина, применение производных белка лептина и использование биологически активных фрагментов белка лептина. Производные лептина согласно настоящему изобретению содержат один или более химических фрагментов, присоединенных к нему, включая водорастворимые полимеры, такие как полиэтиленгликоль. Полученные из полиэтиленгликоля 12 производные могут быть моно-, ди-, три- или тетрапегилированными, например монопегилированными на N-конце. Предпочтительны монопегилированные на N-конце производные лептина, необязательно содержащие (пегилированный) метионин на N-конце. Были описаны различные ингибиторы активности ФРЭС или образования ФРЭС, и они могут использоваться в сочетании с лептином для повышения степени ингибирования ангиогенеза. В число указанных ингибиторов входят 3,7-диметил-1-пропаргилксантин (ДМПК) в качестве А 2-антагониста,7-(бетагидроксиэтил)теофиллин, 8-фенилтеофиллин,антагонист А 2-рецептора аденозина ХСК (8-(3 хлорстирил)кофеин), теобромин, антагонист варианта ФРЭС - растворимый рецептор ФРЭСGrengrinovitch et al., J. Biol. Chem. 270, 1505915065, 1995). Различные ингибиторы ангиогенеза описаны в литературе, и они могут применяться в сочетании с лептином для более эффективного ингибирования ангиогенеза, чем в случае их использования отдельно. В число указанных ингибиторов входят K1-5 (Cao, R. et al., Proc.(Bergers G. et al., Science 284, 808-812, 1999). В рамки настоящего изобретения включается также использование векторов экспрессии,кодирующих лептин или гомологи лептина,вводимые в рамках генной терапии, необязательно вместе с ингибиторами действия или образования ФРЭС или с другими ингибиторами ангиогенеза, для ингибирования ангиогенеза в опухолях. Такие лекарственные средства могут применяться в методах лечения, включающих внутривенную, внутриартериальную, внутрибрюшинную, внутримышечную, подкожную,назальную, пероральную или легочную системы доставки. Настоящее изобретение включает также использование векторов экспрессии, кодирующих лептин или гомологи лептина, вводимые в рамках генной терапии, в сочетании с ингибиторами действия или образования ФРЭС или с другими ингибиторами ангиогенеза, применяе 13 мыми для регрессии жировой ткани. Такая терапия может быть полезна при лечении заболевания, выбранного из группы, состоящей из диабета, высокого давления крови и высокого уровня холестерина, как часть комбинированной терапии, включающей использование лекарственного средства для лечения таких расстройств. Указанные лекарственные средства могут использоваться в методах терапии, включающих внутривенную, внутриартериальную,внутрибрюшинную, внутримышечную, подкожную, назальную, пероральную или легочную системы доставки. Опосредованные ангиогенезом заболевания включают, не ограничиваясь приведенным списком, ожирение, солидные опухоли, опухоли крови, такие как лейкозы, метастазы опухолей,доброкачественные опухоли, например гемангиомы, акустические невриномы, нейрофибромы, трахомы и пиогенные гранулемы, ревматоидный артрит, псориаз, глазные ангиогенные заболевания, например диабетическую ретинопатию, синдром Терри, дегенерацию желтого пятна, отторжение трансплантата роговицы,неоваскулярную глаукому, ретролентальную фиброплазию, покраснение, синдром ОслераУэббера, миокардиальный ангиогенез, бляшечную реваскуляризацию, телангиэктазию, гемофилическую артропатию, ангиофиброму и грануляцию раневой поверхности. Лептин, или гомологи лептина, или производные лептина, необязательно в сочетании с ФРЭС и другими ингибиторами или ингибиторами ангиогенеза, полезны при лечении заболеваний, характеризующихся избыточной или аномальной стимуляцией эндотелиальных клеток. Указанные заболевания включают, не ограничиваясь ими, адгезии кишечной ткани, болезнь Крона, артериосклероз, склеродерму и гипертрофические рубцы, например келоиды. Лептин, или гомологи лептина, или производные лептина, необязательно вместе с ингибиторами ФРЭС или другими ингибиторами ангиогенеза, могут использоваться в сочетании с другими композициями и процедурами для лечения заболеваний. Так, например, опухоль может быть подвергнута традиционному лечению хирургическим путем, облучением или химиотерапией в сочетании с лептином, или гомологами лептина, или производными лептина,необязательно вместе с ингибиторами ФРЭС или другими ингибиторами ангиогенеза, и впоследствии лептин, или гомологи лептина, или производные лептина, необязательно вместе с ингибиторами ФРЭС или другими ингибиторами ангиогенеза, могут быть введены пациенту для продления состояния покоя микрометастазов и для стабилизации и ингибирования роста любой остаточной первичной опухоли. Кроме того, лептин, или гомологи лептина,или производные лептина, необязательно вместе с ингибиторами ФРЭС или другими ингиби 005066 14 торами ангиогенеза, могут быть объединены с фармацевтически приемлемыми наполнителями. Композиции, пригодные для парентерального введения, включают водные и неводные стерильные растворы для инъекции, которые могут содержать антиоксиданты, буферы, бактериостатические вещества и растворенные средства,которые делают композицию изотонической относительно крови предполагаемого реципиента; при этом водные и неводные стерильные суспензии могут также включать средства, способствующие суспендированию, и загустители. Композиции могут быть представлены в виде стандартной разовой дозы или в виде контейнеров с множественной дозой, например в виде закрытых ампул и флаконов, и могут храниться в высушенном вымораживанием (лиофилизованном) состоянии, для использования которых требуется непосредственно перед их применением добавить стерильный жидкий носитель,например воду для инъекций. Растворы и суспензии для немедленной инъекции после приготовления могут быть получены из стерильных порошков, гранул и таблеток описанного ранее вида. Композиции могут необязательно включать матрицу с пролонгированным высвобождением, такую как биоразлагаемые полимеры,для создания терапевтических композиций. Матрица с пролонгированным высвобождением в контексте настоящего описания представляет собой матрицу, приготовленную из материалов,обычно полимеров, которые способны разлагаться путем ферментативного кислотного/основного гидролиза или при растворении. При введении в организм матрица подвергается действию ферментов и жидкостей тела. Матрицу с пролонгированным высвобождением желательно выбирать из биологически совместимых материалов, таких как липосомы, полилактиды(полимолочная кислота), полигликолид (полимер гликолевой кислоты), сополимеры полилактида и гликолида (сополимеры молочной кислоты и гликолевой кислоты), полиангидриды, поли(орто)эфиры, полипептиды, гиалуроновая кислота, коллаген, хондроитинсульфат, карбоновые кислоты, жирные кислоты, фосфолипиды,полисахариды, нуклеиновые кислоты, полиаминокислоты, аминокислоты, такие как фенилаланин, тирозин, изолейцин, полинуклеотиды и поливинилпирролидон. Предпочтительно биоразлагаемая матрица представляет собой матрицу одного из приведенных вариантов: полилактид, полигликолид или сополимер полилактидгликолида (сополимеры молочной кислоты и гликолевой кислоты). Желательно, чтобы полимеры имплантировались в непосредственной близости от места доставки лекарственного вещества, например в жировой ткани или в месте опухоли, или имплантировались так, чтобы лептин или производные лептина, необязательно вместе с ингибиторами 15 ФРЭС или другими ингибиторами ангиогенеза,медленно высвобождались с оказанием системного действия. Биоразлагаемые полимеры и их применение подробно описаны, например, в работе Брема с соавт. (Brem et al., J. Neurosurg. 74:441-446 (1991, которая полностью включена в настоящее описание в качестве ссылки. Фармацевтические композиции, модулирующие ангиогенез, согласно настоящему изобретению могут находиться в твердой, жидкой или аэрозольной форме и могут вводиться любым известным способом. Примеры твердых терапевтических композиций включают пилюли, кремы и имплантируемые стандартные дозированные формы. Пилюли могут вводиться перорально, лечебные кремы могут применяться местно. Имплантируемые стандартные дозы могут вводиться местно, например в месте опухоли, или могут имплантироваться для оказания системного действия при высвобождении лекарственной композиции, модулирующей ангиогенез, например подкожно. Примеры жидких композиций включают композиции, подходящие для инъекций подкожно, внутривенно,внутриартериально, и композиции, пригодные для местного и внутриглазного введения. Примеры аэрозольных композиций включают композиции для ингаляции, вводимые в легкие. Следует понимать, что дополнительно к ингредиентам, указанным выше, композиции согласно настоящему изобретению могут включать другие средства, традиционно используемые в данной области техники при изготовлении рассматриваемых типов композиций. Могут быть необязательно включены цитотоксические средства или другие средства в сочетании с лептином, или гомологами лептина, или производными лептина, необязательно вместе с ингибиторами ФРЭС или другими ингибиторами ангиогенеза, для обеспечения двойного терапевтического эффекта у пациента. Композиции согласно настоящему изобретению могут вводиться с использованием стандартных способов. В целом, сочетания могут вводиться с помощью местного (включая трансбуккальный и сублингвальный) или парентерального (включая подкожный, внутрибрюшинный, внутримышечный, внутривенный, внутрикожный, внутримозговой, интрацеребровентрикулярный, внутричерепной, интраспинальный,внутритрахеальный и эпидуральный), чрескожного, внутривагинального, внутриматочного,перорального, ректального, глазного (включая интравитреальный и интракамеральный) или интраназального способов введения. Могут также использоваться осмотические мининасосы для обеспечения контролируемой доставки высоких концентраций лептина или производных лептина, необязательно вместе с ингибиторами ФРЭС или другими ингибиторами ангиогенеза, через канюлю к нужному месту,например непосредственно к месту метастати 005066 16 ческого роста или в образующуюся сосудистую сеть указанной опухоли. Дозировка лептина или производных лептина, необязательно вместе с ингибиторами ФРЭС или другими ингибиторами ангиогенеза,согласно настоящему изобретению зависит от природы заболевания или болезненного состояния, которое предстоит лечить, и других клинических факторов, таких как вес и тяжесть состояния человека или животного и способ введения соединения. Для лечения людей или животных может вводиться от примерно 0,5 до 10 мг/кг лептина, или гомолога лептина, или производного лептина, необязательно вместе с приемлемой дозой ингибитора ФРЭС, или ингибитора образования ФРЭС, или других ингибиторов ангиогенеза. В зависимости от полупериода существования лептина, или гомолога лептина,или производного лептина в организме конкретного животного или человека лептин, или гомолог лептина, или производное лептина может вводиться от нескольких раз в день до 1 раза в неделю. Предпочтительные стандартные дозированные формы композиции представляют собой такие, которые содержат вводимый ингредиент в виде дневной дозы или стандартной единицы, суточной субдозы или ее соответствующей фракции. Способы настоящего изобретения охватывают как однократное, так и многократное введения, осуществляемые либо одновременно, либо через некоторый период времени. Композиции с лептином, или гомологом лептина, или производным лептина могут быть представлены в виде стандартных дозированных форм и могут быть приготовлены с использованием традиционных фармацевтических методик. Такие методики включают стадию приведения в контакт активного ингредиента и фармацевтического(их) носителя(ей) или наполнителя(ей). В целом, композиции изготавливаются посредством создания равномерного и тесного контакта между активным ингредиентом и жидкими носителями, или тонкоизмельченными твердыми носителями, или ими обоими и затем, при необходимости, придания формы продукту. Предпочтительные стандартные дозированные формы композиции представляют собой такие, которые содержат вводимый ингредиент в виде суточной дозы или стандартной единицы,суточной субдозы или ее соответствующей фракции. Следует понимать, что в дополнение к ингредиентам, указанным выше, композиции согласно настоящему изобретению могут включать другие средства, традиционно используемые в данной области техники при получении композиций указанного типа. Следует понимать, что настоящее изобретение рассчитано на применение как на людях,так и в ветеринарии. Ниже настоящее изобретение иллюстрируется приведенными примерами, которые не сле 17 дует трактовать как ограничивающие область настоящего изобретения. Напротив, следует четко понимать, что настоящее изобретение относится к различным другим вариантам реализации, модификациям и эквивалентам, которые могут возникнуть у специалистов в данной области после ознакомления с настоящим описанием, без отхода от концепции настоящего изобретения и/или тематики, указанной в прилагаемой формуле изобретения. Примеры Пример 1. Индукция регрессии кровеносных сосудов лептином. Для исследования влияния лептина на гомеостаз кровеносных сосудов в жировой ткани взрослых животных самкам мышей линии(0,1-5 мкг/г) в момент времени 0 и 9 ч. Заметная потеря веса отмечается к 48 ч у мышей, получавших 2 х 1 мкг/г лептина (65,40,5 г в сравнении с 62,71,0 г; n=6). Жир из брюшной полости удаляют и фиксируют через 24 и 48 ч после первой инъекции и проводят подсчет кровеносных сосудов после окрашивания заключенных в парафин срезов с антителами к фактору VIII(1982. Наблюдается значительное снижение числа кровеносных сосудов (1981 сосудов на 5 полей с высоким разрешением (ПВР, х 400) у контрольных мышей; 15912,5 сосудов на 5 ПВР у мышей после лечения лептином (2 х 1 мкг/г) после 24 ч и 1067,5 сосудов на 5 ПВР после 48 ч). На фиг. 1 показаны микрофотографии кровеносных сосудов в срезах жировой ткани. На фиг. 2 показана кривая зависимой от дозы регрессии кровеносных сосудов, и на фиг. 3 показано развитие указанной регрессии с течением времени. Пример 2. Лептин индуцирует ангиопоэтин 2 (Ang2) в жировой ткани. Был изучен механизм, посредством которого лептин индуцирует регрессию кровеносных сосудов в жировой ткани, путем измерения его эффекта на уровень экспрессии ангиогенного и ангиостатического факторов. Выделяют суммарную РНК из жировой ткани мышей линий C57BL и C57BL-ob-/- в момент времени 0 и через 24 ч после первого введения лептина. Суммарную РНК выделяют с помощью реагентаTRI. Обратную транскрипцию проводят в объеме 20 мкл с использованием обратной транскриптазы РНК-азы Н- (Superscript II, GIBCOBRL) с 1 мкг (N)6-случайного праймера (NewEngland Biolabs) в соответствии с инструкцией производителя. Аликвоту (2 мкл) продукта обратной транскрипции используют для ПЦР с ДНК-полимеразой VENT (New England Biolabs) и с использованием следующих смысловых и антисмысловых праймеров: мРНК muAng2, номер хранения в GeneBank No. AF4326, нуклео 005066GeneBank No.J00691, нуклеотиды 1670-1691 и 2452-2431. ПЦР реакции останавливают перед насыщением. Было обнаружено, что мРНК Ang2 экспрессируется в жировой ткани нормальных мышей и не экспрессируется у мышей ob-/-. Кроме того, инъекция лептина индуцирует экспрессию Ang2 у обоих типов мышей (фиг. 4). Приведенные результаты показывают, что лептин является мощным индуктором ангиостатического фактора Ang2. Уровень и индукция мРНК Ang2 лептином в жировой ткани мышей ob-/- исследовали затем методом РНК-блоттинга с помощью специфических зондов к Ang2 и ФРЭС. Выделяют суммарную РНК из жировой ткани с помощью набора TRI реагентов (Molecular Research CenterInc.). Образцы РНК (15 мкг) разрешают электрофорезом в 1% агарозном геле в MOPSформальдегидном буфере, переносят на нейлоновую мембрану (Hybond N, Amersham) в буфере 20xSSC, после чего мембрану нагревают в течение 2 ч при температуре 80 С в вакуумной печи. Затем проводят предварительную гибридизацию мембраны (6 ч, 42 С) с денатурированной ДНК спермы лосося (100 мкг/мл в 50% формамиде, 5xSSC, 4 храствор Денхарда и 0,5% ДСН). Затем добавляют зонд, содержащий[32 Р]дЦТФ ДНК (1 х 106 расп./мл), полученный при случайном премировании, и продолжают гибридизацию в течение 18 ч при 42 С. Затем мембрану промывают при комнатной температуре (1xSSC, 0,1% ДСН - дважды; 0,25xSSC,0,1% ДСН и 01xSSC, 0,1% ДСН - дважды; по 30 мин каждая промывка) и проводят ауторадиографию. Затем проводят повторную гибридизацию блотов с использованием 32 Р-меченых проб, соответствующих актину мышей, с целью демонстрации эквивалентных количеств РНК в блоте. После введения лептина отмечается значительная индукция Ang2 (2,90,4 раза, Р 0,05,n=3 через 24 ч и 16,00,31 раза, Р 0,01, n=3 через 48 ч; фиг. 5). Кинетика экспрессии Аng2 соответствует кинетике апоптоза и регрессии кровеносных сосудов. Отмечается лишь незначительная индукция уровня мРНК ФРЭС(1,40,1 раза, n=3 через 48 ч; фиг. 5). Зависимость индукции Аng2 лептином в жировой ткани от дозы изучали методом иммуноблоттинга через 48 ч после первой инъекции лептина. Выделяют клеточные экстракты из жировой ткани с помощью набора TRI реагентов (Molecular Research Center Inc.) параллельно проведению экстракции суммарной РНК. Наносят на 10% ДСН-полиакриламидный гель 50 мкг белка. Иммуноблот-анализ проводят с использованием 5 мкг специфических козлиных антител к человеческому Ang2. Уровень Аng2 был ниже предела определения в жировой ткани контрольных мышей ob-/-, тогда как введение 19 2 х 1 мкг/г лептина было достаточно для высокого уровня индукции Ang2 (фиг. 6). Пример 3. Лептин индуцирует ангиопоэтин 2 (Ang2) в культивируемых адипоцитах. Ранее сообщалось о некоторых видах периферической активности лептина (M.R. SierraHonigmann, et al., Science 281, 1683-1686, 1998;Busse, Circ. Res. 83, 1059-1066, 1998; B. Cohen,D. Novick, M. Rubinstein, Science 274, 1185-1188,1996; D. Barkan, et al., Endocrinology 140, 17311738, 1999). Для исследования того, может ли лептин действовать непосредственно на адипоциты, авторы исследовали эффект лептина на мышиные предадипоциты 3 Т 3-F442A, которые известны тем, что приводят к образованию жироподобной ткани при имплантировании их бестимусным мышам (Н. Green, O. Kehinde, J.Cell Physiol. 101, 169-171, 1979; S. Mandrup,T.M. Loftus, O.A. MacDougald, F.P. Kuhajda,M.D. Lane, Proc. Natl. Acad. Sci. USA 94, 43004305, 1997). Мышиные предадипоциты Swiss 3T3-F442A (Н. Green, О. Kehinde, Cell 5, 19-27,1975) выращивают в среде DMEM (GIBCO) с 10% сыворотки теленка. Для дифференцировки слившиеся клетки поддерживают на средеDMEM с добавкой 10% фетальной сыворотки теленка (ФСТ) в течение 6 дней. Среду заменяют каждые 48 ч. К концу указанного периода большинство клеток приобретает характерную для адипоцитов морфологию, что определяется биохимическими и морфологическими критериями. Лептин (1 мкг/мл) добавляют к культурам дифференцированных и недифференцированных клеток. РНК выделяют из клеток культуры, как описано для случая с жировой тканью в примере 2, и подвергают РНК-блоттингу. Показано, что лептин индуцирует экспрессию мРНК Ang2 в дифференцированных адипоцитах 3T3-F442A и не индуцирует ее в предадипоцитах. По всей видимости, мРНК Ang2 провляется к 24 ч. мРНК ФРЭС конститутивно экспрессируется в предадипоцитах и далее индуцируется лептином. Уровень мРНК ФРЭС был заметно ниже в зрелых адипоцитах и незначительно индуцировался добавлением лептина (фиг. 7). Полученные результаты позволяют предположить,что лептин индуцирует ангиостатический сигнал в зрелых адипоцитах и ангиогенные сигналы в предадипоцитах. Пример 4. Влияние лептина плюс ингибитора ФРЭС на снижение жировой массы. Ангиостатическая активность индуцированного лептином Ang2 меняет направление на противоположное в присутствии ФРЭС. Кроме того, в предыдущих примерах отмечалась умеренная индукция ФРЭС лептином. В этой связи,самкам мышей линии C57BL-ob-/- 8-10 недельного возраста в состоянии ожирения и лишенным эндогенного лептина проводят в/б 20 инъекцию мышиного лептина (0,1-5 мкг/г) в момент времени 0 и 9 ч. Параллельно 8-10 недельным самкам мышей линии C57BL-ob-/- в состоянии ожирения инъецируют в/б в момент времени 0 и 9 ч мышиный лептин (0,1-5 мкг/г) совместно с антагонистом А 2 рецептора аденозина ХСК, который известен как ингибитор ФРЭС (H. Takagi, G.L. King, G.S. Robinson, N.Ferrara, L.P. Aiello, Invest. Ophthalmol. Vis. Sci. 37, 2165-2176, 1996). К 48 ч отмечается заметное снижение веса у мышей, получивших 2 х 1 мкг/г одного лептина (65,40,5 г по сравнению с 62,71,0 г, n=6). Значительно большая потеря веса отмечается у мышей, которым вводили сочетание лептина и ХСК. Следует понимать, что приведенное выше описание относится только к предпочтительным вариантам реализации изобретения и что возможны различные и многочисленные модификации и изменения без отхода от концепции и тематики настоящего изобретения, которые определены в прилагаемой формуле изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение лептина, или гомолога лептина, или его производного вместе с ингибитором действия ФРЭС, или синтеза ФРЭС, и/или ингибитором ангиогенеза для получения лекарственного средства, ингибирующего пролиферацию эндотелиальных клеток. 2. Применение по п.1, включающее ингибитор ангиогенеза. 3. Применение по любому одному из предшествующих пунктов, отличающееся тем,что ингибитор ФРЭС выбирают из ДМПК, антагониста А 2-7-(бета-гидроксиэтил)теофиллина,8-фенилтеофиллина, антагониста А 2 рецептора аденозина - ХСК, теобромина, варианта антагониста ФРЭС - sFLT-1, траниласта, 8-(3-оксо-4,5,6 тригидрокси-3h-ксантен-9-ил)-1-нафтойной кислоты, сурамина и тромбоцитарного фактора-4. 4. Фармацевтическая композиция для ингибирования пролиферации эндотелиальных клеток, включающая лептин, или гомолог лептина, или его производное, необязательно вместе с ингибитором действия ФРЭС, или синтеза ФРЭС, и/или ингибитором ангиогенеза. 5. Способ ингибирования пролиферации эндотелиальных клеток для ингибирования ангиогенеза у млекопитающих, включающий введение субъекту фармацевтической композиции по п.4 в подходящей дозированной форме и с использованием соответствующего режима введения. 6. Смесь для применения в ингибировании ангиогенеза, включающая лептин и ингибитор ФРЭС.
МПК / Метки
МПК: A61K 38/22, A61P 3/00
Метки: пролиферации, применение, клеток, эндотелиальных, лептина, ингибирования
Код ссылки
<a href="https://eas.patents.su/12-5066-primenenie-leptina-dlya-ingibirovaniya-proliferacii-endotelialnyh-kletok.html" rel="bookmark" title="База патентов Евразийского Союза">Применение лептина для ингибирования пролиферации эндотелиальных клеток</a>
Предыдущий патент: Энантиомер 1,2-аннелированного хиназолина, ингибирующий фарнезилтрансферазу
Следующий патент: Фармацевтические растворы левосимендана
Случайный патент: Тележка с составной рамой и узлом привода