Штамм гибридных клеток мыши, продуцирующий моноклональное антитело 14f7 против ганглиозидов ngcgm3, моноклональное антитело 14f7, фармацевтическая композиция и реактив, содержащие указанное антитело
Номер патента: 3318
Опубликовано: 24.04.2003
Авторы: Мулет Сьерра Айлетте, Фернандес Молина Луис Энрике, Карр Перес Адриана, Масорра Херрера Сайма, Перес Родригес Роландо, Васкес Лопес Ана Мария
Формула / Реферат
1. Штамм гибридных клеток мыши 14F7 ECACC 98101901, продуцирующий моноклональное антитело 14F7 против ганглиозидов NGcGM3.
2. Моноклональное антитело 14F7, продуцируемое штаммом гибридных клеток по п.1, специфично распознающее олигосахаридную последовательность N-гликолилированная галактоза-глюкоза-сиаловая кислота в ганглиозиде NGcGM3 и обладающее цитолитической активностью по отношению к опухолевым клеткам, содержащим указанную последовательность.
3. Моноклональное антитело по п.2, отличающееся тем, что его цитолитическая активность в отношении опухолевых клеток, содержащих олигосахаридную последовательность N-гликолилированная галактоза-глюкоза-сиаловая кислота, может быть прямой или опосредованной комплементом.
4. Фармацевтическая композиция, содержащая моноклональное антитело, охарактеризованное в любом из пп.2, 3, и растворитель или наполнитель.
5. Фармацевтическая композиция по п.4, отличающаяся тем, что антитело может быть связано с терапевтическим средством, таким как лекарственный препарат, радиоизотоп, иммуномодулятор, лектин и токсин.
6. Фармацевтическая композиция по любому из пп.4, 5, отличающаяся тем, что используется для лечения злокачественных новообразований.
7. Фармацевтическая композиция по п.6, отличающаяся тем, что злокачественное новообразование представляет собой злокачественную опухоль молочной железы, почки, органов пищеварительной системы или меланому человека.
8. Реактив, содержащий моноклональное антитело, охарактеризованное в любом из пп.2, 3, связанное с такими маркерами, как ферменты, хромофоры, хемилюминесцентные вещества и радионуклиды.
9. Применение реактива, охарактеризованного в п.8, для выявления опухолевых клеток.
10. Применение по п.9, отличающееся тем, что опухолевые клетки представляют собой клетки меланомы человека, молочной железы, почки или органов пищеварительной системы, таких как печень, толстая кишка, желудок и прямая кишка.
Текст
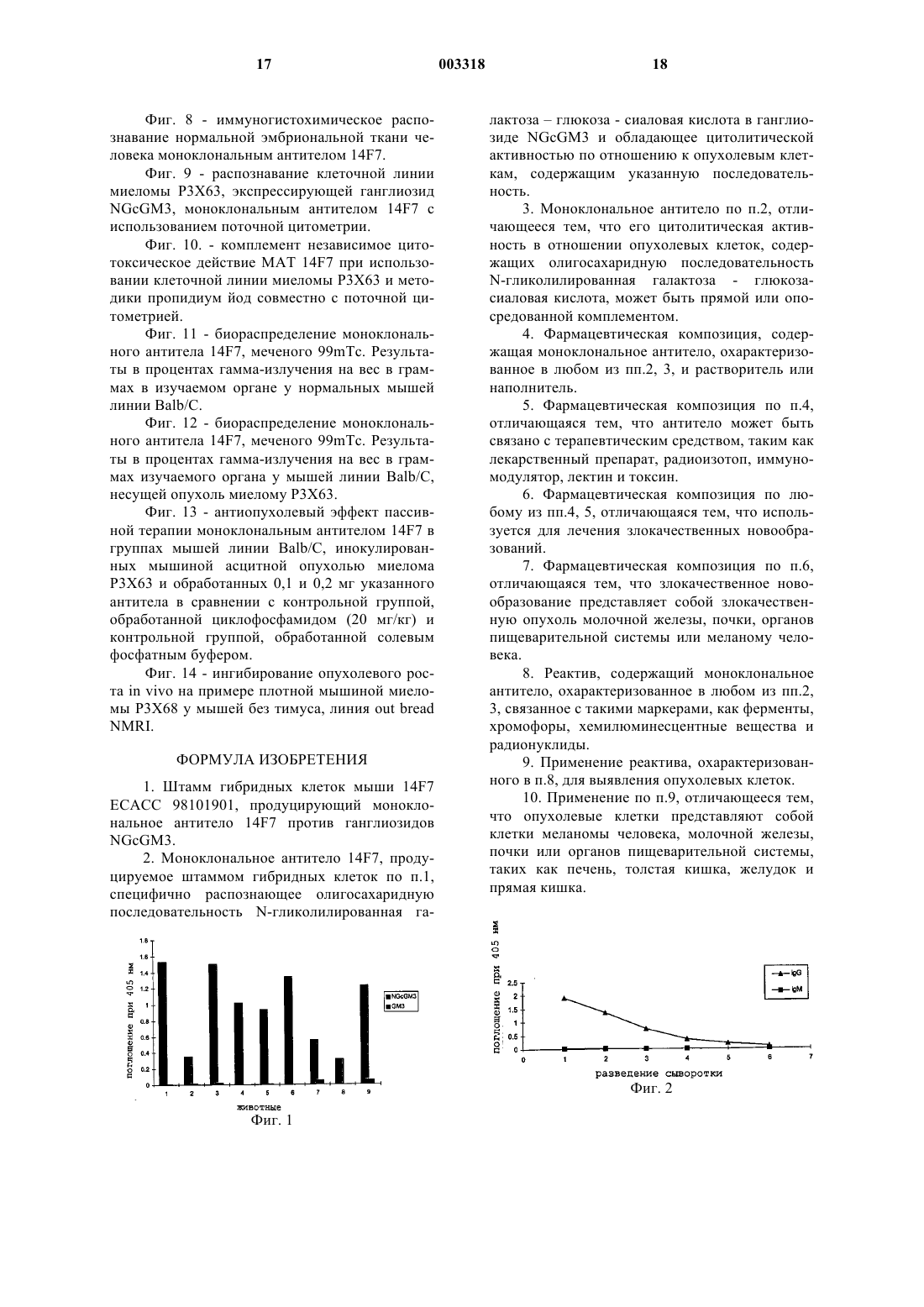
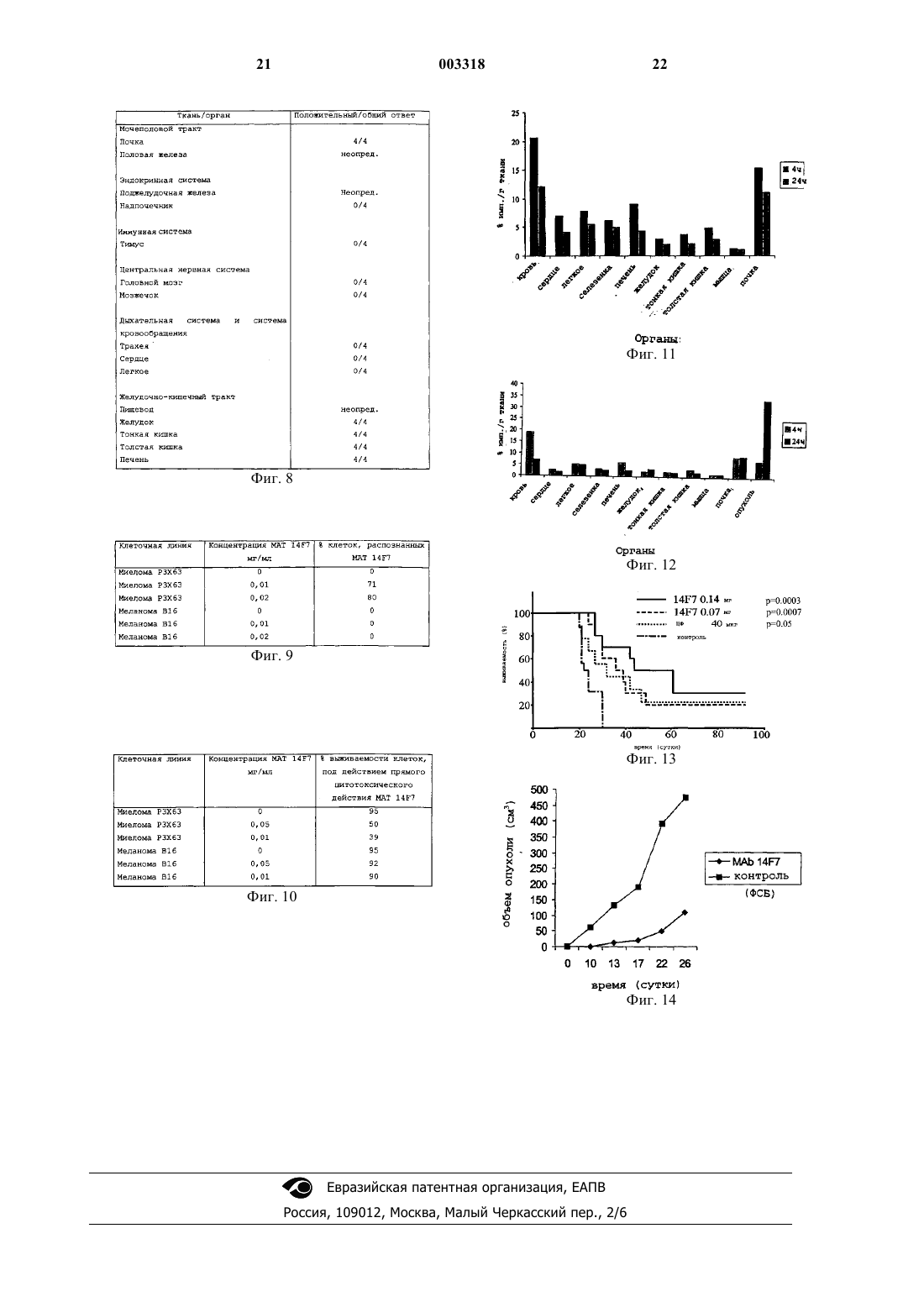
1 Область техники Данное изобретение относится к области иммунологии и медицины человека, особенно в отношении получения и отбора моноклонального антитела (MAT) против олигосахаридной последовательности N-гликолилированная галактоза - глюкоза - сиаловая кислота, которое можно применять для диагностики и лечения определенных опухолевых заболеваний. Уровень техники Олигосахаридные структуры участвуют в образовании гликопротеинов и гликолипидов. Как те, так и другие присутствуют в нормальных и патологических тканях. Приблизительно в 100% случаев злокачественных новообразований описывают аберрантное гликолилирование. Обычные изменения при аберрантном гликолилировании представляют собой, помимо прочего, экспрессию неоантигенов, изменения в составе олигосахаридных последовательностей, увеличение или уменьшение количества молекул сиаловой кислоты в олигосахаридах и увеличение плотности молекул на поверхности клетки (HakomoriS.H. et al.: Curr. Opin. in Immunol. 1991, (3)646653). В дополнение к изменениям, которые можно найти в механизме сиалил-трансфераз,существуют изменения гидроксилаз, зависимые от активированной N-ацетилированной формы сиаловой кислоты. Ганглиозиды являются гликосфинголипидами, которые содержат сиаловую кислоту в своей структуре и характеризуются тем, что присутствуют в большинстве клеток позвоночных. Эти молекулы обнаружены в нормальной ткани и они могут сильнее экспрессироваться в опухолях с отличной организацией и конформацией на поверхности злокачественных клетокMiraldi, F., 1989, Seminars in Nuclear Medicine,XIX, 282-294). За гуморальный иммунный ответ против углеводных антигенов, как правило, отвечают иммуноглобулины, относящиеся к изотипу IgM. Олигосахаридные последовательности, связанные с липидами в большинстве случаев менее иммуногенны, чем гликопротеины. Поэтому применение гликолипидов в качестве иммуногена требует его связывания с белкамипереносчиками или включения в липосомы или в бактерии, такие как Micobacterium tuberculosis или Salmonella minnesota R595. Ответ, индуцируемый против ганглиозидов, является тимуснезависимым. Об этом неоднократно сообщали Livingston et al., (Livingston, P.O. et al., 1982, Proc. Natl, Acad. Sci. USA 84: 2911-2915; Livingston, P.O. et al., 1989, Cancer Res. 49: 7045-7050). Главными особенностями антител, вырабатываемых против ганглиозидов, при исследовании сыворотки различных видов, являются их низкая афинность, значительная перекрестная реактивность и короткий 2 период жизни (Livingston, P.O. 1991, Immunology and Allergy Clinics of North America, 11: 401423, Portoukalian, J. et al., 1991, Int. J. Cancer, 49: 893-899). Экспрессия N-гликолилированной формы олигосахаридов имеет место в нормальных и патологических тканях всех видов позвоночных,за исключением курицы и человека, у которых она обнаружена только в эмбриональной и опухолевой тканях. Нормальные ткани этих двух последних видов содержат толькоNацетилированный вариант (Nishimakit et al.,1979, J. Immunology 122: 2314; Higashi H. et al.,1985, Cancer Res., 45: 3796). Изучение олигосахаридного состава в некоторых опухолях человека показывает присутствие N-гликолилированной формы и в гликолипидах, и в гликопротеинах опухолевых клеток меланомы (Hirabayashi, Y. et al., 1987, J. Canceret al., 1992, J. Dermatol (11): 827-830), также как в опухолях толстой кишки, особенно в гликолипидах (Miyoshi, I., et al., 1986, Mol. Immunol. 23(6): 631; Higashi H., et al., 1985, Cancer Research, 45: 3796-3802). Кроме того, проводили исследования, свидетельствующие о наличии N-гликолилированной формы ганглиозидов в образцах опухоли печени, тератомы, лимфомы и т.д. (Kawai Т. et al., 1991, Cancer Res. (51) 1242-1246). Хотя в первых случаях концентрация Nгликолилированного варианта гликолипидов составляла менее 0,05% от общего содержания сиаловой кислоты, Marquina с сотр. обнаружили в опухолях молочной кислоты приблизительно 10% такой сиаловой кислоты, связанной с липидами (Marquina, G. Et al., 1996, Cancer Res. 56: 5165). Образование моноклональных антител против N-гликолилированного варианта ганглиозидов до сих пор позволяло получать антитела изотипа IgM, которые обычно распознают более одной молекулы ганглиозидов, например,антитела человека 2-39 М и 32-27 М (FurukawaH. et al., 1992, Biochem. Biophys., 2(294) :427). Другие авторы сообщали о получении специфичных антител к N-гликолилированным ганглиозидам, всегда изотипа IgM, среди которых моноклональные антитела Y-2-HD1 противAct., 958, 368) и МК 2-34 против той же молекулы (Miyake, M. et al., 1990, Cancer Res. 48, 6154). Однако, Watarai (Watarai, S. et al., 1995, J.Biochem. 117, 1062) получил моноклональное антитело SHS-1 против i-активных Nгликолилированных ганлиозидов, a Nakumara получил моноклональное антитело YK-3 противBiolog. Chemist., 8 (270):3876). Недавно Vzquez, et al.,(Vzquez, A. M. et al., 1995, Hubridoma, 14, 6, 551) сообщили о получении моноклонального антитела Р 3, которое распознает большинство молекул ганглиозида, содержащихN-гликолилированную форму сиаловой кислоты, также как сульфатированные гликолипиды.Nagai et al. получили моноклональное антитело НМА 1 против ганглиозидов (Nagai Y. etal., патент США 4965198). Они получили специфическое моноклональное антитело против ганглиозида NGcGM2 мыши, страдающей аутоиммунным заболеванием. Хотя они сообщили о нескольких данных антителах, которые дополнительно распознаютYH08, YH09, YH10 и YH11 против ганглиозида 4-O-Acetyl-NGcGM3 также у мышей, страдающих аутоиммунным заболеванием. Моноклональные антитела против ганглиозидов получают, используя данные молекулы как лактоны или используя клеточные линии, содержащие ганглиозиды (патенты США 5308614, 5240833, 5389530 и 5500215). Тем же способом различные моноклональные антитела, мышиные и человеческие, были получены против ганглиозидов GD3, GD2 иGM2 в N-ацетилированной форме, большинство из которых относятся к подклассам IgM и IgG3Immunology, 29, 625-632; Kotani, M. et al. 1992,Biochimica et Biophysica Acta, 1117: 97-103). Пассивную иммунотерапию с применением моноклональных антител против ганглиозидов применяют в клинической практике для лечения некоторых опухолей, таких как меланомы и нейробластомы. В случае меланом введение проводят внутри пораженной области,либо применяют системное лечение всего организма и хотя результаты кажутся обнадеживающими, только у небольшого числа пациентов происходит полная или частичная ремиссияUSA, 82: 1242; Dippold, W.G. et al., 1988, J. Cancer Clin. Oncol; 24: 865; Vadhan-Raj, S. et al.,1988, J. Clin. Oncol., 6: 1636; Saleh M.N. et al.,1992, Cancer Res., 52: 4332-4347). Данные антитела показывают эффект при изучении цитотоксичности, опосредованной комплементом или клетками (RavindramathM.H. et al., 1991, Inter. Rev. Immunol., 7, 303). Все моноклональные антитела, полученные до сих пор против N-гликолилированных ганглиозидов, относятся к изотипу IgM, a ток 003318IgM, как правило, имеют низкую афинность и антиген, и их трудно применять для диагностики или лечения в виде радиоактивно меченых моноклональных антител. Хотя они хорошо фиксируют комплемент и гарантируют адекватную цитотоксичность, широкомасштабное выделение намного сложнее по сравнению с таковым иммуноглобулинов изотипа IgG. Кроме того, в литературе мало данных о моноклональных антителах против N-гликолилированных гликопротеинов, а большинство из них сообщают о диагностических целях.Devine и др. описали моноклональное антитело 3 Е 1.2,которое распознаетNгликолилированную формы белка с молекулярной массой 250 кДа, который присутствует на поверхности цист, образующихся при инфекцииParasitol. (3): 257-266). Описание изобретения Новизна данного изобретения состоит в получении моноклонального антитела, высокоспецифичного к олигосахаридной последовательности N-гликолилированная галактозаглюкоза - сиаловая кислота, присутствующей как в ганглиозиде, так и в гликопротеинах. Кроме того, характеристики получаемого иммуноглобулина изотипа IgG делают его более специфичным и поэтому обладающим большим сродством к молекулам, которые он распознает,улучшая, таким образом, его биологическую активность. Неожиданно данное антитело обнаружило способность вызывать гибель клеток,непосредственно производящих указанную олигосахаридную последовательность. Подробное описание изобретения Получение ганглиозида NGcGM3 Для получения ганглиозида NGcGM3 применяли модификацию методики Hakomori (Hakomori, S. et al., 1974, Methods in Enzymology,32:, Part B, 350) с использованием такого природного источника, как эритроциты лошади. Выход ганглиозида NGcGM3 составлял 180-300 мг/л эритроцитов лошади со степенью очистки выше 90%, подтвержденной высоко эффективной жидкостной хроматографией по методикеGazzotti (Gazzotti, G. et al., 1985, J. of Chromatographу 348: 371-378). Получение иммуногена Чтобы получить иммуноген, ганглиозидNGcGM3 гидрофобно связывали с человеческими липопротеинами очень низкой плотности(Dumontet, С. et аl., 1994, Cancer Immunol Immunother. 38: 311-318). Схема иммунизации Чтобы получить антиганглиозидные моноклональные антитела типа IgG применяли следующий способ иммунизации. Мышей или других млекопитающих иммунизировали вакцинными препаратами, содержащими 0,03 и 0,5 мг ганглиозида NGcGM3, связанного с VLDL, в расчете на дозу, а также адъювант, отобранный из ниже следующих: альбумин, полный или неполный адъювант Фройнда или Montanide ISA 51. Перед и после периода иммунизации брали образцы крови у животных, чтобы получить сыворотку и вести контроль за антителами, появляющимися у животных против ганглиозида,примененного в качестве антигена. С этой целью использовали все известные способы иммуноанализа для определения реакции антигенантитело (Аг - Ат). Животных иммунизировали различными дозами от 2 до 8 с временными интервалами,варьирующимися от 7 до 14 дней. Инъекции осуществляли подкожно или внутримышечно объемами в 0,1 и 0,2 мл. Другими возможными способами иммунизации являются внутривенный и внутрибрюшинный. Животные, получившие этот диапазон доз, показывают специфический ответ на ганглиозид, примененный в качестве иммуногена. Специфический иммунный ответ типа IgG на ганглиозид NGcGM3 имели от 70 до 100% иммунизированных животных. Получение моноклональных антител Для получение специфических MAT против ганглиозида NGcGM3 мышей с антителами против данного ганглиозида снова иммунизировали вакцинным препаратом за 3 дня до того,как получали клетки, продуцирующие антитело. Предпочтительно использовать клетки селезенки, хотя можно использовать и другие клетки. Данные клетки сливают с клетками миеломы, в результате образуются гибридные клетки или гибридомы со способностью неограниченно размножаться in vivo и in vitro. Для этой цели можно использовать любой из известных способов слияния клеток. Для определения антител, образуемых гибридомой, предпочтительно использовать иммуноферментный анализ. Другие методы иммуноанализа также можно использовать. Процедура данного анализа представляет собой распознавание гибридомой ганглиозидов в супернатанте, а реакцию антиген антитело можно выявить, используя вторичное антитело, меченое ферментом, который связывается с антителом, образованным гибридомой в адекватных условиях, определения проводят одновременно. Гибридому, однажды отобранную, клонируют, по крайней мере, два раза, например, ли 003318 6 митирующим разбавлением. Синтезируемое клетками MAT можно продуцировать in vitro в соответствующей культуральной среде, любой,известной существующему уровню техники, и затем выделять из указанного культурального супернатанта. В данном случае от 1 до 8% секретирующих клеток были иммуноспецифичны кN-гликолилированному ганглиозиду GM3. Другой способ производства антител состоит в инъекции гибридом в животные, (например в сингенные животные). Гибридома вызывает образование несолидной опухоли, которая обеспечивает высокую концентрацию нужного антитела в крови и перитонеальном эксудате животного-хозяина. Очистка моноклонального антитела Очистку моноклональных антител осуществляют, используя асцитную жидкость, полученную после инокуляции 0,2 Х 106 клеток МАТ-продуцирующей гибридомы, в брюшную полость мышей линии Balb/C, предварительно обработанных неполным адъювантом Фройнда в качестве асцитогенного вещества. Асцитную жидкость разбавляют вдвое глициновым буфером 1,5 М, NaCl, 3M; рН 8,9 и подвергают афинной хроматографии, где матриксом служит белок А - сефароза, со скоростью элюции 60 мл/ч. Элюцию MAT проводят,используя цитратный буфер 0,14 М; рН 6. Концентрацию очищенных MAT определяют методом Лоури (Lowry, G. Н., 1951, J. Biol.Chem., 193: 256) и используя коэф. поглощения мышиного IgGl при 280 нм. Специфичность подтверждают с помощью теста ИФА. Получали от 2 до 5 мг антител на мл асцитной жидкости с процентом чистоты выше 95%. Это подтверждали жидкостной хроматографией низкого давления. Исследования специфичности Чтобы определить специфичность полученных моноклональных антител, проводят иммуно-ферментное исследование MAT на планшетах ИФА и применяя тонкослойную хроматографию с использованием N-ацетилированных(GM1, GM2, GM3, GM1, GD1a, GD1b, GD3,GT1b) и N-гликолилированных (GM3, GM2,GM1a, GM1b, GD1 с, GD3) ганглиозидов. При анализе гликолипидов с помощью тонкослойной хроматографии высокого давления система растворителя включает хлороформ:метанол:KСl 0,25% и 2,5 М NН 3 (5:4:1)(объем:объем). Для проявления полос используют орсин. Планшеты покрывают раствором полиизобутилметакрилата и высушивают на воздухе при комнатной температуре. Блокировку осуществляют примерно в течение 30 мин 1% раствором бычьего сывороточного альбумина, растворенного в солевом фосфатном буфере (ФСБ), рН 7,4. Затем моноклональные антитела инкубируют в блокирующем растворе. 7 После чего планшеты промывают раствором ФСБ и добавляют пероксидазу, конъюгированную с мышиным антииммуноглобулином на 1 ч. Планшеты снова промывают и добавляют раствор субстрата фермента, до тех пор пока не появятся полосы. В заключение сравнивают полученные химические и иммунохимические данные. В результате IgG распознавал только ганглиозид NGcGM3. Определение цитотоксичности Чтобы определить, вызывают ли полученные антитела смерть клеток непосредственно или каким-то другим цитотоксическим способом 107 клеток/мл мышиной миеломы Р 3 Х 63,содержащей NGcGM3, инкубируют при 4 и 37 С соответственно с моноклональным антителом в концентрации 0,01-1 мг/мл в течение 30 мин. Затем применяют окрашивание Трипаном синим для определения жизнеспособности. Количество мертвых клеток как следствие действия антитела можно определить, используя пропидиум иод или любой другой маркер жизнеспособности. Для изучения цитотоксичности, опосредованной комплементом, использовали суспензию, содержащую 107 клеток /мл; моноклональные антитела добавляют в концентрации от 0,01 до 0,5 мг/мл. Сыворотку кролика, которая содержит высокую концентрацию белков комплемента, добавляют в разбавлениях от 1/20 до 1/2 и инкубацию проводят в течение 1 ч при 37 С. Цитотоксичность, обусловленную комплементом, определяли, подсчитывая живые клетки,как описано выше, или используя метод выделения хрома Сr51, при котором радиоактивномеченые клетки миеломы Р 3 Х 63, когда умирают,выделяют в культуральный супернатант изотоп. Прямую цитотоксичность измеряли, используя различные способы, которые обнаружили величины от 50 до 85% мертвых клеток по отношению к общему числу изученных клеток. Определение биораспределения моноклонального тела Полученные MAT можно использовать как для диагноза, так и для лечения, вводя метку радиоактивного изотопа такого, как 99mTc,Re186 и Re188. Schwarz and SteinstrasserMed. 28: 721) описали способ получения меченых радиоизотопами моноклональных антител,который был модифицирован Mather у Ellison(Mather S.J. and Ellison D., 1990, J. Nucl. Med. 31: 692-697). Контроль за качеством метки осуществляют, используя хроматографию на Ватмане 3 ММ. Процент включения метки составлял 98 и 100%. Чтобы определить возможное применениеMAT, 10 мышей инокулировали опухолью Р 3 Х 63, а других 10 мышей использовали в качестве обычного контроля (никакую опухоль не инокулировали). Ожидали в течение отрезка времени, необходимого для роста опухоли, иMAT 14F7, меченое 99mТс. Через 4 и 24 ч после инъекции проводили контроль за биораспределением MAT против олигосахаридной последовательности в группах из 5 мышей (5 здоровых и 5 с опухолью). Животных забивали, взвешивали главные органы и опухоль, и гамма излучение количественно определяли в конце опыта. У здоровых животных моноклональные антитела распределялись в основном в крови,печени и почках, а у животных с опухольюMAT обнаружили в первых органах и, предпочтительно, в опухоли через 24 ч. Распознавание моноклональными антителами нормальных и эмбриональных тканей Радиоактивные MAT, как описано в разделе, посвященном уровню техники в данной области, можно использовать, чтобы определить опухоль, в которой наблюдается экспрессия олигосахаридной последовательности. Радиоактивность всего тела можно изучать с помощью Гамма Камеры. Картины в развитии получают через 5 мин и через 1, 3, 5, 24 и 48 ч после инъекции MAT. MAT обнаружили только в опухоли и органах выделения.MAT можно также связывать прямо и опосредованно с другими терапевтическими веществами, такими как лекарства, радиоизотопы,иммуномодуляторы, лектины и токсины. Среди иммуномодуляторов биологического ответа,которые каким-либо образом могут усилить разрушение опухоли с помощью MAT данного изобретения, можно назвать лимфокины, такие как фактор некроза опухоли, фактор активатор макрофага, фактор стимуляции колоний, интерфероны и т.д. Иммуногистохимические исследования проводили с диагностическими целями. Срезы тканей фиксировали в 10% забуференном растворе формалина, затем их обезвоживали, осветляли и заключали в парафин. Для исследования гистопатологии срезы тканей окрашивали гематоксилин-эозином. Серийные срезы из парафиновых блоков,используемые для гистопатологических целей,подвергали иммуноокрашиванию методом биотин стрептавидин пероксидазного комплекса,предварительно описанного (Hsu, S. М. у Raine,L., 1981,. J. Histochem Cytochem. 29: 1349-1353). Депарафинированные и обезвоженные срезы обрабатывали раствором 3% метанола с перекисью водорода в течение 30 мин для удаления эндогенной пероксидазной активности. Срезы ткани инкубировали с очищенными МАТ. Затем следовали антимышиные антитела и стрептавидин пероксидазный комплекс (Dakopatts); реакцию проводили при комнатной температуре. Между инкубациями срезы промывали солевым раствором трис-НСl буфера. Пероксидаз 9 ную реакцию проводили с 30% Н 2O2 и 3-3 диаминобензидином. Срезы промывали водопроводной водой,окрашивали гематоксилином Майера, заключали в бальзам и покрывали покровным стеклом. Реакция с ферментом давала коричневокрасную окраску. Опухолевые ткани молочной железы, легкого, кожи и нервной системы изучали также как ткани эмбриональные и ткани взрослого организма. Свежую биопсию патологических тканей брали в течение первого часа после операции. Кусочки биопсии замораживали, затем делали срезы, и срезы оставались замороженными до начала исследования. Использование эмбриональных тканей обусловлено тем фактом, что неоднократно сообщали о связи ганглиозидов с онкоэмбриональными антигенами, также как о сходстве этих молекул у эмбриональной и опухолевой ткани человека (Cahan, L. et al., 1982, Proc. Natl.Acad. Sci. USA., 79: 7629-7633). Срезы эмбриональной ткани получали из эмбриона в возрасте от 12 до 18 недель. Кусочки ткани взрослого человека получали от людей, погибших при несчастных случаях и/или в результате смерти мозга в течение первого часа после смерти. Среди изученных опухолей опухоли легкого и центральной нервной системы различной этиологии давали отрицательный ответ, также как срезы нормальных тканей человека. Тогда как срезы ткани меланомы и молочной железы все обнаружили положительную реакцию, также как срезы эмбриональной ткани, полученные из органов пищеварительной системы (печени,желудка, тонкой и толстой кишки и почечной системы). Противоопухолевое действие Чтобы показать антиопухолевое действие моноклональных антител против NGcGM3, животных, инокулированных опухолью, несущей ганглиозидную мишень (миелома Р 3 Х 63), обрабатывали полученными антителами. Доза может варьировать от 0,01 мг/кг веса до 200 мг/кг веса при одной или более обработках в течение одного или нескольких дней. Антитела можно применять в виде парентеральной инъекции(внутривенной, внутрибрюшинной, внутримышечной, подкожной, внутриполостной или трансдермальной). В типичном эксперименте процент выживания мышей, обработанных антителом, составлял 30-80% по сравнению с мышами контрольной группы, что подтверждено тестом Log Ramedits. Chapman Hall). Обнаружили статистически значимые различия (0,05%) между группой,обработанной MAT, и контрольной группой.NGcGM3/VLDL/адъювант Фройнда, измеренный иммуноферментной методикой. Женским особям мышей линии Balb/C в возрасте 6-8 недель инъецировали внутримышечно 0,2 мг препарата человеческой вакциныNGcGM3/VLDL с полным адъювантом Фройнда в первой дозе и неполным адъювантом Фройнда в последующих дозах (произведено фирмой Сигма), смешанными в равных объемах. Каждое животное получало 6 доз. Первые 4 дозы еженедельно и 2 остальные каждые 14 дней. Взятие крови осуществляли перед первой дозой и затем каждые 2 недели. Уровни антитела измеряли в сыворотке животных, используя косвенный тест ИФА на планшетах Полисорп марки (Nunc trade mark),на которых ганглиозиды иммобилизовали следующим описанным ниже способом. Ганглиозиды NAcGM3 и NGcGM3 растворяли отдельно в метаноле (4 мкл/мл) и в каждую лунку вносили 50 мкл. Планшет помещали при 37 С на полтора часа, чтобы выпарить метанол. Затем добавляли 100 мкл/лунку буфер трис-НСl 0,05 М, рН 7,8, содержащий 2% бычьего сывороточного альбумина (БСА), и инкубировали в течение 1 ч при комнатной температуре. Затем 50 мкл сыворотки разбавляли тем же буфером и инкубировали в течение ночи при комнатной температуре. Лунки промывали 4 раза 200 мкл фосфатного солевого буфера (ФСБ) и добавляли 50 мкл антисыворотки мышиных антииммуноглобулинов, конъюгированной с биотином в соответствующем разбавлении, на 1,5 ч при 37 С. После дополнительного промывания с ФСБ добавляли 50 мкл соответственно разбавленной щелочной фосфатазы, конъюгированной со стрептавидином. В конце лунки промывали последний раз и 100 мкл р-нитрофенилфосфатасубстрата растворяли в диэтаноламиновом буфере, рН 9,8 (1 мг /мл). Поглощение измеряли при 405 нм на счетчике ИФА. Фиг. 1 показывает данные оптической плотности O.D. при 405 нм в сыворотке каждого животного, разбавленной 1/80 на 56-й день эксперимента. Ответ на NGсGM3 и GM3 определяли с помощью теста ИФА, используя мышиный анти IgG, конъюгированный с биотином и стрептавидин со щелочной фосфатазой от Джексона. Более 70% животных, иммунизированных препаратом вакцины, имели величины O.D. при 405 нм, превышающие 0,5 в ответ на NGcGM3. Все иммунизированные животные показывалиIgG ответ против NGcGM3 и никакого ответа не наблюдали к NAcGM3, несмотря на минимальные различия между этими двумя молекулами. 11 Фиг. 2 показывает длительный специфический ответ антител (изотип IgG против ганглиозида NGcGM3, три месяца спустя после последней дозы иммунизации, при этом никакого ответа не было против NAcGM3. Пример 2. Получение моноклональных антител против NGcGM3. Антитела получали иммунизацией мышей линии Balb/C с использованием процедуры,описанной в примере 1. За три дня до слияния животных реиммунизировали иммуногеном NGcGM3/VLDL, используя полный адъювант Фройнда. После чего получали селезенку мышиную и готовили клеточную суспензию, пропуская ткань через стальное сито, либо путем перфузии. Слияние клеток проводили как описано у Khler Milstein(Nature, 1975, No. 256, 495-497) с некоторыми модификациями. Клетки несекретирующей миеломы мыши Р 3/Х 63 Аg8 6.5.3 сливали с клетками селезенки мыши в соотношении 1:10, в 0,5 мл среды для слияния, содержащей 42% полиэтиленгликоля(3000-3600, Сигма) в среде RPMI 1640. После слияния клетки культивировали в селективной среде HAT (гипоксантин/аминоптерин/тимидин) при 37 С во влажной атмосфере 5% CO2. Между 10 и 15 днями после того, как провели клеточное слияние, начинали опыт по определению наличия антител в супернатанте культуры клеток гибридомы, используя технику ИФА, описанную в примере 1. Отбирали клетки культуры гибридомы, которые реагировали на интересующий ганглиозид, и клонировали их дважды способом лимитирующего разбавления в присутствии кондиционирующих клеток. Специфичность антител, образованных отобранными гибридомами, определяли, применяя косвенный тест ИФА с набором гликолипидов. Количество специфических клонов против ганглиозида NGcGM3 составляло 5,5%. Один из полученных клонов был обозначен как клон 14F7. Пример 3. Определение субкласса моноклонального антитела 14F7. Чтобы определить, к какому субклассу иммуноглобулинов относится моноклональное антитело данного изобретения, использовали косвенный тест ИФА с планшетами, покрытымиNGcGM3, как описано в примере 1, но при этом заменяли сыворотку разбавлениями супернатанта от гибридомы или очищенным МАТ. Мышиные Anti IgG1, IgG2a, IgG2b и IgG3,конъюгированные с биотином и полученные в крысах (Фарминген), разбавляли буфером для инкубации и вносили в лунки. После 1 ч инкубации при 37 С планшеты промывали и добавляли разбавленную в инкубационном буфере щелочную фосфатазу, конъюгированную стреп 003318 12 тавидином. В качестве контроля каждого субкласса использовали мышиные MAT, предварительно охарактеризованные. В конце добавляли раствор субстрата. Определение поглощения проводили, как описали раньше. Фиг. 3 показывает, что MAT 14F7 принадлежит к субклассу IgG1. Пример 4. Изучение специфичности моноклонального антитела 14F7 с применением иммуноокрашивания в сочетании с тонкослойной хроматографией высокого разрешения. Высокого разрешения тонкослойную хроматографию применяли для разделения гликолипидов. Система использованного растворителя представляла собой хлороформ:метанол:KСl 0,25% и 2,5 М NH3 (5:4:1) объем:объем. Полосы проявляли с помощью орсина (Svennerholm L. 1964, J. Lipid. Res., 5, 145), в то время как для иммуноокрашивания применяли способ Kawashima Y. с сотр. 1993 (J. Biochem, 114, 186). Пластины, на которых проводили тонкослойную хроматографию, покрывали пластиком,погружая на 75 с в раствор 0,1% полиизобутилметакрилата (ПИБМ) в N-гексане. Пластины затем высушивали при комнатной температуре в течение 30 мин. 1% раствором ПИБМ обрабатывали края пластины, оставляя их на ночь при комнатной температуре. Блокирование неспецифических взаимодействий осуществляли, применяя в течение 30 мин раствор 1% бычьего сывороточного альбумина, растворенного в ФСБ, рН между 7,2 и 7,4. Немедленно после этого пластины инкубировали с MAT 14F7 с концентрацией от 0,01 до 0,02 мг/мл в растворе для блокирования. Пластины промывали ФСБ и инкубировали с пероксидазой из хрена, конъюгированной с антисывороткой кролика против иммуноглобулинов мыши, разбавленной раствором для блокирования. После одного часа инкубации с перемешиванием при комнатной температуре пластины снова промывали и добавляли раствор субстрата, состоящий из 0,4 мг/мл ортофенилдиамина(Riedel de Haen). Реакцию останавливали повторными промываниями фосфатным буфером. Реакция выявила специфичность только в отношении ганглиозида NGcGM3 и никакой реакции не наблюдали в отношении других Nгликолилированных ганглиозидов, обозначенных как GM1a, GM1b, GM2, и N-ацетилированных (фиг. 4 и 5). Пример 5. Распознавание моноклональным антителом 14F7 опухолевых и эмбриональных тканей. Срезы тканей фиксировали в 10% забуференном растворе формалина, затем обезвоживали, осветляли и заключали в парафин. Гистопатологию исследовали на срезах тканей, окрашенных гематоксилин-эозином. 13 Серийные срезы, полученные из парафиновых блоков, использованные в гистопатологических исследованиях, подвергали иммуноокрашиванию способом биотин стрептавидин пероксидазного комплекса, предварительно описанного (Hsu, S. М. у Raine, L., 1981, J. Histochem Cytochem. 29: 1349-1353). Депарафинизированные и обезвоженные срезы обрабатывали 3% раствором метанола с перекисью водорода в течение 30 мин для удаления эндогенной пероксидазной активности. Срезы тканей инкубировали с очищенным MAT 14F7 в течение 1 ч при комнатной температуре. Затем следовали конъюгированные с биотином антимышиные антитела и стрептавидин пероксидазный комплекс (Dakopatts) при комнатной температуре. Между инкубациями срезы промывали солевым раствором буфера трис-HCl. Пероксидазную реакцию проводили с 5 мл раствора, забуференного трис-буфером. Добавляли также 0,005 мл 30% Н 2O2 и 3 мг 3-3 диаминобензидина. Срезы промывали водопроводной водой,окрашивали гематоксилином Майера, заключали в бальзам и покрывали покровным стеклом. Реакция с ферментом давала коричневокрасную окраску. Кусочки ткани взрослого человека получали от людей, погибших при несчастных случаях и/или в результате смерти мозга, в течение первого часа после смерти. Свежую биопсию патологических тканей брали в течение первого часа после операции. Срезы эмбриональной ткани получали от эмбриона в возрасте от 12 до 18 недель в течение первого часа после аборта. Все кусочки биопсии промывали в солевом растворе и немедленно замораживали в жидком азоте и хранили в замороженном состоянии при -80 С. Серийные срезы толщиной в 5 мкм получали из кусочков замороженной ткани в криостате Лейса при -25 С. Срезы высушивали на воздухе и использовали немедленно или хранили при -20 С завернутыми в алюминиевую фольгу. Во всех случаях срезы фиксировали в момент использования в 4% параформальдегиде в течение 20 мин. Фиг. 6 показывает результаты иммуногистохимического исследования MAT 14F7 в тканях здорового человека. Реакционную способность MAT в мембране и в цитоплазматической области не наблюдали. Фиг. 7 показывает результаты того же исследования на патологических тканях. Все изученные ткани молочной железы (33/33) и меланомы (20/20) дали положительную реакцию, в то время как 70 опухолей легкого различной этиологии дали отрицательную реакцию также,как 33 различные опухоли центральной нервной системы. 14 Фиг. 8 демонстрирует распознавание MAT 14F7 в случае пищеварительной системы и эмбриональных почечных тканей. Пример 6. Распознавание с помощью MAT 14F7 ганглиозида NGcGM3 в клетках, изучаемых поточной цитометрией. Изучаемые клеточные линии включали мышиную миелому Р 3 Х 63, экспрессирующую(Muthing, J. et al., 1994, J. Biochem 116: 64-73) и миелому В 16, которая экспрессирует GM3. Клетки культивировали в среде RPMI с 8% бычьей эмбриональной сывороткой. Концентрацию клеток доводили до 107 клеток/мл солевого фосфатного буфера рН 7,4, содержащего 0,02% азида натрия и 1% бычьего сывороточного альбумина. В каждую пробирку, содержащую 0,1 мл клеточной суспензии, добавляли 0,05 мл раствора MAT 14F7, растворенного в солевом фосфатном буфере до окончательной концентрации 0,1 мг/мл, и затем инкубировали в течение 30 мин при 4 С. Клетки затем промывали раствором, в котором их суспендировали. Затем клеточные культуры центрифугировали в течение 5 мин при низкой скорости, чтобы осадить. Добавляли антимышиный(IgG+IgM) конъюгат биотина (Джексон) и промывали после 30 минутной инкубации при 4 С. В конце добавляли 0,002 мг флуоресцеин стрептавидина FITC (Джексон) и инкубировали в тех же условиях, описанных ранее. Последнее промывание проводили солевым фосфатным буфером. Супернатант после последнего центрифугирования выливали и клетки ресуспендировали в 0,6 мл раствора для последнего промывания. 80% клеток миеломы Р 3 Х 68 давали положительную окраску с моноклональным антителом 14F7 (фиг. 9). Пример 7. Изучение прямой цитотоксичности у моноклонального антитела 14F7. Клеточную линию мышиной миеломы Р 3 Х 63 инкубировали с MAT 14F7, как описано в примере 6. После промывания добавляли к клеткам 0,01 мл раствора пропидий йода в солевом фосфатном буфере для определения клеточной жизнеспособности с помощью поточной цитометрии. Результаты показали, что 78% клеток мертвые (фиг. 10). Пример 8. Изучение биораспределения 99mTc - меченого моноклонального антитела 14F7 у мышей линии Balb/C, здоровых и несущих опухоль миеломы Р 3 Х 63. Двадцать женских особей мышей линииBalb/C весом от 20 до 22 г (10 здоровых и 10,инокулированных опухолью миеломы Р 3 Х 63 перитонеальным путем) получали внутривенную инъекцию MAT 14F7, меченого 99mTc. Концентрация метки составляла 0,03 мг MAT 14F7/60 мкKи 99mTc. 15 Результаты определения радиоактивности в различных органах получали на 5 животных в каждой группе, через 4 и 24 ч после инъекции. Животных забивали и вес каждого органа определяли на весах Сарториус. Радиоактивность всех пробирок определяли одновременно, приблизительно через 25 ч после начала эксперимента на гамма счетчике WALLAC (модельWIZARD 1470). Способ мечения был предварительно описан у Schwarz Steinstrasser (1987) и модифицирован у Muther и Ellison в 1990. Меченое MAT 14F7 удалялось из организма здоровой мыши с помощью почек и печениMAT 14F7 обнаружили через 4 ч (12% общей инъецированной радиоактивности на грамм ткани) и через 24 ч (35% общей инъецированной радиоактивности на грамм ткани). Удаление из организма MAT происходило в основном через почки (фиг. 12). Пример 9. Антиопухолевый эффект моноклонального антитела 14F7 у мышей линииBalb/C, несущих асцитную миелому Р 3 Х 63. Самки мышей линии Balb/C весом 20-22 г инъецировались внутривенно 6 дозами моноклонального антитела 14F7 (одну группу 0,1 мг и другую 0,2 мг) каждые 2 дня, моноклональное антитело растворяли в солевом фосфатном буфере. За три дня до эксперимента в брюшинной полости вызывали воспаление с помощью неполного адъюванта Фройнда, чтобы стимулировать момент, когда опухоль можно измерить. 10000 клеток мышиной миеломы Р 3 Х 63 инокулировали внутрибрюшинно в 0 день эксперимента, в то же самое время когда пассивную терапию с моноклональным антителом 14F7 начинали, только в случае моноклонального антитела проводили внутривенную инокуляцию. Контрольная группа с хорошим прогнозом(наилучшее лечение), используемая для сравнения, составляла третью группу, которую обрабатывали внутривенно циклофосфамидом(Shangai Hua Lian Pharmaceutical Corp.) с дозой 20 мг/кг веса тела, которая составляла еженедельную дозу в течение всего эксперимента. Внутривенная обработка раствором солевого фосфатного буфера, рН 7,4, служила контролем эксперимента. Фиг. 13 показывает результаты по выживанию в 4 группах, предварительно описанных. В группах, обработанных 14F7 (0,1 и 0,2 мг), а также 20 мг/кг веса циклофосфамида, не обнаружили измеримой опухоли у отдельных животных. Результаты по выживанию были в пользу групп, обработанных MAT 14F7. На 30 день эксперимента, когда ни одно животное из контрольной группы не оставалось живым, 6 животных были еще живы, как из первой группы 16 циклофосфамидом, а также 7 животных из второй группы (0,2 мг MAT). На 60 день обработки 2 животных первой группы и 2 животных, обработанных циклофосфамидом, оставались живы,тогда как во второй группе 5 животных были еще живы. Пример 10. Ингибирование опухолевого роста плотной миеломы Р 3 Х 63 у мышей без тимуса. В 0 день эксперимента 10 женским мышиным особям, лишенным тимуса из линии outbread NMRI, с весом от 20 до 22 г инокулировали подкожно 106 клеток опухолевой мышиной линии миеломы Р 3 Х 63. Животных разделяли на две группы по 5. Одну группу начинали обрабатывать внутрибрюшинно очищенным MAT 14F7, по 0,15 мг в дозе (6 доз) каждые 2 дня. В то время как другая группа служила контролем и получала тем же способом то же число доз с той же частотой равный объем солевого фосфатного буфера. Фиг. 14 показывает ингибирование роста опухолей у мышей, обработанных MAT 14F7,по сравнению с контрольной группой. Статистически значимые различия наблюдали у этих групп. КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ Фиг. 1 показывает уровни антител в сыворотке, полученных против NGcGM3, но не против GM3, на 56 день эксперимента у мышей,иммунизированных препаратом вакцины, содержащим NGcGM3/VLDL/полный адъювант Фройнда. Фиг. 2 - определение с помощью теста ИФА изотипов ответа антитела на ганглиозидNGcGM3 в сыворотке мышей 3 месяца спустя после получения четвертой дозы 0,2 мг комплексаNGсGM3/VLDL/полный адъювант Фройнда. Фиг. 3 - определение с помощью теста ИФА субкласса иммуноглобулина, к которому относится моноклональное антитело 14F7. Фиг. 4 - распознавание с помощью иммуноокрашивания с тонкослойной хроматографией N-гликолилированных и N-ацетилированных ганглиозидов, которые использовали при изучении специфичности моноклонального антитела 14F7. Фиг. 5 - распознавание ганглиозидаNGcGM3 моноклональным антителом 14F7 при использовании иммуноокрашивания с тонкослойной хроматографией. Фиг. 6 - отрицательный ответ в распознавании у нормальных тканей взрослого организма при обработке моноклональным антителом 14F7 и последующем иммуногистохимическом исследовании. Фиг. 7 - иммуногистохимическое распознавание некоторых злокачественных и доброкачественных опухолей человека моноклональным антителом 14F7. 17 Фиг. 8 - иммуногистохимическое распознавание нормальной эмбриональной ткани человека моноклональным антителом 14F7. Фиг. 9 - распознавание клеточной линии миеломы Р 3 Х 63, экспрессирующей ганглиозидNGcGM3, моноклональным антителом 14F7 с использованием поточной цитометрии. Фиг. 10. - комплемент независимое цитотоксическое действие MAT 14F7 при использовании клеточной линии миеломы Р 3 Х 63 и методики пропидиум йод совместно с поточной цитометрией. Фиг. 11 - биораспределение моноклонального антитела 14F7, меченого 99mТс. Результаты в процентах гамма-излучения на вес в граммах в изучаемом органе у нормальных мышей линии Balb/C. Фиг. 12 - биораспределение моноклонального антитела 14F7, меченого 99mТс. Результаты в процентах гамма-излучения на вес в граммах изучаемого органа у мышей линии Balb/C,несущей опухоль миелому Р 3 Х 63. Фиг. 13 - антиопухолевый эффект пассивной терапии моноклональным антителом 14F7 в группах мышей линии Balb/C, инокулированных мышиной асцитной опухолью миелома Р 3 Х 63 и обработанных 0,1 и 0,2 мг указанного антитела в сравнении с контрольной группой,обработанной циклофосфамидом (20 мг/кг) и контрольной группой, обработанной солевым фосфатным буфером. Фиг. 14 - ингибирование опухолевого роста in vivo на примере плотной мышиной миеломы Р 3 Х 68 у мышей без тимуса, линия out breadNMRI. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Штамм гибридных клеток мыши 14F7 ЕСАСС 98101901, продуцирующий моноклональное антитело 14F7 против ганглиозидовNGcGM3. 2. Моноклональное антитело 14F7, продуцируемое штаммом гибридных клеток по п.1,специфично распознающее олигосахаридную последовательность N-гликолилированная га 003318 18 лактозаглюкоза - сиаловая кислота в ганглиозиде NGcGM3 и обладающее цитолитической активностью по отношению к опухолевым клеткам, содержащим указанную последовательность. 3. Моноклональное антитело по п.2, отличающееся тем, что его цитолитическая активность в отношении опухолевых клеток, содержащих олигосахаридную последовательностьN-гликолилированная галактоза - глюкозасиаловая кислота, может быть прямой или опосредованной комплементом. 4. Фармацевтическая композиция, содержащая моноклональное антитело, охарактеризованное в любом из пп.2, 3, и растворитель или наполнитель. 5. Фармацевтическая композиция по п.4,отличающаяся тем, что антитело может быть связано с терапевтическим средством, таким как лекарственный препарат, радиоизотоп, иммуномодулятор, лектин и токсин. 6. Фармацевтическая композиция по любому из пп.4, 5, отличающаяся тем, что используется для лечения злокачественных новообразований. 7. Фармацевтическая композиция по п.6,отличающаяся тем, что злокачественное новообразование представляет собой злокачественную опухоль молочной железы, почки, органов пищеварительной системы или меланому человека. 8. Реактив, содержащий моноклональное антитело, охарактеризованное в любом из пп.2,3, связанное с такими маркерами, как ферменты,хромофоры, хемилюминесцентные вещества и радионуклиды. 9. Применение реактива, охарактеризованного в п.8, для выявления опухолевых клеток. 10. Применение по п.9, отличающееся тем,что опухолевые клетки представляют собой клетки меланомы человека, молочной железы,почки или органов пищеварительной системы,таких как печень, толстая кишка, желудок и прямая кишка.
МПК / Метки
МПК: C07K 16/30, C12N 5/20, A61P 35/00, G01N 33/574, A61K 51/10, A61K 39/395, G01N 33/577, A61K 47/48
Метки: ngcgm3, мыши, фармацевтическая, ганглиозидов, против, антитело, указанное, 14f7, клеток, реактив, гибридных, содержащие, продуцирующий, моноклональное, штамм, композиция
Код ссылки
<a href="https://eas.patents.su/12-3318-shtamm-gibridnyh-kletok-myshi-produciruyushhijj-monoklonalnoe-antitelo-14f7-protiv-gangliozidov-ngcgm3-monoklonalnoe-antitelo-14f7-farmacevticheskaya-kompoziciya-i-reaktiv-soderzha.html" rel="bookmark" title="База патентов Евразийского Союза">Штамм гибридных клеток мыши, продуцирующий моноклональное антитело 14f7 против ганглиозидов ngcgm3, моноклональное антитело 14f7, фармацевтическая композиция и реактив, содержащие указанное антитело</a>
Предыдущий патент: Способ и устройство для введения оборудования в трубопровод и перемещения его по трубопроводу
Следующий патент: Производные замещенного бензолсульфонамида-пролекарства ингибиторов сох-2.
Случайный патент: Способ получения 2-(2,3-диметилфенил)-1-пропаналя с использованием хлорацетона