Имплантат с полостями, содержащими лекарственные средства
Номер патента: 3260
Опубликовано: 27.02.2003
Авторы: Завитовски Томас, Брандау Вольфганг, Фишер Альфонс, Шмид Гюнтер
Формула / Реферат
1. Имплантат (1) с основой (2), в частности, из металла, и, по крайней мере, с одним лекарственным средством (5), в котором основа (2) содержит, по крайней мере, частично сформированный внешний слой (6), преимущественно расположенный в областях, которые в особенности контактируют с тканями и/или жидкостями организма, и который имеет множество пустот (10), образованных путем электролитического оксидирования, с отдельными отверстиями (9), открытыми в сторону поверхности (8) внешнего слоя (6), для поглощения, по крайней мере, одного лекарственного средства (5), отличающийся тем, что внешний слой (6), по крайней мере, в основном, состоит из полученных электролитическим оксидированием оксида алюминия, оксида магния, оксида тантала, оксида железа и/или оксида вольфрама, при этом отверстия (9) имеют средний диаметр, не превышающий 100 нм.
2. Имплантат по п.1, отличающийся тем, что толщина внешнего слоя (6) составляет, по крайней мере, в основном, не более 1,5 мкм, преимущественно не более 200 нм и, в частности, приблизительно от 30 до 150 нм.
3. Имплантат по п.1 или 2, отличающийся тем, что внешний слой (6) содержит изолирующую прослойку (11), непроницаемую, в частности, для жидкостей организма, которая преимущественно покрывает всю поверхность (7) основы (2).
4. Имплантат по любому из предшествующих пунктов, отличающийся тем, что пустоты (10) сформированы, по крайней мере, в основном, равномерно и имеют, по крайней мере, в основном, удлиненную форму, в частности трубообразную, и закрыты, по крайней мере, с одного конца.
5. Имплантат по любому из предшествующих пунктов, отличающийся тем, что пустоты (10), по крайней мере, в основном, проходят параллельно одна другой.
6. Имплантат по любому из пп.1-4, отличающийся тем, что пустоты (10), по крайней мере, в основном, проходят перпендикулярно к поверхностям (7, 8) внешнего слоя (6) и/или основы (2).
7. Имплантат по любому из предшествующих пунктов, отличающийся тем, что любая из пустот (10) содержит участки с разными или увеличивающимися, и/или уменьшающимися поперечными сечениями и/или является разветвленной.
8. Имплантат по любому из предшествующих пунктов, отличающийся тем, что отверстия (9) распределены, по крайней мере, на части поверхности (8) внешнего слоя (6) с поверхностной плотностью от 108 до 1011 шт/см-2.
9. Имплантат по любому из предшествующих пунктов, отличающийся тем, что сумма площадей поперечного сечения отверстий (9) составляет не более 50% площади поверхности (8) внешнего слоя (6).
10. Имплантат по любому из предшествующих пунктов, отличающийся тем, что отверстия (9) имеют, по крайней мере, в основном, одинаковый минимальный и/или максимальный диаметр.
11. Имплантат по любому из предшествующих пунктов, отличающийся тем, что пустоты (10) имеют поперечное сечение со средним диаметром, равным не более 100 нм, преимущественно не более 50 нм, в частности 25 нм или меньше.
12. Имплантат по любому из предшествующих пунктов, отличающийся тем, что отверстия (9) имеют площадь, определяемую средним диаметром, не превышающим 50 нм, в частности 25 нм или меньше.
13. Имплантат по любому из предшествующих пунктов, отличающийся тем, что он выполнен в форме стента.
14. Имплантат по любому из предшествующих пунктов, отличающийся тем, что лекарственное средство (5) химически зафиксировано или связано, по крайней мере, частично со стенками (12) пустот (10), в частности, с помощью комплексообразующих веществ (13).
15. Имплантат по любому из предшествующих пунктов, отличающийся тем, что лекарственное средство (5) связано или зафиксировано в пустотах (10) таким образом, что оно выделяется из имплантата (1) в имплантированном состоянии при превышении заранее заданной температуры и/или под действием специфических тканей и жидкостей организма, ферментов или активирующих материалов, под влиянием другой активации, в частности лазерной или ультразвуковой.
16. Имплантат по любому из предшествующих пунктов, отличающийся тем, что он содержит, по крайней мере, два лекарственных средства (5), поглощенных пустотами (10) таким образом, что средства (5) высвобождаются последовательно, и/или с разной скоростью, и/или в разных количествах в имплантированном состоянии.
17. Имплантат по любому из предшествующих пунктов, отличающийся тем, что он содержит в качестве лекарственного средства (5) радиоактивный материал, в котором содержится, преимущественно, заранее определенное количество, по крайней мере, одного радионуклида.
18. Имплантат по п.17, отличающийся тем, что радиоактивный материал химически связан со стенками (12) пустот (10), в частности, с помощью комплексообразующих веществ (13), таких как тиолы.
19. Имплантат по п.17 или 18, отличающийся тем, что радиоактивный материал содержит радиоактивный рений и/или технеций, которые зафиксированы в пустотах, в частности, с помощью сульфидных групп.
20. Имплантат по пп.17-19, отличающийся тем, что радиоактивный материал содержит разные, в частности имеющие разные периоды полураспада, виды и энергию излучения радионуклиды в заранее определенных количествах или соотношениях.
21. Имплантат по любому из предшествующих пунктов, отличающийся тем, что внешний слой (6) или отверстия (9) покрыты или закрыты верхним покровным слоем (14), преимущественно из золота, по крайней мере, до его отделения от поверхности внешнего слоя (6) или растворения в организме.
22. Способ изготовления имплантата, описанного в любом из пп.1-21, отличающийся тем, что имплантат (1) помещают в вакуум для опустошения пустот (10) и затем в пустоты (10) через отверстия (9) вводят лекарственное средство (5) и/или связующее вещество (13), которое фиксирует лекарственное средство (5) в пустотах (10), в частности, путем погружения имплантата (1) в лекарственное средство (5) или связующее вещество (13), после чего давление нормализуют.
23. Способ изготовления имплантата, описанного в любом из пп.1-21, отличающийся тем, что вводят в пустоты (10) лекарственное средство (5) и/или связующее вещество (13), которое фиксирует лекарственное средство в пустотах (10) с помощью ультразвуковой обработки, в частности, когда имплантат (1) погружен в лекарственное средство (5) или в связующее вещество (13).
24. Способ изготовления имплантата, описанного в любом из пп.1-21, отличающийся тем, что пустоты (10), соответственно их стенки (12) покрывают комплексообразующими средствами (13) или реакционными компонентами, которые химически связывают лекарственное средство (5), после чего в пустоты (10) через отверстия (9) вводят лекарственное средство (5).
25. Способ изготовления имплантата по п.24, отличающийся тем, что радиоактивный материал как лекарственное средство (5) фиксируют в пустотах (10) путем формирования комплексов и/или химических связей и/или покрытия отверстий (9) или внешнего слоя (6) покровным слоем (14), например, из золота.
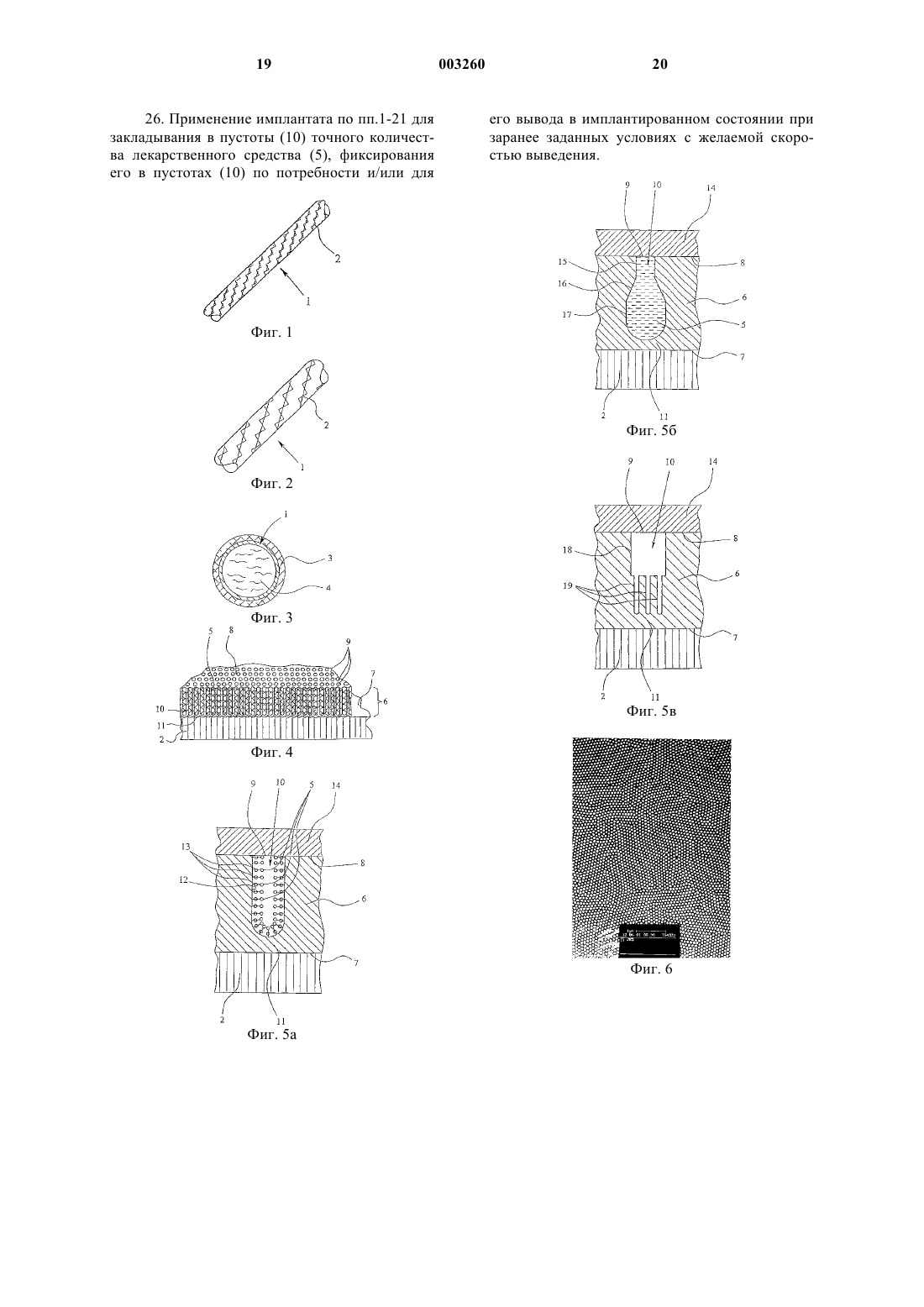
26. Применение имплантата по пп.1-21 для закладывания в пустоты (10) точного количества лекарственного средства (5), фиксирования его в пустотах (10) по потребности и/или для его вывода в имплантированном состоянии при заранее заданных условиях с желаемой скоростью выведения.
Текст
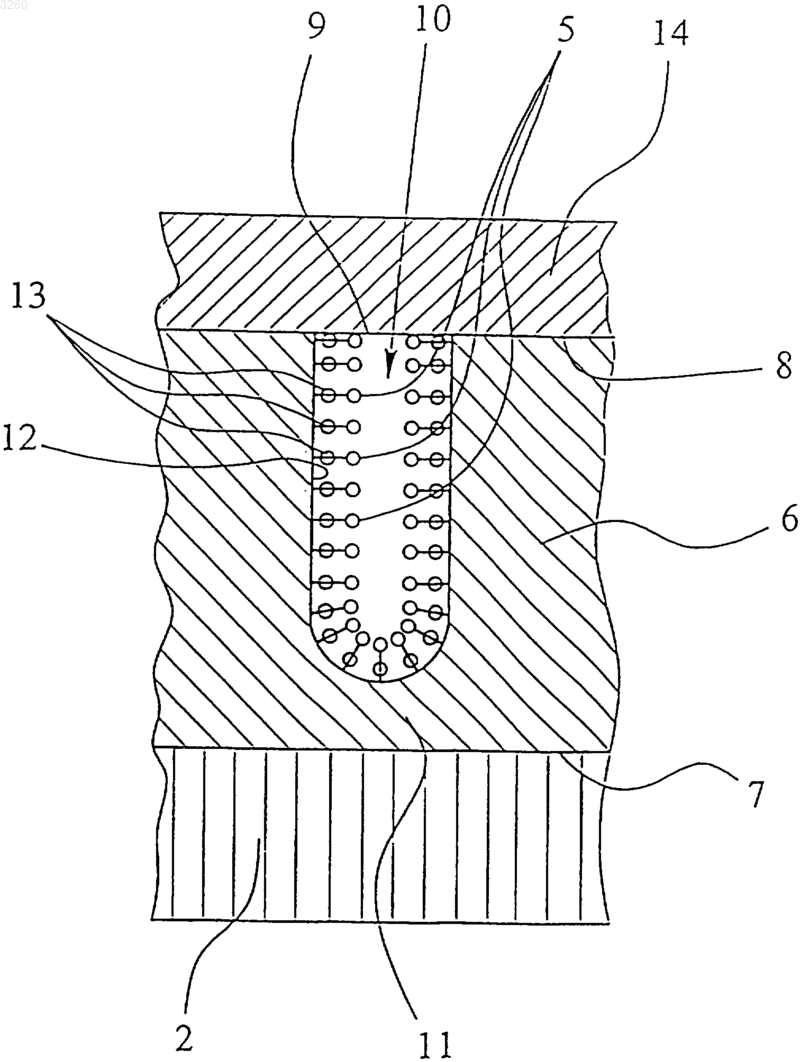
1 Данное изобретение касается имплантата в соответствии с ограничительной частью п.1 формулы изобретения и способа изготовления имплантата в соответствии с ограничительной частью пп.25, 29 и 30 формулы изобретения. Под термином "имплантат" здесь подразумевается, прежде всего, в узком понимании,вставляемый, по крайней мере, временно, в тело животного или человека элемент, который может выполнять, например, терапевтические,поддерживающие функции и/или функции сустава, как, например, временные имплантаты, так называемые "зерна" или стенты для лечения или терапии опухоли, трахеальные стенты и подобные. В широком смысле здесь, однако, также подразумеваются элементы, которые контактируют, в частности, временно, с телом снаружи. Имплантаты в форме стентов вводятся, например, для поддержки расширенных сосудов. Эти трубообразные вставки вводятся после расширения стенотических сосудов и потом радиально расширяются так, чтобы стенты поддерживали стенки сосудов изнутри. Стенты врастают на протяжении 1-3 месяцев у стенки сосудов. Во избежание чрезмерного роста стенок сосудов внутрь, что может привести к рестенозу, то есть к повторному сужению сосудов, оправдывает себя локальное радиоактивное облучение стенок сосудов. Для этого существуют такие возможности. Во-первых, вставляется баллон-катетер,наполненный радиоактивной жидкостью. Поскольку баллон-катетер в расширенном состоянии закрывает, как минимум, часть сосуда, то контакт со стенкой сосуда и тем самым введения баллона-катетера очень ограниченные в времени. Чтобы при локальном применении можно было достичь эффективной дозы, должно быть использовано большое количество радиоактивного вещества, что вызывает технические проблемы, связанные с защитой от облучения. К тому же существует очень высокий риск для пациента в случае механического повреждения баллона. Во-вторых, возможно введение через катетер изолированного источника излучения. В этом случае также из-за ограниченного срока нахождения катетера в сосуде должна быть применена большая доза облучения, что вызывает технические сложности по защите от облучения. Кроме того, в этом случае возникает проблема центрирования источников излучения. В-третьих, могут быть вставлены радиоактивные стенты. Тем самым можно избежать уже названных проблем и рисков и достичь желаемой и/или эффективной дозы при введении незначительного количества радиоактивного вещества на протяжении увеличенного времени контакта. В последнем случае, то есть для радиоактивного выполнения стентов, уже известно проведение ионной имплантации. При этом в суще 003260 2 ствующие поверхности стента имплантируется радиоактивный фосфор (32 Р) с помощью ионных лучей. Далее известен способ, при котором никель-титановые стенты бомбардируют протонами в циклотроне или подобном устройстве, чтобы превратить титан, содержащийся в используемом никель-титановом сплаве, в радиоактивный ванадий (48V). Как ионная имплантация, так и протонная активация отличаются высокой технической сложностью, это означает, что практически возможно только "поштучное" изготовление стентов. Кроме того, оба метода до сих пор ограничены незначительным количеством мест изготовления и небольшим выбором радионуклидов. Дальнейший процесс изготовления радиоактивных стентов предусматривает осаждение радиоактивного рения электрохимическим способом на поверхностях стента с последующим нанесением защитного слоя золота. Как и во всех случаях многослойных конструкций, здесь существует опасность сегментирования, то есть опасность отслаивания, которая очень высока именно в случае стентов из-за деформации при радиальном расширении внутри сосуда. Даже если отслаивается только защитный слой или он, возможно, был нанесен не сплошь, то возникает опасность, что радиоактивный рений, который свободно находится на большой поверхности, частично растворится в крови и может попасть в другие части тела с нежелательными последствиями. Кроме того, может оказаться целесообразным, по возможности, более локальное действие медикаментов, чтобы, например, воспрепятствовать отторжению имплантата или чтобы провести местное лечение опухоли. Из патента СА-А-2,235,031, который соответствует патенту ЕР-А-0875218 и является исходным пунктом данного изобретения, уже известен стент, который конструктивно представляет собой непористую основу с пористым внешним слоем. Пористый внешний слой образовывают агломерированные частицы металла. Медикамент и/или лекарственное средство поглощается порами пористого внешнего слоя и может быть в имплантированном состоянии снова выделен стентом, если пористый внешний слой покрыт, например, растворимым или проницаемым покровным слоем. При необходимости как медикамент может быть введен также радиоактивный материал. Недостатком известного стента является то, что агломерированные металлические частицы пористого внешнего слоя образуют неравномерные, неопределенные поры. Поэтому при выделении медикамента достигаются только относительно неопределенные параметры его вывода. Если радиоактивный материал поглощается порами внешнего слоя, существует опасность, что из-за неоднородности пор с неопре 3 деленными отверстиями радиоактивный материал бесконтрольно и нежелательно улетучится. В таком случае дополнительно предусмотренное нанесение покрытия не обеспечивает достаточной защиты. Прочность и предельно допустимая нагрузка внешнего слоя, образованного из агломерированных металлических частиц, недостаточны, в особенности при деформации стента. В частности, существует опасность, что, по меньшей мере, отдельные металлические частицы отделятся от внешнего слоя. Вдобавок существует опасность сегментации внешнего слоя, в особенности при радиальном расширении стентов. Кроме того, в зависимости от условий существует опасность, что, например, частички внешнего слоя попадут благодаря кровообращению в другие части тела с нежелательными последствиями. Этот риск в особенности высок при введении радиоактивного материала, который как медикамент или лекарственное средство должен оставаться зафиксированным в пористом внешнем слое. Кроме того, существует предположение,что металлические имплантаты, в особенности никель, оказывают содействие чрезмерному клеточному росту, в особенности в области вокруг введенного имплантата. Кроме того, другие металлы, которые также могут мигрировать(даже если только в очень маленьком количестве) из металлических поверхностей в жидкости,находящиеся в организме, такие как кровь, могут вызвать нежелательные последствия или, по крайней мере, непредвиденные реакции в организме. В этом отношении значительным недостатком известного стента является большая поверхность металлических частиц пористого внешнего слоя, которая может вступать в контакт с жидкостями или тканями тела, которые врастают в пористое покрытие. Однако уже известно, например, нанесение на металлические поверхности имплантатов керамического внешнего слоя или покрытия, например, из патентовDE-A-43 11 772, DE-A-320410589 или ЕР-А-0 520 721. В основе данного изобретения лежит задача предложить такой имплантат и способ изготовления имплантата, чтобы, в частности, имплантат, выполненный в виде стента, был относительно легко изготовляемым, причем можно было бы избежать указанных выше недостатков прототипа или, по крайней мере, свести их к минимуму, и чтобы при этом имплантат мог поглощать лекарственные средства и, если необходимо, снова выделять их в имплантированном состоянии, и в особенности чтобы имплантат, прежде всего стент, позволял надежно фиксировать радионуклиды на и/или в поверхности. Вышеупомянутая задача решается с помощью имплантата согласно п.1, способу по пп.22,23, 24 или согласно применению имплантата по 4 п.26. Другие полезные усовершенствования являются объектом остальных пунктов. В частности, внешний слой имеет множество пустот определенного вида с отдельными отверстиями на его поверхности для поглощения, по меньшей мере, одного лекарственного средства. Под термином "пустоты" здесь подразумеваются также определенные дефекты в кристаллической структуре или нечто подобное,которые пригодны для поглощения лекарственного вещества. Благодаря формированию определенных и,прежде всего, отделенных одна от другой пустот во внешнем слое возможно, в отличие от прототипа, закладывать в пустоты очень точное количество лекарственного средства, фиксировать его в пустотах по потребности и, если необходимо, снова выводить в имплантированном состоянии при определенных условиях, например, с желаемой скоростью выделения. Под термином "лекарственное средство" в этой патентной заявке подразумеваются медикаменты в самом широком понимании, а при необходимости также радиоактивные материалы или другие лекарственные материалы. В частности, учитываются и все названные в патенте ЕР-А-08750218, обозначенные как "лечебные средства" лекарственные средства или рецептор-агонисты, рецептор-антагонисты, энзимингибиторы, нейротрансмиттеры, цитостатики,антибиотики, гормоны, витамины, метаболические субстраты, антиметаболиты, диуретики и прочие. Кроме того, предлагаемый имплантат имеет основу и внешний слой, причем внешний слой преимущественно состоит, по меньшей мере, в основном, из оксида металла и/или керамического материала. В частности, внешний слой состоит, в основном, из оксидов алюминия,магния, тантала, железа и/или титана. Внешний слой такого рода является относительно легко изготовляемым, например, с помощью электролитического осаждения и оксидирования и образует концентрированное, химически и механически стабильное, в частности, очень плотное покрытие основы. Это покрытие может, по меньшей мере, значительно воспрепятствовать(ионному) выделению никеля или других металлов из основы. Таким образом, чрезмерный клеточный рост вокруг имплантата или в контактной области устройства, обусловленный выделяющимися металлами, может быть, по меньшей мере, минимизирован. Простая структура пустот во внешнем слое достигается преимущественно анодным оксидированием поверхностного слоя, который может быть частью основы или нанесенным на нее покрытием. Пустоты единообразной формы и заданного размера могут быть легко сформированы простым образом. Предпочтительно весьма однородные по форме пустоты могут быть полу 5 чены очень просто при электролитическом формировании слоя оксида алюминия в качестве внешнего слоя на поверхности основы. При таком искусственном оксидировании алюминия(анодировании) могут образовываться заданные пустоты в зависимости от приложенного напряжения. Кроме оксида алюминия, для этого подходят, в частности, все так называемые вентильные оксиды металлов, например оксиды титана и вольфрама. Кроме того, учитывается и оксид магния. С помощью изменения электрического напряжения при анодировании могут быть изменены диаметры пустот и поверхностная плотность пустот, то есть количество пустот на единицу поверхности. Длина пустот зависит от продолжительности анодирования. Таким образом, форма пустот в широких пределах может регулироваться так, чтобы легко реализовывалась оптимальная форма пустот, например, принимая во внимание желательные параметры процесса вывода (скорость выделения, количество выведенного вещества). Например, пустоты, по меньшей мере, в основном, формируются в виде трубок и направлены от поверхности внешнего слоя, в основном, перпендикулярно,вглубь внешнего слоя, причем часть пустот и/или их отверстий уменьшается по диаметру или частично по площади, чтобы получить желаемые свойства. В зависимости от случая применения и потребности, пустотами могут также поглощаться несколько лекарственных средств, которые выводятся в имплантированном состоянии, например, поочередно и/или с разной скоростью выделения. Так, например, лекарственные средства с разными молекулярными размерами могут поступать в разные, подходящие по размерам пустоты внешнего слоя имплантата. По потребности пустоты или их отверстия на поверхности слоя можно делать маленькими сравнительно с компонентами, которые обычно находятся в жидкостях организма, такими как кровь, в особенности протеины, с таким расчетом, чтобы не происходило растворения или вымывания (происходящего в противном случае) лекарственного средства, находящегося в пустотах, макромолекулярными компонентам крови или подобными веществами, поскольку они не могут проникнуть в пустоты. Расположение пустот во внешнем слое основы делает возможным создать относительно тонкую структуру с соответственно меньшей склонностью к сегментированию, то есть структуру с наиболее подходящими механическими свойствами. Образование пустот на определенных местах с относительно маленькой поверхностью сравнительно с величиной всей поверхности внешнего слоя дает такое преимущество, что механические свойства внешнего слоя, в основном, зависят только от материала внешнего 6 слоя, а не от лекарственных или подобных средств в пустотах. Соответственно оказывается возможным сочетание, с одной стороны, именно в случае стентов, внешнего слоя, оптимального относительно высокой механической нагрузки,и, с другой стороны, лекарственного средства,оптимального относительно лечения. В принципе, пустоты могут быть соединены между собой. Однако, принимая во внимание маленькую высоту, точнее толщину внешнего слоя, предпочтительным является формирование пустот отдельно одна от другой. В частности, в случае раздельно сформированных пустот возможно размещать в пустотах лекарственное средство или несколько лекарственных средств либо с разной концентрацией, либо в разных количествах, либо с разными условиями выделения, чтобы, например,достичь желаемого неоднородного распределения дозы во времени и/или пространстве, например с повышенной дозой на концах стента. Введение лекарственного средства, и/или комплексообразующих веществ, или связующих компонентов в пустоты происходит преимущественно посредством того, что пустоты внешнего слоя вакуумируют, а потом добавляют лекарственное средство, или комплексообразующие вещества, или связующие компоненты, которое(ые) затем поглощаются пустотами или всасываются в них. При необходимости этот процесс повторяется, например, для пустот в заданных областях поверхности, в особенности в конечных областях имплантата для того, чтобы достичь локального повышения количества поглощенного лекарственного средства. Альтернативно или дополнительно введение лекарственного средства или связующих компонентов в пустоты можно производить с помощью ультразвука, что при погружении имплантата в средство, которое вводится, позволяет удалить имеющиеся в пустотах воздух или другие газы. Еще один аспект данного изобретения заключается в том, чтобы по потребности зафиксировать или связать лекарственное средство или лекарственные средства в пустотах, например, ионами посредством водородного мостика,с помощью комплексообразующих веществ,посредством сил Ван дер Ваальса или им подобных, для достижения желаемого выделения или высвобождения лекарственного средства или средств. Также возможны связи, которые химически или ферментативно расщепляются или разрушаются в биологических системах и тем самим вызывают выделение. Желаемые свойства пустот могут быть достигнуты относительно легко путем химической модификации стенок пустот, в особенности тем, что на поверхности стенок химически фиксируются пригодные для действующего лекарственного средства связующие компоненты. 7 Наконец, необходимо указать на то, что предложенный имплантат может иметь также пустоты во внешнем слое, которые открываются наружу, причем размер пустот может быть выбран таким образом, чтобы клетки или части клеток тканей тела, которые граничат с имплантатом, могли бы врастать в пустоты и, таким образом, например, может быть достигнуто очень надежное крепление имплантата в теле. Кроме того, существует возможность покрыть внешний слой или отверстия пустот покровным слоем в качестве защитного. Этот покровный слой может быть нанесен очень тонким, так как, в основном, служит только для того, чтобы достичь желаемых свойств поверхности или покрытия материалов внешнего слоя. Покровный слой может, в зависимости от конкретного применения, например, быть образован таким образом, чтобы в организме, например, под действием температуры тела, искусственного нагревания, химического или ферментативного влияния жидкостей или специфических субстанций организма он мог распадаться или растворяться с поверхности внешнего слоя,или он может быть проницаемым для адсорбированных пустотами лекарственных средств. В частности, покровный слой может формироваться, как описанное в патенте ЕР-А-0 875 218 покрытие пористого материала. В специальном случае использования радиоактивных материалов в качестве лекарственных средств важный аспект данного изобретения состоит в том, что радиоактивные материалы применяются не на большой площади, а локализуются лишь на отдельных участках или распределяются во внешнем слое основы. Внешний слой может быть, в принципе, образован поверхностным слоем, то есть верхней частью основы или, в частности, нанесенным на поверхность основы слоем или покрытием. Таким образом, пустоты или их отверстия на поверхности слоя можно делать маленькими по сравнению с компонентами, которые обычно находятся в жидкостях тела, таких как кровь, в особенности протеинов, с таким расчетом, чтобы при нанесении радиоактивного материала на большую поверхность было невозможно растворение или вымывание радиоактивного материала макромолекулярными компонентами крови, которое обычно имеет место, благодаря тому, что последние не могут проникнуть в пустоты. Еще одно преимущество пустот состоит в создании стенками пустот очень большой внутренней поверхности. Эта внутренняя поверхность представляет собой поверхность, существенным образом большую, чем внешняя поверхность внешнего слоя, и обеспечивает тем самым более прочное и надежное соединение большего количества радиоактивного материала, чем традиционные многослойные конструкции. 8 Следующее преимущество размещения радиоактивного материала в пустотах состоит в разной, в зависимости от потребности, концентрации радиоактивного материала для того,чтобы достичь желаемого неоднородного в пространственном отношении распределения дозы,например повышенной дозы на концах стента,путем заполнения пустот в некоторых областях поверхности различным количеством радиоактивного материала. Пустоты преимущественно образованы, в основном, в форме трубок и проходят от поверхности внешнего слоя, главным образом,вертикально вглубь внешнего слоя, причем поперечное сечение пустот и/или их отверстий преимущественно задано такого маленького размера, чтобы, по меньшей мере, большинство обычных протеинов, которые находятся в крови,из-за своего молекулярного размера не могли проникнуть в пустоты, в особенности, если те заполнены лишь частично. Благодаря этому радиоактивный материал, который находится в пустотах, не может быть вынесен кровью. Использование оксидного слоя, в особенности из оксида алюминия, в качестве внешнего слоя дает дополнительное преимущество, такое,что оксидный слой в жидкости подвергается своего рода расширению, которое ведет к закрытию или дальнейшему уменьшению площади отверстий пустот во внешнем слое, и тем самым еще более затрудняется или предотвращается проникновение относительно больших протеинов, которые содержатся в крови. Понятно, что это расширение должно учитываться,если отверстия, например, при желательном выделении некоторого лекарственного средства уже не должны закрываться. Введение радиоактивного материала и/или комплексообразующих веществ в пустоты может преимущественно проходить благодаря тому, что пустоты вакуумируются, и затем прибавляется радиоактивный материал или комплексообразующие вещества, которые потом поглощаются пустотами или квазивсасываются. По потребности этот процесс повторяется, например, для пустот в определенных областях поверхности, в особенности на концах имплантата, чтобы добиться локального повышения радиоактивности. Следующий, независимый аспект данного изобретения состоит в фиксации радиоактивного материала, то есть заданного количества радионуклида или разных радионуклидов, преимущественно в пустотах с помощью комплексообразующих веществ, таких как амины, фосфины, карбоксилаты и/или тиолы. В частности,в качестве комплексообразующих веществ предусмотрены тиолы и, например, технеций и рений как радиоактивный материал, так как соединения технеция (V) и рения (V) с сернистыми лигандами образовывают металлокомплексы, которые демонстрируют чрезвычайно высо 9 кую стабильность in vivo. Радиоактивная медь в качестве другого примера, связывается, наоборот, лучше с помощью карбоксилата. С помощью комплексообразующих веществ, прежде всего, радиоактивные катионы (металлы) очень крепко связываются химически, в особенности в пустотах или порах внешнего слоя. Сами комплексообразующие вещества при этом фиксируются или образуются преимущественно на стенках пустот, в частности, за счет силанизации так, что комплекс полностью фиксируется на поверхности или во внешнем слое носителя. Альтернативно может быть предусмотрено также соединение радиоактивных анионов (неметаллов), например йода, с помощью образования комплекса с соответствующими комплексообразующими веществами или соответствующими связующими компонентами, например зафиксированными в пустотах такими металлами, как благородные металлы, в частности серебром. Еще один независимый важный аспект этого изобретения состоит в том, что разные радионуклиды с соответствующими периодами полураспада и излучениями, такие как 186Re(T1/2=90 ч, Еmах=1,071 Me) и 188Re (T1/2=16,7 ч,Еmах=2,116 Me), используются в смеси в определенных количествах и соотношениях. Таким образом, может быть достигнуто применение оптимального распределения дозы, как в пространственном, так и во временном отношении. Фиксация разных радионуклидов возможна благодаря формированию пустот для поглощения радионуклидов, так как механические свойства радионуклидов или образованных радионуклидами соединений из-за относительно малой протяженности пустот играют во всех случаях незначительную роль в механических свойствах внешнего слоя, так что даже обычно неприменимые для больших по площади покрытий радионуклиды или их соединения поглощаются пустотами и фиксируются там. Кроме того, существует возможность покрытия внешнего слоя или отверстия пустот покровным слоем, например, из золота в качестве защитного слоя. Этот покровный слой может быть нанесен очень тонко, так как, в основном,он служит только для того, чтобы достичь желаемых свойств поверхности, или для покрытия материала внешнего слоя, причем в противоположность прототипу предотвращение контакта крови с радиоактивным материалом имеет вторичное значение, поскольку радиоактивный материал в пустотах химически зафиксирован и,таким образом, уже и без того защищен пустотами. Кроме этого, может быть достигнута существенным образом лучшая адгезия покровного слоя с внешним слоем благодаря возможности произвольного выбора материала, так как на механические и химические свойства внешнего 10 слоя используемые радиоактивные материалы уже существенным образом не влияют. Далее это изобретение будет подробнее разъяснено с помощью фигур изображения лучших вариантов воплощения изобретения. На них показаны на фиг. 1 - схематическое изображение предлагаемого имплантата, выполненного в виде стента, в нерасширенном состоянии; на фиг.2 - схематическое изображение стента согласно фиг. 1 в радиально расширенном состоянии; на фиг. 3 - схематический поперечный разрез введенного в сосуд и радиально расширенного стента согласно фиг. 2; на фиг. 4 - увеличенный фрагмент основы с прилегающим внешним слоем с несколькими пустотами имплантата; на фиг. 5 а, б, в - увеличенный фрагмент пустот внешнего слоя согласно фиг. 4 и прилегающий покровный слой и на фиг. 6, 7 - электронно-микроскопические снимки слоя из оксида алюминия при разном увеличении. Предлагаемый имплантат 1 схематично показан на фиг. 1-3. Имплантат 1 имеет в представленных примерах воплощения форму стента, то есть трубообразной вставки для сосудов,как это показано на фиг. 1 и 2. Имплантат 1 или стент имеет преимущественно металлическую или металлизированную основу 2. Конструкция основы 2 позволяет ему деформироваться так, что стент может быть расширен в радиальном направлении. Фиг. 1 показывает стент в нерасширенном состоянии. Фиг. 2 - в радиально расширенном. Фиг. 3 показывает стент в радиально расширенном состоянии в сосуде 3, причем стент или имплантат 1 прилегает своей внешней стороной к внутренней стороне стенки сосуда и,таким образом, поддерживает, например, расширенный сосуд изнутри. Сосуд представляет собой телесную ткань, которая находится в контакте с основой 2. Кроме того, основа 2 или имплантат 1 находятся в контакте с жидкостями организма, такими как, например, кровь, которая протекает через сосуд и стент. В основу 2 помещается лекарственное средство или медикамент 5, которое фиксируется на или в основе, как это показано на схематическом увеличенном фрагменте поверхности основы 2 с прилегающим, частично удаленным внешним слоем 6 согласно фиг. 4. Относительно лекарственного средства 5, для него справедлива ссылка на вышеприведенное определение. Внешний слой 6 нанесен здесь преимущественно на всю поверхность 7 основы 2, например, с помощью электролитического осаждения и оксидирования или плазмового напыления. Альтернативно внешний слой 6 мог бы быть образован также поверхностным слоем основы 11 2, в зависимости от материала основы 2 и желательного состава и структуры внешнего слоя 6. Внешний слой 6 на своей противоположной от основы 2 поверхности 8 содержит множество рассредоточенных, отделенных друг от друга отверстий 9, сообщающихся с пустотами 10. Лекарственное средство 5, на котором более подробно остановимся позже, содержится и при необходимости химически фиксируется в пустотах 10, что будет разъяснено позже с помощью фиг. 5 а. Пустоты 10 образованы здесь, в основном,в форме трубок и, если необходимо, закрыты на концах. Они проходят от поверхности 8 внешнего слоя 6, в основном, нормально к основе 2. В частности, пустоты 10 не доходят ни до поверхности 7 основы 2, ни вглубь основы 2, а каждая из них заканчиваются "глухим" концом во внешнем слое 6, и они отделены с помощью изолирующей прослойки 11 внешнего слоя 6 от поверхности 7 основы 2. Тем самым достигается, как минимум, дальнейшая герметизация всей поверхности 7 основы 2 от тканей и жидкостей организма. При этом важна высокая химическая стабильность внешнего слоя 6 в организме. Пустоты 10 образованы здесь, в основном,в виде круговых цилиндров. Они, однако, могут иметь также и многоугольное поперечное сечение или поперечное сечение неправильной формы. Пустоты 10 размещаются здесь, в основном,параллельно друг другу и разделены, не сообщаясь друг с другом. Это, однако, не является обязательным требованием: при необходимости пустоты 10 во внешнем слое 6 могут сообщаться между собой. Внешний слой состоит преимущественно из оксида алюминия, который, в основном, наносится осаждением или формируется электролитическим способом на поверхности основы 2. При электролитическом оксидировании диаметр отверстий 9 или пустот 10 может быть очень просто изменен с помощью соответствующего регулирования приложенного напряжения. При этом получают диаметры приблизительно от 1,2 до 1,4 нм на 1 В анодного напряжения. Альтернативно внешний слой 6 или неокисленный материал внешнего слоя, такой как алюминий, может быть, например, нанесен на поверхность 7 основы 2 с помощью плазменного напыления и потом, при необходимости, оксидирован. Этот способ имеет особое преимущество в том случае, если необходимо получить покрытие только с внешней стороны; однако,таким способом возможно наносить покрытие также и на внутренние поверхности. Изготовление внешнего слоя 6 не ограничивается, однако, приведенными выше примерами: например, возможно также оксидирование соответствующего поверхностного слоя основы 2. Далее, материал для внешнего слоя 6 не ограничивается оксидом алюминия, а может быть, например, заменен оксидом магния и/или 12 титана. Больше того, кроме оксидов для образования внешнего слоя 6 могут применяться, в частности, и керамические материалы; существенными параметрами являются механические свойства внешнего покрытия 6, которое получается в результате, и заданная структура пустот 10 для поглощения лекарственного средства 5. Схематично представленный на фиг. 5 а увеличенный разрез пустот 10 наглядно показывает возможную фиксацию лекарственного средства 5 в пустотах 10 внешнего слоя 6. Стенка 12 пустоты 10 содержит, например, компоненты реакции, такие как комплексообразующие вещества 13, которые, например, с помощью силанизации в пустотах 10 связываются с их стенками. Вместо комплексообразующих веществ 13,приведенных в качестве примера на фиг. 5 а,стенки 12 пустот 10 могут быть снабжены, если необходимо, другими связующими компонентами, которые обеспечивают желаемое связывание лекарственного средства 5. Альтернативно лекарственное средство 5, по меньшей мере,поглощается пустотами 10, не будучи там связанным или зафиксированным. В частности, при необходимости, в этом случае, а в других случаях, как правило, желательно предусмотреть на поверхности 8 внешнего слоя 6 покровный слой 14, который также покрывает пустоты 10 и их отверстия 9. Покровный слой 14 служит, в частности,для того, чтобы препятствовать преждевременной утечке или выделению лекарственного средства 5 из пустот 10 до имплантирования имплантата. Однако покровный слой 14, в особенности, если в случае лекарственного средства 5 речь идет о радиоактивном материале, может быть также препятствием для непосредственного контакта тканей и/или жидкостей организма с лекарственным средством 5. Поскольку общая поверхность отверстий 9 преимущественно меньшая, существенно меньшая, чем контактная площадь поверхности 8 внешнего слоя 6 с покровным слоем 14, то покровный слой 14 может, в зависимости от избранного материала для внешнего слоя 6 и покровного слоя 14 и независимо от лекарственного средства 5, очень хорошо держаться на внешнем слое 6. Стенки 12 пустот 10 образовывают существенно большую внутреннюю поверхность, чем поверхность 8 внешнего слоя 6, в особенности, при желательной фиксации лекарственного средства в пустотах 10. Существенным является то, что внешний слой 6 и предусмотренный при необходимости покровный слой 14 сформированы так и их размеры заданы таким образом, чтобы их повреждение, например, при радиальном расширении стента было надежно предотвращено. Для этого лучше избрать толщину внешнего слоя 6 преимущественно меньшей, чем 1,5 мкм, желательно не более 200 нм и в частности от 30 до 13 150 нм. Однако толщина внешнего слоя может достигать, например, и 150 мкм, в частности,для увеличения поглощающего объема в пустотах. На фиг. 5 б показана альтернативная форма конструкции с модифицированными пустотами 10 в соответствующем фиг. 5 а фрагменте разреза. Здесь пустоты 10 имеют в сечении, перпендикулярном плоскости внешнего слоя 6, бутылкообразную форму, или, соответственно, суженный участок 15 в области отверстия 9, затем переходный участок 16, который прилегает к участку 15 и имеет поперечное сечение, увеличивающееся в направлении, противоположном отверстию 9, и, наконец, прилегающий к нему конечный участок 17 с наибольшим поперечным сечением или диаметром. В этом примере конструкции отрезок 15 с уменьшенным поперечным сечением или диаметром ограничивает норму или скорость вывода, с которой лекарственное средство 5 выделяется из пустот 10 в имплантированном состоянии при отсутствующем или проницаемом покровном слое 14. В зависимости от выбора размеров пустот 10 (посредством изменения напряжения при электролитическом анодировании) может быть достигнута желаемая скорость выделения. При необходимости последовательность представленных в качестве примера на фиг. 5 б участков 15-17 пустот 10 может быть изменена на противоположную так, что участок 17, который имеет наибольший диаметр или поперечное сечение, открывается на поверхности 8, чтобы достичь сначала очень высокой, а потом уменьшенной нормы выделения. В каждом случае может быть установлено с помощью формы или размеров пустот 10 желаемое временное и, при необходимости, пространственное распределение дозы лекарственного средства 5, которое выделяется или высвобождается. Существенной при этом является определенная структура пустот 10. На фиг. 5 б, например, показано, что пустотами 10 поглощено одно лекарственное средство 5. При необходимости пустотами могут поглощаться также разные лекарственные средства 5, например, послойно, чтобы достичь последовательного вывода разных лекарственных средств 5. Альтернативно или дополнительно разные лекарственные средства 5 могут быть помещены, например, в различным образом сконфигурированных и/или снаряженных разными связующими компонентами пустотах 10 внешнего слоя 6, чтобы можно было получить, в случае необходимости, одновременное выделение разных лекарственных средств 5 в желаемых дозах. Фиг. 5 в показывает в соответствующем фиг. 5 а и 5 б изображении другой пример изготовления имплантата 1 с иначе модифицированными пустотами 10 для объяснения различных возможностей его реализации. В этом случае 14 пустоты 10 имеют, в меру необходимости, один,первый, открывающийся на поверхности 8 внешнего слоя 6 участок 18, и много участков 19, которые прилегают к участку 18 на конце,противоположном отверстию 9; они существенным образом уменьшены в диаметре или поперечном сечении сравнительно с участком 18. Участки 19 в виде корешков примыкают к участкам 18 пустот 10 и вследствие их уменьшенного диаметра или поперечного сечения по сравнению, например, с участками 18 обеспечивают замедленное выделение или высвобождение поглощенного лекарственного средства 5 в сравнении с выделением или выводом участками 18. В случае необходимости участки 18 и 19 пустот 10 могут быть снаряжены или наполнены также разными лекарственными средствами 5; причем и длины отрезков 18 и 19, то есть их длина в направлении, перпендикулярном к основному уровню или к поверхности 8 внешнего слоя 6, любого в отдельности и всех в целом,также могут быть подобраны для достижения желаемых параметров выделения. Чтобы было возможным достижение достаточно высокой дозы, необходимо определенное количество лекарственного средства или средств 5, поглощаемого пустотами 10. Желательно предусмотреть около 108-1011 пустот на см 2 поверхности 8 внешнего слоя 6. На фиг. 6 и 7 представлены электронномикроскопические снимки поверхности слоя из оксида алюминия при разном увеличении. Отчетливо видно, что трубообразные пустоты, которые показаны светлым, равномерно распределены и размещены в слое оксида алюминия. Соответственно примеру наилучшего воплощения изобретения радиоактивный материал в качестве лекарственного средства 5 поглощается в пустотах 10 и, в частности, фиксируется там. Схематическое увеличенное изображение пустоты 10 на фиг. 5 а наглядно демонстрирует фиксацию радиоактивного материала в пустотах 10 внешнего слоя 6. Стенка 12 пустоты 10 снаряжена компонентами реакции или комплексообразующими веществами 13, преимущественно тиолами или карбоксилатами, которые, например, связаны в пустотах 10 или на их стенках с помощью силанизации и которые, например,посредством меркаптогрупп связывают или фиксируют радиоактивный материал в пустотах. Например, радиоактивный материал содержит радиоактивный технеций и/или рений,причем, в частности, соединения технеция (V) и/или рения (V) образованы с лигандами, которые содержат серу и которые имеют чрезвычайно высокую стабильность in vivo. Соответственно другому примеру радиоактивный материал фиксируется (поли-)карбоксилатами в пустотах 10 в форме 86Y, 90Y, 89Sr, 153Sm, 64 Сu, 67 Сu и/или 105Rh, причем карбоксилаты, со своей сто 15 роны, связаны в пустотах 10 преимущественно с помощью силанизации. Однако также и другие радионуклиды и,например, анионы, такие как йод, могут быть зафиксированы в пустотах 10 как радиоактивный материал, и, в частности, химически связаны с помощью подходящих компонентов реакции, например благородных металлов, в частности серебра. Как дальнейший пример можно привести связывание с помощью серебра в пустотах 10 введенного в жидком состоянии радиоактивного материала 5 в форме 120I, 123I, 124I, 125I,131I и/или 211At, причем серебро, со своей стороны, связано, например, посредством (поли-)карбоксилатов, которые, в свою очередь, связаны в пустотах 10 с помощью процесса силанизации. Предпочтительным является содержание в радиоактивном материале разных радионуклидов в таком заданном соотношении, при котором вследствие различных свойств радионуклидов достигается доза, оптимальная в пространственном и временном отношении. Это можно осуществить относительно просто в случае предложенного введения радиоактивного материала в пустоты 10, так как, например, разные радиоизотопы и/или разные радионуклиды с разными периодами полураспада, энергиями и/или видами излучения (, +, -, ) вводятся у пустоты, например, в виде смеси и там могут быть зафиксированы, например, с помощью соответственно подобранного комплексообразующего вещества 13. Как альтернатива, в пустоты 10 могут быть введены друг за другом разные радионуклиды,то есть, например, послойно, и зафиксированы с помощью соответствующего или, например,селективного комплексообразующего вещества 13. Альтернативно или дополнительно можно заполнить пустоты 10 радиоактивным материалом не полностью, а, например, добавить дополнительный наполнитель для стабилизации и/или закрытия отверстий 9 при лишь частичном заполнении радиоактивным материалом 5. Кроме того, уже упоминалось возможное разное наполнение пустот 10 радиоактивным материалом для модификации распределения дозы . В частности, диаметр пустот 10 и/или отверстий 9 выбирают таким образом, чтобы компоненты крови или обычно присутствующие в крови молекулы, которые имеют относительно большие размеры, не могли проникнуть сквозь отверстия 9 к пустотам 10 вследствие своих значительных размеров. Это можно надежно обеспечить при диаметрах отверстий 9 приблизительно от 5 до, максимум, 100 нм. Чтобы можно было достичь довольно высокой дозы, необходимо определенное количество радиоактивного материала, который поглощается пустотами 10. Лучше всего преду 003260 16 смотреть от около 108 до 1011 пустот на см 2 поверхности 8 внешнего слоя 6. В заключение, необходимо указать на то,что предлагаемое размещение радиоактивного материала в пустотах 10 предлагаемого внешнего слоя 6 не ограничивается имплантатами, а также может применяться в случаях других встраивающихся элементов или радиоактивных излучателей с желаемыми радиоактивными свойствами. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Имплантат (1) с основой (2), в частности, из металла, и, по крайней мере, с одним лекарственным средством (5), в котором основа(2) содержит, по крайней мере, частично сформированный внешний слой (6), преимущественно расположенный в областях, которые в особенности контактируют с тканями и/или жидкостями организма, и который имеет множество пустот (10), образованных путем электролитического оксидирования, с отдельными отверстиями (9), открытыми в сторону поверхности(8) внешнего слоя (6), для поглощения, по крайней мере, одного лекарственного средства (5),отличающийся тем, что внешний слой (6), по крайней мере, в основном, состоит из полученных электролитическим оксидированием оксида алюминия, оксида магния, оксида тантала, оксида железа и/или оксида вольфрама, при этом отверстия (9) имеют средний диаметр, не превышающий 100 нм. 2. Имплантат по п.1, отличающийся тем,что толщина внешнего слоя (6) составляет, по крайней мере, в основном, не более 1,5 мкм,преимущественно не более 200 нм и, в частности, приблизительно от 30 до 150 нм. 3. Имплантат по п.1 или 2, отличающийся тем, что внешний слой (6) содержит изолирующую прослойку (11), непроницаемую, в частности, для жидкостей организма, которая преимущественно покрывает всю поверхность (7) основы (2). 4. Имплантат по любому из предшествующих пунктов, отличающийся тем, что пустоты(10) сформированы, по крайней мере, в основном, равномерно и имеют, по крайней мере, в основном, удлиненную форму, в частности трубообразную, и закрыты, по крайней мере, с одного конца. 5. Имплантат по любому из предшествующих пунктов, отличающийся тем, что пустоты(10), по крайней мере, в основном, проходят параллельно одна другой. 6. Имплантат по любому из пп.1-4, отличающийся тем, что пустоты (10), по крайней мере, в основном, проходят перпендикулярно к поверхностям (7, 8) внешнего слоя (6) и/или основы (2). 7. Имплантат по любому из предшествующих пунктов, отличающийся тем, что любая из 17 пустот (10) содержит участки с разными или увеличивающимися, и/или уменьшающимися поперечными сечениями и/или является разветвленной. 8. Имплантат по любому из предшествующих пунктов, отличающийся тем, что отверстия(9) распределены, по крайней мере, на части поверхности (8) внешнего слоя (6) с поверхностной плотностью от 108 до 1011 шт/см-2. 9. Имплантат по любому из предшествующих пунктов, отличающийся тем, что сумма площадей поперечного сечения отверстий (9) составляет не более 50% площади поверхности(8) внешнего слоя (6). 10. Имплантат по любому из предшествующих пунктов, отличающийся тем, что отверстия (9) имеют, по крайней мере, в основном,одинаковый минимальный и/или максимальный диаметр. 11. Имплантат по любому из предшествующих пунктов, отличающийся тем, что пустоты (10) имеют поперечное сечение со средним диаметром, равным не более 100 нм, преимущественно не более 50 нм, в частности 25 нм или меньше. 12. Имплантат по любому из предшествующих пунктов, отличающийся тем, что отверстия (9) имеют площадь, определяемую средним диаметром, не превышающим 50 нм, в частности 25 нм или меньше. 13. Имплантат по любому из предшествующих пунктов, отличающийся тем, что он выполнен в форме стента. 14. Имплантат по любому из предшествующих пунктов, отличающийся тем, что лекарственное средство (5) химически зафиксировано или связано, по крайней мере, частично со стенками (12) пустот (10), в частности, с помощью комплексообразующих веществ (13). 15. Имплантат по любому из предшествующих пунктов, отличающийся тем, что лекарственное средство (5) связано или зафиксировано в пустотах (10) таким образом, что оно выделяется из имплантата (1) в имплантированном состоянии при превышении заранее заданной температуры и/или под действием специфических тканей и жидкостей организма, ферментов или активирующих материалов, под влиянием другой активации, в частности лазерной или ультразвуковой. 16. Имплантат по любому из предшествующих пунктов, отличающийся тем, что он содержит, по крайней мере, два лекарственных средства (5), поглощенных пустотами (10) таким образом, что средства (5) высвобождаются последовательно, и/или с разной скоростью,и/или в разных количествах в имплантированном состоянии. 17. Имплантат по любому из предшествующих пунктов, отличающийся тем, что он содержит в качестве лекарственного средства 18 жится, преимущественно, заранее определенное количество, по крайней мере, одного радионуклида. 18. Имплантат по п.17, отличающийся тем,что радиоактивный материал химически связан со стенками (12) пустот (10), в частности, с помощью комплексообразующих веществ (13),таких как тиолы. 19. Имплантат по п.17 или 18, отличающийся тем, что радиоактивный материал содержит радиоактивный рений и/или технеций, которые зафиксированы в пустотах, в частности, с помощью сульфидных групп. 20. Имплантат по пп.17-19, отличающийся тем, что радиоактивный материал содержит разные, в частности имеющие разные периоды полураспада, виды и энергию излучения радионуклиды в заранее определенных количествах или соотношениях. 21. Имплантат по любому из предшествующих пунктов, отличающийся тем, что внешний слой (6) или отверстия (9) покрыты или закрыты верхним покровным слоем (14), преимущественно из золота, по крайней мере, до его отделения от поверхности внешнего слоя (6) или растворения в организме. 22. Способ изготовления имплантата, описанного в любом из пп.1-21, отличающийся тем,что имплантат (1) помещают в вакуум для опустошения пустот (10) и затем в пустоты (10) через отверстия (9) вводят лекарственное средство(5) и/или связующее вещество (13), которое фиксирует лекарственное средство (5) в пустотах (10), в частности, путем погружения имплантата (1) в лекарственное средство (5) или связующее вещество (13), после чего давление нормализуют. 23. Способ изготовления имплантата, описанного в любом из пп.1-21, отличающийся тем,что вводят в пустоты (10) лекарственное средство (5) и/или связующее вещество (13), которое фиксирует лекарственное средство в пустотах(10) с помощью ультразвуковой обработки, в частности, когда имплантат (1) погружен в лекарственное средство (5) или в связующее вещество (13). 24. Способ изготовления имплантата, описанного в любом из пп.1-21, отличающийся тем,что пустоты (10), соответственно их стенки (12) покрывают комплексообразующими средствами(13) или реакционными компонентами, которые химически связывают лекарственное средство(9) вводят лекарственное средство (5). 25. Способ изготовления имплантата по п.24, отличающийся тем, что радиоактивный материал как лекарственное средство (5) фиксируют в пустотах (10) путем формирования комплексов и/или химических связей и/или покрытия отверстий (9) или внешнего слоя (6) покровным слоем (14), например, из золота. 19 26. Применение имплантата по пп.1-21 для закладывания в пустоты (10) точного количества лекарственного средства (5), фиксирования его в пустотах (10) по потребности и/или для 20 его вывода в имплантированном состоянии при заранее заданных условиях с желаемой скоростью выведения.
МПК / Метки
МПК: A61L 31/14
Метки: средства, имплантат, полостями, лекарственные, содержащими
Код ссылки
<a href="https://eas.patents.su/12-3260-implantat-s-polostyami-soderzhashhimi-lekarstvennye-sredstva.html" rel="bookmark" title="База патентов Евразийского Союза">Имплантат с полостями, содержащими лекарственные средства</a>
Предыдущий патент: Система для управления вращающимся устройством
Следующий патент: Способ реакционной кристаллизации для улучшения размера частиц