Предварительно спрессованные быстро распадающиеся лекарственные формы соединений с низкой пероральной биодоступностью
Номер патента: 19147
Опубликовано: 30.01.2014
Авторы: У Юй-Сань, Кет Алдо В., Кейл Хенни, Ван Томме Софи Р., Мешвитцер Ян П., Дусбюрг-Девит Люсия Мария
Формула / Реферат
1. Твердая фармацевтическая лекарственная форма для орального введения, содержащая (1) активный фармацевтический ингредиент, (2) гидронабухающий полимер, выбранный из гидроксипропилметилцеллюлоз НРМС Е5 и НРМС Е6, микрокристаллической целлюлозы и поливинилпирролидона K12, и (3) предварительно спрессованный гранулят сшитого поливинилпирролидона.
2. Лекарственная форма по п.1, где указанный предварительно спрессованный гранулят получен посредством приложения сжимающего усилия к сшитому поливинилпирролидону.
3. Лекарственная форма по п.2, где указанное сжимающее усилие обеспечивается устройством, выбранным из фрикционных роликов, вальцового или брикетирующего прессов, экструдеров, кольцевых матричных прессов и гранулирующих прессов.
4. Лекарственная форма по любому из пп.1-3, где указанный активный фармацевтический ингредиент находится в форме наночастиц.
5. Лекарственная форма по любому из пп.1-4, дополнительно содержащая один или более эксципиентов, усиливающих проницаемость.
6. Лекарственная форма по любому из пп.1-4, дополнительно содержащая поверхностно-активное вещество.
7. Лекарственная форма по любому из пп.1-4, дополнительно содержащая один или более эксципиентов, усиливающих проницаемость, и поверхностно-активное вещество.
8. Лекарственная форма по п.6 или 7, где указанное поверхностно-активное вещество выбирается из додецилсульфата натрия и витамина Е TPGS 1000.
9. Способ получения лекарственной формы по п.1, включающий стадии:
(ia) получения раствора гидронабухающего полимера, выбранного из гидроксипропилметилцеллюлоз НРМС Е5 и НРМС Е6, микрокристаллической целлюлозы и поливинилпирролидона K12, посредством нагрева воды с последующим добавлением гидронабухающего полимера при перемешивании до получения гомогенной суспензии, которой дают охладиться,
(ib) растворения активного фармацевтического ингредиента и слабой кислоты в поверхностно-активном веществе посредством перемешивания и нагрева,
(ic) смешивания раствора, полученного на стадии (ia), с раствором, полученным на стадии (ib), и распылительной сушки смеси или
(id) растворения активного фармацевтического ингредиента и гидронабухающего полимера в растворителе и удаления растворителя упариванием с получением аморфной дисперсии,
(ii) прессования сшитого поливинилпирролидона в таблетку,
(iii) разрушения крупной таблетки до гранул,
(iv) смешивания просеянной фракции этих гранул с высушенным посредством распылительной сушки продуктом стадии (ic) или аморфной дисперсией, полученной на стадии (id),
(v) прессования таблетки из полученной смеси.
Текст
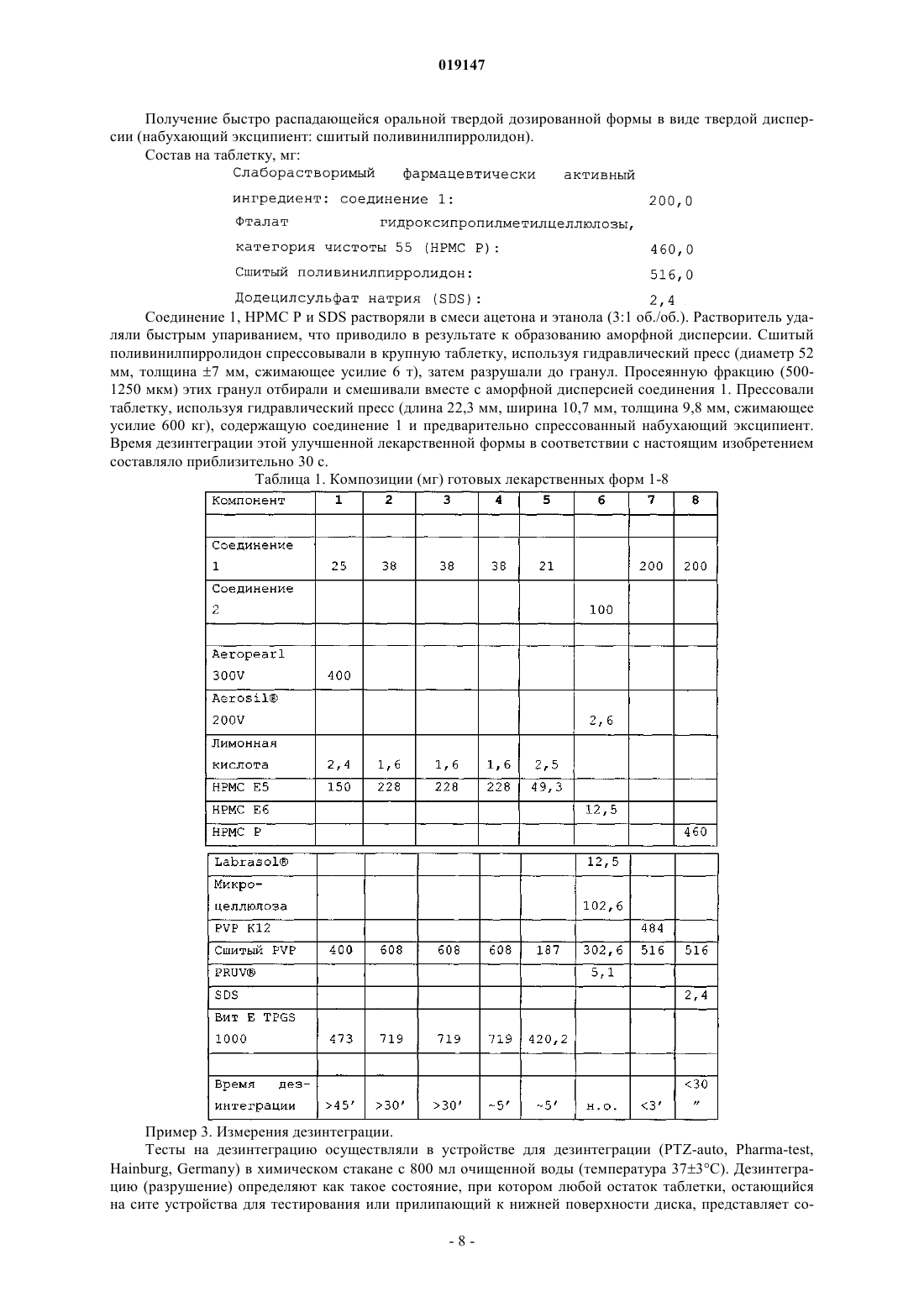
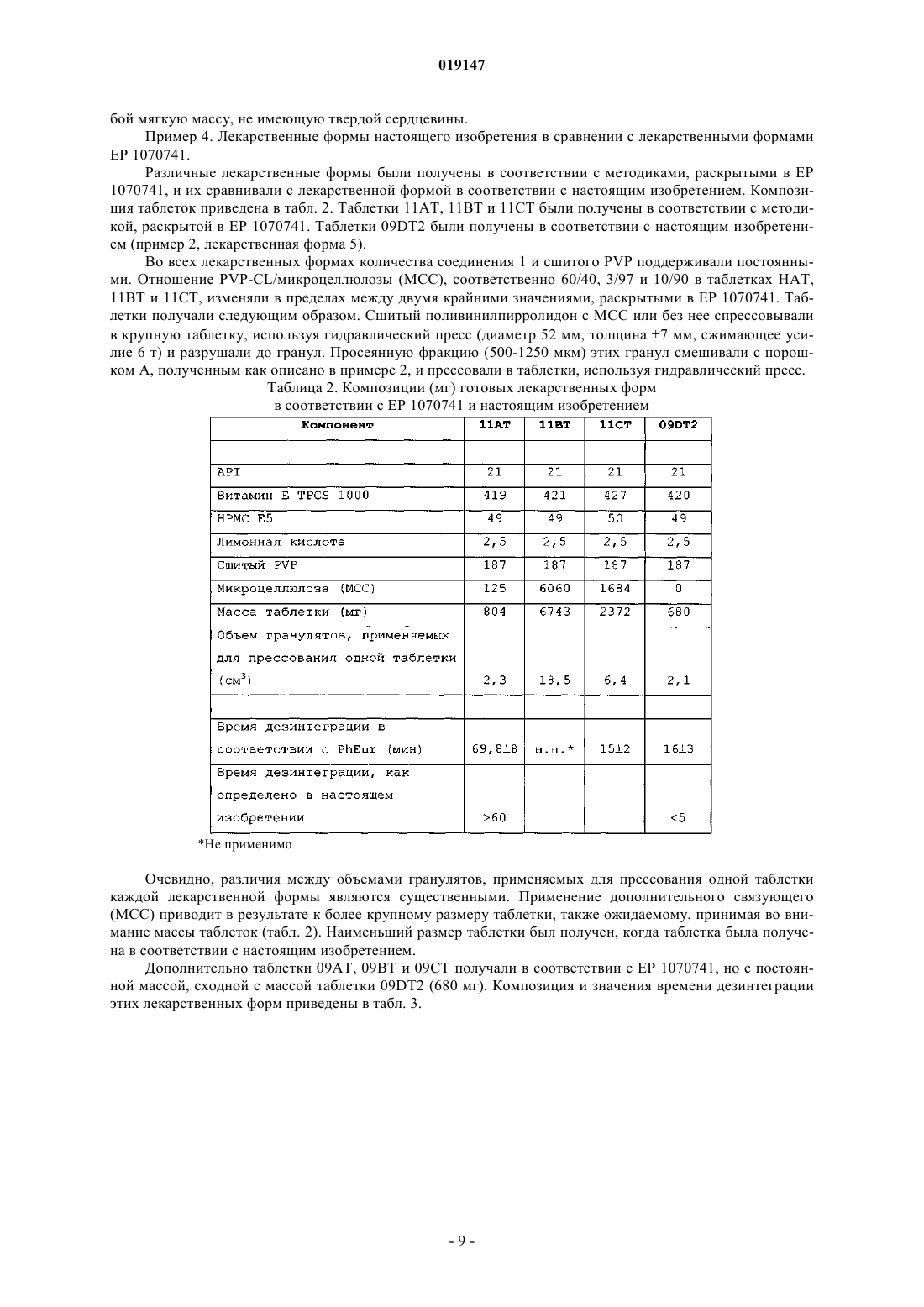
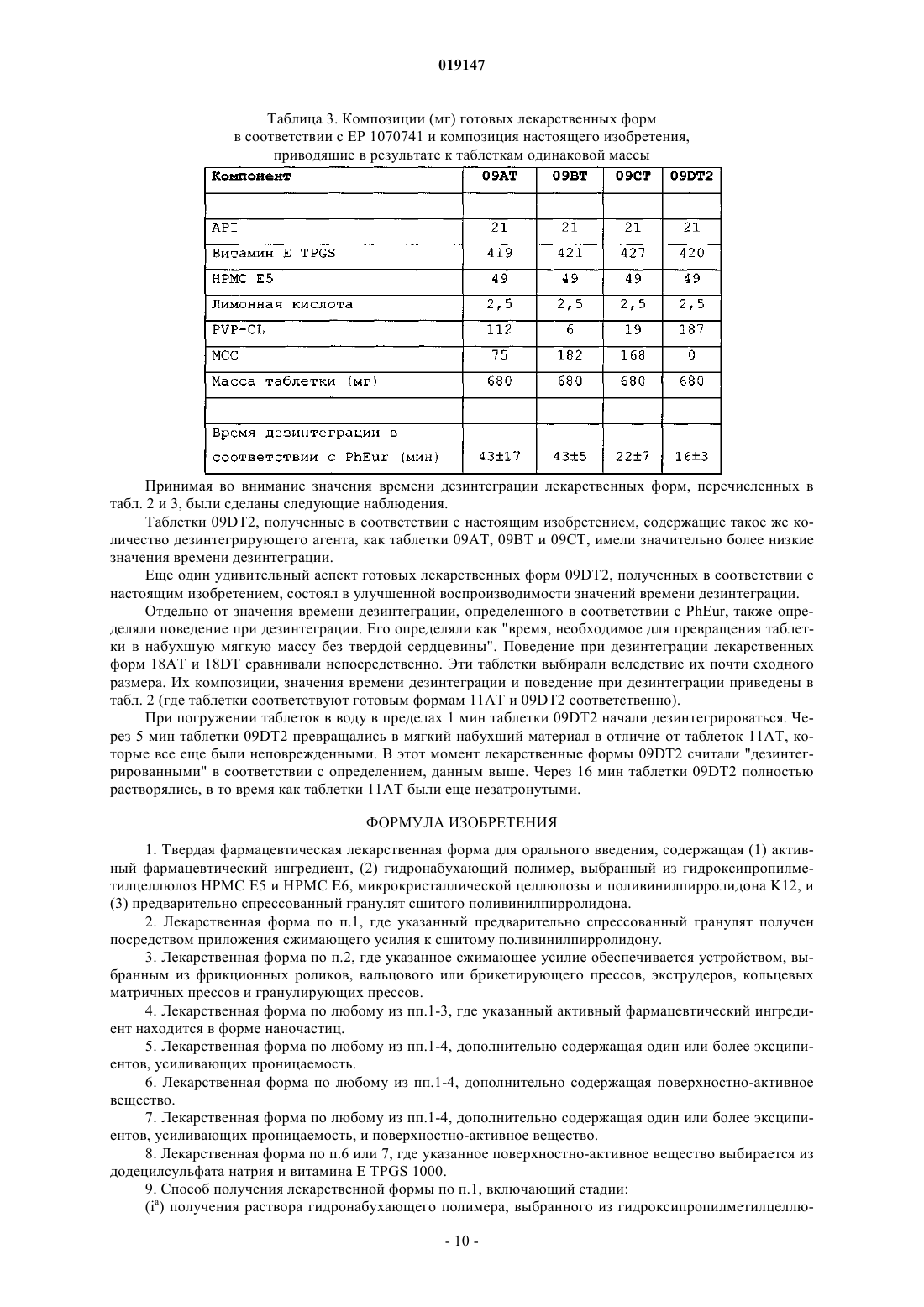
ПРЕДВАРИТЕЛЬНО СПРЕССОВАННЫЕ БЫСТРО РАСПАДАЮЩИЕСЯ ЛЕКАРСТВЕННЫЕ ФОРМЫ СОЕДИНЕНИЙ С НИЗКОЙ ПЕРОРАЛЬНОЙ БИОДОСТУПНОСТЬЮ Изобретение относится к области фармацевтической химии. Варианты осуществления настоящего изобретения относятся к предварительно спрессованным, быстро распадающимся лекарственным формам соединений с низкой пероральной биодоступностью.(71)(73) Заявитель и патентовладелец: ЭББОТТ ХЕЛТКЭА ПРОДАКТС Б.В. Изобретение относится к области фармацевтической химии. Варианты осуществления настоящего изобретения относятся к предварительно спрессованным, быстро распадающимся лекарственным формам соединений с низкой пероральной биодоступностью. Предшествующий уровень техники Многие новые молекулы лекарственных средств, появляющиеся в результате программ по разработке лекарственных средств, обладают плохой биодоступностью после орального введения. Биодоступность, в основном, определяется двумя факторами: клиренсом первого прохождения и всасыванием. На всасывание главным образом влияют растворимость соединения, его скорость растворения и/или его проницаемость. Клиренс первого прохождения является результатом как кишечного, так и печеночного клиренса (Thakker, D.R. "Strategic use of preclinical pharmacokinetic studies and in vitro models in optimizingR.T. Borchardt, E.H. Kerns, M.J. Hageman, D.R. Thakker, J.L. Stevens, AAPS press/Springer, 2006). Как следствие вышесказанного, в принципе, могут быть описаны три различных типа скрытой биодоступности. Молекула лекарственного средства может иметь низкую пероральную биодоступность,причинами которой являются (1) слабая скорость растворения, (2) плохая растворимость или (3) ограниченная скорость проницаемости. В зависимости от ситуации следуют различным стратегиям для улучшения всасывания лекарственного средства при оральном введении. Попытки улучшить скорости растворения плохо растворимых молекул лекарства включают подходы с изменением лекарственной формы, такие как микронизация, нанонизация или получение лекарственной формы молекул лекарственного средства в виде твердых дисперсий или твердых растворов. Биодоступность лекарственных соединений с ограниченной скоростью растворения может быть улучшена посредством различных методов солюбилизации, например посредством применения больших количеств поверхностно-активных веществ, циклодекстринов, мицелл, полимерных мицелл, липосом или дендримеров. Для решения проблемы низкой проницаемости в литературе предлагают много веществ, улучшающих проницаемость, включающих мукоадгезивные полимеры, модификаторы pH, усилители проницаемости и ингибиторы оттока. Вещества, улучшающие проницаемость, могут быть жидкими, полутвердыми или твердыми эксципиентами, которые добавляют к твердой дозированной форме в качестве усилителя проницаемости в случаях, где пероральная биодоступность ограничена вследствие плохой всасываемости лекарственного средства. Недавние исследования были в основном сосредоточены на разработке или улучшении новых подходов, связанных с составлением лекарственных форм для увеличения биодоступности проблематичных соединений. Несколько попыток было предпринято, чтобы также разработать конечные твердые дозированные формы, которые поддерживают или даже улучшают благоприятный профиль высвобождения лекарственного средства, полученного в виде лекарственной формы относительно усложненным образом. Для успеха выбранного метода получения лекарственной формы является существенным, чтобы благоприятные свойства лекарственной формы также поддерживались в конечной твердой дозированной форме. Один стандартный подход для уменьшения времени дезинтеграции твердых дозированных форм состоит в применении дезинтегрирующих агентов. Дезинтегрирующий агент представляет собой эксципиент, который добавляют к твердой дозированной форме, например в форме таблетки или капсулы,чтобы способствовать разрушению прессованной массы, когда ее помещают в окружение текучей среды. Это является особенно важным для продуктов с немедленным высвобождением, где требуется быстрое высвобождение лекарственного вещества. Дезинтегрирующий агент может быть добавлен в порошковую смесь для прямого прессования или инкапсулирования. Он может также использоваться с продуктами,которые гранулируют во влажном состоянии (http://www.pformulate.com/disintegrs.htm). Многие дезинтегрирующие агенты были описаны (Rowe, R.C., P.J. Shesky and S.C. Owen (editors), Handbook of Pharmaceutical Excipients, 5th Edition, Pharmaceutical Press, London, Chicago, 2006). Применение больших количеств поверхностно-активных веществ (для подходов, основанных на солюбилизации) или полимеров(например, для твердой дисперсии) может нанести значительный ущерб поведению при дезинтеграции полученных в результате твердых дозированных форм. Некоторые твердые дозированные формы становятся "камедеобразными" и никогда не растворяются или распадаются полностью. Спрессовывание лекарственных форм, содержащих наночастицы лекарственного средства, может также приводить к существенному снижению скорости растворения посредством выраженной агломерации наночастиц лекарственного средства. Этот противоположный эффект является нежелательным. Таким образом, увеличенное время дезинтеграции, являющееся следствием прессования всей лекарственной формы, может компенсировать или даже сверхкомпенсировать положительный эффект подхода, связанного с усилением биодоступности лекарственной формы. Следовательно, важным является подход, связанный с составлением лекарственных форм, для твердых дозированных форм, при которых необходима усиленная дезинтеграция. Патент США 4072535 раскрывает применение свободно текучего порошкового материала - связующее-дезинтегрирующего агента, состоящего из предварительно спрессованного порошка крахмала,специально адаптированного для применения в таблетирующих машинах с прямым прессованием для получения неломких таблеток, имеющих превосходные дезинтеграционные свойства. Патент США 6303560 раскрывает применение спрессованного гранулята дезинтегрирующего агента для улучшения дезинтеграции изделий, полученных формованием при спрессовывании. В частности,этот патент раскрывает применение спрессованного гранулята дезинтегрирующего агента для таблеток,содержащих по меньшей мере 60-99% (мас./мас.) целлюлозы, не растворимой в воде, 1-40% (мас./мас.) по меньшей мере одного полимерного связующего и 0-7% (мас./мас.) по меньшей мере одного жидкого поверхностно-активного вещества, образующего гель в воде. Цель патента США 6303560 состояла в разработке лекарственной формы для прямого прессования со следующими свойствами: свободно сыпучие однородные частицы для простого предварительного смешивания с активными ингредиентами и удобной загрузки таблетирующих машин; насыпная плотность, подходящая для обеспечения однородного спрессовывания в таблетки с высокой твердостью, низкой ломкостью и однородной дозировкой, которые остаются постоянными по размеру после таблетирования и будут выдерживать требуемые манипуляции; инертный материал, совместимый с активным ингредиентом и пригодный для орального усваивания; эффективная степень дезинтеграции и легкая доступность при низких затратах. В EP 1070741 раскрыто применение предварительно спрессованной смеси дезинтегрирующего агента и микрокристаллической целлюлозы. Этот подход имеет некоторые недостатки: относительно высокая загрузка эксципиента в конечной дозированной форме, приводящая в результате либо к большому размеру таблетки или низкой загрузке лекарственного средства. Размер мог бы быть снижен, если бы применяли чистый дезинтегрирующий агент; применение комбинации дезинтегрирующий агент-наполнитель увеличивает сложность лекарственной формы. Когда для получения смеси наполнитель-дезинтегрирующий агент применяют прессование вальцами, необходимо удалить в отходы не полностью переработанный материал, чтобы гарантировать воспроизводимый процесс. Этого бы не случилось, если бы переработке подвергали только единственный компонент, такой как чистый дезинтегрирующий агент; дополнительный материал наполнителя приводит к более крупному объему гранулята, что постепенно приводит к более медленному заполнению формы во время процесса таблетирования. Ни один из документов не описывает применение подхода, основанного на применении лекарственной формы, усиливающей биодоступность вместе с предварительно спрессованным дезинтегрирующим агентом для усиления биодоступности лекарственного соединения с низкой собственной биодоступностью. Цель настоящего изобретения заключается в предоставлении улучшенной лекарственной формы для молекул лекарственного средства с собственной низкой биодоступностью. Раскрытие изобретения Изобретение относится к предварительно спрессованным, быстро распадающимся лекарственным формам соединений с низкой собственной биодоступностью, к твердым лекарственным формам для орального введения, содержащим фармацевтически активный ингредиент, гидронабухающий полимер и предварительно спрессованный гранулят набухающего эксципиента. Дополнительные варианты осуществления предоставляют одну или более лекарственных форм, где указанный предварительно спрессованный гранулят получают посредством приложения сжимающего усилия к набухающему эксципиенту. Применимое сжимающее усилие обеспечивается устройством, выбранным из фрикционных роликов, вальцового или брикетирующего прессов, экструдеров, кольцевых матричных прессов и гранулирующих прессов. Изобретение также относится в некоторых вариантах осуществления к лекарственным формам, как описано выше, дополнительно содержащим эксципиенты, усиливающие проницаемость или поверхностно-активное вещество. Другие варианты осуществления предоставляют одну или более лекарственных форм, как описано выше, где указанный фармацевтически активный ингредиент находится в форме наночастиц. В предпочтительных вариантах осуществления изобретения набухающий эксципиент представляет собой сшитый поливинилпирролидон; гидронабухающий полимер выбирают из гидроксипропилметилцеллюлоз НРМС Е 5 и НРМС Е 6, микрокристаллической целлюлозы и поливинилпирролидона K12, и поверхностно-активное вещество выбирают из додецилсульфата натрия и витамина Е TPGS 1000. Изобретение также относится к способу получения лекарственных форм, описанных выше, включающему стадии:(ia) получения прозрачного раствора гидронабухающего полимера, посредством нагрева воды с последующим добавлением гидронабухающего полимера при перемешивании до получения гомогенной суспензии, которой дают охладиться,(ib) растворения активного фармацевтического ингредиента и слабой кислоты в поверхностноактивном веществе посредством перемешивания и нагрева,(ic) смешивания раствора, полученного на стадии (ia), с раствором, полученным на стадии (ib), и распылительной сушки смеси или(id) растворения активного фармацевтического ингредиента и гидронабухающего полимера в рас-2 019147 творителе и удаления растворителя упариванием с получением аморфной дисперсии,(ii) прессования набухающего эксципиента (дезинтегрирующего агента) в таблетку,(iii) разрушения крупной таблетки до гранул,(iv) смешивания просеянной фракции этих гранул с высушенным посредством распылительной сушки продуктом стадии (ic) или аморфной дисперсией, полученной на стадии (id),(v) прессования таблетки из полученной смеси. В предпочтительных вариантах осуществления способов набухающий эксципиент представляет собой сшитый поливинилпирролидон; гидронабухающий полимер выбирают из гидроксипропилметилцеллюлоз НРМС Е 5 и НРМС Е 6, микрокристаллической целлюлозы и поливинилпирролидона K12, слабая кислота представляет собой лимонную кислоту, и поверхностно-активное вещество выбирают из додецилсульфата натрия и витамина Е TPGS 1000. Определения В контексте данного описания термин "набухающий эксципиент" включает вещество, которое способно поглощать текучую среду при высоком расширении объема. Степень набухания может быть определена гравиметрически посредством поглощающей способности воды. Поглощение воды, определенное таким образом, предпочтительно составляет от 500 до 2000%, включая 600, 700, 800, 900, 1000, 1100,1200, 1300, 1400, 1500, 1600, 1700, 1800 и 1900%, с включением всех значений и субинтервалов между ними. Предпочтительный набухающий эксципиент представляет собой сшитый поливинилпирролидон,также называемый поливинилпирролидон или PVP-CL."Гидронабухающие полимеры", также называемые "водорастворимые полимеры", включают гидроксипропилметилцеллюлозу (НРМС), гидроксипропилцеллюлозу (НРС), гидроксиэтилцеллюлозу (НЕС),карбоксиметилцеллюлозу (CMC). Предпочтительные гидронабухающие полимеры представляют собой гидроксипропилметилцеллюлозы НРМС Е 5 и НРМС Е 6, микрокристаллическую целлюлозу и поливинилпирролидон K12. Простые эфиры целлюлозы, которые могут применяться в настоящем изобретении,являются хорошо известными в данной области и доступны с фармацевтической степенью чистоты и с различными средними молекулярными массами, приводящими к различным значениям вязкости этих простых эфиров целлюлозы. Гидрофильные полимеры могут быть характеризованы значениями их вязкости в 2% (мас./мас.) водном растворе как имеющие низкую вязкость (менее чем приблизительно 1000 мПас), среднюю вязкость (от приблизительно 1000 до приблизительно 10000 мПас) и высокую вязкость(НРМС) являются доступными с различными категориями вязкости от Dow Chemical Co. под торговым наименованием Methocel и от Shin Etsu под наименованием Metolose. Примерами полимеров с низкой вязкостью являются Methocel Е 5, Methocel E-15LV, Methocel E50LV, Methocel K100LV и MethocelF50LV, 2% водные растворы которых при 25C имеют вязкости, равные 5, 15, 50, 100 и 50 мПас соответственно. Примерами НРМС со средней вязкостью являются Methocel Е 4 М и Methocel K4M, 2% водные растворы которых при 25C имеют вязкости, равные 4000 мПас. Примерами НРМС с высокой вязкостью являются Methocel K15M и Methocel K100M, 2% водные растворы которых при 25C имеют вязкости, равные 15000 и 100000 мПас. Гидрофильные полимеры гидроксиэтилцеллюлозы (НЕС) являются доступными с различными категориями вязкости от AQUALON под торговым наименованием Natrosol и от Amerchol Corporation под наименованием Cellosize. Примерами полимеров с низкой вязкостью являются Natrosol L и Natrosol J, 2% водные растворы которых при 25C имеют вязкости, равные 10 и 20 мПас соответственно. Примерами полимеров со средней вязкостью являются Natrosol G иNatrosol K, 2% водные растворы которых при 25C имеют вязкости, равные 200 и 1500 мПас соответственно. Примерами полимеров с высокой вязкостью являются Natrosol M и Natrosol HH, 2% водные растворы которых при 25C имеют вязкости, равные 4000 и 90000 мПас соответственно. Лимонная кислота является примером "слабой кислоты", а додецилсульфат натрия (SDS) и "Витамин Е TPGS 1000" (сукцинат dтокоферилполиэтиленгликоля 1000) являются примерами "поверхностно-активных веществ". Термин "собственная биодоступнсть" описывает теоретически определенную оральную биодоступность, основанную на количественной взаимосвязи структура - свойство (QSPR) без учета таких параметров лекарственной формы, как размер частиц или кристалличность (Kim, J. et al., "Improvement ofbioavailability of water insoluble drugs: Estimation of intrinsic bioavailability", Korean J. Chem. Eng., 25(1),171-175 (2008. Термин "оральная биодоступность" описывает скорость и степень активного фармацевтического ингредиента, при которых он достигает системной циркуляции при всасывании после орального введения. Ее можно выражать в виде абсолютной оральной биодоступности при сравнении с соответствующей плазменной концентрацией после внутривенного введения такого же API. В контексте настоящего изобретения абсолютная оральная биодоступность менее 20% рассматривается как "низкая оральная биодоступность"."Предварительно спрессованный гранулят" в соответствии с настоящим изобретением относится к грануляту, который получают только посредством приложения сжимающего усилия к готовой форме порошка набухающего эксципиента, что приводит в результате к более плотному агломерату набухаю-3 019147 щего эксципиента. Термин "наночастица" определяет частицу, содержащую фармацевтически активный ингредиент со средним размером ниже 1000 нм. Термин "средний размер" в формате настоящего изобретения относится к эффективному среднему диаметру, определенному методами динамического светорассеяния (например, фотокоррелляционной спектроскопией (PCS), лазерной дифракцией (LD) , низкоугловым лазерным светорассеянием (LALLS), среднеугловым лазерным светорассеянием (MALLS), методами светового затемнения (методом Култье, например), реологии, микроскопии (оптической или электронной) в пределах, установленных выше). "Эффективный средний размер частиц менее чем приблизительно X нм" относится к веществу, по меньшей мере 90% частиц которого имеют средний размер менее чем приблизительно X нм при измерениях посредством вышеуказанных методов. Термин "твердая дисперсия" определяет систему в твердом состоянии (в противоположность жидкому или газообразному состоянию), содержащую по меньшей мере два компонента, где один компонент диспергирован более или менее равномерно во всем другом компоненте или компонентах. Твердая дисперсия, которая химически и физически является однородной или гомогенной по всему объему или состоит из одной фазы, как определено в термодинамике, может также относиться к "твердому раствору"(WO 97/044014). Твердый матрикс может быть либо кристаллическим или аморфным. Лекарственное средство может быть диспергировано молекулярно или существовать в виде аморфных частиц (кластеров), а также кристаллических частиц (твердая дисперсия). Примерами такой твердой дисперсии являются готовая лекарственная форма тебуфелона, описанная в патенте США 5281420, и готовая лекарственная форма биоактивного пептида, описанная в WO 2005/053727. Термин "эксципиент, усиливающий проницаемость" включает эксципиенты, известные как вещества, улучшающие проницаемость, например мукоадгезивные полимеры, модификаторы pH, усилители проницаемости и ингибиторы оттока. Термины "форма" и "кристаллическая форма" охватывают все твердые формы того же соединения,например полиморфы, сольваты и аморфные формы. "Сокристаллы" представляют собой многокомпонентные кристаллы с уникальной решеткой: новые химические образцы, полученные с нейтральными соединениями. "Аморфные формы" являются некристаллическими веществами без дальнего порядка атомов и, в целом, не образуют четкой матрицы рентгеновской дифракции порошка. Для предоставления более лаконичного описания некоторые из количественных выражений, данных в настоящем описании, не дополняют термином "приблизительно". Следует понимать, что независимо от того, используется ли термин "приблизительно" недвусмысленно или нет, каждое количество,приведенное в настоящем документе, означает, что оно относится к действительному данному значению,и это также означает, что оно относится к аппроксимации такого данного значения, которое разумным образом выводилось бы на основании принятой квалификации в данной области, включая аппроксимации вследствие условий эксперимента или измерений для такого данного значения. По всему описанию и формуле изобретения данной спецификации слово "содержат" и вариации слова, такие как "содержащие" и "содержит", не предназначены для исключения других добавок, компонентов, целых чисел или стадий. В настоящем изобретении "время дезинтеграции" определяют как время, необходимое для превращения таблетки в набухшую мягкую массу без твердого ядра."Фармацевтическая композиция" содержит по меньшей мере один фармацевтически активный ингредиент (API) вместе с одним или более из его фармацевтически приемлемых носителей и с одним или более из других терапевтических ингредиентов или без них. Носитель(и) должен быть "приемлемым" с точки зрения совместимости с другими ингредиентами готовой лекарственной формы и не вредными для ее реципиента. Термин "композиция", как использован в настоящем документе, охватывает продукт, содержащий установленные ингредиенты в предварительно определенных количествах или пропорциях,так же как любой продукт, который получают напрямую или опосредованно в результате объединения установленных ингредиентов в установленных количествах. В отношении к фармацевтическим композициям этот термин охватывает продукт, содержащий один или более активных ингредиентов и необязательный носитель, содержащий инертные ингредиенты, а также любой продукт, который получают напрямую или опосредованно в результате объединения, комплексования или агрегации любых двух или более ингредиентов, или в результате диссоциации одного или более ингредиентов, или в результате других типов реакций или взаимодействий одного или более ингредиентов. В целом, фармацевтические композиции получают посредством обеспечения однородной и тесной ассоциации активного ингредиента с жидким носителем, или мелко измельченным твердым носителем, или обоими и затем, при необходимости, формования продукта в желательную готовую лекарственную форму. Фармацевтическая композиция включает достаточно активного целевого соединения для получения желательного эффекта при развитии или состоянии заболеваний. Под "фармацевтически приемлемым" подразумевают то, что носитель, разбавитель или эксципиент должны быть совместимы с другими ингредиентами готовой лекарственной формы и не являться вредными для ее реципиента. Термин "терапевтически эффективное количество", как использован в настоящем описании, относится к количеству терапевтического средства для лечения состояния, излечиваемого посредством вве-4 019147 дения композиции изобретения. Такое количество включает количество, достаточное для проявления обнаруживаемого терапевтического или улучшающего ответа в тканевой системе у животного или человека. Эффект может включать, например, условия лечения, приведенные в настоящем документе. Точное фармацевтически эффективное количество для субъекта будет зависеть от размера и состояния здоровья субъекта, природы и степени тяжести излечиваемого состояния, рекомендаций лечащего врача (исследователя, ветеринара, медицинского доктора или другого клинициста) и терапевтических средств или комбинации терапевтических средств, выбранных для введения. Таким образом, неприменимым является устанавливать точное фармацевтически эффективное количество заранее. В описании настоящего изобретения термины "биологически активное вещество", "фармацевтически активное вещество", "лекарственное средство", "активное соединение" и "активный ингредиент" используют взаимозаменяемо для ссылки на химическое вещество или химическое соединение, которое при введении человеку или животному индуцирует фармакологический эффект. Пример 1. Соединения, применяемые в лекарственных формах.Aeropearl 300V, Aerosil 200V (аморфный безводный коллоидный диоксид кремния), лимонная кислота, гидроксипропилметилцеллюлозы (НРМС Е 5 и НРМС Е 6), фталат гидроксипропилметилцеллюлозы, степени чистоты (категории) 55 (НРМС Р), Labrasol, микрокристаллическая целлюлоза, поливинилпирролидон K12, сшитый поливинилпирролидон, PRUV (стеарилфумарат натрия), додецилсульфат натрия (SDS) и витамин Е TPGS 1000 были получены из коммерческих источников. Пример 2. Получение конкретных лекарственных форм. Лекарственная форма 1. Получение оральной твердой дозированной формы с повышенной биодоступностью (набухающий эксципиент: сшитый поливинилпирролидон). Состав на таблетку, мг: Раствор 10% (мас./мас.) НРМС Е 5 получали посредством первоначального нагрева воды до 65C и с последующим добавлением НРМС Е 5 при перемешивании до получения гомогенной суспензии. Ей дали охладиться, что привело в результате к образованию прозрачного раствора. В течение ночи соединение 1 и лимонную кислоту растворяли в Витамине Е TPGS 1000 посредством перемешивания и нагрева при 60C. Этот раствор смешивали с раствором НРМС Е 5 и подвергали распылительной сушке (температура ВВОДА 160C, температура ВЫВОДА 81C) с получением порошка, где Витамин Е TPGS 1000 и соединение 1 термостабильно погружали в матрикс НРМС Е 5, далее именуемый как порошок А. Таблетку прессовали с использованием порошковой смеси, содержащей соединение 1, Aeropearl 300V и набухающий эксципиент. Время дезинтеграции 45 мин. Лекарственная форма 2. Получение пероральной твердой дозированной формы с повышенной биодоступностью (набухающий эксципиент: сшитый поливинилпирролидон). Порошок А получали, как описано выше, и смешивали со сшитым поливинилпирролидоном. Эту порошковую смесь спрессовывали в крупную таблетку, используя гидравлический пресс (диаметр 52 мм,толщина 7 мм, сжимающее усилие 6 т), затем разрушали до гранул, которые, используя гидравлический пресс (длина 22,3 мм, ширина 10,7 мм, толщина 12,0 мм, сжимающее усилие 600 кг), затем прессовали в таблетки, содержащие соединение 1 и набухающий эксципиент. Время дезинтеграции 30 мин. Лекарственная форма 3. Получение пероральной твердой дозированной формы с повышенной биодоступностью (набухающий эксципиент: сшитый поливинилпирролидон). Состав на таблетку, мг: Порошок А, полученный, как описано выше, спрессовывали в крупную таблетку, используя гидравлический пресс (диаметр 52 мм, толщина 7 мм, сжимающее усилие 6 т), затем разрушали до гранул. Сшитый поливинилпирролидон смешивали вместе с этими гранулами и прессовали в таблетки, используя гидравлический пресс (длина 22,3 мм, ширина 10,7 мм, толщина 12,0 мм, сжимающее усилие 600 кг),содержащие соединение 1 и набухающий эксципиент. Время дезинтеграции 30 мин. Лекарственная форма 4. Получение пероральной твердой дозированной формы с повышенной биодоступностью (набухающий эксципиент: сшитый поливинилпирролидон). Состав на таблетку, мг: Сшитый поливинилпирролидон спрессовывали в крупную таблетку, используя гидравлический пресс (диаметр 52 мм, толщина 7 мм, сжимающее усилие 6 т), затем разрушали до гранул (предварительное прессование через сильный удар). Просеянную фракцию (500-1250 мкм) этих гранул смешивали с порошком А, полученным, как описано выше. Прессовали таблетку, используя гидравлический пресс(длина 22,3 мм, ширина 10,7 мм, толщина 12,0 мм, сжимающее усилие 600 кг), содержащую соединение 1 и предварительно спрессованный набухающий эксципиент. Время дезинтеграции этой улучшенной лекарственной формы в соответствии с настоящим изобретением составляло приблизительно 5 мин. Лекарственная форма 5. Получение быстро распадающейся оральной твердой дозированной формы с повышенной биодоступностью (набухающий эксципиент: сшитый поливинилпирролидон). Сшитый поливинилпирролидон спрессовывали в крупную таблетку, используя гидравлический пресс (диаметр 52 мм, толщина 7 мм, сжимающее усилие 6 т), затем разрушали до гранул. Просеянную фракцию (500-1250 мкм) этих гранул смешивали с порошком А, полученным, как описано выше. Прессовали таблетку, используя порошковую смесь, содержащую соединение 1 и предварительно спрессованный набухающий эксципиент. Время дезинтеграции этой улучшенной лекарственной формы в соответствии с настоящим изобретением составляло приблизительно 5 мин. Лекарственная форма 6. Получение быстро распадающейся оральной твердой дозированной формы с повышенной биодоступностью (набухающий эксципиент: сшитый поливинилпирролидон). Состав на таблетку, мг: Раствор 10% (мас./мас.) НРМС Е 6 получали посредством первоначального нагрева воды до 65C и с последующим добавлением НРМС Е 6 при перемешивании до получения гомогенной суспензии. Ей дали охладиться, что привело в результате к образованию прозрачного раствора. Labrasol диспергировали в растворе НРМС Е 6 и подвергали распылительной сушке (температура ВВОДА 145C, температура ВЫВОДА 88C) с получением порошка, где Labrasol термостабильно погружали в матрикс НРМС Е 6. Сшитый поливинилпирролидон прессовали в крупную таблетку, используя гидравлический пресс (диаметр 52 мм, толщина 7 мм, сжимающее усилие 6 т), затем разрушали до гранул. Просеянную фракцию(500-1250 мкм) этих гранул отбирали и смешивали вместе с соединением 2, микрокристаллической целлюлозой, Labrasol, погруженном в НРМС, Aerosil и PRUV. Таблетку прессовали, используя порошковую смесь, содержащую соединение 2 и предварительно спресованный набухающий эксципиент. Лекарственная форма 7. Получение быстро распадающейся оральной твердой дозированной формы в виде твердой дисперсии (набухающий эксципиент: сшитый поливинилпирролидон). Состав на таблетку, мг: Соединение 1 и поливинилпирролидон K12 растворяли в смеси ацетона и этанола (3:1 об./об.). Растворитель удаляли быстрым упариванием, что приводило в результате к образованию аморфной дисперсии. Сшитый поливинилпирролидон спрессовывали в крупную таблетку, используя гидравлический пресс (диаметр 52 мм, толщина 7 мм, сжимающее усилие 6 т), затем разрушали до гранул, просеянную фракцию (500-1250 мкм) этих гранул отбирали и смешивали вместе с аморфной дисперсией соединения 1. Прессовали таблетку, используя гидравлический пресс (длина 22,3 мм, ширина 10,7 мм, толщина 9,8 мм, сжимающее усилие 600 кг), содержащую соединение 1 и предварительно спрессованный набухающий эксципиент. Время дезинтеграции этой улучшенной лекарственной формы в соответствии с настоящим изобретением составляло от приблизительно 2 до 3 мин. Лекарственная форма 8. Получение быстро распадающейся оральной твердой дозированной формы в виде твердой дисперсии (набухающий эксципиент: сшитый поливинилпирролидон). Состав на таблетку, мг: Соединение 1, НРМС Р и SDS растворяли в смеси ацетона и этанола (3:1 об./об.). Растворитель удаляли быстрым упариванием, что приводило в результате к образованию аморфной дисперсии. Сшитый поливинилпирролидон спрессовывали в крупную таблетку, используя гидравлический пресс (диаметр 52 мм, толщина 7 мм, сжимающее усилие 6 т), затем разрушали до гранул. Просеянную фракцию (5001250 мкм) этих гранул отбирали и смешивали вместе с аморфной дисперсией соединения 1. Прессовали таблетку, используя гидравлический пресс (длина 22,3 мм, ширина 10,7 мм, толщина 9,8 мм, сжимающее усилие 600 кг), содержащую соединение 1 и предварительно спрессованный набухающий эксципиент. Время дезинтеграции этой улучшенной лекарственной формы в соответствии с настоящим изобретением составляло приблизительно 30 с. Таблица 1. Композиции (мг) готовых лекарственных форм 1-8 Пример 3. Измерения дезинтеграции. Тесты на дезинтеграцию осуществляли в устройстве для дезинтеграции (PTZ-auto, Pharma-test,Hainburg, Germany) в химическом стакане с 800 мл очищенной воды (температура 373C). Дезинтеграцию (разрушение) определяют как такое состояние, при котором любой остаток таблетки, остающийся на сите устройства для тестирования или прилипающий к нижней поверхности диска, представляет со-8 019147 бой мягкую массу, не имеющую твердой сердцевины. Пример 4. Лекарственные формы настоящего изобретения в сравнении с лекарственными формами ЕР 1070741. Различные лекарственные формы были получены в соответствии с методиками, раскрытыми в ЕР 1070741, и их сравнивали с лекарственной формой в соответствии с настоящим изобретением. Композиция таблеток приведена в табл. 2. Таблетки 11 АТ, 11 ВТ и 11 СТ были получены в соответствии с методикой, раскрытой в ЕР 1070741. Таблетки 09DT2 были получены в соответствии с настоящим изобретением (пример 2, лекарственная форма 5). Во всех лекарственных формах количества соединения 1 и сшитого PVP поддерживали постоянными. Отношение PVP-CL/микроцеллюлозы (МСС), соответственно 60/40, 3/97 и 10/90 в таблетках HAT,11BT и 11 СТ, изменяли в пределах между двумя крайними значениями, раскрытыми в ЕР 1070741. Таблетки получали следующим образом. Сшитый поливинилпирролидон с МСС или без нее спрессовывали в крупную таблетку, используя гидравлический пресс (диаметр 52 мм, толщина 7 мм, сжимающее усилие 6 т) и разрушали до гранул. Просеянную фракцию (500-1250 мкм) этих гранул смешивали с порошком А, полученным как описано в примере 2, и прессовали в таблетки, используя гидравлический пресс. Таблица 2. Композиции (мг) готовых лекарственных форм в соответствии с ЕР 1070741 и настоящим изобретением Очевидно, различия между объемами гранулятов, применяемых для прессования одной таблетки каждой лекарственной формы являются существенными. Применение дополнительного связующего(МСС) приводит в результате к более крупному размеру таблетки, также ожидаемому, принимая во внимание массы таблеток (табл. 2). Наименьший размер таблетки был получен, когда таблетка была получена в соответствии с настоящим изобретением. Дополнительно таблетки 09 АТ, 09 ВТ и 09 СТ получали в соответствии с ЕР 1070741, но с постоянной массой, сходной с массой таблетки 09DT2 (680 мг). Композиция и значения времени дезинтеграции этих лекарственных форм приведены в табл. 3. Таблица 3. Композиции (мг) готовых лекарственных форм в соответствии с ЕР 1070741 и композиция настоящего изобретения,приводящие в результате к таблеткам одинаковой массы Принимая во внимание значения времени дезинтеграции лекарственных форм, перечисленных в табл. 2 и 3, были сделаны следующие наблюдения. Таблетки 09DT2, полученные в соответствии с настоящим изобретением, содержащие такое же количество дезинтегрирующего агента, как таблетки 09 АТ, 09 ВТ и 09 СТ, имели значительно более низкие значения времени дезинтеграции. Еще один удивительный аспект готовых лекарственных форм 09DT2, полученных в соответствии с настоящим изобретением, состоял в улучшенной воспроизводимости значений времени дезинтеграции. Отдельно от значения времени дезинтеграции, определенного в соответствии с PhEur, также определяли поведение при дезинтеграции. Его определяли как "время, необходимое для превращения таблетки в набухшую мягкую массу без твердой сердцевины". Поведение при дезинтеграции лекарственных форм 18AT и 18DT сравнивали непосредственно. Эти таблетки выбирали вследствие их почти сходного размера. Их композиции, значения времени дезинтеграции и поведение при дезинтеграции приведены в табл. 2 (где таблетки соответствуют готовым формам 11 АТ и 09DT2 соответственно). При погружении таблеток в воду в пределах 1 мин таблетки 09DT2 начали дезинтегрироваться. Через 5 мин таблетки 09DT2 превращались в мягкий набухший материал в отличие от таблеток 11 АТ, которые все еще были неповрежденными. В этот момент лекарственные формы 09DT2 считали "дезинтегрированными" в соответствии с определением, данным выше. Через 16 мин таблетки 09DT2 полностью растворялись, в то время как таблетки 11 АТ были еще незатронутыми. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Твердая фармацевтическая лекарственная форма для орального введения, содержащая (1) активный фармацевтический ингредиент, (2) гидронабухающий полимер, выбранный из гидроксипропилметилцеллюлоз НРМС Е 5 и НРМС Е 6, микрокристаллической целлюлозы и поливинилпирролидона K12, и(3) предварительно спрессованный гранулят сшитого поливинилпирролидона. 2. Лекарственная форма по п.1, где указанный предварительно спрессованный гранулят получен посредством приложения сжимающего усилия к сшитому поливинилпирролидону. 3. Лекарственная форма по п.2, где указанное сжимающее усилие обеспечивается устройством, выбранным из фрикционных роликов, вальцового или брикетирующего прессов, экструдеров, кольцевых матричных прессов и гранулирующих прессов. 4. Лекарственная форма по любому из пп.1-3, где указанный активный фармацевтический ингредиент находится в форме наночастиц. 5. Лекарственная форма по любому из пп.1-4, дополнительно содержащая один или более эксципиентов, усиливающих проницаемость. 6. Лекарственная форма по любому из пп.1-4, дополнительно содержащая поверхностно-активное вещество. 7. Лекарственная форма по любому из пп.1-4, дополнительно содержащая один или более эксципиентов, усиливающих проницаемость, и поверхностно-активное вещество. 8. Лекарственная форма по п.6 или 7, где указанное поверхностно-активное вещество выбирается из додецилсульфата натрия и витамина Е TPGS 1000. 9. Способ получения лекарственной формы по п.1, включающий стадии:(ia) получения раствора гидронабухающего полимера, выбранного из гидроксипропилметилцеллю- 10019147 лоз НРМС Е 5 и НРМС Е 6, микрокристаллической целлюлозы и поливинилпирролидона K12, посредством нагрева воды с последующим добавлением гидронабухающего полимера при перемешивании до получения гомогенной суспензии, которой дают охладиться,(ib) растворения активного фармацевтического ингредиента и слабой кислоты в поверхностноактивном веществе посредством перемешивания и нагрева,(ic) смешивания раствора, полученного на стадии (ia), с раствором, полученным на стадии (ib), и распылительной сушки смеси или(id) растворения активного фармацевтического ингредиента и гидронабухающего полимера в растворителе и удаления растворителя упариванием с получением аморфной дисперсии,(ii) прессования сшитого поливинилпирролидона в таблетку,(iii) разрушения крупной таблетки до гранул,(iv) смешивания просеянной фракции этих гранул с высушенным посредством распылительной сушки продуктом стадии (ic) или аморфной дисперсией, полученной на стадии (id),(v) прессования таблетки из полученной смеси.
МПК / Метки
МПК: A61K 31/4155, A61K 31/4353, A61K 9/26, A61K 9/20
Метки: спрессованные, биодоступностью, быстро, пероральной, лекарственные, низкой, предварительно, распадающиеся, формы, соединений
Код ссылки
<a href="https://eas.patents.su/12-19147-predvaritelno-spressovannye-bystro-raspadayushhiesya-lekarstvennye-formy-soedinenijj-s-nizkojj-peroralnojj-biodostupnostyu.html" rel="bookmark" title="База патентов Евразийского Союза">Предварительно спрессованные быстро распадающиеся лекарственные формы соединений с низкой пероральной биодоступностью</a>
Предыдущий патент: Агонисты рецептора меланокортина
Следующий патент: Бытовая сушильная машина для белья и способ фильтрации водного конденсата в ней
Случайный патент: Способ иммунизации растений против бактериальных болезней