Композиции, содержащие ингибитор jnk и циклоспорин
Формула / Реферат
1. Фармацевтическая композиция, содержащая циклоспорин и ингибитор JNK, выбранный из соединений формулы (I)
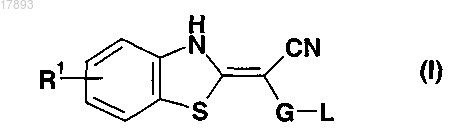
где G означает пиримидинил,
L означает аминогруппу формулы -NR3R4, где R3 и R4, каждый независимо друг от друга, означают Н или С1-С6алкилгетероарил, где гетероарил представляет собой пиридил,
R1 означает водород,
а также таутомеров, геометрических изомеров, оптически активных форм, таких как энантиомеры, диастереомеры и рацемические формы, и фармацевтически приемлемых солей указанных соединений.
2. Фармацевтическая композиция по п.1, в которой ингибитор JNK представлен любой из формул (Ia), (Ia') или (Ia")
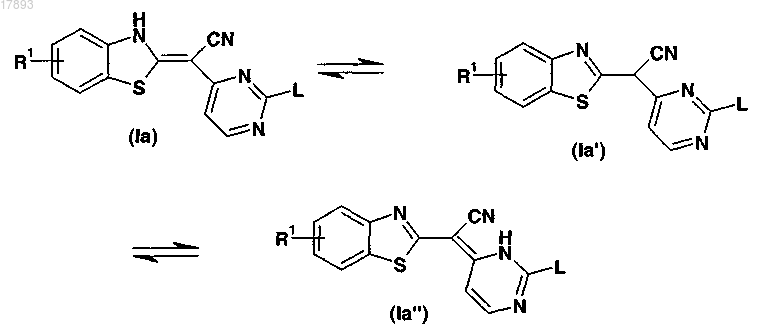
где R1 означает водород,
L означает аминогруппу формулы -NR3R4, где R3 и R4 означают Н.
3. Фармацевтическая композиция по п.1, в которой ингибитор JNK представлен любой из формул (Ia), (Ia') или (Ia")

где R1 означает водород,
L означает аминогруппу формулы -NR3R4, где R3 и R4 определены в п.1.
4. Фармацевтическая композиция по п.3, в которой R3 означает водород, a R4 означает C1-С6алкилгетероарил, где гетероарил представляет собой пиридил.
5. Фармацевтическая композиция по п.3, в которой L представляет собой следующую группу:
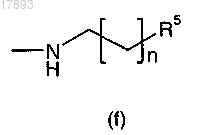
где n равно от 1 до 6,
R5 означает гетероарил, где гетероарил представляет собой пиридил.
6. Фармацевтическая композиция по любому из пп.1-5, в которой ингибитор JNK представляет собой 1,3-бензотиазол-2-ил[2-{[2-(3-пиридинил)этил]амино}-4-пиримидинил]ацетонитрил.
7. Фармацевтическая композиция по любому из пп.1-6, в которой циклоспорином является циклоспорин А.
8. Фармацевтическая композиция по любому из пп.1-7, в которой молярное соотношение циклоспорин/ингибитор JNK составляет от 1:1 до 1:100.
9. Фармацевтическая композиция по любому из пп.1-8, в которой доза циклоспорина составляет от 1 до 100 мг/кг.
10. Фармацевтическая композиция по любому из пп.1-9, кроме того, включающая фармацевтически приемлемый эксципиент.
11. Фармацевтическая композиция по любому из пп.1-10, предназначенная для использования в качестве лекарственного средства, предназначенного для лечения нейронального расстройства, аутоиммунного заболевания, воспалительного процесса, рака или сердечно-сосудистого заболевания.
12. Фармацевтическая композиция, содержащая циклоспорин и ингибитор JNK, выбранный из соединений формулы (II)
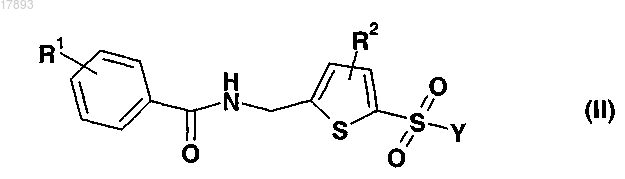
где Y означает пиперидин
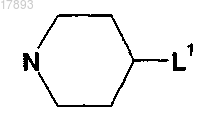
где L1 означает -NHR3, где R3 означает прямой или разветвленный С4-С12алкил, причем атом азота в указанном цикле образует связь с сульфонильной группой формулы (I) с образованием сульфонамида,
R1 означает галоген,
R2 означает водород,
а также геометрических изомеров, оптически активных форм, таких как энантиомеры, диастереомеры и рацемические формы, и фармацевтически приемлемых солей указанных соединений.
13. Фармацевтическая композиция по п.12, где R3 означает прямой или разветвленный С8-С12алкил.
14. Фармацевтическая композиция по п.12 или 13, в которой ингибитор JNK представляет собой 4-хлор-N-[(5-{[4-(бутиламино)пиперидин-1-ил]сульфонил}тиен-2-ил)метил]бензамид ацетонитрила.
15. Фармацевтическая композиция по любому из пп.12-14, в которой циклоспорином является циклоспорин А.
16. Фармацевтическая композиция по любому из пп.12-15, в которой молярное соотношение циклоспорин/ингибитор JNK составляет от 1:1 до 1:100.
17. Фармацевтическая композиция по любому из пп.12-16, в которой доза циклоспорина составляет от 1 до 100 мг/кг.
18. Фармацевтическая композиция по любому из пп.12-17, кроме того, включающая фармацевтически приемлемый эксципиент.
19. Фармацевтическая композиция по любому из пп.12-18, предназначенная для использования в качестве лекарственного средства, предназначенного для лечения нейронального расстройства, аутоиммунного заболевания, воспалительного процесса, рака или сердечно-сосудистого заболевания.
20. Применение композиции по любому из пп.1-19 для получения лекарственного средства, предназначенного для лечения нейронального расстройства, аутоиммунного заболевания, воспалительного процесса, рака или сердечно-сосудистого заболевания.
Текст
Настоящее изобретение относится к композиции, включающей ингибитор JNK, выбранный из соединений формулы I или формулы II и циклоспорин, прежде всего предназначенной для лечения нейрональных нарушений,аутоиммунных заболеваний, воспалительных процессов, рака или сердечно-сосудистых заболеваний.(71)(73) Заявитель и патентовладелец: ЛАБОРАТУАР СЕРОНО СА (CH) Область изобретения Настоящее изобретение относится к композиции, содержащей ингибитор JNK и циклоспосрин,прежде всего предназначенной для лечения нейрональных нарушений, аутоиммунных заболеваний, рака и сердечно-сосудистых заболеваний. Предпосылки создания изобретенияN-концевые киназы c-Jun (JNK). Клетки млекопитающих провляют чувствительность к ряду внеклеточных стимулов за счет активации каскада передачи сигналов, опосредованных различными митоген-активируемыми протеинкиназами(MAPK). Несмотря на различие ответных реакций клеток на стимулы, которые действуют на ранних стадиях киназных каскадов, каскады киназ MAP действуют по аналогичной схеме и включают киназакиназа-киназы MAP (MAPKKK или MEKK), киназа-киназы MAP (MAPKK или MKK) и киназы MAP(MAPK). Киназы MAP относятся к многочисленному семейству киназ, которое включает N-концевые киназы c-Jun (JNK), которые называются также стресс-активируемыми протеинкиназами (SAPK), а также регулируемые внеклеточным сигналом киназы (ERK) и киназы p38 MAP. Каждое из этих подсемейств киназ MAP включены по крайней мере в три различные, но параллельные пути передачи сигнала,которые передают информацию, стимулированную внешним сигналом. Путь передачи сигнала JNK активируется при воздействии на клетки стрессовых факторов окружающей среды, таких как химические токсины, радиация, гипоксия или осмотический шок, а также при обработке клеток факторами роста или провоспалительными цитокинами, такими как альфа-фактор некроза опухоли (TNF-) или бетаинтерлейкин-1 (IL-1). Две киназа-киназы MAP (известные также как MKK или MAPKK), то есть MKK4 (известная также как JNKK1) и MKK7, активируют JNK двойным фосфорилированием специфических остатков треонина и тирозина, расположенных во фрагменте Thr-Pro-Tyr в составе петли активации фермента, в ответ на цитокины и стрессовые сигналы. Боле того, известно, что сама по себе киназа MKK4 на ранней стадии каскада передачи сигнала активируется также ферментом киназа-киназа-киназой MAP, MEKK1, за счет фосфорилирования остатков серина и треонина. После активации JNK связывается с N-концевым фрагментом мишени-фактора транскрипции и фосфорилирует активирующие транскрипцию домены, что приводит к регуляции на ранней стадии экспрессии различных генных продуктов, которые могут привести к апоптозу, воспалительным ответным реакциям или онкогенным процессам (1). Некоторые факторы транскрипции, известные как субстраты JNK, являются белками Jun (c-jun,JunB и JunD), родственными факторами транскрипции ATF2 и ATF, факторами транскрипции Ets, такими как Elk-1 и Sap-1, опухолевый депрессант p53 и белковый домен гибели клеток (DENN). В настоящее время идентифицировано три различных фермента JNK в качестве продуктов геновJNK1, JNK2 и JNK3, идентифицировано также десять различных изоформ JNK (2). JNK1 и JNK2 экспрессируются во множестве тканей человека, в то время как JNK3 селективно экспрессируется в ткани мозга, сердца и яичек (2). Каждая изоформа связывается с субстратами с различной специфичностью, что свидетельствует о наличии in vivo субстратно-специфичной регуляции путей передачи сигнала различными изоформами JNK. Путь передачи сигнала с участием JNK выявлен при ряде заболеваний и является перспективной мишенью при разработке новых лекарственных средств. Кроме того, молекулярно-генетические исследования подтверждают гипотезу о патогенной роли указанного пути при развитии различных заболеваниий. Например, аутоиммунные и воспалительные заболевания связаны с аномальной активацией иммунной системы. Активированные иммунные клетки экспрессируют множество генов, кодирующих воспалительные молекулы, включая цитокины, факторы роста, рецепторы клеточной поверхности, молекулы клеточной адгезии и деградирующие ферменты. Известно, что многие из этих генов регулируются с участием пути JNK через активацию факторов транскрипции c-Jun и ATF-2. При ингибировании активации JNK в бактериальных активированных липополисахаридом макрофагах наблюдается эффективное модулирование продуцирования основного провоспалительного цитокина, TNF- (3). При ингибировании активации JNK наблюдается снижение активации фактора транскрипции, ответственного за индуцибельную экспрессию матричных металлопротеиназ (ММР) (4), которые, как известно, являются ответственными за развитие изъязвления хряжей и кости при ревматоидном артрите и за развитие общей деструкции ткани при других аутоиммунных заболеваниях. Каскад JNK активируется также в Т клетках при стимуляции антигеном и совместной стимуляции рецептором CD28 (5), а также регулирует продуцирование промотера IL-2 (6). Аномальная активация Т лимфоцитов инициирует и стабилизирует множество аутоиммунных заболеваний, включая астму, синдром воспаленного кишечника и рассеянный склероз. В нейронах, поврежденных при болезни Альцгеймера, и в нейронах пациентов, страдающих от острой гипоксии (7), наблюдается высокая степень экспрессии белка JNK3. Установлено также, что ген JNK экспрессируется в поврежденных участках мозга пациентов, страдающих от болезни Альцгеймера (8). Кроме того, установлено, что нейроны, выделенные из мышей KO JNK3, проявляют устойчивость к нейрональному апоптозу, индуцированному каиновой кислотой, по сравнению с нейронами мышей дикого типа. Полученные данные свидетельствуют о том, что пути передачи сигнала JNK и прежде всего JNK2 иJNK3, по-видимому, включены в процесс развития опосредованных апоптозом нейродегенеративных заболеваний, таких как болезнь Альцгеймера, болезнь Паркинсона, эпилепсия и эпилептические припадки, болезнь Гентингтона, расстройства ЦНС, травматическое повреждение мозга, а также ишемические нарушения и гемораггический шок. В качестве модуляторов пути JNK предложены несколько низкомолекулярных соединений. Производные арилоксииндола общей формулы (A) (WO 00/35909, WO 00/35906, WO 00/3592) и формулы (В) (WO 00/64872) были предложены для лечения нейродегеративных заболеваний, воспаления и солидных опухолей (соединения формулы (А и для лечения широкого спектра заболеваний, включая нейродегенеративные заболевания, воспаление и аутоиммунные заболевания, сердечно-сосудистые заболевания и нарушения костной ткани (соединения формулы (В. Производные пиразолоантронов формулы (C) являются ингибиторами JNK, пригодными для лечения неврологических дегенеративных заболеваний, воспалительных и аутоиммунных расстройств, а также сердечно-сосудистых патологий, как описано в заявке WO 01/12609. Производные тетрагидропиримидина формулы (D) являются ингибиторами JNK, пригодными для лечения множества заболеваний, включая нейродегенеративные заболевания, воспалительные и аутоиммунные расстройства, сердечные патологии и деструктивные заболевания костной ткани, как описано в заявке WO 00/75118. Другие гетероциклические соединения формулы (E) являются ингибиторами протеинкиназ и прежде всего N-концевых киназ c-jun, как описано в заявке WO 01/12621, пригодными для лечения "JNKопосредованных состояний", включая нейродегенеративные заболевания, воспалительные и аутоиммунные расстройства, деструктивные заболевания костной ткани, сердечно-сосудистые и инфекционные заболевания. Производные бензазола, такие как производные бензазола формулы (F), описанные в заявке WO 01/47920, являются модуляторами пути JNK, которые пригодны для лечения нейронных расстройств,аутоиммунных заболеваний, различных видов рака и сердечно-сосудистых заболеваний. Некоторые производные сульфонамида формулы (G), заявка WO 01/23378, производные сульфониламинокислоты формулы (H), заявка WO 01/23379 и производные сульфонилгидразида формулы (J), заявка WO 01/23382 используются для ингибирования JNK, прежде всего JNK2 и JNK3 при лечении нейродегенеративных заболеваний, аутоиммунных расстройств, различных видов рака и сердечнососудистых заболеваний. Циклоспорин. Производные циклоспорина относятся к классу циклических полипептидов, включающих одиннадцать аминокислот, и продуцируются в виде вторичных метаболитов грибов вида Tolypocladium inflatumGams. Установлено, что циклоспорины обратимо ингибируют иммунокомпетентные лимфоциты, прежде всего T-лимфоциты, в фазе клеточного цикла G0 или G1. Установлено также, что производные циклоспорина являются обратимыми ингибиторами продуцирования и высвобождения лимфокинов (16). Хотя известно множество производных циклоспорина, наиболее широко используется циклоспорин А. Депрессивное действие циклоспорина А связано с ингибированием событий, опосредованных активациейT-клеток. Также депрессивное действие сопровождается связыванием циклоспорина с внутриклеточным белком циклофилином. В свою очередь, этот комплекс ингибирует кальций- и кальмодулин-зависимую серин-треонинфосфатазную активность фермента кальциневрина. Ингибирование кальциневрина предотвращает активацию факторов транскрипции, таких как NFATp/c и NF-[K]B, которые необходимы для индукции генов цитокинов (IL-2, IFN-[], IL-4, и GM-CSF) в процессе активации T-клеток. Циклоспорин также ингибирует продуцирование лимфокинов T-хелперными клетками in vitro и приостанавливает созревание клеток CD8 и CD4 в тимусе (16). К другим свойствам циклоспорина in vitro относится ингибирование продуцирующих IL-2 T-лимфоцитов и цитотоксических T-лимфоцитов, ингибирование высвобождения IL-2 при активации T-клеток, ингибирование покоящихся T-лимфоцитов в ответ на аллоантигенный и экзогенный лимфокин, ингибирование продуцирования IL-1 и ингибирование митогенактивированных T-лимфоцитов, продуцирующих IL-2 (16). Циклоспорин является эффективным иммунодепрессантом, что подтверждается его способностью подавлять гуморальный иммунитет и опосредованные клетками иммунные реакции, такие как отторжение аллотрансплантата, гиперчувствительность, экспериментальный аллергический энцефаломиелит,адъювантные артриты Фрейнда и реакция "трансплантант-против-хозяина". Циклоспорин используется для профилактики отторжения органа после его пересадки, для лечения ревматоидного артрита, псориаза и других аутоимунных заболеваний, включая диабет типа I, болезнь Крона, волчанку и т.п. С момента открытия циклоспорина было выявлено и идентифицировано множество природных циклоспоринов, а позднее были разработаны синтетические или полусинтетические способы культивирования неприродных циклоспоринов с применением усовершенствованных технологий культивирования микроорганизмов. В связи с этим к настоящему времени класс циклоспоринов включает множество производных, например природные циклоспорины от A до Z (17, 18, 19, 20), а также неприродные производные циклоспорина и искусственные или синтетические циклоспорины, включая дигидро- и изоциклоспорины, циклоспорины (например, в которых атом 3'-O в остатке -MeBmt- ацилирован или -атом углерода в остатке саркозина в положении 3 содержит другой заместитель); циклоспорины, в которых остаток -MeBmt находится в изомерной форме (например, в которых заместители в положении 6' и 7' в остатке -MeBmt находятся в цис-конфигурации, а не в трансконфигурации), и циклоспорины, в аминокислотную последовательность которых включены другие аминокислотные остатки в определенных положениях, полученные, например, с использованием полностью синтетического метода получения циклоспоринов, описанного в статьях: 21, 17, 18, 19, 21, 22, 23 (см. также патенты US 4108985, US 4210581,US 4220641, US 4288431, US 4554351, US 4396542, и патенты EP 003467, EP 0056782, и заявку WO 86/02080). В статье Rich и др. (24) описаны аналоги циклоспорина А, содержащие модифицированные аминокислотные остатки в положении 1. Иммунодепрессивные, противовоспалительные и антипаразитарные аналоги циклоспорина А описаны в патентах фирмы Sandoz: US 4384996, US 4771122, US 5284826 и US 5525590. Другие аналоги циклоспорина описаны в заявке фирмы Isotechnika WO 99/18120. Термины Ciclosporin, ciclosporin, cyclosporine и Cyclosporin являются взаимозаменяемыми и означают циклоспорин. При лечении циклоспорином А наблюдается множество побочных эффектов, включающих нефротоксичность, гепатотоксичность, развитие катаракты, гирсутизм, паротит, десневую гиперплазию. Наиболее серьезным из указанных побочных эффектов является нефротоксичность, которая зависит от дозы введеного циклоспорина А. Лекарственные средства на основе циклоспорина А с немедленным высвобождением (например,неорал(R) и сандиммун(R) фирмы Novartis) проявляют нефротоксичные и другие побочные токсичные эффекты за счет быстрого высвобождения активного агента, его высокой концентрации в крови и быстрой абсорбции. Известно, что при максимальной концентрации лекарственного средства наблюдаются побочные действия. Краткое изложение сущности настоящего изобретения Настоящее изобретение относится к композиции, содержащей ингибитор JNK и циклоспорин,предназначенной, прежде всего, для лечения нейронных расстройств, аутоиммунных заболеваниий, рака и сердечно-сосудистых заболеваний. В одном варианте ингибитором JNK является бензазол формулы (I). Подробное описание предпочтительных вариантов осуществления настоящего изобретения В следующем разделе приведены определения различных химических остатков, из которых состоят соединения по настоящему изобретению и которые использованы для описания соединений, если не указано иное точное определение в более широком диапазоне."C1-C6 алкил" означает алкильные группы, содержащие от 1 до 6 атомов углерода. Примеры указанного термина включают метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутил, н-бутил, нпентил, н-гексил и т.п.N-концевой киназой c-jun (JNK) фактора транскрипции JNK, который является мишенью JNK. Ингибитором JNK называется агент, способный ингибировать активность JNK in vitro или in vivo. Такую ингибирующую активность определяют методом анализа или на моделях животных по известным методикам. Ингибитором JNK по настоящему изобретению является соединение формулы (I) или (II)."JNK" означает белок или его изоформу, кодируемые генами JNK 1, JNK 2 или JNK 3 (Gupta S., Barrett Т., Whitmarsh A. J., Cavanagh J., Sluss H. K., Derijard В. и Davis R. J., The EMBO J., 15, 2760-2770(1996. Термин "фармацевтически приемлемые соли или комплексы" означает соли или комплексы указанных ниже соединений формулы (I), которые сохраняют требуемую биологическую активность. Примеры таких солей включают, без ограничения перечисленным, кислотно-аддитивные соли неорганических кислот (например, соляная кислота, бромисто-водородная кислота, серная кислота, фосфорная кислота,азотная кислота и т.п.) и соли органических кислот, таких как уксусная кислота, щавелевая кислота, винная кислота, янтарная кислота, яблочная кислота, фумаровая кислота, малеиновая кислота, аскорбиновая кислота, дубильная кислота, бензойная кислота, памоевая кислота, альгиновая кислота, полиглютаминовая кислота, нафталинсульфоновая кислота, нафталиндисульфоновая кислота, метансульфокислота и полигалактуроновая кислота. Указанные соединения также получают в виде фармацевтически приемлемых известных четвертичных солей, прежде всего соль четвертичного аммония формулы -NR,R',R"+ Z-,где R, R', R" независимо означают водород, алкил или бензил, C1-C6 алкил, C2-C6 алкенил, C2-C6 алкинил,C1-C6 алкиларил, C1-C6 алкилгетероарил, циклоалкил, гетероциклоалкил, a Z означает противоион, включая хлорид, бромид, иодид, -О-алкил, толуолсульфонат, метилсульфонат, сульфонат, фосфат или карбоксилат (такой как бензоат, сукцинат, ацетат, гликолят, малеат, малат, фумарат, цитрат, тартрат, аскорбат,циннамоат, манделоат и дифенилацетат)."Фармацевтически активное производное" означает любое соединение, которое после введения реципиенту проявляет непосредственно или косвенно активность, описанную в данном контексте."Избыток энантиомера" (ее) означает продукты, полученные методом асимметрического синтеза, то есть при взаимодействии нерацемических исходных материалов и/или реагентов, или синтеза, включающего по крайней мере одну энантиоселективную стадию, на которой получают энантиомер, избыток которого (ее) составляет по крайней мере 52%. Известно, что активность ингибиторов JNK повышается при комбинации с циклоспорином. В качестве ингибитора JNK используют, прежде всего, любой из описанных в настоящем изобретении ингибиторов JNK. Такие соединения, пептиды или белки ингибируют JNK1 и/или JNK2 и/или JNK3. В одном варианте, ингибитор JNK селективно ингибирует JNK3 (например, его активность в отношенииJNK3 выше по крайней мере в 2, или 3, или 4, или 5, или 6 или более раз, по сранению с JNK1 или JNK 2). В другом варианте, ингибитор JNK селективно ингибирует JNK2 (например, его активность в отношении JNK2 выше по крайней мере в 2, или 3, или 4, или 5, или 6 или более раз, по сравнению с JNK1 или JNK3). Активность ингибитора JNK определяют по известной методике определения ферментативной активности JNK. В одном варианте ингибитор JNK, прежде всего любой из описанных в данном контексте ингибиторов JNK, ингибирует активность JNK1 и/или JNK2 и/или JNK3 в концентрации по крайней мере 10 мкМ. В другом варианте ингибитор JNK ингибирует активность JNK1 и/или JNK2 и/или JNK3 в концентрации по крайней мере 1-5 мкМ. В еще одном варианте ингибитор JNK ингибирует активность JNK1 и/или JNK2 и/или JNK3 в концентрации по крайней мере 1 мкМ. Предпочтительным циклоспорином является циклоспорин А. В одном варианте ингибиторы JNK представлены формулой I. Указанные соединения описаны в заявке WO 01/47920 (Applied Research Systems ARS Holding NV),в которой производные бензазолов формулы (А) предложены для применения, прежде всего при лечении нейронных расстройств, аутоимммунных заболеваний, рака и сердечно-сосудистых заболеваний.B соединениях формулы I G означает пиримидинил, L означает аминогруппу формулы -NR3R4, где 3R и R4 каждый независимо друг от друга означает Н или С 1-С 6 алкилгетероарил, где гетероарил представляет собой пиридил, R1 означает водород. Формула (I) также включает таутомеры, геометрические изомеры, оптически активные формы, такие как энантиомеры, диастереомеры и рацемические формы, также как и фармацевтически приемлемые соли указанных соединений. Предпочтительные фармацевтически приемлемые соли формулы (I) включают соли фармацевтически приемлемых кислот, такие как гидрохлорид, гидробромид, сульфат или бисульфат, фосфат или гидрофосфат, ацетат, бензоат, сукцинат, фумарат, малеат, лактат, цитрат, тартрат,глюконат, метансульфонат, бензолсульфонат и пара-толуолсульфонат. Более подробно, ацетонитрилы бензотиазола формулы (I) включают таутомерные формы, например, как указано ниже: В специальном варианте настоящего изобретения предлагаются ацетонитрилы бензотиазола формулы (Ia) в их таутомерных формах, например, как указано ниже:R1 и L имеют значения, как описано для формулы (I). В специальном варианте остаток L означает аминогруппу формулы -NR3R4, где R3 и R4 означают Н. В специфическом варианте L представляет собой следующую группу: где n равно от 1 до 6, R5 означает гетероарил, где гетероарил представляет собой пиридил. Специфический пример соединения формулы I включает соединение: 1,3-бензотиазол-2-ил(2-[2-(3-пиридинил)этил]амино-4-пиримидинил)ацетонитрил. Соединения формулы (I) получают по методикам, описанным в заявке WO 01/47920. В другом варианте ингибиторы JNK представлены формулой (II): где L1 означает -NHR3, где R3 означает прямой или разветвленный С 4-С 12 алкил, причем атом азота в указанном цикле образует связь с сульфонильной группой формулы I с образованием сульфонамида, R1 означает галоген, R2 означает водород. Примеры соединений формулы (II) включают 4-хлор-N-[(5-[4-(бутиламино)пиперидин-1-ил]сульфонилтиен-2-ил)метил]бензамид ацетонитрила. Соединения формулы (II) получают по известным методикам, описанным в заявках WO 01/23378,WO 02/28856 и WO 02/26733. Циклоспорины выпускаются в виде коммерческих препаратов, кроме того, их можно получить по любой методике, описанной в вышеуказанных патентах. Циклоспорин выпускается в виде продукта "Sandimmun Neoral" фирмы Novartis (циклоспорин А) или "Ciclosol" фирмы Ecosol (равноценен циклоспорину А). Эти продукты выпускаются в виде капсул по 10, 25, 50 и 100 мг, а также в виде концентрата для вливания, предназначенного для применения в качестве иммунодепрессанта, например, при трансплантации органов и тканей. Композиции по настоящему изобретению обладают улученной эффективностью по сравнению с композициями, содержащими только ингибиторы JNK или только циклоспорин. Действительно, установлено, что активность ингибиторов JNK при лечении воспаления или аутоиммунных заболеваний,ишемии, нейронального расстройства, сердечно-сосудистого заболевания или рака можно повысить(усилить) при комбинации с циклоспорином, прежде всего в случае лечения человека. Такие нарушения нейрональной системы включают, например, нейродегенеративные заболевания,например болезнь Альцгеймера, болезнь Гентингтона, болезнь Паркинсона, заболевания сетчатки, повреждения спинного мозга, рассеянный склероз, травмы головы, эпилепсию и эпилептические припадки,ишемию и гемораггический инсульт мозга. Нарушения иммунной системы включают, например, астму, отторжение трансплантата (при пересадке костного мозга, заболевание трансплантат-против-хозяина), воспалительные процессы, такие как воспаление кишечника (IBD), нарушения при изъязвлении хрящей и кости, ревматоидный артрит, септический шок, склеродерма, псориаз, дерматит. Композицию по настоящему изобретению можно использовать при лечении рака, такого как рак молочной железы, колоректальный рак, рак поджелудочной железы, предстательной железы, яичек, яичников, легких, печени и почек. В другом варианте композицию по настоящему изобретению можно использовать при лечении сердечно-сосудистых заболеваниц, включая атеросклероз, рестеноз, инсульт, ишемию, например ишемию мозга, инфаркт миокарда. В еще одном варианте композицию по настоящему изобретению можно использовать при лечении различных ишемических состояний, включая сердечную и почечную недостаточность, расстройства печени и повреждения мозга при реперфузии. В одном варианте композицию по настоящему изобретению можно использовать при лечении диабета. Пригодная доза циклоспорина (например, циклоспорина А) находится в диапазоне от 1 до 100 мг/кг, предпочтительно 5-50, например, 25 или 15 или 10 мг/кг. Доза ингибитора JNK находится в диапазоне от 10 до 100 мг/кг, предпочтительно 40-80 мг/кг. Пригодное молярное соотношение циклоспорин/ингибитор JNK составляет от 1:1 до 1:100, или 1:20, или 1:10 или 1:5, или 1:2 (в сторону увеличения содержания ингибитора JNK). Композиции по настоящему изобретению, кроме того, содержат стандартные адъюванты, носители,разбавители или эксципиент, их используют в различной форме, например, в твердой форме в форме таблеток или заполненных капсул, или жидкостей, таких как растворы, суспензии, эмульсии, элексиры,или капсулы, заполненные указанными жидкостями, причем все указанные формы используют для перорального введения или для инъекции парентеральным способом (включая подкожный способ). Такие фармацевтические композиции и их стандартные лекарственные формы могут включать ингредиенты в стандартном соотношении, в присутствии или в отсутствие дополнительных активных соединений или составных частей, и такие стандартные лекарственные формы могут содержать любое приемлемое эффективное количество активного ингредиента, соответствующее интервалу назначенной суточной дозы. Фармацевтические композиции по настоящему изобретению можно вводить множеством способов,включая пероральный, ректальный, чрескожный, подкожный, внутривенный, внутримышечный, внутриоболочечный, внутрибрюшинный и интраназальный способы. В зависимости от требуемого способа доставки соединения предпочтительно перерабатывают в инъекционную, местную или пероральную композицию. Композиции для перорального введения получают в виде жидких продуктов, например, растворов или суспензий или нерасфасованных порошков. Но в типичном случае композиции получают в виде стандартной лекарственной формы для обеспечения точной дозировки. Термин стандартная лекарственная форма означает физически дискретные элементы, пригодные для однократной дозировки при лечении человека или других млекопитающих, причем каждый элемент содержит предварительно определенное количество активного материала, достаточного для обеспечения требуемого терапевтического действия, в сочетании с пригодным фармацевтическим эксципиентом. Типичные стандартные лекарственные формы включают предварительно заполненные ампулы или шприцы определенного размера в случае жидкой композиции или пилюли, таблетки, капсулы или т.п. в случае твердой композиции. В таких композициях соединение бензотиазола обычно является минорным компонентом (от приблизительно 0,1 до приблизительно 50 мас.% или предпочтительно от 1 до приблизительно 40 мас.%), а остальное количество составляют различные носители или наполнители и вспомогательные материалы, упрощающие переработку в требуемую лекарственную форму. Пригодные для перорального введения жидкие формы включают пригодные водные или неводные наполнители и буферные вещества, суспендирующие и диспергирующие агенты, красители, ароматизоторы и т.п. Твердые формы включают, например, любой из следующих ингредиентов или соединений аналогичной природы: связующее, такое как микрокристаллическая целлюлоза, камедь трагакант или желатин, эксципиент, такой как крахмал или лактоза, дезинтегрирующий агент, такой как альгиновая кислота, примогель или кукурузный крахмал, замасливатель, такой как стеарат магния, глидант, такой как коллоидный диоксид кремния, подсластитель, такой как сахароза или сахарин, или ароматизатор,такой как перечная мята, метилсалицилат или апельсиновый ароматизатор. Композиции для инъекции обычно получают на основе инъекционного стерильного солевого и фосфатного-солевого буферных растворов или на основе других стандартных инъекционных носителей. Как указано выше, производное бензотиазола формулы I или сульфонамид формулы (II) в комбинации с циклоспорином в таких композициях обычно представляет собой минорный компонент, его содержание в большинстве случаев составляет диапазон от 0,05 до 10 мас.%, а остальное количество составляет инъекционный носитель и т.п. Описанные выше компоненты пероральных или инъекционных композиций представлены только для иллюстрации изобретения. Другие материалы и методы переработки и т.п. описаны в книге "Remington's Pharmaceutical Sciences", 20-e изд., Marck Publishing Company, Easton, Pennsylvania, гл.5 (2000), которая включена в данное описание в качестве ссылки. Композиции по настоящему изобретению можно также вводить в виде формы с замедленным высвобождением или в виде системы доставки лекарственного средства с замедленным высвобождением. Примеры таких типичных матералов для замедленного высвобождения также описаны в книге "Remington's Pharmaceutical Sciences". Пример 1. Получение фармацевтических составов В следующих примерах описаны примеры фармацевтических композиций по настоящему изобретению без ограничения перечисленным. Состав 1. Таблетки Сухой порошкообразный ингибитор JNK, например соединение бензотиазола формулы I, смешивали с циклоспорином и с сухим желатиновым связующим в массовом соотношении приблизительно 1:2. В качестве замасливателя добавляли незначительное количество стеарата магния. Из смеси формовали таблетки массой 240-270 мг (80-90 мг активного соединения бензотиазола в одной таблетке) в машине для таблетирования. Состав 2. Капсулы Сухой порошкообразный ингибитор JNK, например соединение бензотиазола формулы I, смешивали с циклоспорином и с крахмалом в качестве разбавителя в массовом соотношении приблизительно 1:1. Полученной смесью заполняли капсулы массой 250 мг (по 125 мг активного соединения бензотиазола и 25 или 50 мг циклоспорина в капсуле). Состав 3. Жидкость Ингибитор JNK, например соединение бензотиазола формулы I, циклоспорин (1250 мг), сахарозу(1,75 мг) и ксантановую камедь (4 мг) смешивали и просеивали через сито 10 меш U.S., затем смешивали с предварительно полученным раствором микрокристаллической целлюлозы и натриевой соли карбоксиметилцеллюлозы (11:89, 50 мг) в воде. Бензоат натрия (10 мг), ароматизатор и краситель разбавляли водой и добавляли в смесь при перемешивании. В полученную смесь добавляли воду до конечного объема 5 мл. Состав 4. Таблетки. Ингибитор JNK, например порошкообразные сухие соединения бензотиазола формулы I и циклоспорин смешивали с сухим желатиновым связующим в массовом соотношении приблизительно 1:2. Затем в качестве замасливателя добавляли небольшое количество стеарата магния. Из смеси формовали таблетки массой 450-900 мг (150-300 мг активного ингибитора JNK и 25 или 50 мг циклоспорина) на машине для таблетирования. Состав 5. Раствор для инъекции Ингибитор JNK, например соединение бензотиазола формулы I и циклоспорин растворяли в стерильном солевом буферном растворе для инъекций до концентрации приблизительно 5 мг/мл. Пример 2. Биологические испытания Преимущества композиций по настоящему изобретению можно продемонстрировать с использованием ряда методов анализа in vivo. Следующий метод анализа свидетельствует об улучшенной нейропротективной активности композиций по изобретению. Анализ in vivo: Нейропротективное действие ингибитора JNK в смеси с циклоспорином на модели глобальной ишемии у песчанок. Следующий метод анализа использовали для оценки нейропротективного действия исследуемых композиций in vivo на модели глобальной (обширной) ишемии у песчанок. Метод анализа В испытаниях использовали 73 особи песчанок (60-80 г, фирмы Elevage Janvier, Франция), 4 группы, в каждой 6-36 особей): Группа 1 (n=36): животным вводили внутрибрюшинно дозу носителя 10 мг/кг. Группа 2 (n=6): животным вводили внутрибрюшинно дозу циклоспорина 15 мг/кг. Группа 3 (n=8): животным вводили внутрибрюшинно дозу ингибитора JNK формулы (I) или (II) 60 или 40 мг/кг. Группа 4 (n=7-8): животным вводили внутрибрюшинно дозу исследуемой композиции, содержащей ингибитор JNK формулы (I) или (II) 60 или 40 мг/кг совместно с дозой циклоспорина 15 мг/кг. Методика испытаний Хирургия: Песчанок массой 60-80 г анестезировали 4% изофлураном (фирмы Baxter, Volketswil, Швейцария) из медицинского баллона с использованием хирургической маски. В ходе операции анестезию поддерживали с использованием 3% изофлурана до завершения операции. Билатеральную общую сонную артерию иссекали и обтурировали бульдожьей клеммой в течение 5 мин. Гистология: Через семь дней после начала закупорки животных обезглавливали. Мозг замораживали при -20C в 2-метилбутане и разрезали на срезы толщиной 20 мкм в криомикротоме (Microtom HM 500 ОМ, Walldorf, Германия). Срезы проявляли крезилацетатом фиолетовым и повреждения в гиппокампе оценивали по 5-балльной системе: 0 баллов: потери нейронов CA1 не наблюдается,1 балл: слабое повреждение CA1 (СА 1/основание или CA1/CA3 граница),2 балла: потеря нейронов CA1 (1/2),3 балла: потеря нейронов CA1 (1/2) и 4 балла: общая потеря нейронов CA1 и распространение на другие участки (CA3, зубчатая извилина, кора головного мозга). Общее число баллов определяли по сумме баллов в правом и левом полушариях. Результаты Пример 2 а. Например, для животных группы 4, которым в качестве ингибитора JNK вводили 1,3-бензотиазол 2-ил(2-[2-(3-пиридинил)этил]амино-4-пиримидинил)ацетонитрил, то есть соединение А (60 мг/кг,внутрибрюшинно), повреждения гиппокампа оценивали по данным гистологии и сравнивали с животными, которым вводили носитель (группа 1), и с животными, которым вводили только ингибитор JNK(группа 3): при совместном введении циклоспорина (15 мг/кг, внутрибрюшинно) наблюдается увеличение нейропротективного действия ингибитора JNK (60 мг/кг, внутрибрюшинно). Пример 2b. Например, для животных группы 4, которым в качестве ингибитора JNK вводили 4-хлор-N-[(5-[4(бутиламино)пиперидин-1-ил]сульфонилтиен-2-ил)метил]бензамид ацетонитрила, то есть соединение В(40 мг/кг, внутрибрюшинно), повреждения гиппокампа оценивали по данным гистологии и сравнивали с животными, которым вводили носитель (группа 1), и с животными, которым вводили только ингибиторJNK (группа 3): при совместном введении циклоспорина (15 мг/кг, внутрибрюшинно) наблюдается увеличение нейропротективного действия ингибитора JNK (40 мг/кг, внутрибрюшинно). В обоих примерах 2 а и 2b у животных группы 2 (то есть которым вводили только циклоспорин) не наблюдалось никакого эффекта, то есть при введении одного циклоспорина не наблюдается никакого увеличения эффекта по данным гистологии (сумма баллов). Таблица In - число исследованных животных,в/б - внутрибрюшинно,CO - средняя ошибка, соединение В означает 4-хлор-N-[(5-[4-(бутиламино)пиперидин-1 ил]сульфонилтиен-2-ил)метил]бензамид ацетонитрила Список литературы 1. Davis Roger J., Signal Transduction by the JNK Group of MAP Kinases, Cell, 103:239-252 (2000). 2. Gupta S. и др., Selective interaction of JNK protein kinase isoforms with transcription factors, The 21. Wenger, Transpl. Proc., т. 15, Suppl. 1, c 2230 (1983). 22. Wenger, Angew. Chem. Int. Ed., т. 24, c. 77 (1985). 23. Wenger, Progress in the Chemistry of Organic Natural Products, т. 50, c. 123 (1986). 24. Rich и др., J. Med. Chem., т. 29, c. 978 (1986). 25. WO 01/47920 26. WO 01/23378. 27. WO 02/28856. 28. WO 02/26733. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Фармацевтическая композиция, содержащая циклоспорин и ингибитор JNK, выбранный из соединений формулы (I) где G означает пиримидинил,L означает аминогруппу формулы -NR3R4, где R3 и R4, каждый независимо друг от друга, означают Н или C1-C6 алкилгетероарил, где гетероарил представляет собой пиридил,R1 означает водород,а также таутомеров, геометрических изомеров, оптически активных форм, таких как энантиомеры,диастереомеры и рацемические формы, и фармацевтически приемлемых солей указанных соединений. 2. Фармацевтическая композиция по п.1, в которой ингибитор JNK представлен любой из формул где R1 означает водород,L означает аминогруппу формулы -NR3R4, где R3 и R4 означают Н. 3. Фармацевтическая композиция по п.1, в которой ингибитор JNK представлен любой из формул где R1 означает водород,L означает аминогруппу формулы -NR3R4, где R3 и R4 определены в п.1. 4. Фармацевтическая композиция по п.3, в которой R3 означает водород, a R4 означает C1C6 алкилгетероарил, где гетероарил представляет собой пиридил. 5. Фармацевтическая композиция по п.3, в которой L представляет собой следующую группу: где n равно от 1 до 6,R5 означает гетероарил, где гетероарил представляет собой пиридил. 6. Фармацевтическая композиция по любому из пп.1-5, в которой ингибитор JNK представляет собой 1,3-бензотиазол-2-ил[2-[2-(3-пиридинил)этил]амино-4-пиримидинил]ацетонитрил. 7. Фармацевтическая композиция по любому из пп.1-6, в которой циклоспорином является циклоспорин А. 8. Фармацевтическая композиция по любому из пп.1-7, в которой молярное соотношение циклоспорин/ингибитор JNK составляет от 1:1 до 1:100. 9. Фармацевтическая композиция по любому из пп.1-8, в которой доза циклоспорина составляет от 1 до 100 мг/кг. 10. Фармацевтическая композиция по любому из пп.1-9, кроме того, включающая фармацевтически приемлемый эксципиент. 11. Фармацевтическая композиция по любому из пп.1-10, предназначенная для использования в качестве лекарственного средства, предназначенного для лечения нейронального расстройства, аутоиммунного заболевания, воспалительного процесса, рака или сердечно-сосудистого заболевания. 12. Фармацевтическая композиция, содержащая циклоспорин и ингибитор JNK, выбранный из соединений формулы (II) где L1 означает -NHR3, где R3 означает прямой или разветвленный C4-C12 алкил, причем атом азота в указанном цикле образует связь с сульфонильной группой формулы (I) с образованием сульфонамида,R1 означает галоген,R2 означает водород,а также геометрических изомеров, оптически активных форм, таких как энантиомеры, диастереомеры и рацемические формы, и фармацевтически приемлемых солей указанных соединений. 13. Фармацевтическая композиция по п.12, где R3 означает прямой или разветвленный C8-C12 алкил. 14. Фармацевтическая композиция по п.12 или 13, в которой ингибитор JNK представляет собой 4 хлор-N-[(5-[4-(бутиламино)пиперидин-1-ил]сульфонилтиен-2-ил)метил]бензамид ацетонитрила. 15. Фармацевтическая композиция по любому из пп.12-14, в которой циклоспорином является циклоспорин А. 16. Фармацевтическая композиция по любому из пп.12-15, в которой молярное соотношение циклоспорин/ингибитор JNK составляет от 1:1 до 1:100. 17. Фармацевтическая композиция по любому из пп.12-16, в которой доза циклоспорина составляет от 1 до 100 мг/кг. 18. Фармацевтическая композиция по любому из пп.12-17, кроме того, включающая фармацевтически приемлемый эксципиент. 19. Фармацевтическая композиция по любому из пп.12-18, предназначенная для использования в качестве лекарственного средства, предназначенного для лечения нейронального расстройства, аутоиммунного заболевания, воспалительного процесса, рака или сердечно-сосудистого заболевания. 20. Применение композиции по любому из пп.1-19 для получения лекарственного средства, предназначенного для лечения нейронального расстройства, аутоиммунного заболевания, воспалительного процесса, рака или сердечно-сосудистого заболевания.
МПК / Метки
МПК: A61K 31/551, A61K 31/4535, A61K 31/505, C07D 409/12, A61K 31/506, A61K 38/13, C07D 413/14, C07D 417/14, C07D 417/06, A61K 31/428
Метки: композиции, содержащие, циклоспорин, ингибитор
Код ссылки
<a href="https://eas.patents.su/12-17893-kompozicii-soderzhashhie-ingibitor-jnk-i-ciklosporin.html" rel="bookmark" title="База патентов Евразийского Союза">Композиции, содержащие ингибитор jnk и циклоспорин</a>
















