Иммунотерапевтические композиции для получения аутоантител, способных предотвращать связывание интерлейкина-2 со своим рецептором, и их использование в лечении рака
Номер патента: 12072
Опубликовано: 28.08.2009
Авторы: Алонсо Сардуи Ливан Бладимир, Перес Родригес Роландо, Монтеро Касимиро Хосе Энрике, Лаге Давила Агустин Бьенвенидо
Формула / Реферат
1. Терапевтическая композиция для индуцирования иммунного ответа против IL-2, используемая для терапии больных раком, включающая по крайней мере один из компонентов:
A - IL-2 или любое производное IL-2, присоединенные к любому белку-носителю генетически или химической коньюгацией, и включающий приемлемый адъювант;
В - моноклональное антитело против IL-2;
С - противораковая вакцина, основанная на специфичных опухолевых антигенах или факторах роста;
D - моноклональное антитело против CD25.
2. Терапевтическая композиция для индуцирования иммунного ответа против IL-2 по п.1, включающая одновременное или последовательное введение компонентов А+С или A+D или В+С или B+D.
3. Терапевтическая композиция для индуцирования иммунного ответа против IL-2 по п.1, включающая IL-2 или его любое производное, присоединенные к белку-носителю, и приемлемый адъювант.
4. Терапевтическая композиция для индуцирования иммунного ответа против IL-2 по п.3, включающая IL-2, присоединенный к белку-носителю, и приемлемый адъювант.
5. Терапевтическая композиция для индуцирования иммунного ответа против IL-2 по п.4, где используемый белок-носитель представляет собой P64k, полученный из Neisseria meningitidis.
6. Терапевтическая композиция для индуцирования иммунного ответа против IL-2 по п.5, где адъювант выбран из группы, включающей гидроокись алюминия и Montanide ISA 51.
7. Терапевтическая композиция для индуцирования иммунного ответа против IL-2 по п.6, где адъювантом является Montanide ISA 51.
8. Терапевтическая композиция для индуцирования иммунного ответа против IL-2 по п.1, включающая химический конъюгат между IL-2 и P64k.
9. Терапевтическая композиция для индуцирования иммунного ответа против IL-2 по п.1, включающая слитый белок, состоящий из IL-2 и P64k.
10. Терапевтическая композиция для индуцирования иммунного ответа против IL-2 по п.1, включающая слитый белок, состоящий из пептидов, производных от IL-2 и P64k.
11. Терапевтическая композиция для индуцирования иммунного ответа против IL-2 по п.1, включающая специфичное моноклональное антитело против IL-2 человека.
12. Терапевтическая композиция для индуцирования иммунного ответа против IL-2 по п.2, включающая введение пациенту IL-2 или любого его производного, присоединенного к белку-носителю, и адъюванта в комбинации с противораковой вакциной, основанной на специфичных опухолевых антигенах или факторах роста.
13. Терапевтическая композиция для индуцирования иммунного ответа против IL-2 по п.12, где противораковая вакцина включает EGF.
14. Терапевтическая композиция для индуцирования иммунного ответа против IL-2 по п.2, включающая введение пациенту IL-2 или любого его производного, присоединенного к белку-носителю, и адъюванта в комбинации со специфичным моноклональным антителом против CD25.
15. Терапевтическая композиция для индуцирования иммунного ответа против IL-2 по п.13, включающая специфичное моноклональное антитело против CD25.
16. Терапевтическая композиция по пп.1-15 для изготовления лекарственного препарата для индуцирования иммунного ответа против IL-2 и способного ингибировать рост опухолей у больных раком.
17. Применение терапевтической композиции по пп.1-15 для ингибирования роста опухолей.
Текст
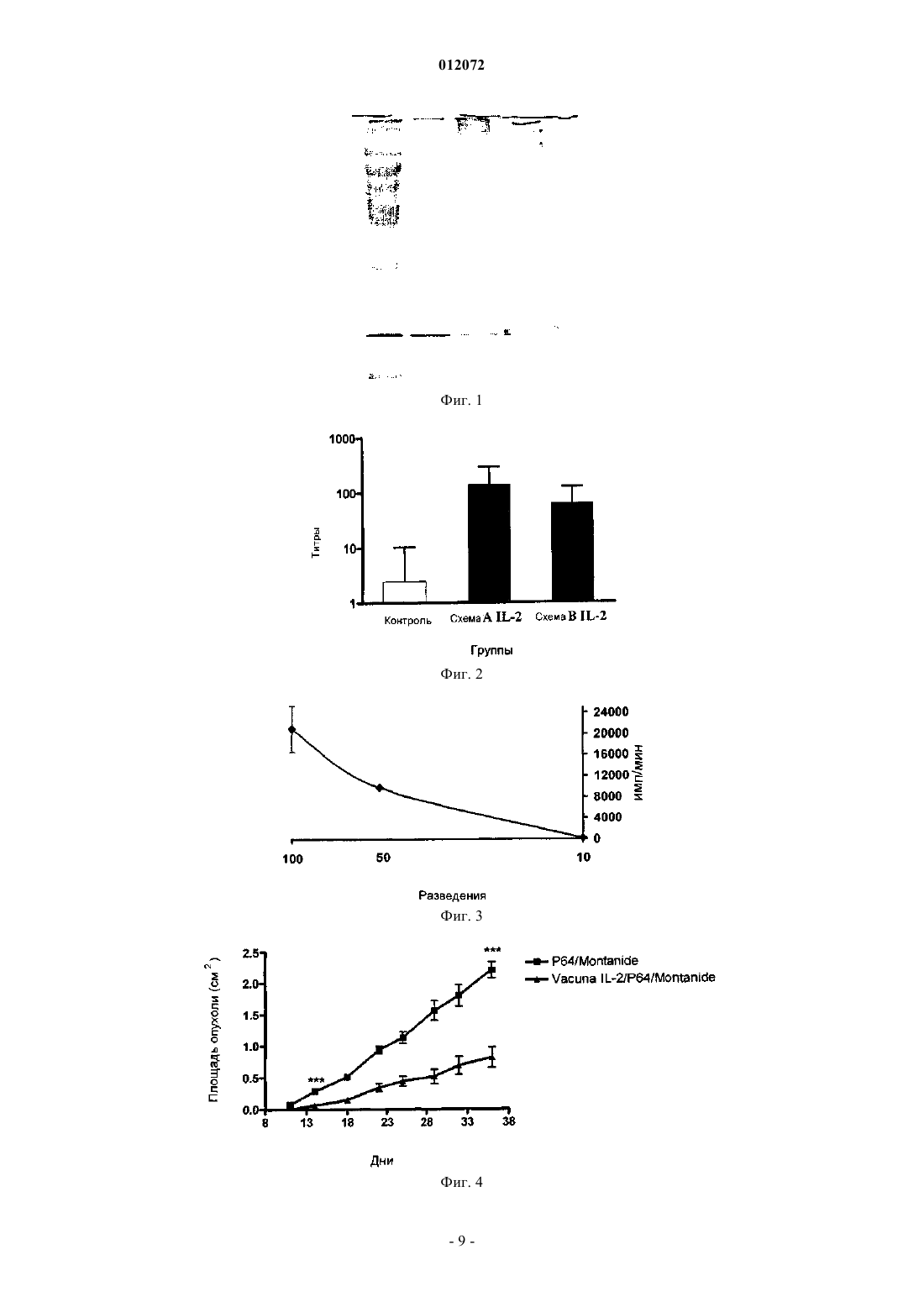
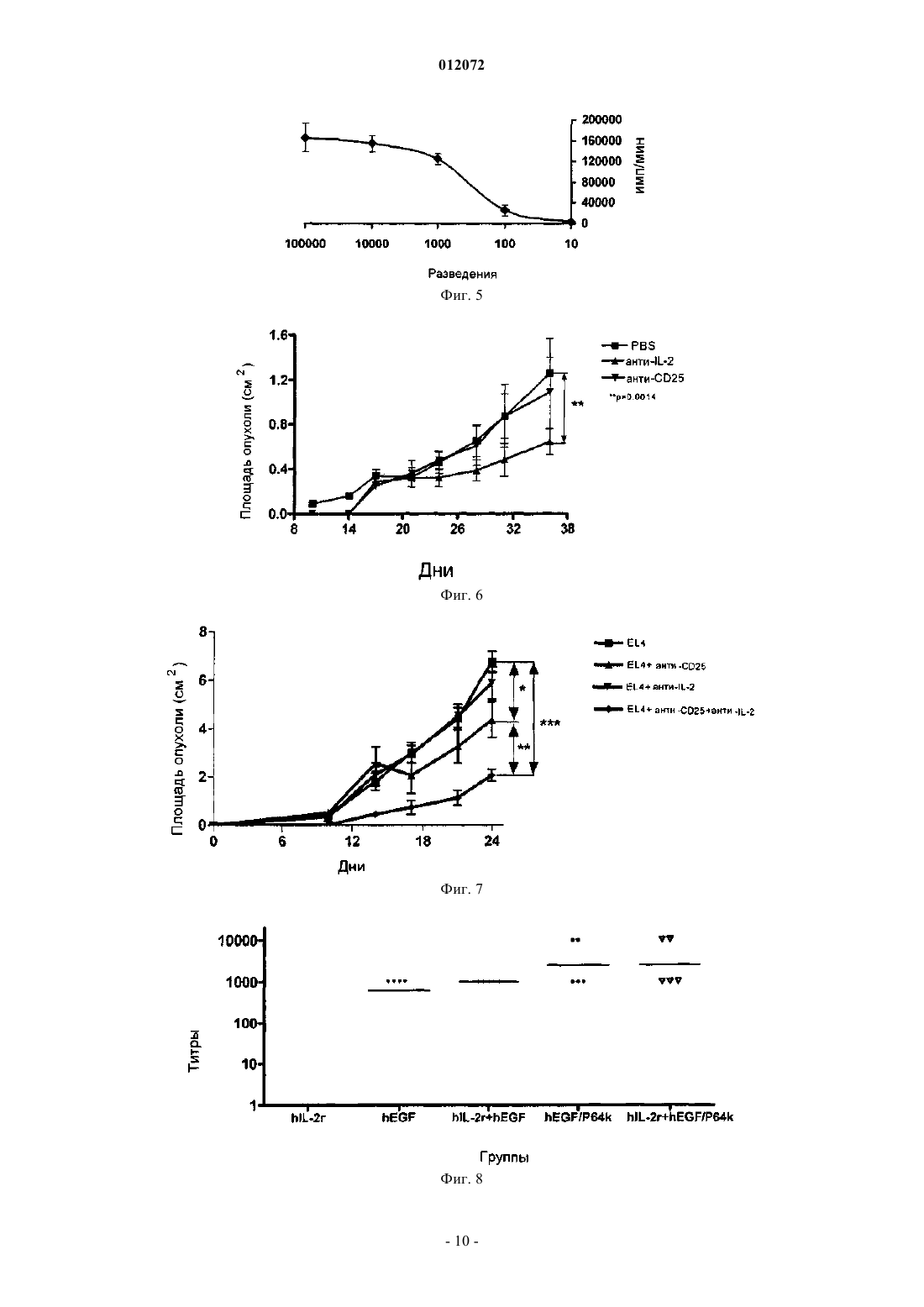
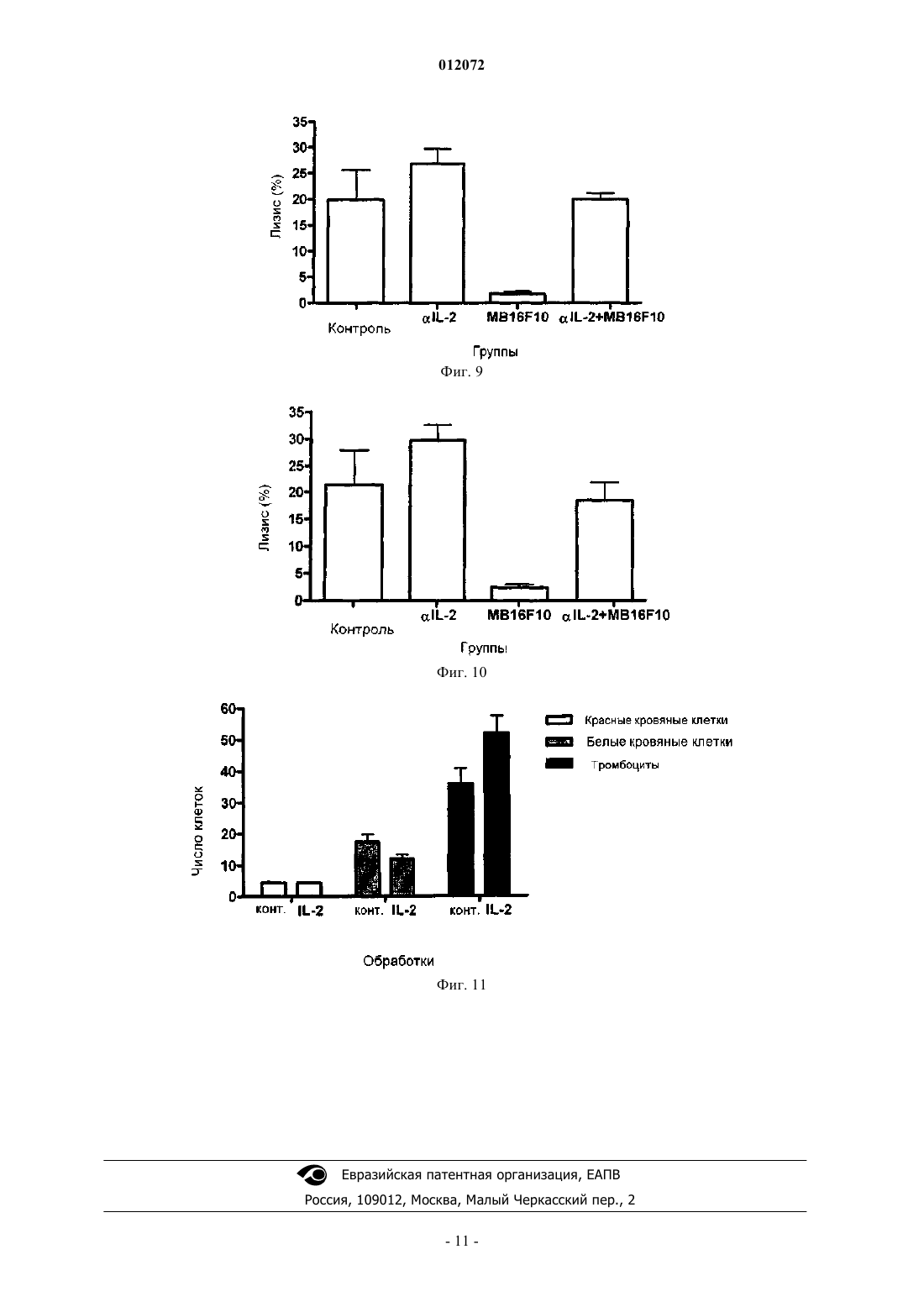
012072 Область техники, к которой относится изобретение Настоящее изобретение относится к фармацевтическим композициям, способным усиливать иммунный ответ против интерлейкина-2 (IL-2) и вызывать повышение титра аутоантител, которые блокируют связывание с рецептором и которые являются пригодными для лечения опухолей. Описание уровня техники Открытие способности иммунной системы, и в особенности Т-клеток, узнавать антигены опухоли представляет собой один из фундаментальных столпов для развития стратегий воздействия на иммунную систему с целью лечения пациентов с раком. Следовательно, для разработки методов для извлечения определенных Т-клеток, инфильтрирующих строму опухоли, известных как опухолеспецифичные лимфоциты или опухолевые инфильтрующиеся лимфоциты (TIL), или происходящих из периферической крови людей, не подвергнутых лечению, или после применения терапевтических противораковых вакцин, основные усилия были направлены на стимуляцию этих клеток с целью увеличить их противопухолевую эффекторную способность in vivo. Поэтому главные стратегии были направлены на усиление их специфического цитотоксического действия против множества опухолеассоциированных антигенов (TAA). Основной терапевтический подход был нацелен на использование in vitro интерлейкина-2 (IL-2), чтобы активировать и размножить TIL от людей, имеющих опухоль, которых затем повторно инъецируют этими клетками (Rosenberg, S.A. et al. (1986)et al. (1994) Proc. Natl. Acad. Sci. USA 91, 3515-3519). Однако такие вмешательства ограничили терапевтические результаты, несмотря на демонстрируемую стимуляцию клеточного иммунного ответа, полученного in vitro. Это привело к оценке терапевтических методов, основанных на использовании действующих методик специфической иммунизации терапевтическими противоопухолевыми вакцинами, с помощью разработки вакцинных векторов, которые содержат опухолевые антигены, связанные с IL-2, с целью облегчить индукцию эффективного клеточного иммунного ответа in vivo, но эти подходы дали плохие результаты (Rosenberg, S.A., et al. (1998) Nat. Med. 4, 321-327). В настоящее время основные клинические стратегии переключились на разработку метода лечения,основанного на адоптивном переносе реактивных Т-клеток пациента к его собственным опухолевым антигенам. Эти клетки стимулируются и размножаются in vitro с использованием моноклональных антител против CD3 (mAb) и IL-2 и предоставляются после повторной инфузии в ток крови IL-2 при помощи парентерального введения. Этот способ составляет одно из главных терапевтических вмешательств, задуманных для лечения больных раком, хотя терапевтические результаты продолжают оставаться невысокими (Dudley, M.E., et al. (2002) Science 298, 850-854; Rosenberg, S.A. et al. (2004) Proc. Natl. Acad. Sci.USA. 101 Suppl. 2, 14639-45). Рациональная разработка всех этих терапевтических стратегий основана на использовании интерлейкина-2 в качестве основной молекулы в клеточной активации противоопухолевого иммунного ответа(US 6060068 и US 5830452). Данные по функции IL-2 в иммунитете основаны на экспериментах, выполненных in vitro. После открытия IL-2 был признан способным стимулировать пролиферацию Т-клеток (так, акронимом IL-2 является фактор роста Т-клеток). Дальнейшая демонстрация пролиферации и функционирования Т-клеток in vitro могла быть остановлена с использованием антител к IL-2 или рецептору IL-2, что подтверждает эту точку зрения (Smith, K.А. Immunol. Rev. 51: 337-357, 1980). Недавно было экспериментально продемонстрировано, что человеческие опухоли могут снижать ответ иммунной системы путем генерации Т-клеток со способностью супрессии противоопухолевого иммунитета. Эти клетки были характеризованы в животных моделях и у пациентов, презентирующих различные маркеры дифференцировки, хотя их значимость отличается от экспериментальной модели(Bach, J.F. (2003) Nat. Rev. Immunol. 3, 189-198; Chakraborty, N.G., et al. (2004) Hum. Immunol. 65, 794802; Markus, Y.M. у Sykes, M. (2004) J. Clin. Oncol. 22, 1136-1151). Дифференцировочный кластер 25 (CD25) составляет альфа-цепь рецептора IL-2. Кроме того, структура рецептора для этого цитокина включает бета- (CD122) и гамма- (CD132) цепи. Они конститутивно экспрессируются в нестимулированных Т-лимфоцитах, и активация этих клеток вызывает синтез альфацепи, формирование гетеротримерного рецептора высокой аффинности и секрецию IL-2. CD25 конститутивно экспрессируется в 5-10% CD4+ Т-лимфоцитов и в менее чем 1% периферических CD8+ T-лимфоцитов. Эти клетки являются анергическими и проявляют супрессорную активность in vitro (Shevach, E.M.mAb против CD25 вызывает противоопухолевый ответ в небольшом количестве экспериментальных опухолей, хотя другие являются невосприимчивыми к такой терапии (Onizuka, S. et al. (1999) Cancer Res. 59, 3128-3133). Способность иммунной системы вызвать ответ против "своих" молекул ограничена, особенно по отношению к растворимым молекулам, таким как факторы роста. Однако активная иммунизация указанными факторами, связанными с белком-носителем и эмульгированными в адъювантах, способствует индукции иммунного ответа против этих молекул (патент США 5984018). Специфичные аутоантитела,произведенные против аутологичных или гетерологичных молекул, ингибируют связывание с их рецеп-1 012072 тором, блокируя механизмы пролиферации, индуцированные указанным связыванием. Исходя из этих результатов, в уровне техники принято, что противоопухолевый ответ зависит от присутствия IL-2. Следовательно, авторы решили характеризовать in vivo воздействие на развитие опухоли аутоантител к IL-2, индуцированных активной иммунизацией с IL-2, связанным с молекулойносителем в адъюванте. Удивителен тот факт, что индукция аутоантител, блокирующих связывание IL-2 с его рецептором,вызывает сокращение роста опухоли, даже в опухолях, которые являются устойчивыми к противоопухолевому действию, вызванному пассивным введением mAb против CD25. Дополнительно присутствие таких аутоантител не влияет на иммунный ответ к противораковым вакцинам у подвергнутых лечению участников эксперимента. Подробное описание изобретения Настоящее изобретение относится к фармацевтическим композициям, которые оказывают эффект при лечении опухолей, для которых является важной роль иммунной системы испытуемого. В частности,настоящее изобретение включает генерацию иммунотерапевтических композиций, способных повысить титр аутоантител, которые блокируют связывание интерлейкина-2 с его рецептором и ингибируют рост опухолей. Объектом настоящего изобретения является терапевтическая композиция, которая ингибирует связывание IL-2 с его рецептором, являющаяся полезной в лечении больных раком, где указанная композиция включает IL-2 или его пептиды, связанные с белком-носителем; дополнительно указанная композиция содержит подходящий адъювант. В частности, терапевтическая композиция настоящего изобретения включает белок-носитель Р 64k, полученный из Neisseria meningitidis и адъюванта, выбранного из группы, включающей гидроокись алюминия и Montanide ISA 51. В варианте исполнения настоящего изобретения терапевтическая композиция включает IL-2, присоединенный к Р 64k путем химической конъюгации. В другом варианте исполнения настоящего изобретения композиция включает IL-2 или его пептиды и P64k в составе гибридного белка. Также терапевтическая композиция по изобретению ингибирует связывание IL-2 с его рецептором и полезна при лечении людей с раком, и также включает специфичное моноклональное антитело противIL-2 человека (hIL-2). Способ лечения больного раком является также объектом настоящего изобретения, при котором требуется блокада связывания IL-2 со своим рецептором, с целью вызвать подходящий иммунный ответ против опухоли, и который включает введение вакцинной композиции, которая содержит IL-2 или антитело против IL-2. В другом аспекте настоящего изобретения говорится о терапевтической комбинации вакцины, основанной на IL-2 с другими противораковыми вакцинами, основанными на специфических опухолевых антигенах или факторах роста опухоли, а также химиотерапевтических агентах или радиотерапии, обычно используемых на данный момент. Термин "терапевтическая комбинация" относится к физической комбинации (т.е. в форме смеси) относительно объединения двух составленных как различные и отдельные систем (пример в форме партий реактивов), и когда они используются в комбинации, чтобы лечить пациента. Таким образом, фармацевтические комбинации представляют собой те полезные комбинации в схеме лечения, которые вовлекают введение двух составляющих, более предпочтительно физической смеси, нежели независимых доз,которые вводят тому же самому пациенту в ходе терапии. Термин "противораковые вакцины" относится к полезному агенту в активной иммунотерапии, такому, который вызывает у участника эксперимента,подвергнутого лечению, иммунный ответ, который узнает антиген, используемый в вакцине, и этот показатель может быть измерен. Получение иммуногенной композиции Вакцинная композиция настоящего изобретения включает в качестве активного начала человеческий рекомбинантный интерлейкин-2 (hIL-2r), сшитый с белком-носителем, предпочтительно белком,полученным из внешнего мембранного комплекса Neisseria meningitidis P64k (ЕР 0474313 А 2 и патент США 5286484). Дополнительно эта вакцинная композиция включает соответствующий адъювант. В вакцинной композиции настоящего изобретения в качестве адъюванта используется предпочтительноMontanide ISA 51. Конъюгация между hIL-2r и белком-носителем может быть химической конъюгацией или представлять собой конструкцию в виде гибридного белка, полученного методами генной инженерии. Получение вакцинной композиции, которая включает hIL-2r,сшитый с белком Р 64k химической конъюгацией Чтобы получить белковый конъюгат между hIL-2r и белком Р 64k, оба компонента смешивают в переменной пропорции от 20:1 до 5:1 (моль hIL-2r к молю белка P64k), предпочтительно 10:1 (моль hIL-2r к молю белка P64k). Глутаральдегид добавляют к этой смеси в конечной концентрации, имеющей значение между 0,02 и 0,1%, предпочтительно 0,5%, и инкубируют при комнатной температуре (RT) в течение 1-5 ч. В заключение указанную смесь тщательно диализуют в фосфатно-солевом буферном растворе (PBS). Реакцию конъюгации подтверждают электрофорезом в 10% ДСН-полиакриламидном геле (Laemmli-2 012072 Получение вакцинной композиции, которая включает гибридный белок между hIL-2r и белком Р 64k Ген, который кодирует IL-2 человека (447 п.н.), амплифицируют полимеразной цепной реакцией(PCR) с использованием специфичных праймеров. Получающийся фрагмент ДНК расщепляют и встраивают по специфическому связывающему сайту в экспрессионный вектор, в котором клонирован ген, который кодирует белок-носитель, таким образом, что получающийся белок включает одну или более копий обеих молекул. Может использоваться любой экспрессирующий вектор как для клеток млекопитающих, так и для бактерий или дрожжей. Вектор также может включать шесть гистидинов на N-конце белка-носителя. Получающуюся плазмиду проверяют рестрикционным анализом при помощи электрофореза в агарозном геле; анализом последовательности ДНК с использованием фермента Sequenase 2,0(Amersham-USB); и наконец, анализом продукции слитого белка в любом экспрессионном штаммеEschericia coli с помощью метода "Вестерн блоттинга" с использованием специфичного моноклонального антитела против hIL-2. Чтобы получить белок, стенки бактериальных клеток разрушают, используя метод сильного разрыва дробления, после чего белок очищают с помощью комбинации различных методов осаждения с сульфатом аммония и хроматографических методов. Наконец, белок фильтруют в стерильных условиях и хранят при -20 С или лиофилизируют и хранят при 4 С до его последующего использования. Получение вакцинных композиций, которые включают пептиды, производные от hIL-2r,химически сшитые с белком P64k или соединенные в виде гибридного белка Пептиды, производные от аминокислотной последовательности IL-2, полученные химическим синтезом, могут быть связаны с помощью химической конъюгации с белком P64k, как это описано в патенте США 5984018. Альтернативно, гибридный белок пептида, производного от hIL-2r, и белка Р 64k получают, по существу, тем же самым способом, описанным в предыдущем пункте. Примеры могут включать пептиды из следующих областей. Электрофорез химического конъюгата hIL-2r-P64k Электрофорез может быть выполнен в 10% ДСН-полиакриламидном геле (Laemmli U.K. (1970)Nature 277, 680-685). В лунку наносят по 15 мкг пробы и окрашивают с помощью кумасси. Характеристика эффекта, вызванного вакцинной композицией, которая включает hIL-2r и белок P64k,доклинические исследования Иммуногенность вакцинной композиции. Чтобы изучить иммуногенность препарата вакцины настоящего изобретения у животных, использовались самки мышей линии BALB/c в возрасте 8-12 недель и весом 18-20 г. В ходе эксперимента мыши содержались в стандартных условиях кормления и манипуляций, установленных Стандартным Регламентом Работ (SOPs), согласно Рекомендуемым Нормам содержания и использования экспериментальных животных. Можно следовать различным графикам иммунизации. График А, 4 дозы по 4 мкг эквивалента hIL-2r, конъюгированного в вакцине hIL-2r-P64k/MontanideISA 51 в объеме 0,1 мл, вводят внутримышечным путем каждые 2 недели, чередуя участки иммунизации на конечностях. График В, 4 дозы по 10 мкг эквивалента hIL-2r, конъюгированного в вакцине hIL-2r-P64k/MontanideISA 51 в объеме 0,1 мл, вводят внутримышечным путем. Первые 2 дозы вводят одновременно в независимых участках иммунизации на двух конечностях, а 2 недели спустя 2 дозы вводят в две другие конечности. Оценка ответа антител против hIL-2r, вызванного вакциной hIL-2r-P64k/Montanide ISA 51 Титры аутоантител могут быть определены в сыворотке одним из методов, доступных из уровня техники для анализа блокирующих антител или оценки специфического иммунного ответа в периферической крови, путем анализа специфичных антител или В-клеток. Антитела против hIL-2r, индуцированные вакциной hIL-2r-P64k/Montanide ISA 51, могут быть оценены косвенным ELISA (твердофазный иммуноферментный анализ) с сыворотками иммунизированных животных, как это описано. В 96-луночные плоскодонные микропланшеты (Costar, High Binding, USA) наносят по 50 мкл на лунку hIL-2r, приготовленного в концентрации 10 мкг/мл в 0,1 М карбонатбикарбонатном буфере, рН 9,6. Планшеты инкубируют в течение ночи при 4 С и промывают каждую лунку 2 раза 200 мкл PBS, содержащим 0,05% Tween 20 (PBS-Tween 20). После инкубации в течение 1 ч при 37 С со 100 мкл на лунку буфера, содержащего 1% бычьего сывороточного альбумина (PBS-BSA 1%), планшеты промывают 200 мкл на лунку PBS-Tween 20 и затем добавляют 50 мкл на лунку образцов сыворотки в различных разведени-3 012072 ях в 1% PBS-BSA. После инкубации в течение 1 ч при 37 С планшеты промывают PBS-Tween 20 и добавляют 50 мкл на лунку противомышиной сыворотки овец, конъюгированной с щелочной фосфатазой(Jackson lmmunoresearch Laboratories), разведенной 1/5000 в PBS-BSA, и инкубируют 1 ч при 37 С. Планшеты промывают и добавляют по 50 мкл на лунку раствора субстрата, содержащего 1 мкг/мл п-нитрофенилфосфата (Sigma) в диэтаноламиновом буферном растворе, рН 9,8. После инкубации планшетов в течение 30 мин при комнатной температуре (RT) спектральное поглощение продукта реакции измеряютELISA-считывающим устройством (Organon Teknika, Австрия) при 405 нм. Оценка ответа антител против hEGF, индуцированного основанной на EGF вакциной Титры аутоантител могут быть определены в сыворотке одним из методов, доступных из уровня техники для анализа блокирующих антител или оценки специфического иммунного ответа в периферической крови, путем анализа специфичных антител или В-клеток. Антитела к hEGF, индуцированные вакциной, основанной на EGF, могут быть оценены косвеннымELISA (твердофазный иммуноферментный анализ) с сыворотками иммунизированных животных, как это описано у Gonzalez, G., et al. (2002) Vaccine Research 5, 233-244. Воздействие на пролиферацию линии клеток CTLL-2 после инкубации с сыворотками животных,вакцинированных hIL-2-P64k/Montanide ISA 51 или специфическим моноклональным антителом (mAb) к hIL-2r Линию IL-2-зависимых Т-клеток, какой является CTLL-2, поддерживают в среде RPMI-1640, содержащей 1 Ед/мл hIL-2h при непрерывной пролиферации. Культуру CTLL-2 приготавливают в 75 см 2 колбах для клеточных культур, содержащих 25 мл RPMI-1640 с 8-20% эмбриональной сыворотки теленка (FCS) с плотностью суспензии клеток 0,5105-106 клеток/мл. Клетки используются через 2 дня после размножения in vitro. Для проведения анализа клетки извлекают из культуры in vitro и промывают не менее 4 раз RPMI1640 или PBS. В 96-луночные плоскодонные культуральные планшеты (Costar, High Binding, USA) высевают 5103 клеток. Эти клетки обрабатывают растворами сывороток животного, иммунизированного вакциной hIL-2-P64k/Montanide ISA 51 с титром ELISA к IL-2 1:10000 или специфическими mAb противIL-2, и добавляют 1 Ед/мл hIL-2r. Культуру подготавливают в течение 24 ч во влажной атмосфере с 5%CO2 при 37 С в инкубаторе. Пролиферацию анализируют с помощью импульсной подачи [3 Н]тимидина(1 мкКи/лунка) в течение заключительных 18-24 ч культивирования. Включение тимидина измеряют жидкостным сцинтилляционным счетчиком. Все манипуляции проводят в стерильных условиях. Противоопухолевое действие вакцины hIL-2-P64k/Montanide ISA 51,доклинические исследования Для изучения у животных противоопухолевого эффекта препарата вакцины настоящего изобретения используются самки мыши BALB/c в возрасте 8-12 недель и весом 18-20 г. Животные могут быть иммунизированы вакциной hIL-2-P64k/Montanide ISA 51 согласно предварительно назначенным схемам А и В, и 1 неделю спустя делают прививку линией клеток опухоли, такой как грудная карцинома F3II,дозой 5104 клеток на животное подкожным путем ортотропно. Мыши, имеющие прощупываемые опухоли, отбираются как положительные, рост опухоли измеряют, используя штангенциркуль, причем самая большая длина поверхности (а) и ее перпендикулярная ширина (b) была определена, и размер опухоли обозначили как аb. Опухоль проверяли периодически. Неожиданно авторы настоящего изобретения обнаружили, что имеет место нейтрализация связывания IL-2 с его рецептором у испытуемых, имеющих злокачественную опухоль, иммунный ответ против этой опухоли увеличивается, вызывая сокращение размера опухоли. Предыдущий уровень техники показывал, что такое действие может вызвать ингибирование ответа иммунной системы человека к опухоли. Авторы нашли, что указанное воздействие на рост опухоли оказывается при существенном снижении уровней циркулирующего IL-2, когда испытуемый находится под активной терапией вакцинной композицией настоящего изобретения, как в тех случаях, когда указанное снижение получено при пассивной терапии моноклональными антителами к IL-2. По этой причине результаты настоящего изобретения обладают бесспорными преимуществами при лечении пациентов, страдающих от злокачественных опухолей, и предоставляют способ вакцинирования с IL-2, который является эффективным, простым и намного менее раздражающим и агрессивным для пациентов, чем обычные способы лечения, используемые в указанных случаях. Следующие примеры включают экспериментальные детали, иллюстрируя иммунологическую эффективность вакцинных композиций, представляющих собой объект изобретения. Примеры Человеческий рекомбинантный IL-2 (hIL-2r), используемый в составе вакцины настоящего изобретения, был коммерчески доступен (патент США 5614185). Белок Р 64k из Neisseria Meningitidis, используемый в вакцине, был получен технологией рекомбинантной ДНК, описанной в ЕР 0474313 А 2 и патенте США 5286484. Пример 1. Ответ антител, вызванный вакциной hIL-2r-P64k/Montanide ISA 51. Чтобы повысить иммуногенность против человеческого интерлейкина-2, молекулу интерлейкина-4 012072 химически присоединяют к белку-носителю, белку P64k из Neisseria Meningitidis. Химическая конъюгация может быть проведена глутаральдегидным методом (патент США 5984018). Эффективность конъюгации проверяют с помощью электрофореза в 10% ДСН-полиакриламидном геле, нанося образцы каждого компонента по отдельности (hIL-2r, P64k), сравниваемые с химическим конъюгатом hIL-2r-P64k и стандартным образцом молекулярного веса. Из-за существования сплошной полосы на дорожке, где был нанесен hIL-2r-P64k, можно подтвердить, что конъюгат был получен (фиг. 1). Чтобы оценить ответ антител на hIL-2r, вызванный вакциной hIL-2r-P64k/Montanide ISA 51, мышиBALB/c были иммунизированы по схемам A и В. Гипериммунная сыворотка животного, которое отвечает на вакцину hIL-2r-P64k/Montanide ISA 51, использовалась в качестве положительного контроля, а сыворотка, полученная до иммунизации, в качестве отрицательного контроля. Это было определено как титр антител иммунизированных животных, причем разведение было больше во столько раз, во сколько раз оптическая плотность сывороток была выше, чем среднее значение оптической плотности доиммунной сыворотки плюс пятикратное стандартное отклонение. Чтобы определить титры у контрольных животных, использовался тот же вышеуказанный критерий, если только в качестве отрицательного контроля вместо доиммунной сыворотки не использовался 1% PBS-BSA. Был индуцирован ответ антител, достигающий титров от 1:100 до 1:50000. Указанная схема иммунизации длится приблизительно 52 дня, вот почему было необходимо внести в нее изменения, чтобы получить подобные или лучшие титры антител за более короткий период времени, таким образом, авторы использовали схему В и получили подобные результаты, которые представлены на фиг. 2. Пример 2. Анализ пролиферации линии клеток CTLL-2, обработанных сыворотками животных,иммунизированных вакциной hIL-2-P64k/Montanide ISA 51. Способность к связыванию IL-2 in vitro у антител сыворотки, выработанных животными, иммунизированными вакциной hIL-2r-P64k/Montanide ISA 51, была оценена путем культивирования указанных антител с линией IL-2-зависимых Т-клеток CTLL-2. Клетки CTLL-2 были посеяны в культуральные планшеты в присутствии IL-2, чтобы позволить им вырасти, после чего были добавлены различные разведения сывороток животного с титрами антител приблизительно 1:10000. Наблюдалась прямая корреляция между концентрацией сыворотки и ингибированием пролиферации линии клеток CTLL-2 (фиг. 3). Это демонстрирует способность сыворотки вакцинированных животных к нейтрализации IL-2 in vitro. Пример 3. Противоопухолевые эксперименты с животными, подвергнутыми терапии вакциной hIL2-20 P64k/Montanide ISA 51. Животные были иммунизированы вакциной hIL-2r-P64k/Montanide ISA 51 по схеме В. 1 неделю спустя животных подвергли контрольному заражению 5104 клетками опухоли F3II. Кинетические показатели роста опухоли у животных, иммунизированных hIL-2r-P64k/MontanideISA 51, были ниже по сравнению с контрольной группой, иммунизированной PBS-P64k/Montanide ISA 51 (фиг. 4 а). Между размерами опухоли в двух указанных группах наблюдались статистически существенные различия. Пример 4. Анализ пролиферации линии клеток CTLL-2, обработанных специфичными mAb противIL-2. Способность к связыванию IL-2 in vitro у специфичных антител против hIL-2r, выработанных гибридомой S4B6 (АТССНВ-8794), была оценена путем культивирования указанных антител с линией IL2-зависимых Т-клеток CTLL-2. Клетки CTLL-2 были посеяны в культуральные планшеты в присутствииIL-2, чтобы позволить им вырасти, после чего были добавлены различные разведения антител. Наблюдалась прямая корреляция между концентрацией сыворотки и ингибированием пролиферации линии клеток CTLL-2 (фиг. 5). Было обнаружено, что при разведении 1:100 антитела способны ингибировать более чем 80% пролиферации линии клеток CTLL-2, демонстрируя способность моноклонального антитела к нейтрализации IL-2 in vitro. Пример 5. Противоопухолевый эффект mAb против IL-2 и mAb против CD25 (АТСС-РС 61). F3II экспериментальная модель (карцинома молочной железы). Мышей ежедневно обрабатывали дозой специфичного моноклоналького антитела в количестве 1 мг(mAb против IL-2 или mAb против CD25) в течение 5 дней подряд. 2 дня спустя мышей подвергли контрольному заражению 5104 клетками/мышь экспериментальной карциномы молочной железы F3II подкожной инъекцией ортотропно. Самую протяженную длину поверхности (а) и перпендикулярную ширину опухоли (b) измеряли периодически. Размер опухоли в контрольной группе (обрабатываемой PBS) был больше, чем в группе, обрабатываемой mAb против IL-2 (фиг. 6). Размер опухоли между двумя экспериментальными группами был статистически различен. Однако размер опухоли у животных, обрабатываемых mAb против CD25 (АТСС-РС 61), был аналогичным по сравнению с контрольной группой. Этот результат показывает, что антитела, нейтрализующие IL-2, оказывают мощный противоопухолевый эффект даже в тех опухолях, в которых удаление регуляторных CD25 клеток не дает никакого эффекта. Пример 6. Противоопухолевый эффект mAb против IL-2 и mAb против CD25 (ATCC-PC61). EL4 экспериментальная модель (лимфома). Животных C57BL/6 заражали подкожно 5104 клетками лимфомы EL4 на мышь. Животных обраба-5 012072 тывали внутривенно 1 дозой 1 мг mAb против CD25 (РС 61) за 2 дня до заражения опухолью или ежедневной дозой 1 мг mAb против IL-2 (S4B6) в течение 5 дней подряд, начиная за 6 дней до прививки опухоли. Другим группам также вводили mAb к CD25 и к IL-2 в соответствии с аналогичным графиком,описанным выше. Рост опухоли в каждой группе мышей был зарегистрирован. Размер опухоли у каждой мыши дважды измеряли по двум перпендикулярным измерениям еженедельно после вызова опухоли. Статистические различия для опухоли EL4 равны р=0,0232, р=0,0039, р 0,0001. На фиг. 7 показано, что комбинация двух моноклональных антител оказала сильный эффект на рост опухоли. Пример 7. Индукция аутоантител к IL-2 не влияет на ответ противораковой вакцины EGF. Для оценки того, был ли ответ антител против hEGF, индуцированный вакциной hEGFP64k/Montanide ISA 51, вызван предыдущей вакцинацией с hIL-2r, которая приводит к индукции аутоантител, животные BALB/c были иммунизированы препаратом вакцины hIL-2r-P64k/Montanide ISA 51 согласно схеме А, а 9 дней спустя иммунизированы препаратом вакцины hEGF-P64k/Montanide ISA 51 илиhEGF/Montanide ISA 51. Во всех экспериментах, где была проведена иммунизация вакциной hEGF, 4 мкг эквивалента hEGF, связанного в препарате вакцины, вводили внутримышечным путем в объеме 0,1 мл. Гипериммунная сыворотка животных, реагирующих на вакцину hEGF-P64k/Montanide ISA 51, использовалась в качестве положительного контроля, а отрицательным контролем являлась доиммунная сыворотка. Это было определено как титры антител иммунизированных животных, причем разведение было больше во столько раз, во сколько раз оптическая плотность сывороток была выше, чем среднее значение оптической плотности доиммунной сыворотки плюс пятикратное стандартное отклонение. Чтобы определить титры в контрольных группах животных, использовался тот же предыдущий критерий, если только в качестве отрицательного контроля вместо доиммунной сыворотки не использовался 1% PBS-BSA. Было найдено, что индукция аутоантител против hIL-2r не влияет на титры антител против EGF, индуцированные вакцинацией EGF/Montanide ISA 51 или hEGF-P64k/Montanide ISA 51, как показано на фиг. 8. Пример 8. Нейтрализация интерлейкина-2 in vivo восстанавливает цитолитическую активность,оцененную в клетках лимфатических узлов организмов-хозяев, имеющих опухоль. Был оценен эффект нейтрализации IL-2 на иммунный ответ к номинальному антигену у организмахозяина, имеющего опухоль. Самки мыши C57BL/6J (Н-2b) содержались в стандартных условиях размещения. Для всех экспериментов использовались мыши в возрасте от 6 до 12 недель. Овальбумин (OVA) и пептиды: OVA grade VII (Sigma, St. Louis, МО), были модельными белковыми антигенами, используемыми в ходе этих экспериментов. Доминантный пептид OVA275-264 (SIINFEKL) использовался при чистоте 90%. Анализ пролиферации: мыши C57BL/6 были заражены 104 клетками опухоли MB16F10 или PBS, введенными подкожным путем в левый бок. Диаметры опухоли измеряют периодически. 3 недели спустя эти мыши были иммунизированы в день 0 подкожно 1 мг OVA с использованием 100 мкг/мышь полиинозиновой:полицитидиловой кислот [poly I:C] (PIC) (Sigma, St. Louis, МО), а в последующие 2 дня вводили только PIC. Одновременно животных обрабатывали специфическим моноклональным антителом к hIL-2r (IL-2) или PBS 5 дней подряд. Цитолитическая активность in vivo была определена с использованием клеток селезенки от нативных мышей, дифференцированно меченных флуоресцентным красителем CFSE (Molecular Probes, Paisley, Великобритания). Клетки, меченные CFSE на высоком уровне (CFSEhigh), использовались как целевые и обрабатывались SIINFEKL в импульсном режиме (1 мкМ; 90 мин при 37 С, 5% СО 2), тогда как клетки, слабо меченные CFSE (CFSElow), были оставлены необработанными, чтобы служить внутренним контролем. Импульсно обработанные пептидом целевые клетки были тщательно промыты, чтобы удалить свободный пептид, а затем, вместе с необработанными клетками, введены внутривенно предварительно иммунизированным мышам в отношении 1:1. 16 ч спустя лимфатические узлы и селезенка были удалены, и общее число событий, соответствующих значениям обеих интенсивностей флуоресценции (CFSElow и CFSEhigh), было определено поточной цитометрией. Отношение между процентами непокрытых клеток и SIINFEKL-покрытых(CFSEint/CFSEhigh) было вычислено, чтобы получить числовое значение цитотоксичности. Цитолитическая активность клеток лимфатических узлов по отношению к пептиду OVA, оцененная in vivo в мышахC57BL/6, иммунизированных OVA плюс PIC, давала максимальный ответ. Введение ежедневно в течение 5 дней подряд моноклонального антитела к IL-2 в дозе 1 мг внутривенной инъекцией не влияет на цитолитический ответ у этих животных. Мыши C57BL/6, которых заражают опухолью MB16F10, испытывают иммуносупрессию с пониженной цитолитической активностью по отношению к OVA. Однако введение моноклонального антитела со способностью к нейтрализацииIL-2 in vivo восстанавливает иммунный ответ клеток лимфатических узлов (фиг. 9). Пример 9. Нейтрализация интерлейкина-2 in vivo восстанавливает цитолитическую активность,оцененную в клетках селезенки организмов-хозяев, имеющих опухоль. Был оценен эффект нейтрализации IL-2 на иммунный ответ к номинальному антигену в имеющем опухоль организме-хозяине. Мыши C57BL/6 были иммунизированы OVA плюс PIC, и была оценена цитолитическая активность клеток селезенки по отношению к пептиду OVA in vivo, дав максимальный ответ. Введение ежедневно в течение 5 дней подряд моноклонального антитела к IL-2 в дозе 1 мг внутривенной инъекцией не влияет на цитолитический ответ у этих животных. Мыши C57BL/6, которых зара-6 012072 жают опухолью MB16F10, испытывают иммуносупрессию с пониженной цитолитической активностью по отношению к OVA. Однако введение моноклонального антитела со способностью к нейтрализацииIL-2 in vivo восстанавливает иммунный ответ клеток лимфатических узлов (фиг. 10). Пример 10. Подсчет клеток крови у животных, иммунизированных препаратом вакцины hIL-2rP64k/Montanide ISA 51. С целью оценить, вызывает ли иммунизация препаратом вакцины hIL-2r-P64k/Montanide ISA 51 изменения количества клеток крови, был проведен подсчет красных кровяных клеток, белых клеток крови и тромбоцитов как у животных, иммунизированных препаратом вакцины (согласно схемы А), так и у животных без вакцинации через 100 дней после первой иммунизации. Как видно на фиг. 11, ни одно животное не проявляло различий в количестве клеток среди проанализированных групп. Краткое описание фигур Фиг. 1 - электрофорез химически коньюгированного hIL-2r-P64k. Полосы слева направо соответствуют P64k, hIL-2r, hIL-2r-Р 64k и стандартному образцу молекулярной массы, соответственно. Фиг. 2 - титры антител против hIL-2r, индуцированные вакцинацией hIL-2r-P64k/Montanide ISA 51 с использованием вышеописанных обоих графиков иммунизации. Ось у представляет среднее геометрическое значение титра антител против IL-2. Ось x представляет группы, которые соответствуют животным,иммунизированным с. Контроль: P64k/Montanide ISA 51. Схема A IL-2: hIL-2r-P64k/Montanide ISA 51 согласно схеме А. Схема В IL-2: hIL-2r-P64k/Montanide ISA 51 согласно схеме В. Фиг. 3 - пролиферация линии CTLL-2 в присутствии hIL-2r и различных разведений сывороток животных, иммунизированных вакциной hIL-2r-P64k/Montanide ISA 51, и которые имели титр порядка от 1:1000 до 1:50000. Фиг. 4 - рост опухоли у животных, привитых вакцинами hIL-2r-P64k/Montanide ISA 51 илиP64k/Montanide ISA 51 (контрольная группа) и позже зараженных опухолью F3II. Ось у представляет область опухоли, определенную как больший диаметр, а х - меньший диаметр, выбранный перпендикулярно. Фиг. 5 - пролиферация линии CTLL-2 в присутствии hIL-2r и различных разведений антител противIL-2. Фиг. 6 - рост опухоли у животных, прошедших терапию с mAb к IL-2, с mAb к CD25 или PBS (контрольная группа) и зараженных линией клеток опухоли F3II. Ось у представляет область опухоли, определенную как больший диаметр, а x - меньший диаметр, выбранный перпендикулярно. Фиг. 7 - рост опухоли у животных, прошедших терапию с mAb к (XCD25, с mAb к CD25 или PBS(контрольная группа) и позже зараженных лимфомой EL4. Ось у представляет область опухоли, определенную как больший диаметр, а x - меньший диаметр, выбранный перпендикулярно. Фиг. 8 - титры антител к EGF, вызванные вакцинацией с hIL-2r-P64k/Montanide ISA 51 и hEGFP64k/Montanide ISA 51. Ось у представляет средние геометрические значения титров антител к EGF. Ось х представляет группы, иммунизированные с.hIL-2r+hEGF/P64k: hIL-2r-P64k/Montanide+hEGF/P64k/Montanide. Фиг. 9 - индуцированные антитела к интерлейкину-2 восстанавливают цитолитическую активность,оцененную в клетках лимфатических узлов, имеющих опухоль организмов-хозяев. Все мыши были иммунизированы в день 0 подкожно 1 мг OVA со 100 мкг/мышь PIC, а в последующие 2 дня вводили только PIC. Цитолитическая активность in vivo была определена с использованием клеток селезенки от нативных мышей, дифференцированно меченных флуоресцентным красителемCFSE. Клетки, меченные CFSE на высоком уровне (CFSEhigh), использовались как целевые и обрабатывались SIINFEKL в импульсном режиме, тогда как клетки, слабо меченные CFSE (CFSElow), были оставлены необработанными, чтобы служить внутренним контролем, и затем были введены внутривенно предварительно иммунизированным мышам в отношении 1:1. Цитолитическая активность была оценена в клетках лимфатических узлов. Контроль - животные, обработанные PBS; IL-2 - животные, обработанные моноклональными антителами, нейтрализующими IL-2; MB16F10 - животные, аналогичные контрольным, но зараженныеMB16F10; IL-2+MB16F10 - мыши, имеющие опухоль MB16F10, обработанные моноклональными антителами, нейтрализующими IL-2. Фиг. 10 - индуцированные антитела к интерлейкину-2 восстанавливают цитолитическую активность, оцененную в клетках селезенки, имеющих опухоль организмов-хозяев. Все мыши были иммунизированы в день 0 подкожно 1 мг OVA со 100 мкг/мышь PIC, а в последующие 2 дня вводили только PIC. Цитолитическая активность in vivo была определена с использованием клеток селезенки от нативных мышей, дифференцированно меченных флуоресцентным красителемCFSE. Клетки, меченные CFSE на высоком уровне (CFSEhigh), использовались как целевые и обрабатывались SIINFEKL в импульсном режиме, тогда как клетки, слабо меченные CFSE (CFSElow), были оставлены необработанными, чтобы служить внутренним контролем, и затем были введены внутривенно предварительно иммунизированным мышам в отношении 1:1. Цитолитическая активность была оценена в клетках селезенки. Контроль - животные, обработанные PBS; IL-2 - животные, обработанные моноклональными антителами, нейтрализующими IL-2; MB16F10 - животные, аналогичные контрольным, но зараженныеMB16F10; IL-2+MB16F10 - мыши, имеющие опухоль MB16F10, обработанные моноклональными антителами, нейтрализующими IL-2. Фиг. 11 - число клеток крови (лейкоциты (белые кровяные клетки), эритроциты (красные кровяные клетки) и тромбоциты) у животных, иммунизированных вакциной hIL-2r-P64k/Montanide ISA 51, сравниваемое с контролем (P64k/Montanide ISA 51). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Терапевтическая композиция для индуцирования иммунного ответа против IL-2, используемая для терапии больных раком, включающая по крайней мере один из компонентов:A - IL-2 или любое производное IL-2, присоединенные к любому белку-носителю генетически или химической коньюгацией, и включающий приемлемый адъювант; В - моноклональное антитело против IL-2; С - противораковая вакцина, основанная на специфичных опухолевых антигенах или факторах роста;D - моноклональное антитело против CD25. 2. Терапевтическая композиция для индуцирования иммунного ответа против IL-2 по п.1, включающая одновременное или последовательное введение компонентов А+С или A+D или В+С или B+D. 3. Терапевтическая композиция для индуцирования иммунного ответа против IL-2 по п.1, включающая IL-2 или его любое производное, присоединенные к белку-носителю, и приемлемый адъювант. 4. Терапевтическая композиция для индуцирования иммунного ответа против IL-2 по п.3, включающая IL-2, присоединенный к белку-носителю, и приемлемый адъювант. 5. Терапевтическая композиция для индуцирования иммунного ответа против IL-2 по п.4, где используемый белок-носитель представляет собой P64k, полученный из Neisseria meningitidis. 6. Терапевтическая композиция для индуцирования иммунного ответа против IL-2 по п.5, где адъювант выбран из группы, включающей гидроокись алюминия и Montanide ISA 51. 7. Терапевтическая композиция для индуцирования иммунного ответа против IL-2 по п.6, где адъювантом является Montanide ISA 51. 8. Терапевтическая композиция для индуцирования иммунного ответа против IL-2 по п.1, включающая химический конъюгат между IL-2 и P64k. 9. Терапевтическая композиция для индуцирования иммунного ответа против IL-2 по п.1, включающая слитый белок, состоящий из IL-2 и P64k. 10. Терапевтическая композиция для индуцирования иммунного ответа против IL-2 по п.1, включающая слитый белок, состоящий из пептидов, производных от IL-2 и P64k. 11. Терапевтическая композиция для индуцирования иммунного ответа против IL-2 по п.1, включающая специфичное моноклональное антитело против IL-2 человека. 12. Терапевтическая композиция для индуцирования иммунного ответа против IL-2 по п.2, включающая введение пациенту IL-2 или любого его производного, присоединенного к белку-носителю, и адъюванта в комбинации с противораковой вакциной, основанной на специфичных опухолевых антигенах или факторах роста. 13. Терапевтическая композиция для индуцирования иммунного ответа против IL-2 по п.12, где противораковая вакцина включает EGF. 14. Терапевтическая композиция для индуцирования иммунного ответа против IL-2 по п.2, включающая введение пациенту IL-2 или любого его производного, присоединенного к белку-носителю, и адъюванта в комбинации со специфичным моноклональным антителом против CD25. 15. Терапевтическая композиция для индуцирования иммунного ответа против IL-2 по п.13, включающая специфичное моноклональное антитело против CD25. 16. Терапевтическая композиция по пп.1-15 для изготовления лекарственного препарата для индуцирования иммунного ответа против IL-2 и способного ингибировать рост опухолей у больных раком. 17. Применение терапевтической композиции по пп.1-15 для ингибирования роста опухолей.
МПК / Метки
МПК: C07K 14/55
Метки: интерлейкина-2, аутоантител, лечении, предотвращать, рецептором, своим, связывание, иммунотерапевтические, использование, способных, рака, композиции, получения
Код ссылки
<a href="https://eas.patents.su/12-12072-immunoterapevticheskie-kompozicii-dlya-polucheniya-autoantitel-sposobnyh-predotvrashhat-svyazyvanie-interlejjkina-2-so-svoim-receptorom-i-ih-ispolzovanie-v-lechenii-raka.html" rel="bookmark" title="База патентов Евразийского Союза">Иммунотерапевтические композиции для получения аутоантител, способных предотвращать связывание интерлейкина-2 со своим рецептором, и их использование в лечении рака</a>