Применение антипрогестинов для профилактики и лечения гормонозависимых заболеваний
Номер патента: 7529
Опубликовано: 27.10.2006
Авторы: Шнайдер Мартин, Лихтнер Роземария, Зимайстер Герхард, Фурманн Ульрике, Хоффманн Йенс
Формула / Реферат
1. Применение антипрогестина 11b -(4-ацетилфенил)-17b -гидрокси-17a -(1,1,2,2,2-пентафторэтил)эстра-4,9-диен-3-она или его фармацевтически приемлемого производного или аналога для приготовления лекарственного средства, предназначенного для профилактики или лечения рака, выбранного из группы рака молочной железы, рака яичников, эндометриального рака, миеломы, ановуляторного бесплодия и/или менингомы у млекопитающего.
2. Применение по п.1, в котором млекопитающим является человек.
3. Применение по п.1 или 2, при котором лекарственное средство вводят орально.
4. Применение по любому из предыдущих пунктов, в котором антипрогестин 11b -(4-ацетилфенил)-17b -гидрокси-17a -(1,1,2,2,2-пентафторэтил)эстра-4,9-диен-3-он вводят в виде суточной дозы 0,1-400 мг.
5. Применение по любому из предыдущих пунктов, в котором лекарственное средство дополнительно содержит антиэстроген.
6. Применение по п.5, в котором антиэстроген представляет собой нестероидный антиэстроген.
7. Применение по п.5, в котором антиэстроген представляет собой стероидный антиэстроген.
Текст
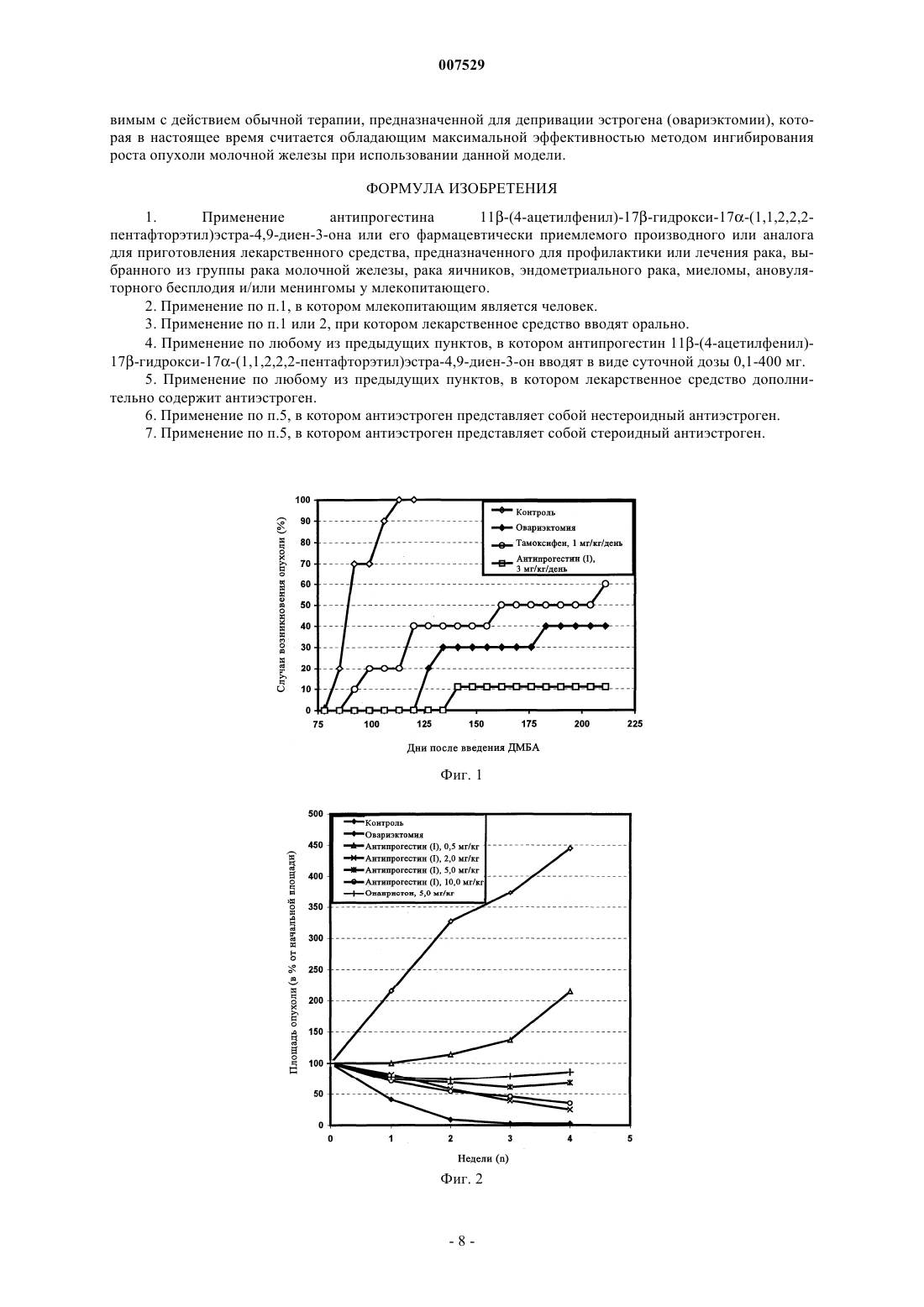
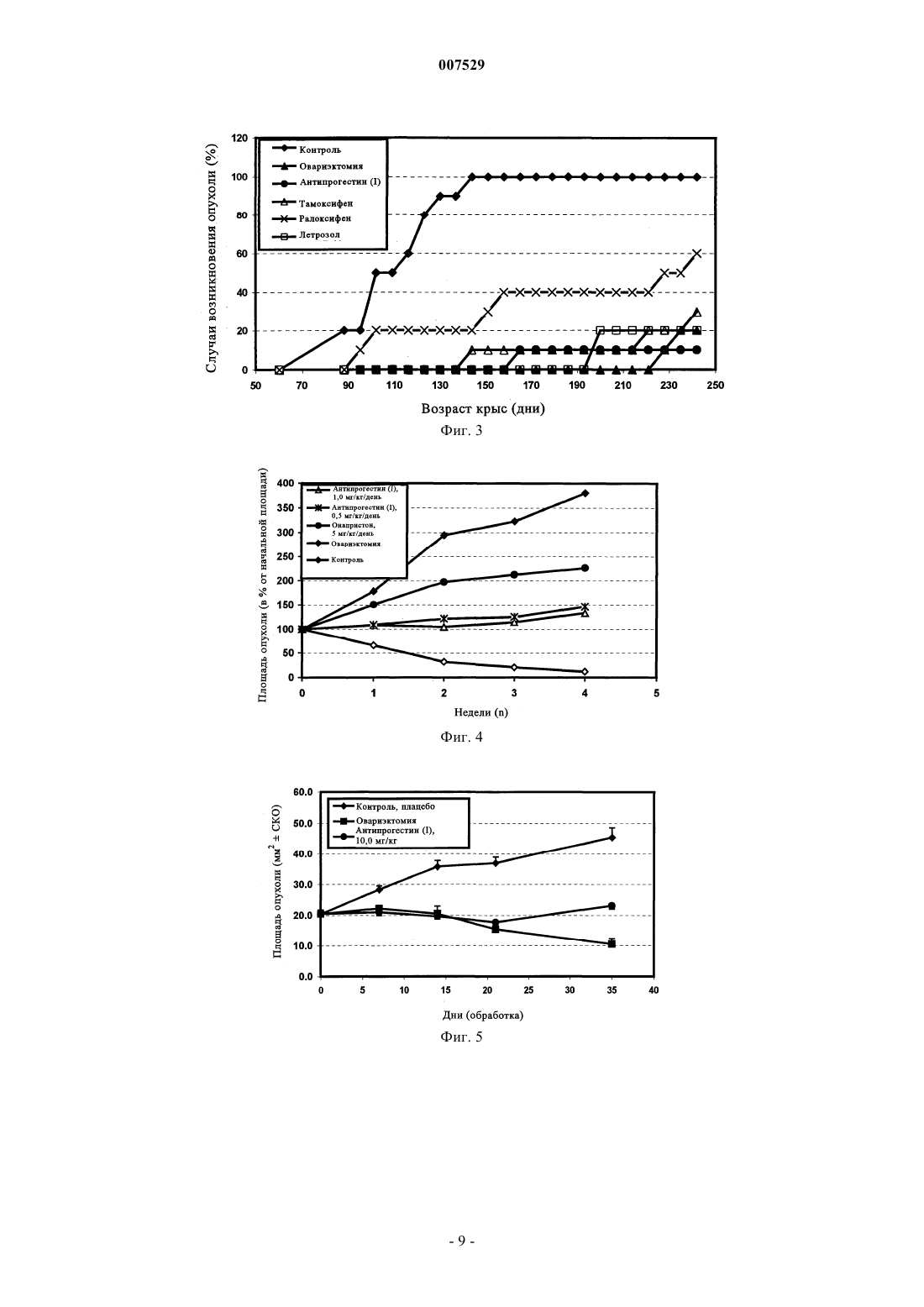
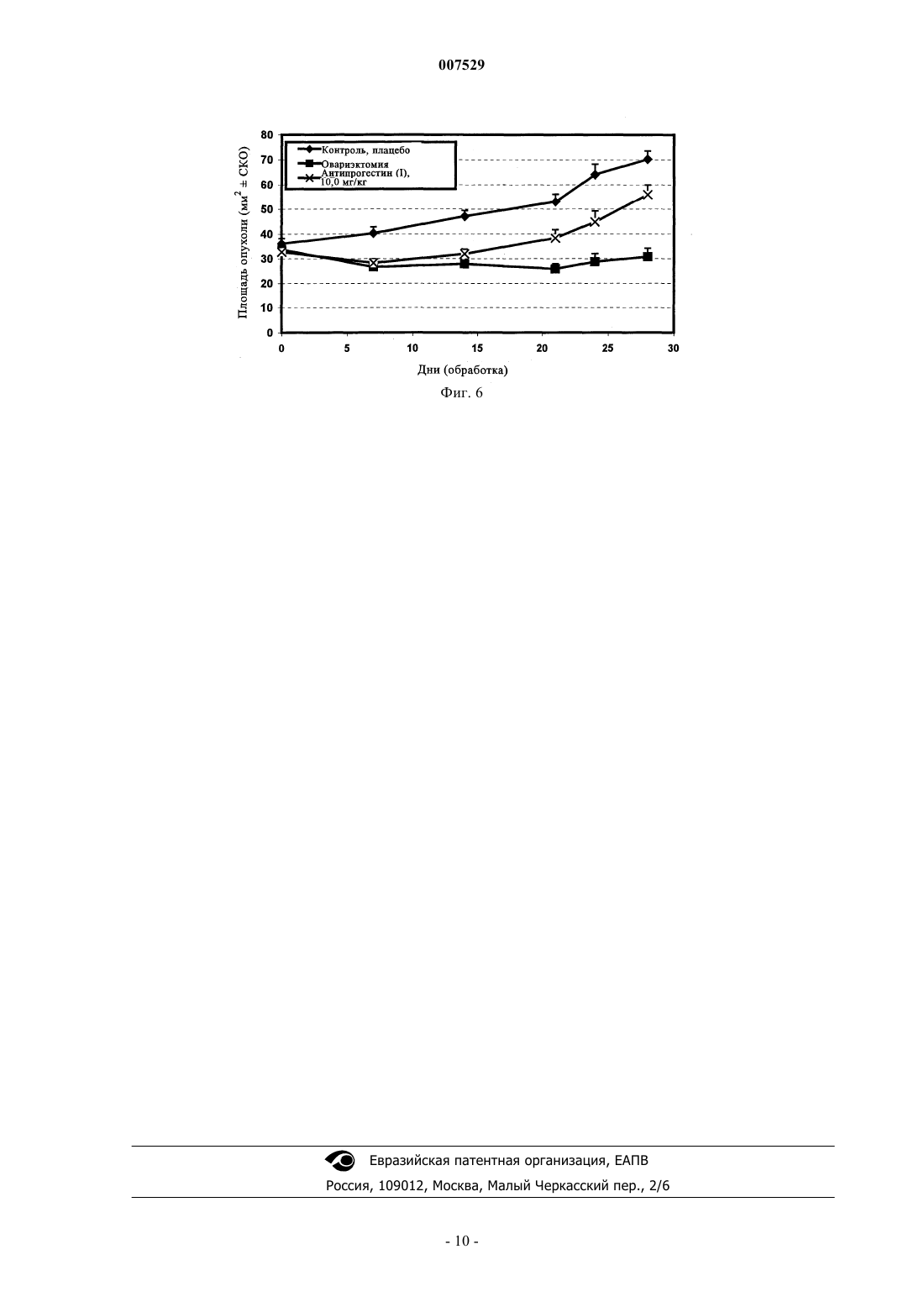
007529 Область техники, к которой относится изобретение Настоящее изобретение относится к применению антипрогестинов для профилактики и лечения гормонозависимых заболеваний, в частности, рака молочной железы. Таким антипрогестином является 11-(4-ацетилфенил)-17-гидрокси-17-(1,1,2,2,2-пентафторэтил)эстра-4,9-диен-3-он или его фармацевтически приемлемое производное или аналог. Предпосылки создания изобретения Эндокринная терапия является основным эффективным обладающим минимальной токсичностью паллиативным методом лечения метастатического рака молочной железы. В качестве стандартного паллиативного средства при лечении неоперабельных карцином молочной железы, а также при дополнительной терапии после первичного лечения карцином молочной железы применяют в основном антиэстроген тамоксифен. Однако тамоксифен не может излечивать рак молочной железы. Поэтому для дополнительной терапии как правило применяют прогестины или ингибиторы ароматазы. Для женщин в предменопаузальном периоде, овариэктомия, применение тамоксифена и аналогов ЛГ-РФ (рилизинг-фактор лютениизирующего гормона) дают сопоставимые результаты (Н.Т. Mouridison и др., Eur. J. Cancer Clin.Oncol., 24, cc. 99-105, 1988). Хотя тамоксифен широко применяют при дополнительной терапии рака молочной железы, его использование в качестве агента для химиопревентивной терапии является проблематичным, поскольку было установлено, что такое лечение приводит к увеличению количества случаев возникновения различных типов рака эндометрия (I.N. White, Carcinogenesis, 20(7): 1153-1160, 1999). Антипрогестины представляют собой относительно новый и перспективный класс терапевтических агентов, которые могут иметь большое значение для лечения рака молочной железы. Хотя антипрогестины первоначально были разработаны для медицинского нехирургического прекращения беременности(ЕР 129499), оказалось, что некоторые антипрогестины имеют большое значение, для эндокринной терапии таких типов рака молочной железы, которые отличаются наличием рецепторов прогестерона (Т.(Anti) Steroidal Agents, изд-во Raven Press, New York, 1987, cc. 55-59). Эта новая стратегия эндокринной терапии основана на данных о том, что антипрогестины обладают противоопухолевой активностью invitro в отношении имеющих рецептор прогестерона линий клеток опухоли молочной железы человека иin vivo в отношении некоторых типов гормонозависимых опухолей молочной железы мышей и крыс. В частности, механизм противоопухолевой активности таких антипрогестинов, как онапристон и мифепристон (RU 486) уже был изучен с использованием модели гормонозависимой опухоли молочной железы линии МХТ мыши, а также на моделях опухоли молочной железы, индуцированной канцерогеном ДМБА (7,12-диметилбенз(а)антрацен) и НММ (N-метилнитрозомочевина) (М. R. Schneider и др., Eur. J.Cancer Clin. Oncol., т. 25,4, сс. 691-701, 1989; Н. Michna и др., Breast Cancer Research and Treatment 14:275-288, 1989; H. Michna, J. Steroid. Biochem. т. 34,1-6, cc. 447-453, 1989). Однако вследствие низкой активности и побочных воздействий, например мифепристона, это соединение нельзя рекомендовать в качестве единственного агента для лечения рака молочной железы (D. Perrault и др., J. Clin. Oncol. 1996 Oct, 14(10), cc. 2709-2712). Антипрогестины можно применять для инициации абортов и тем самым для контроля фертильности в период после совокупления, в качестве контрацептивов для женщин (WO-A 93/23020, WO-A 93/21927), а также для лечения гормональных расстройств, для инициации менструации и для инициации родов. Их можно применять также для гормонзаместительной терапии (WO-A 94/18983), для лечения нарушений, связанных с дисменорееей и для лечения эндометриоза (ЕР-А 0266303), а также миом. 17-фторалкилстероиды, обладающие выраженной антипрогестинной активностью, а также методы их получения, описаны в WO 98/34947. Известные из существующего уровня техники антипрогестины, которые ранее тестировались или использовались благодаря их противоопухолевому действию, зачастую обладали рядом недостатков. Например, несмотря на то, что известные из существующего уровня техники антипрогестины обладали антипрогестагенной активностью, эти соединения оказались непригодными для лечения гормонозависимых заболеваний, таких как рак молочной железы. В частности, известные из существующего уровня техники соединения обладали побочными действиями, например, установлено, что мифепристон оказывает выраженные побочные антиглюкокортикоидные действия (см. L.M. Kettel и др., Fertil. Steril., сентябрь 1991, 56(3), сс. 402-407; X. Bertagna, Psychoneuroendocrinology 1997; 22 приложение 1, сс. 51-55) и кроме того, в клинических опытах он обладал лишь небольшой активностью (см. цитированную выше статью D. Perrault и др., J. Clin. Oncol., октябрь 1996, 14(10), сс. 2709-2712). Касательно побочных действий других уже упомянутых выше методов лечения, основанных на использовании гормонов, следует отметить, что введение тамоксифена может приводить к возрастанию количества случаев заболевания раком эндометрия (I.N. White, Carcinogenesis, 20(7): 1153-1160, 1999). Еще одной проблемой, связанной с известными из существующего уровня техники антипрогестинами, является их низкая биологическая доступность при пероральном введении. Вследствие этого их необходимо вводить, как правило, в высоких дозах, что приводит к возникновению нежелательных побочных действий. Кроме того, пероральное введение требуется согласовывать с комфортом и соблюде-1 007529 нием пациентом предписанного режима. Кроме того, существует необходимость в создании соединений, которые обладают эффективностью не только в отношении лечения, но и профилактики рака молочной железы и других гормонозависимых заболеваний. Увеличение количества случаев возникновения рака эндометрия в результате применения тамоксифена делает это соединение непригодным для профилактического применения для здоровых женщин, однако других пригодных для этой цели соединений не имеется (см. L. Bergman и др., The Lancet, т. 356, Sept. 9, 2000; 881-887). Задача настоящего изобретения Задача настоящего изобретения заключается в устранении или уменьшении недостатков существующих методов предупреждения или лечения гормонозависимых заболеваний, таких как рак молочной железы. Наиболее важным является разработка способов предупреждения и лечения гормонозависимых заболеваний, таких как рак молочной железы, основанных на введении высокоэффективных агентов,которые по своей эффективности превосходят известные методы, включая овариэктомию, и используемые в настоящее время агенты. Так, в частности, очень важной является разработка способа лечения гормонозависимых заболеваний, таких как рак молочной железы, который позволяет избежать серьезного и сопровождающегося риском хирургического вмешательства, связанного с овариэктомией. Кроме того, существует необходимость в выявлении агента для применения согласно изобретению, который обладает меньшими побочными действиями, чем агенты, используемые в известных или предлагаемых в настоящее время методах лечения гормонозависимых заболеваний, таких как рак молочной железы. При создании изобретения неожиданно было установлено, что эту задачу можно решать путем применения антипрогестина по настоящему изобретению и фармацевтических композиций и лекарственных средств, содержащих такие антипрогестины. Таким антипрогестином является 11-(4 ацетилфенил)-17-гидрокси-17-(1,1,2,2,2-пентафторэтил)эстра-4,9-диен-3-он или его фармацевтически приемлемое производное или аналог. Еще одной задачей настоящего изобретения было выявить и показать, что такой антипрогестин, как 11-(4-ацетилфенил)-17-гидрокси-17-(1,1,2,2,2-пентафторэтил)эстра-4,9-диен-3-он или его фармацевтически приемлемое производное или аналог, особенно пригоден для перорального введения. Краткое изложение сущности изобретения Основой настоящего изобретения послужило неожиданное установление нового факта, что определенные антипрогестины, это прежде всего 11-(4-ацетилфенил)-17-гидрокси-17-(1,1,2,2,2 пентафторэтил)эстра-4,9-диен-3-он или его фармацевтически приемлемое производное или аналог, обладает высокой активностью в отношении предупреждения и уменьшения роста опухоли при исследовании на моделях рака молочной железы, индуцированного ДМБА (7,12-диметилбензантрацен) и НММ (Nметилнитрозомочевина). Действительно, указанный антипрогестин 11-(4-ацетилфенил)-17-гидрокси 17-(1,1,2,2,2-пентафторэтил)эстра-4,9-диен-3-он (I) обладает намного большей эффективностью в отношении предупреждения развития рака молочной железы, чем тамоксифен и овариэктомия. В соответствии с этим в настоящем изобретении предложен способ профилактики и лечения рака молочной железы и других гормонозависимых заболеваний у млекопитающих, в частности, у человека,нуждающегося в таком лечении, заключающийся во введении пациенту фармацевтически эффективного количества антипрогестина 11-(4-ацетилфенил)-17-гидрокси-17-(1,1,2,2,2-пентафторэтил)эстра-4,9 диен-3-она или его фармацевтически приемлемого производного или аналога. На его основе могут быть приготовлены фармацевтические композиции, содержащие 11-(4 ацетилфенил)-17-гидрокси-17-(1,1,2,2,2-пентафторэтил)эстра-4,9-диен-3-он или его фармацевтически приемлемое производное или аналог, в количестве, достаточном для профилактики или лечения рака молочной железы или других гормонозависимых заболеваний. Антипрогестин 11-(4-ацетилфенил)-17-гидрокси-17-(1,1,2,2,2-пентафторэтил)эстра-4,9-диен-3 он в настоящем описании обозначен как антипрогестин (I). Краткое описание чертежей На приведенных ниже фигурах представлено на фиг. 1 - действие антипрогестина (I) в отношении предупреждения развития опухоли у крыс с индуцированной ДМБА карциномой молочной железы, по сравнению с контролем, обработкой такмоксифеном и овариэктомией; на фиг. 2 - ингибирующие рост опухоли действия антипрогестина (I) в зависимости от дозы в опыте на крысах с индуцированной ДМБА карциномой молочной железы по сравнению с контролем, обработкой онапристоном, а также с овариэктомией. Опыт проводили с использованием доз антипрогестина (I) 0,5, 2,0, 5,0 и 10,0 мг/кг, вводимых подкожно (s.c.); на фиг. 3 - действие антипрогестина (I) в отношении предупреждения развития опухоли у крыс с индуцированной НММ карциномой молочной железы, по сравнению с контролем, обработкой антиэстрогенами ралоксифеном и тамоксифеном, ингибитором ароматазы летрозолом, а также с овариэктомией; на фиг. 4 - ингибирующее рост опухоли действие антипрогестина (I) в дозах 0,5 и 1,0 мг/кг в опыте на крысах с индуцированной НММ карциномой молочной железы, по сравнению с контролем, обработ-2 007529 кой онапристоном (5 мг/кг) и овариэктомией; на фиг. 5 - ингибирующее рост опухоли действие антипрогестина (I), вводимого в дозе 10 мг/кг s.c.,в отношении ксенотрансплантата человеческой опухоли линии T47D у бестимусных мышей по сравнению с контролем и овариэктомией; на фиг. 6 - ингибирующее рост опухоли действие антипрогестина (I), вводимого в дозе 10 мг/кг s.c.,в отношении ксенотрансплантата человеческой опухоли линии MCF7 у бестимусных мышей по сравнению с контролем и овариэктомией. Подробное описание изобретения Антипрогестин (I), т.е. 11-(4-ацетилфенил)-17-гидрокси-17-(1,1,2,2,2-пентафторэтил)эстра-4,9 диен-3-он, представлен ниже формулой (I) Антипрогестин (I) (или его фармацевтически приемлемое производное или аналог, обладающие сопоставимой активностью) представляет собой имеющий большое значение фармацевтический агент, обладающий выраженной антипрогестинной активностью. Антипрогестин (I), а также другие антипрогестины можно применять согласно настоящему изобретению для профилактики и лечения рака молочной железы и других гормонозависимых заболеваний. В контексте настоящего изобретения понятие "антипрогестин" относится прежде всего ко всем соединениям, обладающим способностью конкурентно ингибировать рецепторы прогестерона. Однако оно включает также соединения, обладающие способностью ингибировать биосинтез прогестинов. В контексте настоящего описания фармацевтически приемлемые производные или аналоги антипрогестина (I) могут включать, например, любое из соединений, заявленных в WO 98/34947. В контексте настоящего изобретения понятие зависящие от гормонов заболевания может включать, но не ограничиваясь ими, рак молочной железы, рак яичника, рак эндометрия, миелому, ановуляторное бесплодие, менингому, т.е заболевания, которые в основном обусловлены или на которые оказывает влияние наличие рецепторов гормонов и/или зависящих от гормонов путей метаболизма. Если рассматривать преимущества настоящего изобретения по сравнению с существующим уровнем техники, то следует специально отметить, например, что побочные действия в отношении эндокринной системы при использовании антипрогестина (I) согласно настоящему изобретению в отличие от действия, например андрогена, эстрогена или глюкокортикоида, являются очень слабыми или вообще отсутствуют. Благодаря высокой биологической доступности антипрогестина (I) его можно вводить орально,тем самым создавая максимальное удобство для пациента, нуждающегося в таком лечении. Еще одним преимуществом является то, что антипрогестин (I) обладает хорошей переносимостью и его можно вводить в сравнительно малых дозах по сравнению с дозами лекарственных средств, используемыми при общепринятых методах лечения, уменьшая тем самым нежелательные побочные действия, такие как повышение частоты возникновения раков эндометрия, связанное с введением тамоксифена (см. I.N. White,Carcinogenesis, 20(7): 1153-1160, 1999; L. Berman и др., The Lancet, т. 356, Sept. 9, 2000, 881-887), а также антиглюкокортикоидные действия и некоторые токсические действия, связанные с введением мифепристона (см. D. Perrault и др., J.Clin.Oncol., 1996 Oct., 14(10), сс. 2709-2712; L.M. Kettel и др., Fertil. Steril.,1991, Sep., 56(3), сс. 402-407; X. Bertagna, Psychoneuroendocrinology,1997, 22 прилож. 1; сс. 51-55). Еще одно преимущество настоящего изобретения по сравнению с существующим уровнем техники заключается в разработке эффективного способа профилактики гормонозависимых заболеваний, таких как рак молочной железы, который позволяет осуществлять заранее лечение пациентов, для которых существует высокий риск развития или рецидива гормонозависимых заболеваний, с целью предупреждения таких заболеваний. Одним из объектов настоящего изобретения является способ профилактики или лечения рака молочной железы или других гормонозависимых заболеваний, заключающийся в том, что млекопитающему, предпочтительно человеку, нуждающемуся в такой профилактике или лечении, вводят по меньшей мере один антипрогестин, предпочтительно антипрогестин (I) или его фармацевтически приемлемое производное или аналог. Следующим объектом настоящего изобретения является применение указанных выше антипрогестинов, предпочтительно антипрогестина (I) или его фармацевтически приемлемого производного или аналога, для приготовления лекарственного средства, предназначенного, в частности, для профилактики или лечения рака молочной железы или других гормонозависимых заболеваний.-3 007529 Еще одним объектом настоящего изобретения являются фармацевтические композиции, содержащие по меньшей мере один указанный выше антипрогестин, предпочтительно антипрогестин (I) или его фармацевтически приемлемое производное или аналог. Антипрогестин (I) необязательно можно применять в сочетании с другими обладающими фармацевтической активностью агентами. Например, антипрогестин можно применять в сочетании с цитотоксическим агентом для лечения путем связывания с рецептором гормона. Приготовление лекарственных средств можно осуществлять с помощью методов, известных в данной области. Можно применять широко известные и общепринятые вспомогательные вещества, а также другие приемлемые носители или разбавители. В качестве приемлемых носителей и вспомогательных веществ можно использовать соединения, рекомендованные для применения в фармацевтике, косметике и родственных областях, которые описаны в: Ullmann's Encyclopedia of Technical Chemistry, т. 4, (1953),cc. 1-39; Journal of Pharmaceutical Sciences, т. 52 (1963), с. 918 и далее; H.V.Czetsch-Lindenwald,"Hilfsstoffe fr Pharmazie und angrenzende Gebiete"; Pharm. Ind. 2, 1961, c.72 и далее; Dr. H.P. Fiedler,Lexikon der Hilfsstoffe fr Pharmazie, Kosmetik und angrenzende Gebiete, изд-во Cantor KG, Aulendorf inWrttemberg, 1971. Антипрогестин (I) можно применять для целей настоящего изобретения, так же как и его фармацевтически приемлемое производное или аналог, которые можно включать в состав фармацевтических композиций с помощью известных методов приготовления галеновых форм для орального или парентерального, например, внутрибрюшинного, внутримышечного, подкожного или чрескожного введения. Их можно также имплантировать в ткань. Имплантаты могут содержать инертные материалы, например,биоразложимые полимеры и синтетические силиконы, такие, например, как силиконовый каучук. Их можно вводить в форме таблеток, пилюль, драже, гелевых капсул, гранул, суппозиториев, имплантатов, инъецируемых стерильных водных или масляных растворов, суспензий или эмульсий, мазей,кремов, гелей или интравагинальных (например, вагинальных колец) или внутриматочных систем (например, диафрагм, петель). Для приготовления фармацевтических композиций, предназначенных для орального введения, описанные выше антипрогестин, пригодный для применения согласно настоящему изобретению, можно смешивать с широко известными и общепринятыми вспомогательными веществами и носителями, такими, например, как гуммиарабик, тальк, крахмал, сахара, такие, например, как маннит, метилцеллюлоза,лактоза, желатин, поверхностно-активными веществами, стеаратом магния, водными или неводными эксципиентами, производными парафина, сшивающими агентами, разрыхлителями, эмульгаторами, замасливателями, консервантами и корригентами (например, эфирными маслами). В фармацевтической композиции антипрогестин может находиться в диспергированном состоянии в виде микрочастиц, например в виде наночастиц. Для дополнительного повышения биологической доступности действующего вещества описанные выше антипрогестины, пригодные для применения согласно настоящему изобретению, можно включать в состав препаративной формы также в виде циклодекстриновых клатратов, подвергая их взаимодействию с -, - или -циклодекстринами или их производными согласно методу, описанному в РСТ/ЕР 95/02656. Для парентерального введения описанный выше антипрогестин, пригодный для применения согласно настоящему изобретению, можно растворять или суспендировать в физиологически приемлемом разбавителе, таком, например, как масла, вместе с солюбилизаторами, поверхностно-активными агентами, диспергирующими агентами или эмульгаторами или без них. Примерами масел, которые можно применять (но не ограничиваясь ими), являются оливковое масло, арахисовое масло, хлопковое масло,соевое масло, касторовое масло и кунжутное масло. Предназначенное для введения количество (т.е. фармацевтически эффективное количество) варьируется в широких пределах и зависит от состояния, подлежащего лечению, и пути введения. Оно может представлять собой любое количество, являющееся эффективным для осуществления требуемого лечения. Определение фармацевтически эффективного количества находится в компетенции специалиста в данной области. Одна стандартная доза может содержать приблизительно от 0,1 до 100 мг действующих(его) веществ(а). Для введения человеку суточная доза действующих(его) веществ(а) составляет приблизительно от 0,1 до 400 мг, предпочтительно от 10 до 100 мг, наиболее предпочтительно 50 мг. Фармацевтические композиции по изобретению можно вводить также путем инъекции депо, имплантата или ВМС (внутриматочное противозачаточное средство), необязательно обеспечивающего замедленное высвобождение действующих(его) веществ(а). Предпочтительным путем введения является оральное введение. Антипрогестины, пригодные для применения согласно изобретению, в частности, антипрогестин (I) или его фармацевтически приемлемое производное или аналог, наиболее предпочтительно вводят оральным путем. Согласно всем объектам настоящего изобретения антипрогестин (I) или его фармацевтически приемлемое производное или аналог можно применять также в сочетании по меньшей мере с одним антиэстрогеном, поскольку для многих гормонозависимых заболеваний, в частности для рака молочной желе-4 007529 зы, характерно наличие не только рецепторов прогестерона, но также и рецепторов эстрогена. Антиэстроген можно вводить как одновременно, так и последовательно с антипрогестином (I) или его фармацевтически приемлемым производным или аналогом. Количество антипрогестина и антиэстрогена могут быть одинаковыми или один из компонентов может присутствовать в большем количестве, чем другой,например, соотношение антипрогестин:антиэстроген может составлять от 1:50 до 50:1, предпочтительно от 1:30 до 30:1, и наиболее предпочтительно от 1:15 до 15:1. Примерами антиэстрогенов, которые можно применять согласно изобретению, являются нестероидные антиэстрогены, такие как тамоксифен и нафоксидин, а также ралоксифен и ЕМ 800 и стероидный антиэстроген фаслодекс. Примерами стероидных антиэстрогенов являются соединения, описанные в ЕР 0348341 А и соединения, описанные в WO 98/07740, в частности, 11-фтор-7-5-[N-метил-N-3(4,4,5,5,5-пентафторпентилтиопропил)амино]пентилэстра-1,3,5(10)-триен-3,17-диол, или соединения,описанные вWO 99/33855,в частности,11-фтор-7-5-[метил-(7,7,8,8,9,9,10,10,10 нонафтордецил)амино]пентилэстра-1,3,5(10)-триен-3,17-диол или их фармацевтически приемлемые производные или аналоги. В качестве антиэстрогенов можно применять также ингибиторы ароматазы,обладающие антиэстрогенной активностью, такие, например, которые описаны на сс. 7-8 ЕР 0495825 В 1. Ниже изобретение проиллюстрировано на примерах. Следует иметь в виду, что приведенные ниже примеры не ограничивают объем изобретения. Ниже изобретение проиллюстрировано на примерах. Следует иметь в виду, что приведенные ниже примеры не ограничивают объем изобретения. Примеры Пример 1. Модель индуцированного ДМБА рака молочной железы у крыс (изучение предупреждения развития рака) Материалы и методы Данное исследование проводили на неполовозрелых самках крыс линии Sprague-Dawley (возрастом 49-51 день; 10 животных/группу). Канцероген 7,12-диметилбенз[а]антрацен (ДМБА) вводили перорально в виде однократной дозы (10 мг). Через 20 дней осуществляли следующие виды обработки: 1) обработка растворителем в качестве контроля, 2) овариэктомия перед началом опыта, 3) тамоксифен 1 мг/кг s.c., 4) антипрогестин (I), 3 мг/кг s.c. в течение 6 дней в неделю. Еженедельно путем пальпации осуществляли выявление опухолей молочной железы у крыс. В качестве критерия оценки профилактического действия принимали относительное количество случаев развития опухоли (количество животных с опухолью/группу, в %). Более подробное описание и оценка модели, предназначенной для изучения предотвращения развития индуцированных ДМБА и НММ опухоли, приведены у R.G. Metha, European Journalof Cancer 36 (2000), cc. 1275-1282. Результаты: В контрольной группе у всех крыс в течение 10 недель после обработки происходило образование опухолей молочной железы (встречаемость 100%) и наблюдался прогрессивный рост опухоли. Профилактическое лечение антипрогестином (I) полностью предотвращало развитие опухоли в течение 12 недель, а по окончании эксперимента через 22 недели опухоль была выявлена только у одной крысы(встречаемость 10%). У 40% крыс, подвергнутых овариэктомии, к моменту окончания эксперимента были выявлены развитые опухоли. По сравнению с этими данными обработка антиэстрогеном тамоксифеном приводила к снижению количества случаев развития опухоли только до 60%. Выводы: При исследовании на модели индуцированной ДМБА опухоли молочной железы крыс антипрогестин (I) полностью подавлял развитие опухоли у интактных животных в течение более чем 12 недель после начала обработки. Данные, приведенные на фиг. 1, свидетельствуют о том, что эффективность антипрогестина (I) при профилактическом лечении превосходит эффективность обычно применяемого для лечения рака молочной железы агента тамоксифена и даже эффективность стандартной терапии, основанной на депривации эстрогена (овариэктомия). Таким образом, применение антипрогестина (I) является более эффективным по сравнению с общепринятой стандартной терапией в отношении предупреждения рака молочной железы у женщин, имеющих высокий риск развития заболевания (профилактическая терапия с использованием тамоксифена). Эти и приведенные далее результаты свидетельствуют о том, что применение антипрогестина (I) для профилактики и лечения рака молочной железы является более эффективным по сравнению с общепринятыми стандартными терапевтическими методами лечения. Пример 2. Модель индуцированного ДМБА рака молочной железы у крыс (эксперимент по изучению терапевтического действия/изучение зависимости реакции от дозы) Материалы и методы Данное исследование проводили на неполовозрелых самках крыс линии Sprague-Dawley (возрастом 49-51 день; 10 животных/группу). Опухоли молочной железы индуцировали путем однократного перорального введения 10 мг 7,12-диметилбенз[а]антрацена (ДМБА, фирма Serva, Гейдельберг). Крыс, у которых была выявлена по меньшей мере одна опухоль, имеющая размер, превышающий 150 мм 2, в тече-5 007529 ние 4 недель подвергали следующим обработкам: 1) растворитель (контроль), 2) овариэктомия перед началом опыта, 3) антипрогестин (I), 0,5 мг/кг s.c., 4) антипрогестин (I), 2 мг/кг s.c., 5) антипрогестин (I),5 мг/кг s.c., 6) антипрогестин (I), 10 мг/кг s.c. ежедневно и 7) онапристон, 5 мг/кг, s.c. В качестве критераия для оценки ингибирования роста использовали изменение площади опухоли (в % по отношению к исходному размеру опухоли), которую оценивали путем еженедельного измерения с помощью циркуля. Для статистического анализа различий средних значений между группами использовали критерий Крускала-Уоллиса. Результаты: У интактных контрольных животных был выявлен прогрессивный рост опухоли, в то время как у 90% подвергнутых овариэктомии животных был выявлен существенный регресс опухоли. Лечение антипрогестином (I) в дозах, равных или превышающих 2 мг/кг, приводило к существенному ингибированию роста опухоли по сравнению с контролем (см. фиг. 2). В этом случае обнаружена выраженная зависимость реакции от дозы. В то время как лечение с использованием 0,5 мг/кг антипрогестина (I) не приводило к существенному ингибированию роста опухоли, при использовании дозы 2 мг/кг наблюдались максимальное ингибирование роста. В этой группе у 50% крыс был выявлен полный регресс опухоли. Воздействие максимальной изученной в данном эксперименте дозы антипрогестина (I) (10 мг/кг), оказалось сопоставимым с воздействием дозы 2 мг/кг. Онапристон (5 мг/кг, s.c.) оказался существенно менее эффективным, чем антипрогестин (I), при применении в сопоставимых дозах. Выводы: При исследовании на модели индуцированной ДМБА опухоли молочной железы у крыс антипрогестин (I) полностью подавлял рост опухоли у интактных животных. Было установлено, что максимальное действие на рост опухоли достигалось при использовании дозы антипрогестина (I), составляющей 2 мг/кг. Эффективность антипрогестина (I) существенно превосходила эффективность онапристона. Пример 3. Модель индуцированного НММ рака молочной железы у крыс (изучение предупреждения развития рака) Материалы и методы У самок крыс линии Sprague-Dawley (полученных от фирмы Tierzucht Schonwalde, возраст 50-55 дней) индуцировали опухоли путем однократной внутривенной инъекции НММ (нитрозометилмочевина,50 мг/кг). Через 10 дней животных подвергали следующим обработкам: 1) растворитель (контроль), 2) овариэктомия перед началом опыта, 3) тамоксифен, 3 мг/кг s.c., 4) антипрогестин (I), 3,0 мг/кг s.c., 5) летрозол 3 мг/кг s.c., 5) ралоксифен, 3 мг/кг s.c. шесть раз в неделю. Еженедельно крыс обследовали в отношении наличия опухолей путем пальпации. В качестве критерия для оценки профилактического действия принимали относительное количество случаев развития опухоли (количество животных с опухолью/группу, в %). Более подробное описание и оценка модели, предназначенной для изучения предотвращения развития индуцированной ДМБА и НММ опухоли, приведены у R.G. Metha, European Journalof Cancer 36 (2000), cc. 1275-1282. Результаты: В контрольной группе у всех крыс в течение 10 недель после обработки происходило образование опухолей молочной железы (встречаемость 100%, см. фиг. 3) и наблюдался прогрессивный рост опухоли. Профилактическое лечение антипрогестином (I) полностью предотвращало развитие опухоли в течение 12 недель, а по окончании эксперимента через 27 недель опухоль была выявлена только у одной крысы(встречаемость 10%). По сравнению с этими данными обработка другими антиэстрогенами или ингибитором ароматазы летрозолом приводила к снижению количества случаев развития опухоли только до 2060%. В конце эксперимента 20% крыс, подвергнутых овариэктомии, имели развитые опухоли. Выводы: При исследовании на модели индуцированной НММ опухоли молочной железы у крысы антипрогестин (I) полностью подавлял рост опухоли у интактных животных в течение более чем 12 недель после начала лечения. Эффективность профилактического лечения антипрогестином (I) с точки зрения уменьшения количества случаев возникновения опухоли и роста опухоли превосходила эффективность лечения антиэстрогенами, обычно применяемыми для лечения рака молочной железы (т.е. ралоксифеном,тамоксифеном), и ингибитором ароматазы летрозолом, а также эффективность стандартной терапии, основанной на депривации эстрогена (овариэктомия). Как и в случае модели опухоли, индуцированной ДМБА (см. пример 1), эти результаты свидетельствуют о том, что эффективность антипрогестина (I) в отношении предупреждения развития опухолей молочной железы превосходит эффективность стандартного профилактического лечения, например, с использованием тамоксифена. Пример 4. Модель индуцированного НММ рака молочной железы у крыс (изучение терапевтического действия) Материалы и методы Самкам крыс линии Sprague-Dawley (полученных от фирмы Tierzucht Schonwalde, возраст 50-55 дней) индуцировали опухоли путем однократной внутривенной инъекции НММ (нитрозометилмочевина,50 мг/кг). Через 10 дней крыс, у которых была выявлена по меньшей мере одна опухоль, подвергали в-6 007529 течение 4 недель следующим обработкам: 1) растворитель (контроль), 2) Овариэктомия перед началом опыта, 3) антипрогестин (I), 1,0 мг/кг/день, 4) антипрогестин (I), 0,5 мг/кг/день и 5) онапристон, 5 мг/кг. В качестве критерия для оценки ингибирования роста использовали изменение площади опухоли (в % по отношению к исходному размеру опухоли), которую оценивали путем еженедельного измерения с помощью циркуля. Для статистического анализа различий средних значений между группами использовали критерий Крускала-Уоллиса. Результаты: У интактных контрольных животных был выявлен прогрессивный рост опухоли, в то время как овариэктомия приводила к полному ингибированию роста опухоли. Введение антипрогестина (I) в дозах 0,5 или 1,0 мг/кг приводило к существенному ингибированию роста опухоли по сравнению с контролем(см. фиг. 4). Онапристон (5 мг/кг) оказался значительно менее эффективным, чем антипрогестин (I), вводимый в существенно меньшей дозе 0,5 мг/кг. Выводы: В опытах на модели индуцированной НММ опухоли молочной железы у крыс установлено, что антипрогестин (I) полностью подавлял рост опухоли у интактных животных. Было установлено,что антипрогестин (I), вводимый в дозе 1,0 мг/кг и даже в дозе, составляющей только 0,5 мг/кг, оказывал существенное действие на рост опухоли. Таким образом, эффективность антипрогестина (I) превосходит эффективность известных антипрогестинов, таких как онапристон. Пример 5. Ксенотрансплантат клеток человеческой опухоли линии T47D (изучение терапевтического действия) Материалы и методы Самкам бестимусных мышей линии Fox Chase (фирма МВ) вводили пеллеты эстрадиола (фирмаInnovative Research of America). Клетки линии T47D рака молочной железы, полученные из клеточной культуры и суспендированные в матригеле, имплантировали s.c. в паховую область мышей. Обработку начинали после того, как опухоли достигали размера приблизительно 25 мм 2. Обработку продолжали до тех пор, пока продолжалось развитие опухолей. В эксперименте использовали следующие группы животных: 1) контрольная группа (обработанная носителем), 2) группа, подвергнутая овариэктомии, 3) группа, обрабатываемая антипрогестином (I), 10 мг/кг s.c. Площадь опухоли определяли с помощью циркуля. Для статистического анализа различий средних значений между группами использовали критерий Крускала-Уоллиса. Результаты: В опытах с использованием модели рака молочной железы T47D овариэктомия приводила к существенному ингибированию роста опухоли по сравнению с быстрым ростом в контроле. Данные, приведенные на фиг. 5, свидетельствуют о том, что введение антипрогестина (I) в дозе 10 мг/кг s.c. также вызывало ингибирование роста опухоли, практически сопоставимое с действием обычной терапии, основанной на депривации эстрогена (овариэктомия). Выводы: Действие антипрогестина (I) в отношении ингибирования роста клеток T47D рака молочной железы человека, ксенотрансплантированных бестимусным мышам линии Fox Chas, оказалось сопоставимым с действием обычной терапии, предназначенной для депривации эстрогена (овариэктомии), которая в настоящее время считается обладающим максимальной эффективностью методом ингибирования роста опухоли молочной железы при использовании данной модели. Пример 6. Ксенотрансплантат клеток человеческой опухоли линии MCF7 (изучение терапевтического действия) Материалы и методы Самкам бестимусных мышей линии Fox Chase (фирма МВ) вводили пеллеты эстрадиола (фирмаInnovative Research of America). Клетки линии MCF7 рака молочной железы, полученные из клеточной культуры и суспендированные в матригеле, имплантировали s.c. в паховую область мышей. Обработку начинали после того, как опухоли достигали размера приблизительно 25 мм 2. Обработку продолжали до тех пор, пока продолжалось развитие опухоли. В эксперименте использовали следующие группы животных: 1) контрольная группа (обработанная носителем), 2) группа, подвергнутая овариэктомии, 3) группа,обрабатываемая антипрогестином (I), 10 мг/кг s.c. Площадь опухоли определяли с помощью циркуля. Для статистического анализа различий средних значений между группами использовали критерий Крускала-Уоллиса. Результаты: В опытах с использованием модели рака молочной железы линии MCF7 овариэктомия приводила к существенному ингибированию роста опухоли по сравнению с быстрым ростом в контроле. Данные,приведенные на фиг. 6, свидетельствуют о том, что введение антипрогестина (I) s.c. в дозе 10 мг/кг также приводило к ингибированию роста опухоли, практически сопоставимому с действием обычной терапии,предназначенной для депривации эстрогена (овариэктомии). Выводы: Действие антипрогестина (I) в отношении ингибирования роста клеток линии MCF7 рака молочной железы человека, ксенотрансплантированных бестимусным мышам линии Fox Chas, оказалось сопоста-7 007529 вимым с действием обычной терапии, предназначенной для депривации эстрогена (овариэктомии), которая в настоящее время считается обладающим максимальной эффективностью методом ингибирования роста опухоли молочной железы при использовании данной модели. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение антипрогестина 11-(4-ацетилфенил)-17-гидрокси-17-(1,1,2,2,2 пентафторэтил)эстра-4,9-диен-3-она или его фармацевтически приемлемого производного или аналога для приготовления лекарственного средства, предназначенного для профилактики или лечения рака, выбранного из группы рака молочной железы, рака яичников, эндометриального рака, миеломы, ановуляторного бесплодия и/или менингомы у млекопитающего. 2. Применение по п.1, в котором млекопитающим является человек. 3. Применение по п.1 или 2, при котором лекарственное средство вводят орально. 4. Применение по любому из предыдущих пунктов, в котором антипрогестин 11-(4-ацетилфенил)17-гидрокси-17-(1,1,2,2,2-пентафторэтил)эстра-4,9-диен-3-он вводят в виде суточной дозы 0,1-400 мг. 5. Применение по любому из предыдущих пунктов, в котором лекарственное средство дополнительно содержит антиэстроген. 6. Применение по п.5, в котором антиэстроген представляет собой нестероидный антиэстроген. 7. Применение по п.5, в котором антиэстроген представляет собой стероидный антиэстроген.
МПК / Метки
МПК: A61K 31/56, A61P 35/00
Метки: лечения, применение, гормонозависимых, заболеваний, антипрогестинов, профилактики
Код ссылки
<a href="https://eas.patents.su/11-7529-primenenie-antiprogestinov-dlya-profilaktiki-i-lecheniya-gormonozavisimyh-zabolevanijj.html" rel="bookmark" title="База патентов Евразийского Союза">Применение антипрогестинов для профилактики и лечения гормонозависимых заболеваний</a>
Предыдущий патент: Игровой автомат
Следующий патент: Противоопухолевые комбинации
Случайный патент: Микроэлементная добавка в кормовые смеси для животных и птицы в биодоступной форме