Ингибирование поглощения моноамина
Номер патента: 5768
Опубликовано: 30.06.2005
Авторы: Вонг Дэвид Тайвай, Сауер Джон-Майкл, Уилер Вилльям Джо, Маттиуз Эдвард Луис
Формула / Реферат
1. Соединение формулы I
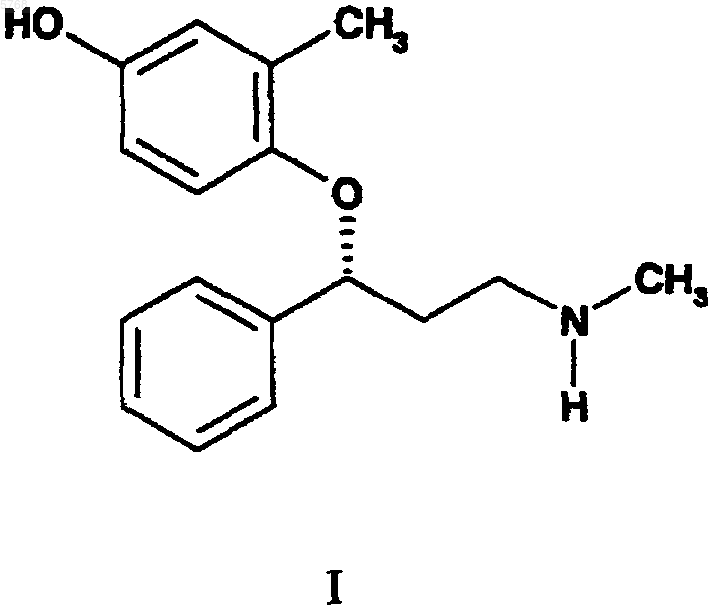
или его фармацевтически приемлемая соль.
2. Соединение R-(-)-N-метил-3-((2-метил-4-гидроксифенил)окси)-3-фенил-1-аминопропангидрохлорид.
3. Фармацевтический состав, включающий соединение формулы I
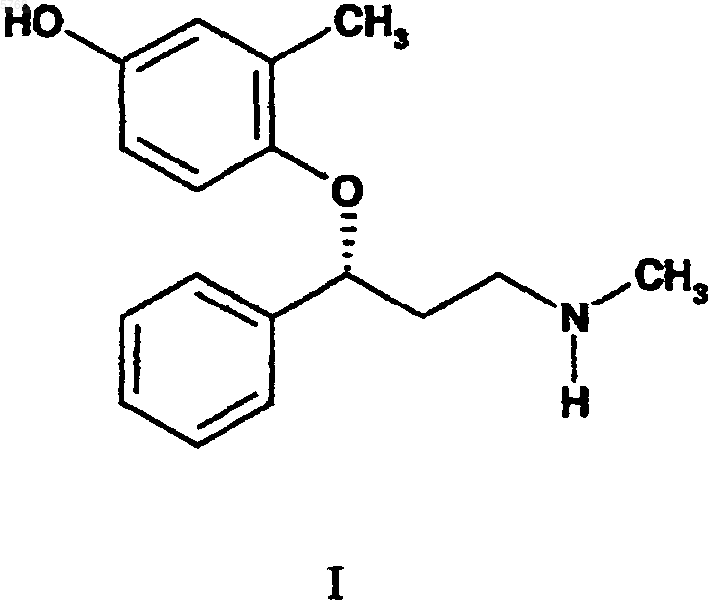
или его фармацевтически приемлемую соль в сочетании с фармацевтически приемлемым носителем, разбавителем или наполнителем.
4. Фармацевтический состав по п.3, где соединение формулы I представляет собой R-(-)-N-метил-3-((2-метил-4-гидроксифенил)окси)-3-фенил-1-аминопропангидрохлорид.
5. Фармацевтический состав в форме твердой желатиновой капсулы, содержащий сухую смесь R-(-)-N-метил-3-((2-метилфенил)окси)-3-фенил-1-аминопропангидрохлорида с разбавителем в виде крахмала и смазывающим веществом в виде силиконового масла.
Текст
005768 Установлена взаимосвязь между поглощением моноамина и рядом неврологических нарушений у млекопитающих, и обнаружено, что 3-арилокси-3-замещенные-1-аминопропаны характеризуются удивительным разнообразием в своей способности к ингибированию поглощения моноаминов. Найдено, что некоторые члены класса 3-арилокси-3-замещенных-1-аминопропанов применимы для лечения неврологических нарушений. Например, флуоксетин, т.е. N-метил-3-4-трифторметилфенил)окси)-3-фенил-1 аминопропангидрохлорид, является селективным ингибитором поглощения серотонина, находящим широкий рынок сбыта в качестве средства, показанного для лечения депрессии и ряда других заболеваний. Атомоксетин, т.е. (-)-N-метил-3-2-метилфенил)окси)-3-фенил-1-аминопропангидрохлорид, является селективным ингибитором поглощения норэпинефрина, имеющим клинические показания для лечения нарушений, связанных с недостатком внимания/гиперактивностью. Дулоксетин, т.е. (+)-N-метил-3-(1 нафталинилокси)-3-(2-тиенил)-1-аминопропангидрохлорид, ингибирует поглощение как норэпинефрина,так и серотонина и проходит в настоящее время клинические испытания по лечению депрессии. Указанные соединения принадлежат к числу многих 3-арилокси-3-замещенных-1-аминопропанов, описанных в патентах США 4018895, 4194009, 4314081, 4956388 и 5023269. Однако применимость в этом отношении гидроксилированного 3-фенокси-3-фенил-1-аминопропана до сих пор не оценена. Настоящее изобретение касается соединения формулы I или его фармацевтически приемлемой соли. Настоящее изобретение также касается фармацевтического состава, который включает соединение формулы I в сочетании с фармацевтически приемлемым носителем, разбавителем или наполнителем. Настоящее изобретение касается способа ингибирования поглощения норэпинефрина и серотонина в организме млекопитающих, включающего введение нуждающемуся в таком ингибировании млекопитающему фармацевтически эффективного количества соединения формулы I. Еще один вариант выполнения настоящего изобретения составляет способ ингибирования поглощения норэпинефрина и серотонина в организме млекопитающих в целях лечения разнообразных нарушений, связанных с пониженной серотониноргической и/или норэпинефриноргической нейропередачей у млекопитающих. Такие нарушения включают депрессию, мигрень, булимию, предменструальный синдром или синдром поздней фазы лютеинизации, алкоголизм, злоупотребление курением, паническое расстройство, состояние тревоги, общую боль, посттравматический синдром, потерю памяти, старческое слабоумие, социофобию, нарушение, связанное с недостатком внимания/гиперактивностью, псориаз,нарушение, связанное с оппозиционным демонстративным поведением, нарушение поведения, нарушение, приводящее к пограничному состоянию личности, обсессивно-компульсивное расстройство, синдром хронического переутомления, преждевременную эякуляцию, эректильную затруднeнность, нервную анорексию, нарушение сна, аутизм, мутизм, аллергический ринит, симптомы простуды, нарколепсию, недержание, трихотилломанию, невралгию тройничного нерва, зубную боль или дисфункциональную боль височно-нижнечелюстного сустава. Любой из указанных способов включает использование соединения формулы I. Настоящее изобретение также касается применения соединения формулы I в целях промышленного получения лекарственного препарата для ингибирования поглощения норэпинефрина и серотонина. Кроме того, настоящее изобретение касается фармацевтического состава, предназначенного для ингибирования поглощения норэпинефрина и серотонина, содержащего соединение формулы I или его метаболический предшественник. Далее, настоящее изобретение касается способа получения соединения формулы I, включающего стадии а) сочетания соединения формулы (i)b) взаимодействия соединения формулы (ii) с источником иона иодида, приводящего к соединению формулы (iii)c) взаимодействия соединения формулы (iii) с метиламином, приводящего к R-(-)-N-метил-3-2 метил-4-гидроксифенил)окси)-3-фенил-1-аминопропану; иd) необязательной обработки R-(-)-N-метил-3-2-метил-4-гидроксифенил)окси)-3-фенил-1-аминопропана фармацевтически приемлемой кислотой. Настоящее изобретение касается также способа получения соединения формулы I, включающего стадии а) сочетания соединения формулы (i)b) взаимодействия соединения формулы (iv) с агентом для снятия защиты, приводящего к R-(-)-Nметил-3-2-метил-4-гидроксифенил)окси)-3-фенил-1-аминопропану; иc) необязательной обработки R-(-)-N-метил-3-2-метил-4-гидроксифенил)окси)-3-фенил-1-аминопропана фармацевтически приемлемой кислотой. Соединения формул (ii), (iii) и (iv), являющиеся полезными промежуточными соединениями для получения соединений формулы I, представляют дальнейшие варианты выполнения настоящего изобретения. Соединение формулы I обычно означает R-(-)-N-метил-3-2-метил-4-гидроксифенил)окси)-3-фенил-1-аминопропан. Поскольку указанное соединение является амином, оно имеет основной характер и следовательно взаимодействует с любым соединением из ряда неорганических и органических кислот с образованием фармацевтически приемлемых кислотно-аддитивных солей. Предпочтительно превращать свободный амин в фармацевтически приемлемую кислотно-аддитивную соль для удобства в обращении и применении. Кислотами, обычно используемыми для получения солей, являются неорганические кислоты, такие как хлористо-водородная кислота, бромисто-водородная кислота, йодисто-водородная кислота, серная кислота, фосфорная кислота и тому подобное, и органические кислоты, такие как п-толуолсульфоновая кислота, метансульфоновая кислота, щавелевая кислота, п-бромфенилсульфоновая кислота,угольная кислота, янтарная кислота, лимонная кислота, бензойная кислота, уксусная кислота и тому по-2 005768 добное. Таким образом, примерами таких фармацевтически приемлемых солей являются сульфат, пиросульфат, бисульфат, сульфит, бисульфит, фосфат, моногидрофосфат, дигидрофосфат, метафосфат, пирофосфат, хлорид, бромид, иодид, ацетат, пропионат, деканоат, каприлат, акрилат, формиат, изобутират,капроат, гептаноат, пропиолат, оксалат, малонат, сукцинат, суберат, себацат, фумарат, малеат, бутин-1,4 диоат, гексин-1,6-диоат, бензоат, хлорбензоат, метилбензоат, динитробензоат, гидроксибензоат, метоксибензоат, фталат, сульфонат, ксилолсульфонат, фенилацетат, фенилпропионат, фенилбутират, цитрат,лактат, -гидроксибутират, гликолят, тартрат, метансульфонат, пропансульфонат, нафталин-1-сульфонат, нафталин-2-сульфонат, манделат и тому подобное. Предпочтительными фармацевтически приемлемыми солями являются соли, образованные хлористо-водородной кислотой и щавелевой кислотой. Соединения формулы I являются хиральными и могут быть получены хиральной хроматографией рацемических или энантиомерно обогащенных форм соединений формулы I либо дробной кристаллизацией солей, полученных из рацемического или энантиомерно обогащенного свободного амина и хиральной кислоты. Альтернативно, свободный амин может быть подвергнут взаимодействию со вспомогательным хиральным веществом и энантиомеры отделены хроматографически с последующим удалением хирального вспомогательного вещества в целях регенерации свободного амина. Кроме того, разделение энантиомеров может быть выполнено в любой удобный момент синтеза соединений по изобретению. Предпочтительно соединения по изобретению получают из хиральных исходных веществ. Настоящее изобретение касается способа ингибирования поглощения серотонина и норэпинефрина. Указанные механизмы действуют в организме млекопитающих, и предпочтительно млекопитающим является человек. Соединения структурного класса 3-арилокси-3-замещенного-1-аминопропана исторически являлись притягательным объектом для синтеза, и ряд полезных синтезов описан в литературе. Синтезы атомоксетина (R-(-)-N-метил-3-2-метилфенил)окси)-3-фенил-1-аминопропан, прежде известный как томоксетин,и флуоксетина, например, описаны в Tetrahedron Letters, 30(39), 5207 (1989); Tetrahedron Letters, 35(9),1339 (1994); Tetrahedron, 53(20), 6739 (1997); WO 99/18947; WO 00/58262 и WO 00/61540. R-(-)-N-метил 3-2-метил-4-гидроксифенил)окси)-3-фенил-1-аминопропан удобно получать по следующей иллюстративной схеме, где Рg означает кислородзащитную группу и X означает либо хлор, либо NHMe. Схема I Требуемые фенолы формулы (i) могут быть получены из коммерчески доступного метилгидрохинона путем введения подходящей кислородзащитной группы по стандартным методикам. Подходящие кислородзащитные группы для фенолов хорошо известны специалисту в данной области и описаны в(1999. Предпочтительными защитными группами для способа по настоящему изобретению являются сложные алканоиловые эфиры и простые силиловые эфиры. В особенности предпочтительными кислородзащитными группами являются ацетил, трет-бутоксикарбонил и трет-бутилдиметилсилил. Использование трет-бутоксикарбонила в особенности предпочтительно. Соединения формулы (v) хорошо известны в данной области и могут быть получены стандартными способами синтеза. Синтез 1-фенил-1-гидрокси-3-хлорпропана (v, Х=Сl) описан Corey and ReichardA1. Сочетание соответствующего фенола (i) осуществляют либо с 1-фенил-1-гидрокси-3-хлорпропаном(v, Х=Сl), либо с 1-фенил-1-гидрокси-3-(метиламино)пропаном (v, X=NHMe) в присутствии диалкилазодикарбоксилата и трифенилфосфина в стандартных условиях сочетания по Mitsunobu, получая простой ариловый эфир (ii) или простой ариловый эфир (iv) соответственно. Обычно раствор эквивалентного количества фенола (i) и эквивалентного количества спирта (v) объединяют в подходящем растворителе-3 005768 приблизительно с 1,0-1,1 эквивалентами трифенилфосфина. Подходящие растворители включают любой растворитель, который растворяет достаточное количество реагентов, которое позволяет осуществлять требуемое взаимодействие без существенных помех. Подходящие растворители включают диоксан, диэтиловый эфир и тетрагидрофуран. Предпочтительным растворителем является тетрагидрофуран. Раствор охлаждают приблизительно до (-5)-(+5)С, предпочтительно до 0-5 С. Реакционную смесь выдерживают в инертной атмосфере азота или аргона. К реакционной смеси добавляют около 1,0-1,5 эквивалентов, предпочтительно около 1,1 эквивалента диалкилазодикарбоксилата, предпочтительно диизопропилазодикарбоксилата. Затем полученную смесь перемешивают около 1-24 ч, после чего требуемый простой ариловый эфир выделяют и очищают стандартными способами. Раствор простого арилового эфира (ii) в подходящем растворителе, предпочтительно ацетоне, обрабатывают в пределах приблизительно от 1 молярного эквивалента до большого избытка источником иона иодида. Приемлем любой источник иона иодида, который совместим с выбранным растворителем и простым ариловым эфиром (ii). Предпочтительные источники иона иодида включают иодид натрия и калия. Предпочтительным источником иона иодида является иодид натрия. Полученный простой ариловый эфир (iii) выделяют и очищают стандартными способами. Раствор простого арилового эфира (iii) в подходящем растворителе, обычно тетрагидрофуране,подвергают взаимодействию с метиламином, в пределах приблизительно от эквивалента до большого избытка. Метиламин может быть добавлен к реакционной смеси в виде газа, конденсирующегося в реакционной смеси до жидкости, либо добавлен в виде водного раствора. Сразу после завершения добавления реагенты перемешивают приблизительно от 1 до 24 ч, после чего требуемый амин выделяют и очищают стандартными способами. Специалисту в данной области будет очевидно, что, в зависимости от природы конкретной используемой кислородзащитной группы (Рg), на данной стадии выделяют либо соединение формулы (iv), либо R-(-)-N-метил-3-2-метил-4-гидроксифенил)окси)-3-фенил-1-аминопропан. Например, когда Рg означает ацетил, защитную группу удаляют на стадии аминирования. Когда конкретная защитная группа (Рg) соединения формулы (iv) должна быть удалена на стадии разделения, для специалиста в данной области очевидно, что специфические условия восстановления фенольной группы зависят от природы защитной группы. Стандартные способы удаления кислородзащитных групп описаны в Greene and Wuts, см. выше. Например, когда Рg означает трет-бутилдиметилсилил, защитную группу обычно удаляют обработкой исходного простого силилового эфира (iv) источником иона фторида в подходящем растворителе. Альтернативно, когда Рg означает трет-бутоксикарбонил,защитную группу обычно удаляют обработкой с помощью кислоты, характерным примером которой является хлористо-водородная кислота. Полученный R-(-)-N-метил-3-2-метил-4-гидроксифенил)окси)3-фенил-1-аминопропан может затем быть выделен и очищен стандартными способами. Следующие препаративные примеры и примеры более конкретно иллюстрируют варианты выполнения настоящего изобретения и получения R-(-)-N-метил-3-2-метил-4-гидроксифенил)окси)-3-фенил 1-аминопропана. Препаративньхй пример I. 4-Ацетокси-2-метилфенол. Уксусный ангидрид (4,73 г, 4,37 мл, 46,3 мМоль) добавляют по каплям к смеси 4-гидрокси-2-метилфенола (5 г, 46,3 мМоль) и карбоната цезия (15,1 г, 46,3 мМоль) в ацетонитриле (50 мл). После перемешивания в течение ночи смесь фильтруют и фильтрат концентрируют при пониженном давлении. Остаток очищают гель-хроматографией на силикагеле, элюируя смесью 5:1 пентан:этилацетат. Фракции, содержащие продукт, объединяют и концентрируют при пониженном давлении, получая 0,24 г (3%) требуемого соединения. 1H-ЯМР(CDСl3) : 1,54 (1 Н, уш.с), 2,18 (3 Н, с), 2,22 (3 Н, с), 6,59 (1 Н, м), 6,65 (1 Н, м), 6,82 (1 Н, м). Препаративный пример II. (S)-3-Хлор-1-фенил-1-пропанол. К раствору (S)-1-фенил-1,3-пропандиола (125 г, 0,822 моль) в метил-трет-бутиловом эфире (500 мл) добавляют триэтиламин (135 мл). Полученную смесь охлаждают до 0 С и добавляют по каплям за 3 ч раствор 4-бромбензолсульфонилхлорида (230 г, 0,92 моль) в метил-трет-бутиловом эфире (300 мл) и тетрагидрофуране (300 мл). После добавления реакционную смесь перемешивают при 0 С в течение 3 ч и затем нагревают до температуры окружающей среды. После перемешивания при температуре окружающей среды в течение 18 ч добавляют бензилтриэтиламмонийхлорид (210 г, 0,92 моль) и полученную смесь нагревают до 55 С в течение 3 ч. Реакционную смесь охлаждают до температуры окружающей среды и затем разбавляют водой. После отделения органической фазы водную фазу дважды экстрагируют диэтиловым эфиром. Объединенные органические экстракты промывают 1,0 н хлористо-водородной кислотой, насыщенным водным бикарбонатом натрия, водой, насыщенным водным хлоридом натрия,сушат над сульфатом магния и концентрируют при пониженном давлении, получая не совсем белое твердое вещество (160 г). Указанный твердое вещество очищают гель-хроматографией на силикагеле,элюируя смесью этилацетат/гексан (1:9), что дает 110 г (80%) указанного в заголовке соединения. 1(45%), 51 (19%). Препаративный пример III. 4-трет-Бутоксикарбонил)окси)-2-метилфенол. Ди-трет-бутоксикарбонат (52,4 г, 0,24 моль) в тетрагидрофуране (100 мл) добавляют по каплям к раствору метилгидрохинона (99,2 г, 0,80 моль) и диметиламинопиридина (4,8 г, 4,0 мМоль) в диэтиловом эфире (1,1 л) при температуре окружающей среды. После перемешивания в течение 40 мин реакционную смесь гасят 1 н хлористо-водородной кислотой (200 мл). Органический слой отделяют, промывают насыщенным водным хлоридом натрия (200 мл), сушат над сульфатом натрия и концентрируют до неочищенного масла, затвердевающего при стоянии. Очистка неочищенного твердого вещества хроматографией на Biotage Flash 75 при элюировании смесью 94/6 гексан/этилацетат (94/6) дает не совсем белое твердое вещество, которое перекристаллизовывают из смеси дихлорметан/гексан (15/85), получая 28,5 (53%) указанного в заголовке соединения. 1(R)-3-Хлор-1-фенил-1-(2-метил-4-ацетоксифенокси)пропан. Раствор (S)-(-)-3-хлор-1-фенил-1-пропанола (0,204 г, 1,20 мМоль), 4-ацетокси-2-метилфенола (0,200 г,1,20 мМоль) и трифенилфосфина (0,346 г, 1,32 мМоль) в 10 мл тетрагидрофурана охлаждают до 0-5 С в атмосфере аргона. Указанную смесь обрабатывают, добавляя по каплям диизопропилазодикарбоксилат(0,26 мл, 1,32 мМоль) в тетрагидрофуране (2 мл). Полученную смесь перемешивают в течение 1 ч при 05 С и затем оставляют нагреваться до комнатной температуры. После перемешивания при комнатной температуре в течение ночи реакционную смесь концентрируют при пониженном давлении и остаток растирают с 10% этилацетатом в пентане и перемешивают до тех пор, пока суспендированный твердый продукт не закристаллизуется. Суспензию фильтруют и выделенный кристаллический твердый продукт промывают 10% этилацетатом в пентане. Объединенные фильтраты концентрируют при пониженном давлении и остаток очищают гель-хроматографией на силикагеле, элюируя толуолом. Содержащие продукт фракции объединяют и концентрируют при пониженном давлении, получая 0,205 г (54%) требуемого соединения в виде светло-желтого масла.(R)-3-Иод-1-фенил-1-(2-метил-4-ацетоксифенокси)пропан. Смесь (R)-3-хлор-1-фенил-1-(2-метил-4-ацетоксифенокси)пропана (0,200 г, 0,63 мМоль) и 15 мл ацетона, насыщенного иодидом калия, перемешивают при кипячении с обратным холодильником в атмосфере аргона в течение ночи. Реакционную смесь выливают в 50 мл диэтилового эфира и образовавшуюся суспензию фильтруют. Фильтраты промывают насыщенным водным гидросульфитом натрия с последующей промывкой водой. Оставшуюся органическую фазу сушат над сульфатом магния и концентрируют при пониженном давлении, получая 0,18 г (70%) требуемого соединения в виде бесцветного масла.MC (FD): m/e=410 (M+). Аминирование. Смесь (R)-3-иод-1-фенил-1-(2-метил-4-ацетоксифенокси)пропана (0,180 г, 0,44 мМоль) и 40% водного метиламина (5 мл, 71 мМоль) в 15 мл тетрагидрофурана перемешивают при комнатной температуре в течение ночи. Реакционную смесь концентрируют при пониженном давлении и остаток распределяют между водой и этилацетатом. Этилацетатную фазу промывают водой, сушат над сульфатом магния и концентрируют при пониженном давлении. Остаток растворяют в этилацетате и обрабатывают щавелевой кислотой (0,04 г, 0,44 мМоль). Полученное белое твердое вещество выделяют фильтрованием, промывают этилацетатом и сушат при пониженном давлении, получая 0,107 г (67%) указанного в заголовке соединения.(R)-3-Хлор-1-фенил-1-(2-метил-4-О-трет-бутоксикарбоксифенокси)пропан. В высушенную в сушильном шкафу трехгорлую круглодонную колбу на 2 л загружают (S)-3-хлор-1 фенилпропанол (52 г, 304 мМоль), 4-трет-бутоксикарбонил)окси)-2-метилфенол (73,86 г, 329 мМоль), трифенилфосфин (87,36 г, 333 мМоль) и безводный тетрагидрофуран (600 мл). Реакционную смесь охлаждают до 0 С и добавляют в течение 6 ч раствор диизопропилазадикарбоксилата (76 мл, 365 ммоль) в сухом тетрагидрофуране (100 мл). Реакционную смесь перемешивают еще 2 ч при 0 С и затем оставляют постепенно нагреваться до комнатной температуры. Реакционную смесь дополнительно перемешивают при комнатной температуре в течение 24 ч и затем реакционную смесь концентрируют при пониженном давлении. Остаток обрабатывают 2 л смеси 9:1 пентан:этилацетат. Образовавшуюся суспензию сохраняют при -20 С в течение 24 ч и нерастворимые вещества удаляют фильтрованием. Осадок промывают-5 005768 смесью 9:1 пентан:этилацетат (200 мл). Объединенные фильтраты концентрируют при пониженном давлении. Неочищенный остаток (150 г) очищают на предварительно заполненной насадочным материалом 150 flash Biotage колонке, элюируя 3% этилацетатом в гексане, что дает (R)-3-хлор-1-фенил-1-(2-метил 4-трет-бутоксикарбонил)окси)фенокси)пропан (100 г) с выходом 85%. 1 Н-ЯМР (CDCl3 400 МГц) : 1,50 (с, 9 Н), 2,20 (м, 1 Н), 2,27 (с, 3 Н), 2,46 (м, 1 Н), 3,60 (м, 1 Н), 3,76 (м,1 Н), 5,31 (м, 1 Н), 6,56 (д, J=8,8 Гц, 1 Н), 6,72 (м, 1 Н), 7,24 (м, 1 Н), 7,32 (с, 4 Н). 13 С-ЯМР (СDСl3 75 МГц) : 15,27, 16,59, 27,69, 41,25, 41,48, 83,20, 113,15, 113,71, 118,42, 118,84,122,21, 123,42, 125,39, 125,81, 127,93, 128,17, 128,80, 140,77, 144,29, 152,46, 153,44.(R)-3-Иод-1-фенил-1-(2-метил-4-трет-бутоксикарбонил)окси)фенокси)пропан. В сухую круглодонную колбу на 1 л загружают (R)-3-хлор-1-фенил-1-(2-метил-4-трет-бутоксикарбонил)окси)фенокси)пропан (18,00 г, 47,80 мМоль), иодид натрия (90,0 г, 600 мМоль) и 2-бутанон(550 мл). Реакционную колбу защищают от света. Реакционную смесь перемешивают при кипячении с обратным холодильником в атмосфере азота в течение 16 ч. Смесь охлаждают до комнатной температуры и выливают в диэтиловый эфир (1 л). Нерастворимые неорганические соли (белый осадок) удаляют фильтрованием. Фильтрат концентрируют при пониженном давлении и неочищенный остаток растворяют в диэтиловом эфире (1 л). Эфирный слой промывают охлажденным насыщенным раствором бисульфита натрия (2 x 200 мл), водой и насыщенным водным хлоридом натрия. Органический слой сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Остаток подвергают флэшхроматографии, элюируя 20% этилацетатом в гексане, что дает 20,5 г (91%) требуемого соединения. 1(R)-3-Иод-1-фенил-1-(2-метил-4-трет-бутоксикарбонил)окси)фенокси)пропан (20,0 г, 42,66 мМоль) растворяют в безводном тетрагидрофуране (100 мл). Раствор обрабатывают метиламином (300 мл, 2 М раствор в тетрагидрофуране) в атмосфере азота и реакционную смесь перемешивают при температуре окружающей среды в течение 15 ч, за указанное время реакционная смесь упаривается досуха. Остаток обрабатывают этилацетатом и холодной водой. Два слоя разделяют. Водный слой экстрагируют этилацетатом. Объединенные органические слои тщательно промывают охлажденным насыщенным раствором бисульфита натрия, холодной водой, сушат над сульфатом магния и концентрируют при пониженном давлении. Остаток растворяют в этилацетате. Раствор экстрагируют охлажденной льдом 0,1 н хлористоводородной кислотой. Лиофилизация водного раствора дает желтое твердое вещество, которое растворяют в метаноле и пропускают через короткую колонку с активированным углем, Norit, порошок, 100 меш(2% древесный уголь). Растворитель удаляют и полученную хлористо-водородную соль осаждают при растирании с минимальным количеством воды. Хлористо-водородную соль перекристаллизовывают из воды, получая требуемый продукт (7,22 г, 55%). 1MC (FAB): м/z=272,4. ЭА: рассчитано для C17H21NО 2-HCl: С, 66,33, Н, 7,20, N, 4,55, Cl, 11,52. Найдено: С, 66,23, Н, 7,22, N, 5,37, Cl, 11,23. Все соединения пригодны для перорального применения и обычно вводятся перорально, и такое пероральное введение является предпочтительным. Однако пероральное введение не является единственным или даже единственным предпочтительным способом. Например, трансдермальное введение может быть очень желательно для пациентов, которые забывают принимать пероральные лекарственные средства или выражают при этом недовольство. Соединения формулы I могут также быть введены чрескожным, внутривенным, внутримышечным, интраназальным или интраректальным способом, в зависимости от конкретных обстоятельств. Способ введения может быть выбран из соображений, ограничиваемых физическими характеристиками лекарственного средства, удобством пациента и осуществляющего уход за больным персонала и другими имеющими отношение к данному случаю обстоятельствами(Remington's Pharmaceutical Sciences, 18th Edition, Mack Publishing Co. (1990. Фармацевтические композиции получают хорошо известным в области фармации способом. Носитель или наполнитель может быть твердым, полутвердым или жидким материалом, который может служить растворителем или средой для активного ингредиента. Подходящие носители или наполнители хорошо известны в данной области. Фармацевтическая композиция может быть предназначена для перо-6 005768 рального, в виде ингаляции, парентерального или местного применения и может быть введена пациенту в форме таблеток, капсул, аэрозолей, средств для ингаляции, суппозиториев, растворов, суспензий или тому подобного. Соединения по настоящему изобретению могут быть введены перорально, например с инертным разбавителем или в капсулах, либо спрессованные в таблетки. В целях перорального терапевтического введения соединения могут быть объединены с наполнителями и использованы в форме таблеток, пастилок, капсул, эликсиров, суспензий, сиропов, облаток, жевательных резинок и тому подобного. Такие препараты должны содержать по меньшей мере 4% соединения по настоящему изобретению, т.е. активного ингредиента, но возможны отклонения в зависимости от конкретной формы, и обычно содержание может составлять приблизительно от 4 до 70% от массы дискретной единицы. Количество, в котором соединение присутствует в композициях, является таким, чтобы могла быть получена соответствующая доза. Предпочтительные композиции и препараты по настоящему изобретению могут быть определены специалистом в данной области. Таблетки, пилюли, капсулы, пастилки и тому подобное могут также содержать одно или несколько следующих вспомогательных веществ: связующие вещества, такие как микрокристаллическая целлюлоза, трагакантовая камедь или желатин; наполнители, такие как крахмал или лактоза, дезинтегрирующие средства, такие как альгиновая кислота, Primogel, кукурузный крахмал и тому подобное; смазывающие средства, такие как стеарат магния или Sterotex; средства, обеспечивающие скольжение, такие как коллоидный диоксид кремния; и могут быть добавлены подсластители, такие как сахароза или сахарин, или корригенты, такие как мята перечная, метилсалицилат или апельсиновая вкусовая добавка. Когда дозированная лекарственная форма представляет собой капсулу, она может содержать, в дополнение к материалам указанного выше типа, жидкий наполнитель, такой как полиэтиленгликоль или жирное масло. Другие дозированные лекарственные формы могут содержать другие разнообразные материалы,модифицирующие физическую форму стандартной дозировки, например, в качестве покрытий. Так, таблетки или пилюли могут быть покрыты сахаром, шеллаком или другими агентами для покрытия. Сироп может содержать, в дополнение к настоящим соединениям, сахарозу в качестве подсластителя и некоторые консерванты, красители и пигменты и корригенты. Материалы, используемые для получения указанных разнообразных композиций, должны быть фармацевтически чистыми и нетоксичными в употребляемых количествах. Состав, полезный для введения R-(-)-N-метил-3-2-метилфенил)окси)-3-фенил-1-аминопропангидрохлорида (атомоксетина), метаболического предшественника R-(-)-N-метил-3-2-метил-4-гидроксифенил)окси)-3-фенил-1-аминопропана, включает сухую смесь R-(-)-N-метил-3-2-метилфенил)окси)-3-фенил-1-аминопропангидрохлорида с разбавителем или смазывающим средством. Крахмал, такой как желатинированный кукурузный крахмал, является подходящим разбавителем, а силиконовое масло, такое как диметикон, подходящим смазывающим средством для применения в твердых желатиновых капсулах. Подходящие составы получают в виде составов, содержащих приблизительно 0,4-26% R-(-)-N-метил-32-метилфенил)окси)-3-фенил-1-аминопропангидрохлорида, приблизительно 73-99% крахмала и порядка 0,2-1,0% силиконового масла. Следующие таблицы иллюстрируют в особенности предпочтительные составы.-7 005768 В целях парентерального терапевтического введения соединения по настоящему изобретению могут быть включены в раствор или суспензию. Такие препараты обычно содержат по меньшей мере 0,1% соединения по изобретению, но возможны вариации в пределах 0,1-90% по массе указанного соединения. Количество соединения формулы I, присутствующего в таких композициях, является таким, что обеспечивает получение соответствующей дозы. Растворы или суспензии могут также включать одно или несколько следующих вспомогательных веществ: стерильные разбавители, такие как вода для инъекции, солевой раствор, нелетучие масла, полиэтиленгликоли, глицерин, пропиленгликоль или другие синтетические растворители; антибактериальные средства, такие как бензиловый спирт или метилпарабен; антиоксиданты, такие как аскорбиновая кислота или бисульфит натрия; хелатообразующие вещества, такие как этилендиаминтетрауксусная кислота; буферы, такие как ацетаты, цитраты или фосфаты, и агенты, придающие изотоничность, такие как хлорид натрия или декстроза. Парентеральный препарат может быть заключен в ампулы, шприцы одноразового применения или флаконы, содержащие дозы многократного применения, изготовленные из стекла или пластика. Предпочтительные композиции и препараты могут быть определены специалистом в данной области. Соединения по настоящему изобретению могут также быть введены местно, и в этом случае удобно, чтобы носитель включал основу в виде раствора, мази или геля. Основа, например, может содержать один или несколько следующих компонентов: вазелин, ланолин, полиэтиленгликоли, пчелиный воск,минеральное масло, разбавители, такие как вода и спирт, и эмульгаторы и стабилизаторы. Составы местного применения могут содержать в некоторой концентрации соединение формулы I или его фармацевтически приемлемую соль, приблизительно 0,1-10% м/о (мас./об.). Специалисту будет очевидно, что R-(-)-N-метил-3-2-метил-4-гидроксифенил)окси)-3-фенил-1 аминопропан может быть получен путем конверсии, например, при ферментативном или кислотном катализе, метаболических предшественников R-(-)-N-метил-3-2-метил-4-гидроксифенил)окси)-3-фенил-1 аминопропана. Метаболическим предшественником R-(-)-N-метил-3-2-метил-4-гидроксифенил)окси)3-фенил-1-аминопропана является соединение, которое может быть превращено в R-(-)-N-метил-3-2 метил-4-гидроксифенил)окси)-3-фенил-1-аминопропан in vivo после введения метаболического предшественника млекопитающему. Поэтому в дополнение к способам, описанным в предшествующих параграфах, введение R-(-)-N-метил-3-2-метил-4-гидроксифенил)окси)-3-фенил-1-аминопропана может также быть осуществлено путем введения метаболического предшественника R-(-)-N-метил-3-2-метил-4-гидроксифенил)окси)-3-фенил-1-аминопропана. Указанный метаболический предшественник может быть введен в таких количественных дозах, которые обеспечивают эффективное ингибирование поглощения серотонина и норэпинефрина, не оказывая опасных или неблагоприятных побочных действий. Метаболические предшественники R-(-)-N-метил-3-2-метил-4-гидроксифенил)окси)-3-фенил-1 аминопропана включают сложные эфиры карбоновых кислот, сложные сульфонатные эфиры, аминокислотные эфиры и простые эфиры гидроксигруппы соединений формулы I. Кроме того, установлено, чтоR-(-)-N-метил-3-2-метил-4-гидроксифенил)окси)-3-фенил-1-аминопропан может быть получен ферментативным превращением R-(-)-N-метил-3-2-метилфенил)окси)-3-фенил-1-аминопропана, т.е. атомоксетина, in vivo. Далее, предпочтительным способом системного введения R-(-)-N-метил-3-2-метил-4-гидроксифенил)окси)-3-фенил-1-аминопропана является пероральное введение млекопитающим R-(-)-Nметил-3-2-метилфенил)окси)-3-фенил-1-аминопропангидрохлорида, т.е. атомоксетина. Т.е. системное введение R-(-)-N-метил-3-2-метил-4-гидроксифенил)окси)-3-фенил-1-аминопропана может предпочтительно осуществляться путем перорального введения млекопитающим R-(-)-N-метил-3-2-метилфенил)окси)-3-фенил-1-аминопропангидрохлорида, т.е. атомоксетина, как метаболического предшественника R-(-)-N-метил-3-2-метил-4-гидроксифенил)окси)-3-фенил-1-аминопропана. Анализы на моноамины методом микродиализа. Крысам линии Sprague-Dawley (Harlan или Charles River) массой 270-300 г хирургическим путем вживляют датчики микродиализатора, используя анастезию хлоральгидрат/пентобарбитал (170 и 36 мг/кг,в.б., в 30% пропиленгликоле, 14% этаноле), как описано Perry и Fuller (Perry and Fuller, Effect of fluoxetineon serotonin and dopamine concentration in rat hypothalamus after administration of fluoxetine plus L-5hydroxytryptophan, Life Sci., 50, 1683-90 (1992. Для односторонней имплантации датчика в гипоталамус при координатах рострально - 1,5 мм, латерально - 1,3 мм и вентрально - 9,0 мм используют стереотаксический инструмент Давида Копфа (David Kopf, Paxinos and Watson, 1986). После 48-часового периода восстановления крыс помещают в большие пластиковые камеры, снабженные жидкостной поворотной системой (СМА/120 система для свободного перемещения животных, Bioanalytical Systems, West Lafayette,IN). Фильтрованную искусственную спинно-мозговую жидкость (CSF) (150 мМ NaCl, 3,0 мМ КСl, 1,7 мМ CaCl2 и 0,9 мМ MgCl2) перфузируют через датчик при скорости 1,0 мл/мин. На выходную линию диализата устанавливают десятиканальный клапан ВЭЖХ с петлей в 20 мкл. По окончанию каждого 30 минутного периода отбора образцов собранный в петле диализат впрыскивают в аналитическую колонку(Spherisorb 3ODS2, 2 х 150 мм, Keystone Scientific). Способ, используемый для определения моноаминов, является способом, описанным Perry и Fuller(1992). Вкратце, диализат, собранный в петле на 20 мкл, анализируют на 5-НТ и NE. Впрыскиваемый образец в 20 мкл поступает на колонку с подвижной фазой, которая разделяет NE и 5-НТ: 75 мМ ацетата-8 005768 калия, 0,5 мМ этилендиаминтетрауксусной кислоты, 1,4 мМ натриевой соли октансульфоновой кислоты и 8% метанола, рН 4,9. Подвижная фаза колонки для аминов подается с помощью насоса с программируемой производительностью при начальной скорости потока 0,2 мл/мин, возрастающей до 0,3 мл/мин в течение 5 мин, затем вновь убывающей до 0,2 мл/мин в течение 26 мин, с общей продолжительностью работы 30 мин. Программирование потока используют для вымывания 5-НТ за период времени 25 мин. Электрохимический детектор (EGГ, Model 400) колонки для аминов устанавливают при напряжении 400 мВ и чувствительности 0,2 нА/В. Перед введением лекарственного средства базисные уровни измеряют в течение по меньшей мере 90 мин. С целью введения требуемых доз получают лекарственные препараты в фильтрованной деионизованной воде (объем 0,25-0,3 мл).R-(-)-N-Метил-3-2-метил-4-гидроксифенил)окси)-3-фенил-1-аминопропан испытан, по существу,как описано выше, и установлено, что указанное соединение ингибирует как серотонин (Ki=43 нМ), так и норэпинефрин (Ki=3,0 нМ). Превращение в ходе обмена веществ R-(-)-N-метил-3-2-метил-4-фенил)окси)-3-фенил-1-аминопропана в R-(-)-N-метил-3-2-метил-4-гидроксифенил)окси)-3-фенил-1-аминопропан в организме человека. Исследование с помощью открытой метки проводят на 7 здоровых мужчинах. Генотип CYP2D6 идентифицируют перед началом исследования как ЕМ (индивидуум с экстенсивными метаболическими способностями) или РМ (индивидуум со слабыми метаболическими способностями). CYP2D6 является ферментом с генетическим полиморфизмом, приводящим по меньшей мере к 2 группам индивидуумов, с активными либо слабыми метаболическими способностями. Большинство людей определяются как "индивидуумы с экстенсивными метаболическими способностями" (ЕМ) и обладают "нормальной" активностью CYP2D6. Мутации или делеция гена CYP2D6 приводят к незначительному количеству людей (5%10% белой расы; 1% жителей Азии), известных как "индивидуумы со слабыми метаболическими способностями" (РМ) относительно субстратов CYP2D6. Многократные 20-мг дозы R-(-)-N-метил-3-2-метилфенил)окси)-3-фенил-1-аминопропана вводят дважды в день в течение 5 дней, с последующим введением разовой дозы (20 мг) меченного радиоактивным изотопом томоксетина (фактическая доза 19,66 мг) на утро 6-го дня. [3-14 С]-R-(-)-N-Метил-3-2 метилфенил)окси)-3-фенил-1-аминопропан с радиоактивной меткой, выпускаемый в виде 20-мг капсулR-(-)-N-метил-3-2-метилфенил)окси)-3-фенил-1-аминопропангидрохлорида, содержащего достаточное количество [3-14 С]-R-(-)-N-метил-3-2-метилфенил)окси)-3-фенил-1-аминопропангидрохлорида, для обеспечения дозы порядка 3,7 МБк (100 мкКюри). Приблизительно через 12 ч после введения утренней дозы на дни 1-5 вводят содержимое второй 20 мг капсулы с 240 мл воды. Указанную вечернюю дозу вводят спустя по меньшей мере 30 мин после легкого ужина. На утро 6-го дня капсулу с 20 мг R-(-)-N-метил-3-2-метилфенил)окси)-3-фенил-1 аминопропангидрохлорида, содержащего 100 мкКюри [3-14 С]-R-(-)-N-метил-3-2-метилфенил)окси)-3 фенил-1-аминопропангидрохлорида, дают перорально с 240 мл воды через 30 мин после окончания стандартного завтрака. Пробы цельной крови отбирают у ЕМ-субъектов за 12 ч до введения, и непосредственно перед введением [3-14 С]-R-(-)-N-метил-3-2-метилфенил)окси)-3-фенил-1-аминопропангидрохлорида (предшествующая введению доз контрольная проба), и приблизительно через 1, 2, 3, 4, 6, 8, 12, 18, 24, 36, 48 и 72 ч после введения дозы. Пробы цельной крови отбирают у РМ-субъектов за 12 ч до введения, и непосредственно перед введением [3-14 С]-R-(-)-N-метил-3-2-метилфенил)окси)-3-фенил-1-аминопропангидрохлорида (предшествующая введению доз контрольная проба), и приблизительно через 1, 2, 3, 4, 6, 8, 12, 18,24, 48, 72, 96, 120, 144, 168, 192 и 216 ч после введения дозы. Отбор проб цельной крови (порядка 12 мл) в каждый момент времени производят в стеклянные пробирки, содержащие гепарин в качестве антикоагулянта. Пробы цельной крови сохраняют на льду до центрифугирования. Для получения плазмы кровь центрифугируют приблизительно при 3000 об./мин примерно в течение 15 мин и при температуре порядка 4 С в течение 1 ч после забора. Аликвоты плазмы отбирают для определения радиоэквивалентных концентраций. Оставшуюся плазму сохраняют при температуре приблизительно -70 С до начала анализа на концентрации конъюгированного и неконъюгированного N-метил-3-2-метилфенил)окси)-3-фенил-1 аминопропана, R-(-)-N-метил-3-2-метил-4-гидроксифенил)окси)-3-фенил-1-аминопропана, 3-2-метилфенил)окси)-3-фенил-1-аминопропана или анализа профиля метаболитов. Гепаринизированные пробы плазмы крови человека анализируют на N-метил-3-2-метилфенил)окси)-3-фенил-1-аминопропан, R-(-)-N-метил-3-2-метил-4-гидроксифенил)окси)-3-фенил-1-аминопропан и, используя принятый способ APCI LC/MS/MS (жидкостная хроматография химической ионизации при атмосферном давлении/масс-спектрометрия/масс-спектрометрия), охватывают интервалы концентраций 1,00-800,00 нг/мл для N-метил-3-2-метилфенил)окси)-3-фенил-1-аминопропана и R-(-)-N-метил-3-2 метил-4-гидроксифенил)окси)-3-фенил-1-аминопропана и 2,50-2000,00 нг/мл для 3-2-метилфенил)окси)-3-фенил-1-аминопропана. Дополнительный анализ проводят, используя принятый способ APCILC/MS/MS для более низких концентраций, охватывая пределы концентраций 1,00-100,00 нг/мл для R(-)-N-метил-3-2-метилфенил)окси)-3-фенил-1-аминопропана и R-(-)-N-метил-3-2-метил-4-гидрокси-9 005768 фенил)окси)-3-фенил-1-аминопропана и 0,25-25,00 нг/мл для R-(-)-3-2-метилфенил)окси)-3-фенил-1 аминопропана. Первичным метаболитом R-(-)-N-метил-3-2-метилфенил)окси)-3-фенил-1-аминопропангидрохлорида, продуцируемым как субъектами с ЕМ, так и РМ CYP2D6, является R-(-)-N-метил-3-2-метил-4 гидроксифенил)окси)-3-фенил-1-аминопропан. У ЕМ-субъектов в ходе обмена веществ в организме преобразуется 86,5% R-(-)-N-метил-3-2-метилфенил)окси)-3-фениламинопропангидрохлорида в R-(-)-Nметил-3-2-метил-4-гидроксифенил)окси)-3-фенил-1-аминопропан. У РМ-субъектов в ходе обмена веществ в организме преобразуется 40% R-(-)-N-метил-3-2-метилфенил)окси)-3-фенил-1-аминопропангидрохлорида в R-(-)-N-метил-3-2-метил-4-гидроксифенил)окси)-3-фенил-1-аминопропан. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы I или его фармацевтически приемлемая соль. 2. Соединение R-(-)-N-метил-3-2-метил-4-гидроксифенил)окси)-3-фенил-1-аминопропангидрохлорид. 3. Фармацевтический состав, включающий соединение формулы I или его фармацевтически приемлемую соль, в сочетании с фармацевтически приемлемым носителем,разбавителем или наполнителем. 4. Фармацевтический состав по п.3, где соединение формулы I представляет собой R-(-)-N-метил-32-метил-4-гидроксифенил)окси)-3-фенил-1-аминопропангидрохлорид. 5. Фармацевтический состав в форме твердой желатиновой капсулы, содержащий сухую смесь R(-)-N-метил-3-2-метилфенил)окси)-3-фенил-1-аминопропангидрохлорида с разбавителем в виде крахмала и смазывающим веществом в виде силиконового масла.
МПК / Метки
МПК: C07C 217/48, A61K 31/138, A61P 25/00
Метки: моноамина, ингибирование, поглощения
Код ссылки
<a href="https://eas.patents.su/11-5768-ingibirovanie-pogloshheniya-monoamina.html" rel="bookmark" title="База патентов Евразийского Союза">Ингибирование поглощения моноамина</a>
Предыдущий патент: Перорально вводимая система контролируемой доставки лекарственного средства, обеспечивающая временной и пространственный контроль
Следующий патент: Мутанты интерлейкина-18, их продуцирование и применение
Случайный патент: Клапанное устройство газового прибора












