Маркеры hbf и a1m в качестве маркеров ранней стадии преэклампсии
Формула / Реферат
1. Способ раннего прогнозирования риска развития преэклампсии, включающий следующие этапы:
a) измерение в период от 10 до 20 недели беременности уровня A1M, HbA и HbF в образце материнской сыворотки;
b) расчет соотношения HbF/общий Hb (HbF-соотношения), при этом предполагается повышенная вероятность развития преэклампсии, если измеренное HbF-соотношение превышает 0,0020 и измеренный уровень A1M превышает 21 мкг/мл.
2. Способ по п.1, в котором измерение проводят в период от 11 до 16 недели беременности.
3. Способ по п.1 или 2, в котором уровень HbF определяют анализом ELISA.
4. Способ по любому из предыдущих пунктов, в котором уровень A1M определяют радиоиммуноанализом (РИА) или ELISA.
5. Способ по любому из предыдущих пунктов, в котором концентрацию общего Hb измеряют анализом ELISA или конкурентным ELISA.
6. Способ по любому из предшествующих пунктов, в котором вероятность развития преэклампсии анализируется с помощью анализа бинарной логистической регрессии с тестом отношения правдоподобия (LR).
7. Способ по любому из предыдущих пунктов, в котором предполагается повышенная вероятность развития преэклампсии, если измеренный уровень A1M превышает 23, 25, 30, 35 или 40 мкг/мл.
8. Способ по любому из предыдущих пунктов, в котором предполагается повышенная вероятность развития преэклампсии, если HbF-соотношение превышает 0,0025, 0,0060 или 0,01.
9. Способ по любому из предыдущих пунктов, в котором предполагается повышенная вероятность развития преэклампсии, если HbF-соотношение превышает 0,0020, 0,0025, 0,0060 или 0,01 и уровень A1M превышает 21, 23, 25, 30, 35 или 40 мкг/мл.
10. Применение A1M и HbF в качестве маркеров ранней стадии преэклампсии в период от 10 до 20 недели беременности, согласно которому предполагается повышенная вероятность, если измеренный уровень A1M превышает 21 мкг/мл и измеренный уровень HbF превышает 0,45 мкг/мл.
11. Применение по п.10, в котором уровень HbF определен анализом ELISA.
12. Применение по п.10 или 11, в котором уровень A1M определен радиоиммуноанализом (РИА) или ELISA.
13. Применение по любому из пп.10-12, в котором предполагается повышенная вероятность развития преэклампсии, если уровень A1M превышает 23, 25, 30, 35 или 40 мкг/мл.
14. Применение по любому из пп.10-13, в котором предполагается повышенная вероятность развития преэклампсии, если уровень HbF превышает 0,75, 1,0, 1,5 или 2,5 мкг/мл.
15. Применение по любому из пп.10-14, в котором предполагается повышенная вероятность развития преэклампсии, если уровень A1M превышает 23, 25, 30, 35 или 40 мкг/мл и уровень HbF превышает 0,75, 1,0, 1,5 или 2,5 мкг/мл.
Текст
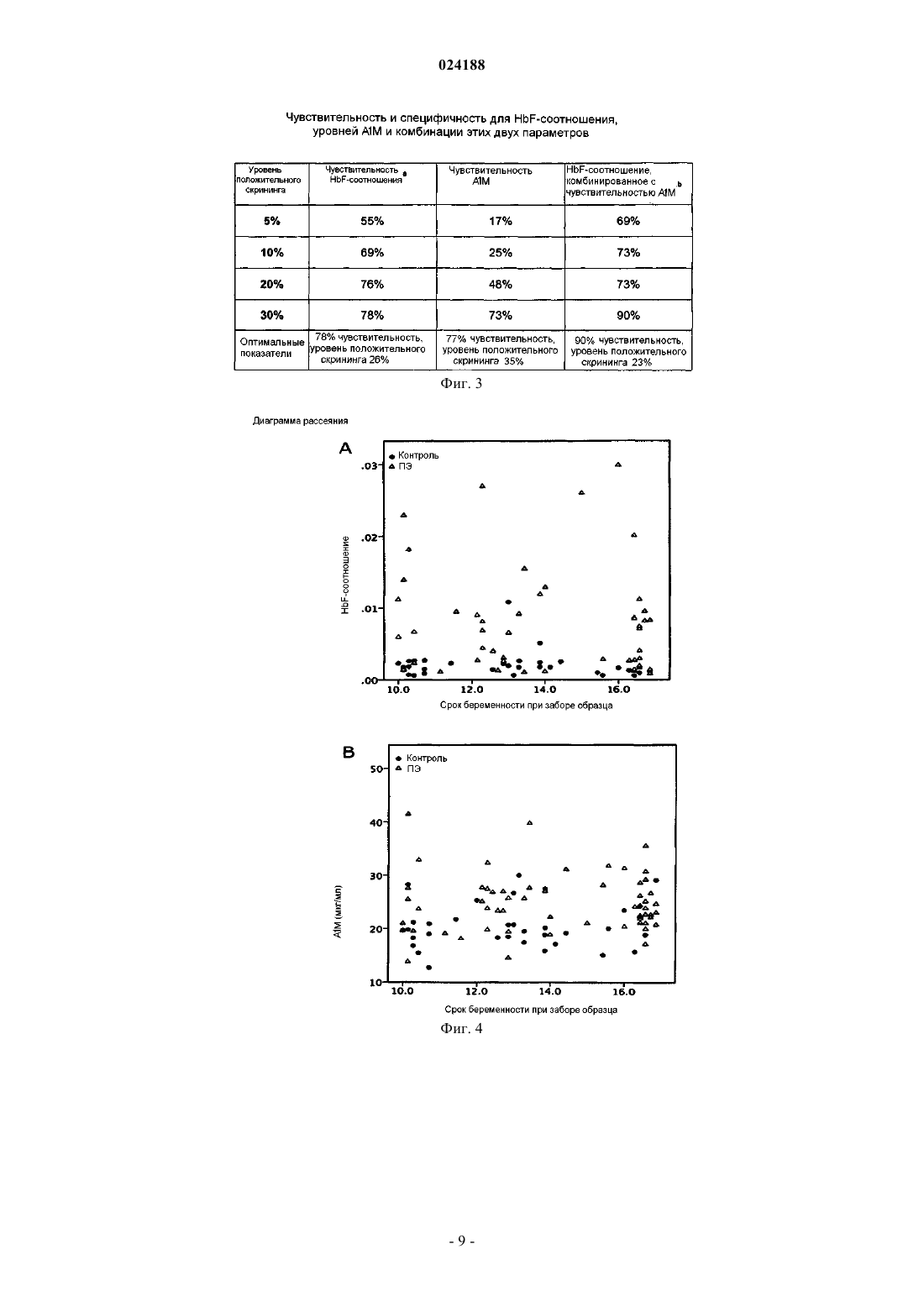
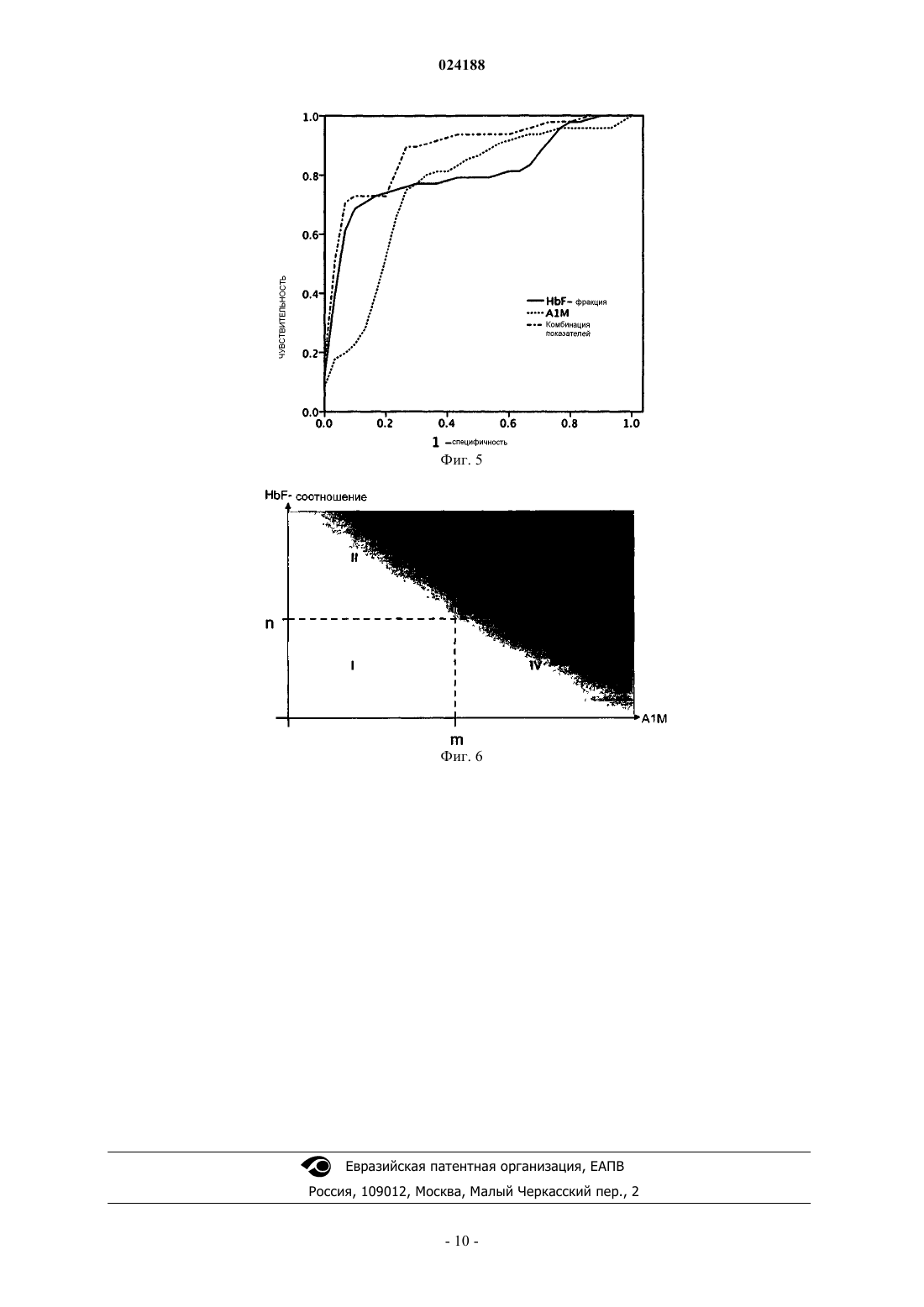
МАРКЕРЫ HbF И A1M В КАЧЕСТВЕ МАРКЕРОВ РАННЕЙ СТАДИИ ПРЕЭКЛАМПСИИ Изобретение относится к способу раннего прогнозирования риска развития преэклампсии,включающему следующие этапы: а) измерение в период от 10 до 20 недели беременности уровня(HbF-соотношения), при этом предполагается повышенная вероятность развития преэклампсии,если измеренное HbF-соотношение превышает 0,0020 и измеренный уровень A1M превышает 21 мкг/мл. С помощью комбинированной информации, относящейся к A1M и HbF, наблюдали улучшение диагностики или прогнозирования. Область техники, к которой относится изобретение Настоящее изобретение относится к применению эмбрионального гемоглобина (HbF) и (A1M) в качестве маркера преэклампсии (ПЭ). Уровень изобретения Преэклампсия (ПЭ) осложняет течение 7-15% всех беременностей и является важным фактором материнской заболеваемости и смертности. Клинические проявления ПЭ возникают в период от второго до третьего триместра. Наиболее тяжелая форма ПЭ с ранним началом наступает перед 34 неделей беременности (НБ). Симптомы часто выглядят смазанными и разнообразными, например головная боль, потеря четкости зрения и отеки. Дифференциальными симптомами, а также неотъемлемой составляющей диагностики заболевания являются гипертония и протеинурия. Обычно в развитии ПЭ выделяют две стадии, при этом первая стадия характеризуется нарушением образования и прикрепления плаценты, что приводит к неравномерному кровоснабжению, ишемическим реперфузионным повреждениям и повышенному окислительному стрессу в плаценте. Вторая стадия ПЭ,или материнский синдром, характеризуется генерализованной сосудистой дисфункцией, обусловленной тяжелым поражением эндотелия, что в конечном счете вызывает вазокострикцию, генерализованное сосудистое воспаление и полиорганную дисфункцию. Хотя клинические параметры, применяемые для диагностики ПЭ, хорошо известны, но вместе с тем имеются большие трудности в клинической диагностике ПЭ, обусловленные в основном смазанностью симптомов. По исследованиям Schroeder B.M. (ACOG practice bulletin on diagnosing and managing preeclampsia and eclampsia, 15; 66(2): 330-1 и Redman C.W.Sargent I.L., Science; 308(5728): 1592-4) ни количественные показатели протеинурии, ни уровень гипертензии не имеют строгой корреляции со степенью тяжести ПЭ. В настоящее время отсутствуют какие-либо надежные биомаркеры для прогноза и/или диагностики ПЭ, и поэтому большие усилия уделяются решению этой задачи. Однако главной проблемой является выявление хорошего биомаркера. Для улучшения диагностической точности необходимо объединять друг с другом многие из предложенных маркеров и/или проводить оценку в комбинации с допплеровским ультразвуковым исследованием. В настоящее время предложены некоторые маркеры, но ни один не расценивается в качестве полезного биомаркера для клинического прогнозирования или диагностики ПЭ. Предложены два антиангиогенных фактора с выявленной выраженной связью: растворимая fmsподобная тирозинкиназа 1 (sFIt) и растворимый эндоглин, которые описаны и обсуждены в публикацияхet al., Current opinion in obstetricsgynecology 2006 Dec; 18(6): 594-600. В предшествующем уровне техники описан ряд способов диагностики, но ни один из них до сих пор не нашел успешного применения в клинике в широком масштабе. Например, можно упомянуть патент США 5079171 и патент США 5108898, которые раскрывают возможности диагностики ПЭ,эклампсии и гипертензии, которая индуцирована беременностью, с помощью выявления присутствия эндотелиального клеточного маркера, например клеточного фибронектина, в образце крови, плазмы или сыворотки беременной женщины путем конкурентного иммуноанализа или сэндвич-иммуноанализа. Клеточный фибронектин происходит из эндотелиальных клеток, которые разрываются или разрушаются при патологическом процессе. В ряде исследований с применением ультразвукового допплеровского исследования уровень прогнозирования, в особенности для раннего начала ПЭ, составлял приблизительно 50%. Антиангиогенный маркер sFIt представляет собой хорошо изученный потенциальный маркер ПЭ,применяемый во втором и третьем триместрах. Однако в первом триместре, по сравнению с нормальными беременностями, уровень sFlt не изменяется, что делает его менее полезным для прогнозирования ПЭ. В качестве маркера ПЭ также предложен фактор роста плаценты (ФРП), но доступные данные показывают противоречивые результаты. По сравнению с прогностическим показателями, полученными при использовании комбинации sFlt/ФРП, эндоглин имеет более низкую эффективность для скрининга при ранних сроках беременности. В патенте США 5238819 раскрыта диагностика ПЭ с помощью анализа определения митогенного фактора в крови. Митогенный фактор представляет собой белковоподобное соединение приблизительно 160 кДа, которое способно стимулировать митоз фибробластов. Его присутствие обнаруживают путем детекции радиомеченного тимидина, который захватывается клетками, активированными сывороткой или плазмой субъекта с ПЭ. Этот маркер появляется после повреждения материнского сосудистого ложа, следовательно, на позднем этапе развития болезни. Публикация WO 05/093413 (Йельский университет и женская больница Brigham) раскрывает способ диагностики тяжелой ПЭ у беременных женщин, который содержит измерение уровня свободного гемоглобина (Hb) в образце спинномозговой жидкости. В настоящее время не существует какого-либо известного способа лечения ПЭ. По степени тяжести ПЭ может варьировать от легкой степени тяжести до опасного для жизни состояния. Форма легкой степени тяжести ПЭ может оставаться легкой при постельном режиме и частом контроле. При состоянии от-1 024188 средней до тяжелой формы необходима госпитализация, и назначается медикаментозное лечение артериального давления и противосудорожное лечение для предотвращения судорог. Если условие становится опасным для жизни матери или ребенка, единственным способом лечения является прерывание беременности, часто приводящее к преждевременному появлению ребенка. Очевидно, что недостатки лечения ПЭ наряду с давно существующими проблемами возможности ранней диагностики до прогрессирования болезни в более тяжелую форму вызывают потребность в новых подходах для диагностики и лечения ПЭ, которая представляет собой существенную проблему здравоохранения. Сущность изобретения Раскрытие настоящего изобретения основано на данных исследований профиля генов и белков, которые выявили увеличенный синтез и накопление эмбрионального гемоглобина (HbF) в просвете сосудов плаценты, полученной от женщин с ПЭ. Дополнительно, авторы изобретения выявили, что концентрация HbF в материнской плазме и/или сыворотке и "мусорщик" гема 1-микроглобулин (A1M) коррелируют со степенью тяжести болезни на сроках беременности. В настоящем раскрытии авторы изобретения, к удивлению, обнаружили, что комбинация соотношения HbF и показателей A1M обеспечивает превосходное точное прогнозирование и ее можно применять в качестве биомаркеров для раннего скрининга ПЭ. Подробное описание изобретения Исследования, проведенные авторами изобретения, указывают на вовлеченность Hbиндуцированного окислительного стресса в развитие ПЭ. При ПЭ наблюдается повышающая регуляция генов HbF и накопление белка в плаценте. Свободный Hb, т.е. находящийся вне эритроцитов, и его метаболиты гем и железо вызывают окислительный стресс посредством образования активных форм кислорода (АФК). Окислительный стресс может повреждать гемоплацентарный барьер, что приводит к выходуHbF в материнское кровеносное русло и в итоге вызывает повышение его уровня в материнской плазме или сыворотке. В действительности и в плазме, и в плаценте у женщин с ПЭ было выявлено повышение содержания HbF, общего Hb и маркеров окислительного стресса, а также "мусорщика" гема и антиокислительного эндогенного белка A1M.A1M представляет собой важный эндогенный "мусорщик" для гема. Показано, что повышающая регуляция его экспрессии осуществляется в ответ на свободный Hb и АФК. Синтез и секреция A1M в основном происходит в печени и быстро распространяется в разные ткани, где обнаруживается в экстраваскулярном пространстве как в свободной форме, так и в виде высокомолекулярных комплексов, связанных с иммуноглобулином IgA, альбумином и протромбином. Биологическая и метаболическая связь между Hb и A1M дополнительно подтверждается текущими результатами авторов изобретения, поскольку в образцах при первом триместре наблюдали повышение и HbF, и A1M. Одновременное повышение содержания A1M и Hb также выявлено при ПЭ при полносрочной беременности. В изобретении раскрыто, что для прогнозирования риска развития ПЭ можно использовать показатели концентрации A1M и одного или нескольких маркеров HbA, HbF или соотношение HbF(HbF/общий Hb). Прогностические значения, полученные для HbF-соотношения и уровней A1M, особенно в их комбинации, имеют преимущества при сравнении их с большинством других прогностических биомаркеров ПЭ. Кроме того, HbF-соотношение и уровни A1M также являются полезными для диагностики ПЭ и определения степени тяжести ПЭ при полносрочной беременности. В одном аспекте изобретение относится к использованию показателей HbF и уровня A1M в комбинации для диагностики ПЭ. Следовательно, в этом аспекте изобретение относится к способу прогнозирования риска развития ПЭ путем измерения у субъекта концентрации HbF и A1M (уровни HbF и A1M) и определения соотношения измеренных показателей и референсных значений для оценки риска развития ПЭ. Концентрацию можно измерять в образцах, включающих пробы мочи, крови, сыворотки или плазмы, образцы слюны и, наиболее предпочтительно, в образцах плазмы человека. Уровни HbF и A1M можно измерять любым подходящим способом, включающим хроматографию, масс-спектрометрию и,наиболее предпочтительно, энзимсвязанный иммуносорбентный способ исследования (ELISA) для определения HbF и радиоиммунный анализ (РИА) для определения A1M. В дополнительном аспекте изобретение относится к использованию HbF-соотношения вместе с уровнем A1M для диагностики ПЭ. Для коррекции влияния HbF, происходящего из разрушенных материнских эритроцитов, использовали соотношение HbF/общий Hb (HbF-соотношение). При этом необходимо проявлять осторожность, чтобы минимизировать часто случающийся технологический гемолиз во время обработки образца. С помощью HbF-соотношения можно оценивать большинство образцов без риска ложноположительного прогноза или диагноза. HbF-соотношение коррелирует с уровнем A1M и,таким образом, представляет собой более точный способ измерения, применимый для прогнозирования риска развития ПЭ. Следовательно, в этом аспекте изобретение относится к способу прогнозирования риска развития ПЭ путем измерения у субъекта концентрации HbA, HbF и A1M (уровней HbA, HbF иA1M) путем вычисления HbF-соотношения и корреляции расчетного HbF-соотношения и уровня A1M по схеме или с референсными значениями с целью получения показателя риска развития ПЭ. Математический анализ можно выполнять любым подходящим способом, включающим анализ регрессии или анали-2 024188 зы логистической регрессии, например анализы бинарной логистической регрессии. Концентрацию можно измерять в образцах, включающих образцы мочи, крови, сыворотки, слюны и наиболее предпочтительно в образцах плазмы человека. Уровни HbF и A1M можно измерять любым подходящим способом, включающим хроматографию, масс-спектрометрию и наиболее предпочтительно энзимсвязанный иммуносорбентный анализ (ELISA) для определения HbF и радиоиммуноанализ (РИА) или ELISA дляA1M. В дополнительном аспекте изобретение относится к способу диагностики или прогнозирования риска развития ПЭ, где способ характеризуется содержанием следующих этапов:a) измерение уровня содержания A1M и одного или нескольких из соединений HbA, HbF у субъекта или в образце, выделенном от субъекта;b) сравнение измеренных уровней с одним или несколькими референсными значениями для оценки вероятности развития ПЭ. Как упомянуто выше, объединенная информация в отношении уровней A1M и HbF имеет преимущество по сравнению с информацией, касающейся только HbF в отдельности. Далее, в упомянутый способ могут быть включены дополнительные этапы, таким образом, представлен способ диагностики или прогнозирования риска развития ПЭ, где способ отличается содержанием следующих этапов:a) измерение уровня содержания A1M и одного или нескольких из соединений HbA, HbF у субъекта или в образце, выделенном от субъекта;c) сравнение измеренных уровней с одним или несколькими референсными значениями для оценки вероятности развития ПЭ. Дополнительно, способ можно улучшать, таким образом предоставляя способ диагностики или прогнозирования риска развития преэклампсии, где способ отличается содержанием следующих этапов:a) измерение уровня содержания A1M, HbA и HbF у субъекта или в образце, выделенном от субъекта;c) сравнение HbF-соотношения и концентрации A1M с референсными значениями для оценки вероятности развития преэклампсии. В качестве дополнения к разработанному способу можно применять математические способы и анализы, в которых проводится статистический анализ измеренных показателей, и таким образом предоставляют способ диагностики или прогнозирования риска развития ПЭ, где способ отличается содержанием следующих этапов:a) измерение уровня содержания A1M и одного или нескольких из соединений HbA, HbF у субъекта или в образце, выделенном от субъекта;d) сравнение соотношения, рассчитанного в b), данных корреляции, рассчитанных в с), или уровней содержания, измеренных в а), с одним или несколькими референсными значениями для оценки вероятности развития ПЭ. Способ(ы) настоящего изобретения может дополнительно включать статистические анализы измеренных значений согласно изобретению. Следовательно, можно проводить диагностику или оценивать риск развития ПЭ с помощью анализа уровня A1M и HbF-соотношения и/или уровней HbF, HbA илиA1M в виде отдельных способов, используя анализ бинарной логистической регрессии, необязательно с тестом отношения правдоподобия (LR). Для оценки риска развития ПЭ можно интерпретировать измеренные и/или расчетные значения и сравнивать их с наборами референсных значений. Риск развития ПЭ у субъекта можно оценивать, измеряя и анализируя уровень HbF. Считается, что у субъекта существует повышенная вероятность развития ПЭ, если измеренный уровень HbF превышает 0,45 мкг/мл, и составляет, например, 0,75 мкг/мл, например, 1,0 мкг/мл, например, 1,5 мкг/мл, например,2,5 мкг/мл. Риск развития ПЭ у субъекта можно оценивать, измеряя и анализируя уровень A1M. Считается, что у субъекта существует повышенная вероятность развития ПЭ, если измеренный уровень A1M превышает 21 мкг/мл, и составляет, например, 23 мкг/мл, например, 25 мкг/мл, например, 30 мкг/мл, например, 35 мкг/мл, например, 40 мкг/мл. Риск развития ПЭ у субъекта можно оценивать с помощью измерения и анализа уровней HbA и HbF путем вычисления HbF-соотношения. Способ соответствует любому из предыдущих пунктов, при этом считается, что субъект имеет повышенную вероятность развития ПЭ, если HbF-соотношение превышает 0,0020 и составляет, например, 0,0025, например 0,0060, например 0,01. Риск развития ПЭ у субъекта можно оценивать, измеряя и анализируя уровни HbF, HbA и A1M, путем вычисления HbF-соотношения и определения отношения HbF к уровню A1M. Это можно выполнять,например, способом логистической регрессии.-3 024188 Как показано на фиг. 6, для улучшения прогнозирования развития ПЭ можно использовать HbFсоотношение в комбинации с уровнем A1M. Точность прогнозирования значительно возрастает при комбинированном использовании этих двух параметров. Как показано на фиг. 6, можно определять конкретные референсные значения уровня A1M(значение m на фиг. 6), а также HbF-соотношение (значение n на фиг. 6), по которым у субъектов предполагается наличие повышенного риска развития ПЭ, если превышены показатели указанных референсных значений. В настоящем изобретении референсное значение (m) составляет приблизительно 21 мкг/мл, например 23 мкг/мл, например 25 мкг/мл, например 30 мкг/мл, например 35 мкг/мл, например 40 мкг/мл, и тогда считается, что субъект имеет повышенную вероятность развития преэклампсии. Референсное значение (n) составляет приблизительно 0,0020, например 0,0025, например 0,0060, например 0,01. Таким образом, если одно из референсных значений превышено (показано как область II и IV), считается, что субъект имеет повышенную вероятность развития ПЭ. Если превышены оба значения (т.е. область III на фиг. 6), считается, что субъект имеет значительно повышенный риск развития ПЭ. Уровни содержания маркеров можно измерять в образцах, выделенных у субъекта, наиболее предпочтительно, в материнских образцах. Образцы могут включать образцы крови, плазмы, мочи и сыворотки/плазмы. В изобретении описаны результаты, полученные из материнской венозной сыворотки/плазмы. Уровни содержания можно измерять с помощью энзимсвязанного иммуносорбентного анализа (ELISA), радиоиммуноанализа(РИА), Вестерн-блоттинга, спектрофотометрии, LS-MS, MALDI-TOF MS, хроматографии и т.д. Образцы также можно выделять из плаценты или мочи. Можно проводить забор и анализ образцов субъекта в течение всего периода беременности, например, в период от 3 до 42 недели беременности, например в период от 7 до 24 недели беременности, например в период от 10 до 20 недели беременности, например на 11-16 неделе беременности. При возможности, можно проводить неинвазивное измерение у субъекта в период от 3 до 42 недели беременности, например в период от 7 до 24 недели беременности, например в период от 10 до 20 недели беременности, например на 11-16 неделе беременности. Уровень HbF можно измерять любым подходящим способом, включающим хроматографию, массспектрометрию и наиболее предпочтительно энзимсвязанный иммуносорбентный анализ ELISA. Уровень A1M можно измерять любым подходящим способом, включающим хроматографию, массспектрометрию и предпочтительно энзимсвязанный иммуносорбентный анализ или радиоиммуноанализ(РИА). Общий уровень содержания Hb, а также HbA можно измерять любым подходящим способом,включающим хроматографию, масс-спектрометрию и предпочтительно энзимсвязанный иммуносорбентный анализ или радиоиммуноанализ (РИА). В дополнительном варианте осуществления изобретение относится к комплекту для измерения и анализа уровня A1M и еще одного из соединений HbA или HbF у субъекта или в образце, выделенном у субъекта. В дополнение к устройствам для измерения уровня A1M, HbA и HbF комплект может содержать руководство о проведении статистического анализа полученных данных, алгоритмах проведения статистического анализа измеренных уровней содержания и референсных значений, с которыми можно сравнивать измеренные и/или расчетные значения для оценки риска развития ПЭ. Дополнительно в комплект может входить автоматизированное устройство для измерения, вычисления и оценки риска ПЭ,например стационарное или мобильное электронное устройство. Определения В настоящем изобретении, если не указано иначе, формы единственного числа означают "один или несколько", "один или более". Определение упоминаемой в изобретении "преэклампсии (ПЭ) " соответствует определению Международного общества по изучению гипертензии при беременности. Определением ПЭ является следующее: два измерения артериального давления с промежутком по меньшей мере 4 ч, показывающие более чем 140/90 мм рт. ст., и показатели протеинурии, равные 300 мг или более в течение 24 ч, или два измерения средней порции мочи или образца мочи из катетера с показателями по меньшей мере 2+ по анализу с тестом-полоской, если недоступен сбор мочи в течение 24 ч. Альтернативно, можно применять другие определения термина "преэклампсия", например, в соответствии с критериями, установленными Комитетом по терминологии Колледжа акушерства и гинекологии США, а именно, гипертензия плюс протеинурия, выраженные отеки, или оба симптома. Например, можно определять ПЭ при наличии артериального давления 140/90 мм рт. ст. и протеинурии 0,3 г/л после 20 недель беременности. Используемое в изобретении понятие "нормальная беременность" определяют как роды после 37 НБ и нормальное артериальное давление. Гемоглобин А (HbA). Существуют разные формы Hb. Взрослый Hb (HbA) состоит из двух альфа- и двух бета-полипептидных цепей (Hb , Hb ), каждая из которых содержит группу непептидного гема,которая обратимо присоединяет одиночную молекулу кислорода. Другой компонент взрослого Hb, обо-4 024188 значаемый HbA2, состоит из двух альфа-цепей и двух дельта-цепей (Hb, Hb). Термин "свободный Hb" в настоящем описании в общем относится к свободному Hb и включает общий свободный Hb, свободный HbA, свободный HbA2, свободный HbF, любую субъединицу свободного Hb (например, цепи Hb, Hb, Hb или Hb) или их любую комбинацию. Это понятие дополнительно включает элементы Hb или в виде полипептида (белка) или в виде нуклеотида (РНК), кроме случаев их применения в качестве мишени для лечения. Эмбриональный гемоглобин (HbF). Термин "эмбриональный Hb" относится к свободному HbF или любой субъединице HbF и включает элементы HbF в виде полипептида (белка) или нуклеотида (РНК),кроме случаев их применения в качестве мишени для лечения. Используемый в настоящем описании термин "свободный", среди прочего, в понятиях "свободныйHb", "свободный эмбриональный Hb" или "свободные субъединицы Hb (например, цепи Hb, Hb, Hb или Hb)", относятся к Hb, эмбриональному Hb или субъединицам Hb, свободно циркулирующим в биологической жидкости, в противоположность клеточному Hb, который относится к молекулам, расположенным в клетках. Таким образом, термин "свободный" в этом смысле главным образом применяется в целях отличия свободного Hb от Hb, который находится в интактных эритоцитах. Используемый в изобретении термин "HbF-соотношение" означает пропорцию HbF/общий Hb, и ее вычисляют, соответственно, по значению содержания HbF, разделенному на значение общего уровня Hb. Термины "маркер" или "биомаркер" в настоящем описании относятся к биомолекуле, предпочтительно к полипептиду или белку, который дифференцированно присутствует в образце, взятом у женщины с ПЭ или у женщины с повышенным риском развития ПЭ, по сравнению с сопоставимым образцом,взятым у женщины, называемой "здоровой" женщиной/субъектом, у которой нет преэклампсии или нет повышенного риска развития ПЭ. Термин "биологический образец от беременной самки млекопитающего", термин "субъект" или эквиваленты этих понятий означают образец, полученный непосредственно от млекопитающего; соответственно, это не является образцом, полученным, например, от эмбриона или из амниотической жидкости. Используемый в изобретении термин "эмбриональный Hb", сокращенно обозначаемый HbF, относится к типу Hb, который является основным компонентом Hb у эмбриона. Эмбриональный Hb имеет две альфа- и две гамма-полипептидные цепи (Hb, Hb). Упомянутый в изобретении 1-микроглобулин (A1M) относится к члену семейства липокалинов,называемому альфа-1-микроглобулином. В литературе альфа-1-микроглобулин может встречаться под наименованием A1M, EDC1, НСР, HI30, IATIL, ITI, ITIL, ITILC и UTI. Везде в тексте настоящего изобретения любые и все ссылки конкретно включены в настоящее изобретение путем ссылки. Краткое описание фигур Фиг. 1. Демографические данные случаев и контрольной группы. Данные о неделе беременности при родах, о времени осуществления забора образцов, о весе при рождении, о количестве родов в анамнезе, о преждевременных родах. Показаны средние значения (2 стандартная ошибка) или количественные данные (%). Использовали U-тест Mann-Whitney за исключением е. а: р=0,001 после нормализации для внутриутробного возраста плода,d: 27 первобеременных среди страдающих ПЭ и 18 среди нормальных беременностей,е: преждевременные роды, определяемые как роды раньше 37+0 НБ. У 7 пациенток с ПЭ роды наступили раньше 34+0. Фиг. 2 показывает среднюю концентрацию HbF, A1M и общего Hb в случаях преэклампсии и в контрольной группе. Для определения показателя использовали бинарную логистическую регрессию. а: не вычисляли, поскольку различие между группами было несущественным.HbF-соотношение определяли как концентрацию HbF/общая концентрация Hb. с: вычисления коэффициента несогласия, основанного на HbF-соотношении 100. Это обусловлено очень низкими значениями содержания HbF-фракции. Фиг. 3. Оценка чувствительности и специфичности для HbF-соотношения, уровней A1M и комбинации этих двух параметров. а: на основании логистической регрессии, включающей оба параметра. Фиг. 4. Диаграмма разброса. А: диаграмма разброса показывает графическое представление распределения контрольных образцов и ПЭ относительно HbF-соотношения и время осуществления забора образца.HbF-соотношение = HbF/общий Hb. НБ забора образца: неделя беременности на момент забора образца. В: диаграмма разброса показывает графическое представление распределения контрольных образ-5 024188 цов и ПЭ относительно уровня A1M и время осуществления забора образца.A1M: уровень A1M, измеряемый в мкг/мл. НБ забора образца: неделя беременности на момент образца. Фиг. 5. График соотношения правильных и неверных заключений (ROC) - кривые. Кривые ROC показывают графическое представление специфичности (ось X) и чувствительности(ось Y) HbF-соотношения, уровня A1M и их комбинации. Фиг. 6. Графическое представление профиля риска.I: низкий риск,II и IV: повышенный риск,III: очень высокий риск. Цветной градиент, темный цвет отображает риск. Примеры Пример 1. Пациентки и демографические показатели. В исследование были включены в общей сложности 96 женщин. Пациентки с другими заболеваниями, такими как диабет и первичная артериальная гипертензия, не включались в исследование. Были включены шестьдесят женщин, у которых впоследствии возникла ПЭ (случаи) и 36 женщин с нормальной неосложненной беременностью (контрольная группа). Все роды в контрольной группе произошли после 37+0 НБ. Характеристики приведены в табл. 1. Из упомянутых 60 случаев в 20 случаях роды произошли ранее 37+0 недель беременности (НБ), из которых семь родов было ранее 34+0 НБ. Результаты всех беременностей были получены из базы данных родильного отделения и проверены в каждом индивидуальном случае. Использовали определение ПЭ, соответствующее определению Международного общества по изучению гипертензии при беременности: два измерения артериального давления с промежутком по меньшей мере 4 ч, показывающие больше чем 140/90 мм рт. ст., и показатели протеинурии, равные 300 мг или больше, в течение 24 ч, или два измерения средней порции мочи или образца мочи из катетера с показателями по меньшей мере 2+ по анализу с тестом-полоской, если недоступен сбор мочи в течение 24 ч. Нормальную беременность определяли как роды после 37 НБ и при нормальном артериальном давлении. Контрольные образцы рандомизированно забирали у женщин, которые принимали участие в исследовании в течение того же периода времени. Пациентов по этическому разрешению включали в исследование, проводимое в первом триместре как часть непрерывного проспективного ультразвукового исследования и определения сывороточных маркеров ПЭ у женщин при обычном дородовом посещении акушерского отделения St.Georges Hospital в Лондоне. Срок беременности вычисляли от последнего менструального периода и подтверждали ультразвуковым измерением копчиково-теменного размера. Пример 2. Забор образцов. Образец материнской венозной сыворотки забирали на 11-16 НБ для анализа HbF, общего Hb иA1M. Венозную кровь собирали в пробирку с вакуумом объемом 5 мл (Beckman Dickson) без добавок,что позволяло крови свертываться, и центрифугировали при 2000 g при комнатной температуре в течение 10 мин. Сыворотку сохраняли при -80 С до дальнейшего анализа. Пример 3. Измерение общего количества Hb, HbF и A1M. Концентрации HbF и A1M определяли анализом сэндвич-ELISA и радиоиммуноанализом (РИА) соответственно, как описано выше. Концентрацию общего Hb в сыворотке измеряли конкурентным ELISA, используя антитела против взрослого Hb (HbA), как описано ранее. Отношение HbF/общий Hb вычисляли и обозначали как HbF-соотношение. Пример 4. Статистический анализ. Для анализа данных использовали статистическое программное обеспечение (SPSS). Вероятность развития ПЭ анализировали в зависимости от HbF-соотношения и/или уровней HbF, HbA или A1M, используя анализ бинарной логистической регрессии с тестом отношения правдоподобия (LR). Для биомаркеров вычисляли коэффициент несогласия (OR). Поскольку HbF-соотношение имело низкое значение, его умножали на 100 перед вычислением OR. Во всех тестах использовали доверительный уровень 0,05. Кривые ROC для HbF, A1M, HbF-соотношения и комбинации HbF-соотношения и A1M получали на основании результатов логистической регрессии. Область под кривой (AUC) вычисляли по кривымROC. Анализ логистической регрессии позволил авторам тестировать чувствительность при разных-6 024188 уровнях положительного скрининга. Оценивали оптимальный уровень чувствительности. Линейные корреляции между тремя биомаркерами оценивали с помощью анализа двумерной корреляции с расчетом коэффициентов корреляции Пирсона. Пример 5. Группы исследования. Демографические данные включенных в исследование случаев и контрольной группы показаны на фиг. 1 и в примере 1. Выявлены ожидаемые значительные различия в продолжительности беременности к моменту родов. Наблюдали значительные различия в весе при рождении при корреляции со сроком беременности (р=0,001). Образцы крови при ПЭ в среднем забирали на 8 дней позже, чем образцы в контрольной группе (р=0,018). Пример 6. Уровни HbF-соотношения и содержания A1M в плазме. Отмечена высокая концентрация общего Hb во всех образцах, что предполагало определенную степень гемолиза. Высокие уровни подтверждены спектрофотометрией (данные не показаны). Вместе с тем в исследованных группах не было каких-либо существенных отличий в концентрации общего Hb, которая составляла 178 мкг/мл при ПЭ и 206 мкг/мл в контрольной группе (р=0,232) (фиг. 2). Средняя концентрация HbF составляла 1,38 мкг/мл при ПЭ и 0,45 мкг/мл в контрольной группе. Поскольку на значение HbF мог влиять исходный гемолиз и поскольку уровни HbF в значительной степени коррелировали с уровнем общего Hb, вычисляли HbF-соотношение (HbF/общий Hb). Среднее HbF-соотношение было значительно повышено в группе ПЭ по сравнению с контрольной группой (р 0,0001) (фиг. 2). HbFсоотношение в зависимости от срока беременности показано в диаграмме разброса (фиг. 3 А). Среднее содержание A1M было значительно повышено при ПЭ (24 мкг/мл) по сравнению с контрольной группой(21 мкг/мл, р=0,0001). Уровни A1M связаны со сроком беременности и показаны в диаграмме разброса(фиг. 3 В). Пример 7. Корреляционный анализ. Не выявлено значительной корреляции ни уровня HbF, ни уровня HbF-соотношения с содержаниемA1M (р=0,17, г=0,16). Однако уровни HbF в значительной степени коррелировали с общим уровнем Hb(р=0,001, г=0,35), и еще более выраженная корреляция наблюдалась в случаях ПЭ (р=0,005, г=0,39). Уровни общего Hb и A1M не показывали значительной корреляции (р=0,б 1, г=-0,055). Корреляция HbF-соотношения со сроком беременности.HbF-соотношение и уровень A1M тестировали на корреляцию со сроком беременности в период забора образцов (графически показано на фиг. 1). На сроке 10-16 НБ отсутствовала корреляция со сроком беременности и для HbF-соотношения, и для A1M. Логистическая регрессия и кривые соотношения правильных и неверных заключений (ROC). Использовали анализ логистической регрессии для вычисления доверительного уровня и отношения разногласий (фиг. 2). Изображали кривые ROC (фиг. 5) и получали данные чувствительности и специфичности для HbF-соотношения, A1M и их комбинации. Результаты анализировали по четырем разным пороговым значениям, как показано на фиг. 3. Область под кривой (AUC) составляла 0,82 для HbFсоотношения, 0,75 для A1M и 0,89 для комбинации HbF-соотношения и A1M. Комбинация этих двух маркеров показывала самые высокие прогностические показатели, с оптимальной чувствительностью 90% на уровне положительного скрининга 23% (фиг. 3). Пример 8. Диагностика с помощью комбинированного измерения HbF-соотношения и уровня A1M. Концентрации HbF и A1M определяли с помощью сэндвич-ELISA и радиоиммуноанализа (РИА) соответственно, как описано выше. Концентрацию общего Hb в сыворотке измеряли конкурентным анализом ELISA с использованием антител против взрослого Hb (HbA), как описано выше. Вычисляли отношение HbF/общий Hb, которое называли HbF-соотношением. Как показано на фиг. 6, можно использовать HbF-соотношение в комбинации с уровнем A1M для улучшения прогнозирования развития ПЭ. Путем комбинирования этих двух параметров значительно повышается точность прогнозирования. Как показано на фиг. 6, можно определять конкретные референсные значения уровня A1M (значение m на фиг. 6), а также HbF-соотношения (значение n на фиг. 6), по которым субъектов относят к группе повышенного риска развития ПЭ, если превышены указанные референсные значения. В настоящем изобретении референсное значение (m) составляет приблизительно 21 мкг/мл, например 23 мкг/мл, например 25 мкг/мл, например 30 мкг/мл, например 35 мкг/мл, например 40 мкг/мл, при этом у субъекта предполагается повышенная вероятность развития преэклампсии. Референсное значение(n) составляет приблизительно 0,0020, например 0,0025, например 0,0060, например 0,01. Таким образом,если превышено одно из референсных значений (показанное как область II и IV), у субъекта предполагается повышенный риск развития ПЭ. Если превышены оба значения (т.е. область III на фиг. 6), у субъекта предполагается наличие высокого риска развития ПЭ.-7 024188 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ раннего прогнозирования риска развития преэклампсии, включающий следующие этапы:a) измерение в период от 10 до 20 недели беременности уровня A1M, HbA и HbF в образце материнской сыворотки;b) расчет соотношения HbF/общий Hb (HbF-соотношения), при этом предполагается повышенная вероятность развития преэклампсии, если измеренное HbF-соотношение превышает 0,0020 и измеренный уровень A1M превышает 21 мкг/мл. 2. Способ по п.1, в котором измерение проводят в период от 11 до 16 недели беременности. 3. Способ по п.1 или 2, в котором уровень HbF определяют анализом ELISA. 4. Способ по любому из предыдущих пунктов, в котором уровень A1M определяют радиоиммуноанализом (РИА) или ELISA. 5. Способ по любому из предыдущих пунктов, в котором концентрацию общего Hb измеряют анализом ELISA или конкурентным ELISA. 6. Способ по любому из предшествующих пунктов, в котором вероятность развития преэклампсии анализируется с помощью анализа бинарной логистической регрессии с тестом отношения правдоподобия (LR). 7. Способ по любому из предыдущих пунктов, в котором предполагается повышенная вероятность развития преэклампсии, если измеренный уровень A1M превышает 23, 25, 30, 35 или 40 мкг/мл. 8. Способ по любому из предыдущих пунктов, в котором предполагается повышенная вероятность развития преэклампсии, если HbF-соотношение превышает 0,0025, 0,0060 или 0,01. 9. Способ по любому из предыдущих пунктов, в котором предполагается повышенная вероятность развития преэклампсии, если HbF-соотношение превышает 0,0020, 0,0025, 0,0060 или 0,01 и уровеньA1M превышает 21, 23, 25, 30, 35 или 40 мкг/мл. 10. Применение A1M и HbF в качестве маркеров ранней стадии преэклампсии в период от 10 до 20 недели беременности, согласно которому предполагается повышенная вероятность, если измеренный уровень A1M превышает 21 мкг/мл и измеренный уровень HbF превышает 0,45 мкг/мл. 11. Применение по п.10, в котором уровень HbF определен анализом ELISA. 12. Применение по п.10 или 11, в котором уровень A1M определен радиоиммуноанализом (РИА) или ELISA. 13. Применение по любому из пп.10-12, в котором предполагается повышенная вероятность развития преэклампсии, если уровень A1M превышает 23, 25, 30, 35 или 40 мкг/мл. 14. Применение по любому из пп.10-13, в котором предполагается повышенная вероятность развития преэклампсии, если уровень HbF превышает 0,75, 1,0, 1,5 или 2,5 мкг/мл. 15. Применение по любому из пп.10-14, в котором предполагается повышенная вероятность развития преэклампсии, если уровень A1M превышает 23, 25, 30, 35 или 40 мкг/мл и уровень HbF превышает 0,75, 1,0, 1,5 или 2,5 мкг/мл.
МПК / Метки
МПК: G01N 33/68
Метки: ранней, маркеров, стадии, преэклампсии, качестве, маркеры
Код ссылки
<a href="https://eas.patents.su/11-24188-markery-hbf-i-a1m-v-kachestve-markerov-rannejj-stadii-preeklampsii.html" rel="bookmark" title="База патентов Евразийского Союза">Маркеры hbf и a1m в качестве маркеров ранней стадии преэклампсии</a>
Предыдущий патент: Способ получения по меньшей мере одного производного этилена
Следующий патент: Композиция фруктового льда
Случайный патент: Машина для сортировки упаковок