Способ получения г-ксф человека
Номер патента: 22782
Опубликовано: 31.03.2016
Авторы: Пател Панкадж Р., Сарасват Вибхор, Мендиратта Санджив Кумар
Формула / Реферат
1. Способ получения гранулоцитарного колониестимулирующего фактора (Г-КСФ) с высоким объемным выходом (5,8-8,3 г/л) при нециклическом культивировании с подпиткой бактериальных клеток, трансформированных плазмидой со встроенным геном Г-КСФ человека, в среде, содержащей 5-10 г/л тиамина, 60-180 мМ ионов калия, а также 60-300 мМ ионов натрия или 150-250 мМ ионов магния, где выращивание и увеличение биомассы указанных клеток осуществляют до достижения оптической плотности среды приблизительно в 50 единиц (при длине волны 600 нм), после чего добавляют изопропилтиогалактозид (IPTG), индуцирующий экспрессию и продуцирование Г-КСФ.
2. Способ по п.1, где культуральная жидкость дополнительно включает культивируемую в культуральной жидкости клетку-хозяин, содержащую плазмиду, которая кодирует Г-КСФ.
3. Способ по п.2, где клетка-хозяин представляет собой Е. coli.
Текст
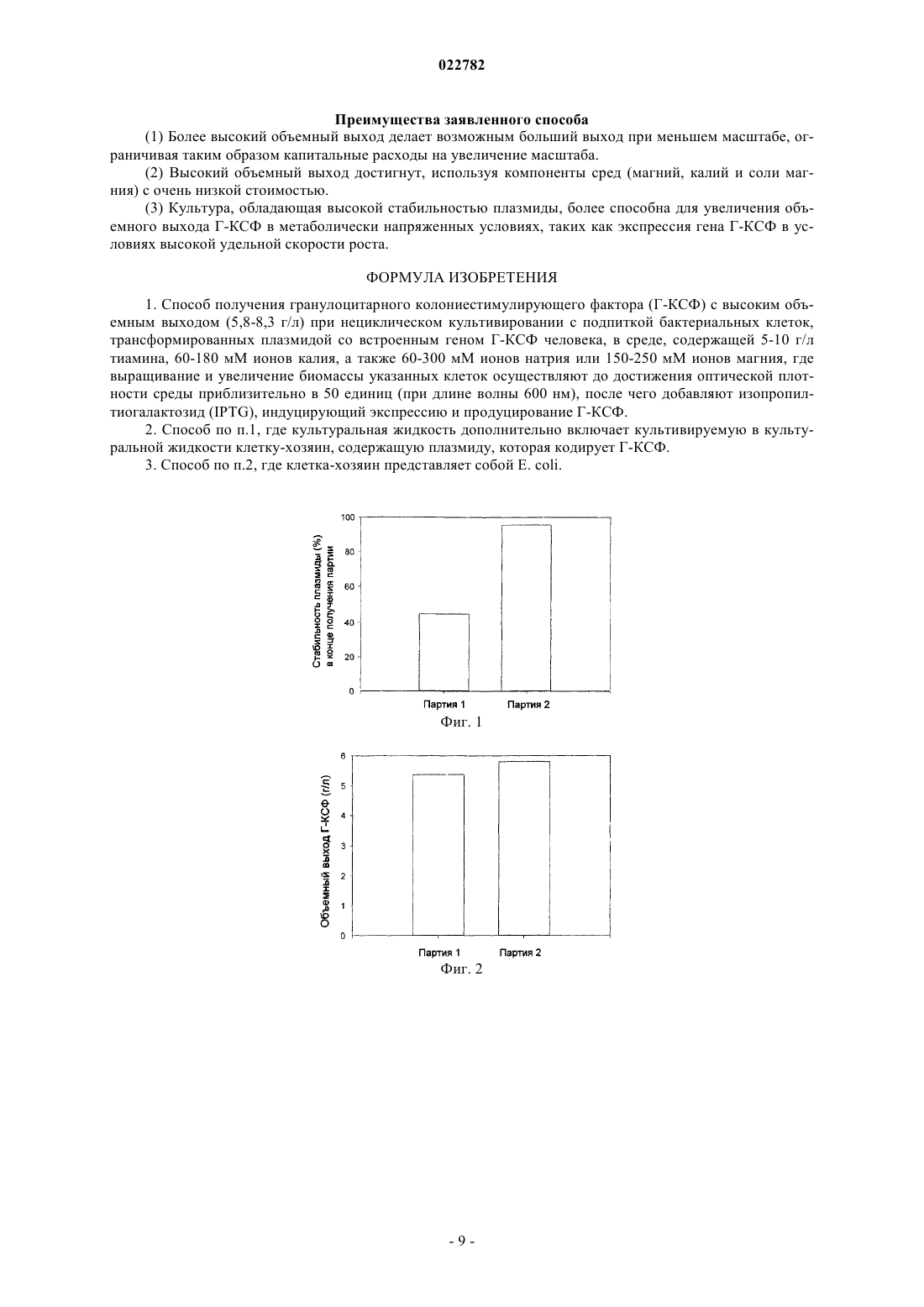
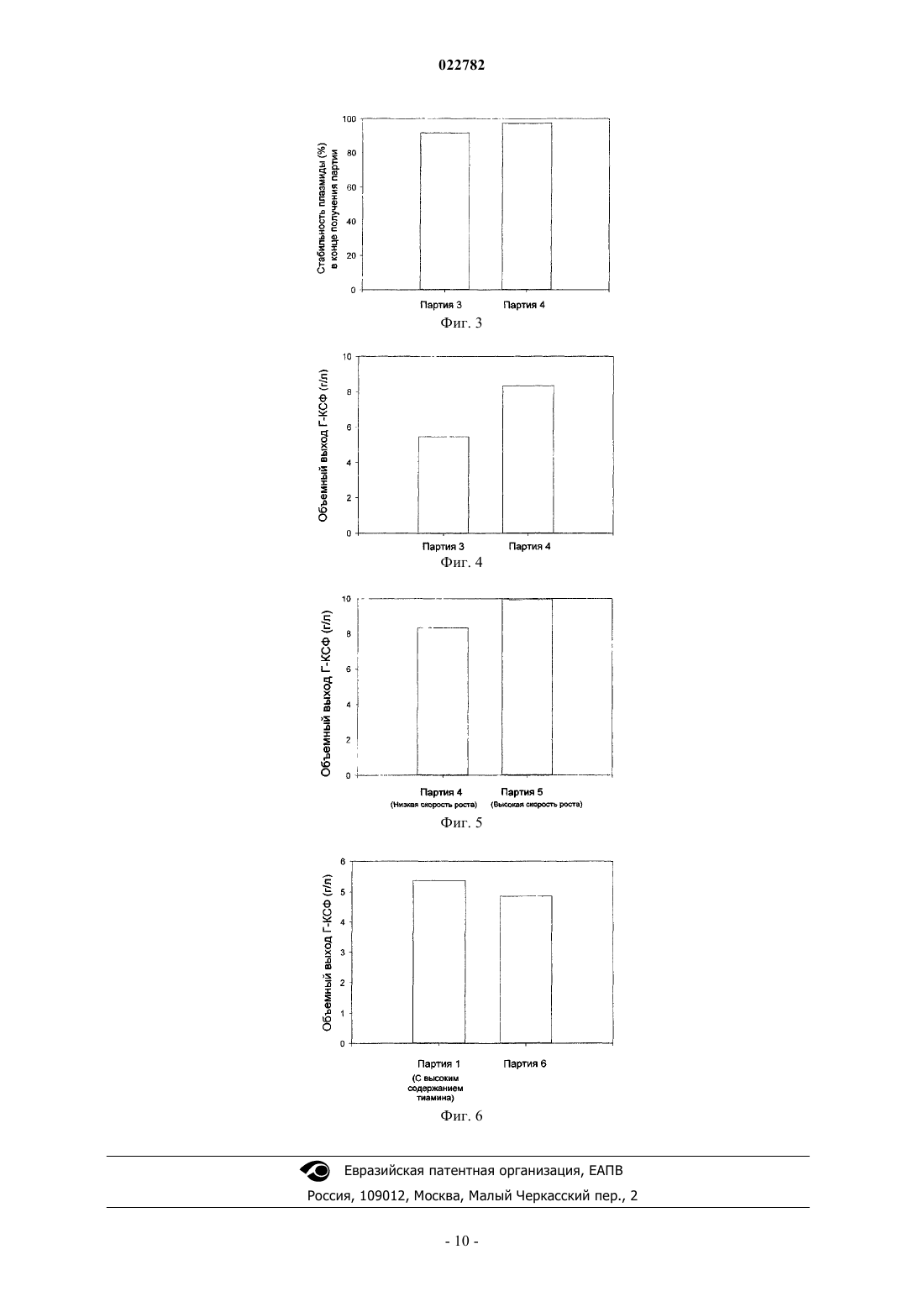
Изобретение относится к способу получения гранулоцитарного колониестимулирующего фактора(Г-КСФ) с высоким объемным выходом (5,8-8,3 г/л) при нециклическом культивировании с подпиткой бактериальных клеток, трансформированных плазмидой со встроенным геном Г-КСФ человека, в средах, содержащих 5-10 г/л тиамина, 60-180 мМ ионов калия, а также 60-300 мМ ионов натрия или 150-250 мМ ионов магния. Выращивание и увеличение биомассы указанных клеток осуществляют до достижения оптической плотности среды приблизительно в 50 единиц (при длине волны 600 нм). Далее добавляют изопропилтиогалактозид IPTG, индуцирующий экспрессию и продуцирование Г-КСФ. Способ позволяет получить Г-КСФ с высоким объемным выходом за счет поддержания высокой стабильности плазмиды, используя простой и устойчивый процесс.(71)(73) Заявитель и патентовладелец: КАДИЛА ХЕЛЗКЭР ЛИМИТЕД (IN) Область изобретения Настоящее изобретение относится к улучшенному способу получения Г-КСФ с высоким выходом, с использованием плазмиды с высокой стабильностью, индуцированной солью, в фазе продуцирования. Предпосылки изобретения Лечение цитокином, гранулоцитарным колониестимулирующим фактором (Г-КСФ) значительно улучшает качество жизни пациентов с тяжелой хронической нейтропенией [Jones et al. JAMA, 270: 11321133 (1993)]. Г-КСФ представляет собой мощный эндогенный элемент запуска высвобождения нейтрофилов из запасов костного мозга и их активации для усиленной антимикробной активности. Г-КСФ широко рассматривался в различных доклинических моделях острых заболеваний, как правило, с многообещающими результатами [Marshall J.C. Shock, 24: 120-9 (2005)]. Благодаря его доказанной эффективности в циклах химиотерапии, Г-КСФ является важным биофармацевтическим лекарственным средством, используемым в онкологии. Г-КСФ клонирован и экспрессирован в различных типах клеток, например бактериальных клетках [Souza L.M. Science, 232: 61-65 (1986); Hu Z.Y. et al. Zhongguo ShenghuaEpub ahead of print, (2005)], клетках кошачьих [Yamamoto et al. Gene, 274: 263-269 (2001)], клетках яичника китайского хомячка [Monaco L. et al. Gene, 180:145-150 (1996)], клетках насекомых [Shinkai et al.Protein Expr Purif., 10: 379-385 (1997)] и даже трансгенных коз [Ko J.H. et al. Transgenic Res., 9: 215-22(2000)]. Для фармацевтического использования Г-КСФ преимущественно получают в Escherichia coli[Jevsevar S. et al. Biotechnol. Prog., 21: 632-639 (2005)], где он продуцируется как тела включений, которые представляют собой нерастворимые агрегаты рекомбинантного белка в ненативной конформации[Baneyx F.Mujacic M. Nature Biotechnol., 22: 1399-1408 (2004)], которые, как правило, не обладают биологической активностью [Bernardez С.Е. Curr. Opin. Biotechnol., 9: 157-163 (1998)]. Также опубликован способ его секреторного получения [Jeong K.J.Lee S.Y. Protein Expr Purif., 23: 311-318 (2001); LeeS.Y. et al. Methods Mol. Biol., 308: 31-42 (2005)]. Секреторная экспрессия приводит, как правило, к высвобождению в периплазматическое пространство или внеклеточную среду Г-КСФ в надлежащем образом свернутой форме, но выходы его много меньше выходов, получаемых с телами включения. Поэтому с коммерческой точки зрения выгоднее экспрессировать Г-КСФ как тела включения в Е. coli. Надлежащим образом свернутый биологически активный белок Г-КСФ легко получают из тел включения коммерчески приемлемым способом, с использованием процесса денатурации и ренатурации после отделения и растворения тел включения [Rudolph R., In Protein Engineering: Principles и Practice; Cleland, J.L., Craik,S.C., Eds.; Wiley-Liss, Inc.: New York, 1996; p. 283-298; Rathore A.S. et al. J. Pharm. Biomed Anal., 32:11991211 (2003)]. Одним из наиболее эффективных способов получения рекомбинантных белков в Е. coli является способ культивирования с подпиткой, который можно выполнять в циклическом или в нециклическом режиме. Нециклический процесс менее сложный и поэтому более пригоден для промышленного производства. Действительно, в уровне техники описан один из наивысших выходов Г-КСФ в способе культивирования с подпиткой, который находится в диапазоне от 4,2 до 4,4 г/л. [Yim S.C. et al. Bioprocess и Biosystems Engineering, (2001), 24, 249-254]. Выполнение ферментации с подпиткой в циклическом режиме для получения более высокого совокупного выхода приводит к высокой нестабильности плазмиды [ChoiS.-J. et al. J. Microbiol. Biotechnol., 10: 321-326 (2000)], при этом ограничивая устойчивость процесса. Как правило, для того чтобы иметь высокую экспрессию продукта, необходимо поддерживать внехромосомную плазмиду, содержащую ген продукта, внутри клетки в надлежащем состоянии. Как правило, это достигается селекционным воздействием на рекомбинантный микроорганизм путем добавления подходящего антибиотика к культуральной жидкости. Было описано увеличение уровня экспрессии Г-КСФ за счет добавления каждые 1-2 ч антибиотика (ампициллина) во время ферментации для уменьшения "сегрегационной нестабильности" рекомбинантного штамма (Krivopalova G.N. et al.Russian Patent RU 2158303 C2 20001027). Нормативное требование о подтверждении очистки конечного продукта от антибиотика ограничивает его использование. Широкое использование антибиотиков также может с большей вероятностью привести к нежелательному воздействию на окружающую среду. Но уменьшение создаваемого антибиотиками селекционного воздействия часто приводит к уменьшению стабильности плазмиды и уровней экспрессии, что ставит под угрозу устойчивость процесса. Следовательно, ограничение использования антибиотика с увеличением стабильности плазмиды и уровня экспрессии, особенно в фазе образования продукта, представляет собой техническую проблему. Кроме того,низкая стабильность плазмиды в течение фазы образования продукта также может быть обусловлена метаболическим стрессом [Saraswat V. et al. FEMS Microbiol. Lett., 179: 367-373 (1999)] и может приводить к низким уровням экспрессии [Cheng С. et al. Biotechnol. Bioeng. ,56: 23-31 (1997)], обычно в культурах большого объема. Кроме обусловленного антибиотиком селекционного воздействия, стабильность плазмиды может быть улучшена на уровне конструкции вектора [Schweder Т. et al. Appl Microbiol Biotechnol., 38:91-93(1992); Pan S.H. и Malcom B.A. Biotechniques, 29:1234-1238 (2000)]. В процессе культивирования она может быть улучшена подбором условий культивирования, такими как избежание недостатка подачи пита-1 022782 тельных веществ [SmithBidochka Can. J. Microbiol., 44: 351-355 (1998)]. При проведении крупномасштабных ограничиваемых субстратом способов культивирования с подпиткой ограничение/недостаток подачи питательных веществ неизбежны, и добавление антибиотика слишком часто или в больших количествах представляет собой нецелесообразное и затратное решение для обеспечения высокого выхода продукта и высокой стабильности плазмиды в процессе с низкой степенью комплексности. Следовательно, существует очевидная необходимость разработки альтернативного способа получения Г-КСФ с высоким объемным выходом, за счет поддержания высокой стабильности плазмиды, используя простой и устойчивый процесс. Сущность изобретения Настоящее изобретение описывает нециклический способ культивирования с подпиткой для получения гранулоцитарного колониестимулирующего фактора (Г-КСФ) с высоким объемным выходом вEscherichia coli, за счет поддержания высокой стабильности плазмиды в культуре с использованием ионов калия в сочетании с ионами магния или натрия в высоких концентрациях в среде продуцирования и в культуральной жидкости. Краткое описание чертежей На фиг. 1 показано влияние использования высоких концентраций катионов калия и натрия в фазе образования продукта на стабильность плазмиды, содержащей ген Г-КСФ, в клетках BL21 (DE3) в момент сбора партии. Партия 2 получена при высокой концентрации солей калия и натрия, тогда как Партия 1 получена в отсутствии высокой концентрации солей калия или натрия в фазе образования продукта. Партии получены раздельно в 30-л ферментере. На фиг. 2 показано влияние использования высоких концентраций катионов калия и натрия в фазе образования продукта на объемный выход Г-КСФ в полученных партиях. Партия 2 получена при высокой концентрации солей калия и натрия, тогда как Партия 1 получена в отсутствии высокой концентрации солей калия или натрия в фазе образования продукта. Партии получены раздельно в 30-л ферментере. На фиг. 3 показано влияние использования высокой концентрации катионов магния и калия в фазе образования продукта на стабильность плазмиды, содержащей ген Г-КСФ, в клетках BL21(DE3) во время сбора партии. Партия 4 получена при высокой концентрацией соли магния, тогда как для Партии 3 в фазе образования продукта не использовали высокую концентрацию магния. Обе партии получены при высокой концентрация соли калия раздельно в 30-л ферментере. На фиг. 4 показано влияние использования высокой концентрации катионов магния и натрия на объемный выход Г-КСФ в полученных партиях. Партию 4 получали при высокой концентрации соли магния, тогда для Партии 3 не использовали высокую концентрацию соли магния в фазе образования продукта. Обе партии получены при высокой концентрации соли калия раздельно в 30-л ферментере. На фиг. 5 показано влияние использования высокой удельной скорости роста в фазе образования продукта на объемный выход Г-КСФ в собранных партиях. Во время фазы образования продукта средняя удельная скорость роста для Партии 4 составляла приблизительно 0,04 л/ч, тогда как средняя удельная скорость роста для Партии 5 составляла приблизительно 0,07 л/ч. Обе партии получены при высокой концентрации солей калия и магния, раздельно в 30-л ферментере. На фиг. 6 показано влияние использования высокой концентрации тиамина в фазе образования продукта на объемный выход в полученных партиях. Во время фазы образования продукта Партия 1 содержала 7 г/л тиамина в продуцирующей среде, тогда как Партия 6 получена без использования тиамина в среде продуцирования. Обе партии получены раздельно в 30-л ферментере. Описание изобретения Настоящее изобретение относится к улучшенному способу ферментации для производства гранулоцитарного колониестимулирующего фактора (Г-КСФ) с улучшенным уровнем объемного выхода. Оно также раскрывает условия культивирования для улучшенной стабильности плазмиды, что в дальнейшем приводит к высокому объемному выходу Г-КСФ. Способ по изобретению включает нециклический способ культивирования с подпиткой с использованием многократных индукций, выполняемый в присутствии высокой концентрации калия, в сочетании с другими неорганическими солями, такими как натриевые, магниевые и т.п., в высоких концентрациях в продуцирующей среде. Как ни удивительно, когда такой способ, использующий соли по настоящему изобретению, как детально описано здесь, использовали в сочетании с высокой удельной скоростью роста, он все еще поддерживал высокую стабильность плазмиды, ведущую к дополнительному увеличению объемного выхода. Настоящее изобретение дополнительно подробно описано ниже. Можно использовать любой полипептид, относящийся к гранулоцитарному колониестимулирующему фактору (также именуемому здесь "Г-КСФ"). Термин "гранулоцитарный колониестимулирующий фактор" или "Г-КСФ" относится к природному Г-КСФ, белку, появляющемуся в результате мутаций,фрагментам, синтетическим конструкциям, его аналогам и производным или демонстрирующему по меньшей мере 60% биологической или рецепторсвязывающей активности как природного чГ-КСФ или сохраняющему по меньшей мере приблизительно 80% аминокислотной идентичности. Примеры таких последовательностей включают последовательность из Genbank ID GI:27437048 и последовательности,-2 022782 описанные в патенте США 4810643. Клетки Escherichia coli трансформированы подходящим экспрессирующим вектором, содержащим кодирующую последовательность Г-КСФ и подходящий промотор, выбранный из t7, tac и подобных промоторов наряду с другими компонентами вектора, используя способы трансформации, хорошо известные в данной области техники. В описанном ниже способе ферментация относится к анаэробному выращиванию микроорганизмов,предпочтительно рекомбинантных Е. coli, для получения Г-КСФ. В таком способе загрузочная фаза выращивания относится к периоду, в котором после засева в культуральную жидкость в ферментере не добавлено никакое питательное вещество, кроме гидроксида аммония (если требуется). Культуральная жидкость представляет собой суспензию клеток, сред и производных сред и клеток (если таковые имеются). Фаза роста в способе культивирования с подпиткой, ограничиваемом субстратом, относится к той части фазы роста, в которой основное увеличение биомассы (по меньшей мере 2 удвоения) происходит при добавлении среды для выращивания с подпиткой к культуральной жидкости таким образом, что лимитирующей является концентрация основного источника углерода/энергии (например, глюкозы). Расход указанной среды определяет удельную скорость роста культуры. Преиндукционная среда относится к среде с составом, отличным от среды для выращивания, которая добавлена к культуральной жидкости перед добавлением индуктора (например, IPTG). Индукция представляет собой процесс существенного увеличения концентрация Г-КСФ в клетках, как определено средствами, известными из уровня техники,при добавлении индуктора (например, IPTG и лактозы). Среда продуцирования имеет состав, отличный от среды для выращивания, и добавляется к культуральной жидкости в ферментере во время индукции гена Г-КСФ. Среду продуцирования также добавляли таким способом, что концентрация субстрата (например, глюкозы) оставалась ограничивающей. Расход среды продуцирования определяет удельную скорость роста культуры на фазе продуцирования. Клетки-хозяева Е. coli, предварительно трансформированные подходящим вектором экспрессии,кодирующим Г-КСФ, первоначально культивировали при 37C в колбе-качалке, чтобы вырастить посевной материал для ферментера. Культуру посевного материала использовали для засева стерильной среды для выращивания в ферментере. Режим фазы роста ферментации с подпиткой, ограничиваемой субстратом, начинают, как только начинает расти культура рекомбинантных Е. coli и концентрация глюкозы в культуральной жидкости падает до 0,5 г/л или менее. Подача среды для выращивания в процессе с подпиткой, добавляемой в режиме подпитки, ограничиваемой субстратом, поддерживается непрерывной(экспоненциальная или постоянная скорость) или прерывистой во время фазы роста. После достижения плотности клеток 1-60 г/л сухой массы клеток и концентрации глюкозы в культуральной жидкости менее чем 0,5 г/л добавление препродуцирующих сред завершают, а затем начинают и продолжают подачу сред продуцирования непрерывным или прерывистым, ограничиваемым субстратом, образом. Многократные индукции гена Г-КСФ выполняют IPTG. Среднюю удельную скорость роста не уменьшают во время или после добавления индуктора. Значение рН поддерживают приблизительно равным 5-7. Температуру поддерживают приблизительно равной 30-42C. После от 2 до 48 ч добавления препродуцирующей среды среду для культивирования удаляют и подвергают последующей обработке согласно способам, известным в данной области техники. Среда фазы роста содержит источники углерода и энергии, выбранные из группы, включающей глюкозу, глицерин и т.д., и т.п., или их смеси, комплексные компоненты среды выбраны из группы,включающей дрожжевой экстракт, триптон, пептон, продукт ферментативного гидролиза казеина, продукт гидролиза соевого казеина и т.п., или их смеси, подходящие соли/питательные вещества выбраны из группы, включающей лимонную кислоту, хлорид калия, хлорид натрия, сульфат магния, гидрофосфат диаммония, дигидрофосфат калия, бутират натрия, тиамин, глицин и хлорид цинка. Другие условия ферментации, такие как аэрация, перемешивание, посевная культура, время засева и т.д., все выбраны для удобства как известные из уровня техники. Среда препродукции включает комплексные компоненты среды, выбранные из экстракта дрожжей,триптона, пептона, продуктов ферментативного гидролиза казеина, продуктов гидролиза соевого казеина, наряду с питательными веществами, такими как тимин, глицин и т.п. или их смесей; антибиотики,такие как канамицин, и ампициллин и т.п. Подходящие соли выбирают из группы, включающей лимонную кислоту, хлорид калия, хлорид натрия, сульфат магния, гидрофосфат диаммония, дигидрофосфат калия, бутират натрия и хлорид цинка, таким образом, чтобы среда содержала высокий уровень концентрации ионов K в сочетании с ионами или Na, или Mg. Среда продуцирования содержит источник углерода в дополнение к компонентам среды препродукции. Подходящий источник углерода можно выбрать из группы, состоящей из глицерина, глюкозы,фруктозы и т.п. или их смесей. Предпочтительный источник углерода по настоящему изобретению представляет собой глюкозу. Во время фазы продуцирования культуральную жидкость поддерживают с высоким уровнем ионов K в сочетании с ионами или Na или Mg. Концентрацию в культуральной жидкости ионов K поддерживают от приблизительно 60 до приблизительно 300 мМ, ионов Na - от приблизительно 60 до приблизительно 300 мМ, и ионов Mg - от приблизительно 150 до приблизительно 250 мМ. В предпочтительном варианте осуществления концентрация ионов K составляет от 90 до 150 мМ и концентра-3 022782 ция ионов Mg в культуральной жидкости находится в диапазоне от 180 до 220 мМ. В дополнительном варианте осуществления добавление тимина в высокой концентрации (в диапазоне от 5 до 10 г/л) обеспечивает выход Г-КСФ в диапазоне 5-6 г/л. Способ по настоящему изобретению приводит к получению Г-КСФ с высоким выходом (5-9,5 г/л) с поддержанием высокой стабильности плазмиды на всем протяжении фазы роста и продуцирования (7590%). Пример 1. Влияние высокой концентрации ионов Na и K на стабильность плазмиды и объемный выход. Эксперимент выполняли в 30-л ферментере. Посевной материал клеток Е. coli BL21 (DE3), трансформированных с геном Г-КСФ человека, засевали в среду для выращивания следующего состава. Добавление следующей "среды для выращивания способом культивирования с подпиткой" в режиме культивирования лимитируемым субстратом привело к основному увеличению биомассы. В фазе роста гидроксид аммония использовали как регулятор рН для поддержания рН в диапазоне от 6,8 до 7,0. Температуру поддерживали при 37C. После достижения оптической плотности приблизительно 50 ед.погл. (при 600 нм) в Партии 2 в культуральную жидкость добавляли среду преиндукции,состоящую из следующих компонентов. Конечная концентрация катионов калия и натрия в культуральной жидкости составляла приблизительно 120 и 250 мМ соответственно. Затем начинали подачу следующей среды продуцирования. Экспрессию гена Г-КСФ индуцировали многократными добавлениями стерилизованного фильтрованием раствора IPTG к культуральной жидкости. В фазе продуцирования гидроксид аммония использовали как регулятор рН для поддержания рН 6,8. Температуру поддерживали при 37C. Для создания селекционного воздействия к культуре добавляли канамицин. Количество канамицина, использованного во время фазы продуцирования для Партии 2 (37,5 мг, добавлен однократно), составляло приблизительно 1% от количества использованного в Партии 1 (2925 мг, многократные добавления), для того чтобы тщательно проверить влияние солей на стабильность плазмиды. Стабильность плазмиды определяли сначала асептическим отбором образца готовой партии в стерильную пробирку и асептическим распределением подходящего объема соответствующего разведенного образца по среде Луриа-Бертани с канамицином (50 мг/л) и без. Чашки Петри инкубировали при 37C в течение 48 ч, и чашки, имевшие статистически значимые колонии, подвергали учету. Величина, полученная делением количества колоний, полученных на канамицинсодержащих чашках, на количество колоний в чашках, не содержащих канамицин, использовали для того, чтобы вычислить стабильность плазмиды. Стабильность плазмиды в Партии 2 (96,8%) была более чем вдвое выше по сравнению со стабильностью плазмиды в Партии 1 (45,0%), тем самым показывая важность катионов натрия и калия в улучшении стабильности плазмиды (фиг. 1). Объемный выход Г-КСФ, как определено денситометрическим измерением полосы Г-КСФ по сравнению со стандартной кривой аутентичного стандарта после SDS-PAGE, составлял 5,38 г/л в Партии 1 и 5,81 г/л в Партии 2. Объемный выход в Партии 2 был приблизительно на 8% выше, чем в Партии 1 (фиг. 2). Пример 2. Влияние высокой концентрации магния и калия на стабильность плазмиды и объемный выход. Эксперимент выполняли в 30-л ферментере. Так как среды фазы продуцирования обеих партий(Партии 3 и Партии 4) были идентичны, включая концентрации катиона калия, кроме только концентрации катиона магния, результаты отражали влияние сочетания катионов калия и магния. Посевной материал клеток Е. coli BL21 (DE3), трансформированных с геном Г-КСФ человека, засевали в среды для выращивания следующего состава. Добавление следующей "среды для выращивания способом культивирования с подпиткой" в режиме культивирования, лимитируемым субстратом, обусловливало основное увеличение биомассы. В фазе роста гидроксид аммония использовали как регулятор рН для поддержания рН в диапазоне от 6,8 до 7,0. Температура поддерживалась при 37C. После достижения оптической плотности приблизительно 50 ед.погл. (при 600 нм) среду преиндукции, состоящую из следующей смеси, добавляли в Затем начинали подачу следующей среды продуцирования. Экспрессию гена Г-КСФ индуцировали многократными добавлениями к культуральной жидкости стерилизованного фильтрацией IPTG. В фазе продуцирования гидроксид аммония использовали, как регулятор рН, чтобы поддерживать рН 6,8. Температуру поддерживали при 37C. Для того чтобы создать селекционное воздействие, к культуре добавляли канамицин. Равное количество канамицина (37,5 мг,добавлен однократно) использовали в фазе продуцирования. Концентрация в культуральной жидкости катионов калия и магния во время фазы продуцирования составляла приблизительно 120 и 200 мМ соответственно. Стабильность плазмиды определяли, как описано выше. Стабильность плазмиды в Партии 4(97,3%) была приблизительно на 6% выше, чем стабильность плазмиды в Партии 3 (91,8%), таким образом показывая эффективность катионов калия и магния в улучшении устойчивости плазмиды (фиг. 3). Стабильность плазмиды, полученная в присутствии катионов магния и калия, была на 116,2% выше, чем в Партии 1 (в отсутствие высокой концентрации солей в фазе продуцирования). Объемный выход Г-КСФ, как определяли денситометрическим количественным анализом полосы ГКСФ по отношению к стандартной кривой аутентичного стандарта, после SDS-PAGE составил 5,48 г/л в Партии 3 и 8,35 г/л в Партии 4 (фиг. 4). Объемный выход в Партии 4 был на приблизительно 55% выше, чем в Партии 1. Пример 3. Влияние высокой скорости удельного роста во время фазы продуцирования на объемный выход. Эксперимент выполнили в 30-л ферментере. Среды фазы продуцирования обеих партий (Партии 4 и Партии 5) были идентичными, включая концентрации катионов калия и магния. Средняя удельная скорость роста во время фазы продуцирования для Партии 5 была выше, чем в фазе продуцирования для Партии 4. Посевной материал, клетки Е. coli BL21 (DE3), трансформированные с геном Г-КСФ человека,засевали в среды для выращивания следующего состава. Добавление следующей "среды для выращивания способом культивирования с подпиткой" в режиме культивирования, лимитируемым субстратом, обуславливало основное увеличение биомассы. В фазе роста гидроксид аммония использовали как регулятор рН для поддержания рН в диапазоне от 6,8 до 7,0. Температуру поддерживали при 37C. После достижения оптической плотности приблизительно 50 ед.погл. (при 600 нм) в культуральную жидкость добавляли среду преиндукции, имеющую следующий состав. Затем начинали подачу следующей среды продуцирования. Экспрессию гена Г-КСФ индуцировали многократными добавлениями стерилизованного фильтрацией раствора IPTG к культуральной среде. В фазе продуцирования гидроксид аммония использовали как регулятор рН для поддержания рН 6,8. Температуру поддерживали при 37C. Для создания селекционного воздействия к культуре добавляли канамицин. Эквивалентное количество канамицина (37,5 мг, добавлен однократно) использовали во время фазы продуцирования. Средняя удельная скорость роста во время фазы продуцирования в Партии 4 составила приблизительно 0,04 л/ч, тогда как в Партии 5 составила приблизительно 0,07 л/ч. Объемный выход Г-КСФ, определенный как описано ранее, составил 8,35 г/л в Партии 4 и 9,94 г/л в Партии 5. Объемный выход в Партии 5 был примерно на 19% выше, чем выход в Партии 4 (фиг. 5). Стабильность плазмиды в образцах, взятых в конце процесса из обеих партий, была высокой (75%). Пример 4. Влияние использования высокой концентрации тиамина в фазе продуцирования на объемный выход. Эксперимент выполняли в 30-л ферментере. Посевную культуру клеток Е. coli BL21 (DE3), трансформированных геном Г-КСФ человека, засевали в среду для выращивания следующего состава. Добавление следующей "среды для выращивания способом культивирования с подпиткой" в режиме культивирования, лимитируемым субстратом, обуславливало основное увеличение биомассы. В фазе роста гидроксид аммония использовали как регулятор рН для поддержания рН приблизительно 6,8. Температуру поддерживали при 37C. После достижения оптической плотности приблизительно 50 ед.погл. (при 600 нм) начинали подачу следующей среды продуцирования. Экспрессию гена Г-КСФ индуцировали многократными добавлениями стерилизованного фильтрацией раствора IPTG к культуральной среде. В фазе продуцирования гидроксид аммония использовали как регулятор рН, чтобы поддерживать рН 6,8. Температуру поддерживали при 37C. Объемный выход Г-КСФ определяли, как описано выше. Объемный выход в Партии 1 в образце, взятом в конце процесса (партия с высокой концентрацией тиамина), был на приблизительно 10,7% выше, чем выход в Партии 6 (4,86 г/л), таким образом, показывая эффективность высокой концентрации тиамина в улучшении объемного выхода Г-КСФ (фиг. 6).(1) Более высокий объемный выход делает возможным больший выход при меньшем масштабе, ограничивая таким образом капитальные расходы на увеличение масштаба.(2) Высокий объемный выход достигнут, используя компоненты сред (магний, калий и соли магния) с очень низкой стоимостью.(3) Культура, обладающая высокой стабильностью плазмиды, более способна для увеличения объемного выхода Г-КСФ в метаболически напряженных условиях, таких как экспрессия гена Г-КСФ в условиях высокой удельной скорости роста. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения гранулоцитарного колониестимулирующего фактора (Г-КСФ) с высоким объемным выходом (5,8-8,3 г/л) при нециклическом культивировании с подпиткой бактериальных клеток,трансформированных плазмидой со встроенным геном Г-КСФ человека, в среде, содержащей 5-10 г/л тиамина, 60-180 мМ ионов калия, а также 60-300 мМ ионов натрия или 150-250 мМ ионов магния, где выращивание и увеличение биомассы указанных клеток осуществляют до достижения оптической плотности среды приблизительно в 50 единиц (при длине волны 600 нм), после чего добавляют изопропилтиогалактозид (IPTG), индуцирующий экспрессию и продуцирование Г-КСФ. 2. Способ по п.1, где культуральная жидкость дополнительно включает культивируемую в культуральной жидкости клетку-хозяин, содержащую плазмиду, которая кодирует Г-КСФ. 3. Способ по п.2, где клетка-хозяин представляет собой Е. coli.
МПК / Метки
МПК: C12N 15/68, C07K 14/535, C12N 1/21, C12N 15/67
Метки: человека, получения, г-ксф, способ
Код ссылки
<a href="https://eas.patents.su/11-22782-sposob-polucheniya-g-ksf-cheloveka.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения г-ксф человека</a>
Предыдущий патент: Гербицидная суспензия, способ ее получения, гербицидное средство и применение гербицидной суспензии и гербицидного средства для борьбы с ростом нежелательных растений
Следующий патент: Применение аналогов розувастатина для лечения болезненных состояний, которые поддаются лечению путем ингибирования hmg-coa редуктазы
Случайный патент: Промежуточное соединение для использования в синтезе доцетаксела и способ его получения