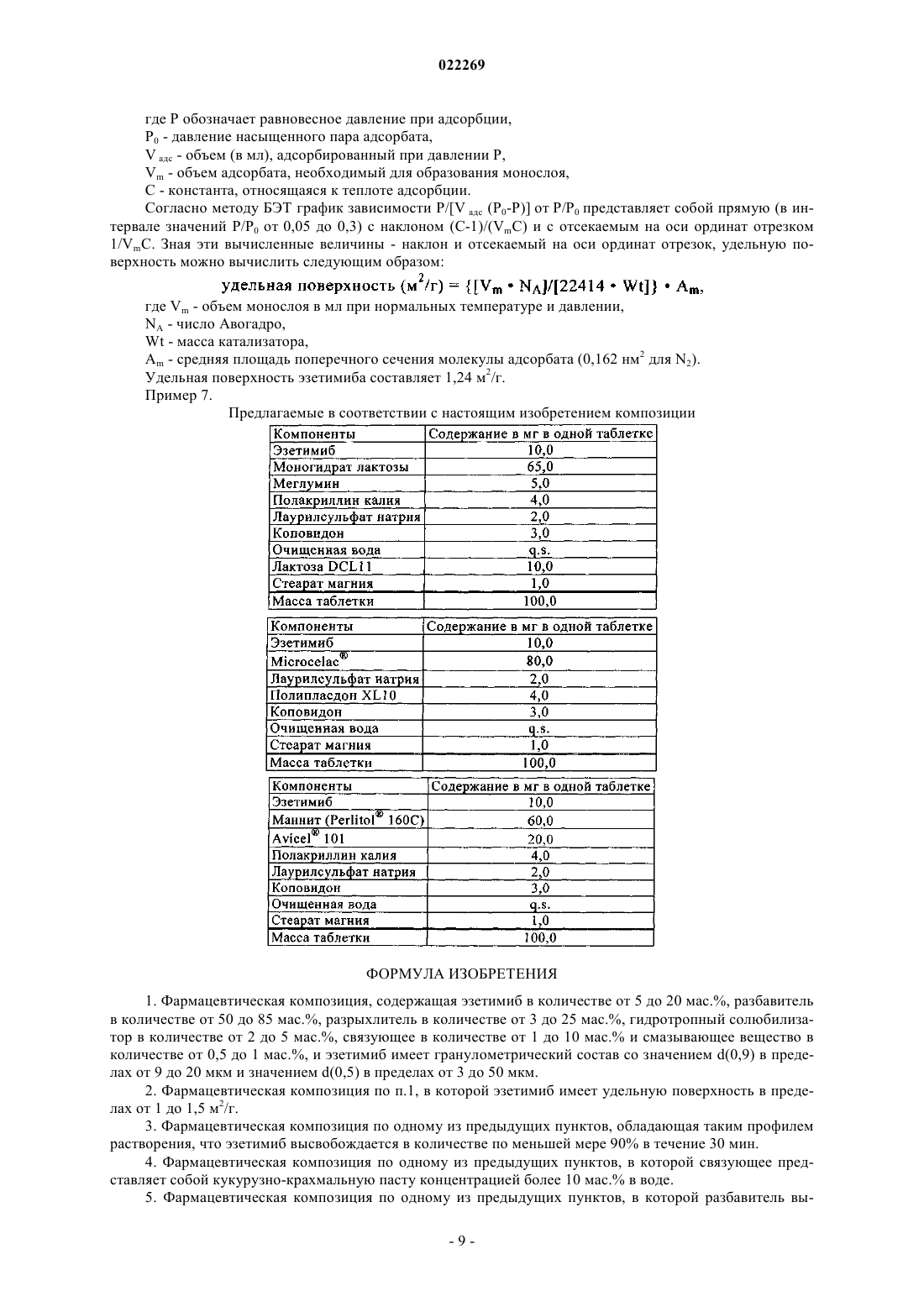
Фармацевтическая композиция, содержащая эзетимиб
Номер патента: 22269
Опубликовано: 30.12.2015
Авторы: Хуссаин Джавед, Гат Ганеш, Джиридхара-Рао Пасупулети
Формула / Реферат
1. Фармацевтическая композиция, содержащая эзетимиб в количестве от 5 до 20 мас.%, разбавитель в количестве от 50 до 85 мас.%, разрыхлитель в количестве от 3 до 25 мас.%, гидротропный солюбилизатор в количестве от 2 до 5 мас.%, связующее в количестве от 1 до 10 мас.% и смазывающее вещество в количестве от 0,5 до 1 мас.%, и эзетимиб имеет гранулометрический состав со значением d(0,9) в пределах от 9 до 20 мкм и значением d(0,5) в пределах от 3 до 50 мкм.
2. Фармацевтическая композиция по п.1, в которой эзетимиб имеет удельную поверхность в пределах от 1 до 1,5 м2/г.
3. Фармацевтическая композиция по одному из предыдущих пунктов, обладающая таким профилем растворения, что эзетимиб высвобождается в количестве по меньшей мере 90% в течение 30 мин.
4. Фармацевтическая композиция по одному из предыдущих пунктов, в которой связующее представляет собой кукурузно-крахмальную пасту концентрацией более 10 мас.% в воде.
5. Фармацевтическая композиция по одному из предыдущих пунктов, в которой разбавитель выбран из группы, включающей моногидрат лактозы, лактозу распылительной сушки, маннит, микрокристаллическую целлюлозу и их комбинации.
6. Фармацевтическая композиция по одному из предыдущих пунктов, в которой разрыхлитель выбран из группы, включающей кукурузный крахмал, поливинилполипирролидон, полакриллин калия и их комбинации.
7. Фармацевтическая композиция по одному из предыдущих пунктов, в которой связующее представляет собой кукурузно-крахмальную пасту и/или коповидон.
8. Фармацевтическая композиция по одному из предыдущих пунктов, в которой смазывающее вещество представляет собой стеарат магния.
9. Фармацевтическая композиция по одному из предыдущих пунктов, в которой гидротропный солюбилизатор выбран из группы, включающей меглумин, лаурилсульфат натрия и их комбинации.
10. Фармацевтическая композиция по одному из предыдущих пунктов, которая представляет собой таблетку с твердостью в пределах от 20 до 70 Н.
11. Фармацевтическая композиция по одному из предыдущих пунктов, время распада которой составляет менее 120 с.
12. Фармацевтическая композиция по одному из предыдущих пунктов, содержащая эзетимиб в количестве 10 мас.%, моногидрат лактозы в количестве 71 мас.%, кукурузный крахмал в количестве 13 мас.%, кукурузно-крахмальную пасту в количестве 5 мас.% и стеарат магния в количестве 1 мас.%.
13. Способ приготовления фармацевтической композиции, содержащей эзетимиб, заключающийся в том, что
а) подготавливают эзетимиб, имеющий гранулометрический состав и удельную поверхность, указанные в одном из пп.1-2,
б) приготавливают смесь, содержащую эзетимиб и одно или несколько фармацевтически приемлемых вспомогательных веществ, в качестве которых используют разбавитель в количестве от 50 до 85 мас.%, разрыхлитель в количестве от 3 до 25 мас.%, гидротропный солюбилизатор в количестве от 2 до 5 мас.%, связующее в количестве от 1 до 10 мас.% и смазывающее вещество в количестве от 0,5 до 1 мас.%, и
в) смесь перерабатывают в композицию.
14. Способ по п.13, заключающийся в том, что дополнительно (г) смесь гранулируют.
15. Применение эзетимиба с указанными в одном из пп.1-2 характеристиками для приготовления медикамента с профилем растворения, указанным в п.3.
16. Применение кукурузно-крахмальной пасты с содержанием кукурузного крахмала по меньшей мере 11 мас.% для приготовления фармацевтической композиции по п.1.
Текст
В патенте описана фармацевтическая композиция, содержащая в качестве действующего вещества эзетимиб в количестве от 5 до 20 мас.%, разбавитель в количестве от 50 до 85 мас.%, разрыхлитель в количестве от 3 до 25 мас.%, гидротропный солюбилизатор в количестве от 2 до 5 мас.%,связующее в количестве от 1 до 10 мас.% и смазывающее вещество в количестве от 0,5 до 1 мас.%, причем эзетимиб имеет гранулометрический состав со значением d(0,9) в пределах от 9 до 20 мкм и значением d(0,5) в пределах от 3 до 50 мкм. Дополнительно заявка относится к способу приготовления фармацевтической композиции в соответствии с настоящим изобретением, а также к применению эзетимиба с указанными характеристиками гранулометрического состава для приготовления медикамента. В том числе настоящая заявка относится к применению кукурузнокрахмальной пасты с содержанием кукурузного крахмала по меньшей мере 11 мас.% для приготовления фармацевтической композиции в соответствии с настоящим изобретением. Область техники, к которой относится изобретение Изобретение относится к новым композициям, содержащим эзетимиб в качестве действующего вещества. Предпосылки создания изобретения Соединение эзетимиб относится к классу гиполидемических средств, которые избирательно подавляют всасывание холестерина и родственных фитостеринов в кишечнике. Согласно имеющимся в литературе данным эзетимиб обладает механизмом действия, отличным от механизма действия гипохолестеринемических средств других классов, таких как ингибиторы ГМГKoA-редуктазы, средства, усиливающие экскрецию жлчной кислоты (смолы), производные фиброевой кислоты и растительные станолы. По данным литературных источников эзетимиб не ингибирует синтез холестерина в печени или не усиливает экскрецию жлчной кислоты. Более того, было установлено, что эзетимиб локализуется и проявляет свое действие в щеточной каемке эпителия тонкой кишки и препятствует всасыванию холестерина, уменьшая тем самым поступление холестерина из кишечника в печень. В результате этого снижаются запасы холестерина в печени и увеличивается выведение холестерина из крови. Подобный механизм действия дополняет механизм действия ингибиторов ГМГ-KoA-редуктазы. В США эзетимиб поступает в продажу под товарным знаком Zetia в таблетках для приема внутрь,которые помимо эзетимиба, количество которого в одной таблетке составляет 10 мг, содержат также следующие неактивные компоненты: натриевую соль кроскармеллозы NF, моногидрат лактозы NF, стеарат магния NF, микрокристаллическую целлюлозу NF, повидон USP и лаурилсульфат натрия NF. В WO 2006/060808 А 1 описаны полиморфы эзетимиба и способы их получения. В указанной публикации описаны, в частности, способы получения кристаллических форм эзетимиба, таких как его форма А или форма В, осаждением эзетимиба из определенных растворителей. Частицы микронизированного эзетимиба, описанные в WO 2006/060808, имеют небольшие размеры и высокую удельную поверхность. В ЕР 1353696 В 1 описана конкретная композиция, содержащая эзетимиб в количестве 10%, моногидрат лактозы в количестве 55%, микрокристаллическую целлюлозу NF в количестве 20%, повидонUSP в количестве 4%, натриевую соль кроскармеллозы NF в количестве 8%, лаурилсульфат натрия в количестве 2% и стеарат магния в количестве 1%. Такая композиция, описанная в ЕР 1353696 В 1, не содержит крахмал и не содержит крахмальную пасту. В WO 95/08532 А 1 и WO 95/35277 А 1 описаны замещенные азетидиноновые соединения, пригодные для применения в качестве гипохолестеринемических средств. В обеих указанных публикациях описана композиция, содержащая действующее вещество, лактозу, кукурузный крахмал в виде 10%-ной пасты в очищенной воде, кукурузный крахмал и стеарат магния. Однако содержание действующего вещества в композициях, описанных в указанных публикациях, превышает 30 мас.%, а концентрация лактозы составляет менее 50%. В данной области сохраняется потребность в содержащих эзетимиб фармацевтических композициях, которые обладали бы достаточно высокой скоростью растворения и необязательно обладали бы способностью к быстрому распаду. В соответствии с этим задача изобретения состояла в том, чтобы предложить содержащие эзетимиб композиции с подобными предпочтительными свойствами. Краткое изложение сущности изобретения В настоящем изобретении предлагается фармацевтическая композиция, содержащая эзетимиб в количестве от 5 до 20 мас.%, разбавитель в количестве от 50 до 85 мас.%, разрыхлитель в количестве от 3 до 25 мас.%, гидротропный солюбилизатор в количестве от 2 до 5 мас.%, связующее в количестве от 1 до 10 мас.% и смазывающее вещество в количестве от 0,5 до 1 мас.% и отличающаяся тем, что эзетимиб имеет гранулометрический состав со значением d(0,9) в пределах от 9 до 20 мкм и значением d(0,5) в пределах от 3 до 50 мкм. В предпочтительном варианте эзетимиб имеет удельную поверхность в пределах то 1 до 1,5 м 2/г. Еще одним объектом изобретения является способ приготовления медикамента, заключающийся в том, что а) подготавливают эзетимиб, имеющий гранулометрический состав со значением d(0,9) в пределах от 9 до 20 мкм и значением d(0,5) в пределах от 3 до 50 мкм и необязательно имеющий удельную поверхность менее 5 м 2/г,б) приготавливают смесь, содержащую эзетимиб с указанными характеристиками и одно или несколько фармацевтически приемлемых вспомогательных веществ,в) смесь необязательно гранулируют и г) смесь перерабатывают в композицию (лекарственную форму), предпочтительно в таблетку,где фармацевтически приемлемые вспомогательные вещества представляют собой разбавитель в количестве от 50 до 85 мас.%, разрыхлитель в количестве от 3 до 25 мас.%, гидротропный солюбилизатор в количестве от 2 до 5 мас.%, связующее в количестве от 1 до 10 мас.% и смазывающее вещество в количестве от 0,5 до 1 мас.%. Объектом настоящего изобретения является также применение эзетимиба с описанными выше характеристиками для приготовления медикамента, обладающего таким профилем растворения, что при его определении описанным в WO 95/08532 методом эзетимиб высвобождается в количестве по меньшей мере 90% в течение 30 мин. Следующим объектом раскрытия является применение эзетимиба для приготовления вышеуказанного медикамента. Еще одним объектом раскрытия является применение кукурузного крахмала и кукурузно-крахмальной пасты для приготовления содержащего эзетимиб медикамента, при растворении которого действующее вещество высвобождается в количестве по меньшей мере 90% в течение 30 мин. Подробное описание изобретения Химическое название эзетимиба звучит как 1-(4-фторфенил)-3(R)-[3-(4-фторфенил)-3(S)-гидроксипропил]-4(S)-(4-гидроксифенил)-2-азетидинон. Это соединение имеет следующую структурную формулу: В понятие "эзетимиб", используемое в описании настоящего изобретения, включены любые фармацевтически приемлемые соли и сольваты вышеуказанного соединения. Согласно настоящему изобретению эзетимиб характеризуется особым гранулометрическим составом. Частицы эзетимиба, используемого для приготовления предлагаемой в изобретении фармацевтической композиции и/или присутствующего в ней, имеют значение d(0,9) по меньшей мере 9 мкм, наиболее предпочтительно по меньшей мере 10 мкм. Верхний предел величины d(0,9) составляет 20 мкм. Значениеd(0,5) преимущественно составляет по меньшей мере 3 мкм, предпочтительно по меньшей мере 4 мкм,более предпочтительно по меньшей мере 5 мкм, наиболее предпочтительно по меньшей мере 6 мкм. Верхний предел величины d(0,5) обычно составляет 50 мкм, предпочтительно 20 мкм, более предпочтительно 15 мкм, наиболее предпочтительно 10 мкм. Интервал значений d(0,9) составляет от 9 до 20 мкм. Предпочтительный интервал значений d(0,5) составляет, например от 3 до 20 мкм, более предпочтительно от 4 до 10 мкм. Другие возможные интервалы значений d(0,5) составляют от 4 до 50 мкм, от 5 до 50 мкм и от 6 до 15 мкм. В предпочтительном варианте эзетимиб, применяемый согласно настоящему изобретению, имеет гранулометрический состав со значением d(0,9) в пределах от 9 до 20 мкм и со значением d(0,5) в пределах от 4 до 10 мкм. Величины "d(0,9)" и "d(0,5)" согласно настоящему изобретению означают, что 90%, соответственно 50% частиц от всего их количества имеют размер меньше указанного. Размеры частиц можно определять любым широко известным методом. В качестве примера таких методов, которые можно использовать для определения размеров частиц, можно назвать ситовой анализ,седиментационный анализ, кондуктометрический (электрозонный) метод дисперсионного анализа (метод, основанный на использовании счетчика Культера), микроскопию и малоугловую лазерную дифрактометрию. Предпочтительным согласно настоящему изобретению методом дисперсионного анализа является лазерная дифрактометрия или микроскопия. Наиболее предпочтительны методы, используемые в примерах, приведенных ниже в настоящем описании, например, "мокрый метод дисперсионного анализа", описанный в примере 56). Частицы применяемого согласно изобретению эзетимиба в предпочтительном варианте имеют удельную поверхность менее 5 м 2/г, более предпочтительно менее 4 м 2/г, особенно предпочтительно менее 3 м 2/г. Удельная поверхность частиц применяемого согласно изобретению эзетимиба составляет от 1 до 1,5 м 2/г. Удельную поверхность определяют, используя прибор Культера и производя вычисления по уравнению Брунауэра-Эммета-Теллера (БЭТ). Одно из преимуществ предлагаемой в настоящем изобретении фармацевтической композиции состоит в наличии у нее оптимального профиля растворения. Профиль растворения предпочтительно определять методом, описанным ниже в примере 2, т.е. с использованием стандартного оборудования согласно Фармакопее США (USP) в 500 мл 1%-ного раствора лаурилсульфата натрия в фосфатном буфере с рН 4,5 при 50 об/мин. В другом варианте профиль растворения можно определять методом, описанным вWO 95/08532. В предпочтительном варианте эзетимиб в течение 30 мин высвобождается in vitro из предлагаемой в изобретении фармацевтической композиции в количестве по меньшей мере 80%, более предпочтительно по меньшей мере 90%, особенно предпочтительно по меньшей мере 95%, наиболее предпочтительно по меньшей мере 99%, от всего его содержащегося в фармацевтической композиции количества. Предлагаемая в настоящем изобретении фармацевтическая композиция может далее обладать оптимальными свойствами ее распада. Так, например, время распада композиции (предпочтительно в виде таблетки) может составлять менее 180 с, предпочтительно менее 120 с, наиболее предпочтительно менее 60 с, например, от 30 до 60 с. Предлагаемая в настоящем изобретении фармацевтическая композиция может представлять собой таблетку. Такая таблетка может иметь твердость от примерно 15 до примерно 70 Н, предпочтительно от примерно 20 до примерно 50 Н, более предпочтительно от примерно 20 до примерно 40 Н, особенно предпочтительно от примерно 25 до примерно 45 Н, наиболее предпочтительно от примерно 35 до примерно 45 Н. Предлагаемые в настоящем изобретении фармацевтические композиции можно при необходимости смешивать с другими формами эзетимиба и/или с другими действующими веществами, такими как ингибиторы ГМГ-КоА-редуктазы. Помимо этого предлагаемые в настоящем изобретении фармацевтические композиции могут содержать неактивные компоненты, такие как разбавители, носители, наполнители,увеличивающие объем добавки, связующие, разрыхлители, ингибиторы распада, ускорители всасывания,смачиватели, смазывающие вещества, скользящие вещества, поверхностно-активные вещества, ароматизаторы, гидротропные солюбилизаторы и другие. В состав предлагаемых в настоящем изобретении фармацевтических композиций можно далее включать один или несколько фармацевтически приемлемых носителей, одно или несколько вспомогательных веществ и/или одну или несколько добавок. Содержание вспомогательного вещества или добавки может составлять от примерно 10 до примерно 95 мас.%,предпочтительно от примерно 80 до примерно 95 мас.%, в пересчете на всю массу композиции или терапевтической комбинации. Очевидно, что количество носителя(-ей), вспомогательных веществ и добавок может варьироваться. Предлагаемая в изобретении фармацевтическая композиция содержит от 50 до 85 мас.%, предпочтительно от примерно 50 до примерно 75 мас.% разбавителя. Разбавители увеличивают объем твердой фармацевтической композиции и позволяют упростить для пациента и ухаживающего за больными персонала обращение с лекарственной дозированной формой, содержащей такую композицию. К числу разбавителей относятся производные целлюлозы, производные сахаров, производные крахмала, фосфат кальция, оксиды, карбонаты, сульфаты и хлориды магния, кальция или натрия и другие. В качестве примера конкретных разбавителей для твердых композиций (лекарственных форм) можно назвать микрокристаллическую целлюлозу (в частности Avicel), Microcelac (смесь из 75% моногидрата лактозы и 25% микрокристаллической целлюлозы), высокодисперсную целлюлозу, лактозу, крахмал, предварительно желатинизированный крахмал, карбонат кальция, сульфат кальция, сахар, декстраты, декстрин,декстрозу, дигидрат двухосновного фосфата кальция, трехосновный фосфат кальция, каолин, моногидрат лактозы, карбонат магния, оксид магния, мальтодекстрин, маннит, полиметакрилаты (в частности Eudragit), хлорид калия, порошковую целлюлозу, лактозу распылительной сушки, хлорид натрия, сорбит и тальк. К пригодным для применения в фармацевтических композициях носителям относятся (но не ограничиваясь только ими) лактоза, белый (очищенный) сахар, хлорид натрия, глюкоза, мочевина, крахмал,карбонат кальция, каолин, кристаллическая целлюлоза, кремниевая кислота и другие. Предлагаемая в изобретении фармацевтическая композиция содержит от 1 до 10 мас.%, предпочтительно от 2 до 8 мас.% связующего. Связующие способствуют скреплению между собой действующего вещества и иных вспомогательных веществ после прессования. К числу связующих относятся производные целлюлозы, производные сахара, производные крахмала, желатин, гуаровая камедь, алюмосиликат магния, альгинат натрия, стеариновая кислота, гидрофильные или гидрофобные полимеры и другие. В качестве примера конкретных связующих для твердых фармацевтических композиций можно назвать аравийскую камедь, альгиновую кислоту, карбомер (в частности карбопол), натриевую соль карбоксиметилцеллюлозы, коповидон (Plasdone S-630), декстрин, этилцеллюлозу, желатин, гуаровую камедь, гидрогенизированное растительное масло, гидроксиэтилцеллюлозу, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, жидкую глюкозу, алюмосиликат магния, мальтодекстрин, метилцеллюлозу, полиметакрилаты, поливинилпирролидон (ПВП), предварительно желатинизированный крахмал, альгинат натрия и крахмал. Предлагаемая в изобретении фармацевтическая композиция содержит от 3 до 25 мас.%, предпочтительно от примерно 5 до примерно 20 мас.%, разрыхлителя. Разрыхлители позволяют повысить распадаемость. К числу разрыхлителей относятся производные целлюлозы, гидрофильные полимеры, фосфат кальция, альгиновая кислота, коллоидный диоксид кремния, крахмал, натрийкрахмалгликолят, алюмосиликаты, гуаровая камедь и другие. В качестве примера конкретных разрыхлителей можно назвать альгиновую кислоту, кальциевую соль карбоксиметилцеллюлозы, натриевую соль карбоксиметилцеллюлозы,коллоидный диоксид кремния, натриевую соль кроскармеллозы, кросповидон, гуаровую камедь, алюмосиликат магния, метилцеллюлозу, микрокристаллическую целлюлозу, полакриллин калия, поливинилполипирролидон (ПВПП, сшитый поливинилпирролидон, Polyplasdon XL 10), порошковую целлюлозу,предварительно желатинизированный крахмал, альгинат натрия, натрийкрахмалгликолят и крахмал. Предлагаемая в изобретении фармацевтическая композиция содержит от 2 до 5 мас.% гидротропного солюбилизатора. Гидротропные солюбилизаторы повышают растворимость эзетимиба. К числу гидротропных солюбилизаторов относятся (но не ограничиваясь только ими) лаурилсульфат натрия, подщелачивающие вещества, такие как меглумин (D-(-)-N-[-метилглюкамин) и другие. В качестве примера ингибиторов распада можно назвать (но не ограничиваясь только ими) белый(очищенный) сахар, стеарин, кокосовое масло, гидрогенизированные масла и другие. В качестве примера ускорителей всасывания можно назвать (но не ограничиваясь только ими) четвертичное аммониевое основание и другие. В качестве примера смачивателей можно назвать (но не ограничиваясь только ими) глицерин,крахмал и другие. К пригодным для применения адсорбентам относятся (но не ограничиваясь только ими) крахмал,лактоза, каолин, бентонит, коллоидная кремниевая кислота и другие. Предлагаемая в изобретении фармацевтическая композиция содержит от 0,5 до 1 мас.% смазывающего вещества. Смазывающее вещество (антиадгезив) можно добавлять в композицию для уменьшения адгезии получаемого из нее продукта к пуансону или матрице и для легкого отделения продукта от пуансона или матрицы в процессе таблетирования. К числу смазывающих веществ относятся производные глицерила, масла, стеарилфумарат натрия или магния, стеариновая кислота, стеарат кальция или магния,тальк и другие. В качестве примера конкретных смазывающих веществ можно назвать стеарат магния,стеарат кальция, глицерилмоностеарат, глицерилпальмитостеарат, гидрогенизированное касторовое масло, гидрогенизированное растительное масло, минеральное масло, полиэтиленгликоль, бензоат натрия,стеарилфумарат натрия, стеариновую кислоту, тальк и стеарат цинка. Скользящие вещества (средства против слипания) можно добавлять для улучшения сыпучести неуплотненной (непрессованной) твердой композиции и для повышения точности дозирования. В качестве примера вспомогательных веществ, которые могут выполнять функцию скользящих веществ, можно назвать коллоидный диоксид кремния,трисиликат магния, порошковую целлюлозу, крахмал, тальк и трехосновный фосфат кальция. Ароматизаторы и улучшители вкуса (корригенты) придают лекарственной форме более приятные для пациента вкус и запах. К числу широко используемых в фармацевтических продуктах ароматизаторов и улучшителей вкуса, которые можно включать в состав предлагаемой в настоящем изобретении композиции, относятся, например, мальтол, ванилин, этилванилин, ментол, лимонная кислота, фумаровая кислота, этилмальтол и винная кислота. Таблетки можно далее снабжать покрытиями из общеизвестных материалов, например, изготавливать в виде таблеток с сахарным покрытием, таблеток с желатиновым пленочным покрытием, таблеток с энтеросолюбильным покрытием, таблеток с пленочными покрытиями, двухслойных таблеток и многослойных таблеток. Капсулы могут быть изготовлены, например, из желатина и необязательно могут содержать пластификатор, такой как глицерин или сорбит, и вещество, делающее капсулу непрозрачной,или краситель. Твердым и жидким композициям можно также придавать ту или иную окраску с целью улучшения их внешнего вида и/или с целью облегчить для пациента идентификацию продукта и разовой дозы, для чего можно использовать любой фармацевтически приемлемый краситель. В предлагаемых в настоящем изобретении жидких фармацевтических композициях представленные в настоящем описании формы эзетимиба и любые иные твердые компоненты присутствуют в виде, растворенном или суспендированном в жидком носителе, таком как вода, растительное масло, спирт, полиэтиленгликоль, пропиленгликоль или глицерин. Жидкие фармацевтические композиции могут содержать эмульгаторы, назначение которых состоит в обеспечении однородного распределения действующего вещества или иного вспомогательного вещества, которое не растворимо в жидком носителе, в объеме композиции. В качестве примера эмульгаторов, пригодных для применения в предлагаемых в настоящем изобретении жидких композициях, можно назвать желатин, яичный желток, казеин, холестерин, аравийскую камедь, трагакант, каррагинан из водоросли рода хондрус, пектин, метилцеллюлозу, карбомер, цетостеариловый спирт и цетиловый спирт. Предлагаемые в настоящем изобретении жидкие фармацевтические композиции могут также содержать загустители для улучшения создаваемого продуктом ощущения во рту и/или для обволакивания выстилки желудочно-кишечного тракта. В качестве примера таких загустителей можно назвать аравийскую камедь, альгиновую кислоту, бентонит, карбомер, кальциевую или натриевую соль карбоксиметилцеллюлозы, цетостеариловый спирт, метилцеллюлозу, этилцеллюлозу, желатин, гуаровую камедь,гидроксиэтилцеллюлозу, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, мальтодекстрин,поливиниловый спирт, повидон, пропиленкарбонат, пропиленгликольальгинат, альгинат натрия, натрийкрахмалгликолят, крахмал, трагакант и ксантановую камедь. Для улучшения вкуса композиции к ней можно добавлять подслащивающие вещества, такие как сорбит, сахарин, натриевая соль сахарина, сахароза, аспартам, фруктоза, маннит и инвертный сахар. Для повышении стойкости композиции при хранении к ней можно добавлять в безопасных количествах консерванты и хелатообразователи, такие как спирт, бензоат натрия, бутилированный гидрокситолуол, бутилированный гидроксианизол и этилендиаминтетрауксусная кислота. Предлагаемая в настоящем изобретении жидкая композиция может также содержать буфер, такой как глюконовая кислота, молочная кислота, лимонная кислота, уксусная кислота, глюконат натрия, лактат натрия, цитрат натрия или ацетат натрия. Композицию для таблетирования или для заполнения капсул можно приготавливать мокрым гранулированием. При мокром гранулировании некоторые или все действующие вещества и вспомогательные вещества в порошковой форме смешивают между собой и затем перемешивают в присутствии жидкости,обычно воды, которая вызывает комкование порошков с образованием гранул. Образовавшийся гранулят просеивают и/или размалывают, сушат и затем вновь просеивают и/или размалывают до частиц требуемого размера. После этого гранулят можно таблетировать либо добавлять к нему до таблетирования другие вспомогательные вещества, такие как скользящее вещество и/или смазывающее вещество. Композицию для таблетирования можно также приготавливать обычным путем - сухим смешением. Так, например, смесь из действующих веществ и вспомогательных веществ можно уплотнять или спрессовывать в заготовку в виде бруска или листа и затем измельчать ее с получением спрессованных гранул. Такие спрессованные гранулы можно затем прессованием перерабатывать в таблетки. Вместо сухого гранулирования смесь из действующих веществ и вспомогательных веществ можно методами прямого прессования непосредственно перерабатывать прессованием в прессованные лекарственные формы. Технология прямого прессования позволяет получать более однородные таблетки без гранул. К числу вспомогательных веществ, наиболее пригодных для таблетирования путем прямого прессования, относятся микрокристаллическая целлюлоза, лактоза распылительной сушки, дигидрат дикальцийфосфата и коллоидный диоксид кремния. Соответствующее применение этих и других вспомогательных веществ в процессах таблетирования путем прямого прессования известно специалистам, обладающим необходимыми опытом и квалификацией прежде всего в области приготовления лекарственных форм таблетированием путем прямого прессования. Содержимое предлагаемых в настоящем изобретении капсул может представлять собой или содержать любую из указанных выше смесей и любой из указанных выше гранулятов, рассмотренных в описании процесса таблетирования, но не подвергнутых заключительной стадии таблетирования. Особым объектом настоящего изобретения является способ приготовления предлагаемой в изобретении фармацевтической композиции, заключающийся в том, что кукурузный крахмал диспергируют в холодной воде (с температурой, например, 5-20 С), смесь нагревают с образованием пасты, смесь охлаждают до температуры примерно 40-60 С (например, до температуры 50 С) с получением первой композиции, эзетимиб смешивают с моногидратом лактозы и кукурузным крахмалом с получением второй композиции, первую композицию гранулируют совместно со второй композицией, гранулы при необходимости просеивают и/или размалывают, гранулы сушат, высушенные гранулы при необходимости просеивают через сито с приемлемым размером ячеек, полученную смесь смешивают со стеаратом магния и смесь перерабатывают прессованием на приемлемой таблетировочной машине в таблетки требуемых размеров и массы либо расфасовывают в приемлемые капсулы. При приготовлении композиции, содержащей крахмальную пасту, 1 часть кукурузного крахмала можно диспергировать в примерно 1-20 частях холодной воды, предпочтительно в примерно 2-10 частях холодной воды, более предпочтительно в примерно 3-8 частях холодной воды, наиболее предпочтительно в примерно 4-6 частях холодной воды, например, в примерно 5 частях холодной воды. При создании изобретения было установлено, что характеристики растворения улучшаются при использовании менее 10 частей холодной воды для приготовления кукурузно-крахмальной пасты. В соответствии с этим еще одним объектом настоящего изобретения является применение кукурузно-крахмальной пасты для приготовления предлагаемой в изобретении фармацевтической композиции,при этом указанная кукурузно-крахмальная паста имеет концентрацию более 10 мас.%, предпочтительно в воде. В предпочтительном варианте концентрация кукурузного крахмала в пасте составляет от 11 до 30 мас.%, более предпочтительно от 15 до 20 мас.%, наиболее предпочтительно от 16 до 18 мас.%. Предлагаемые в изобретении композиции можно в терапевтически эффективном количестве вводить в организм нуждающегося в соответствующем лечении млекопитающего для лечения одного или нескольких патологических состояний, например, сосудистых заболеваний, таких как атеросклероз, гиперлипидемии (включая, но не ограничиваясь только ими, гиперхолестеринемию, гипертриглицеридемию, ситостеролемию), воспаления сосудов (васкулита), апоплексического удара, диабета, ожирения и/или для снижения уровня стерина(-ов) в плазме крови. Композиции и терапевтические комбинации можно вводить в организм любым приемлемым методом, обеспечивающим контакт действующих веществ с местом их воздействия в организме, например, в плазме крови, печени или тонкой кишке млекопитающего, в том числе человека. Предлагаемые в настоящем изобретении композиции можно применять в виде любой обычной лекарственной формы, предпочтительно в виде лекарственной формы для приема внутрь, такой как капсула, таблетка, порошок, облатка, суспензия или раствор. Лекарственные формы и фармацевтические композиции можно приготавливать традиционными, принятыми в фармацевтике методами. Некоторые примеры приготовления лекарственных форм приведены ниже. Фармацевтические композиции можно выпускать и применять в виде, например, таблеток, пилюль, порошков, жидкостей, суспензий, эмульсий,гранул, капсул, суппозиториев, препаратов для инъекций (растворов и суспензий) и других лекарственных форм. Назначаемая доза фармацевтической композиции для снижения уровня холестерина согласно настоящему изобретению зависит от пути ее введения в организм, а также от возраста, пола, веса и общего состояния здоровья пациента. Обычно содержание эзетимиба в дозированной лекарственной форме мо-5 022269 жет составлять от примерно 1 до 200 мг, а предпочтительна при этом таблетка с содержанием эзетимиба 10 мг. Различные описанные выше композиции и терапевтические комбинации можно вводить в организм пациента в суточной дозе один раз в день разовой дозой или же несколько раз в день несколькими субдозами. Суточную дозу можно, например, разделить на 2-6 субдозы из расчета соответственно на 2-6 приемов в день. Предпочтительно, однако, вводить предлагаемую в изобретении фармацевтическую композицию в организм один раз в день. Выше изобретение описано на примере некоторых предпочтительных вариантов его осуществления, однако для специалистов в данной области очевидны и иные возможные варианты его осуществления, вытекающие из настоящего описания. Ниже изобретение более подробно рассмотрено на примерах. Однако для специалистов в данной области представляется очевидным, что при реализации настоящего изобретения на практике возможны многочисленные модификации касательно применяемых материалов и методов, не выходящие при этом за объем изобретения. Примеры Сравнительный пример: композиция согласно примеру А из WO 95/08532 или WO 95/35277 Способ приготовления. Компоненты 1 и 2 смешивают между собой в течение 10-15 мин в приемлемом смесителе. Полученную смесь гранулируют совместно с компонентом 3. Влажные гранулы при необходимости измельчают продавливанием через сито с крупными отверстиями (например, 1/4", 0,63 см). Затем влажные гранулы сушат. После этого высушенные гранулы при необходимости просеивают, смешивают с компонентом 4 и перемешивают в течение 10-15 мин. Далее добавляют компонент 5 и перемешивают в течение 1-3 мин. Из полученной смеси на приемлемой таблетировочной машине прессуют таблетки требуемых размеров и массы. Пример 1 (ссылочный пример). Способ приготовления. Кукурузный крахмал диспергируют в холодной воде (1 часть кукурузного крахмала на 8 частей воды). После этого смесь нагревают до примерно 95 С с образованием пасты и затем охлаждают до примерно 50 С. Эзетимиб смешивают с лактозой и кукурузным крахмалом и гранулируют с использованием кукурузно-крахмальной пасты. Влажные гранулы сушат при температуре примерно 50 С, пропускают через сито 18 и смешивают со стеаратом магния. Из полученной смеси на приемлемой таблетировочной машине (с пуансоном размером 8x5,5 мм) прессуют таблетки требуемых размеров и массы. Таким путем приготавливают композиции с различными образцамиэзетимиба, описанными ниже в примере 5. Пример 2. Определение профиля растворения. а) Композиции из примера 1 и сравнительного примера анализировали для определения скорости растворения, используя стандартное оборудование согласно Фармакопее США. Скорость растворения определяли погружением каждой таблетки в 500 мл 1%-ного раствора лаурилсульфата натрия в фосфатном буфере с рН 4,5. Раствор непрерывно перемешивали лопастной мешалкой при скорости ее вращения 50 об/мин. Полученные результаты приведены ниже. Количество высвободившегося действующего вещества в процентах Примечание: скорость растворения определяли в другой среде растворения и при других условиях: 0,01-молярный натрийфосфатный буфер с рН 7 + 0,5% лаурилсульфата натрия, 50 об/мин, 900 мл. Пример 3 (ссылочный пример). Предлагаемая в представленном раскрытии композиция Способ приготовления. Компонент 4 диспергируют в холодной воде (1 часть кукурузного крахмала на 5 частей воды). Смесь нагревают до примерно 95 С с образованием пасты и затем охлаждают до примерно 50 С. Компонент 1 в течение 10-15 мин смешивают с компонентами 2 и 3 в приемлемом смесителе и гранулируют совместно с кукурузно-крахмальной пастой. Влажные гранулы, просеянные через сито с крупными отверстиями, при необходимости измельчают. Затем влажные гранулы сушат. После этого высушенные гранулы при необходимости просеивают через приемлемое сито (30) и в течение 3-5 мин смешивают с компонентом 5. Полученную смесь перерабатывают прессованием на приемлемой таблетировочной машине в таблетки требуемых размеров и массы либо расфасовывают в приемлемой машине для заполнения капсул в соответствующие твердожелатиновые капсулы. При определении скорости растворения таблеток из примера 3 из них в течение 30 мин высвобождается более 90% содержащегося в них действующего вещества, вследствие чего увеличение количества пасты и уменьшение количества воды можно аналогично уровню техники использовать для совершенствования технологических аспектов без отрицательного влияния на характеристики высвобождения действующего вещества. Пример 4 (ссылочный пример). Предлагаемая в представленном раскрытии композиция Способ приготовления. Компонент 5 диспергируют в холодной воде (1 часть кукурузного крахмала на 5 частей воды). Смесь нагревают до примерно 95 С с образованием пасты и затем охлаждают до примерно 50 С. Компонент 1 в течение 10-15 мин смешивают с компонентами 2, 3 и 4 в приемлемом смесителе и гранулируют совместно с кукурузно-крахмальной пастой. Влажные гранулы, просеянные через сито с крупными отверстиями, при необходимости измельчают. Затем влажные гранулы сушат. После этого высушенные гранулы при необходимости просеивают через приемлемое сито (30) и в течение 3-5 мин смешивают с компонентом 6. Полученную смесь перерабатывают прессованием на приемлемой таблетировочной машине в таблетки требуемых размеров и массы либо расфасовывают в приемлемой машине для заполнения капсул в соответствующие твердожелатиновые капсулы. Пример 5. Определение размера частиц. а) Определение размера частиц "сухим методом дисперсионного анализа". Типичное оборудование и настройки: А) Прибор: анализатор размеров частиц "Mastersizer S" фирмы Malvern. Б) Фокусное расстояние собирающей линзы: 300 мм. В) Длина лазерного луча: 10 мм. Г) Дозатор: MS-64. Д) Представление: 3RHA. Е) Модель анализа: сжатый диапазон ("compressed range"). Ж) Диапазон затемнения: 15-30%. 3) Скорость подачи: 30%. И) Давление воздуха: 2,0 бара. Процедура: небольшой объем анализируемого образца помещают в дозатор сухого порошка. С помощью регулировочной ручки настраивают скорость подачи образца и давление воздуха и начинают процесс измерения, который продолжают до тех пор, пока затемнение не достигнет величины в пределах от 15 до 30%. Пропуская лазерный луч через ячейку с анализируемым образцом, определяют его гранулометрический состав с регистрацией полученных данных в виде гистограммы, после чего результаты определения гранулометрического состава указывают в виде максимальных размеров, меньше которых имеют соответственно 10, 50 и 90% частиц от всего их количества. В процессе измерений мощность лазера должна быть установлена на величину более 60% от максимальной. Результаты определения размеров частиц эзетимиба, используемого в композициях из примеров 1,3 и 4: б) Определение размера частиц "мокрым методом дисперсионного анализа". Анализ образцов эзетимиба с помощью оснащенного позиционно-чувствительным детектором лазерного дифрактометра фирмы Malvern. Для определения гранулометрического состава эзетимиба использовали лазерный дифрактометр фирмы Malvern. В этих целях использовали дифрактометр модели Mastersizer S, оснащенный малообъемным диспергатором MSI с цифровым контроллером. Измерения проводили, используя собирающую линзу 300RF (рабочий интервал определяемых размеров частиц от 0,05 до 900 мкм) при длине лазерного луча 2,40 мм и используя представление 3NHE. В этом случае в качестве среды растворения использовали раствор диоктилсульфосукцината натрия в н-гексане. Перед началом измерений суспензию после ее помещения в измерительную ячейку сначала рециркулировали в течение 1 мин при скорости 2000+10 об/мин. Суспензию приготавливали из 0,1 г образца в 0,065%-ном растворе диоктилсульфосукцината натрия в н-гексане путем вихревого перемешивания в течение 10 с с последующей обработкой ультразвуком в течение 30 с. Согласно принятым рекомендациям стандарта Good Manufacture Practice ("Надлежащая производственная практика") образец эзетимиба предпочтительно анализировать после успешного контрольного измерения (% затемнения не более 0,1%). Полученные результаты приведены ниже. Результаты определения размеров частиц эзетимиба, используемого в композиции из примера 1: Результаты определения размеров частиц других образцов используемого в предлагаемых в изобретении фармацевтических композициях эзетимиба "мокрым методом": Пример 6. Определение удельной поверхности. Метод анализа. Удельную поверхность определяют, используя следующее оборудование и следующие настройки. Прибор: Pulse Chemisorbs 2700 (фирма Micromeritics). Вакуумирование: без вакуумирования. Чувствительность: нет. Вычисления: по методу БЭТ. Тип: одноточечная система. Количество точек: одна. Объем ячейки для образца: 6 см 3. Процедура. Образец 1 из примера 5 б) известной массы помещают в U-образную прозрачную стеклянную трубку для образцов. Образец предварительно нагревают для удаления всей атмосферы при температуре жидкого азота (-196 С). Для этого через трубку с образцом, помещенную в баню из жидкого азота(-196 С), пропускают азот. Величина, отнесенная к массе катализатора, соответственно образца, находящегося в трубке, представляет собой удельную поверхность образца. Определение удельной поверхности по методу БЭТ. Определение удельной поверхности является важным этапом в определении производительности катализатора, позволяющим оценить эффективность носителя катализатора и эффективность промотора. Определение удельной поверхности может использоваться для прогнозирования отравления катализатора и для выявления причин дезактивации катализатора либо вследствие отравления, либо вследствие спекания. Уравнение БЭТ (Брунауэра-Эммета-Теллера) основано на распространении теории Ленгмюра на полислой. Основное уравнение для вычисления удельной поверхности выглядит следующим образом: где Р обозначает равновесное давление при адсорбции,Р 0 - давление насыщенного пара адсорбата,V адс - объем (в мл), адсорбированный при давлении Р,Vm - объем адсорбата, необходимый для образования монослоя,С - константа, относящаяся к теплоте адсорбции. Согласно методу БЭТ график зависимости Р/[V адс (Р 0-P)] от Р/Р 0 представляет собой прямую (в интервале значений P/Р 0 от 0,05 до 0,3) с наклоном (C-1)/(VmC) и с отсекаемым на оси ординат отрезком 1/VmC. Зная эти вычисленные величины - наклон и отсекаемый на оси ординат отрезок, удельную поверхность можно вычислить следующим образом: где Vm - объем монослоя в мл при нормальных температуре и давлении,NA - число Авогадро,Wt - масса катализатора,Am - средняя площадь поперечного сечения молекулы адсорбата (0,162 нм 2 для N2). Удельная поверхность эзетимиба составляет 1,24 м 2/г. Пример 7. Предлагаемые в соответствии с настоящим изобретением композиции ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Фармацевтическая композиция, содержащая эзетимиб в количестве от 5 до 20 мас.%, разбавитель в количестве от 50 до 85 мас.%, разрыхлитель в количестве от 3 до 25 мас.%, гидротропный солюбилизатор в количестве от 2 до 5 мас.%, связующее в количестве от 1 до 10 мас.% и смазывающее вещество в количестве от 0,5 до 1 мас.%, и эзетимиб имеет гранулометрический состав со значением d(0,9) в пределах от 9 до 20 мкм и значением d(0,5) в пределах от 3 до 50 мкм. 2. Фармацевтическая композиция по п.1, в которой эзетимиб имеет удельную поверхность в пределах от 1 до 1,5 м 2/г. 3. Фармацевтическая композиция по одному из предыдущих пунктов, обладающая таким профилем растворения, что эзетимиб высвобождается в количестве по меньшей мере 90% в течение 30 мин. 4. Фармацевтическая композиция по одному из предыдущих пунктов, в которой связующее представляет собой кукурузно-крахмальную пасту концентрацией более 10 мас.% в воде. 5. Фармацевтическая композиция по одному из предыдущих пунктов, в которой разбавитель вы-9 022269 бран из группы, включающей моногидрат лактозы, лактозу распылительной сушки, маннит, микрокристаллическую целлюлозу и их комбинации. 6. Фармацевтическая композиция по одному из предыдущих пунктов, в которой разрыхлитель выбран из группы, включающей кукурузный крахмал, поливинилполипирролидон, полакриллин калия и их комбинации. 7. Фармацевтическая композиция по одному из предыдущих пунктов, в которой связующее представляет собой кукурузно-крахмальную пасту и/или коповидон. 8. Фармацевтическая композиция по одному из предыдущих пунктов, в которой смазывающее вещество представляет собой стеарат магния. 9. Фармацевтическая композиция по одному из предыдущих пунктов, в которой гидротропный солюбилизатор выбран из группы, включающей меглумин, лаурилсульфат натрия и их комбинации. 10. Фармацевтическая композиция по одному из предыдущих пунктов, которая представляет собой таблетку с твердостью в пределах от 20 до 70 Н. 11. Фармацевтическая композиция по одному из предыдущих пунктов, время распада которой составляет менее 120 с. 12. Фармацевтическая композиция по одному из предыдущих пунктов, содержащая эзетимиб в количестве 10 мас.%, моногидрат лактозы в количестве 71 мас.%, кукурузный крахмал в количестве 13 мас.%, кукурузно-крахмальную пасту в количестве 5 мас.% и стеарат магния в количестве 1 мас.%. 13. Способ приготовления фармацевтической композиции, содержащей эзетимиб, заключающийся в том, что а) подготавливают эзетимиб, имеющий гранулометрический состав и удельную поверхность, указанные в одном из пп.1-2,б) приготавливают смесь, содержащую эзетимиб и одно или несколько фармацевтически приемлемых вспомогательных веществ, в качестве которых используют разбавитель в количестве от 50 до 85 мас.%, разрыхлитель в количестве от 3 до 25 мас.%, гидротропный солюбилизатор в количестве от 2 до 5 мас.%, связующее в количестве от 1 до 10 мас.% и смазывающее вещество в количестве от 0,5 до 1 мас.%, и в) смесь перерабатывают в композицию. 14. Способ по п.13, заключающийся в том, что дополнительно (г) смесь гранулируют. 15. Применение эзетимиба с указанными в одном из пп.1-2 характеристиками для приготовления медикамента с профилем растворения, указанным в п.3. 16. Применение кукурузно-крахмальной пасты с содержанием кукурузного крахмала по меньшей мере 11 мас.% для приготовления фармацевтической композиции по п.1.
МПК / Метки
МПК: A61K 31/397, A61K 9/20
Метки: содержащая, композиция, эзетимиб, фармацевтическая
Код ссылки
<a href="https://eas.patents.su/11-22269-farmacevticheskaya-kompoziciya-soderzhashhaya-ezetimib.html" rel="bookmark" title="База патентов Евразийского Союза">Фармацевтическая композиция, содержащая эзетимиб</a>
Предыдущий патент: Сельскохозяйственная система регулирования мощности, подводимой от трактора к пресс-подборщику, и способ регулирования
Следующий патент: Способ транспортирования непрерывного полотна частей поглощающего изделия
Случайный патент: Низколегированная сталь, бесшовные стальные трубы нефтепромыслового сортамента и способ изготовления бесшовной стальной трубы