Способ получения липосомальной формы кверцетина
Номер патента: 21352
Опубликовано: 29.05.2015
Авторы: Швец Виталий Иванович, Ульянов Андрей Михайлович, Тарасов Вадим Владимирович, Балабаньян Вадим Юрьевич, Натыкан Алексей Андреевич, Краснопольский Юрий Михайлович, Шоболов Дмитрий Львович
Формула / Реферат
Способ получения липосомального препарата, содержащего биофлавоноид кверцетин, путем смешивания этанольных растворов фосфатидилхолина и кверцетина, высушивания смеси в вакууме, ее эмульгирования в водном растворе, гомогенизации эмульсии с добавлением лактозы в виде водного раствора, поэтапной стерилизующей фильтрации и лиофильного высушивания, отличающийся тем, что гомогенизацию проводят по меньшей мере в два этапа: первоначальный при давлении 500 атм, последующий при давлении 800 атм, лактозу добавляют дробно в два этапа в начале и в процессе гомогенизации при массовом соотношении компонентов в полученном препарате кверцетин:лактоза 1:(31-76) соответственно.
Текст
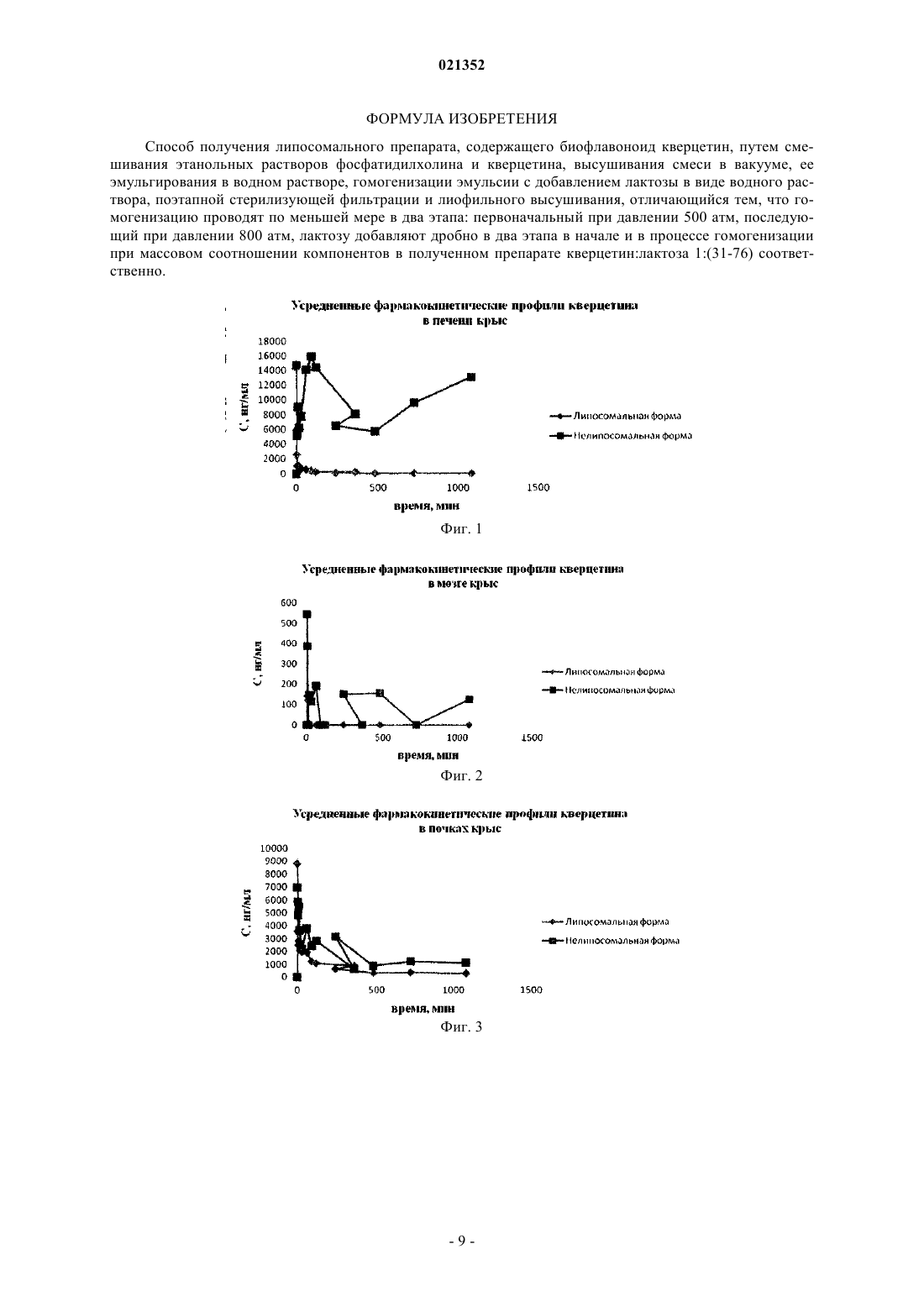
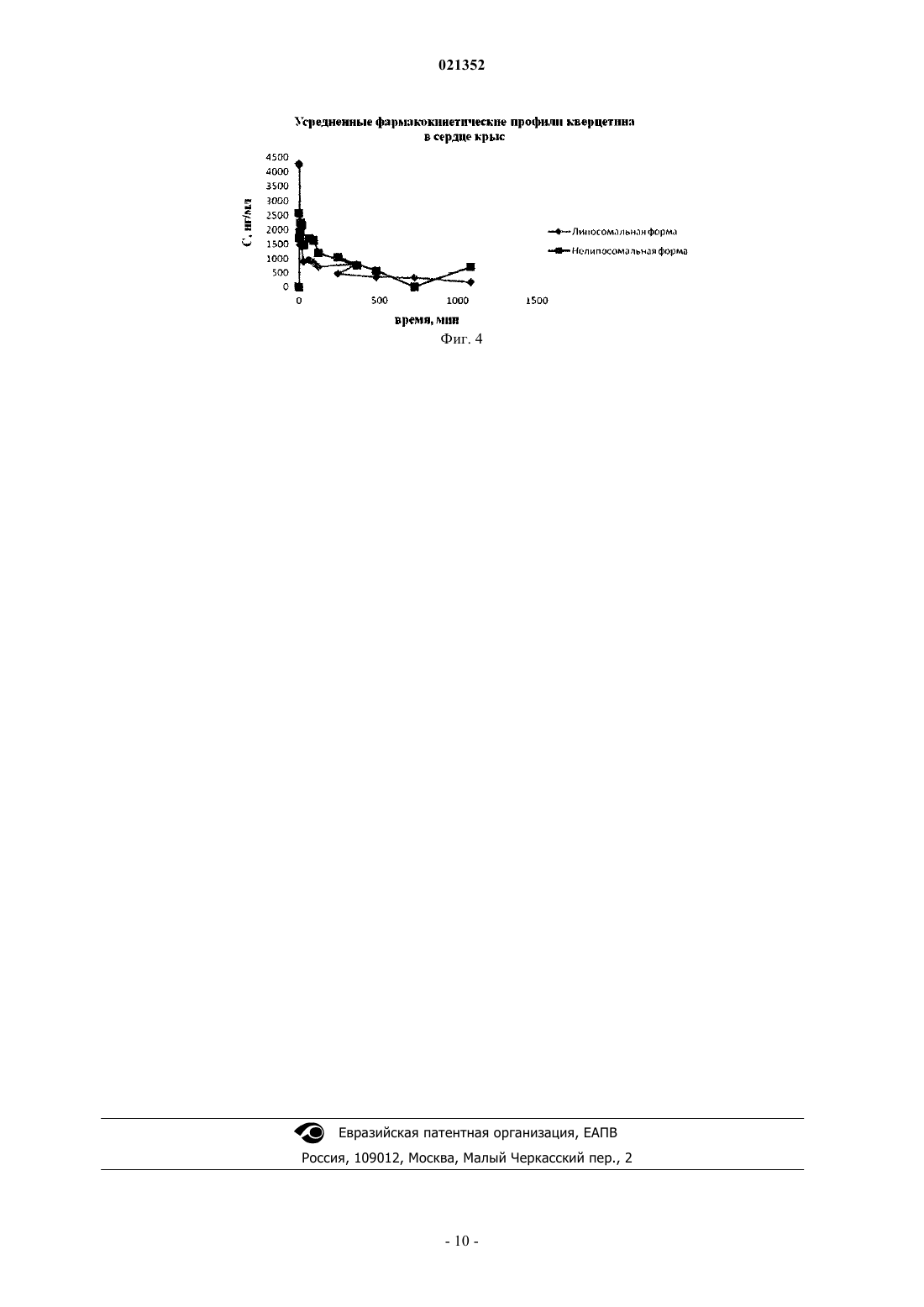
СПОСОБ ПОЛУЧЕНИЯ ЛИПОСОМАЛЬНОЙ ФОРМЫ КВЕРЦЕТИНА Изобретение относится к фармацевтике. Способ включает смешивание этанольных растворов фосфатидилхолина и кверцетина, высушивание смеси в вакууме, е эмульгирование в водном растворе, гомогенизацию эмульсии с добавлением лактозы в виде водного раствора, поэтапную стерилизующую фильтрацию и лиофильное высушивание. Достигаемый результат состоит в стандартности и стабильности полученного препарата липосом (размер липосом представлен в узком диапазоне), содержащих кверцетин, высокой инкапсуляции кверцетина в липосомы,стабильности липосом в процессе хранения. Шоболов Дмитрий Львович (RU),Краснопольский Юрий Михайлович(UA), Ульянов Андрей Михайлович,Натыкан Алексей Андреевич, Тарасов Вадим Владимирович, Балабаньян Вадим Юрьевич, Швец Виталий Иванович (RU) Ермакова Е.А. (RU) Изобретение относится к фармацевтике и касается способа получения липосомального средства,содержащего в составе липосом физиологически активное вещество - кверцетин, который имеет широкий спектр действия: ранозаживляющее, ангиопротекторное, противовоспалительное, антиоксидантное. Хорошо известно использование кверцетина [3] как кардиопротекторного средства, применяемого в комплексной терапии при остром нарушении коронарного кровообращения и инфаркте миокарда, для лечения и профилактики реперфузионного синдрома при хирургическом лечении больных с облитерирующим атеросклерозом брюшной аорты и периферических артерий. Кроме того, кверцетин применяют для профилактики и лечения местных лучевых поражений после рентген - и гамма-лучевой терапии; лечения пародонтоза и эрозивно-язвенных заболеваний слизистой оболочки ротовой полости. Высокая активность отличает кверцетин при приеме в офтальмологии. Кверцетин представляет собой агликон многих растительных флавоноидных гликозидов следующей структурной формулы: Вместе с тем, применение кверцетина в составе лекарственных препаратов ограничено свойствами кверцетина как продукта практически нерастворимого в водной среде, а, следовательно, и в физиологических жидкостях организма. Этот фактор обусловливает создание в основном пероральных форм выпуска кверцетина - порошков и гранул, что приводит к крайне низкой биодоступности препаратов на его основе. Известны способы получения инъекционных препаратов кверцетина [5, 6]. В частности, известен способ получения, при котором кверцетин растворяют в водном растворе (при температуре 75-85C), содержащем натрия тетроборат, трилон Б и поливинилпирролидон в соотношении 1:(0,7-1,0):(5,5-8,0):(0,010-0,015), охлаждают, фильтруют, разливают в ампулы и термически стерилизуют. Известен также способ получения кверцетина для парентерального введения, который предусматривает растворение кверцетина и поливинилпирролидона в этаноле при соотношении 9:1, нейтрализацию,стерилизацию, розлив во флаконы и лиофилизацию. Существенными недостатками этих методов является введение в состав препарата вспомогательных токсичных веществ - трилон Б и поливинилпирролидон,которые ограничено выводятся из организма человека, накапливаясь в печени и почках (поливинилпирролидон). Именно этот факт привел к запрету использования поливинилпирролидона во многих странах. Указанные недостатки известных способов получения препаратов на основе кверцетина обусловливают снижение биодоступности и безвредности целевых продуктов. Одним из приоритетных направлений развития современных фармацевтических технологий является разработка и создание терапевтических систем направленного действия. Для решения этой задачи с успехом применяются наносомальные носители лекарственных веществ, которые способны увеличивать нацеленность действия и обеспечивают увеличение биодоступности. За последние годы появились сообщения о включении кверцетина в наночастицы из различных полимерных носителей, пегилированные частицы и липосомы из природных и синтетических липидов [1, 2, 4, 8-10]. Перевести кверцетин в водорастворимое состояние возможно, включив его в мембрану липидов[12-14]. В литературе описаны методы преодоления лекарственными составами низкой растворимости фармацевтических субстанций в водных растворителях, в частности кверцетина. В частности, известен лекарственный препарат "Липофлавон" на основе липосомальной композиции, который представляет собой фосфатидилхолиновые ЛС с инкапсулированным в них биофлавоноидом - кверцетином, применяемый в виде инъекционной формы в кардиологии и в виде глазных капель [11]. Известно, что препараты кверцетина существенно уменьшают как гемодинамические нарушения,так и объем некротического повреждения при острой ишемии и реперфузии миокарда. Этот эффект обусловлен мембраностабилизирующим действием кверцетина, о чем свидетельствует резкое торможение деградации мембранных ферментов в ишемизированном миокарде, а также торможение активности липоксигеназ и неферментных прооксидантных реакций. Существует мнение, что важным фактором, определяющим кардиопротекторные свойства кверцетина, является его способность повышать уровень оксида азота в тканях и эндотелии миокарда. Этот эффект был экспериментально доказан в опытах на культуре эндотелиоцитов пупочной вены человека и в экспериментах in vivo с прямым определением уровня оксида азота в миокарде и стенке сосудов кролика и при моделировании процессов ишемии/реперфузии миокарда у собак. Сложность использования кверцетина в клинике прежде всего связана с его гидрофобностью. Создание "Липофлавона" как липосомальной формы кверцетина позволило решить эту проблему. Эффективность "Липофлавона" была показана при лечении острого инфаркта, нестабильной стенокардии, а также реперфузионных нарушений при тромболитической терапии. У экспериментальных животных на модели острого инфаркта внутривенное введение "Липофлавона" приводило к стабилизации электрической активности сердца, улучшению коронарного кровообращения и уменьшению зоны некроза в два раза. Препарат производил выраженный противоаритмический эффект. По-видимому, терапевтический эффект "Липофлавона" обусловлен комплексным действием компонентов препарата и его липосомальной структурой: блокадой липооксигеназного пути метаболизма арахидоновой кислоты за счет присутствия в препарате кверцетина, а также антигипоксическим, антиоксидантным и мембранопротекторным действием фосфатадилхолиновых липосом. Установлена безопасность и отсутствие побочных реакций (аллергических, иммунотоксичных, местно-раздражающего действия) при введении препарата. При исследовании ишемической болезни сердца установлено, что терапия "Липофлавоном" больных в течение 7 дней приводит к клиническому улучшению течения заболевания: уменьшению тяжести частоты приступов стенокардии, уменьшению объема необходимой поддерживающей терапии, в том числе антигипертензивных препаратов. "Липофлавон" обладает антиагрегатными, эндотелиопротекторными свойствами, улучшает реологические свойства крови и кровоток в микрососудах. Проведены исследования эффективности "Липофлавона" в комбинации с другим известным антигипоксантом - ацелизином в условиях экспериментальной хронической сердечной недостаточности. Предметом исследования было изучение влияния приведенной комбинации на состояние энергетических ресурсов, активности ферментов энергетического метаболизма - лактатдегидрогеназы и креатинфосфокиназы. Было показано, что использование липосомальной формы кверцетина в комбинации с ацелизином позволяет на 7 сутки наблюдения существенно снизить в сыворотке крови и миокарде интенсивность свободнорадикального окисления. Лечение позволяет предупредить снижение активности ферментов, таких как супероксидисмутаза и каталаза. Было установлено, что "Липофлавон" обладает антирадикальными и антиоксидантными свойствами. На основании проведенных исследований в клинике было рекомендовано применение "Липофлавона": в комплексной терапии при остром инфаркте миокарда без патологического зубца Q и нестабильной стенокардии приводит к более быстрой положительной динамике активности МВ-фракции креатинфосфокиназы в сыворотке крови, препятствует повышению уровня противовоспалительного цитокина интерлейкина-8, способствует электрической стабильности миокарда; при лечении стабильной стенокардии способствует уменьшению тяжести приступов стенокардии, снижению агрегации тромбоцитов, улучшению реологических показателей крови (снижению вязкости крови и агрегации эритроцитов) и микроциркуляции. Известен способ [7] получения липосомальной композиции на основе природного фосфатидилхолина и кверцетина, который обладает фармакологической активностью. Способ [7] выбран наиболее близким аналогом по сумме признаков, а именно: сутью и последовательностью выполнения основных операций и приемов, химической природой фосфофолипида и кверцетина, липосомальной организацией целевого продукта и близостью его фармакотерапевтических проявлений. Известный способ [7] предусматривает смешивание фосфатидилхолина в этиловом спирте и этанольного раствора кверцетина, который растворяют при температуре 47-53C, высушивание смеси проводят при температуре 42-50C, эмульгирование в водной среде, диспергирование эмульсии с добавлением лактозы, поэтапную стерилизующую фильтрацию и лиофильное высушивание при массовом соотношении кверцетин:лактоза 1:24-30. Однако способ [7] предусматривает операции и методы, которые затрудняют реализацию способа и способствуют снижению качества липосомального продукта. Во-первых, это связано с недостатком в препарате криопротектора - лактозы (при массовом соотношении кверцетин:лактоза 1:24-30), что приводит к завышенным размерам липосом после лиофилизации. Во-вторых, проведение процесса гомогенизации эмульсии при 60 МПа ухудшает стабильность системы и может изменять образующуюся систему липосом, что затрудняет стерилизующую фильтрацию и требует поэтапной и стерилизующей фильтрации. В-третьих, предлагаемая в [7] система добавления лактозы (только по окончании гомогенизации) в липосомы не позволяет криопротектору находиться как внутри липосомы, так и в окружающем водном пространстве, что приводит к нестабильности продукта после лиофилизации. Все это снижает эффективность способа-прототипа в процессе его воспроизводства, а также стабильность целевого продукта как химиотерапевтического средства. Задачей заявленного способа является упрощение процесса получения, повышение качества липосомального препарата по показателям стабильности липосомальной структуры после лиофилизации продукта и преимущественное накопление кверцетина в сердечной мышце, что, в свою очередь, обеспечивает фармакологическую активность. При этом результат, полученный при решении поставленной задачи,состоит в стандартности и стабильности полученного препарата липосом (размер липосом представлен в узком диапазоне), содержащих кверцетин, высокой инкапсуляции кверцетина в липосомы, стабильности липосом в процессе хранения, возможности стерилизующей фильтрации без поэтапной фильтрации. Для достижения поставленного результата предлагается способ получения липосомальной композиции на основе фосфатидилхолина и кверцетина, предполагающий смешивание этанольных растворов фосфатидилхолина и кверцетина, высушивание полученной смеси в вакууме, е эмульгирование в водном растворе, гомогенизацию эмульсии с добавлением лактозы (криопротектора) в виде водного раствора, поэтапную стерилизующую фильтрацию и лиофильное высушивание, при этом гомогенизацию про-2 021352 водят в два этапа: первоначальный при давлении 500 атм, последующий при давлении 800 атм, лактозу добавляют дробно в два этапа: в начале и в процессе гомогенизации, при этом массовое соотношение компонентов в полученном препарате составляет кверцетин:лактоза 1:(31-76) соответственно. Практические аспекты реализации способа предусматривают использование яичного фосфатидилхолина и кверцетина в органических растворителях, удаление растворителя упариванием в вакууме, диспергирование полученной массы в водной среде, гомогенизацию многослойных липосом при возрастающем давлении, добавление криопротектора как в начале гомогенизации, так и при достижении размера липосом 150-200 нм, получение липосом размером 80-140 нм, стерилизующую фильтрацию полученной липосомальной эмульсии, розлив во флаконы, лиофилизацию и герметизацию в атмосфере инертного газа (или азота). Способ иллюстрируется графиками фармакокинетических профилей кверцетина в печени, мозге,почках и сердце крыс (фиг. 1-4 соответственно). Эффективность заявляемого способа по качественной и количественной идентификации в готовом продукте липидного компонента - фосфатидилхолина оценивали методом тонкослойной хроматографии на пластинках по хроматограмме раствора целевого продукта в метанол:хлороформ:метанол - 65:25:4, на которой основное пятно желтого цвета находится на уровне основного пятна раствора стандартного образца фосфатидилхолина; индекс окисленности липидов оценивали УФ-спектроскопией при длинах волн 233 и 215 нм. Эффективность заявляемого способа по качественной и количественной идентификации в готовом продукте кверцетина оценивали методом высокоэффективной жидкостной хроматографии, которую проводили для количественного определения посторонних примесей и содержания кверцетина в образцах препарата. Использовали хроматограф "Shimadzu Nexera", колонка хроматографическая размером С 18 4,6250 мм, с размером частиц 5 мкм аналогичная, подвижная фаза: 1% раствор уксусной кислоты и раствор метанол:ацетонитрил; скорость подвижной фазы 1 мл/мин; детектирование при длине волны 71 нм; температура колонки 30C. Физико-химические свойства полученного липосомального препарата оценивали определением величины частиц липосом на наносайзере Zetasizer Nano ZS методом фотонной корреляционной спектроскопии. Размер частиц измеряли при помощи полупроводникового лазера при длине волны 375 нм. Нижеследующие конкретные примеры иллюстрируют процесс получения липосомальной композиции согласно заявленному способу (примеры 1-7) и способу согласно прототипу (пример 8) Пример 1. Лактозу в количестве 54,25 г растворяли в фосфатной буферной смеси (рН 6,5-6,8) в объеме 210 мл. Раствор фильтровали через мембраны с размером пор 0,22 мкм. Точную навеску кверцетина дигидрата в количестве 1750 мг растворяли в 150 мл этилового спирта. 47,25 г фосфатидилхолина (яичного, соевого,ДПФХ и др.) растворяли в 150 мл этилового спирта и перемешивали. Растворы кверцетина и фосфатидилхолина объединяли и фильтровали через мембраны с размером пор 0,22 мкм. Стерильные растворы переносили в колбу ротационного испарителя. Этанол упаривали при 41-45C до получения тонкой пленки. Пленку обрабатывали газообразным азотом в течение 15-20 мин. Полученную пленку со стенок колбы количественно снимали смесью растворов: 1995 мл стерильного фосфатного буферного раствора(рН 6,5-6,8) и 105 мл стерильного раствора лактозы (27,125 г лактозы). Колбу с раствором перемешивали в течение 2 ч до полного растворения пленки. Проводили контроль эмульсии: концентрация кверцетина в эмульсии (определение методом ВЭЖХ) - 0,83 мг/мл. Количество примесей на уровне исходной субстанции кверцетина не превышало 2,8%. Эмульсию переносили в гомогенизатор высокого давления и проводили гомогенизацию при температуре 38-44C. Первоначально создавали давление (3 цикла) 500 атм. Затем продолжали гомогенизацию при 800 атм до размера частиц не более 200 нм. При достижении указанного размера частиц в эмульсию добавляли оставшийся стерильный раствор лактозы 105 мл (27,125 г). Объем эмульсии 2205 мл. Гомогенизацию проводили до размера частиц не более 130-150 нм. Концентрация кверцетина до стерилизующей фильтрации 0,783 мг/мл. Эмульсию фильтровали через каскад фильтров с финишным фильтром размером пор 0,2 мкм. Объем после стерилизующей фильтрации 1830 мл. Размер частиц после стерилизующей фильтрации 138,2 нм - 87,1%, 57,8 нм - 12,9%. Концентрация после стерилизующей фильтрации 0,775 мг/мл. Включение кверцетина в липосомы после стерилизующей фильтрации (определение методом ВЭЖХ) - 98,88%. Количество примесей на уровне исходной субстанции кверцетина не превышало 2,62%. Эмульсию разливали во флаконы, лиофилизировали и герметизировали в атмосфере инертного газа (азота). По результатам контроля продукта, полученного по предлагаемому способу после лиофилизации, установлено, что препарат представлен в виде легкой аморфной массы желтоватого цвета с характерным запахом; размер частиц сохранен в нанодиапазоне - 165 нм - 87%; 75 нм - 13%; рН - 6,75. Включение кверцетина в липосомы не менее 96,2%. Соотношение компонентов в препарате: кверцетин:фосфатидилхолин:лактоза - (1:27:31). Пример 2. Лактозу в количестве 93,625 г растворяли в фосфатной буферной смеси (рН 6,5-6,8) в объеме 210 мл. Раствор фильтровали через мембраны с размером пор 0,22 мкм. Точную навеску кверцетина ди-3 021352 гидрата в количестве 1750 мг растворяли в 150 мл этилового спирта. 47,25 г фосфатидилхолина (яичного,соевого, ДПФХ и др.) растворяли в 150 мл этилового спирта и перемешивали. Растворы кверцетина и фосфатидилхолина объединяли и фильтровали через мембраны с размером пор 0,22 мкм. Стерильные растворы переносили в колбу ротационного испарителя. Этанол упаривали при 41-45C до получения тонкой пленки. Пленку обрабатывали газообразным азотом в течение 15-20 мин. Полученную пленку со стенок колбы количественно снимали смесью растворов: 1995 мл стерильного фосфатного буферного раствора (рН 6,5-6,8) и 105 мл стерильного раствора лактозы (46,81 г лактозы). Колбу с раствором перемешивали в течение 2 ч до полного растворения пленки. Проводили контроль эмульсии: концентрация кверцетина в эмульсии (определение методом ВЭЖХ) - 0,83 мг/мл. Количество примесей на уровне исходной субстанции кверцетина не превышало 2,8%. Эмульсию переносили в гомогенизатор высокого давления и проводили гомогенизацию при температуре 38-44C. Первоначально создавали давление (3 цикла) 500 атм. Затем продолжали гомогенизацию при 800 атм до размера частиц не более 200 нм. При достижении указанного размера частиц в эмульсию добавляли оставшийся стерильный раствор лактозы 105 мл (46,81 г). Гомогенизацию проводили до размера частиц не более 130-150 нм. Концентрация кверцетина до стерилизующей фильтрации 0,8 мг/мл. Эмульсию фильтровали через каскад фильтров, с финишным фильтром размером пор 0,2 мкм. Объем после стерилизующей фильтрации 1830 мл. Размер частиц после стерилизующей фильтрации 148,2 нм - 93,1%; 70,8 нм - 6,9%. Концентрация после стерилизующей фильтрации 0,775 мг/мл. Включение кверцетина в липосомы после стерилизующей фильтрации (определение методом ВЭЖХ) - 96,88%. Количество примесей на уровне исходной субстанции кверцетина не превышало 2,62%. Эмульсию разливали во флаконы, лиофилизировали и герметизировали в атмосфере инертного газа (азота). По результатам контроля продукта, полученного по предлагаемому способу после лиофилизации, установлено, что препарат представлен в виде легкой аморфной массы желтоватого цвета с характерным запахом; размер частиц сохранен в нанодиапазоне - 154,3 нм - 100%; рН - 6,82. Включение кверцетина в липосомы не менее 97,2%. Соотношение компонентов в препарате: кверцетин:фосфатидилхолин:лактоза - (1:27:51,3). Пример 3. Лактозу в количестве 133,0 г растворяли в фосфатной буферной смеси (рН 6,5-6,8) в объеме 210 мл. Раствор фильтровали через мембраны с размером пор 0,22 мкм. Точную навеску кверцетина дигидрата в количестве 1750 мг растворяли в 150 мл этилового спирта. 47,25 г фосфатидилхолина (яичного, соевого) растворяли в 150 мл этилового спирта и перемешивали. Растворы кверцетина и фосфатидилхолина объединяли и фильтровали через мембраны с размером пор 0,22 мкм. Стерильные растворы переносили в колбу ротационного испарителя. Этанол упаривали при 41-45C до получения тонкой пленки. Пленку обрабатывали газообразным азотом в течение 15-20 мин. Полученную пленку со стенок колбы количественно снимали смесью растворов: 1995 мл стерильного фосфатного буферного раствора (рН 6,5-6,8) и 105 мл стерильного раствора лактозы (66,5 г лактозы). Колбу с раствором перемешивали в течение 2 ч до полного растворения пленки. Проводили контроль эмульсии: концентрация кверцетина в эмульсии (определение методом ВЭЖХ) - 0,825 мг/мл. Количество примесей на уровне исходной субстанции кверцетина не превышало 2,8%. Эмульсию переносили в гомогенизатор высокого давления и проводили гомогенизацию при температуре 38-44C. Первоначально создавали давление (3 цикла) 500 атм. Затем продолжали гомогенизацию при 800 атм до размера частиц не более 200 нм. При достижении указанного размера частиц в эмульсию добавляли оставшийся стерильный раствор лактозы 105 мл (66,5 г). Гомогенизацию проводили до размера частиц не более 130-150 нм. Концентрация кверцетина до стерилизующей фильтрации 0,787 мг/мл. Эмульсию фильтровали через каскад фильтров, с финишным фильтром размером пор 0,2 мкм. Объем после стерилизующей фильтрации 1830 мл. Размер частиц после стерилизующей фильтрации 138,2 нм - 87,1%; 57,8 нм - 12,9%. Концентрация после стерилизующей фильтрации 0,775 мг/мл. Включение кверцетина в липосомы после стерилизующей фильтрации (определение методом ВЭЖХ) - 96,88%. Количество примесей на уровне исходной субстанции кверцетина не превышало 2,62%. Эмульсию разливали во флаконы, лиофилизировали и герметизировали в атмосфере инертного газа (азота). По результатам контроля продукта, полученного по предлагаемому способу после лиофилизации, установлено, что препарат представлен в виде легкой аморфной массы желтоватого цвета с характерным запахом; размер частиц сохранен в нанодиапазоне - 148 нм - 87,8%; 57,8 нм - 12,2%; рН - 6,6. Включение кверцетина в липосомы не менее 95,12%. Соотношение компонентов в препарате: кверцетин:фосфатидилхолин:лактоза - (1:26:76). Пример 4. Лактозу в количестве 54,25 г растворяли в фосфатной буферной смеси (рН 6,5-6,8) в объеме 210 мл. Раствор фильтровали через мембраны с размером пор 0,22 мкм. Точную навеску кверцетина дигидрата в количестве 1750 мг растворяли в 150 мл этилового спирта. 47,25 г фосфатидилхолина (яичного, соевого) растворяли в 150 мл этилового спирта и перемешивали. Растворы кверцетина и фосфатидилхолина объединяли и фильтровали через мембраны с размером пор 0,22 мкм. Стерильные растворы переносили в колбу ротационного испарителя. Этанол упаривали при 41-45C до получения тонкой пленки. Пленку обрабатывали газообразным азотом в течение 15-20 мин. Полученную пленку со стенок колбы количест-4 021352 венно снимали смесью растворов: 1995 мл стерильного фосфатного буферного раствора (рН 6,5-6,8) и 105 мл стерильного раствора лактозы (27,125 г лактозы). Колбу с раствором перемешивали в течение 2 ч до полного растворения пленки. Проводили контроль эмульсии: концентрация кверцетина в эмульсии(определение методом ВЭЖХ) - 0,827 мг/мл. Количество примесей на уровне исходной субстанции кверцетина не превышало 2,8%. Эмульсию переносили в гомогенизатор высокого давления и проводили гомогенизацию при температуре 38-44C. Первоначально создавали давление (4 цикла) 500 атм. Затем продолжали гомогенизацию при 800 атм до размера частиц не более 200 нм. При достижении указанного размера частиц в эмульсию добавляли оставшийся стерильный раствор лактозы 105 мл (27,125 г). Гомогенизацию проводили до размера частиц не более 130-150 нм. Концентрация кверцетина до стерилизующей фильтрации 0,784 мг/мл. Эмульсию фильтровали через каскад фильтров с финишным фильтром размером пор 0,2 мкм. Объем после стерилизующей фильтрации 1830 мл. Размер частиц после стерилизующей фильтрации 148,2 нм - 92,1%; 67,8 нм - 7,9%. Концентрация после стерилизующей фильтрации 0,775 мг/мл. Включение кверцетина в липосомы после стерилизующей фильтрации (определение методом ВЭЖХ) - 98,85%. Количество примесей на уровне исходной субстанции кверцетина не превышало 2,4%. Эмульсию разливали во флаконы, лиофилизировали и герметизировали в атмосфере инертного газа (азота). По результатам контроля продукта, полученного по предлагаемому способу после лиофилизации, установлено, что препарат представлен в виде легкой аморфной массы желтоватого цвета с характерным запахом; размер частиц сохранен в нанодиапазоне - 139,6 нм - 94,8%; 42 нм - 5,2%; рН - 6,75. Включение кверцетина в липосомы не менее 93,9%. Соотношение компонентов в препарате: кверцетин:фосфатидилхолин:лактоза - (1:27:31). В данном примере диспергирование при 500 атм - проводится 4 цикла. Пример 5. Лактозу в количестве 54,25 г растворяли в фосфатной буферной смеси (рН 6,5-6,8) в объеме 210 мл. Раствор фильтровали через мембраны с размером пор 0,22 мкм. Точную навеску кверцетина дигидрата в количестве 1750 мг растворяли в 150 мл этилового спирта. 47,25 г фосфатидилхолина (яичного, соевого) растворяли в 150 мл этилового спирта и перемешивали. Растворы кверцетина и фосфатидилхолина объединяли и фильтровали через мембраны с размером пор 0,22 мкм. Стерильные растворы переносили в колбу ротационного испарителя. Этанол упаривали при 41-45C до получения тонкой пленки. Пленку обрабатывали газообразным азотом в течение 15-20 мин. Полученную пленку со стенок колбы количественно снимали смесью растворов: 1995 мл стерильного фосфатного буферного раствора (рН 6,5-6,8) и 105 мл стерильного раствора лактозы (27,125 г лактозы). Колбу с раствором перемешивали в течение 2 ч до полного растворения пленки. Проводили контроль эмульсии: концентрация кверцетина в эмульсии(определение методом ВЭЖХ) - 0,828 мг/мл. Количество примесей на уровне исходной субстанции кверцетина не превышало 2,6%. Эмульсию переносили в гомогенизатор высокого давления и проводили гомогенизацию при температуре 38-44C. Первоначально создавали давление (2 цикла) 500 атм. Затем продолжали гомогенизацию при 800 атм до размера частиц не более 200 нм. При достижении указанного размера частиц в эмульсию добавляли оставшийся стерильный раствор лактозы 105 мл (27,125 г). Гомогенизацию проводили до размера частиц не более 130-150 нм. Концентрация кверцетина до стерилизующей фильтрации 0,809 мг/мл. Эмульсию фильтровали через каскад фильтров, с финишным фильтром размером пор 0,2 мкм. Объем после стерилизующей фильтрации 1830 мл. Размер частиц после стерилизующей фильтрации 138,2 нм - 87,1%; 57,8 нм - 10,9%; 36,7 нм - 2% Концентрация после стерилизующей фильтрации 0,775 мг/мл. Включение кверцетина в липосомы после стерилизующей фильтрации (определение методом ВЭЖХ) - 96,88%. Количество примесей на уровне исходной субстанции кверцетина не превышало 2,62%. Эмульсию разливали во флаконы, лиофилизировали и герметизировали в атмосфере инертного газа (азота). По результатам контроля продукта, полученного по предлагаемому способу после лиофилизации, установлено, что препарат представлен в виде легкой аморфной массы желтоватого цвета с характерным запахом; Размер частиц сохранен в нанодиапазоне - 143,0 нм - 85,4%; 61 нм - 11%; 42 нм -4,6%; рН - 6,55. Включение кверцетина в липосомы не менее 91,2%. Соотношение компонентов в препарате: кверцетин:фосфатидилхолин:лактоза - (1:27:31). В данном примере проведено диспергирование при 500 атм - 2 цикла. Пример 6. Лактозу в количестве 35,0 г растворяли в фосфатной буферной смеси (рН 6,5-6,8) в объеме 210 мл. Раствор фильтровали через мембраны с размером пор 0,22 мкм. Точную навеску кверцетина дигидрата в количестве 1750 мг растворяли в 150 мл этилового спирта. 47,25 г фосфатидилхолина (яичного, соевого) растворяли в 150 мл этилового спирта и перемешивали. Растворы кверцетина и фосфатидилхолина объединяли и фильтровали через мембраны с размером пор 0,22 мкм. Стерильные растворы переносили в колбу ротационного испарителя. Этанол упаривали при 41-45C до получения тонкой пленки. Пленку обрабатывали газообразным азотом в течение 15-20 мин. Полученную пленку со стенок колбы количественно снимали смесью растворов: 1995 мл стерильного фосфатного буферного раствора (рН 6,5-6,8) и 105 мл стерильного раствора лактозы (17,5 г лактозы). Колбу с раствором перемешивали в течение 2 ч до полного растворения пленки. Проводили контроль эмульсии: концентрация кверцетина в эмульсии (определение методом ВЭЖХ) 0,825 мг/мл. Количество примесей на уровне исходной субстанции кверцетина не превышало 2,6%. Эмульсию переносили в гомогенизатор высокого давления и проводили гомогенизацию при температуре 38-44C. Первоначально создавали давление (3 цикла) 500 атм. Затем продолжали гомогенизацию при 800 атм до размера частиц не более 200 нм. При достижении указанного размера частиц в эмульсию добавляли оставшийся стерильный раствор лактозы 105 мл (17,5 г). Гомогенизацию проводили до размера частиц не более 130-150 нм. Концентрация кверцетина до стерилизующей фильтрации 0,787 мг/мл. Эмульсию фильтровали через каскад фильтров, с финишным фильтром размером пор 0,2 мкм. Объем после стерилизующей фильтрации 1830 мл. Размер частиц после стерилизующей фильтрации 148,2 нм - 88,1%; 67,8 нм - 11,9%. Концентрация после стерилизующей фильтрации 0,775 мг/мл. Включение кверцетина в липосомы после стерилизующей фильтрации (определение методом ВЭЖХ) 96,88%. Количество примесей на уровне исходной субстанции кверцетина не превышало 2,62%. Эмульсию разливали во флаконы, лиофилизировали и герметизировали в атмосфере инертного газа (азота). По результатам контроля продукта, полученного по предлагаемому способу после лиофилизации, установлено, что препарат представлен в виде легкой аморфной массы желтоватого цвета с характерным запахом; размер частиц сохранен в нанодиапазоне - 198 нм - 85,8%; 117,8 нм - 10,2%; 547 нм - 4%; рН - 6,6. Включение кверцетина в липосомы не менее 95,12%. Соотношение компонентов в препарате: кверцетин:фосфатидилхолин:лактоза - (1:27:20). В данном примере проведено использование лактозы с уменьшенным количеством. Пример 7. Лактозу в количестве 93,625 г растворяли в фосфатной буферной смеси (рН 6,5-6,8) в объеме 210 мл. Раствор фильтровали через мембраны с размером пор 0,22 мкм. Точную навеску кверцетина дигидрата в количестве 1750 мг растворяли в 150 мл этилового спирта. 47,25 г фосфатидилхолина (яичного,соевого, ДПФХ и др.) растворяли в 150 мл этилового спирта и перемешивали. Растворы кверцетина и фосфатидилхолина объединяли и фильтровали через мембраны с размером пор 0,22 мкм. Стерильные растворы переносили в колбу ротационного испарителя. Этанол упаривали при 41-45C до получения тонкой пленки. Пленку обрабатывали газообразным азотом в течение 15-20 мин. Полученную пленку со стенок колбы количественно снимали смесью растворов: 1995 мл стерильного фосфатного буферного раствора (рН 6,5-6,8) и 210 мл стерильного раствора лактозы (93,625 г лактозы). Колбу с раствором перемешивали в течение 2 ч до полного растворения пленки. Проводили контроль эмульсии: концентрация кверцетина в эмульсии (определение методом ВЭЖХ) 0,783 мг/мл. Количество примесей на уровне исходной субстанции кверцетина не превышало 2,8%. Эмульсию переносили в гомогенизатор высокого давления и проводили гомогенизацию при температуре 38-44C. Первоначально создавали давление (3 цикла) 500 атм. Затем продолжали гомогенизацию при 800 атм до размера частиц не более 200 нм. При достижении указанного размера частиц в эмульсию добавляли оставшийся стерильный раствор лактозы 105 мл (46,81 г). Гомогенизацию проводили до размера частиц не более 130-150 нм. Концентрация кверцетина до стерилизующей фильтрации 0,780 мг/мл. Эмульсию фильтровали через каскад фильтров, с финишным фильтром размером пор 0,2 мкм. Объем после стерилизующей фильтрации 1830 мл. Размер частиц после стерилизующей фильтрации 148,2 нм - 93,1%; 70,8 нм - 6,9%. Концентрация после стерилизующей фильтрации 0,700 мг/мл. Включение кверцетина в липосомы после стерилизующей фильтрации (определение методом ВЭЖХ) 89,74%. Количество примесей на уровне исходной субстанции кверцетина не превышало 2,62%. Эмульсию разливали во флаконы, лиофилизировали и герметизировали в атмосфере инертного газа (азота). По результатам контроля продукта, полученного по предлагаемому способу после лиофилизации, установлено, что препарат представлен в виде легкой аморфной массы желтоватого цвета с характерным запахом; размер частиц сохранен в нанодиапазоне - 134,3 нм - 92,4; 67 нм - 7,6%; рН - 6,82. Включение кверцетина в липосомы не менее 87,2%. Соотношение компонентов в препарате: кверцетин:фосфатидилхолин:лактоза - (1:27:51,3). В данном примере добавление лактозы проводили в начале процесса диспергирования. Пример 8 (по способу прототипа). Точную навеску кверцетина дигидрата в количестве 1000 мг растворяли в 100 мл этилового спирта при температуре 50C, прибавляли к раствору 40,0 г фосфатидилхолина, растворенного в 100 мл этилового спирта, и перемешивали. Раствор переносили в колбу ротационного испарителя. Этанол упаривали при температуре 42C до получения тонкой пленки. После окончания процесса высушивания липидную пленку обрабатывали газообразным азотом в течение 5 мин. Полученную пленку со стенок колбы количественно снимали 1380 мл воды для инъекций. Колбу с эмульсией перемешивали в течение 2 ч. Эмульсию переносили в гомогенизатор высокого давления и проводили гомогенизацию при температуре 40-45C при давлении 600 атм. При достижении оптической плотности 0,15 (длина волны - 540 нм; толщина слоя поглощения - 0,5 см) к полученной эмульсии прибавляли стерильный раствор лактозы 24 г в 120 мл раствора. Продолжали гомогенизацию при тех же параметрах процесса до оптической плотности не более 0,15 (длина волны - 540 нм; толщина слоя поглощения - 0,5 см). Концентрация кверцетина после гомогенизации 0,65 мг/мл. Включение после гомогенизации (определение методом ВЭЖХ) 97%. Полученную эмульсию последовательно фильтровали через фильтры 0,45 и 0,22 мкм, а далее проводили еще одну фильтрацию через 0,22 мкм. Объем после стерилизующей фильтрации 1380 мл. Размер частиц после стерилизующей фильтрации 153 нм - 89,7%; 56,8 нм - 10,3%. Концентрация после стерилизующей фильтрации 0,615 мг/мл. Включение после стерилизующей фильтрации (определение методом ВЭЖХ) - 94,61%. Эмульсию разливали во флаконы, лиофилизировали и герметизировали в атмосфере инертного газа (азота). По результатам контроля продукта, полученного по предлагаемому способу после лиофилизации, установлено, что препарат представлен в виде легкой аморфной массы желтоватого цвета с характерным запахом; размер частиц - 168,5 нм - 82,3%; 56,6 нм - 11,7%; 653 нм - 6%. Включение не менее 93,2%. Соотношение компонентов в препарате: кверцетин:фосфатидилхолин:лактоза - (1:40:24). Пример 9. При исследовании фармакокинетики липосомального и нелипосомального кверцетина при однократном инъекционном введении крысам наблюдается его быстрое выведение из плазмы крови с максимальной концентрацией около 40-70 мкг/мл, что согласуется с данными инструкции по медицинскому применению оригинального препарата кверцетина. Уровни концентраций в плазме липосомального и нелипосомального кверцетина существенно не различались. Наблюдались различия при определении кверцетина в печени крыс. Cmax для липосомальной формы составляла около 5,9 мкг/г (Tmax - 1 мин), для нелипосомальной - около 15,8 мкг/г (Tmax - 90 мин). Липосомальный кверцетин практически полностью выводился из печени к 18 ч, в отличие от нелипосомального, который сохраняется в печени к 18 ч после введения на уровне 13 мкг/г. Также различия наблюдались для мозга - липосомальный кверцетин практически не проникал через ГЭБ и обнаруживался в небольших дозах (до 500 нг/г) не позднее 10 мин после введения. Нелипосомальный кверцетин обнаруживался в мозге крыс даже спустя 18 ч после введения в диапазоне концентраций 120-550 нг/г. Схожие фармакокинетические профили наблюдались для почек: для липосомального кверцетинаCmax составила около 4,2 мкг/г, для нелипосомального - 2,5 мкг/г (Tmax - 1 мин в обоих случаях). Таким образом, результаты физико-химических исследований свидетельствуют, что продукт, полученный согласно заявленному способу, - гомогенизация проводится в два этапа: первоначальный при 500 атм и последующий при 800 атм до указанного размера; соотношение компонентов в итоговом препарате: кверцетин:фосфатидилхолин:лактоза - 1:27:31-76 (см. примеры 1-3) обеспечивают стабильность композиции липосом с включенным в них кверцетином. Воспроизведение заявленного способа при изменении параметров (см. примеры 4-6), а также способ согласно прототипу (пример 8) влечет трудности в реализации собственно способа и снижение качества целевого продукта, а именно: увеличение размера и неоднородность дисперсионного состава липосом (примеры 5, 6, 8); уменьшение включения кверцетина в липосомы и нестабильность размеров липосом (примеры 5, 7). Как видно из примеров 1-3, оптимальным является первоначальное проведение гомогенизации при 500 атм (3 цикла) - гомогенность выше 90%. При проведении диспергирования при 500 атм (2 цикла) обнаруживается гетерогенность размеров липосом, т.е. диаметр липосом находится в широком диапазоне и представлен тремя фракциями (пример 5); при проведении диспергирования при 500 атм (4 цикла) результаты не отличаются от использования трех циклов диспергирования (пример 4). Оптимальным является содержание лактозы при соотношении кверцетин:лактоза 1:31 - 1:76. Использование меньшего количества лактозы приводит к нестабильности липосом после лиофилизации,что, в свою очередь, приводит к гетерогенности размеров липосом и их увеличению до фракции с размером 547 нм (пример 6) Лактозу добавляют дробно: 1/2 первоначально, а затем после достижения размера липосом 200 нм вторую порцию. В случае добавления всей лактозы одновременно после лиофилизации (недостаток криопротекторного действия) увеличиваются размеры липосом и появляется фракция около более 500 нм (прототип, пример 8). При добавлении всего количества лактозы на начальной стадии обнаруживается снижение включения кверцетина в липосомы (пример 7). ФОРМУЛА ИЗОБРЕТЕНИЯ Способ получения липосомального препарата, содержащего биофлавоноид кверцетин, путем смешивания этанольных растворов фосфатидилхолина и кверцетина, высушивания смеси в вакууме, ее эмульгирования в водном растворе, гомогенизации эмульсии с добавлением лактозы в виде водного раствора, поэтапной стерилизующей фильтрации и лиофильного высушивания, отличающийся тем, что гомогенизацию проводят по меньшей мере в два этапа: первоначальный при давлении 500 атм, последующий при давлении 800 атм, лактозу добавляют дробно в два этапа в начале и в процессе гомогенизации при массовом соотношении компонентов в полученном препарате кверцетин:лактоза 1:(31-76) соответственно.
МПК / Метки
МПК: A61K 9/127, A61K 31/352
Метки: кверцетина, способ, липосомальной, формы, получения
Код ссылки
<a href="https://eas.patents.su/11-21352-sposob-polucheniya-liposomalnojj-formy-kvercetina.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения липосомальной формы кверцетина</a>
Предыдущий патент: Способ хирургического лечения травматической катаракты, сопровождающейся дефектом радужки
Следующий патент: Производное инденона и содержащая его фармацевтическая композиция
Случайный патент: Производные n-тиазол-2-илбензамида