Замещенные тетрациклические производные тетрагидрофурана
Номер патента: 1002
Опубликовано: 28.08.2000
Авторы: Хиль-Лопетеги Пилар, Фернандес-Гадеа Франсиско Хавьер, Меерт Тео Франц
Формула / Реферат
1. Соединение формулы
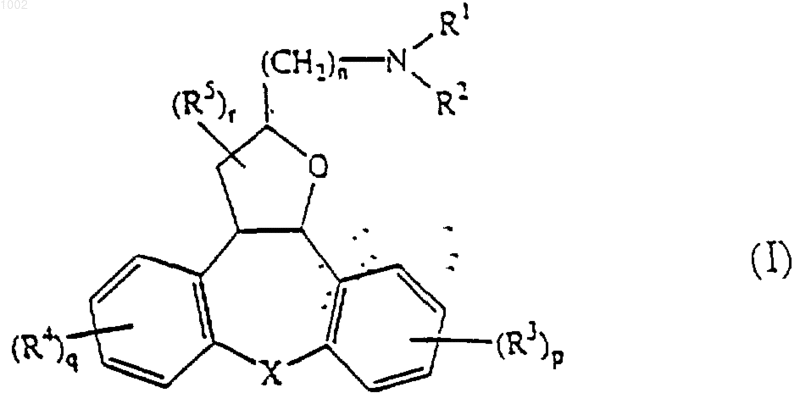
его N-оксидная форма, фармацевтически приемлемая аддитивная соль или его стереохимически изомерная форма,
где n равно нулю, 1, 2, 3, 4, 5 или 6;
р равно нулю, 1, 2, 3 или 4;
q равно нулю, 1, 2, 3 или 4;
r равно нулю, 1,2,3,4 или 5;
R1 и R2 каждый независимо является водородом, С1-6алкилом, С1-6алкилкарбонилом; галогенметилкарбонилом; гидроксизамещенным С1-6алкилом, С1-6алкилоксигруппой, карбоксилом, С1-6алкилкарбонилокси, С1-6алкилоксикарбонилом или арилом; или
R1 и R2, взятые вместе с атомом азота, к которому они присоединены, могут образовывать морфолиниловое кольцо или радикал формулы
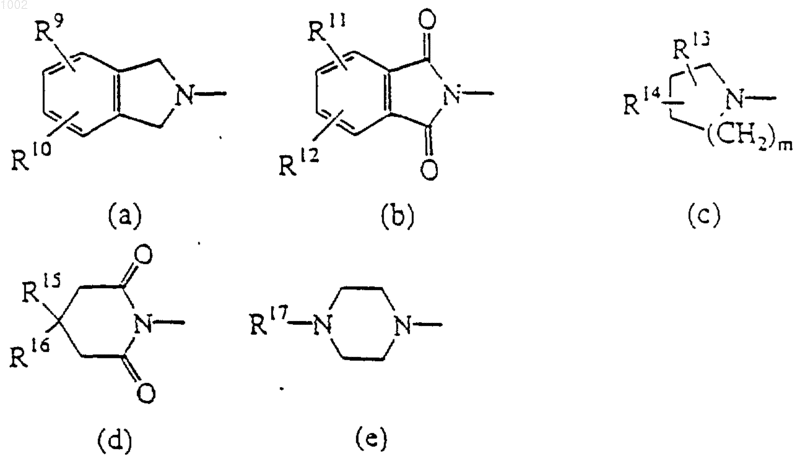
где R9, R10, R11 и R12, каждый независимо, является водородом, галогеном, галогенметилом или C1-6алкилом;
m равно нулю, 1, 2 или 3;
R13, R14, R15 и R16, каждый независимо, является водородом, С1-6алкилом, арилом или арилкарбонилом; или
R15 и R16, взятые вместе, могут образовывать двухвалентный радикал С4-5алкандиил;
R17 является водородом, C1-6алкилом, С1-6алкилкарбонилом; галогенметилкарбонилом, С1-6алкилоксикарбонилом, арилом, ди(арил)метилом, гидроксизамещенным С1-6алкилом, C1-6алкилокси, карбоксилом, С1-6алкилкарбонилокси, С1-6алкилоксикарбонилом или арилом;
каждый R3 независимо является галогеном, циано, гидроксилом, галогенметилом, галогенметокси, карбоксилом, нитро, амино, моно- или ди(C1-6алкил)аминогруппой, С1-6 алкилкарбониламиногруппой, аминосульфонилом, моно- или ди(С1-6алкил)аминосульфонилом, C1-6алкилом, С1-6алкилокси, С1-6 алкилкарбонилом, С1-6алкилоксикарбонилом;
каждый R4 независимо является галогеном, циано, гидроксилом, галогенметилом, галогенметокси, карбоксилом, нитро, амино, моно- или ди(С1-6алкил)аминогруппой, C1-6 алкилкарбониламиногруппой, аминосульфонилом, моно- или ди(С1-6 алкил)аминосульфонилом, С1-6алкилом, C1-6алкилокси, С1-6 алкилкарбонилом, С1-6алкилоксикарбокилом;
каждый R5 независимо является C1-6алкилом, циано группой или галогенметилом;
Х является СR6R7, NR8, О, S, S(=O) или S(=O)2;
где R6 и R7, каждый независимо, является водородом, гидроксилом, С1-6алкилом, галогенметилом, C1-6алкилокси, или
R6 и R7, взятые вместе, могут образовывать метилен, моно- или ди(циано)метилен, двухвалентный радикал формулы -(СH2)2-, -(СH2)3-, -(СH2)4-, -(СН2)5-, -О-(СH2)2-O-, -O-(СН2)3-O-, или вместе с атомом углерода, к которому они присоединены, образуют карбонил;
R8 является водородом, C1-6алкилом, С1-6алкилкарбонилом, арилкарбонилом, арилС1-6алкилкарбонилом, C1-6алкилсульфонилом, арилсульфонилом или арилС1-6алкилсульфонилом;
арил является фенилом или фенилом, замещенным 1, 2 или 3 заместителями, выбранными из галогена, гидроксила, C1-6алкила или галогенметила;
при условии, что соединение не является (а) 3,3а,8,12b-тетрагидро-N-метил-2Н-дибензо[3,4:6,7]циклогепта[1,2-b]фуран-2-метанамином и (b) (+ )-3,3а,8,12b-тетрагидро-N-метил-2Н-дибензо[3,4:6,7]циклогепта[1,2-b]фуран-2-метанамином щавелевой кислоты.
2. Соединение по п.1, где R13, R14, R15 и R16, каждый независимо, является водородом или C1-6алкилом.
3. Соединение по любому из пп.1-2, где Х является CR6R7 или О.
4. Соединение по любому из пп.1-3, где R1 и R2 оба являются C1-6алкилом или R1 и R2, взятые вместе с атомом азота, к которому они присоединены, образуют морфолиниловое кольцо; радикал формулы (с) или радикал формулы (е).
5. Соединение по любому из пп.1-4, где заместители у атомов углерода 3а и 12b имеют транс-конфигурацию.
6. Соединение по любому из пп.1-5, где r, р и q равны нулю.
7. Соединение по любому из пп.1-6, где р равно 1, R3 является галогеном, C1-6алкилом или С1-6алкилоксилом.
8. Соединение по любому из пп.1-6, где q равно 1, R4 является галогеном, C1-6алкилом или C1-6алкилокси.
9. Соединение по п.1, представляющее собой 3,3а,8,12b-тетрагидро-N,N-диметил-2Н-дибензо[3,4:6,7]циклогепта[1,2-b]фуран-2-метанамин, его стереохимически изомерную форму или фармацевтически приемлемую аддитивную соль или его N-оксидную форму.
10. Композиция, включающая фармацевтически приемлемый носитель и терапевтически эффективное количество соединения по любому из пп.1-9.
11. Применение соединение по любому из пп.1-9 для лечения или профилактики расстройств центральной нервной системы.
12. Способ получения соединения по п.1, отличающийся тем, что промежуточный продукт формулы (II) подвергают N-алкилированию промежуточным продуктом формулы (III)
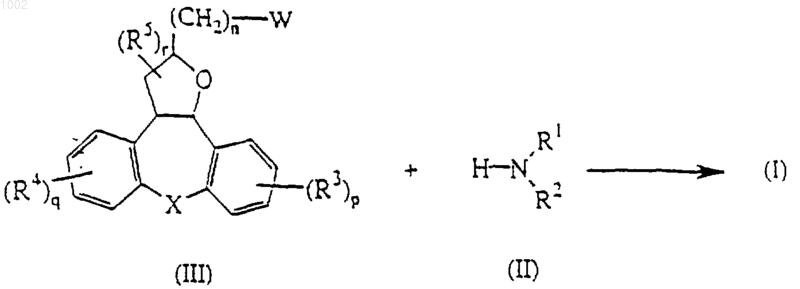
где в промежуточных продуктах (II) и (III) радикалы с R1 по R5, n, р, q, и r, а также Х определены как в п.1, W является подходящей удаляемой группой в инертном растворителе и необязательно в присутствии подходящего основания.
13. Способ по п.12, отличающийся тем, что превращают одно полученное соединение в другое с использованием известных из уровня техники реакций взаимных превращений, и далее, если требуется, превращают соединения формулы (I) в терапевтически активные нетоксичные аддитивные соли кислот путем обработки кислотой или в терапевтически активные нетоксичные аддитивные соли оснований путем обработки основанием или наоборот: превращают аддитивную соль кислоты в свободное основание путем обработки щелочью или аддитивную соль основания превращают в свободную кислоту путем обработки кислотой; если требуется, получают их стереохимически изомерные формы или формы N-оксидов.
Текст
1 Данное изобретение относится к замещенным тетрациклическим производным тетрагидрофурана, обладающим антипсихотической,сердечно-сосудистой и гастрокинетической активностью, и их получению; оно также касается включающих их композиций, равно как и их применение в медицине. В статье Monkovic et al. (J.Med.Chem.[3,4:6,7]-циклогепта[1,2-b]фуран-2-метанамина щавелевой кислоты. Указанное соединение было синтезировано как потенциальный антидепрессант, однако было установлено, что именно это производное тетрагидрофурфуриламина не проявляло активности в качестве антидепрессанта при дозировке 300 мг/кг. Соединения подобного строения описаны в пат. США 4.145 434, опубл. 20 марта 1979 г. и включают производные дибензо(циклогепта-,оксепино-, тиепино-)пирролидина, а также производные дибензопирролидиноазепина, имеющие ЦНС-депрессантную, антигистаминную и антисеротонинную активность. Данные соединения структурно различаются между собой наличием тетрагидрофуранового кольца вместо пирролидинового кольца и обладают ценными фармакологическими свойствами, в частности,они подавляют эффекты, индуцированные мХФП (метахлорфенилпиперазином) у крыс. Данное изобретение касается соединений формулы (I) их N-оксидных форм, фармацевтически приемлемых аддитивных солей и стереохимически изомерных форм,где n равно нулю, 1, 2, 3, 4, 5 или 6; р равно нулю, 1, 2, 3 или 4;R1 и R2 каждый независимо является водородом, C1-6 алкилом, C1-6 алкилкарбонилом; галогенметилкарбонилом,гидроксизамещеннымC1-6 алкилом, C1-6 алкилокси, карбоксилом, C1-6 алкилкарбонилокси, C1-6 алкилоксикарбонилом или арилом; или R1 и R2, взятые вместе с атомом азота, к которому они присоединены, могут образовать морфолиниловое кольцо или радикал формулы где R9, R10, R11 и R12 каждый независимо является водородом, галогеном, галогенметилом илиR13, R14, R15 и R16 каждый независимо является водородом, C1-6 алкилом, арилом или арилкарбонилом;R15 и R16, взятые вместе, могут образовывать двухвалентный радикал С 4-5 алкандиил;S(=O)2; где R6 и R7 каждый независимо является водородом, гидроксилом, галогенметилом, C1-6 алкилокси, или R6 и R7, взятые вместе, могут образовывать метилен, моно- или ди(циано) метилен, двухвалентный радикал формулыR8 является водородом, C1-6 алкилом, C1-6 алкилкарбонилом, арилкарбонилом, арилС 1-6 алкилкарбонилом, C1-6 алкилсульфонилом, арилсульфонилом или арилС 1-6 алкилсульфонилом; арил является фенилом, или фенилом, замещенным 1, 2 или 3 заместителями, выбран 3 ными из галогена, гидроксила, C1-6 алкила или галогенметила; при условии, что соединение является отличным от -3,3 а,8,12b-тетрагидроN-метил-2 Н-дибензо[3,4:6,7]-циклогепта[1,2-b] фуран-2-метанамина щавелевой кислоты. В предшествующих определениях C1-6 алкил обозначает насыщенные углеводородные радикалы с нормальной или разветвленной цепью, имеющие от 1 до 6 атомов углерода, такие как, например, метил, этил, пропил, бутил,1-метилпропил, 1,1-диметилэтил, пентил, гексил; С 4-5 алкандиил обозначает двухвалентные насыщенные углеводородные радикалы с нормальной или разветвленной цепью, имеющие от 4 до 5 атомов углерода, такие как, например,1,4-бутандиил, 1,5-пентандиил; галоген обозначает фтор, хлор, бром или йод. Термин моноцианометилен относится к радикалу формулы=CHCN, а дицианометилен - к радикалу формулы =C(CN)2. Термин галогенметил включает моно-, ди- и тригалогенметил. Примерами галогенметила являются фторметил, дифторметил и особенно трифторметил. В случае, когда R6 иR7, взятые вместе, образуют двухвалентный радикал формулы -(СН 2)2-, -(СН 2)3-, -(СН 2)4-,-(СН 2)5-, -O-(СН 2)2-O- или -О-(СН 2)3-О-, соединения формулы (I) являются спиросоединениями. Фармацевтически приемлемые аддитивные соли, упомянутые здесь ранее, включают терапевтически активное нетоксичное основание и формы аддитивных солей кислот, которые способны образовывать соединения формулы (I). Форма аддитивной соли кислоты соединения формулы (I), которое существует в своем свободном виде как основание, может быть получена обработкой свободного основания соединения формулы (I) подходящей кислотой, такой как неорганическая кислота, например, галогеноводородная кислота, т.е. хлороводородная или бромоводородная, серная, азотная, фосфорная или подобные кислоты, или органической кислотой, такой как, например, уксусная, гидроксиуксусная, пропановая, молочная, пировиноградная, щавелевая, малоновая, янтарная, малеиновая, фумаровая, яблочная, винная, лимонная, метансульфоновая, этансульфоновая, бензолсульфоновая, п-толуолсульфоновая, цикламовая, салициловая, п-аминосалициловая, памовая или подобные кислоты. Соединения формулы (I), содержащие кислые протоны, могут быть превращены в их терапевтически активные нетоксичные основания,т.е. формы аддитивных солей металлов или аминов, путем обработки подходящими органическими или неорганическими основаниями. Формы подходящих солей оснований включают, например, соли аммония, щелочных и щелочно-земельных металлов, например, соли лития, натрия, калия, магния, кальция и тому подобные, соли органических оснований, например, соли бензатина, N-метил-D-глюкамина, 001002 4 гидрабамина, и соли аминокислот, таких как,например, аргинин, лизин и тому подобные. Наоборот, указанные солевые формы могут быть превращены в свободные формы обработкой подходящим основанием или кислотой. Термин аддитивная соль, использованный здесь ранее, включает также сольваты, которые способны образовывать соединения формулы (I), равно как и их соли. Такими сольватами являются, например, гидраты, алкоголяты и тому подобные. Формы N-оксидов соединений формулы (I) включают такие соединения формулы (I), в которых один или несколько атомов азота окислены в так называемый N-оксид, преимущественно такие N-оксиды, в которых азот, имеющий заместители R1 и R2, окислен в N-оксид. Термин стереохимически изомерные формы, используемый здесь и далее, определяет все возможные изомерные формы, в которых может встречаться соединение формулы (I). Если обратное не упомянуто или не обозначено,химическая запись соединений означает смесь, а в особенности рацемическую смесь, всех возможных стереохимически изомерных форм,указанная смесь содержит все диастереомеры и энантиомеры основной молекулярной структуры. Стереохимически изомерные формы соединений формулы (I) и смеси таких форм охватываются формулой (I). Нумерация тетрациклической системы,присутствующей в формуле (I), согласно принятой в Chemical Abstracts номенклатуре, приведена в формуле (I) Соединения формулы (I) имеют, по меньшей мере, три асимметрических центра, а именно: атом углерода 2, атом углерода 3 а и атом углерода 12b. Указанные асимметрические центры и любой другой имеющийся асимметрический центр характеризуется обозначениями R иS. Если в соединении формулы (I) присутствует моноцианометиленовый остаток, то указанный остаток может иметь Е- или Zконфигурацию. Заместители у атомов углерода 3 а и 12b,т.е. водород или R5, могут иметь цис- или трансконфигурацию. При определении указанной цис- или транс-конфигурации атомы углерода 3b и 12 а не рассматриваются как заместители,поскольку они оба являются частью той же самой циклической системы. При установлении конфигурации атомов углерода 3 а и 12b замес 5 титель у атома углерода 3 а и заместитель у атома углерода 12b принимаются во внимание. Они могут быть по одну сторону главной плоскости,определяемой тетрагидрофуранильным циклом,тогда их конфигурация обозначается как цис-,иначе конфигурация обозначается как транс-. Предпочтительно, чтобы оба заместителя у атомов углерода 3 а и 12b были атомами водорода и каждый находился бы на противоположной стороне главной плоскости, определяемой тетрагидрофуранильным циклом, т.е. чтобы они имели транс-конфигурацию. Используемый здесь и далее термин соединения формулы (I) включает также фармацевтически приемлемые аддитивные соли, стереоизомерные формы, а также формы N-оксида. Особая группа соединений включает соединения формулы (I), в которых R13, R14, R15 иR16 каждый независимо являются атомами водорода или C1-6 алкилами. Соединения формулы (I), отличные от 3,3 а,8,12b-тетрагидро-N-метил-2 Н-дибензо[3,4:6,7]-циклогепта[1,2-b]фуран-2-метанамина,представляют особый интерес. Интересными являются соединения формулы (I), у которых оба R1 и R2 являются C1-6 алкилами. Другими интересными соединениями являются такие соединения формулы (I), у которых R1 и R2, взятые вместе с атомом азота, к которому они присоединены, образуют морфолинильное кольцо, радикал формулы (с), в частности, радикал формулы (с), в котором m равно 2, R13 является водородом, а R14 является арилом или арилкарбонилом, или радикал формулыR17 является арилом, C1-6 алкилом или гидроксиС 1-6 алкилом. Еще одними интересными соединениями являются соединения формулы (I), в которых Х является CR6R7 или О. Особыми соединениями являются те соединения формулы (I), в которых оба R1 и R2 являются метилами, а n равно 1. Также особыми соединениями являются те соединения формулы (I), для которых р равно 1,a R3 является галогеном, C1-6 алкилом или C1-6 алкокси, особенно галогеном. Другими особыми соединениями являются те соединения формулы (I), для которых q равно 1, а R4 является галогеном, C1-6 алкилом или C1-6 алкокси, особенно галогеном. Иными особыми соединениями являются те соединения формулы (I), для которых р, q и r равны нулю. Предпочтительными соединениями являются те особые соединения, для которых r равно нулю, а атомы водорода при атомах углерода 3 а и 12b имеют транс-конфигурацию. Наиболее предпочтительными являются: 3,3 а,8,12b-тетрагидро-N,N-диметил-2 Ндибензо[3,4:6,7]циклогепта[1,2-b]фуран-2 001002 6 метанамин, его стереоизомерные формы, фармацевтически приемлемые аддитивные соли и формы N-оксида, более конкретно - те изомерные формы, в которых атомы водорода при атомах углерода 3 а и 12b имеют трансконфигурацию. Соединения формулы (I) в общем случае могут быть получены N-алкилированием промежуточного продукта формулы (II) промежуточным продуктом формулы (III), где W является хорошей уходящей группой, такой как галоген. В промежуточных продуктах (II) и (III) радикалы с R1 по R5, n, p, q и r, а также Х определены как для соединений формулы (I). Указанное N-алкилирование может быть соответствующим образом проведено в инертном растворителе, таком как, например, метанол, метилизобутилкетон, N,N-диметилформамид или диметилсульфоксид, и необязательно в присутствии подходящего основания. Перемешивание и повышенная температура, например, температура кипения растворителя, могут увеличивать скорость реакции. Альтернативно, указанное Nалкилирование также может быть выполнено с использованием способа, описанного Monkovic Соединения формулы (I) могут также быть превращены одно в другое с использованием известных из уровня техники реакций взаимных превращений. Например,а) соединение формулы (I), где R1 и R2,взятые вместе с атомом азота, к которому они присоединены, образуют радикал формулы (b),может быть превращено в соответствующий первичный амин путем обработки гидразином или водной щелочью; б) соединения формулы (I), где R1 или R2 является трифторметилкарбонилом, может быть превращено в соответствующий первичный или вторичный амин путем гидролиза водной щелочью; в) соединение формулы (I), где R1 или R2 является C1-6 алкилом, замещенным C1-6 алкилкарбонилокси, может быть гидролизовано до соединения формулы (I), в котором R1 или R2 является C1-6 алкилом, замещенным гидроксилом; г) соединение формулы (I), где оба R1 и R2 являются атомами водорода, может быть моноили ди-N-алкилировано до соответствующей формы амина;C1-6 алкилоксикарбонильную группу, может быть гидролизовано до соответствующей карбоновой кислоты. Кроме того, соединения формулы (I), в которых Х иной, чем S, могут быть превращены в соответствующие формы N-оксида с использованием известных из уровня техники способов превращения трехвалентного азота в форму егоN-оксида. В общем случае указанная реакция Nокисления может быть выполнена при взаимодействии исходного вещества формулы (I), с подходящим органическим или неорганическим пероксидом. Подходящие неорганические пероксиды включают, например, пероксид водорода, пероксиды щелочных или щелочноземельных металлов, например пероксид натрия, пероксид калия; подходящие органические пероксиды могут включать, например, надкислоты, такие как, например, надбензойная кислота, или галогензамещенная надбензойная кислота, например 3-хлорнадбензойная кислота,жирные надкислоты, например надуксусную кислоту, алкилгидропероксиды, например третбутилгидропероксид. Подходящими растворителями являются, например, вода, низшие спирты, например этанол и другие, углеводороды,например толуол, кетоны, например 2-бутанон,галогенированные углеводороды, например дихлорметан, и смеси таких растворителей. Чистые стереохимически изомерные формы соединений формулы (I) могут быть получены с применением известных из уровня техники способов. Диастереомеры могут быть разделены физическими методами, такими как селективная кристаллизация и хроматографические методики, например противоточное распределение или жидкостная хроматография и тому подобные. Соединения формулы (I), полученные описанными выше способами, обычно являются рацемическими смесями энантиомеров, которые могут быть отделены один от другого с применением известных из уровня техники способов. Рацемические соединения формулы (I), имеющие выраженный основный или кислотный характер, могут быть превращены в формы соответствующих диастереомерных солей взаимодействием соответственно с подходящей хиральной кислотой или с подходящим хиральным основанием. Указанные формы диастереомерных солей в дальнейшем разделяют, например,селективной или фракционной кристаллизацией и выделяют из них свободные энантиомеры действием щелочи или кислоты. Альтернативный способ разделения энантиомерных форм соединений формулы (I) включает жидкостную хроматографию с использованием хиральной неподвижной фазы. Указанные чистые стереохимически изомерные формы могут также быть 8 получены из соответствующих чистых стереоизомерных форм подходящих исходных веществ в том случае, если реакция протекает стереоспецифически. Предпочтительно, если требуется специфический стереоизомер, то указанное соединение следует синтезировать с использованием стереоспецифического способа получения. Эти методы используют преимущественно энантиомерно чистые исходные вещества. Указанные выше промежуточные продукты являются промышленно выпускаемыми, либо могут быть получены способами, известными из уровня техники. Например, промежуточные продукты формулы (III) могут быть синтезированы согласно способу, описанному Monkovic etal. (J.Med.Chem. (1973), 16(4), р. 403-407). Альтернативно, промежуточные продукты формулы (III), в которых n равно 1, а r равно нулю, представленные формулой (III-а), могут также быть получены взаимодействием эпоксипроизводного формулы (IV) с реактивом Гриньяра формулы (V), где Х является галогеном,приводящим к образованию промежуточных продуктов формулы (VI), которые затем могут быть циклизованы согласно способам, известным из уровня техники, один из которых описан Эпоксиды формулы (IV) могут быть получены с использованием способов, известных из уровня техники, таких как пероксидирование промежуточного продукта формулы (VII) подходящим пероксидом,таким как мхлорнадбензойная кислота. Соединения по данному изобретению проявляют сродство к 5-НТ 2-рецепторам, в частности к 5-НТ 2A- и 5-НТ 2C-рецепторам (номенклатура согласно D.Hoyer in "Serotonin (5-HT) inFerrari, publ. in 1994 by the Boerhaave Commission of the University of Leiden). Свойства данных соединений как антагонистов серотонина могут быть показаны на примере их ингибирующего эффекта в Пробе с 5-гидрокситриптофаном на крысах, которая описана вDrug Dev. Res., 13, 237-244 (1988). Кроме того,соединения по настоящему изобретению проявляют интересную фармакологическую активность в Пробе с мХФП на крысах, которая описана в Combined Apomorphine, Tryptamine, 9Pharmacodyn, 227, 238-253 (1977). Соединения по данному изобретению имеют благоприятные физико-химические свойства. Например, они являются устойчивыми соединениями. Ввиду своих фармакологических и физикохимических свойств, соединения формулы (I) используются в качестве терапевтических средств для лечения или профилактики расстройств центральной нервной системы, таких как страх, депрессия, биполярные расстройства,расстройства сна и сексуальные расстройства,психоз, психоз пограничных состояний, шизофрения, мигрень, расстройства личности или навязчиво-компульсивные расстройства, социальные фобии или приступы паники, органические расстройства мышления, расстройства мышления у детей, агрессия, расстройства памяти и внимания у пожилых людей, наркомания и алкоголизм, ожирение, булимия и иных подобных расстройств. В частности данные соединения могут использоваться как антифобические седативные средства (анксиолитики), противопсихозные средства, антидепрессанты, средства против мигрени, а также в качестве средств,способных устранять привыкание вследствие злоупотребления лекарствами (токсикомания). Соединения формулы (1) также могут использоваться в качестве терапевтических средств при лечении двигательных расстройств. Может быть полезным применение данных соединений в сочетании с классическими терапевтическими средствами против таких расстройств. Соединения формулы (I) также могут служить для лечения или профилактики поражения нервной системы, вызванного травмой, припадком, нейродегенеративными заболеваниями и тому подобным, сердечно-сосудистых расстройств, таких как повышенное кровяное давление, тромбоз, сердечный приступ и тому подобных и желудочно-кишечных расстройств,таких как дисфункции перистальтики желудочно-кишечной системы и тому подобных. Ввиду вышеуказанных применений соединений формулы (I), данное изобретение также предоставляет способ лечения теплокровных животных, страдающих такими заболеваниями; указанный способ включает систематическое введение терапевтического количества соединения формулы (I), эффективного при лечении вышеназванных нарушений, в частности, для лечения страха, психоза, депрессии, мигрени и привыкания вследствие злоупотребления лекарствами (токсикомания). Настоящее изобретение направлено также на соединения формулы (I), как указано выше,для использования в медицине, в частности,соединения формулы (I) могут быть использованы для производства медикаментов для лечения страха, психозов, депрессий, мигрени и 10 привыкания вследствие злоупотребления лекарствами (токсикомания). Специалисты в области лечения таких заболеваний могут определить эффективное терапевтическое ежедневное количество по результатам проб, представленных ниже. Эффективное терапевтическое ежедневное количество следует определять от 0,01 до 10 мг/кг живого веса, более предпочтительно от 0,05 до 1 мг/кг живого веса. Для облегчения приема указанные соединения могут выпускаться в различных фармацевтических формах. Для приготовления фармацевтических композиций по данному изобретению терапевтически эффективное количество требуемого соединения в качестве активного ингредиента, необязательно в форме аддитивной соли, смешивают с фармацевтически приемлемым носителем до получения тонкой смеси, которая может иметь большое разнообразие форм в зависимости от требуемой для введения формы препарата. Предпочтительно эти фармацевтические композиции выпускаются в раздельных дозированных формах, подходящих,предпочтительно, для перорального, ректального, чрескожного введения или парентеральной инъекции. Например, для приготовления композиций в пероральных дозированных формах могут использоваться любые обычные фармацевтические среды, такие как, например, вода,гликоли, масла, спирты и тому подобные, в случае жидких препаратов, таких как суспензии,сиропы, эликсиры и растворы; или твердые носители, такие как крахмалы, сахара, каолин, замасливатели, связующие, антиагреганты и тому подобные, в случае порошков, пилюль, капсул и таблеток. Из-за легкости приема таблетки и капсулы представляют наиболее предпочтительную пероральную раздельную дозированную форму,для приготовления которой, очевидно, используются твердые носители. В носителе для парентеральных композиций, по крайней мере,обычно большую часть составляет стерильная вода, хотя могут вводиться и другие ингредиенты, например, для повышения растворимости. Растворы для инъекций могут быть приготовлены, например, на носителе, включающем солевой раствор, раствор глюкозы или смесь солевого раствора и раствора глюкозы. Растворы для инъекций, содержащие соединения формулы (I),могут быть приготовлены на масляной основе для продолжительного воздействия. Например,подходящими для этого маслами являются арахисовое масло, кунжутное масло, хлопковое масло, кукурузное масло, масло из соевых бобов, синтетические эфиры глицерина и жирных кислот с длинными цепями, а также смеси этих и других масел. Растворы для инъекций также могут быть приготовлены с использованием подходящих жидких носителей, суспендирующих агентов и тому подобного. В композициях для чрескожного введения носитель необяза 11 тельно включает агент, ускоряющий проникновение и/или подходящий смачиватель, необязательно в смеси с подходящими добавками разной природы в меньших количествах; данные добавки не должны оказывать любые вредные воздействия на кожу. Указанные добавки могут облегчать введение через кожу и/или могут использоваться для приготовления требуемых композиций. Эти композиции могут вводиться различными путями, например, в виде подкожных имплантантов, пластырей или мазей. Благодаря своей большей растворимости в воде по сравнению с соответствующими формами оснований или кислот, аддитивные соли кислот или оснований соединений формулы (I) более подходят для приготовления водных композиций. Для увеличения растворимости и/или устойчивости соединений формулы (I) в фармацевтических композициях может быть полезным использование -, - или -циклодекстринов или их производных, в частности гидроксиалкилзамещенных циклодекстринов,например, 2-гидроксипропилциклодекстрина. Сорастворители, такие как спирты, могут увеличивать растворимость и/или устойчивость соединений формулы (I) в фармацевтических композициях. Может быть особенно полезным готовить вышеупомянутые фармацевтические композиции в раздельных дозированных формах для облегчения введения и единообразия дозировки. Понятие раздельные дозированные формы,используемое в описании и формуле изобретения, обозначает физически дискретные единицы, используемые в качестве единичных доз,каждая из которых содержит изначально определенное количество активного ингредиента,рассчитанное таким образом, чтобы производить требуемый терапевтический эффект, в сочетании с требуемым фармацевтическим носителем. Примерами таких раздельных дозированных форм являются таблетки (включая таблетки с засечками и таблетки, покрытые оболочкой), капсулы, пилюли, пакеты с порошком,пастилки, растворы или суспензии для инъекций, чайные ложки, столовые ложки и тому подобное и различные их множества. Следующие примеры иллюстрируют данное изобретение, не ограничивая его. Экспериментальная часть А. Получение промежуточных соединений. Пример A.1. а) К смеси 0,054 моль дибенз[bf]оксепин 10(11 Н)-она, полученного согласно способу,описанному в C.R. Acad.Sc.Paris, Serie С 1976,283(15), 683-6, и 0,054 моль трет-бутилата калия в 100 мл трет-бутанола по каплям прибавляют 0,054 моль 3-бромпропена и перемешивают при комнатной температуре в токе N2. Полученную реакционную смесь перемешивают 2 ч при 80 С, а затем охлаждают до комнатной темпера 001002 12 туры. Упаривают растворитель. Остаток разделяют водой и этилацетатом. Органический слой отделяют, сушат, фильтруют и упаривают растворитель. Остаток очищают ВЭЖХ на колонкеLiChroprep (элюент:гексан:этилацетат 98:2). Собирают фракции чистого вещества и упаривают растворитель. Получают 4,5 г (32%) 11-(2-пропенил)-дибенз[bf]оксепин-10(11 Н)-онаb) В 40 мл этанола растворяют 0,007 моль промежуточного продукта 1 и 0,0033 моль боргидрида натрия. Реакционную смесь перемешивают 4 ч при 60 С, а затем охлаждают до комнатной температуры. Реакционную смесь концентрируют и охлаждают в бане с тающим льдом. Реакцию завершают, разбавляя смесь водой, полученную смесь экстрагируют этилацетатом. Органический слой отделяют, сушат,фильтруют и упаривают растворитель. Остаток очищают ВЭЖХ на колонке LiChroprep (элюент:гексан:этилацетат 90:10). Собирают фракции чистого вещества и упаривают растворитель. Получают 0,85 г (50%) -10,11-дигидро 11-(2-пропенил)дибенз[bf]оксепин-10-ола (промежуточный продукт 2).c) В 40 мл четыреххлористого углерода растворяют 0,0047 моль промежуточного продукта 2 и 0,0047 моль пиридина и раствор охлаждают до 0 С. Прибавляют 0,0047 моль брома,полученную реакционную смесь перемешивают 2 ч при комнатной температуре. Смесь промывают водой. Органический слой отделяют, сушат, фильтруют и упаривают растворитель. Остаток отверждают промывкой диизопропиловым эфиром и высушивают. Получают 0,4 г (25%) -2-(бромометил)-2,3,3 а,12bтетрагидро-дибензо[bf]фуро[2,3-d]оксепина(промежуточный продукт 3). Пример А.2. а) В 15 мл тетрагидрофурана растворяют 1 г 1 а,10b-дигидро-6 Н-дибензо[3,4:6,7]циклогепт[1,2-b]оксирена и охлаждают до 0 С в атмосфере азота. К смеси по каплям прибавляют 5,2.мл 1 М раствора 2-пропенил-магнийбромида в тетрагидрофуране и перемешивают при комнатной температуре, а затем еще 2 ч при 60 С. Смесь охлаждают до комнатной температуры и разбавляют 10%-ым NH4Cl и водой, сушат и упаривают растворитель. Получают 0,5 г (48%) 10,11-дигидро-11-(2-пропенил)-5 Н-дибензо[a,d] циклогептен-10-ола (промежуточный продукт 4).b) К раствору 0,5 г промежуточного продукта 4 в 15 мл СНСl3 порциями прибавляют 0,63 г пиридинийтрибромида. Смесь перемешивают 1 ч при -10 С, а затем дают ей нагреться до комнатной температуры. Смесь перемешивают еще час, а затем промывают водой, экстрагируют, сушат и упаривают растворитель. Получают 0,42 г (65%) -2-(бромометил)3,3 а,8,12b-тетрагидро-2 Н-дибензо[3,4:6,7]циклогепта[1,2-b]фурана промежуточный продукт 5). 13 В. Получение соединений формулы (I). Все полученные соединения являются смесями изомерных форм, в которых заместители у атомов углерода 3 а и 12b имеют транс-конфигурацию, если обратное не указано. Пример B.1. Смесь 0,0012 моль промежуточного продукта 3 в 60 мл диметилсульфоксида и 30 мл хлороформа при перемешивании охлаждают до 0 С. В течение 15 мин через смесь барботируют газообразный диметиламин. Реакционную смесь перемешивают 24 ч при 65 С в автоклаве Парра. Реакционную смесь охлаждают до комнатной температуры и концентрируют, промывают водой и экстрагируют диэтиловым эфиром. Органический слой отделяют, сушат, фильтруют и упаривают растворитель. Остаток очищают ВЭЖХ на колонке LiChroprep (элюент: CH2Cl2: СН 3 ОН 95:5). Собирают фракции чистого вещества и упаривают растворитель. Получают 0,14 г(39%) -2,3,3 а,12b-тетрагидро-N,N-диметилдибензо[bf]фуро[2,3-d]оксепин-2-метанамина (соединение 1). Пример В.2. Смесь 0,0045 моль промежуточного продукта 5 и 0,0090 моль 1-(2-гидроксиэтил) пиперазина перемешивают 2 ч при 120 С. Смесь охлаждают до комнатной температуры и выливают в СН 2 Сl2, фильтруют и фильтрат упаривают. Остаток очищают ВЭЖХ на LiChroprep(элюент: CH2Cl2: СН 3 ОН, насыщ. NH3 96:4). Собирают фракции чистого вещества и упаривают растворитель. Остаток превращают в солянокислую соль (1:2). Осадок отфильтровывают и высушивают. Получают 0,73 г (37%) дигидрохлорида-4-[(3,3 а,8,12b-тетрагидро-2 Ндибензо[3,4:6,7]циклогепта[1,2-b]фуран-2-ил) метил]-1-пиперазинэтанола (соединение 3). Пример В.3. Смесь 0,030 моль промежуточного продукта 5 и 150 мл 2 М раствора диметиламина в тетрагидрофуране разбавляют 100 мл тетрагидрофурана и при 65 С оставляют на ночь, при перемешивании в автоклаве Парра. Реакционную смесь охлаждают до комнатной температуры и фильтруют. Фильтрат упаривают. Остаток очищают ВЭЖХ на LiChroprep (элюент СН 2 Сl2: СН 3 ОН/(NH3, газ.) 98:2). Собирают фракции чистого вещества и упаривают растворитель. Остаток превращают в солянокислую соль (1:1). Осадок отфильтровывают и высушивают. Получают 0,8 г (8%) гидрохлорида -3,3 а,8,12bтетрагидро-N,N-диметил-2 Н-дибензо[3,4:6,7] циклогепта[1,2-b]фуран-2-метанамина (1:1) (соединение 4, т. пл. 237 С). При разделении соединения 4 получают четыре чистые энантиомерные формы, т.е. изомерные формы [2R(2,3a,12b], [2R(2,3a,12b], [2S(2,3 а,12b)] и [2S(2,3a,12b)].(I), полученные согласно одному из вышеприведенных примеров. Таблица 1 С.Фармакологические примеры. Пример C.1: Проба с мХФП на крысах. Крысам вводят исследуемое соединение в дозировке, меняющейся от 0,0025 до 40 мг/кг веса тела за 1 ч до времени проведения пробы(метахлорфенилпиперазина) за 15 мин до пробы. По истечении времени Т крыс подвергаютDev. Res. 18, 119-144 (1989), но вместо источника света Kleverlux (12 В/20 Вт) используют инфракрасный источник. Доза, при которой у 40% тестируемых крыс наблюдается подавление эффектов, индуцированных мХФП, т.е. мХФПантагонизм, считается активной дозой. Соединения 1, 2, 4 и 9 активны при тестовой дозе 2,5 мг/кг или менее. Пример С.9: Способность к связыванию для 5-HT2A и 5-НТ 2 С рецепторов in vitro. Взаимодействие соединений формулы (I) с 5-НТ 2A и 5-НТ 2C рецепторами было оценено invitro при проведении радиолигандных экспериментов. Обычно радиолиганд с высокой способностью к связыванию с рецептором, взятый в малой концентрации, выдерживают с образцом препарата ткани (от 1 до 5 мг ткани), богатым данным рецептором, в буферной среде (от 0,2 до 5 мл). В течение выдержки радиолиганд связывается с рецептором. По достижении равновесия связывания рецепторно-связанную радиоактивность отделяют от несвязанной радиоактивно 15 сти, а рецепторно-связанная радиоактивность подсчитывается. Взаимодействие тестируемых соединений с рецепторами оценивают по опытам конкурирующего связывания. Различные концентрации тестируемого соединения прибавляют к выдерживаемой смеси, содержащей препарат ткани и радиолиганд. Связывание радиолиганда ингибируется тестируемым соединением пропорционально его способности к связыванию и его концентрации. В качестве радиолиганда для исследования способности к связыванию с 5-НТ 2A использовался 3H-кетансерин, а в качестве ткани применялся лобный наружный покров крыс. При тестовых концентрациях 10-7 М соединения 3, 4, 5, 8 и 9 ингибировали 5-НТ 2A рецептор более чем на 40%, а другие соединения давали ингибирование меньше чем 40%. В качестве радиолиганда для исследования способности к связыванию с 5-НТ 2C использовался 3H-мезулергин, а в качестве ткани применялась сосудистая оболочка глаза свиней. При тестовых концентрациях 10-7 М соединения 1, 3,4, 5, 6, 7, 8 и 9 ингибировали 5-НТ 2C рецептор более чем на 40%, а соединение 2 давало ингибирование меньше чем 40%.D. Примеры композиций. Понятие активный ингредиент (А.И.),используемое в данных примерах, относится к соединению формулы (I), фармацевтически приемлемой аддитивной соли кислоты, их стереохимически изомерным формам или их Nоксидным формам. Пример D.1: Пероральный раствор. В 4 л кипящей очищенной воды растворяют 9 г метил 4-гидроксибензоата и 1 г пропил-4 гидроксибензоата. В 3 л этого раствора сначала растворяют 10 г 2,3-дигидроксибутандионовой кислоты, а затем растворяют 20 г А.И. Последний раствор объединяют с оставшейся частью предшествующего раствора и прибавляют 12 л 1, 2, 3-пропантриола и 3 л 70%-ого раствора сорбита. В 500 мл воды растворяют 40 г натриевой соли сахарина и прибавляют по 2 мл малиновой и крыжовниковой эссенций. Последний раствор объединяют с предыдущим раствором,добавляют необходимое количество воды до объема 20 л. Получают пероральный раствор,содержащий 5 мг А.И. в чайной ложке (5 мл). Полученный раствор разливают в подходящую тару. Пример D.2: Таблетки, покрытые оболочкой. Получение ядра таблетки Хорошо смешивают 100 г А.И. с 570 г лактозы и 200 г крахмала, после чего смачивают раствором 5 г додецилсульфата и 10 г поливинилпирролидона в 200 мл воды. Влажную смесь порошков просеивают, высушивают и просеивают повторно. Добавляют 100 г микрокристаллической целлюлозы и 15 г гидрированного растительного масла. Все еще раз хорошо смеши 001002 16 вают и таблетируют. Получают 10 000 таблеток,содержащих 10 мг А.И. каждая. Покрытие оболочкой К раствору 10 г метилцеллюлозы в денатурированном этаноле 75 мл добавляют раствор 5 г этилцеллюлозы в 150 мл дихлорметана. Затем добавляют 75 мл дихлорметана и 2,5 мл 1,2,3 пропантриола. 10 г полиэтиленгликоля расплавляют и разбавляют в 75 мл дихлорметана. Последний раствор добавляют к предыдущему,затем добавляют 2,5 г октадеканоата магния, 5 г поливинилпирролидона и 30 мл концентрированной окрашивающей суспензии и все гомогенизируют. Ядра таблеток покрывают полученной таким образом смесью на специальном оборудовании. Пример D.3: Раствор для инъекций. В 500 мл кипящей воды для инъекций растворяют 1,8 г метил 4-гидроксибензоата и 0,2 г пропил-4-гидроксибензоата. После остывания примерно до 50 С при перемешивании туда прибавляют 4 г молочной кислоты, 0,05 г пропиленгликоля и 4 г А.И. Раствор охлаждают до комнатной температуры и добавляют необходимое количество воды для инъекций до объема 1000 мл. Получают раствор, содержащий 4 мг/мл А.И. Раствор стерилизуют фильтрацией и разливают в подходящую стерильную тару. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы его N-оксидная форма, фармацевтически приемлемая аддитивная соль или его стереохимически изомерная форма,где n равно нулю, 1, 2, 3, 4, 5 или 6; р равно нулю, 1, 2, 3 или 4;R1 и R2 каждый независимо является водородом, С 1-6 алкилом, С 1-6 алкилкарбонилом; галогенметилкарбонилом; гидроксизамещенным С 1-6 алкилом, С 1-6 алкилоксигруппой, карбоксилом, С 1-6 алкилкарбонилокси, С 1-6 алкилоксикарбонилом или арилом; илиR1 и R2, взятые вместе с атомом азота, к которому они присоединены, могут образовывать морфолиниловое кольцо или радикал формулыR15 и R16, взятые вместе, могут образовывать двухвалентный радикал С 4-5 алкандиил;R6 и R7, взятые вместе, могут образовывать метилен, моно- или ди(циано)метилен, двухвалентный радикал формулы -(СH2)2-, -(СH2)3-,-(СH2)4-, -(СН 2)5-, -О-(СH2)2-O-, -O-(СН 2)3-O-,или вместе с атомом углерода, к которому они присоединены, образуют карбонил;R8 является водородом, C1-6 алкилом, С 1-6 алкилкарбонилом,арилкарбонилом,арил С 1-6 алкилкарбонилом,C1-6 алкилсульфонилом,арилсульфонилом или арилС 1-6 алкилсульфонилом; арил является фенилом или фенилом, замещенным 1, 2 или 3 заместителями, выбранными из галогена, гидроксила, C1-6 алкила или 18 галогенметила; при условии, что соединение не является (а) 3,3 а,8,12b-тетрагидро-N-метил-2 Ндибензо[3,4:6,7]циклогепта[1,2-b]фуран-2 метанамином и (b) -3,3 а,8,12b-тетрагидро-Nметил-2 Н-дибензо[3,4:6,7]циклогепта[1,2-b] фуран-2-метанамином щавелевой кислоты. 2. Соединение по п.1, где R13, R14, R15 и R16,каждый независимо, является водородом илиC1-6 алкилом. 3. Соединение по любому из пп.1-2, где Х является CR6R7 или О. 4. Соединение по любому из пп.1-3, где R1 2 и R оба являются C1-6 алкилом или R1 и R2, взятые вместе с атомом азота, к которому они присоединены, образуют морфолиниловое кольцо; радикал формулы (с) или радикал формулы (е). 5. Соединение по любому из пп.1-4, где заместители у атомов углерода 3 а и 12b имеют транс-конфигурацию. 6. Соединение по любому из пп.1-5, где r, р и q равны нулю. 7. Соединение по любому из пп.1-6, где р равно 1, R3 является галогеном, C1-6 алкилом или С 1-6 алкилоксилом. 8. Соединение по любому из пп.1-6, где q равно 1, R4 является галогеном, C1-6 алкилом илиC1-6 алкилокси. 9. Соединение по п.1, представляющее собой 3,3 а,8,12b-тетрагидро-N,N-диметил-2 Ндибензо[3,4:6,7]циклогепта[1,2-b]фуран-2 метанамин, его стереохимически изомерную форму или фармацевтически приемлемую аддитивную соль, или его N-оксидную форму. 10. Композиция, включающая фармацевтически приемлемый носитель и терапевтически эффективное количество соединения по любому из пп.1-9. 11. Применение соединение по любому из пп.1-9 для лечения или профилактики расстройств центральной нервной системы. 12. Способ получения соединения по п.1,отличающийся тем, что промежуточный продукт формулыNалкилированию промежуточным продуктом формулы (III) где в промежуточных продуктах (II) и (III) радикалы с R1 по R5, n, р, q, и r, а также Х определены как в п.1, W является подходящей удаляемой группой в инертном растворителе и необязательно в присутствии подходящего основания. 13. Способ по п.12, отличающийся тем, что превращают одно полученное соединение в другое с использованием известных из уровня техники реакций взаимных превращений, и далее,если требуется, превращают соединения форму 19 лы (I) в терапевтически активные нетоксичные аддитивные соли кислот путем обработки кислотой или в терапевтически активные нетоксичные аддитивные соли оснований путем обработки основанием или наоборот: превращают аддитивную соль кислоты в свободное основа 20 ние путем обработки щелочью или аддитивную соль основания превращают в свободную кислоту путем обработки кислотой; если требуется, получают их стереохимически изомерные формы или формы N-оксидов.
МПК / Метки
МПК: A61P 25/00, C07D 493/04, C07D 307/93, A61K 31/34
Метки: замещенные, производные, тетрациклические, тетрагидрофурана
Код ссылки
<a href="https://eas.patents.su/11-1002-zameshhennye-tetraciklicheskie-proizvodnye-tetragidrofurana.html" rel="bookmark" title="База патентов Евразийского Союза">Замещенные тетрациклические производные тетрагидрофурана</a>
Предыдущий патент: Производные пептидов
Следующий патент: Способ ингибирования ингибитора 1 активатора плазминогена.
Случайный патент: Лента транспортера с перекрывающимися плоскими поверхностными пластинами















